现场验尸狂犬病快速免疫性诊断测试资源有限设置与进一步分子应用
In This Article
Summary
我们使用快速免疫球形诊断测试(RIDT)(从脑活检采样到最终解释),为现场条件下动物狂犬病的验尸诊断提供完整的方案。我们还描述了使用该器件进行分子分析和病毒基因分型的进一步应用。
Abstract
功能性狂犬病监测系统对于提供可靠的数据和增加疾病控制所需的政治承诺至关重要。迄今为止,怀疑为狂犬病阳性的动物必须使用经典或分子实验室方法提交验尸确认。然而,大多数流行地区位于低收入和中等收入国家,那里的动物狂犬病诊断仅限于中央兽医实验室。监测基础设施的不足导致偏远地区的严重疾病报告不足。最近开发了一些需要低技术专长的诊断方案,为在分散的实验室中建立狂犬病诊断提供了机会。我们在此介绍使用快速免疫血液测量诊断测试(RIDT)对动物狂犬病进行现场验尸诊断的完整方案,从脑活检采样到最终解释。我们通过描述该装置的进一步使用进行分子分析和病毒基因分型来完成该协议。RIDT很容易在大脑样本中检测狂犬病病毒和其他利莎病毒。这种测试的原理很简单:脑部材料应用于金结合抗体与狂犬病抗原特别结合的测试条上。抗原-抗体复合物进一步结合到测试线上的固定抗体,从而形成清晰可见的紫色线。该病毒在测试条中灭活,但病毒RNA随后可以提取。这使得测试条,而不是传染性大脑样本,可以安全,轻松地发送到一个装备实验室确认和分子打字。根据制造商方案的修改,我们发现测试灵敏度提高,达到98%相比,金标准参考方法,直接免疫荧光抗体测试。该测试的优点有很多:快速、易于使用、成本低,无需对实验室基础设施(如显微镜或冷链合规性)的要求。RIDT 是参考诊断方法不可用的区域的有用替代方案。
Introduction
犬狂犬病是人类狂犬病的主要原因,全球每年约有59,000人死亡,几乎全部发生在亚洲和非洲的低收入和中等收入国家。主要病因剂是神经性犬类相关经典狂犬病病毒(RABV,家族Rhabdoviridae,利萨病毒属,种类狂犬病利萨病毒)。然而,其他狂犬病相关利莎病毒,大多在蝙蝠物种中传播,也会导致疾病,2,3。在受影响地区,疾病监测和控制往往因缺乏可靠的数据而受到低水平政治承诺的4,5,阻碍。疾病报告不足的一个主要原因是没有实验室诊断,部分原因是获得装备齐全的实验室和训练有素的工作人员的机会有限,以及样品的运送困难。实验室诊断是必要的,以确认狂犬病病例,并额外的允许所涉及的菌株的基因特征,提供病毒传播的见解,在区域4级,5,7,级。4
世界卫生组织(WHO)和世界动物健康组织(OIE)批准的现行死亡后狂犬病诊断金标准是直接荧光抗体测试(DFAT)、直接快速免疫组织化学试验(DRIT)和分子方法(如逆转录聚合酶链反应(RT-PCR)4、8。4,8然而,由于实验室设施不足,电源不协调,样品运输不制冷,以及缺乏质量管理体系,LMIC 的适当应用仍然有限。由于动物狂犬病诊断通常只在LMIC的中央兽医实验室进行,现有的监测数据主要反映城市地区的狂犬病情况。
最近开发的低技术诊断替代品提供了在偏远地区建立狂犬病诊断和分散狂犬病实验室,4,8,98的机会。4快速免疫血液造影诊断测试(RIDT)是一种横向流动测试,基于使用金结合检测器抗体的免疫血液学,是一种非常有前途的狂犬病诊断工具10,11,12,13。10,11,12,13原理很简单:稀释后,脑物质混合在提供的缓冲液中,在金偶联单克隆抗体专门与狂犬病抗原结合的试验带上应用几滴,主要是核蛋白(图1)。抗原-抗体复合物然后进行横向流动迁移,在测试线(T线)与狂犬病抗原的固定抗体结合,从而形成清晰可见的紫色线。剩余的金结合抗体不与狂犬病抗原结合,继续迁移,并通过额外的靶向抗体固定到膜上,从而形成清晰可见的紫色控制线(C线)。
一步、低成本的方法快速、极其简单,不需要昂贵的设备或特殊的存储条件。随着制造商协议的修改,以消除稀释步骤,几乎所有执行测试所需的设备和试剂都包含在套件14 中。结果在5-10分钟后在没有显微镜的情况下读取。与 DFAT 测试(需要荧光显微镜和免疫荧光结合体以及冷藏运输和样品储存)不同,这是一个主要优势。即使是可以使用光学显微镜进行的 DRIT 测试,也需要连续的冷链来存储抗狂犬病抗体,这些抗体也尚未上市。与发展中国家技术环境技术相比,RIDT不需要有毒化学品,这是废物处理管理不善的国家的一个特殊优势。与金标准测试 DFAT 和 DRIT 相比,快速测试更不耗时,解释也容易得多。这允许技术专长有限的人员进行现场测试。
基于这些测试特性,对偏远地区疑似动物进行及时诊断是可行的,有助于尽快对暴露者实施暴露后预防(PEP)。此外,不需要对狂犬病样本进行距离运输,从而在检测时提高样本质量。但是,RIDT 测试获得的结果当前应使用参考诊断测试(如 DFAT 或 DRIT)进行确认。
对RABV和其他利莎病毒的检测D组技术进行了评估。韩国研究人员在2007年10日进行了第一批研究。与DFAT方法相比,在51个动物样本和4个RABV分离物中,RIDT的灵敏度和特异性分别为91.7%和100%。这些结果后来用来自韩国的110个动物大脑样本得到证实,其敏感性和特异性与DFAT相比,分别是95%和98.9%。15最近,其他研究评估了这种 RIDT 的性能使用病毒分离和/或受感染的大脑样本从不同的地理来源的各种动物。成功检测了21个样本,包括非洲RABV和其他非洲利莎病毒(Duvenhage病毒(DUVV)、拉各斯蝙蝠病毒(LBV)和莫科拉病毒(MOKV),与DFAT16相比灵敏度为100%。类似的高灵敏度 (96.5%)和特异性 (100%)从来自埃塞俄比亚的115个脑部样本中获取了值。另一项研究评估了欧洲RABV分离物,另外两种欧洲利莎病毒(欧洲蝙蝠1型(EBLV-1)和2型(EBLV-2))和澳大利亚蝙蝠利萨病毒(ABLV)18。通过对172个动物大脑样本的分析,与DFAT相比,RIDT试剂盒具有88.3%的灵敏度和100%特异性,成功检测出3种狂犬病相关病毒。在这项研究中,一些假阴性结果来自储存在甘油缓冲液中的脑部样本,表明不当的甘油去除影响毛细管流动或抗体结合。最近对来自澳大利亚蝙蝠的43个临床样本的分析证实了先前的测试结果,完全符合DFAT19。在印度对数量有限的临床样本(11个和34个样本)进行了两项使用 RIDT 的研究。与DFAT相比,灵敏度在85.7%至91.7%之间,特异性为100%,20,21。20,21使用来自非洲、欧洲和中东的 80 个动物大脑样本对该试剂盒进行的另一次评估,获得了与 DFAT 完全一致性的特异性(100%)但灵敏度更高 (96.9%)相比以前的研究22。在最近利用10个样本组成的小组对22个不同实验室进行的一次实验室间比较中,总体协调度为99.5%23。
最近的一项多中心研究表明,RIDT的整体性能不尽如人意24。测试了三个不同数据集的样本,并提供了与 DFAT 相比的可变灵敏度和特异性值。例如,从实验受感染动物的样本中获得的第一个面板(n=51)和第二个面板(n=31)的灵敏度和特异性,均在实验室 A 中测试,灵敏度分别为 16% 和 43%,而两者特异性为 100%。相反,由实验室B分析的第三组(n=30)现场临床样本的结果与DFAT的结果完全一致性,实验室A(85%的敏感性和100%特异性)进一步几乎完全确认了这一结果。提出了批次到批次的变化,作为对 RIDT24的波动相对较低灵敏度的可能解释。
同时,另一项研究对上述的 RIDT 进行了类似的验证过程,对制造商推荐的协议14进行了修改。在准备大脑材料时省略了PBS中的稀释前步骤(1:10)。基于这种更简单的修改方案,作者通过测试,在实验室条件下,通过73个动物大脑样本,自然或实验性地感染了各种RABV菌株,获得了95.3%和93.3%的灵敏度和特异性。这项研究在实地环境中(乍得、非洲)首次对这一 RIDT进行了评价。在48个临床脑样本中,灵敏度和特异性分别为94.4%和100%。DFAT 和 RIDT 之间的差异是由于 DFAT 的误报结果,经 RT-PCR 确认后确定。当这些结果被删除时,完全一致性,它表明,RIDT更可靠,在这些领域条件14下的DFAT。使用修改后的协议未观察到批处理到批处理的变化。在E格鲍尔等人24的研究中,当修改后的协议应用于少量的DFAT/RIDT发散样品(n=8)时,都发现它们是一致性的(100%的灵敏度)。
RIDT的另一个主要优点是二次使用分子技术(如RT-PCR)和随后的基因分型14,24来检测固定在条带上的病毒RNA。经过提取步骤后,Léchenne等人于14日展示了使用RT-PCR固定在 Anigen器件膜上的病毒RNA,在51个样品的面板中具有86.3%的灵敏度(包括18个样品,在环境温度下从乍得测试并运出)。在测试的14个样本中,93%的样本中,有93%可能随后进行基因分型。使用了长度至少500个核苷酸的PCR安普利素的桑格测序。除RABV分离物外,该测试还检测出另外四种利萨病毒,DUVV、EBLV-1、EBLV-2和博凯洛蝙蝠利萨病毒(BBLV),在完全协调的国际实验室间测试14中。病毒RNA检测的敏感性更高(100%)在艾格鲍尔等人的研究中,基于实验室样品24。后一项研究还表明,RIDT试剂盒中使用的缓冲液灭活了病毒。因此,这些器件可以在环境温度下轻松运输,无需特定的生物安全预防措施,可用于参考实验室,以便进行分子确认和基因分型。
根据以前的评估,RIDT 工具为现场设置提供了许多优势,尤其是在参考诊断技术不可用时。然而,这种测试也有一些局限性,特别是抗原检测的灵敏度低14,24。14,24该测试适用于含有大量病毒抗原的样品,如大脑样本。然而,它不适合其他样品,如唾液或其他体液。另一个缺点是设备成本(欧洲约为 5-10 欧元),与执行 DFAT、RT-PCR 或 DRIT 的成本相比,成本较低,但对 LIC 来说,成本仍然很高。然而,其他公司对类似 RIDT 的未来发展和验证可能导致价格下降。一项研究报告了批次到批次的变化。虽然其他人没有报告,但在测试新批次时,如在质量管理环境中使用的任何试剂,仍应执行严格的质量控制。在使用不同的批14时,修改协议的使用没有改变。除一项研究外,其他研究均表明,与DFAT相比,RDIT的灵敏度很高(约90%-95%)。由于狂犬病始终是致命的,因此强烈建议使用参考诊断测试(如 DFAT、DRIT 或 RT-PCR14)确认 RDIT 的任何阴性结果。
在这份手稿中,我们提出了一个完整的动物狂犬病现场验尸诊断协议,该方案基于商业化 RIDT 的示例,从大脑样本收集到修改协议的应用,与制造商的建议(以前验证过 14)和随后的分子分析相比。该协议在西非和中非的实地条件下多次应用和验证,在该条件下,RIDT 在 DFAT 测试旁边经常用于狂犬病诊断。此外,我们还演示了该设备在实验室环境中使用 RT-PCR 提取和检测该装置的第二个应用。
Protocol
1. 通过前门巨无霸(奥西路)采集样品25
注:此技术可以在实验室条件下或现场环境中实施。样品应在疑似动物死亡后尽快处理,或保持在低温(如有可能)中,以避免分解,从而影响结果。与基于 Lyssavirus 抗原检测的其他参考技术(如 DFAT 和 DRIT)类似,不应对分解样品进行测试,因为它会影响结果(错误阴性结果的风险)。
注意:所有样品应被视为具有潜在传染性。安全法规和程序应严格遵守,即使在现场设置4。特别是,穿戴适当的个人防护装备,包括口罩、眼镜、手套和实验室外套。使用适当的消毒剂进行材料和样品净化(例如,推荐制造商稀释的次氯酸钠、70% 酒精 - 乙醇或异丙醇、1% 肥皂溶液)。所有处理样品的人员都应接种狂犬病疫苗。
- 在第一个颈椎(地图库)之前用刀取出动物头部,以进入前体巨无霸。
注:为了尽量减少感染性气溶胶,请避免使用手动锯或类似工具。 - 使用一次性塑料移液器(图2 A)、吸管(图2B)、夹子(图2BC)或滴管(随 RIDT提供)收集脑干(梅杜拉长方形)样品(图2D)。
注:收集样品时必须特别注意,因为这是结果可靠性的一个极为重要的步骤。除了以简单方式显示如何收集感兴趣的脑干部分的关联视频外,强烈建议采取培训步骤,以确保收集正确的解剖部分。 - 可选地,除了脑干(脑干,通过推和旋转塑料移液器或吸管向眼窝(图3)收集脑干或大脑的其他部分(脑脑、海马、丘脑和皮层)。
- 如果使用吸管或移液器,轻轻挤压它,将大脑样本(0.5-2 g)沉积在管中,以便进行后续分析和/或生物库。
注:不建议在甘油中储存样品,因为它似乎会影响利道18的毛细管流动或抗体结合步骤。
2. 执行修改后的 RIDT 协议14
注:此修改将稀释步骤 (1:10) 省略到 PBS 中,如制造商协议(所有版本)中指定,可以在实验室或现场设置下实现。
- 使用拭子/滴管收集相当于半个花生或豌豆(0.1-0.5 g)的大脑物质,并放在缓冲样品管中。
注:对于修改后的协议,所有试剂/消耗品都包含在试剂盒中(无需PBS或额外的管)(图4)。记录套件的批号并检查到期日期的有效性。 - 用棉签或滴管小心地将大脑材料压碎约30 s,直到获得均匀的悬浮液。
注:缓冲反应在制造商的协议24的条件下使病毒的感染性灭活。 - 使用滴管,将悬浮液的四滴(约 100 μL)沉积在测试设备上的样品入口中。
- 在读取测试设备之前,等待完整的样品迁移(1-5 分钟)。迁移应在样品沉积后(1-5 分钟)快速开始。
- 如果延迟(由于高粘度悬浮)或加速迁移的开始,用滴管轻轻划伤设备沉积站点的底部(1-5 次),并最终再增加 1-2 滴。此后应立即开始迁移。
- 迁移结束后 5-10 分钟,在检测窗口中读取测试结果,在迁移结束后不超过 20 分钟。
- 根据图5,根据检测窗口中的控制线(C 线)和测试线(T 线)(紫色线)的存在或缺失来解释结果。当两条线可见时(图5A),如果仅存在 C 线(图5B),则考虑样本为正数(如果仅存在 T 线或没有可见线(图5C), 则为负数。
注:无效结果应至少重复一次。如果结果仍然无效,应执行其他技术。使用 RIDT 获得的负面结果需要随后使用金标准参考方法进行确认,如 DFAT、DRIT 和分子方法(聚合酶链式反应或 PCR)。尽管此测试的灵敏度很高(参见代表性结果),但并不是 100%。 - 在室温下存放用过的设备,或在可能的情况下冷藏/冷冻设备,以便进行后续分子分析(参见第 4 节)。将缓冲管中剩余的样品悬浮液冷冻在-20°C/-80°C,必要时重复测试或进行后续分子分析。
3. RT-qPCR从 RIDT 器件提取和检测RNA
注:此步骤只能在实验室条件下实施,具有合适的环境和适合分子诊断的设备。它可以在 RIDT 测试后不久完成,或在存档的 RIDT 设备上进行,储存在室温 (15-30 °C), 冷藏或冷冻。
- RNA提取
注:为了监测提取步骤,建议使用内源性mRNA(如β-行为素)或外源性控制(如eGFP合成RNA)在提取26、27的第一步直接刺入样品中的内部控制。- 小心地打开设备并取出滤纸。
- 切割样品的沉积区域,并放入含有 1 mL 三试剂 LS 的管中。在RT孵育1小时,温和定期手动搅拌。
- 按照制造商的建议执行提取,如前所述。在此步骤中,可以添加外源内部控制。
- 在这个过程中,根据制造商的建议,加入2μL的糖原,促进RNA的沉淀。
- 调节无核酸水中RNA再暂停的最终体积,通常使用50μL的容积。
注:在水相分离和有机相分离的离心步骤结束时(在三试剂 LS 中加入 200 μL 的氯仿后),器件中的膜片将位于管的底部,不会干扰上水相的收集。或者,可以使用其他简单而快速的协议,例如,使用苯酚基试剂和二氧化硅膜28。
- RT-qPCR26 检测
注:可使用不同的分子技术(如逆转录 PCR、常规(端点)或实时 PCR (qPCR)))检测提取样品中存在的潜在病毒 RNA。有几种方法可用,如传统的RT-PCR27、29,29或RT-qPCR26、30针对病毒核蛋白或聚合酶基因。26,下面将举一个例子,基于双组合泛利萨病毒RT-qPCR,目标为病毒聚合酶之间的保守区域。此 RT-qPCR 技术将两种不同的 RT-qPCR 关联在一起:一种基于 TaqMan 探头技术(泛 RABV RT-qPCR),另一种使用 SyBR 绿色检测(泛莱萨 RT-qPCR)。此外,在提取过程中直接尖峰的外源内控 (eGFP RNA) 的检测由特定的基于 TaqMan 探针的 RT-qPCR (eGFP RT-qPCR) 完成。仔细现场验证为检测病毒RNA而选择的分子技术非常重要,特别是要验证底源剂和实时RT-PCR探针是否适用于检测在感兴趣区域循环的菌株。- 将RNA样品稀释至1:10,在无核酸酶中。使用 96 井反应板或其他格式重复测试每个 RNA 样本。对每次检测使用阳性和阴性对比,并至少重复测试。
- 根据表1和表2中所示的底像/探针,为三种不同的RT-qPCR测定准备主混合反应溶液。
- 将 5 μL 稀释的 RNA 样品和 15 μL 的主混合添加到三种不同的测定中。泛RABVRT-qPCR测定和eGFPRT-qPCR测定可以在同一个板中循环。
- 按照表3中所示的热循环条件运行不同的检测。如果只有一个 PCR 热循环器可用,请从泛 RABV RT-qPCR 开始,将泛拉莎 RT-qPCR 的板保持在 4°C,直到泛 RABV RT-qPCR 结束。
- 根据表4分析通过三种测定获得的结果。
4. 从 RIDT 设备提取 RNA 后基因分型
- 逆转录 RT27,29
- 使用 6 μL 的 RNA、2 μL 的 pd(N)6 随机质剂(200 μg/μL)和 2 μL 无核酸酶水准备主混合,最终体积为 10 μL。
- 在65°C下孵育10分钟,然后储存在冰上。
- 使用 6 μL 的 5 倍第一链缓冲器准备主混合, 2 μL 的 0.1 M 二核酸酯 (DTT),1 μL (200 U) 的上标 II 逆转录酶,2 μL (80 U) 的 RNasin,2 μL 的 dNTP 混合物 (10 μM),并完成无核酸酶水,每个样品获得 20 μL 的最终体积。
- 将主混合物(20 μL)加入样品(10 μL)(最终体积为30μL),并在42°C下在热块中孵育90分钟。
- 使用 PCR 扩增或将 cDNA 储存在 -20 °C 下,继续执行下一步。
- 传统 PCR27,29,31
注:传统PCR的不同技术可用于基因分型。两个呈现,两个半巢PCR,针对部分核蛋白或部分病毒蛋白的利萨病毒。除底像和循环条件外,每个检测协议都相同。阳性(阳性RNA)和阴性(阴性cDNA和/或无核酸酶水)控制应包含在每个系列和每轮PCR中。- 为 0.2 mL 微管中的每个样品准备第一个 PCR 步骤的主混合反应解决方案。这种混合物含有5μL的10xNH4反应缓冲液, 2.5 μL 的 MgCl2溶液 (50 mM),1 μL 的 dNTP 混合物 (10 μM),每个底端 (10 μM) 的 1 μL, 0.2 μL (1 U) 的生物塔 q DNA 聚合酶和 37.3 μL 无核解酶水(最终体积为 48 μL)。底项表5 中指示底向。
- 根据表6,在每个管中加入2μL的cDNA,并在单独的常规PCR热循环器上循环进行检测。
- 准备第二个与上一个相同的主混合反应溶液,使用适当的底因(表5)进行半巢PCR反应。
- 使用表6中所示的循环参数,在传统的PCR热循环器上加入2μL的PCR产品并循环。
- 将不同的 PCR 产品(第一和第二轮 PCR)加载到 1% 的 agarose 凝胶(100 mL 的三醋酸 EDTA 缓冲液 1x - TAE 1x)上后,用溴化乙基(最终浓度约为 0.01%)在 30 分钟内以 120 V 运行凝胶。以预期大小的亮带的形式观察到正PCR结果(表5)。
- 桑格测序
- 对使用泛利萨病毒半巢PCR获得的安普生进行桑格测序,并完成基因分型分析。
Representative Results
与任何诊断方法一样,样本收集对于结果的可靠性至关重要,尤其是在现场设置中执行时。收集过程需要尽可能简单,以确保收集高质量的样品。如图2A-D 25所示,通过动物狂犬病的验尸诊断的脑活检(脑干与梅杜拉长方形)的收集符合这一要求。
收集后,大脑样本提交到 RIDT 的修改协议,总结于图6。如《议定书》一节所述,制造商提供的主要调整是省略了PBS中的稀释步骤,这简化了程序和必要的耗材/试剂,因此所有消耗品/试剂都包含在试剂盒中(图4)。
这项修改后的议定书在五个不同的实验室实施和评估,包括一个世卫组织狂犬病合作中心(法国实验室1)、一个粮农组织狂犬病参考中心和设在非洲邻国的三个参考实验室,乍得(2号实验室)、象牙海岸(3号实验室)和马里(实验室4)。在乍得,在实验室和实地环境中对 RIDT 进行了评估。
与DFAT参考技术相比,RDIT的灵敏度和特异性在所有实验室中都很高,分别有96%-100%和93.7%至100%(表7)。在实验室验证步骤中,为实验室 1(法国)获得了最低灵敏度和特异性。根据被测试样本的累积数目(n=162)(补充表1),与DFAT相比,总体灵敏度和特异性分别为98.2%和95.8%(表7)。然而,这些初步但有希望的结果是在有限的样本数据集上获得的,需要在大量阳性和阴性样本上进一步确认,特别是在环境区域测试的样本上,以避免由于当前异质数据集而产生任何潜在的低估或偏差。
RIDT测试适用于检测受感染动物脑活检中的利莎病毒,其中利莎病毒抗原水平很重要。然而,检测的测试限制仍然很高,当测试滴定病毒暂停(表8;图 7.
表9(来自Léchenne 201614)显示了双组合泛利萨病毒RT-qPCR针对利萨病毒病毒聚合酶的RNA检测结果示例。测试了在实验室条件(实验室 1,n=32)或乍得(实验室 2,n=19)进行的 51 例阳性 RIDT 测试,然后在环境温度下运送到实验室 1。18(94.7%),26(81.2%)获得阳性检测和 44 (86.3%)分别来自实验室 1、实验 2 和两个样本的组合。此外,使用半巢PCR针对部分核蛋白基因对其中14个样本(10个样本10个和4个实验室2)进行了基因分型,其中13个样本(93%)成功(来自Léchenne等人2016年14月)。
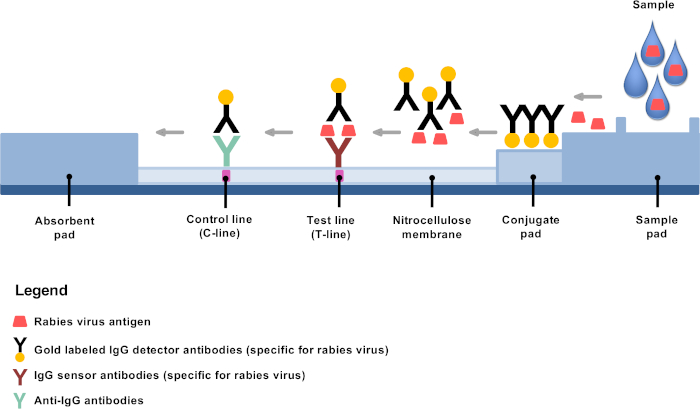
图1:狂犬病诊断 RIDT 结构的示意图。请单击此处查看此图的较大版本。

图2:动物(此处所示的狗)通过田间环境中的腹毛(马里)收集脑样本的快速简单技术(脑干与脑筋急。(A) 收集一次性塑料移液器 (B) 收集与塑料吸管 (C) 收集与夹子 (D) 集合与处置滴管提供在 RIDT 套件.请单击此处查看此图的较大版本。
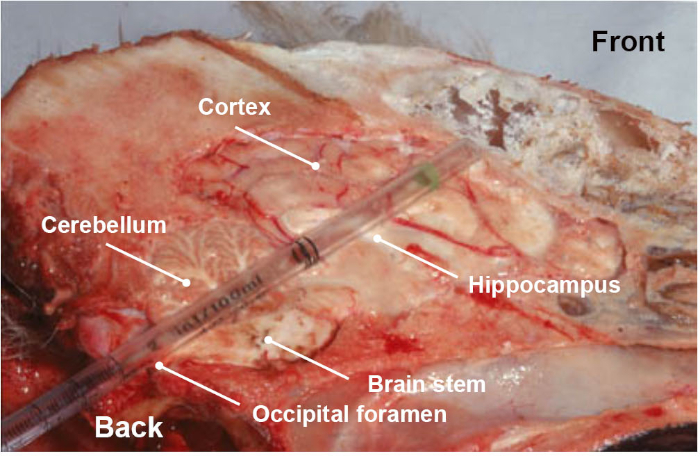
图3:狗头的纵向解剖部分,显示大脑的不同部分(脑干、小脑、海马、丘脑和皮层)在旋转运动中通过腹膜前科路线时收集的一次性塑料移液器。请单击此处查看此图的较大版本。

图4:RIDT套件内容说明,包括设备、一次性塑料滴管、一次性拭子和检测稀释剂。不提供收集和储存样品的管子。请单击此处查看此图的较大版本。
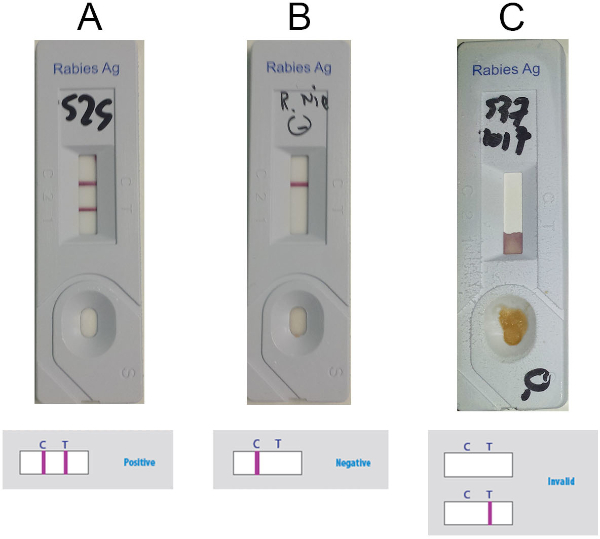
图5:解释阿尼根 RIDT 的代表性结果。(A) 正结果(可见存在两条线,C线和T线)(B)负结果(仅C线可见存在)(C)无效结果(无可见C线)。请单击此处查看此图的较大版本。

图 6:RIDT 协议的示意图,根据制造商说明改编。(A) 修改版本的协议,删除制造商推荐的稀释步骤 (B) 制造商推荐的初始协议,在大脑样本的PBS中预1:10稀释步骤。协议修改版本中删除的步骤(如图6A 所示)用红线表示。请单击此处查看此图的较大版本。
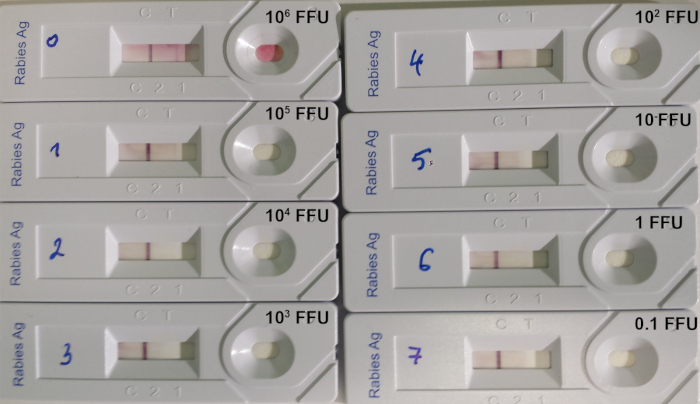
图7:确定 RIDT14 检测限值的示例。使用9704ARG菌株的滴定狂犬病病毒的连续10:1稀释。每个设备上沉积的病毒数量以 FFU(荧光聚焦单位)表示。请单击此处查看此图的较大版本。
| 泛拉布夫RT-qPCR测定 | |
| 试剂 | μL/反应 |
| 2X 反应混合(每个 dNTP 和 6 mM MgSO4 的缓冲液) | 10 |
| 无核酸水 | 1.5 |
| Taq3 长 (前进) [10 [M] | 1 |
| Taq17revlong (反向) [10 [M] | 1 |
| RABV4 [10 [M] | 0.3 |
| RABV5 [10 [M] | 0.3 |
| MgSO4 [50-mM](套件中提供) | 0.25 |
| ROX 参考染料 (25 μM)(套件中提供) | 0.05 |
| RNasin (40U/μL) (普罗梅加) | 0.2 |
| 上脚本 III RT/白金 Taq 混合 | 0.4 |
| 每个反应总数 | 15 |
| egfp Rt - qpcr 测定 | |
| 试剂 | μL/反应 |
| 2X 反应混合(每个 dNTP 和 6 mM MgSO4 的缓冲液) | 10 |
| 无核酸水 | 2.8 |
| EGFP1F (前进) [10 [M] | 0.5 |
| EGFP2R (反向) [10 [M] | 0.5 |
| eGFP 探头 [10 [M] | 0.3 |
| MgSO4 [50-mM](套件中提供) | 0.25 |
| ROX 参考染料 (25 μM)(套件中提供) | 0.05 |
| RNasin (40U/μL) (普罗梅加) | 0.2 |
| 上脚本 III RT/白金 Taq 混合 | 0.4 |
| 每个反应总数 | 15 |
| 泛莱萨RT-qPCR测定 | |
| 试剂 | μL/反应 |
| 2x SYBR 绿色反应混合 | 10 |
| 无核酸水 | 2.1 |
| Taq5 长 (前进) [10 [M] | 1 |
| Taq16revlong (反向) [10 [M] | 1 |
| MgSO4 [50-mM](套件中提供) | 0.25 |
| ROX 参考染料 (25 μM) | 0.05 |
| RNasin (40U/μL) (普罗梅加) | 0.2 |
| 上脚本 III RT/白金 Taq 混合 | 0.4 |
| 每个反应总数 | 15 |
表1:三种不同RT-qPCR测定(泛-RABVRT-qPCR、泛莱萨RT-qPCR和eGFPRT-qPCR)的主混合反应溶液说明。
| Rt - qpcr 测定 | 名字 | 类型 | 长度 | 序列 (5'-3') | 感 | 位置 |
| 泛拉布夫 RT - qpcr 测定 | Taq3long | 底漆 | 22 | ATG AGA AGT GGA AYA AYC ATC A | S | 7273-7294a |
| 塔克17雷夫隆 | 底漆 | 25 | 盖特 Ctg Tct Gaa Taa 标签 AYC 汽车 G | 作为 | 7390-7414a | |
| 拉布夫4 | 探头(法姆/塔姆拉) | 29 | AAC ACY TGA TCB AGK ACA GAR AAY ACA TC | 作为 | 7314-7342a | |
| 拉布夫5 | 探头(法姆/塔姆拉) | 32 | Agr Gtg T T Tcy Agr Acw Cay Gag T Tty Ca | S | 7353-7384a | |
| 泛莱萨RT-qPCR测定 | 塔克5龙 | 底漆 | 23 | 塔特 · 加格 · 阿格 · 阿艾 · 凯 · 卡 | S | 7272-7294a |
| 塔克16雷夫隆 | 底漆 | 25 | 盖特 T Tga Aag Aac Tca TGK Gty C | 作为 | 7366-7390a | |
| egfp Rt - qpcr 测定 | EGFP1F | 底漆 | 20 | 加克 · 卡茨 · 卡格 · 卡格 · 阿克 · 阿克 | S | 637-656b |
| EGFP2R | 底漆 | 19 | GaA Ctc Cag Cag Gac 猫 G | 作为 | 768-750b | |
| 埃及政府 | 探头(法姆/塔姆拉) | 22 | AGC ACC CAG TCC GCC CTG AGC A | S | 703-724b |
表2:三种不同RT-qPCR测定(泛拉布VRT-qPCR、泛莱萨RT-qPCR和eGFPRT-qPCR)的底注/探头说明。a根据巴斯德病毒(PV)RABV基因组序列(GenBank加入编号M13215)。b根据克隆载体pEGFP-1序列(GenBank加入编号U55761)。
| 泛拉布夫 RT-qpcr 和 eGFP RT-qpcr 测定 | ||||
| 步 | 周期 | 临时 | 时间 | 数据采集 |
| 反向转录 | 1 | 45 °C | 15 分钟 | |
| RT 失活/初始变性 | 1 | 95 °C | 3 分钟 | |
| 放大 | 40 | 95 °C | 15 s | |
| 61 °C | 1 分钟 | 终点 | ||
| 泛莱萨RT-qPCR测定 | ||||
| 步 | 周期 | 临时 | 时间 | 数据采集 |
| 反向转录 | 1 | 45 °C | 15 分钟 | |
| RT 失活/初始变性 | 1 | 95 °C | 3 分钟 | |
| 放大 | 40 | 95 °C | 15 s | |
| 55 °C | 1 分钟 | 终点 | ||
| 分离曲线 | 1 | 95 °C | 15 s | 增加 0.1 °C/s, 55~95 °C |
| 55 °C | 1 分钟 | |||
| 95 °C | 15 s | |||
| 55 °C | 15 s | |||
表3:描述三种不同RT-qPCR测定(泛RAPVRT-qPCR、泛莱萨RT-qPCR和eGFPRT-qPCR)的热循环条件。
| 测定 | 分析 | 结果 | 解释 |
| egfp Rt - qpcr | 接受间隔中的 Cq | 已验证提取 | 可以分析其他测定方法 |
| Cq 出接受间隔 | 未验证提取 | 重新测试示例(重复运行或/和提取),如有必要,请求另一个样本 | |
| 泛拉布夫 Rt - qpcr | Cq <38 | 积极 | 病毒RNA的阳性检测 |
| Cq +38 | 负 | 分析泛莱萨RT-qPCR测定 | |
| 潘莱萨 Rt - qpcr | 熔化曲线被视为正 | 积极 | 病毒RNA的阳性检测 |
| 熔化曲线被视为负 | 负 | 病毒RNA检测缺失 |
表4:双组合泛利萨病毒RT-qPCR测定的总体解释。
| 赫米嵌套常规PCR测定 | Pcr 轮 | 名字 | 长度 | 序列 (5'-3') | 感 | 放置a | 安培孔尺寸(bp) |
| 针对聚合酶基因的半巢PCR | 第一轮 | PVO5m | 20 | ATG ACA GAC AAY YTG AAC AA | S | 7170-7189 | 320 |
| PVO9 | 19 | Tga Cca Ttc 汽车车 Gtn G | 作为 | 7471-7489 | |||
| 第二轮 | PVO5m | 20 | 阿加卡格阿卡 Ayy Tga Aca A | S | 7170-7189 | 250 | |
| PVO8 | 22 | GGT CTG ATC TRT CWG ARY AAT A | 作为 | 7398-7419 | |||
| 以核蛋白基因为目标的半巢PCR | 第一轮 | N127 | 20 | ATG TAA CAC CTC TAC AAT GG | S | 55-74 | 1532 |
| N8m | 19 | CAG TCT CYT CNG CCA TCT C | 作为 | 1568-1586 | |||
| 第二轮 | N127 | 20 | ATG TAA CAC CTC TAC AAT GG | S | 55-74 | 845 | |
| N829 | 19 | GCC CTG GTT CGA ACA TTC T | 作为 | 881-899 |
表5:用于传统半巢PCR的底注说明。
| 针对聚合酶基因的半巢PCR | ||||
| 步 | 周期 | 温度 | 时间 | |
| 第一和第二轮 | 初始变性 | 1 | 94 °C | 3 分钟 |
| 变性 | 35 | 94 °C | 30 s | |
| 杂交 | 56 °C | 45 s | ||
| 伸长 | 72 °C | 40 s | ||
| 最终伸长 | 1 | 72 °C | 3 分钟 | |
| 以核蛋白基因为目标的半巢PCR | ||||
| 步 | 周期 | 温度 | 时间 | |
| 第一轮 | 初始变性 | 1 | 94 °C | 3 分钟 |
| 变性 | 35 | 94 °C | 30 s | |
| 杂交 | 56 °C | 30 s | ||
| 伸长 | 72 °C | 45 s | ||
| 最终伸长 | 1 | 72 °C | 3 分钟 | |
| 第二轮 | 初始变性 | 1 | 94 °C | 3 分钟 |
| 变性 | 35 | 94 °C | 30 s | |
| 杂交 | 58 °C | 30 s | ||
| 伸长 | 72 °C | 30 s | ||
| 最终伸长 | 1 | 72 °C | 3 分钟 | |
表6:传统半巢PCR的热循环条件说明。
| 实验室 | 国家 | 评价期间 | 样品的 Nb | DFAT 结果 | RIDT 结果 | 灵敏度 | 特 异性 | ||
| Pos | 内格 | Pos | 内格 | ||||||
| 实验室 1 | 法国 | 2015 | 82 | 50 | 32 | 50 | 32 | 96% | 93.7% |
| 实验室 2 | 乍得 | 2012-2015 | 44 | 33 | 11 | 33 | 11 | 100% | 100% |
| 实验室 3 | 科特迪瓦 | 2017 | 10 | 8 | 2 | 8 | 2 | 100% | 100% |
| 实验室 4 | 马里 | 2017 | 18 | 15 | 3 | 15 | 3 | 100% | 100% |
| 实验室 6 | 意大利 | 2016 | 8 | 8 | 0 | 8 | 0 | 100% | - |
| 所有 | 2015-2017 | 162 | 114 | 48 | 114 | 48 | 98.2% | 95.8% | |
表7:根据对总共162个样品的分析,并由5个不同的实验室参与,确定 RIDT 测试的内在参数(灵敏度、特异性)与参考 DFAT 方法相比。
| 病毒株a | 原始主机 | 位置 | 初始浓度(FFU/mL)bb | 检测限制 (FFU/mL)c |
| 9147FRA | 红狐 | 法国 | 3.1 x 107 | 106 |
| Cvs | 实验室隔离 | - | 1.6 x 107 | 106 |
| 8743THA | 人类 | 泰国 | 8.1 x 107 | > 8.1 x 106 |
| 9508CZK (悲伤) | 实验室隔离 | - | 5.4 x 108 | 107 |
| 光伏 | 实验室隔离 | - | 4.3 x 107 | 106 |
| 9001FRA | 狗 | 法属圭亚那 | 2.4 x 106 | > 2.4 x 105 |
| 9704ARG | 蝙蝠 | 阿根廷 | 9.5 x 107 | 105 |
| 04030PHI | 人类 | 菲律宾 | 2.5 x 107 | 105 |
表8:使用8种不同的滴定狂犬病病毒悬浮液检测DET的限度(来自Léchenne等人,2016年14月)。aCvs: 挑战病毒株, SAD: 街道阿拉巴马州杜弗林, PV: 巴斯德病毒.b每 mL 的荧光对焦形成单位 (FFU) 数。c沉积在条带上的荧光对焦形成单元 (FFU) 数。
| 在 | ||||||||||
| 实验室 1 | 实验室 2 | 联合 | ||||||||
| 积极 | 负 | 总 | 积极 | 负 | 总 | 积极 | 负 | 总 | ||
| 病毒RNA检测 | 积极 | 18 | 1 | 19 | 26 | 0 | 32 | 44 | 7 | 51 |
| 负 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 3 | 3 | |
| 总 | 18 | 1 | 19 | 26 | 0 | 35 | 44 | 10 | 54 | |
表9:在实验室条件下(实验室1)使用、在环境温度下和在环境温度下发货(实验室2)或组合(来自Léchenne等人,2016年14月)使用在阿尼根试验带上使用RT-qPCR的病毒RNA检测。
补充表1:使用 RIDT 测试测试测试的 162 个样本的说明,用于确定表 7 中所示的内在参数。请单击此处查看此表(右键单击以下载)。
Discussion
RIDT 是一种简单、快速、低成本的死后狂犬病诊断方法,也是实验室检测的一种有希望的现场替代方案。这种测试的应用,特别是对低收入和中等收入国家的分散地区,将增进对狂犬病病毒在地方和潜在的国家范围的流行和传播的了解。当与快速大脑样本收集方法(没有完全的尸检)相结合时,一个很大的优点是,测试可以在远离实验室设施的现场环境中完全进行。通过前兆采集的大脑样本可用于测试,因此不需要完全打开动物头骨。该测试操作和解释简单,特别适用于现场监视活动14。RIDT 与 DFAT 或 DRIT 相比的其他优点是无需在室温下进行正负控制和套件存储。此外,修改后的协议,其中稀释步骤(1:10)到PBS省略,不需要额外的试剂来执行测试,并进一步简化了现场条件下的程序。
关键点是大脑样本的质量。样本应在疑似动物死亡后尽快采集和测试,或在测试前保持在低温,以避免降解。不应测试分解的样本,因为它会影响结果(错误阴性结果的风险)。虽然目前还没有关于脑部样本随着时间的推移失去D组灵敏度的数据,但我们假设与DFAT测试32类似。但是,从动物死亡到执行测试之间的时间可以缩短,因为测试可以快速直接在野外进行。因此,一般来说,样品分解的风险较低。
协议中的另一个关键步骤是示例挂起迁移。迁移应在样品沉积后(1-5 分钟)立即开始。因此,悬浮液的高粘度可能会对迁移产生负面影响。用滴管轻轻抓抓设备存放站点的底部,再加 1-2 滴通常可以解决此问题,迁移后立即开始。
在非洲实验室(乍得、象牙海岸和马里)进行的 RIDT 测试大多数是在环境温度可超过 30°C 时进行的,而制造商推荐的储存和使用温度范围为 15 °C - 30 °C。虽然我们没有确定高温对 RIDT 测试性能的任何影响,但有必要更仔细地评估它。同样,在用于病毒RNA检测和基因分型后,高温在设备储存和运输过程中的影响需要额外的评估。从 RIDT 条带进行 RT-qPCR 检测的病毒RNA的灵敏度可能受最初测试中使用的大脑样本的质量的影响,也可能受使用后 RIDT 测试的存储条件的影响。例如,当使用 RIDT 测试在受控实验室条件下存储时,RNA 检测的灵敏度更高 (94.7%)与实地条件(如乍得)(81.2%)相比, 14.这些条件也可能影响固定在条带上的RNA的完整性(特别是长度),可能解释基于较长PCR amplicons(例如>500核苷酸)的基因分型的中度敏感性。在测试条上执行的RT-qPCR的灵敏度低于使用FTA Whatman卡(80.6%)14。14与其他分子技术类似,病毒载量也可以影响基于RDIT条的基因分型的成功,对病毒载量低的样品有潜在的阴性结果。
世卫组织和OIE目前不建议进行常规诊断和疾病监测,不能自己使用结果来指导PEP决策。仍然需要进一步的测试验证。然而,准确的快速狂犬病诊断是功能良好的连续狂犬病监测系统的一个关键因素,并有助于提高政治承诺,这对于成功的可持续狂犬病控制至关重要。在这方面,RIDT测试提供了新的狂犬病诊断机会,是扩大低收入或中等收入地区动物狂犬病监测的有用工具。
Acknowledgements
这项工作得到了全球疫苗和免疫联盟( GAVI )、沃尔夫曼·内盖利基金会、瑞士非洲研究合作组织、 SWF Stiftung füssenschaliche Forschung 、 Freiwillige Akademische Gesellschaft ()巴塞尔、瑞士与亚洲的双边科技合作方案和诺华生物医学研究基金会的支持。
我们特别感谢狗主人、兽医人员和实验室工作人员的高度重视。我们还要感谢丽莎克鲁普的语言编辑。
Materials
| Name | Company | Catalog Number | Comments |
| Anti-Rabies Nucleocapsid Conjugate (lyophilizied, adsorbed) | Bio-Rad, France | 3572112 | Fluorescein-5-isothiocyanate (FITC) conjugated polyclonal antibody against the nucleocapsid of rabies virus. Use for the DFAT reference tecnnique. |
| Applied Biosystems 7500 Real-Time PCR System | Applied Biosystems, France | 4351104 | Amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| Disposable plastic pipette, drinking straw, clamp, dropper | - | - | Equipment used for the collection of the brain stem (medulla oblongata) via the foramen magnus (occipital route). |
| Evans Blue Solution 1% | Bio-Rad, France | 3574911 | Counter-coloration used for the DFAT to facilite the reading under UV microscope. |
| Primer eGFPF1 | Eurofins Genomics, Germany | - | Forward primer for the amplification of the internal control eGFP by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-GACCACTACCAGCAGAACAC-3'. |
| Primer eGFPR2 | Eurofins Genomics, Germany | - | Reverse primer for the amplification of the internal control eGFP by RT-qPCR after extraction from the RIDT device, sequence: 5'-GAACTCCAGCAGGACCATG-3'. |
| Primer Taq17 revlong | Eurofins Genomics, Germany | - | Reverse primer for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-ATGAGAAGTGG AAYAAYCATCA-3'. |
| Primer Taq3 long | Eurofins Genomics, Germany | - | Forward primer for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-GATCTGTCTGAA TAATAGAYCCARG-3'. |
| Probe eGFP FAM/TAMRA | Eurofins Genomics, Germany | - | Forward primer for the amplification of the internal control by RT-qPCR after extraction from the RIDT device, sequence: 5'-AGCACCCAGT CCGCCCTGAGCA-3'. |
| Probe RABV4 FAM/TAMRA | Eurofins Genomics, Germany | - | Probe for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-AACACYTGATCBA GKACAGARAAYACATC-3'. |
| Probe RABV5 FAM/TAMRA | Eurofins Genomics, Germany | - | Probe for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-AGRGTGTTTTCYAG RACWCAYGAGTTTTTYCA-3'. |
| Rapid Rabies Ag Test Kit | BioNote Inc., Republic of Korea | RG18-01DD | Rapid immunochromatographic diagnostic test (RIDT, also named lateral flow device or LFD) for the post-mortem diagnosis of rabies. |
| Recombinant RNasin Ribonuclease Inhibitor | Promega, USA | N2515 | Enzyme used with the kit for the amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| SuperScript III Platinum One-Step qRT-PCR Kit | Invitrogen, France | 11732-020 | Kit for the amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| TRIzol Reagent | Invitrogen, France | 15596026 | Phenol/chloroforme based total RNA extraction using the cellulose membrane of the RIDT. |
References
- Hampson, K., et al. Correction: Estimating the Global Burden of Endemic Canine Rabies. PLoS Neglected Tropical Diseases. 9 (5), e0003786 (2015).
- Rupprecht, C., Kuzmin, I., Meslin, F. Lyssaviruses and rabies: current conundrums, concerns, contradictions and controversies. F1000Research. 6, 184 (2017).
- Walker, P. J., et al. ICTV Virus Taxonomy Profile: Rhabdoviridae. The Journal of General Virology. 99 (4), 447-448 (2018).
- World Health Organization (WHO). WHO Expert Consultation on Rabies, third report. HO Technical Report Series, No. 1012. , (2018).
- Dacheux, L., et al. More Accurate Insight into the Incidence of Human Rabies in Developing Countries through Validated Laboratory Techniques. PLoS Neglected Tropical Diseases. 4 (11), e765 (2010).
- Welburn, S. C., Beange, I., Ducrotoy, M. J., Okello, A. L. The Neglected Zoonoses - The Case for Integrated Control and Advocacy. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. , (2015).
- Dacheux, L., Bourhy, H. Diagnostic tests for human rabies. Revue Scientifique Et Technique (International Office of Epizootics). 37 (2), 581-593 (2018).
- Kasempimolporn, S., Saengseesom, W., Lumlertdacha, B., Sitprija, V. Detection of rabies virus antigen in dog saliva using a latex agglutination test. Journal of Clinical Microbiology. 38 (8), 3098-3099 (2000).
- Kang, B., et al. Evaluation of a rapid immunodiagnostic test kit for rabies virus. Journal of Virological Methods. 145 (1), 30-36 (2007).
- Nishizono, A., et al. A simple and rapid immunochromatographic test kit for rabies diagnosis. Microbiology and Immunology. 52 (4), 243-249 (2008).
- Kasempimolporn, S., Saengseesom, W., Huadsakul, S., Boonchang, S., Sitprija, V. Evaluation of a rapid immunochromatographic test strip for detection of Rabies virus in dog saliva samples. Journal of Veterinary Diagnostic Investigation: Official Publication of the American Association of Veterinary Laboratory Diagnosticians, Inc. 23 (6), 1197-1201 (2011).
- Ahmed, K., et al. Evaluation of a monoclonal antibody-based rapid immunochromatographic test for direct detection of rabies virus in the brain of humans and animals. The American Journal of Tropical Medicine and Hygiene. 86 (4), 736-740 (2012).
- Léchenne, M., et al. Validation of a Rapid Rabies Diagnostic Tool for Field Surveillance in Developing Countries. PLoS Neglected Tropical Diseases. 10 (10), e0005010 (2016).
- Yang, D. K., et al. Comparison of four diagnostic methods for detecting rabies viruses circulating in Korea. Journal of Veterinary Science. 13 (1), 43-48 (2012).
- Markotter, W., et al. Evaluation of a rapid immunodiagnostic test kit for detection of African lyssaviruses from brain material. The Onderstepoort Journal of Veterinary Research. 76 (2), 257-262 (2009).
- Reta, T., et al. Evaluation of Rapid Immunodiagnostic Test for Rabies Diagnosis Using Clinical Brain Samples in Ethiopia. Journal of Veterinary Science & Medical Diagnosis. 2 (3), 1-3 (2013).
- Servat, A., Picard-Meyer, E., Robardet, E., Muzniece, Z., Must, K., Cliquet, F. Evaluation of a Rapid Immunochromatographic Diagnostic Test for the detection of rabies from brain material of European mammals. Biologicals: Journal of the International Association of Biological Standardization. 40 (1), 61-66 (2012).
- Certoma, A., et al. Assessment of a Rabies Virus Rapid Diagnostic Test for the Detection of Australian Bat Lyssavirus. Tropical Medicine and Infectious Disease. 3 (4), (2018).
- Ahmad, A., Singh, C. K. Comparison of rapid immunodiagnosis assay kit with molecular and immunopathological approaches for diagnosis of rabies in cattle. Veterinary World. 9 (1), 107-112 (2016).
- Sharma, P., Singh, C. K., Narang, D. Comparison of immunochromatographic diagnostic test with Hheminested Reverse transcriptase polymerase chain reaction for detection of rabies virus from brain samples of various species. Veterinary World. 8 (2), 135-138 (2015).
- Voehl, K. M., Saturday, G. A. Evaluation of a rapid immunodiagnostic rabies field surveillance test on samples collected from military operations in Africa, Europe, and the Middle East. U.S. Army Medical Department Journal. , 27-32 (2014).
- Servat, A., Robardet, E., Cliquet, F. An inter-laboratory comparison to evaluate the technical performance of rabies diagnosis lateral flow assays. Journal of Virological Methods. 272, 113702 (2019).
- Eggerbauer, E., et al. Evaluation of Six Commercially Available Rapid Immunochromatographic Tests for the Diagnosis of Rabies in Brain Material. PLoS Neglected Tropical Diseases. 10 (6), e0004776 (2016).
- Barrat, J., Meslin, F. X., Kaplan, M. M., Koprowski, H. Simple technique for the collection and shipment of brain specimens for rabies diagnosis. Laboratory techniques in rabies. , 425-432 (1996).
- Dacheux, L., et al. Dual Combined Real-Time Reverse Transcription Polymerase Chain Reaction Assay for the Diagnosis of Lyssavirus Infection. PLoS Neglected Tropical Diseases. 10 (7), e0004812 (2016).
- Dacheux, L., et al. A reliable diagnosis of human rabies based on analysis of skin biopsy specimens. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 47 (11), 1410-1417 (2008).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Application of next generation sequencing to rabies virus and other lyssaviruses. Laboratory techniques in rabies. 2, 49-61 (2019).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Conventional pan-lyssavirus reverse transcriptase polymerase chain reaction. Laboratory techniques in rabies. 2, 1-16 (2019).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Rabies real-time reverse transcriptase polymerase chain reaction. Laboratory techniques in rabies. 2, 17-34 (2019).
- Talbi, C., et al. Evolutionary history and dynamics of dog rabies virus in western and central Africa. The Journal of General Virology. 90 (Pt 4), 783-791 (2009).
- McElhinney, L. M., Marston, D. A., Brookes, S. M., Fooks, A. R. Effects of carcase decomposition on rabies virus infectivity and detection. Journal of Virological Methods. 207, 110-113 (2014).
- Vigilato, M. A. N., et al. Progress towards eliminating canine rabies: policies and perspectives from Latin America and the Caribbean. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 368 (1623), 20120143 (2013).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved