Test de diagnostic immunochromatographique rapide sur le terrain postmortem pour les paramètres limités par les ressources avec d’autres applications moléculaires
In This Article
Summary
Nous présentons un protocole complet pour le diagnostic post mortem de la rage animale dans des conditions de terrain utilisant un essai immunochromagraphic rapide de diagnostic (RIDT), de l’échantillonnage de biopsie de cerveau à l’interprétation finale. Nous décrivons également d’autres applications utilisant le dispositif pour l’analyse moléculaire et le génotypage viral.
Abstract
Les systèmes fonctionnels de surveillance de la rage sont essentiels pour fournir des données fiables et accroître l’engagement politique nécessaire pour lutter contre les maladies. À ce jour, les animaux soupçonnés d’être positifs à la rage doivent être soumis à une confirmation post mortem à l’aide de méthodes de laboratoire classiques ou moléculaires. Cependant, la plupart des zones endémiques se trouvent dans les pays à revenu faible ou intermédiaire où le diagnostic de la rage animale est limité aux laboratoires vétérinaires centraux. La faible disponibilité des infrastructures de surveillance entraîne une sous-déclaration de maladies graves en provenance de régions éloignées. Plusieurs protocoles diagnostiques nécessitant une faible expertise technique ont été récemment élaborés, ce qui donne l’occasion d’établir un diagnostic de rage dans des laboratoires décentralisés. Nous présentons ici un protocole complet pour le diagnostic post mortem sur le terrain de la rage animale à l’aide d’un test de diagnostic immunochromatographique rapide (RIDT), de l’échantillonnage de biopsie du cerveau à l’interprétation finale. Nous complétons le protocole en décrivant une autre utilisation de l’appareil pour l’analyse moléculaire et le génotypage viral. RILT détecte facilement le virus de la rage et d’autres lyssavirus dans les échantillons de cerveau. Le principe de ces tests est simple : le matériel cérébral est appliqué sur une bande d’essai où les anticorps conjugués d’or se lient spécifiquement aux antigènes de la rage. Les complexes antigène-anticorps se lient davantage aux anticorps fixes sur la ligne d’essai, ce qui donne une ligne pourpre clairement visible. Le virus est inactivé dans la bande d’essai, mais l’ARN viral peut être extrait par la suite. Cela permet à la bande d’essai, plutôt qu’à l’échantillon infectieux du cerveau, d’être envoyée en toute sécurité et facilement à un laboratoire équipé pour confirmation et typage moléculaire. Sur la base d’une modification du protocole du fabricant, nous avons constaté une sensibilité accrue aux essais, atteignant 98 % par rapport à la méthode de référence de référence de référence de référence de référence d’or, le test direct d’anticorps d’immunofluorescence. Les avantages du test sont nombreux : rapide, facile à utiliser, peu coûteux et aucune exigence pour l’infrastructure de laboratoire, comme la microscopie ou la conformité à la chaîne du froid. Les RIDU représentent une alternative utile pour les zones où les méthodes de diagnostic de référence ne sont pas disponibles.
Introduction
La rage canine est la principale cause de la rage humaine, responsable mondialement d’environ 59 000 décès humains par an, presque tous dans les pays à revenu faible ou intermédiaire (LMICs) en Asie et en Afrique1. L’agent étiologique principal est un virus de la rage classique associé à la canine neurotropique (RABV, famille Rhabdoviridae, genre Lyssavirus, espèce Antiraby lyssavirus). Cependant, d’autres lyssavirus liés à la rage, qui circulent principalement chez les chauves-souris, causent également la maladie2,3. Dans les régions touchées, la surveillance et le contrôle des maladies sont souvent entravés par un engagement politique de faible niveau probablement dû au manque de données fiables4,5,6. L’une des raisons de la sous-déclaration de la maladie est l’absence de diagnostic en laboratoire, en partie en raison de l’accès limité aux laboratoires équipés et au personnel formé ainsi que des difficultés d’expédition des spécimens. Le diagnostic de laboratoire est nécessaire pour confirmer les cas de rage et permet en outre la caractérisation génétique des souches impliquées, fournissant un aperçu sur la transmission du virus au niveau régional4,5,7.
Les normes actuelles en or pour le diagnostic post mortem de la rage, approuvées par l’Organisation mondiale de la santé (OMS) et l’Organisation mondiale de la santé animale (OIE), sont le test d’anticorps fluorescents directs (DFAT), le test d’immunohistorichimie rapide directe (DRIT) et les méthodes moléculaires (p. ex., réaction en chaîne de polymérase de transcription inversée (RT-PCR)44,8. Toutefois, l’application appropriée dans les CMM demeure limitée en raison de l’insuffisance des installations de laboratoire dont l’alimentation électrique est incohérente, le transport par échantillonnage non refroidi et l’absence d’un système de gestion de la qualité. Étant donné que le diagnostic de la rage animale n’est généralement effectué que dans les laboratoires vétérinaires centraux des CMM, les données de surveillance existantes reflètent principalement la situation de la rage dans les zones urbaines.
Récemment mis au point des solutions de rechange diagnostiques à faible technologie offrent la possibilité d’établir un diagnostic de rage dans les régions éloignées et les laboratoires décentralisés de la rage4,8,9. Le test de diagnostic immunochromatographique rapide (RIDT) est un test de flux latéral basé sur l’immunochromatographie utilisant des anticorps de détecteur conjugués d’or et est un outil très prometteur de diagnostic de rage10,11,12,13. Le principe est simple : après dilution, le matériel cérébral est mélangé dans le tampon fourni, et quelques gouttes sont appliquées sur la bande d’essai où les anticorps monoclonaux conjugués d’or se lient spécifiquement aux antigènes de la rage, principalement les nucléoprotéines (Figure 1). Les complexes antigène-anticorps subissent alors une migration latérale du flux, se liant à la ligne d’essai (ligne T) à des anticorps fixes contre les antigènes de la rage, ce qui donne une ligne pourpre clairement visible. Les anticorps conjugués à l’or restants non liés aux antigènes de la rage continuent de migrer et de se fixer vers la membrane par des anticorps de ciblage supplémentaires, ce qui donne lieu à une ligne de contrôle pourpre clairement visible (ligne C).
La méthode à faible coût en une étape est rapide, extrêmement facile et ne nécessite pas d’équipement coûteux ou des conditions de stockage spéciales. Avec la modification du protocole du fabricant pour éliminer l’étape de dilution, presque tous les équipements et réactifs nécessaires pour effectuer l’essai sont inclus dans le kit14. Le résultat est lu après 5-10 minutes sans microscope. Il s’agit d’un avantage majeur par rapport au test DFAT, qui nécessite un microscope à fluorescence et un conjugué d’immunofluorescence, ainsi que le transport réfrigéré et le stockage des échantillons. Même le test DRIT, qui peut être effectué à l’aide d’un microscope léger, nécessite une chaîne du froid continue pour stocker les anticorps antirabiques, qui ne sont pas encore disponibles dans le commerce. Par rapport au DRIT, le RILT ne nécessite aucun produit chimique toxique, un avantage particulier dans les pays où l’élimination des déchets est mal réglementée. Le test rapide est moins long avec une interprétation beaucoup plus facile par rapport aux tests gold standard DFAT et DRIT. Cela permet d’effectuer des tests sur place par du personnel ayant une expertise technique limitée.
Sur la base de ces propriétés d’essai, le diagnostic rapide des animaux suspects dans les régions éloignées devient faisable, facilitant la mise en œuvre de la prophylaxie post-exposition (PPE) pour les personnes exposées dès que possible. De plus, le transport à distance des échantillons de rage n’est pas nécessaire, ce qui se traduit par une meilleure qualité de l’échantillon au moment des tests. Toutefois, les résultats obtenus avec les tests RIKT devraient actuellement être confirmés à l’aide d’un test de diagnostic de référence tel que le DFAT ou le DRIT.
Les techniques de RIKT pour la détection du RABV et d’autres lyssavirus ont été évaluées. L’une des premières études a été menée par des chercheurs coréens en 200710. Par rapport à la méthode DFAT, dans 51 échantillons d’animaux et 4 isolats rabv, le RIDT a montré une sensibilité et une spécificité de 91,7% et 100%, respectivement. Ces résultats ont été confirmés plus tard avec 110 échantillons de cerveau animal de Corée, avec sensibilité et spécificité, comparés au DFAT, de 95% et 98,9%, respectivement15. Plus récemment, d’autres études ont évalué la performance de ce RIDT à l’aide d’isolats de virus et/ou d’échantillons de cerveau infectés provenant de divers animaux d’origines géographiques différentes. Un panel de 21 échantillons, dont le RABV africain et d’autres lyssavirus africains (virus Duvenhage (DUVV), le virus de la chauve-souris de Lagos (LBV) et le virus Mokola (MOKV)), ont été détectés avec succès, avec une sensibilité de 100% par rapport au DFAT16. Sensibilité élevée similaire (96,5 %) et spécificité (100%) valeurs ont été obtenues à partir d’un panel de 115 échantillons de cerveaux d’Ethiopie17. Une autre étude a évalué les isolats européens de RABV, deux autres lyssavirus européens (lyssavirus européen de chauve-souris de type 1 (EBLV-1) et type 2 (EBLV-2)), et le lyssavirus australien de chauve-souris (ABLV)18. D’après l’analyse de 172 échantillons de cerveaux d’animaux, le kit RIDT avait une sensibilité de 88,3 % et une spécificité de 100 % par rapport au DFAT, et les trois lyssavirus liés à la rage ont été détectés avec succès. Dans cette étude, certains des résultats faux négatifs provenaient d’échantillons de cerveau stockés dans le tampon glycérol, suggérant que l’élimination inappropriée du glycérol a influencé le flux capillaire ou la liaison d’anticorps. Une analyse récente de 43 échantillons cliniques de chauves-souris australiennes a confirmé les résultats des tests précédents, avec une concordance complète avec le DFAT19. Deux études ont été menées en Inde à l’aide du RIKT sur un nombre limité d’échantillons cliniques (11 et 34 échantillons). Par rapport au DFAT, la sensibilité se faisait entre 85,7 % et 91,7 % et la spécificité était de 100 %20,21. Une autre évaluation de ce kit à l’aide de 80 échantillons de cerveaux d’animaux d’Afrique, d’Europe et du Moyen-Orient a obtenu une concordance complète avec le DFAT pour la spécificité (100%) mais une sensibilité plus élevée (96,9%) par rapport aux études précédentes22. Dans une récente comparaison inter-laboratoire de ce RIDT effectuée dans 22 laboratoires différents à l’aide d’un panel de 10 échantillons, la concordance globale était de 99,5%23.
Une seule étude multicentrique récente a montré une performance globale insatisfaisante de RIDT24. Des échantillons de trois ensembles de données différents ont été testés et ont fourni des valeurs de sensibilité et de spécificité variables par rapport au DFAT. Par exemple, la sensibilité et la spécificité obtenues avec le premier panneau (n=51) et le deuxième panneau (n=31) d’échantillons d’animaux infectés expérimentaux, tous testés en laboratoire A, ont donné une sensibilité de 16 % et 43 %, respectivement, alors que la spécificité était de 100 % pour les deux. Inversement, les résultats du troisième panel (n=30) d’échantillons cliniques sur le terrain analysés par le laboratoire B ont fourni une concordance complète avec les résultats du DFAT, qui a été encore presque entièrement confirmée par le laboratoire A (sensibilité à 85 % et spécificité à 100 %). La variation par lot a été suggérée comme explication possible de la sensibilité relativement faible avec rikt24.
Dans le même temps, une autre étude a effectué un processus de validation similaire de ce qui précède décrit RILT, avec une modification du protocole recommandé par le fabricant14. L’étape de pré-dilution (1:10) dans PBS a été omise pendant la préparation du matériel cérébral. Sur la base de ce protocole modifié plus simple, les auteurs ont obtenu une sensibilité et une spécificité de 95,3% et 93,3%, respectivement, par rapport au DFAT en testant, dans des conditions de laboratoire, un ensemble de données de 73 échantillons de cerveaux animaux, infectés naturellement ou expérimentalement par diverses souches de RABV. L’étude a présenté la première évaluation de ce RILT dans un contexte de terrain (Tchad, Afrique). Dans 48 échantillons cliniques de cerveau, la sensibilité et la spécificité étaient 94.4% et 100%, respectivement. Les écarts entre le DFAT et le RIKT étaient dus à de faux résultats positifs avec le DFAT, déterminés après confirmation avec RT-PCR. Lorsque ces résultats ont été supprimés, il y avait une concordance complète, et il a démontré que le RIDT était plus fiable que le DFAT dans ces conditions sur le terrain14. Aucune variation par lot à lot n’a été observée à l’aide du protocole modifié. Lorsque le protocole modifié a été appliqué à un petit nombre d’échantillons divergents du DFAT/RIDT (n=8) dans l’étude d’Eggerbauer etal.24, tous ont été trouvés concordants (sensibilité à 100 %).
Un autre avantage majeur du RIDT est l’utilisation secondaire pour détecter l’ARN viral fixé sur la bande en utilisant des techniques moléculaires (telles que RT-PCR) et le génotypage ultérieur14,24. À la suite d’une étape d’extraction, Léchenne et coll.14 ont démontré un ARN viral fixé sur la membrane du dispositif Anigen à l’aide de RT-PCR avec une sensibilité de 86,3 % dans un panel de 51 échantillons (dont 18 échantillons testés et expédiés du Tchad à température ambiante). Le génotypage subséquent a été possible dans 93 % des 14 échantillons testés. Le séquençage de Sanger des amplicons de PCR d’au moins 500 nucléotides de longueur ont été utilisés. En plus des isolats rabv, le test a détecté quatre autres espèces de lyssavirus, DUVV, EBLV-1, EBLV-2 et Bkeloh bat lyssavirus (BBLV), au cours d’un test international complet de laboratoireinternational 14. La sensibilité de la détection de l’ARN viral était encore plus élevée (100%) dans l’étude d’Eggerbauer et coll., basée sur l’examen d’échantillons de laboratoire24. Cette dernière étude a également démontré que la mémoire tampon utilisée dans le kit RIDT inactivé le virus. Ainsi, les appareils peuvent être expédiés facilement, à température ambiante, sans précautions spécifiques de biosécurité pour les laboratoires de référence, pour la confirmation moléculaire et le génotypage.
Sur la base des évaluations précédentes, les outils RIDT offrent de nombreux avantages pour une utilisation dans les paramètres de terrain, en particulier lorsque les techniques de diagnostic de référence ne sont pas disponibles. Cependant, ce test a également quelques limitations, en particulier, faible sensibilité de détection d’antigènes14,24. Le test s’applique aux échantillons contenant de grandes quantités d’antigènes viraux, tels que des échantillons de cerveaux. Cependant, il n’est pas approprié pour d’autres échantillons tels que la salive ou d’autres liquides corporels. Un autre inconvénient est le coût de l’appareil (environ 5-10 euros en Europe), qui est moins cher par rapport au coût d’exécution DFAT, RT-PCR ou DRIT, mais qui reste élevé pour les LMICs. Toutefois, le développement et la validation futurs de RIDT similaires provenant d’autres entreprises pourraient entraîner une baisse des prix. Une étude a fait état de variations par lot à par lots. Bien qu’ils ne soient pas signalés par d’autres, des contrôles de qualité stricts devraient néanmoins être effectués lors de l’essai d’un nouveau lot, comme pour tout réactif utilisé dans un environnement de gestion de la qualité. L’utilisation du protocole modifié n’a pas été modifiée lors de l’utilisation de différents lots14. Toutes les études, à l’exception d’une étude, ont démontré que la sensibilité du RDIT était élevée par rapport au DFAT (environ 90 %-95 %). Étant donné que la rage est toujours mortelle, il est toujours fortement recommandé de confirmer les résultats négatifs avec rdit à l’aide d’un test de diagnostic de référence comme le DFAT, le DRIT ou le RT-PCR14.
Dans ce manuscrit, nous présentons un protocole complet pour le diagnostic post mortem sur le terrain de la rage animale basé sur un exemple d’un RIKT commercialisé, de la collecte d’échantillons de cerveau à l’application d’un protocole modifié par rapport aux recommandations du fabricant (qui ont été précédemmentvalidées 14) et l’analyse moléculaire ultérieure. Ce protocole a été appliqué et validé plusieurs fois dans des conditions de terrain en Afrique de l’Ouest et centrale, où le RIDT a été utilisé régulièrement pour le diagnostic de la rage parallèlement au test DFAT. Nous démontrons en outre une deuxième application pour l’appareil, en laboratoire, pour l’extraction et la détection à l’aide de RT-PCR de l’ARN viral fixé sur l’appareil.
Protocol
1. Collecte d’échantillons via le magnum foramen (route occipitale)25
REMARQUE : Cette technique peut être mise en œuvre dans des conditions de laboratoire ou sur le terrain. Les échantillons doivent être traités dès que possible après le décès de l’animal suspect ou conservés à température fraîche (réfrigérés ou congelés, si possible) afin d’éviter la décomposition qui pourrait affecter les résultats. À l’instar d’autres techniques de référence basées sur la détection d’antigènes lyssavirus comme le DFAT et le DRIT, les échantillons décomposés ne doivent pas être testés parce qu’ils peuvent influer sur le résultat (risque de résultat faussement négatif).
ATTENTION : Tous les échantillons doivent être considérés comme potentiellement infectieux. Les règlements et procédures de sécurité doivent être strictement respectés, même dans les milieux de terrain4. En particulier, portez l’équipement de protection individuelle approprié, y compris un masque, des lunettes, des gants et un manteau de laboratoire. Utiliser un désinfectant approprié pour les décontaminations de matériaux et d’échantillons (p. ex., hypochlorite de sodium avec dilutions recommandées du fabricant, 70 % d’alcool - éthanol ou isopropanol, solution de savon à 1 %). Tout le personnel qui manipule des échantillons doit être vacciné contre la rage.
- Retirer la tête de l’animal à l’aide d’un couteau avant la première vertèbre cervicale (vertèbre de l’atlas) pour accéder au magnum foramen.
REMARQUE : Pour réduire au minimum les aérosols infectieux, évitez d’utiliser une scie manuelle ou un outil similaire. - Prélever un échantillon de tronc cérébral (medulla oblongata) à l’aide d’une pipette en plastique jetable (figure 2A),d’unepaille à boire ( figure 2B),d’unepince ( figure 2C)ou d’un goutte-à-goutte (fourni avec le RIDT) (figure 2D).
REMARQUE : Une attention particulière doit être accordée lors de la collecte de l’échantillon, car il s’agit d’une étape très importante pour la fiabilité des résultats. En plus de la vidéo associée qui montre d’une manière simple comment recueillir la partie du tronc cérébral d’intérêt, une étape de formation est fortement recommandée pour s’assurer de recueillir la section anatomique correcte. - En option et en plus du tronc cérébral (medulla oblongata), recueillir d’autres parties du tronc cérébral ou du cerveau (cervelet, hippocampe, thalamus et cortex) par la même voie occipitale en poussant et en faisant pivoter la pipette en plastique ou la paille versl’orbiteoculaire ( Figure 3 ).
- Si vous utilisez une paille ou une pipette, pressez-la doucement pour déposer l’échantillon cérébral (0,5 à 2 g) dans un tube pour une analyse ultérieure et/ou une biobanque.
REMARQUE : Le stockage de l’échantillon dans le glycérol n’est pas recommandé, car il semble affecter le flux capillaire ou l’étape de liaison des anticorps du RIKT18.
2. Exécution du protocole RIDT modifié14
REMARQUE : Cette modification omet une étape de dilution (1:10) dans PBS, telle que spécifiée dans le protocole du fabricant (toutes les versions), et peut être implémentée sous les paramètres de laboratoire ou de champ.
- Utilisez l’écouvillon/goutte-à-goutte pour recueillir l’équivalent d’une demi-arachide ou d’un pois (0,1 à 0,5 g) de matériel cérébral et le placer dans le tube tampon.
REMARQUE : Pour le protocole modifié, tous les réactifs/consommables sont inclus dans le kit (aucun PBS ou tube supplémentaire n’est nécessaire) (figure 4). Documentez le numéro de lot du kit et vérifiez la validité de la date d’expiration. - Écraser soigneusement le matériau cérébral directement dans le tube avec l’écouvillon ou le goutte-à-goutte pendant environ 30 s jusqu’à ce qu’une suspension homogène soit obtenue.
REMARQUE : La réaction tampon inactive l’infectiosité du virus dans les conditions du protocole24du fabricant . - À l’aide du goutte-à-goutte, déposer quatre gouttes (environ 100 μL) de la suspension dans l’entrée de l’échantillon sur le dispositif d’essai.
- Attendez la migration complète de l’échantillon (1-5 min) avant de lire le périphérique de test. La migration doit commencer rapidement après le dépôt de l’échantillon (1-5 min).
- En cas de retard (en raison d’une suspension de viscosité élevée) ou pour accélérer le début de la migration, grattez doucement le bas du site de dépôt de l’appareil avec le dropper (1-5 fois) et éventuellement ajouter 1-2 gouttes de plus. La migration doit commencer immédiatement par la suite.
- Lisez le résultat du test dans la fenêtre de détection après 5-10 min, et pas plus de 20 min, après la fin de la migration.
- Interpréter le résultat en fonction de la présence ou de l’absence de la ligne de commande (ligne C) et de la ligne d’essai (ligne T) (lignes violettes) dans la fenêtre de détection, selon la figure 5. Considérez l’échantillon positif lorsque deux lignes sont visibles (figure 5A),négatif si seulement la ligne C est présente (figure 5B) et non valide si seule la ligne T est présente ou si aucune ligne n’est visible (figure 5C).
REMARQUE : Les résultats non valides doivent être répétés au moins une fois. D’autres techniques doivent être effectuées si les résultats restent invalides. Les résultats négatifs obtenus avec ridt doivent ensuite être confirmés à l’aide d’une méthode de référence de référence de référence d’étalon-or, comme le DFAT, le DRIT et les méthodes moléculaires (réaction en chaîne de polymérase ou PCR). Même si la sensibilité de ce test est élevée (voir résultats représentatifs), il n’est pas à 100%. - Conserver les appareils usagés à température ambiante ou réfrigérer/congeler lorsque c’est possible pour une analyse moléculaire ultérieure (voir la section 4). Congeler la suspension de l’échantillon restante à -20 °C/-80 °C dans le tube tampon pour répéter l’essai si nécessaire ou pour une analyse moléculaire ultérieure.
3. Extraction et détection de l’ARN par RT-qPCR à partir du dispositif RIDT
REMARQUE : Cette étape ne peut être mise en œuvre que dans des conditions de laboratoire avec un environnement adapté et un équipement approprié pour le diagnostic moléculaire. Il peut être fait peu de temps après le test RIDT ou rétrospectivement sur les appareils RIDD archivés, stockés à température ambiante (15-30 °C), réfrigérés ou congelés.
- Extraction de l’ARN
REMARQUE : Pour surveiller l’étape d’extraction, il est recommandé d’utiliser un contrôle interne qui peut être un ARNm endogène (comme l’ß-actine) ou un contrôle exogène (tel que l’ARN synthétique eGFP) directement piqué dans l’échantillon pendant les premières étapes de l’extraction26,27.- Ouvrez soigneusement l’appareil et retirez le papier filtre.
- Couper la zone de dépôt de l’échantillon et le placer dans un tube contenant 1 ml de LS Tri-Réactif. Incuber à RT pendant 1 heure avec une douce agitation manuelle régulière.
- Effectuer l’extraction conformément aux recommandations du fabricant, comme décrit précédemment27. À cette étape, le contrôle interne exogène peut être ajouté.
- Pendant le processus, ajouter 2 μL de glycogène pour faciliter les précipitations de l’ARN, selon les recommandations du fabricant.
- Ajuster le volume final pour la resuspension de l’ARN dans de l’eau sans nucléase, avec un volume de 50 μL généralement utilisé.
REMARQUE : À la fin de l’étape de centrifuge pour la séparation des phases aqueuses et organiques (après l’ajout de 200 μL de chloroforme dans le LS tri-réactif), le morceau de membrane de l’appareil sera au fond du tube et n’interférera pas avec la collecte de la phase aqueuse supérieure. Alternativement, d’autres protocoles faciles et rapides peuvent être utilisés, par exemple, à l’aide de réactifs à base de phénol et de membranes de silice28.
- Détection par RT-qPCR26
REMARQUE : La détection de l’ARN viral potentiel présent dans les échantillons extraits peut se faire à l’aide de différentes techniques moléculaires, telles que le PCR à transcription inversée, le PCR conventionnel (point de terminaison) ou le PCR en temps réel (qPCR). Plusieurs méthodes sont disponibles, telles que les classiques RT-PCR27,29 ou RT-qPCR26,30 ciblant la nucléoprotéine virale ou le gène de la polymérase. Un exemple sera présenté ci-dessous sur la base d’un double combiné pan-lyssavirus RT-qPCR ciblant une région conservée parmi la polymérase virale. Cette technique RT-qPCR associe deux RT-qPCR différents : l’une basée sur la technologie de sonde TaqMan (pan-RABV RT-qPCR) et l’autre à l’aide de la détection SyBR Green (pan-lyssa RT-qPCR). En outre, la détection d’un contrôle interne exogène (ARN eGFP) directement piqué pendant le processus d’extraction est effectuée par un RT-qPCR spécifique basé sur la sonde TaqMan (eGFP RT-qPCR). Il est important, en particulier, de vérifier que les amorces et les sondes pour RT-PCR en temps réel sont adaptées pour la détection des souches circulant dans la région d’intérêt4.- Diluer l’échantillon d’ARN à 1:10 dans l’eau libre de nucléase. Testez chaque échantillon d’ARN en double, à l’aide d’une plaque de réaction de 96 puits ou d’autres formats. Utilisez des contrôles positifs et négatifs pour chaque test et testez au moins en double.
- Préparer la solution de réaction de mix maître pour les trois différents tests RT-qPCR selon le tableau 1, et avec les amorces/sondes indiquées dans le tableau 2.
- Ajouter 5 μL d’échantillons d’ARN dilué et 15 μL de mélange principal à chacun des trois tests différents. L’essai RT-qPCR pan-RABV et le test RT-qPCR eGFP peuvent cycle dans la même plaque.
- Exécutez les différents tests suivant les conditions de cycle thermique indiquées au tableau 3. Si un seul cycleur thermique PCR est disponible, commencez par le pan-RABV RT-qPCR et gardez la plaque pour la pan-lyssa RT-qPCR à 4 °C jusqu’à la fin du pan-RABV RT-qPCR.
- Analyser les résultats obtenus avec les trois essais selon le tableau 4.
4. Génotypage après extraction de l’ARN à partir du dispositif RIDT
- Transcription inversée RT27,29
- Préparer un mélange principal avec 6 μL d’ARN, 2 μL d’amorces aléatoires pd(N)6 (200 μg/μL) et 2 μL d’eau sans nucléase pour un volume final de 10 μL.
- Incuber à 65 °C pendant 10 min dans un bloc de chaleur, puis conserver sur la glace.
- Préparer un mélange principal avec 6 μL de tampon 5x first-strand, 2 μL de 0,1 M de dithiothreitol (TNT), 1 μL (200 U) de transcriptionase inverse Superscript II, 2 μL (80 U) de RNasin, 2 μL de mélange dNTP (10 μM) et complet avec de l’eau sans nucléase pour obtenir un volume final de 20 μL pour chaque échantillon.
- Ajouter le mélange principal (20 μL) à l’échantillon (10 μL) (volume final de 30 μL) et incuber à 42 °C pendant 90 min dans un bloc thermique.
- Passez à l’étape suivante avec l’amplification pcr ou stockez l’ADC à -20 °C.
- PCR conventionnel27,29,31
REMARQUE : Différentes techniques de PCR conventionnelles sont disponibles pour le génotypage. Deux sont présentés, les deux hemi-imbriqué PCR, ciblant une partie de la nucléoprotéine ou une partie de la protéine virale du lyssavirus. Le protocole est le même pour chacun de ces tests, à l’exception des amorces et des conditions de cyclisme. Les contrôles positifs (ARN positif) et négatifs (ADC négatif et/ou eau sans nucléase) devraient être inclus dans chaque série et chaque série de PCR.- Préparez pour chaque échantillon dans un microtube de 0,2 mL une solution de réaction de mix maître pour la première étape PCR. Ce mélange contient 5 μL de tampon de réaction NH4 10x, 2,5 μL de solution MgCl2 (50 mM), 1 μL de mix dNTP (10 μM), 1 μL de chaque amorce (10 μM), 0,2 μL (1 U) de polymérase d’ADN biotaq et 37,3 μL d’eau libre de nucléase (volume final de 48 μL). Les amorces sont indiquées dans le tableau 5.
- Ajouter 2 μL d’ADC dans chaque tube et cycle sur un cycle thermique PCR conventionnel distinct pour chaque essai, selon le tableau 6.
- Préparer une deuxième solution de réaction de mélange maître identique à la précédente avec l’utilisation des amorces appropriées (Tableau 5) pour la réaction pcr hemi-imbriqué.
- Ajouter 2 μL du premier produit PCR et le cycle sur un cycleur thermique PCR conventionnel en utilisant les paramètres de cycle indiqués dans le tableau 6.
- Visualiser les différents produits PCR (pcr du premier et du deuxième tour) après les avoir chargés sur un gel agarose de 1% (100 mL de tampon EDTA tris-acétate 1x - TAE 1x) avec bromure d’éthidium (concentration finale autour de 0,01%) et faire couler le gel pendant 30 min à 120 V. Un résultat pcr positif est observé sous la forme d’une bande lumineuse de la taille prévue (Tableau 5).
- Séquençage sanger
- Effectuer un séquençage Sanger des amplicons obtenus avec le PCR hemi pan-lyssavirus et compléter l’analyse de génotypage.
Representative Results
Comme pour toute méthode de diagnostic, la collecte d’échantillons est d’une importance capitale pour la fiabilité des résultats, en particulier lorsqu’elle est effectuée dans les paramètres de terrain. Le processus de collecte doit être aussi simple que possible pour garantir la collecte d’échantillons de haute qualité. La collecte d’une biopsie du cerveau (tronc cérébral avec médulla oblongata) par l’intermédiaire de la voie avant-plan magnum pour le diagnostic post mortem de la rage animale répond à cette exigence, comme indiqué dans la figure 2A-D25.
Après la collecte, l’échantillon cérébral est soumis au protocole modifié du RIKT, résumé à la figure 6. Comme indiqué dans la section Protocole, l’adaptation majeure du protocole fourni par le fabricant est l’omission de l’étape de dilution dans pbs, qui simplifie la procédure et les consommables/réactifs nécessaires, donc tous inclus dans le kit (figure 4).
Ce protocole modifié a été mis en œuvre et évalué dans cinq laboratoires différents, dont un centre de collaboration de l’OMS sur la rage (Lab 1, France), un centre de référence de la FAO pour la rage (Lab 5, Italie) et trois laboratoires de référence situés dans des pays africains enzootiques, le Tchad (Lab 2), la Côte d’Ivoire (Lab 3) et le Mali (Lab 4). Au Tchad, une évaluation du RILT a été effectuée en laboratoire et sur le terrain.
Par rapport à la technique de référence DFAT, la sensibilité et la spécificité du RDIT étaient élevées pour tous les laboratoires, avec respectivement 96 % à 100 % et 93,7 % à 100 % (tableau 7). La sensibilité et la spécificité les plus faibles du RDIT ont été obtenues pour le laboratoire 1 (France) lors de l’étape de validation en laboratoire. D’après le nombre cumulatif d’échantillons testés (n=162) (tableau supplémentaire 1),la sensibilité globale et la spécificité par rapport au DFAT étaient respectivement de 98,2 % et 95,8 % (tableau 7). Toutefois, ces résultats préliminaires mais prometteurs ont été obtenus sur un ensemble limité de données d’échantillons et doivent être confirmés sur un grand nombre d’échantillons positifs et négatifs, en particulier pour ceux testés dans les zones enzootiques, afin d’éviter toute sous-estimation ou biais potentiel dû aux ensembles de données hétérogènes actuels.
Le test RIDT est approprié pour détecter le lyssavirus dans les biopsies cérébrales d’animaux infectés, où le niveau d’antigènes lyssavirus est important. Toutefois, la limite de détection des tests demeure élevée lors du test de la suspension du virus titré (tableau 8; Figure 7).
Le tableau 9 (de Léchenne 201614)montre un exemple de résultats obtenus après la détection de l’ARN par le double pan-lyssavirus combiné RT-qPCR ciblant la polymérase virale du lyssavirus. Un panel de 51 tests ridt positifs effectués en laboratoire (laboratoire 1, n=32) ou au Tchad (laboratoire 2, n=19) puis expédié à température ambiante au laboratoire 1, a été testé. La détection positive a été obtenue pour 18 (94,7 %), 26 (81,2 %) et 44 (86,3 %) échantillons du laboratoire 1, du laboratoire 2 et des deux combinés, respectivement. En outre, le génotypage a été effectué pour 14 de ces échantillons (10 du laboratoire 1 et 4 du laboratoire 2) utilisant le PCR hemi-imbriqué ciblant le gène partiel de nucléoprotéine et a réussi pour 13 d’entre eux (93%) (de Léchenne et coll. 201614).
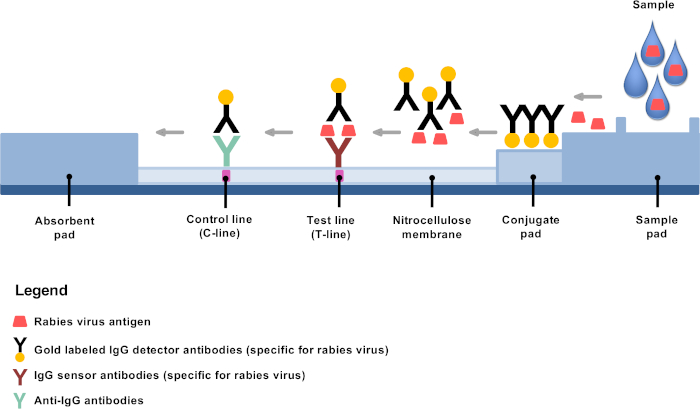
Figure 1 : Représentation schématique de la structure d’un RIKT pour le diagnostic de la rage. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Exemples de techniques simples rapides pour la collecte d’échantillons de cerveau (tronc cérébral avec médulla oblongata) chez les animaux (chien montré ici) par l’intermédiaire du foramen occipital dans les milieux de terrain (Mali). (A) Collection avec pipette en plastique jetable (B) Collection avec une paille à boire en plastique (C) Collection avec une pince (D) Collection avec le dropper d’élimination fourni dans le kit RIDT. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
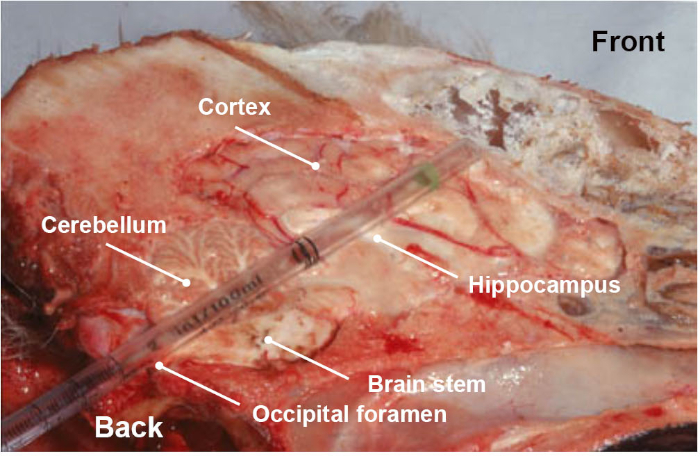
Figure 3 : Section anatomique longitudinale de la tête de chien, montrant les différentes parties du cerveau (tronc cérébral, cervelet, hippocampe, thalamus et cortex) recueillies en poussant, dans un mouvement de rotation, une pipette en plastique jetable à travers la route occipitale foramen. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Description du contenu du kit RIKT, y compris l’appareil, un goutte-à-goutte en plastique jetable, un écouvillon jetable et le diluant d’essai. Le tube où l’échantillon sera prélevé et stocké n’est pas fourni. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
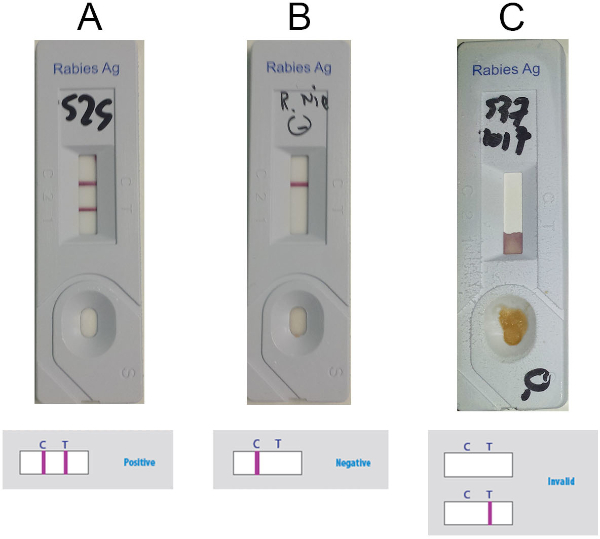
Figure 5 : Résultats représentatifs pour l’interprétation de l’Anigen RILT. (A) Résultats positifs (présence visible de deux lignes, ligne C et ligne T) (B) Résultats négatifs (présence visible de la ligne C seulement) (C) Résultats non valides (absence de ligne C visible). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 6 : Représentation schématique du protocole RIDT, adapté des instructions du fabricant. (A) Version modifiée du protocole, avec suppression de l’étape de dilution recommandée par le fabricant (B) Protocole initial recommandé par le fabricant, avec une étape de dilution avant 1:10 dans pbs des échantillons de cerveau. Les étapes supprimées dans la version modifiée du protocole (présentée à la figure 6A)sont indiquées avec une ligne rouge. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
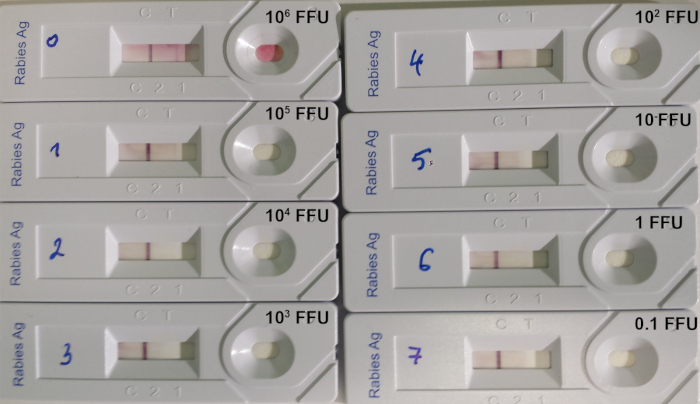
Figure 7 : Exemple de détermination de la limite de détection du RIKT14. Une dilution série 10:1 d’un virus de la rage titré de la souche 9704ARG a été utilisée. La quantité de virus déposée sur chaque appareil est indiquée dans FFU (unités fluorescentes de formation de focus). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Essai Pan-RABV RT-qPCR | |
| Réactif | μL/Réaction |
| 2X Reaction Mix (un tampon contenant 0,4 mM de chaque dNTP et 6 mM MgSO4) | 10 |
| Eau libre de nucléase | 1.5 |
| Taq3long (Vers l’avant) [10 μM] | 1 |
| Taq17revlong (Reverse) [10 μM] | 1 |
| RABV4 [10 μM] | 0.3 |
| RABV5 [10 μM] | 0.3 |
| MgSO4 [50 mM] (fourni dans le kit) | 0.25 |
| Colorant de référence ROX (25 μM) (fourni dans le kit) | 0.05 |
| RNasin (40U/μL) (Promega) | 0.2 |
| SuperScript III RT/Platinum Taq Mix | 0.4 |
| Total par réaction | 15 |
| eGFP RT-qPCR essai | |
| Réactif | μL/Réaction |
| 2X Reaction Mix (un tampon contenant 0,4 mM de chaque dNTP et 6 mM MgSO4) | 10 |
| Eau libre de nucléase | 2.8 |
| EGFP1F (Attaquant) [10 μM] | 0.5 |
| EGFP2R (Reverse) [10 μM] | 0.5 |
| sonde eGFP [10 μM] | 0.3 |
| MgSO4 [50 mM] (fourni dans le kit) | 0.25 |
| Colorant de référence ROX (25 μM) (fourni dans le kit) | 0.05 |
| RNasin (40U/μL) (Promega) | 0.2 |
| SuperScript III RT/Platinum Taq Mix | 0.4 |
| Total par réaction | 15 |
| Essai Pan-lyssa RT-qPCR | |
| Réactif | μL/Réaction |
| 2x Mix de réaction vert SYBR | 10 |
| Eau libre de nucléase | 2.1 |
| Taq5long (Vers l’avant) [10 μM] | 1 |
| Taq16revlong (Reverse) [10 μM] | 1 |
| MgSO4 [50 mM] (fourni dans le kit) | 0.25 |
| Colorant de référence ROX (25 μM) | 0.05 |
| RNasin (40U/μL) (Promega) | 0.2 |
| SuperScript III RT/Platinum Taq Mix | 0.4 |
| Total par réaction | 15 |
Tableau 1 : Description de la solution de réaction de mélange principal pour les trois différents tests RT-qPCR (pan-RABV RT-qPCR, pan-lyssa RT-qPCR et eGFP RT-qPCR).
| Essai RT-qPCR | Nom | Type | Longueur | Séquence (5'-3') | Sens | Position |
| essai pan-RABV RT-qPCR | Taq3long | Amorce | 22 | ATG AGA AGT GGA AYA AYC ATC A | S | 7273-7294a |
| Taq17revlong | Amorce | 25 | GAT CTG TCT GAA TAA TAG AYC CAR G | Comme | 7390-7414a | |
| RABV4 | Sonde (FAM/TAMRA) | 29 | AAC ACY TGA TCB AGK ACA GAR AAY ACA TC | Comme | 7314-7342a | |
| RABV5 | Sonde (FAM/TAMRA) | 32 | AGR GTG TTT TCY AGR ACW CAY GAG TTT TTY CA | S | 7353-7384a | |
| Essai Pan-lyssa RT-qPCR | Taq5long | Amorce | 23 | TAT GAG AAA TGG AAC AAY CAY CA | S | 7272-7294a |
| Taq16revlong | Amorce | 25 | GAT TTT TGA AAG AAC TCA TGK GTY C | Comme | 7366-7390a | |
| eGFP RT-qPCR essai | EGFP1F | Amorce | 20 | GAC CAC TAC CAG CAG AAC AC | S | 637-656b |
| EGFP2R | Amorce | 19 | GAA CTC CAG CAG GAC CAT G | Comme | 768-750b | |
| EGFP | Sonde (FAM/TAMRA) | 22 | AGC ACC CAG TCC GCC CTG AGC A | S | 703-724b |
Tableau 2 : Description des amorces/sondes pour les trois différents tests RT-qPCR (pan-RABV RT-qPCR, pan-lyssa RT-qPCR et eGFP RT-qPCR). un Selon la séquence du génome du virus Pasteur (PV) (numéro d’adhésion GenBank M13215). b Selon la séquence pEGFP-1 vecteur de clonage (numéro d’adhésion GenBank U55761).
| Essais RT-qPCR et eGFP RT-qPCR | ||||
| Étape | Cycle | Temp | Heure | Collecte de données |
| Transcription inversée | 1 | 45 °C | 15 min | |
| Inactivation RT/dénaturation initiale | 1 | 95 °C | 3 min | |
| Amplification | 40 | 95 °C | 15 s | |
| 61 °C | 1 min | Point de terminaison | ||
| Essai Pan-lyssa RT-qPCR | ||||
| Étape | Cycle | Temp | Heure | Collecte de données |
| Transcription inversée | 1 | 45 °C | 15 min | |
| Inactivation RT/dénaturation initiale | 1 | 95 °C | 3 min | |
| Amplification | 40 | 95 °C | 15 s | |
| 55 °C | 1 min | Point de terminaison | ||
| Courbe de dissociation | 1 | 95 °C | 15 s | Augmentation de 0,1 °C/s, 55–95 °C |
| 55 °C | 1 min | |||
| 95 °C | 15 s | |||
| 55 °C | 15 s | |||
Tableau 3 : Description des conditions de cycle thermique des trois différents tests RT-qPCR (pan-RABV RT-qPCR, pan-lyssa RT-qPCR et eGFP RT-qPCR).
| Dosage | Analyse | Résultats | Interprétation |
| eGFP RT-qPCR | Cq dans l’intervalle d’acceptation | Extraction validée | L’analyse d’autres tests peut être effectuée |
| Cq hors de l’intervalle d’acceptation | Extraction non validée | Retester l’échantillon (répéter l’exécution ou/et l’extraction), demander un autre échantillon si nécessaire | |
| pan-RABV RT-qPCR | Cq <38 | Positif | Détection positive de l’ARN viral |
| Cq ≥38 | Négatif | Analyse de l’essai pan-lyssa RT-qPCR | |
| pan-lyssa RT-qPCR | Courbe de fusion considérée comme positive | Positif | Détection positive de l’ARN viral |
| Courbe de fusion considérée comme négative | Négatif | Absence de détection de l’ARN viral |
Tableau 4 : Interprétation globale du double essai combiné du pan-lyssavirus RT-qPCR.
| Essai PCR conventionnel imbriqué par Hemi | Ronde PCR | Nom | Longueur | Séquence (5'-3') | Sens | Positionnerun | Taille d’Amplicon (pb) |
| PCR hemi-imbriqué ciblant le gène de la polymérase | 1er tour | PVO5m | 20 | ATG ACA GAC AAY YTG AAC AA | S | 7170-7189 | 320 |
| PVO9 | 19 | TGA CCA TTC CAR CAR GTN G | Comme | 7471-7489 | |||
| 2e tour | PVO5m | 20 | ATGA CAG ACA AYY TGA ACA A | S | 7170-7189 | 250 | |
| PVO8 | 22 | GGT CTG ATC TRT CWG ARY AAT A | Comme | 7398-7419 | |||
| PCR hemi-imbriqué ciblant le gène de la nucléoprotéine | 1er tour | N127 | 20 | ATG TAA CAC CTC TAC AAT GG | S | 55-74 | 1532 |
| N8m | 19 | CAG TCT CYT CNG CCA TCT C | Comme | 1568-1586 | |||
| 2e tour | N127 | 20 | ATG TAA CAC CTC TAC AAT GG | S | 55-74 | 845 | |
| N829 | 19 | GCC CTG GTT CGA ACA TTC T | Comme | 881-899 |
Tableau 5 : Description des amorces utilisées pour le PCR classique imbriqué par hemi.
| PCR hemi-imbriqué ciblant le gène de la polymérase | ||||
| Étape | Cycle | Température | Heure | |
| Premier et deuxième tours | Dénaturation initiale | 1 | 94 °C | 3 min |
| Dénaturation | 35 | 94 °C | 30 s | |
| Hybridation | 56 °C | 45 s | ||
| Allongement | 72 °C | 40 s | ||
| Élongation finale | 1 | 72 °C | 3 min | |
| PCR hemi-imbriqué ciblant le gène de la nucléoprotéine | ||||
| Étape | Cycle | Température | Heure | |
| Premier tour | Dénaturation initiale | 1 | 94 °C | 3 min |
| Dénaturation | 35 | 94 °C | 30 s | |
| Hybridation | 56 °C | 30 s | ||
| Allongement | 72 °C | 45 s | ||
| Élongation finale | 1 | 72 °C | 3 min | |
| Deuxième tour | Dénaturation initiale | 1 | 94 °C | 3 min |
| Dénaturation | 35 | 94 °C | 30 s | |
| Hybridation | 58 °C | 30 s | ||
| Allongement | 72 °C | 30 s | ||
| Élongation finale | 1 | 72 °C | 3 min | |
Tableau 6 : Description des conditions de cycle thermique pour le PCR classique imbriqué par hemi.
| Laboratoire | Pays | Période d’évaluation | Nb d’échantillons | Résultats du DFAT | Résultats rint | Sensibilité | Spécificité | ||
| Pos | Neg | Pos | Neg | ||||||
| Laboratoire 1 | France | 2015 | 82 | 50 | 32 | 50 | 32 | 96% | 93.7% |
| Laboratoire 2 | Tchad | 2012-2015 | 44 | 33 | 11 | 33 | 11 | 100% | 100% |
| Laboratoire 3 | Côte d’Ivoire | 2017 | 10 | 8 | 2 | 8 | 2 | 100% | 100% |
| Laboratoire 4 | Mali | 2017 | 18 | 15 | 3 | 15 | 3 | 100% | 100% |
| Laboratoire 6 | Italie | 2016 | 8 | 8 | 0 | 8 | 0 | 100% | - |
| Tous | 2015-2017 | 162 | 114 | 48 | 114 | 48 | 98.2% | 95.8% | |
Tableau 7 : Détermination des paramètres intrinsèques (sensibilité, spécificité) du test RIDT par rapport à la méthode de référence DFAT, sur la base de l’analyse d’un total de 162 échantillons et avec la participation de 5 laboratoires différents.
| Virus souchea | Hôte original | Emplacement | Concentration initiale (FFU/mL)b | Limite de détection (FFU/mL)c |
| (9147) | Renard rouge | France | 3,1 x 107 | 106 |
| Cvs | Isolat de laboratoire | - | 1,6 x 107 | 106 |
| (8743) | Humain | Thaïlande | 8,1 x 107 | > 8,1 x 106 |
| 9508CZK (SAD) | Isolat de laboratoire | - | 5,4 x 108 | 107 |
| Pv | Isolat de laboratoire | - | 4,3 x 107 | 106 |
| (9001) | Chien | Guyane | 2,4 x 106 | > 2,4 x 105 |
| (9704ARG) | Bat | Argentine | 9,5 x 107 | 105 |
| 04030PHI | Humain | Philippines | 2,5 x 107 | 105 |
Tableau 8 : Limite de détection du RILT à l’aide de 8 suspensions différentes du virus de la rage (de Léchenne et al. 201614). un CVS: Souche de virus Challenge, SAD: Street Alabama Dufferin, PV: Virus Pasteur. b Nombre d’unités fluorescentes de mise au point (FFU) par mL. c c Nombre d’unités fluorescentes de mise au point (FFU) déposées sur la bande.
| RILT a joué dans | ||||||||||
| Laboratoire 1 | Laboratoire 2 | Combiné | ||||||||
| Positif | Négatif | Total | Positif | Négatif | Total | Positif | Négatif | Total | ||
| Détection de l’ARN viral | Positif | 18 | 1 | 19 | 26 | 0 | 32 | 44 | 7 | 51 |
| Négatif | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 3 | 3 | |
| Total | 18 | 1 | 19 | 26 | 0 | 35 | 44 | 10 | 54 | |
Tableau 9 : Détection de l’ARN viral avec RT-qPCR sur la bande d’essai d’Anigen utilisée dans des conditions de laboratoire (laboratoire 1), dans des conditions de terrain et expédiée à température ambiante (laboratoire 2) ou combinée (de Léchenne et al., 201614).
Tableau supplémentaire 1 : Description des 162 échantillons testés au test RIKT pour déterminer ses paramètres intrinsèques présentés au tableau 7. Veuillez cliquer ici pour voir ce tableau (cliquez avec le bouton droit pour télécharger).
Discussion
Le RILT est une méthode simple, rapide et peu coûteuse pour le diagnostic post-mortem de la rage et une alternative prometteuse sur le terrain aux tests de laboratoire. L’application d’un tel test, en particulier pour les zones décentralisées des pays à revenu faible ou intermédiaire, améliorerait la compréhension de la prévalence et de la transmission du virus de la rage à l’échelle locale et potentiellement nationale. Lorsqu’il est combiné avec la méthode de collecte rapide d’échantillons de cerveau (sans autopsie complète), un grand avantage est que le test peut être entièrement effectué dans le cadre sur le terrain, loin des installations de laboratoire. Des échantillons de cerveau prélevés via le magnum foramen peuvent être utilisés pour des tests, il n’est donc pas nécessaire d’ouvrir complètement le crâne animal. Le test est simple à effectuer et à interpréter et convient particulièrement aux activités de surveillance sur le terrain14. D’autres avantages du RIKT par rapport au DFAT ou au DRIT ne sont pas nécessairement pour des contrôles positifs et négatifs et le stockage du kit à température ambiante. En outre, le protocole modifié, lorsque l’étape de dilution (1:10) en PBS est omise, ne nécessite pas de réactifs supplémentaires pour effectuer l’essai et simplifie davantage la procédure dans des conditions de terrain.
Un point clé est la qualité des échantillons de cerveau. Les échantillons doivent être prélevés et testés dès que possible après la mort de l’animal suspect, ou conservés à température fraîche avant l’essai, afin d’éviter la dégradation. Les échantillons décomposés ne doivent pas être testés car ils peuvent influer sur le résultat (risque de résultat faussement négatif). Bien qu’aucune donnée ne soit encore disponible concernant la perte de sensibilité du RIDT au fil du temps pour les échantillons de cerveau, nous supposons qu’il est similaire par rapport au test DFAT32. Cependant, le temps entre la mort de l’animal et l’exécution de l’essai peut être réduit, car le test peut être fait rapidement et directement sur le terrain. Ainsi, il y a en général un risque plus faible d’échantillons décomposés.
Une autre étape critique du protocole est la migration de suspension de l’échantillon. La migration doit commencer directement après le dépôt de l’échantillon (1-5 min). La viscosité élevée de la suspension pourrait donc avoir une influence négative sur la migration. Gratter doucement le fond du site de dépôt de l’appareil avec le dropper et ajouter 1-2 gouttes de plus résout souvent ce problème, et la migration commence immédiatement après.
La plupart des essais ridt effectués dans des laboratoires africains (Tchad, Côte d’Ivoire et Mali) ont été effectués à une température ambiante supérieure à 30 °C, alors que la plage de température pour le stockage et l’utilisation recommandée par le fabricant est de 15 °C - 30 °C. Bien que nous n’ayons pas identifié d’impact de température élevée sur les performances des essais RIKT, il est nécessaire de l’évaluer plus attentivement. De même, l’impact de la température élevée pendant le stockage et le transport de l’appareil après utilisation pour la détection de l’ARN viral et le génotypage nécessite une évaluation supplémentaire. La sensibilité de la détection de l’ARN viral par RT-qPCR de la bande RIDT peut être affectée par la qualité de l’échantillon cérébral initialement utilisé dans le test, mais aussi par l’état de stockage des tests RIDT après utilisation. Par exemple, la sensibilité de la détection de l’ARN était plus élevée lorsque les tests RIDT utilisés étaient stockés dans des conditions de laboratoire contrôlées (94,7 %) par rapport à dans des conditions de terrain (p. ex., Tchad) (81,2 %)14. Ces conditions peuvent également affecter l’intégrité (en particulier la longueur) de l’ARN fixé sur la bande, ce qui explique peut-être la sensibilité modérée pour le génotypage basé sur des amyplicons PCR plus longs (p. ex., >500 nucléotides)14. La sensibilité de RT-qPCR effectuée sur la bande d’essai était inférieure à celle obtenue à l’aide des cartes FTA Whatman (80,6 %)14. Semblable à d’autres techniques moléculaires, la charge virale peut également avoir un impact sur le succès du génotypage basé sur les bandes RDIT, avec des résultats négatifs potentiels pour les échantillons avec une faible charge virale14.
Le test n’est pas actuellement recommandé par l’OMS et l’OIE pour le diagnostic de routine et la surveillance des maladies, et un résultat ne peut pas être utilisé seul pour guider la prise de décision en MATIÈRE de PPE. D’autres validations de test sont encore nécessaires. Toutefois, un diagnostic rapide et précis de la rage est un élément crucial du bon fonctionnement des systèmes continus de surveillance de la rage et contribue à accroître l’engagement politique, ce qui est éminemment important pour réussir la lutte durable contre la rage33. Les tests rict offrent de nouvelles possibilités de diagnostic de la rage dans ce contexte et sont un outil utile pour étendre la surveillance de la rage animale sur le terrain dans les zones enzootiques à revenu faible ou moyen.
Acknowledgements
Ces travaux ont été soutenus par l’Alliance mondiale pour les vaccins et la vaccination (GAVI), la Fondation Wolfermann Nägeli, la Coopération suisse pour la recherche en Afrique (SARECO), le SWF Stiftung für wissenschaftliche Forschung, la Freiwillige Akademische Gesellschaft (FAG) Basel, le Programme bilatéral de coopération scientifique et technologique de la Suisse avec l’Asie et la Fondation Novartis pour la recherche biomédicale.
Nous remercions en particulier les propriétaires de chiens, le personnel vétérinaire et le personnel du laboratoire pour leur grand engagement. Nous tenons également à remercier Lisa Crump pour l’édition linguistique.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-Rabies Nucleocapsid Conjugate (lyophilizied, adsorbed) | Bio-Rad, France | 3572112 | Fluorescein-5-isothiocyanate (FITC) conjugated polyclonal antibody against the nucleocapsid of rabies virus. Use for the DFAT reference tecnnique. |
| Applied Biosystems 7500 Real-Time PCR System | Applied Biosystems, France | 4351104 | Amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| Disposable plastic pipette, drinking straw, clamp, dropper | - | - | Equipment used for the collection of the brain stem (medulla oblongata) via the foramen magnus (occipital route). |
| Evans Blue Solution 1% | Bio-Rad, France | 3574911 | Counter-coloration used for the DFAT to facilite the reading under UV microscope. |
| Primer eGFPF1 | Eurofins Genomics, Germany | - | Forward primer for the amplification of the internal control eGFP by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-GACCACTACCAGCAGAACAC-3'. |
| Primer eGFPR2 | Eurofins Genomics, Germany | - | Reverse primer for the amplification of the internal control eGFP by RT-qPCR after extraction from the RIDT device, sequence: 5'-GAACTCCAGCAGGACCATG-3'. |
| Primer Taq17 revlong | Eurofins Genomics, Germany | - | Reverse primer for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-ATGAGAAGTGG AAYAAYCATCA-3'. |
| Primer Taq3 long | Eurofins Genomics, Germany | - | Forward primer for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-GATCTGTCTGAA TAATAGAYCCARG-3'. |
| Probe eGFP FAM/TAMRA | Eurofins Genomics, Germany | - | Forward primer for the amplification of the internal control by RT-qPCR after extraction from the RIDT device, sequence: 5'-AGCACCCAGT CCGCCCTGAGCA-3'. |
| Probe RABV4 FAM/TAMRA | Eurofins Genomics, Germany | - | Probe for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-AACACYTGATCBA GKACAGARAAYACATC-3'. |
| Probe RABV5 FAM/TAMRA | Eurofins Genomics, Germany | - | Probe for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-AGRGTGTTTTCYAG RACWCAYGAGTTTTTYCA-3'. |
| Rapid Rabies Ag Test Kit | BioNote Inc., Republic of Korea | RG18-01DD | Rapid immunochromatographic diagnostic test (RIDT, also named lateral flow device or LFD) for the post-mortem diagnosis of rabies. |
| Recombinant RNasin Ribonuclease Inhibitor | Promega, USA | N2515 | Enzyme used with the kit for the amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| SuperScript III Platinum One-Step qRT-PCR Kit | Invitrogen, France | 11732-020 | Kit for the amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| TRIzol Reagent | Invitrogen, France | 15596026 | Phenol/chloroforme based total RNA extraction using the cellulose membrane of the RIDT. |
References
- Hampson, K., et al. Correction: Estimating the Global Burden of Endemic Canine Rabies. PLoS Neglected Tropical Diseases. 9 (5), e0003786 (2015).
- Rupprecht, C., Kuzmin, I., Meslin, F. Lyssaviruses and rabies: current conundrums, concerns, contradictions and controversies. F1000Research. 6, 184 (2017).
- Walker, P. J., et al. ICTV Virus Taxonomy Profile: Rhabdoviridae. The Journal of General Virology. 99 (4), 447-448 (2018).
- World Health Organization (WHO). WHO Expert Consultation on Rabies, third report. HO Technical Report Series, No. 1012. , (2018).
- Dacheux, L., et al. More Accurate Insight into the Incidence of Human Rabies in Developing Countries through Validated Laboratory Techniques. PLoS Neglected Tropical Diseases. 4 (11), e765 (2010).
- Welburn, S. C., Beange, I., Ducrotoy, M. J., Okello, A. L. The Neglected Zoonoses - The Case for Integrated Control and Advocacy. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. , (2015).
- Dacheux, L., Bourhy, H. Diagnostic tests for human rabies. Revue Scientifique Et Technique (International Office of Epizootics). 37 (2), 581-593 (2018).
- Kasempimolporn, S., Saengseesom, W., Lumlertdacha, B., Sitprija, V. Detection of rabies virus antigen in dog saliva using a latex agglutination test. Journal of Clinical Microbiology. 38 (8), 3098-3099 (2000).
- Kang, B., et al. Evaluation of a rapid immunodiagnostic test kit for rabies virus. Journal of Virological Methods. 145 (1), 30-36 (2007).
- Nishizono, A., et al. A simple and rapid immunochromatographic test kit for rabies diagnosis. Microbiology and Immunology. 52 (4), 243-249 (2008).
- Kasempimolporn, S., Saengseesom, W., Huadsakul, S., Boonchang, S., Sitprija, V. Evaluation of a rapid immunochromatographic test strip for detection of Rabies virus in dog saliva samples. Journal of Veterinary Diagnostic Investigation: Official Publication of the American Association of Veterinary Laboratory Diagnosticians, Inc. 23 (6), 1197-1201 (2011).
- Ahmed, K., et al. Evaluation of a monoclonal antibody-based rapid immunochromatographic test for direct detection of rabies virus in the brain of humans and animals. The American Journal of Tropical Medicine and Hygiene. 86 (4), 736-740 (2012).
- Léchenne, M., et al. Validation of a Rapid Rabies Diagnostic Tool for Field Surveillance in Developing Countries. PLoS Neglected Tropical Diseases. 10 (10), e0005010 (2016).
- Yang, D. K., et al. Comparison of four diagnostic methods for detecting rabies viruses circulating in Korea. Journal of Veterinary Science. 13 (1), 43-48 (2012).
- Markotter, W., et al. Evaluation of a rapid immunodiagnostic test kit for detection of African lyssaviruses from brain material. The Onderstepoort Journal of Veterinary Research. 76 (2), 257-262 (2009).
- Reta, T., et al. Evaluation of Rapid Immunodiagnostic Test for Rabies Diagnosis Using Clinical Brain Samples in Ethiopia. Journal of Veterinary Science & Medical Diagnosis. 2 (3), 1-3 (2013).
- Servat, A., Picard-Meyer, E., Robardet, E., Muzniece, Z., Must, K., Cliquet, F. Evaluation of a Rapid Immunochromatographic Diagnostic Test for the detection of rabies from brain material of European mammals. Biologicals: Journal of the International Association of Biological Standardization. 40 (1), 61-66 (2012).
- Certoma, A., et al. Assessment of a Rabies Virus Rapid Diagnostic Test for the Detection of Australian Bat Lyssavirus. Tropical Medicine and Infectious Disease. 3 (4), (2018).
- Ahmad, A., Singh, C. K. Comparison of rapid immunodiagnosis assay kit with molecular and immunopathological approaches for diagnosis of rabies in cattle. Veterinary World. 9 (1), 107-112 (2016).
- Sharma, P., Singh, C. K., Narang, D. Comparison of immunochromatographic diagnostic test with Hheminested Reverse transcriptase polymerase chain reaction for detection of rabies virus from brain samples of various species. Veterinary World. 8 (2), 135-138 (2015).
- Voehl, K. M., Saturday, G. A. Evaluation of a rapid immunodiagnostic rabies field surveillance test on samples collected from military operations in Africa, Europe, and the Middle East. U.S. Army Medical Department Journal. , 27-32 (2014).
- Servat, A., Robardet, E., Cliquet, F. An inter-laboratory comparison to evaluate the technical performance of rabies diagnosis lateral flow assays. Journal of Virological Methods. 272, 113702 (2019).
- Eggerbauer, E., et al. Evaluation of Six Commercially Available Rapid Immunochromatographic Tests for the Diagnosis of Rabies in Brain Material. PLoS Neglected Tropical Diseases. 10 (6), e0004776 (2016).
- Barrat, J., Meslin, F. X., Kaplan, M. M., Koprowski, H. Simple technique for the collection and shipment of brain specimens for rabies diagnosis. Laboratory techniques in rabies. , 425-432 (1996).
- Dacheux, L., et al. Dual Combined Real-Time Reverse Transcription Polymerase Chain Reaction Assay for the Diagnosis of Lyssavirus Infection. PLoS Neglected Tropical Diseases. 10 (7), e0004812 (2016).
- Dacheux, L., et al. A reliable diagnosis of human rabies based on analysis of skin biopsy specimens. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 47 (11), 1410-1417 (2008).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Application of next generation sequencing to rabies virus and other lyssaviruses. Laboratory techniques in rabies. 2, 49-61 (2019).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Conventional pan-lyssavirus reverse transcriptase polymerase chain reaction. Laboratory techniques in rabies. 2, 1-16 (2019).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Rabies real-time reverse transcriptase polymerase chain reaction. Laboratory techniques in rabies. 2, 17-34 (2019).
- Talbi, C., et al. Evolutionary history and dynamics of dog rabies virus in western and central Africa. The Journal of General Virology. 90 (Pt 4), 783-791 (2009).
- McElhinney, L. M., Marston, D. A., Brookes, S. M., Fooks, A. R. Effects of carcase decomposition on rabies virus infectivity and detection. Journal of Virological Methods. 207, 110-113 (2014).
- Vigilato, M. A. N., et al. Progress towards eliminating canine rabies: policies and perspectives from Latin America and the Caribbean. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 368 (1623), 20120143 (2013).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved