שדה הנתיחה לאחר המוות חיסוני מהיר מבחן אבחון עבור הגדרות מוגבלות משאב עם יישומים מולקולריים נוספים
In This Article
Summary
אנו מציגים פרוטוקול מלאה לאבחון שלאחר המוות של כלבת בעלי חיים תחת תנאי שדה באמצעות מבחן חיסוני מהיר האבחון (RIDT), מן הבדיקה ביופסיה המוח לפרשנות הסופי. אנו גם לתאר יישומים נוספים באמצעות המכשיר לניתוח מולקולרי הגנוזות ויראלי.
Abstract
מערכות מעקב פונקציונלי לכלבת הן חיוניות למתן נתונים אמינים ולהגברת המחויבות הפוליטית הנחוצה לבקרת מחלות. עד היום, יש להגיש בעלי חיים החשודים ככלבת-חיובית לאישור שלאחר המוות בשיטות מעבדה קלאסיות או מולקולריות. עם זאת, רוב האזורים האנדמיים נמצאים במדינות בעלות הכנסה נמוכה ובינונית, שם מוגבלת האבחנה של כלבת בעלי חיים למעבדות וטרינריות מרכזיות. הזמינות הירודה של תשתיות המעקב מובילה למחלות קשות המדווחות מאזורים מרוחקים. כמה פרוטוקולים אבחון הדורשים מומחיות טכנית נמוכה פותחו לאחרונה, מתן הזדמנות להקים אבחון כלבת במעבדות מבוזרות. אנו מציגים כאן פרוטוקול מלא עבור האבחון הנתיחה שלאחר המוות של כלבת בעלי חיים באמצעות מבחן האבחון המהיר חיסוני (RIDT), החל בדיקת ביופסיה של המוח לפרשנות הסופית. אנו משלימים את הפרוטוקול על-ידי תיאור שימוש נוסף בהתקן לניתוח מולקולרי והקלדה נגיפית. RIDT בקלות מזהה וירוס כלבת ו lyssaviruses אחרים בדגימות המוח. העיקרון של בדיקות כאלה הוא פשוט: חומר המוח מוחל על רצועת מבחן שבה נוגדנים מצוייטים הזהב לאגד במיוחד אנטיגנים כלבת. אנטיגן-נוגדן מתחמי לאגד נוסף נוגדנים קבוע על קו הבדיקה, וכתוצאה מכך קו סגול גלוי בבירור. הווירוס הוא בלתי מופעל ברצועת המבחן, אך ויראלי RNA ניתן לחלץ לאחר מכן. זה מאפשר את רצועת הבדיקה, ולא את דגימת המוח הזיהומיות, כדי להיות בטוח ובקלות נשלח מעבדה מצוידת לאישור והקלדה מולקולרית. בהתבסס על שינוי של הפרוטוקול של היצרן, מצאנו רגישות מבחן מוגברת, להגיע 98% לעומת שיטת התייחסות סטנדרטית הזהב, בדיקת נוגדנים החיסונית הישירה. יתרונות הבדיקה הם רבים: מהירה, קלה לשימוש, עלות נמוכה ואין דרישה לתשתית מעבדה, כגון מיקרוסקופ או ציות לשרשרת קרה. האפשרות ' ריטס ' מייצגת חלופה שימושית עבור אזורים שבהם שיטות אבחון של הפניה אינן זמינות.
Introduction
כלבת הכלב היא הגורם העיקרי לכלבת האדם, האחראית באופן כללי ל-59,000 מקרי מוות אנושיים בשנה, כמעט כולם מתרחשים במדינות בעלות הכנסה נמוכה ובינונית (LMICs) באסיה ובאפריקה1. הסוכן הראשי העיקרי הינו וירוס כלבת מסוג נוירוטרופי הקשור לכלבי הכלבת (RABV, משפחת תמס שריר, סוג lyssavirus, מיני כלבת lyssavirus). עם זאת, אחרים הקשורים לכלבת lyssaviruses, בעיקר מחזורי מינים בת, גם לגרום למחלה2,3. באזורים המושפעים, מעקב ובקרה של מחלות מושפעים לעתים קרובות על ידי מחויבות פוליטית ברמה נמוכה כנראה עקב חוסר נתונים אמינים4,5,6. אחת הסיבות לדיווח על המחלה היא היעדר אבחון מעבדה, בשל הגישה המוגבלת למעבדות מאובזרות ולצוות מיומן, כמו גם לקשיי המשלוח של הדגימות. אבחון מעבדה הכרחי כדי לאשר מקרים כלבת ובנוסף מאפשר אפיון גנטי של זנים מעורבים, מתן תובנה על שידור וירוס ברמה האזורית4,5,7.
תקני הזהב הנוכחיים לאבחון כלבת שלאחר המוות, אושרו על ידי ארגון הבריאות העולמי (אשר) והארגון העולמי לבריאות בעלי חיים (oie), הם בדיקת נוגדן הפלורסנט ישירה (dfat), מבחן החיסונית המהירה מהירה אימונוהיסטוכימיה (drit) ושיטות מולקולריות4,(למשל, תמלול ה עם זאת, יישום תקין ב-LMICs נשאר מוגבל עקב מתקני מעבדה לא מספיקים עם אספקת חשמל לא עקבית, הובלה מדגם לא מקורר, וחוסר מערכת ניהול איכותית. מכיוון שאבחון כלבת בעלי חיים מתנהל בדרך כלל רק במעבדות וטרינריות מרכזיות ב-LMICs, נתוני מעקב קיימים משקפים בעיקר את מצב הכלבת באזורים עירוניים.
לאחרונה פיתח חלופות אבחון טכנולוגיה נמוכה להציע הזדמנויות להקמת אבחון כלבת באזורים מרוחקים ומעבדות כלבת מבוזרות4,8,9. הבדיקה המהירה של האבחון החיסוני (ridt) היא בדיקת זרימה לרוחב מבוסס על כרומטוגרפיה באמצעות נוגדנים גלאי מצומת זהב הוא כלי מבטיח מאוד אבחון כלבת10,11,12,13. העיקרון הוא פשוט: לאחר דילול, חומר המוח מעורבב במאגר המסופק, וכמה טיפות מוחלים על רצועת המבחן שבו זהב מצובבות נוגדנים מונבטיים לאגד במיוחד אנטיגנים כלבת, בעיקר הנוקלאופילים (איור 1). אנטיגן-נוגדן מתחמי לאחר מכן לעבור הגירה זרימה לרוחב, כריכה בשורת המבחן (T-line) כדי לקבוע נוגדנים נגד אנטיגנים כלבת, וכתוצאה מכך קו סגול גלוי בבירור. הנוגדנים הנותרים זהב המצומות לא כרוך אנטיגנים כלבת להמשיך לעבור ולתקן את הקרום באמצעות מיקוד נוסף נוגדנים, והתוצאה היא בבירור קו בקרה סגול גלוי (C-line).
שיטת השלב האחד, העלות הנמוכה היא מהירה, קלה מאוד ואינה דורשת ציוד יקר או תנאי אחסון מיוחדים. עם שינוי של פרוטוקול היצרן כדי לחסל את שלב הדילול, כמעט כל הציוד והחומרים הדרושים לביצוע הבדיקה נכללים בערכה14. התוצאה היא לקרוא לאחר 5-10 דקות ללא מיקרוסקופ. זהו יתרון גדול על פני בדיקת DFAT, אשר דורש מיקרוסקופ פלואורסצנטית ו immunofluorescence המשלים, יחד עם הובלה בקירור ואחסון לדוגמה. גם בדיקת DRIT, אשר ניתן לבצע באמצעות מיקרוסקופ אור, דורשת שרשרת קרה רציפה לאחסון נוגדנים נגד כלבת, אשר גם לא זמין מסחרית עדיין. בהשוואה ל-DRIT, ה-RIDT אינו דורש כימיקלים רעילים, יתרון מסוים במדינות שבהן סילוק פסולת מוסדר בצורה גרועה. המבחן המהיר הוא פחות זמן רב עם פרשנות קלה הרבה יותר בהשוואה לתקן זהב בדיקות DFAT ו DRIT. זה מאפשר בדיקות באתר על ידי כוח אדם עם מומחיות טכנית מוגבלת.
בהתבסס על מאפייני הבדיקה הללו, אבחון בקשה של בעלי חיים חשודים באזורים מרוחקים הופך להיות ריאלי, הקלה על יישום של מניעה לחשוף לאחר חשיפה לאנשים חשופים בהקדם האפשרי. בנוסף, אין צורך בהעברת מרחק של דגימות כלבת, וכתוצאה מכך איכות דגימה טובה יותר בזמן הבדיקה. עם זאת, התוצאות שהתקבלו עם הבדיקות של RIDT אמורות להיות מאושרות כרגע באמצעות בדיקת אבחון הפניה כגון DFAT או DRIT.
RIDT טכניקות לזיהוי של RABV ו-lyssaviruses אחרים הוערכו. אחד המחקרים הראשונים נערך על ידי חוקרים קוריאני ב 200710. בהשוואה לשיטת DFAT, ב51 בדיקות בעלי חיים ו 4 מבודד RABV, הראה RIDT רגישות וספציפיות של 91.7% ו 100%, בהתאמה. תוצאות אלה אושרו מאוחר יותר עם 110 דגימות מוח בעלי חיים מקוריאה, עם רגישות וספציפיות, לעומת DFAT, של 95% ו 98.9%, בהתאמה15. לאחרונה, מחקרים אחרים העריכו את הביצועים של RIDT זה באמצעות וירוס מבודד ו/או דגימות המוח הנגוע מבעלי חיים שונים עם מקורות גיאוגרפיים שונים. פאנל של 21 דגימות, כולל אפריקה RABV ווירוסים אחרים lyssaviruses (וירוס Duvenhage (DUVV), לאגוס בת וירוס (LBV) וירוס מוקדי (מוקדי)), זוהו בהצלחה, עם רגישות של 100% לעומת DFAT16. רגישות גבוהה דומה (96.5%) וספציפיות (100%) ערכים הושגו מפאנל של 115 דגימות מוח מאתיופיה17. עוד מחקר העריך האירופי RABV מבודד, שני lyssaviruses האירופי (ליתיום האירופי סוג lyssaviruses 1 (EBLV-1) וסוג 2 (EBLV-2)), ואת הגרסה האוסטרלית lyssaviruses (ABLV)18. בהתבסס על ניתוח של 172 דגימות מוח בעלי חיים, ערכת RIDT היה 88.3% רגישות ו 100% ספציפיות לעומת DFAT, ואת שלושת הקשורים לכלבת lyssaviruses זוהו בהצלחה. במחקר זה, כמה תוצאות שליליות שווא הגיעו דגימות המוח המאוחסנים מאגר גליצרול, הרומז כי הסרת גליצרול פסולים השפיעו על זרימת נימי או מחייב נוגדנים. ניתוח שנערך לאחרונה של 43 דגימות קליניות מ העטלפים האוסטרלי אישר תוצאות בדיקה קודמות, עם קונקורדנציה מלאה ל-DFAT19. שני מחקרים נערכו בהודו באמצעות RIDT על מספר מוגבל של דגימות קליניות (11 ו 34 דגימות). לעומת dfat, רגישות היה בין 85.7% ו 91.7% ו-ספציפיות היה 100%20,21. הערכה נוספת של קיט זה באמצעות 80 בעלי חיים דגימות מוח מאפריקה, אירופה והמזרח התיכון קיבלו הקונקורדנציה מלאה עם DFAT עבור ספציפיות (100%) אבל רגישות גבוהה יותר (96.9%) לעומת המחקרים הקודמים22. בהשוואה בין מעבדות לאחרונה של RIDT זה הופיע 22 מעבדות שונות באמצעות פאנל של 10 דגימות, הקונקורדנציה הכוללת היתה 99.5%23.
רק מחקר אחד שנערך לאחרונה במחקר האחרון הראה ביצועים לא משביע רצון RIDT24. דגימות משלוש ערכות נתונים שונות נבדקו וסיפקו רגישות משתנה וערכים מסוימים בהשוואה ל-DFAT. לדוגמה, רגישות וספציפיות שהתקבלו עם הפאנל הראשון (n = 51) והפאנל השני (n = 31) של דגימות מבעלי חיים נגועים ניסיוניים, כל נבדק במעבדה A, נתן רגישות של 16% ו 43%, בהתאמה, בעוד הספציפיות היה 100% עבור שניהם. לעומת זאת, התוצאות של הפאנל השלישי (n = 30) של דגימות השדה הקליני שנותחו על ידי מעבדה B סיפק הקונקורדנציה מלאה עם התוצאות של DFAT, אשר היה מאושר יותר כמעט לחלוטין על ידי מעבדה (85% רגישות ו 100% ספציפיות). אצווה-to-אצווה וריאציה הוצע כהסבר אפשרי עבור תנודות רגישות נמוכה יחסית עם RIDT24.
באותו זמן, מחקר אחר ביצע תהליך אימות דומה של RIDT שתוארו לעיל, עם שינוי של היצרן מומלץ פרוטוקול14. השלב שלפני הדילול (1:10) בערוץ PBS הושמט במהלך הכנת חומר המוח. בהתבסס על פרוטוקול זה שונה פשוט, המחברים השיגו רגישות וספציפיות של 95.3% ו 93.3%, בהתאמה, לעומת DFAT על ידי בדיקות, תחת תנאי מעבדה, ערכת נתונים של 73 בעלי חיים דגימות המוח, באופן טבעי או ניסויים נגועים בזנים RABV שונים. המחקר הציג את ההערכה הראשונה של RIDT זה בהגדרת שדה (צ'אד, אפריקה). ב 48 דגימות מוח קליני, רגישות וספציפיות היו 94.4% ו 100%, בהתאמה. הסתירות בין DFAT ו-RIDT היו בשל תוצאות חיוביות שווא עם DFAT, נקבע לאחר אישור עם RT-PCR. כאשר תוצאות אלה נמחקו, היתה הקונקורדנציה מלאה, והוא הוכיח כי RIDT היה אמין יותר DFAT תחת תנאי שדה אלה14. אין וריאציה של אצווה לאצווה נצפתה באמצעות הפרוטוקול שהשתנה. כאשר הפרוטוקול שהשתנה הוחל על מספר קטן של הדגימות DFAT/RIDT מפוצלים (n = 8) בחקר Eggerbauer ואח '24, כולם נמצאו concordant (100% רגישות).
יתרון מרכזי נוסף של ridt הוא שימוש משני לזיהוי רנ א ויראלי קבוע על רצועת באמצעות טכניקות מולקולריות (כגון RT-PCR) והבאים הקלדה14,24. בעקבות צעד החילוץ, לשצ ואח '14 הפגינו ויראלי RNA קבוע על הממברנה המכשיר anigen באמצעות RT-PCR עם 86.3% רגישות בפאנל של 51 דגימות (כולל 18 דגימות נבדק ונשלח מ צ'אד בטמפרטורת הסביבה). ה93 הבאים היה אפשרי ב-4% מתוך 14 הדגימות שנבדקו. שימוש ברצף הגברה של ה-PCR לפחות 500 נוקלאוטידים באורך. בנוסף מבודד RABV, הבדיקה זיהה ארבעה מינים lyssavirus אחרים, DUVV, EBLV-1, EBLV-2 ו Bokeloh בת lyssavirus (BBLV), במהלך concordant הבינלאומי בדיקה בין מעבדה בינלאומית14. רגישות של גילוי RNA ויראלי היה אפילו גבוה יותר (100%) במחקר של אגגרבאואר ואח ', המבוססת על דגימות מעבדה24. המחקר האחרון הוכיח גם כי המאגר המשמש במערכת וירוס RIDT מופעל. ובכך, ניתן לשלוח את המכשירים בקלות, בטמפרטורת הסביבה ללא אמצעי זהירות מסוימים של בטיחות ביולוגית כדי להפנות למעבדות, לאישור מולקולרי ולהקלדה מולקולרית.
בהתבסס על ההערכות הקודמות, כלי RIDT מציעים יתרונות רבים לשימוש בהגדרות שדה, במיוחד כאשר טכניקות אבחון הפניה אינן זמינות. עם זאת, בדיקה זו יש גם כמה מגבלות, בפרט, רגישות נמוכה של זיהוי אנטיגן14,24. הבדיקה מתאימה לדגימות המכילות כמויות גבוהות של אנטיגנים ויראליים, כגון דגימות מוח. עם זאת, הוא אינו מתאים לדגימות אחרות כגון רוק או נוזלי גוף אחרים. חיסרון נוסף הוא עלות של המכשיר (סביב 5-10 יורו באירופה), אשר יקר פחות לעומת העלות של ביצוע DFAT, RT-PCR או DRIT, אבל מה שעדיין נשאר גבוה עבור LMICs יקרופונים. עם זאת, התפתחות עתידית ותיקוף של ריטים דומים מחברות אחרות עלולות להוביל לירידה במחיר. מחקר אחד דיווח וריאציות אצווה-to-אצווה. למרות שלא דווחו על-ידי אחרים, יש לבצע בקרת איכות קפדנית בכל זאת בעת בדיקת אצווה חדשה, באשר לכל מגיב שנעשה בו שימוש בסביבת ניהול איכותית. השימוש בפרוטוקול שהשתנה לא השתנה בעת שימוש באצוות שונות14. כל פרט למחקר אחד הראה כי הרגישות של RDIT היה גבוה לעומת DFAT (סביב 90%-95%). מכיוון שכלבת היא תמיד קטלנית, עדיין מומלץ מאוד לאשר תוצאות שליליות עם RDIT באמצעות בדיקת אבחון הפניה כגון DFAT, DRIT או RT-PCR14.
בכתב יד זה, אנו מציגים פרוטוקול מלא לאבחון השדה שלאחר המוות של כלבת בעלי חיים המבוססת על דוגמה של RIDT ממוסחר, מאוסף דגימת מוח ליישום של פרוטוקול שונה לעומת המלצות היצרן (אשר היו מאומתים בעבר14) וניתוח מולקולרי הבאים. פרוטוקול זה יושם ואומת פעמים רבות תחת תנאי שדה במערב ובמרכז אפריקה, שם השתמשו ב-RIDT באופן שגרתי לאבחון כלבת לצד מבחן DFAT. אנחנו בנוסף להדגים יישום שני עבור המכשיר, הגדרות מעבדה, לחילוץ ואיתור באמצעות RT-PCR של RNA ויראלי קבוע על המכשיר.
Protocol
1. אוסף לדוגמה באמצעות מגנום האמן (תוואי העורף)25
הערה: ניתן ליישם טכניקה זו בתנאי מעבדה או בהגדרות שדה. יש לעבד דגימות בהקדם האפשרי לאחר מותו של בעל החיים החשוד או לשמור בטמפרטורה מגניבה (בקירור או בהקפאה, אם אפשר) כדי למנוע ריקבון שעלול להשפיע על התוצאות. דומה טכניקות התייחסות אחרים המבוסס על איתור אנטיגנים lyssavirus כגון DFAT ו-DRIT, דגימות מפורקת לא צריך להיבדק כי זה יכול להשפיע על התוצאה (סיכון של תוצאה שלילית כוזבת).
התראה: כל הדגימות נחשבות לזיהומיות בפוטנציה. יש לעקוב בקפדנות אחר תקנות בטיחות ונהלים, אפילו בהגדרות השדה4. בפרט, יש ללבוש ציוד הגנה אישי מתאים כולל מסכה, משקפיים, כפפות וחלוק מעבדה. השימוש בחיטוי מתאים לחומר ולדוגמה decontaminations (למשל, היפוכלוניט נתרן עם מדלל יצרן מומלצים, 70% אלכוהול-אתנול או איזופנול, 1% סבון פתרון). . יש לחיסון נגד כלבת
- הסירו את ראש בעל החיים בסכין לפני חוליית הצוואר הראשונה (חוליית האטלס) כדי לגשת אל מגנום האמן.
הערה: כדי למזער את התרסיס הזיהומיות, הימנע משימוש במסור ידני או בכלי דומה. - לאסוף גזע המוח (לשד מאובלונגאטה) לדוגמה באמצעות צינורות פלסטיק חד פעמיות (איור 2a), קש שתייה (איור 2B), קלאמפ (איור 2ג) או טפטפת (שסופקו עם ridt) (איור 2ד).
הערה: יש לשלם תשומת לב מיוחדת בעת איסוף המדגם, משום שזהו צעד חשוב ביותר למהימנות התוצאות. בנוסף וידאו המשויך אשר מציג באופן פשוט כיצד לאסוף את החלק של המוח של העניין, צעד הדרכה מומלץ מאוד כדי לוודא לאסוף את החלק האנטומי הנכון. - באופן אופציונלי ובנוסף גזע המוח (לשד מוונגאטה), לאסוף חלקים אחרים של גזע המוח או את המח (המוח השני, ההיפוקמפוס, תלמוס וקליפת) על ידי התוואי העורף אותו על ידי דחיפה וסיבוב של הצינורות פלסטיק או קש לכיוון שקע העין (איור 3).
- אם משתמשים בקשית או בפיפטה, סוחטים אותו בעדינות כדי להפקיד את דגימת המוח (0.5-2 גרם) בצינור לניתוח העוקב ו/או biobanking.
הערה: האחסון לדוגמה בגליצרול אינו מומלץ, כפי שנראה להשפיע על זרימת נימי הדם או על הצעד המחייב של הנוגדן של RIDT18.
2. ביצוע פרוטוקול RIDT המתוקן14
הערה: שינוי זה משמיט שלב דילול (1:10) ל-PBS, כפי שמצוין בפרוטוקול היצרן (כל הגירסאות), וניתן ליישם אותה תחת הגדרות מעבדה או שדה.
- השתמש בספוגית/טפטפת כדי לאסוף את המקבילה של חצי בוטנים או אפונה (0.1-0.5 g) של חומר המוח ומניחים אותו בשפופרת לדוגמה מאגר.
הערה: עבור פרוטוקול שהשתנה, כל החומרים הריאגנטים/מתכלים נכללים בערכה (אין צורך ב-PBS או בצינור נוסף) (איור 4). תעד את מספר האצווה של הערכה ובדוק את תוקף תאריך התפוגה. - למחוץ בזהירות את חומר המוח ישירות בצינור עם הספוגית או טפטפת על 30 s עד השעיית הומוגנית מושגת.
הערה: תגובת המאגר אינה מפעילה את הנגועים בווירוס בתנאים של פרוטוקול היצרן24. - באמצעות טפטפת, הפקדה 4 טיפות (כ 100 μL) של ההשעיה במדגם לדוגמה במכשיר הבדיקה.
- המתן להשלמת הגירה לדוגמה (1-5 דקות) לפני קריאת התקן הבדיקה. ההעברה אמורה להתחיל במהירות לאחר הפקדה של המדגם (1-5 דקות).
- במקרה של עיכוב (בשל השעיית צמיגות גבוהה) או כדי להאיץ את תחילת ההגירה, בעדינות לשרוט את החלק התחתון של האתר ההפקדה של המכשיר עם טפטפת (1-5 פעמים) ובסופו של דבר להוסיף 1-2 יותר טיפות. על ההעברה להתחיל מיד לאחר מכן.
- קרא את תוצאת הבדיקה בחלון הזיהוי לאחר 5-10 דקות, ולא יותר מ-20 דקות, לאחר סיום ההעברה.
- פענוח התוצאה בהתבסס על נוכחות או היעדרות של קו הבקרה (C-line) ושורת הבדיקה (T-line) (קווים סגולים) בחלון הזיהוי, לפי איור 5. שקול את הדוגמה החיובית כאשר שתי שורות גלויות (איור 5א), שליליות אם רק ה-C מופיע (איור 5B) ואינו חוקי אם רק השורה T קיימת או אם אין שורות גלויות (איור 5ג).
הערה: יש לחזור על תוצאות לא חוקיות לפחות פעם אחת. יש לבצע טכניקות אחרות אם התוצאות נשארות לא חוקיות. תוצאות שליליות שהתקבלו עם RIDT צריך להיות אישר לאחר מכן באמצעות שיטת התייחסות זהב סטנדרטי, כמו DFAT, DRIT ושיטות מולקולריות (תגובת שרשרת פולימראז או PCR). למרות שרגישות המבחן גבוהה (ראה תוצאות מייצגות), היא אינה 100%. - אחסן התקנים משומשים בטמפרטורת החדר, או להכניס למקרר/הקפאה כאשר הדבר אפשרי, לניתוח מולקולרי הבא (ראה סעיף 4). הקפא את ההשעיה לדוגמה הנותרת ב-20 ° צ'/-80 ° צ' בצינור החיץ כדי לחזור על הבדיקה במידת הצורך או לניתוח מולקולרי שלאחר מכן.
3. הוצאת RNA ואיתור באמצעות RT-qPCR מהתקן RIDT
הערה: ניתן ליישם שלב זה רק בתנאי מעבדה עם סביבה מותאמת וציוד מתאים לאבחון מולקולרי. זה יכול להיעשות זמן קצר לאחר מבחן RIDT או מצטברת על התקני RIDT בארכיון, המאוחסנים בטמפרטורת החדר (15-30 ° c), בקירור או קפוא.
- הוצאת רנ א
הערה: כדי לנטר את שלב החילוץ, מומלץ להשתמש בפקד פנימי שיכול להיות mrna אנדוסוגני (כגון "למשל") או בקרת אקסוגני (כגון ה-RNA הסינתטי של egfp) מחודדים ישירות לתוך המדגם במהלך הצעדים הראשונים של החילוץ26,27.- פתח בזהירות את ההתקן והסר את נייר הסינון.
- חותכים את אזור ההפקדה של המדגם ומניחים אותו לתוך צינור המכיל 1 מ ל של LS Tri-מגיב. מודטה at RT עבור שעה אחת עם עצבנות באופן קבוע באופן ידני.
- בצע את החילוץ בהתאם להמלצות היצרן, כפי שתוארה בעבר27. בשלב זה, ניתן להוסיף את השליטה הפנימית האקסודוגני.
- במהלך התהליך, להוסיף 2 μL של הגליקוגן להקלה על משקעים של RNA, על פי המלצות היצרן.
- כוונן את אמצעי האחסון הסופי ל-RNA מחדש ב-nuclease-מים ללא תשלום, עם נפח של 50 μL המשמש בדרך כלל.
הערה: בסוף השלב הצנטריפוגה עבור הפרדת הפאזה והשלב האורגני (לאחר התוספת של 200 μL של כלורופורם לתוך התלת-מגיב), פיסת הקרום מהמכשיר תהיה בתחתית הצינורית ולא תפריע לאוסף של השלב העליון מימית. לחילופין, ניתן להשתמש בפרוטוקולים קלים ומהירים אחרים, למשל, בעזרת ריאגנטים וממברנות סיליקה מבוססי-פנול28.
- איתור באמצעות RT-qPCR26
הערה: זיהוי ה-RNA הפוטנציאלי הנוכחי בדגימות שחולצו ניתן לבצע באמצעות טכניקות מולקולריות שונות, כגון היפוך הפוך PCR, קונבנציונאלי (נקודת קצה) או בזמן אמת PCR (qPCR). מספר שיטות זמינות, כגון המקובלת RT-PCR27,29 או RT-qpcr26,30 מיקוד של הנואופלפרוטאין או פלראז גן. דוגמה אחת יוצגו להלן מבוסס על כפול פאן-lyssavirus וירוס RT-qPCR מיקוד אזור שימור בין הנגיפי פולימראז. זו טכניקה RT-qPCR שותפים שני RT שונים-qPCR: אחד מבוסס על טכנולוגיית הבדיקה TaqMan (פאן-RABV RT-qPCR) והשני באמצעות זיהוי ירוק SyBR (פאן-lyssa RT-qPCR). בנוסף, הזיהוי של שליטה פנימית אקסוגני (eGFP RNA) מחודדים ישירות במהלך תהליך החילוץ נעשית על ידי מבוסס TaqMan בדיקה מבוססי-qPCR (eGFP RT-qPCR). זהירות באתר אימות של הטכניקות המולקולריות שנבחרו לאיתור RNA ויראלי חשוב, בפרט, כדי לוודא כי התחל, ו בדיקות בזמן אמת RT-PCR, מותאמים לגילוי של זנים מחזורי באזור של עניין4.- לדלל את ה-RNA לדוגמה ל 1:10 במים חופשיים נוקלאז. בדיקת כל מדגם RNA בשכפול, באמצעות צלחת תגובה 96-היטב או פורמטים אחרים. השתמש בפקדים חיוביים ושליליים עבור כל מבחן ובדיקה לפחות בשכפול.
- הכינו את פתרון התגובה לערבב הורים עבור שלוש RT-qPCR שונים על פי שולחן 1, עם התחל/הבדיקות המצוין בטבלה 2.
- הוסף 5 μL של מדולל RNA דגימות ו 15 μL של מיקס מאסטר לכל אחד משלושת השלבים השונים. שיטת הפאן-רבייב RT-qPCR והאפשרות היחידה למחזור ה-Qpcr יכולה לחזור לאותה צלחת.
- הפעל את התנאים השונים בעקבות תנאי הרכיבה התרמיים המצוינים בטבלה 3. אם יש רק ציקלוניר תרמי אחד זמין, להתחיל עם פאן-RABV RT-qPCR ולשמור את הצלחת עבור פאן-lyssa RT-qPCR ב 4 ° צ' עד הסוף של פאן-RABV RT-qPCR.
- לנתח את התוצאות שהתקבלו עם שלושת הדרישות לפי שולחן 4.
4. הגנוהקלדה לאחר חילוץ RNA ממכשיר RIDT
- 27שעתוק הפוך 27,29
- להכין לערבב הורים עם 6 μL של RNA, 2 μL של pd (N) 6 התחל אקראית (200 μg/μL) ו-2 μL של nuclease-מים ללא תשלום עבור נפח סופי של 10 μL.
- דגירה ב 65 ° c עבור 10 דקות בבלוק חום ולאחר מכן לאחסן על קרח.
- להכין לערבב מאסטר עם 6 μL של מאגר הגדיל 5x הראשון, 2 μL של 0.1 M dithiopol (DTT), 1 μL (200 U) של כתב עילי הפוך הטרנסקריפטאז, 2 μL (80 U) של RNasin, 2 μL של שילוב Dtt (10 μM) ולהשלים עם nuclease-מים ללא תשלום כדי להשיג נפח סופי של 20 μL עבור כל מדגם.
- הוסף את התמהיל הראשי (20 μL) למדגם (10 μL) (הנפח הסופי של 30 μL) ו-דגירה ב 42 ° c עבור 90 דקות בבלוק חום.
- המשך לשלב הבא עם הגברה של ה-PCR או אחסן את cDNA ב-20 ° c.
- ה-PCR המקובל27,29,31
הערה: טכניקות שונות של ה-PCR המקובל זמינים להקלדה. שניים מוצגים, שניהם ה-PCR המקונן, מיקוד חלק של הנואופלפרוטאין או חלק של החלבון הנגיפי של lyssavirus. הפרוטוקול זהה לכל אחד מאותם התנאים, פרט לתנאי התחל והרכיבה על אופניים. חיובי (RNA חיובי) ושלילי (שלילי cDNA ו/או nuclease-מים חינם) יש לכלול בכל סדרה וכל סיבוב של ה-PCR.- היכונו עבור כל מדגם ב-0.2 mL מיקרוtube פתרון התגובה ערבוב המאסטר לשלב ה-PCR הראשון. תערובת זו מכילה 5 μL של 10x NH4 התגובה מאגר, 2.5 μL של MgCl2 פתרון (50 mM), 1 μl של שילוב dntp (10 μm), 1 μl של כל פריימר (10 μm), 0.2 μl (1 U) של ביוטאק DNA פולימראז ו37.3 μl של nuclease-מים ללא תשלום (הנפח הסופי של 48 μl). . התחל מצוין בשולחן 5
- הוסף 2 μL של cDNA בכל צינור ומחזור על הציקלונים הקונבנציונאלי PCR התרמי עבור כל שיטת, על פי שולחן 6.
- הכינו פתרון התגובה השני לערבב מאסטר זהה הקודם עם באמצעות התחל המתאים (שולחן 5) לתגובת ה-PCR המקונן.
- הוסף 2 μL של המוצר העגול הראשון PCR ומחזור על הציקלה הקונבנציונלי PCR התרמי באמצעות פרמטרי אופניים המצוין בטבלה 6.
- המחש את מוצרי ה-PCR השונים (PCR בסיבוב הראשון והשני) לאחר טעינת אותם ב-1% agarose ג'ל (100 mL של מאגר EDTA של טריס בשנת 1x-טאה 1x) עם אתידיום ברומיד (הריכוז הסופי סביב 0.01%) ולהפעיל את ג'ל במהלך 30 דקות ב 120 V. תוצאת ה-PCR החיובית נצפתה בצורת להקה בהירה בגודל הצפוי (שולחן 5).
- רצף שטנגר
- בצע רצף Sanger של הגברה שהתקבלו עם ה-PCR הפאן-lyssavirus מקונן ולהשלים את ניתוח ה-גנוהקלדה.
Representative Results
כמו בכל שיטת אבחון, אוסף המדגם הוא בעל חשיבות עליונה למהימנות התוצאות, במיוחד כאשר מבוצע בהגדרות שדה. תהליך הגבייה צריך להיות פשוט ככל האפשר כדי להבטיח איסוף של דגימות באיכות גבוהה. האוסף של ביופסיה במוח (גזע המוח עם לשד אובונגאטה) דרך מגנום מאגנום עבור אבחון שלאחר המוות של כלבת בעלי חיים ממלאת דרישה זו, כפי שצוין באיור 2a-D25.
לאחר האיסוף, דגימת המוח מוגשת לפרוטוקול המתוקן של ה-RIDT, המסוכם באיור 6. כפי שמצוין בסעיף ' פרוטוקול ', ההתאמה העיקרית מהיצרן שסיפק פרוטוקול היא השמטה של שלב הדילול ב-PBS, אשר מפשט את ההליך ואת מתכלים/ריאגנטים הדרושים, ולכן כלולים בערכה (איור 4).
פרוטוקול שהשתנה זה יושם והוערך בחמש מעבדות שונות, כולל אחד המרכז השיתופית על כלבת (Lab 1, צרפת), מרכז התייחסות לכלבת (Lab 5, איטליה) ושלוש מעבדות יעץ הממוקמות במדינות אפריקה, צ'אד (lab 2), חוף השנהב (Lab 3) ומאלי (Lab 4). בצ, הערכה של ה-RIDT נעשתה בהגדרות המעבדה והשדה.
לעומת טכניקת ההתייחסות DFAT, רגישות וספציפיות של RDIT היו גבוהים עבור כל המעבדות, עם 96% כדי 100% ו 93.7% כדי 100%, בהתאמה (טבלה 7). הרגישות והספציפיות ביותר של RDIT הושגו עבור Lab 1 (צרפת) במהלך תהליך אימות המעבדה. מבוסס על המספר המצטבר של דגימות נבדק (n = 162) (טבלה משלימה 1), את הרגישות הכוללת ואת הספציפיות לעומת dfat היו 98.2% ו 95.8%, בהתאמה (שולחן 7). עם זאת, התוצאות הראשוניות אך מבטיח הושגו על ערכת נתונים מוגבלת לדוגמה וצריך להיות מאושר נוסף על מספר רב של דגימות חיוביות ושליליות, במיוחד עבור אלה שנבדקו באזורים enzootic, כדי למנוע כל להמעיט פוטנציאל או הטיה עקב ערכות נתונים הטרוגניים הנוכחי.
מבחן RIDT מתאים לזהות lyssavirus ביופסיה במוח מבעלי חיים נגועים, שם רמת של אנטיגנים lyssavirus חשוב. עם זאת, מגבלת הבדיקה של זיהוי נשאר גבוה בעת בדיקת השעיית וירוס טיטרציה (שולחן 8; איור 7).
שולחן 9 (מתוך לצ 201614) מראה דוגמה של תוצאות שהתקבלו לאחר הזיהוי RNA על ידי משולב כפול פאן-LYSSAVIRUS RT-qpcr מיקוד הפלאז הנגיפי של lyssavirus. פאנל של 51 חיובי RIDT בדיקות שבוצעו בתנאי מעבדה (מעבדה 1, n = 32) או בצ (Lab 2, n = 19) ולאחר מכן נשלח בטמפרטורת הסביבה למעבדה 1, נבדק. זיהוי חיובי התקבל עבור 18 (94.7%), 26 (81.2%) ו 44 (86.3%) דגימות מהמעבדה 1, מעבדה 2. והשתיים ביחד, בהתאמה בנוסף, בוצעה הקלדה עבור 14 מדגמים אלה (10 מהמעבדה 1 ו -4 מהמעבדה 2) באמצעות ה-PCR המקונן המכוון את הגן החלקי של הנואופלפרוטאין והצליח עבור 13 מהם (93%) (מתוך לצ ואח ' 201614).
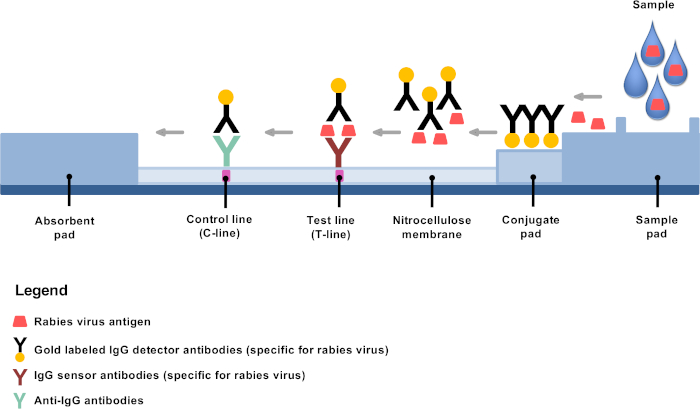
איור 1: ייצוג סכמטי של מבנה הארגון לאבחון כלבת. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: דוגמאות של טכניקות פשוטות מהירות לאיסוף דגימות מוח (גזע המוח עם לשד מוונגאטה) בבעלי חיים (כלב המוצג כאן) דרך העורף העצמי בהגדרות שדה (מאלי). (א) אוסף עם מארז פלסטיק חד-פעמי (ב) אוסף עם קשית שתייה פלסטיק (C) אוסף עם קלאמפ (D) אוסף עם טפטפת לסילוק המסופק בערכת ridt. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
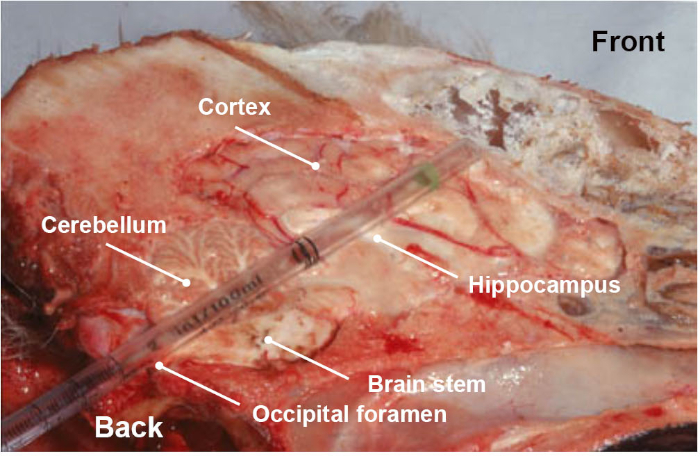
איור 3: החלק האנטומי האורך של ראש הכלב, מראה חלקים שונים של המוח (גזע במוח, המוח הראשי, ההיפוקמפוס, תלמוס וקליפת) נאסף כאשר דוחף, בתנועה סיבובית, צינורות פלסטיק חד פעמיות דרך הנתיב העורף לדרך. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: תיאור התוכן של ערכת RIDT, כולל המכשיר, טפטפת פלסטיק חד פעמי, ספוגית חד פעמי, ואת השיטת הדגימה. הצינור שבו המדגם ייאסף ומאוחסן אינו מסופק. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
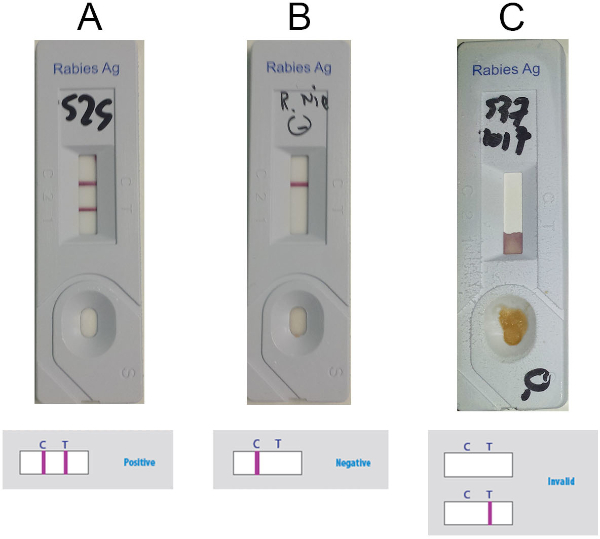
איור 5: תוצאות מייצגות לפרשנות האניגן RIDT. (א) תוצאות חיוביות (נוכחות גלויה של שתי שורות, C-line ו-T-line) (ב) תוצאות שליליות (ב) תוצאה שלילית (נוכחות גלויה של c-line בלבד) (c) תוצאות לא חוקיות (העדר c-line גלוי). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 6: ייצוג סכמטי של פרוטוקול RIDT, המותאם להוראות היצרן. (A) הגרסה המתוקנת של הפרוטוקול, עם מחיקה של שלב הדילול המומלץ על ידי היצרן (B) הפרוטוקול הראשוני המומלץ על ידי היצרן, עם צעד מראש 1:10 דילול ב-PBS של דגימות המוח. השלבים שנמחקו בגירסת הפרוטוקול ששונתה (המוצגים באיור 6א) מסומנים בקו אדום. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
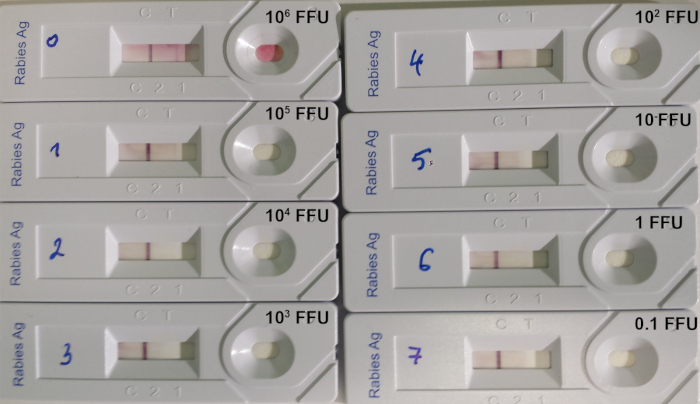
איור 7: דוגמה לקביעת מגבלת הזיהוי של RIDT14. שימוש סדרתי 10:1 של וירוס כלבת טיטרציה של זן 9704arg היה בשימוש. כמות הווירוס הופקד על כל התקן מצוין FFU (מיקוד המיקוד יחידות). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| שיטת הפאן-רבנו RT-qPCR | |
| ריאגנט | μL/תגובה |
| 2X שילוב התגובה (מאגר המכיל 0.4 mM של כל dNTP ו 6 מ"מ MgSO4) | 10 |
| נוקיחכירה מים חופשיים | 1.5 |
| Taq3long (קדימה) [10 μM] | 1 |
| Taq17revlong (הפוך) [10 μM] | 1 |
| RABV4 [10 μM] | 0.3 |
| RABV5 [10 μM] | 0.3 |
| MgSO4 [50-mM] (בתנאי הערכה) | 0.25 |
| צבע התייחסות רוקס (25 μM) (המסופקים בערכה) | 0.05 |
| RNasin (40U/μL) (פרונגה) | 0.2 |
| השלישי כתב עילי/פלטינה מיקס Taq | 0.4 |
| סה כ לכל תגובה | 15 |
| שיטת eGFP | |
| ריאגנט | μL/תגובה |
| 2X שילוב התגובה (מאגר המכיל 0.4 mM של כל dNTP ו 6 מ"מ MgSO4) | 10 |
| נוקיחכירה מים חופשיים | 2.8 |
| EGFP1F (קדימה) [10 μM] | 0.5 |
| EGFP2R (הפוך) [10 μM] | 0.5 |
| לווין בדיקה [10 μM] | 0.3 |
| MgSO4 [50-mM] (בתנאי הערכה) | 0.25 |
| צבע התייחסות רוקס (25 μM) (המסופקים בערכה) | 0.05 |
| RNasin (40U/μL) (פרונגה) | 0.2 |
| השלישי כתב עילי/פלטינה מיקס Taq | 0.4 |
| סה כ לכל תגובה | 15 |
| שיטת פאן-ליסה RT-qPCR | |
| ריאגנט | μL/תגובה |
| 2x SYBR התגובה הירוקה מיקס | 10 |
| נוקיחכירה מים חופשיים | 2.1 |
| Taq5long (קדימה) [10 μM] | 1 |
| Taq16revlong (הפוך) [10 μM] | 1 |
| MgSO4 [50-mM] (בתנאי הערכה) | 0.25 |
| צבע התייחסות רוקס (25 μM) | 0.05 |
| RNasin (40U/μL) (פרונגה) | 0.2 |
| השלישי כתב עילי/פלטינה מיקס Taq | 0.4 |
| סה כ לכל תגובה | 15 |
טבלה 1: תיאור של פתרון התגובה לערבב מאסטר עבור שלושה RT שונים-qpcr בחני (פאן-rabv rt-qpcr, פאן-lyssa rt-qpcr ו-egfp-qpcr).
| שיטת RT-qPCR | שם | סוג | אורך | רצף (5 '-3 ') | גיוני | עמדה |
| שיטת הפאן-רבנו RT-qPCR | Taq3long | פריימר | 22 | היחידה לאטלא א | S | 7273-7294א |
| Taq17revlong | פריימר | 25 | גת CTG TCT גה TAA תג AYC מכונית G | כמו | 7390-7414א | |
| RABV4 | בדיקה (משפחה/טמרה) | 29 | המנון ה, הלסינקי לעצמאות | כמו | 7314-7342א | |
| RABV5 | בדיקה (משפחה/טמרה) | 32 | מחסום הגנה מפני כוהל | S | 7353-7384א | |
| שיטת פאן-ליסה RT-qPCR | Taq5long | פריימר | 23 | מחסום הארקה | S | 7272-7294א |
| Taq16revlong | פריימר | 25 | מוטי מינור-התעשייה הליטאית | כמו | 7366-7390א | |
| שיטת eGFP | EGFP1F | פריימר | 20 | מזגן הקאג | S | 637-656b |
| EGFP2R | פריימר | 19 | גה CTC מפקד הקאג | כמו | 768-750b | |
| מיכל בגין | בדיקה (משפחה/טמרה) | 22 | מג מג | S | 703-724b |
טבלה 2: תיאור התחל/הבדיקות של שלוש RT-qPCR שונים (פאן-RABV rt-qpcr, פאן-lyssa rt-qpcr ו-eGFP-qpcr). מהווה על פי וירוס פסטר (PV) רצף הגנום RABV (הצטרפות GenBank מספר M13215). ב על פי שיבוט וקטור pEGFP-1 רצף (הצטרפות GenBank מספר U55761).
| "פאן-רבייב"-קיוב ומוסר-השכל | ||||
| צעד | חזור | Temp | זמן | איסוף נתונים |
| תמלול הפוכה | 1 | 45 ° c | 15 דקות | |
| הפעלת הפעלה/הסטה ראשונית | 1 | 95 ° c | 3 דקות | |
| גברה | 40 | 95 ° c | בנות 15 | |
| 61 ° c | 1 דקות | נקודת סיום | ||
| שיטת פאן-ליסה RT-qPCR | ||||
| צעד | חזור | Temp | זמן | איסוף נתונים |
| תמלול הפוכה | 1 | 45 ° c | 15 דקות | |
| הפעלת הפעלה/הסטה ראשונית | 1 | 95 ° c | 3 דקות | |
| גברה | 40 | 95 ° c | בנות 15 | |
| 55 ° c | 1 דקות | נקודת סיום | ||
| עקומת דיסוציאציה | 1 | 95 ° c | בנות 15 | הגדל 0.1 ° צ'/ים, 55-95 ° c |
| 55 ° c | 1 דקות | |||
| 95 ° c | בנות 15 | |||
| 55 ° c | בנות 15 | |||
שולחן 3: תיאור תנאי הרכיבה התרמיים עבור שלושת RT-qpcr בחני (פאן-rabv rt-qpcr, פאן-lyssa rt-qpcr ו egfp-qpcr).
| Assay | ניתוח | תוצאות | פרשנות |
| . אני מבין | Cq במרווח של קבלה | החילוץ אומת | ניתן לבצע ניתוח של היתר |
| Cq מתוך מרווח הזמן של קבלה | החילוץ לא אומת | בדוק מחדש את המדגם (חזור על ההפעלה או/והחילוץ), בקש דוגמה נוספת במידת הצורך | |
| פאן-רבנו RT-qPCR | מ< 38 | חיובי | זיהוי חיובי של רנ א ויראלי |
| Cq ≥ 38 | שלילי | אנליזה של הפאן-lyssa RT-שיטת ה-qPCR | |
| פאן-lyssa RT-qPCR | עקומת התכה נחשב חיובי | חיובי | זיהוי חיובי של רנ א ויראלי |
| עקומת התכה הנחשבת לשלילית | שלילי | העדר זיהוי של רנ א ויראלי |
שולחן 4: הפרשנות הכוללת של שיטת הפאן-ליסביסאווירוס הכפולה המשולבת.
| המי-שיטת ה-PCR המקובלת על מקונן | מעגל PCR | שם | אורך | רצף (5 '-3 ') | גיוני | הצבמ | הגודל amplicon (bp) |
| המי-PCR מקונן במטרה לכוון את הגן הפילמור | סיבוב ראשון | PVO5m | 20 | הג האמריקאי | S | 7170-7189 | 320 |
| PVO9 | 19 | TGA אמנות עכשווית TTC רכב רכב GTN G | כמו | 7471-7489 | |||
| סיבוב שני | PVO5m | 20 | היחידה למשחק | S | 7170-7189 | 250 | |
| PVO8 | 22 | מחלקת החייאה | כמו | 7398-7419 | |||
| המי-PCR מקונן נגד הגן הנואופפרוטאין | סיבוב ראשון | N127 | 20 | ATG TAA CAC CTC TAC GG | S | 55-74 | 1532 |
| N8m | 19 | הקאג אמנות עכשווית TCT C | כמו | 1568-1586 | |||
| סיבוב שני | N127 | 20 | ATG TAA CAC CTC TAC GG | S | 55-74 | 845 | |
| N829 | 19 | מועצת המשפ א בע | כמו | 881-899 |
שולחן 5: תיאור התחל בשימוש של ה-PCR המקובל בקינון ההמי.
| המי-PCR מקונן במטרה לכוון את הגן הפילמור | ||||
| צעד | חזור | טמפרטורה | זמן | |
| סיבוב ראשון ושניה | דנטורציה ראשונית | 1 | 94 ° c | 3 דקות |
| דנטורציה | 35 | 94 ° c | שלושים בנות | |
| Hybridation | 56 ° c | 45 ס | ||
| תארכות | 72 ° c | 40 ס | ||
| התארכות סיום | 1 | 72 ° c | 3 דקות | |
| המי-PCR מקונן נגד הגן הנואופפרוטאין | ||||
| צעד | חזור | טמפרטורה | זמן | |
| סיבוב ראשון | דנטורציה ראשונית | 1 | 94 ° c | 3 דקות |
| דנטורציה | 35 | 94 ° c | שלושים בנות | |
| Hybridation | 56 ° c | שלושים בנות | ||
| תארכות | 72 ° c | 45 ס | ||
| התארכות סיום | 1 | 72 ° c | 3 דקות | |
| סיבוב שני | דנטורציה ראשונית | 1 | 94 ° c | 3 דקות |
| דנטורציה | 35 | 94 ° c | שלושים בנות | |
| Hybridation | 58 ° c | שלושים בנות | ||
| תארכות | 72 ° c | שלושים בנות | ||
| התארכות סיום | 1 | 72 ° c | 3 דקות | |
טבלה 6: תיאור תנאי הרכיבה התרמיים עבור ה-PCR המקונן המקובל.
| מעבדה | מדינה | תקופת הערכה | Nb של דגימות | תוצאות DFAT | תוצאות RIDT | רגישות | ספציפיות | ||
| Pos | ינוס | Pos | ינוס | ||||||
| מעבדה 1 | צרפת | 2015 | 82 | 50 | 32 | 50 | 32 | 96% | 93.7% |
| מעבדה 2 | צ'אד | 2012-2015 | 44 | 33 | 11 | 33 | 11 | 100% | 100% |
| מעבדה 3 | חוף השנהב | 2017 | 10 | 8 | 2 | 8 | 2 | 100% | 100% |
| מעבדה 4 | מאלי | 2017 | 18 | 15 | 3 | 15 | 3 | 100% | 100% |
| מעבדה 6 | איטליה | 2016 | 8 | 8 | 0 | 8 | 0 | 100% | - |
| כל | 2015-2017 | 162 | 114 | 48 | 114 | 48 | 98.2% | 95.8% | |
טבלה 7: קביעת הפרמטרים הפנימיים (רגישות, ספציפיות) של מבחן RIDT לעומת שיטת DFAT התייחסות, מבוסס על ניתוח של סך של 162 דגימות ובהשתתפות 5 מעבדות שונות.
| מאמץ וירוס מ | מארח מקורי | מיקום | ריכוז ראשוני (FFU/mL)b | מגבלת זיהוי (FFU/mL)c |
| 9147FRA | שועל אדום | צרפת | 3.1 x 107 | מיכלבן 10 |
| CVS | בידוד מעבדה | - | 1.6 x 107 | מיכלבן 10 |
| 8743THA | אדם | תאילנד | 8.1 x 107 | > 8.1 x 106 |
| 9508CZK (עצוב) | בידוד מעבדה | - | 5.4 x 108 | שבעה עשר |
| PV | בידוד מעבדה | - | 4.3 x 107 | מיכלבן 10 |
| 9001FRA | כלב | גיאנה הצרפתית | 2.4 x 106 | > 2.4 x 105 |
| 9704ARG | בת | ארגנטינה | 9.5 x 107 | 10מתוך 5 |
| 04030PHI | אדם | פיליפינים | 2.5 x 107 | 10מתוך 5 |
שולחן 8: מגבלת הזיהוי של ה-RIDT תוך שימוש ב-8 שתלים שונים של וירוס כלבת (מתוך לצ ואח '. 201614). מהווה קורות חיים: האתגר זן וירוס, עצוב: רחוב אלבמה Dufferin, PV: וירוס פסטר. ב מספר יחידות המיקוד של פלורסנט (FFU) לכל mL. ג מספר יחידות המיקוד הפלואורסצנטית (FFU) הופקד על הרצועה.
| Ridt הופיעה ב | ||||||||||
| מעבדה 1 | מעבדה 2 | שילוב | ||||||||
| חיובי | שלילי | כולל | חיובי | שלילי | כולל | חיובי | שלילי | כולל | ||
| גילוי רנ א נגיפי | חיובי | 18 | 1 | 19 | 26 | 0 | 32 | 44 | 7 | 51 |
| שלילי | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 3 | 3 | |
| כולל | 18 | 1 | 19 | 26 | 0 | 35 | 44 | 10 | 54 | |
טבלה 9: איתור RNA ויראלי עם RT-qPCR על רצועת המבחן Anigen המשמש בתנאי מעבדה (Lab 1), בתנאי שדה ונשלח בטמפרטורת הסביבה (Lab 2) או בשילוב (מתוך לצ ואח '. 201614).
טבלה משלימה 1: תיאור של 162 דגימות נבדק עם מבחן RIDT לקביעת הפרמטרים הפנימיים שלה הציג בטבלה 7. אנא לחץ כאן כדי להציג טבלה זו (לחץ לחיצה ימנית כדי להוריד).
Discussion
ה-RIDT הוא שיטה פשוטה, מהירה ובעלות נמוכה לאבחון כלבת שלאחר המוות וחלופה מבטיחה בתחום הבדיקות המעבדתיות. היישום של מבחן כזה, במיוחד עבור אזורים מבוזרים של מדינות נמוכות ובעלות הכנסה בינונית, ישפר את ההבנה של שכיחות וירוס הכלבת ושידור בקנה מידה מקומי ופוטנציאלי לאומי. בשילוב עם שיטת האיסוף מהירה לדגימת מוח (ללא נמק מלא), יתרון גדול הוא שהבדיקה יכולה להתבצע לחלוטין במסגרת השטח, הרחק ממתקני המעבדה. דגימות מוח שנאספו באמצעות מגנום foramen יכול לשמש לבדיקה, ולכן זה לא נדרש כדי לפתוח לחלוטין את הגולגולת בעלי חיים. המבדק פשוט לביצוע ולפענוח ומתאים במיוחד לפעילויות מעקב בשטח14. יתרונות אחרים של RIDT על DFAT או DRIT אינם זקוקים לפקדים חיוביים ושליליים ואחסון קיט בטמפרטורת החדר. בנוסף, הפרוטוקול שהשתנה, כאשר שלב הדילול (1:10) ל-PBS מושמט, אינו דורש הרבה ריאגנטים לבצע את הבדיקה ומפשט עוד יותר את ההליך תחת תנאי שדה.
נקודת מפתח היא איכות דגימות המוח. יש לאסוף ולבדוק דגימות בהקדם האפשרי לאחר מותו של בעל החיים החשוד, או לשמור על טמפרטורה מגניבה לפני בדיקה, כדי למנוע השפלה. אין לבדוק דגימות מפורקת מכיוון שהיא יכולה להשפיע על התוצאה (סיכון של תוצאה שלילית כוזבת). למרות שאין נתונים עדיין זמינים לגבי אובדן הרגישות של RIDT לאורך זמן עבור דגימות מוח, אנחנו ההשערה כי זה דומה בהשוואה DFAT מבחן32. עם זאת, ניתן לצמצם את הזמן שבין מותו של בעל החיים לבין ביצוע המבדק, מאחר שניתן לבצע את המבדק במהירות ובאופן ישיר בשטח. כך, באופן כללי יש סיכון נמוך יותר של דגימות מפורקת.
שלב קריטי נוסף בתוך הפרוטוקול הוא הגירה ההשעיה של המדגם. ההעברה אמורה להתחיל ישירות לאחר הפקדה של המדגם (1-5 דקות). צמיגות גבוהה של ההשעיה יכול אפוא להשפיע לרעה על ההגירה. שורט בעדינות את החלק התחתון של אתר ההפקדה של ההתקן עם טפטפת והוספת 1-2 טיפות יותר לעתים קרובות פותרת בעיה זו, וההעברה מתחילה מיד לאחר.
רוב הבדיקות המתבצעות במעבדות האפריקאיות (צ'אד, חוף השנהב ומאלי) בוצעו בטמפרטורת הסביבה שיכולה לעלות על 30 ° c, ואילו מגוון הטמפרטורות לאחסון והשימוש המומלץ על-ידי היצרן הוא 15 ° c-30 ° c. למרות שלא זיהינו כל השפעה של טמפרטורות גבוהות על ביצועי הבדיקה של RIDT, יש צורך להעריך אותו ביתר זהירות. באופן דומה, ההשפעה של טמפרטורה גבוהה במהלך אחסון והובלה של המכשיר לאחר שימוש עבור גילוי RNA ויראלי וצרכים הערכה נוספת. הרגישות של ה-RNA ויראלי זיהוי על-ידי RT-qPCR מרצועת RIDT יכול להיות מושפע באיכות של דגימת המוח בשימוש בתחילה במבחן, אבל גם על ידי מצב אחסון של בדיקות RIDT לאחר השימוש. לדוגמה, הרגישות של זיהוי ה-RNA היה גבוה יותר כאשר בשימוש בדיקות RIDT אוחסנו תחת תנאי מעבדה מבוקרת (94.7%) בהשוואה לתנאי שדה (למשל, צ'אד) (81.2%) תנאים אלה עשויים גם להשפיע על היושרה (במיוחד את האורך) של RNA קבוע על הרצועה, ואולי להסביר את הרגישות המתון עבור הגנוזה מבוסס על הגברה יותר PCR (g., > 500 נוקלאוטידים)14. הרגישות של RT-qPCR שבוצעה על רצועת המבחן היה נמוך יותר מאשר השיג באמצעות כרטיסי FTA Whatman (80.6%) בדומה טכניקות מולקולריות אחרות, העומס הנגיפי יכול גם להשפיע על ההצלחה של מבוסס הגנוזה על בסיס רצועות RDIT, עם תוצאות שליליות פוטנציאליות עבור דגימותעם עומס נגיפינמוך.
המבדק אינו מומלץ כרגע על ידי מי ו-OIE לאבחון שגרתי ומעקב אחר מחלות, ואין אפשרות להשתמש בתוצאה משלה כדי להנחות את קבלת החלטות ה-אפ. בדיקה נוספת נדרשת עדיין. עם זאת, אבחון מהיר של כלבת מהירה הוא גורם מכריע במערכות מעקב מתמשכות של כלבת והוא אינסטרומנטלי להגברת המחויבות הפוליטית, שהיא חשובה ביותר לשליטה מוצלחת של כלבת בת-קיימא33. בדיקות RIDT מציעות הזדמנויות אבחון כלבת חדשה בהקשר זה והם כלי שימושי כדי להרחיב את הפיקוח על כלבת בעלי חיים בתחום באזורים enzootic נמוך או בינוני.
Acknowledgements
עבודה זו הייתה נתמכת באמצעות הברית הגלובלית לחיסונים וחיסונים (GAVI), קרן וולפרמאן, שיתוף הפעולה השוויצרי האפריקאי (SARECO), SWF Stiftung, וויטרזאשפושיפיפיטקצ פורשונג, באזל, המדע הדו והטכנולוגיה של שוויץ עם אסיה וקרן נובארטיס למחקר ביו-רפואי.
אנו מודים במיוחד לבעלי הכלבים, לאנשי הוטרינר ולצוות המעבדה על המחויבות הגדולה שלהם. אנחנו גם רוצים להכיר את ליסה Crump עבור עריכת השפה.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-Rabies Nucleocapsid Conjugate (lyophilizied, adsorbed) | Bio-Rad, France | 3572112 | Fluorescein-5-isothiocyanate (FITC) conjugated polyclonal antibody against the nucleocapsid of rabies virus. Use for the DFAT reference tecnnique. |
| Applied Biosystems 7500 Real-Time PCR System | Applied Biosystems, France | 4351104 | Amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| Disposable plastic pipette, drinking straw, clamp, dropper | - | - | Equipment used for the collection of the brain stem (medulla oblongata) via the foramen magnus (occipital route). |
| Evans Blue Solution 1% | Bio-Rad, France | 3574911 | Counter-coloration used for the DFAT to facilite the reading under UV microscope. |
| Primer eGFPF1 | Eurofins Genomics, Germany | - | Forward primer for the amplification of the internal control eGFP by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-GACCACTACCAGCAGAACAC-3'. |
| Primer eGFPR2 | Eurofins Genomics, Germany | - | Reverse primer for the amplification of the internal control eGFP by RT-qPCR after extraction from the RIDT device, sequence: 5'-GAACTCCAGCAGGACCATG-3'. |
| Primer Taq17 revlong | Eurofins Genomics, Germany | - | Reverse primer for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-ATGAGAAGTGG AAYAAYCATCA-3'. |
| Primer Taq3 long | Eurofins Genomics, Germany | - | Forward primer for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-GATCTGTCTGAA TAATAGAYCCARG-3'. |
| Probe eGFP FAM/TAMRA | Eurofins Genomics, Germany | - | Forward primer for the amplification of the internal control by RT-qPCR after extraction from the RIDT device, sequence: 5'-AGCACCCAGT CCGCCCTGAGCA-3'. |
| Probe RABV4 FAM/TAMRA | Eurofins Genomics, Germany | - | Probe for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-AACACYTGATCBA GKACAGARAAYACATC-3'. |
| Probe RABV5 FAM/TAMRA | Eurofins Genomics, Germany | - | Probe for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-AGRGTGTTTTCYAG RACWCAYGAGTTTTTYCA-3'. |
| Rapid Rabies Ag Test Kit | BioNote Inc., Republic of Korea | RG18-01DD | Rapid immunochromatographic diagnostic test (RIDT, also named lateral flow device or LFD) for the post-mortem diagnosis of rabies. |
| Recombinant RNasin Ribonuclease Inhibitor | Promega, USA | N2515 | Enzyme used with the kit for the amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| SuperScript III Platinum One-Step qRT-PCR Kit | Invitrogen, France | 11732-020 | Kit for the amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| TRIzol Reagent | Invitrogen, France | 15596026 | Phenol/chloroforme based total RNA extraction using the cellulose membrane of the RIDT. |
References
- Hampson, K., et al. Correction: Estimating the Global Burden of Endemic Canine Rabies. PLoS Neglected Tropical Diseases. 9 (5), e0003786 (2015).
- Rupprecht, C., Kuzmin, I., Meslin, F. Lyssaviruses and rabies: current conundrums, concerns, contradictions and controversies. F1000Research. 6, 184 (2017).
- Walker, P. J., et al. ICTV Virus Taxonomy Profile: Rhabdoviridae. The Journal of General Virology. 99 (4), 447-448 (2018).
- World Health Organization (WHO). WHO Expert Consultation on Rabies, third report. HO Technical Report Series, No. 1012. , (2018).
- Dacheux, L., et al. More Accurate Insight into the Incidence of Human Rabies in Developing Countries through Validated Laboratory Techniques. PLoS Neglected Tropical Diseases. 4 (11), e765 (2010).
- Welburn, S. C., Beange, I., Ducrotoy, M. J., Okello, A. L. The Neglected Zoonoses - The Case for Integrated Control and Advocacy. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. , (2015).
- Dacheux, L., Bourhy, H. Diagnostic tests for human rabies. Revue Scientifique Et Technique (International Office of Epizootics). 37 (2), 581-593 (2018).
- Kasempimolporn, S., Saengseesom, W., Lumlertdacha, B., Sitprija, V. Detection of rabies virus antigen in dog saliva using a latex agglutination test. Journal of Clinical Microbiology. 38 (8), 3098-3099 (2000).
- Kang, B., et al. Evaluation of a rapid immunodiagnostic test kit for rabies virus. Journal of Virological Methods. 145 (1), 30-36 (2007).
- Nishizono, A., et al. A simple and rapid immunochromatographic test kit for rabies diagnosis. Microbiology and Immunology. 52 (4), 243-249 (2008).
- Kasempimolporn, S., Saengseesom, W., Huadsakul, S., Boonchang, S., Sitprija, V. Evaluation of a rapid immunochromatographic test strip for detection of Rabies virus in dog saliva samples. Journal of Veterinary Diagnostic Investigation: Official Publication of the American Association of Veterinary Laboratory Diagnosticians, Inc. 23 (6), 1197-1201 (2011).
- Ahmed, K., et al. Evaluation of a monoclonal antibody-based rapid immunochromatographic test for direct detection of rabies virus in the brain of humans and animals. The American Journal of Tropical Medicine and Hygiene. 86 (4), 736-740 (2012).
- Léchenne, M., et al. Validation of a Rapid Rabies Diagnostic Tool for Field Surveillance in Developing Countries. PLoS Neglected Tropical Diseases. 10 (10), e0005010 (2016).
- Yang, D. K., et al. Comparison of four diagnostic methods for detecting rabies viruses circulating in Korea. Journal of Veterinary Science. 13 (1), 43-48 (2012).
- Markotter, W., et al. Evaluation of a rapid immunodiagnostic test kit for detection of African lyssaviruses from brain material. The Onderstepoort Journal of Veterinary Research. 76 (2), 257-262 (2009).
- Reta, T., et al. Evaluation of Rapid Immunodiagnostic Test for Rabies Diagnosis Using Clinical Brain Samples in Ethiopia. Journal of Veterinary Science & Medical Diagnosis. 2 (3), 1-3 (2013).
- Servat, A., Picard-Meyer, E., Robardet, E., Muzniece, Z., Must, K., Cliquet, F. Evaluation of a Rapid Immunochromatographic Diagnostic Test for the detection of rabies from brain material of European mammals. Biologicals: Journal of the International Association of Biological Standardization. 40 (1), 61-66 (2012).
- Certoma, A., et al. Assessment of a Rabies Virus Rapid Diagnostic Test for the Detection of Australian Bat Lyssavirus. Tropical Medicine and Infectious Disease. 3 (4), (2018).
- Ahmad, A., Singh, C. K. Comparison of rapid immunodiagnosis assay kit with molecular and immunopathological approaches for diagnosis of rabies in cattle. Veterinary World. 9 (1), 107-112 (2016).
- Sharma, P., Singh, C. K., Narang, D. Comparison of immunochromatographic diagnostic test with Hheminested Reverse transcriptase polymerase chain reaction for detection of rabies virus from brain samples of various species. Veterinary World. 8 (2), 135-138 (2015).
- Voehl, K. M., Saturday, G. A. Evaluation of a rapid immunodiagnostic rabies field surveillance test on samples collected from military operations in Africa, Europe, and the Middle East. U.S. Army Medical Department Journal. , 27-32 (2014).
- Servat, A., Robardet, E., Cliquet, F. An inter-laboratory comparison to evaluate the technical performance of rabies diagnosis lateral flow assays. Journal of Virological Methods. 272, 113702 (2019).
- Eggerbauer, E., et al. Evaluation of Six Commercially Available Rapid Immunochromatographic Tests for the Diagnosis of Rabies in Brain Material. PLoS Neglected Tropical Diseases. 10 (6), e0004776 (2016).
- Barrat, J., Meslin, F. X., Kaplan, M. M., Koprowski, H. Simple technique for the collection and shipment of brain specimens for rabies diagnosis. Laboratory techniques in rabies. , 425-432 (1996).
- Dacheux, L., et al. Dual Combined Real-Time Reverse Transcription Polymerase Chain Reaction Assay for the Diagnosis of Lyssavirus Infection. PLoS Neglected Tropical Diseases. 10 (7), e0004812 (2016).
- Dacheux, L., et al. A reliable diagnosis of human rabies based on analysis of skin biopsy specimens. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 47 (11), 1410-1417 (2008).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Application of next generation sequencing to rabies virus and other lyssaviruses. Laboratory techniques in rabies. 2, 49-61 (2019).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Conventional pan-lyssavirus reverse transcriptase polymerase chain reaction. Laboratory techniques in rabies. 2, 1-16 (2019).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Rabies real-time reverse transcriptase polymerase chain reaction. Laboratory techniques in rabies. 2, 17-34 (2019).
- Talbi, C., et al. Evolutionary history and dynamics of dog rabies virus in western and central Africa. The Journal of General Virology. 90 (Pt 4), 783-791 (2009).
- McElhinney, L. M., Marston, D. A., Brookes, S. M., Fooks, A. R. Effects of carcase decomposition on rabies virus infectivity and detection. Journal of Virological Methods. 207, 110-113 (2014).
- Vigilato, M. A. N., et al. Progress towards eliminating canine rabies: policies and perspectives from Latin America and the Caribbean. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 368 (1623), 20120143 (2013).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved