आगे आणविक अनुप्रयोगों के साथ संसाधन-सीमित सेटिंग्स के लिए फील्ड पोस्टमॉर्टम रेबीज रैपिड इम्यूनोक्रोमेग्राफिक डायग्नोस्टिक टेस्ट
In This Article
Summary
हम मस्तिष्क बायोप्सी नमूने से अंतिम व्याख्या करने के लिए एक तेजी से इम्यूनोक्रोमेटोग्राफिक नैदानिक परीक्षण (RIDT) का उपयोग कर क्षेत्र की स्थिति के तहत पशु रेबीज के पोस्टमॉर्टम निदान के लिए एक पूरा प्रोटोकॉल प्रस्तुत करते हैं । हम आणविक विश्लेषण और वायरल जेनोटाइपिंग के लिए डिवाइस का उपयोग करके आगे के अनुप्रयोगों का भी वर्णन करते हैं।
Abstract
कार्यात्मक रेबीज निगरानी प्रणाली विश्वसनीय डेटा प्रदान करने और रोग नियंत्रण के लिए आवश्यक राजनीतिक प्रतिबद्धता को बढ़ाने के लिए महत्वपूर्ण हैं । आज तक, रेबीज-पॉजिटिव के रूप में संदिग्ध जानवरों को शास्त्रीय या आणविक प्रयोगशाला विधियों का उपयोग करके पोस्टमॉर्टम पुष्टि करने के लिए प्रस्तुत किया जाना चाहिए। हालांकि, अधिकांश स्थानिक क्षेत्र कम और मध्यम आय वाले देशों में हैं जहां पशु रेबीज निदान केंद्रीय पशु चिकित्सा प्रयोगशालाओं तक सीमित है । निगरानी अवसंरचना की खराब उपलब्धता से दूरदराज के क्षेत्रों से गंभीर बीमारी हो जाती है । कम तकनीकी विशेषज्ञता की आवश्यकता वाले कई नैदानिक प्रोटोकॉल हाल ही में विकसित किए गए हैं, जो विकेंद्रीकृत प्रयोगशालाओं में रेबीज निदान स्थापित करने का अवसर प्रदान करते हैं। हम यहां मस्तिष्क बायोप्सी सैंपलिंग से लेकर अंतिम व्याख्या तक रैपिड इम्यूनोक्रोमेटोग्राफिक डायग्नोस्टिक टेस्ट (आरआईआरटी) का उपयोग करके पशु रेबीज के फील्ड पोस्टमॉर्टम निदान के लिए एक पूर्ण प्रोटोकॉल पेश करते हैं। हम आणविक विश्लेषण और वायरल जेनोटाइपिंग के लिए डिवाइस के एक और उपयोग का वर्णन करके प्रोटोकॉल को पूरा करते हैं। आरआईआरटी मस्तिष्क के नमूनों में रेबीज वायरस और अन्य लिसावइरस का आसानी से पता लगाता है। इस तरह के परीक्षणों का सिद्धांत सरल है: मस्तिष्क सामग्री एक परीक्षण पट्टी पर लागू होती है जहां सोने के संयुग्मित एंटीबॉडी विशेष रूप से रेबीज एंटीजन के लिए बांधते हैं। एंटीजन-एंटीबॉडी कॉम्प्लेक्स परीक्षण लाइन पर निश्चित एंटीबॉडी के लिए आगे बांधते हैं, जिसके परिणामस्वरूप स्पष्ट रूप से दिखाई देने वाली बैंगनी रेखा होती है। वायरस परीक्षण पट्टी में निष्क्रिय है, लेकिन वायरल आरएनए बाद में निकाला जा सकता है । यह परीक्षण पट्टी, बजाय संक्रामक मस्तिष्क नमूना, सुरक्षित रूप से और आसानी से पुष्टि और आणविक टाइपिंग के लिए एक सुसज्जित प्रयोगशाला में भेजा जा करने के लिए अनुमति देता है । निर्माता के प्रोटोकॉल के संशोधन के आधार पर, हमने परीक्षण संवेदनशीलता में वृद्धि पाई, जो गोल्ड स्टैंडर्ड रेफरेंस विधि, प्रत्यक्ष इम्यूनोफ्लोरेसेंस एंटीबॉडी परीक्षण की तुलना में 98% तक पहुंच गया। परीक्षण के फायदे कई हैं: तेजी से, उपयोग में आसान, कम लागत और प्रयोगशाला बुनियादी ढांचे के लिए कोई आवश्यकता नहीं है, जैसे माइक्रोस्कोपी या कोल्ड-चेन अनुपालन। RIDTs उन क्षेत्रों के लिए एक उपयोगी विकल्प का प्रतिनिधित्व करता है जहां संदर्भ नैदानिक विधियां उपलब्ध नहीं हैं।
Introduction
कैनाइन रेबीज मानव रेबीज का मुख्य कारण है, जो प्रति वर्ष लगभग ५९,००० मानव मौतों के लिए विश्व स्तर पर जिम्मेदार है, लगभग सभी एशिया और अफ्रीका में कम और मध्यम आय वाले देशों (LMICs) में होने वाली1। मुख्य एटियोलॉजिकल एजेंट एक न्यूरोट्रोपिक कैनाइन से जुड़े शास्त्रीय रेबीज वायरस (राब्व, परिवार राब्डोविरिडी,जीनस एलिसावायरस,प्रजाति रेबीज lyssavirus) है। हालांकि, रेबीज से संबंधित अन्य lyssaviruses, ज्यादातर चमगादड़ प्रजातियों में घूम, भी रोग का कारण2,,3. प्रभावित क्षेत्रों में, रोग निगरानी और नियंत्रण अक्सर विश्वसनीय डेटा,4, 5, 6,5की कमी के कारण निम्न स्तर की राजनीतिक प्रतिबद्धता से बाधितहोतेहैं । रोग की कम रिपोर्टिंग का एक कारण प्रयोगशाला निदान का अभाव है, जो सुसज्जित प्रयोगशालाओं और प्रशिक्षित कर्मचारियों तक सीमित पहुंच के साथ-साथ नमूनों के शिपमेंट की कठिनाइयों के कारण है । रेबीज के मामलों की पुष्टि करने के लिए प्रयोगशाला निदान आवश्यक है और इसके अतिरिक्त शामिल उपभेदों के आनुवंशिक लक्षण वर्णन के लिए अनुमति देता है, क्षेत्रीय स्तर पर वायरस संचरण पर अंतर्दृष्टि प्रदान करता है4,,5,,7।
पोस्टमॉर्टम रेबीज निदान के लिए वर्तमान सोने के मानकों, दोनों विश्व स्वास्थ्य संगठन (डब्ल्यूएचओ) और पशु स्वास्थ्य के लिए विश्व संगठन (OIE) द्वारा अनुमोदित, प्रत्यक्ष फ्लोरोसेंट एंटीबॉडी परीक्षण (DFAT), प्रत्यक्ष तेजी से इम्यूनोहिस्टोकेमिस्ट्री परीक्षण (DRIT) और आणविक तरीकों (जैसे, रिवर्स ट्रांसक्रिप्शन बहुलक श्रृंखला प्रतिक्रिया (आरटी-पीसीआर))4,,8हैं । हालांकि, एलएमआईसी में उचित आवेदन असंगत बिजली आपूर्ति, अनकूल्ड नमूना परिवहन और गुणवत्ता प्रबंधन प्रणाली की कमी के साथ अपर्याप्त प्रयोगशाला सुविधाओं के कारण सीमित रहता है। क्योंकि पशु रेबीज निदान आम तौर पर केवल LMICs में केंद्रीय पशु चिकित्सा प्रयोगशालाओं में आयोजित किया जाता है, मौजूदा निगरानी डेटा मुख्य रूप से शहरी क्षेत्रों में रेबीज की स्थिति को दर्शाता है ।
हाल ही में विकसित कम प्रौद्योगिकी नैदानिक विकल्प दूरदराज के क्षेत्रों में रेबीज निदान स्थापित करने के अवसर प्रदान करते हैं और विकेंद्रीकृत रेबीज प्रयोगशालाएं4,8,9.9 रैपिड इम्यूनोक्रोमेग्राफिक डायग्नोस्टिक टेस्ट (आरआईआरटी) सोने के संयुग्मित डिटेक्टर एंटीबॉडी का उपयोग करके इम्यूनोक्रोमेग्राफी पर आधारित एक पार्श्व प्रवाह परीक्षण है और यह एक बहुत ही आशाजनक रेबीज नैदानिक उपकरण10,11,12, 13,13है।, सिद्धांत सरल है: कमजोर पड़ने के बाद, प्रदान किए गए बफर में मस्तिष्क सामग्री को मिलाया जाता है, और परीक्षण पट्टी पर कुछ बूंदें लागू की जाती हैं जहां सोने के संयुग्म मोनोक्लोनल एंटीबॉडी विशेष रूप से रेबीज एंटीजन, मुख्य रूप से न्यूकोप्रोटीन(चित्रा 1)के लिए बांधते हैं। एंटीजन-एंटीबॉडी परिसरों को फिर पार्श्व प्रवाह प्रवास से गुजरना पड़ता है, जो रेबीज एंटीजन के खिलाफ निश्चित एंटीबॉडी के लिए परीक्षण लाइन (टी-लाइन) पर बाध्यकारी होता है, जिसके परिणामस्वरूप स्पष्ट रूप से दिखाई देने वाली बैंगनी रेखा होती है। शेष सोने के संयुग्मित एंटीबॉडी रेबीज एंटीजन से बंधे नहीं हैं, जो अतिरिक्त लक्षित एंटीबॉडी के माध्यम से झिल्ली में पलायन और ठीक करते हैं, जिसके परिणामस्वरूप स्पष्ट रूप से दिखाई देने वाली बैंगनी नियंत्रण रेखा (सी-लाइन)।
एक कदम, कम लागत विधि तेजी से, बेहद आसान है और महंगे उपकरण या विशेष भंडारण स्थितियों की आवश्यकता नहीं है। कमजोर पड़ने वाले कदम को खत्म करने के लिए निर्माता प्रोटोकॉल के संशोधन के साथ, परीक्षण करने के लिए आवश्यक लगभग सभी उपकरण और अभिकर्षक किट14में शामिल हैं। परिणाम माइक्रोस्कोप के बिना 5-10 मिनट के बाद पढ़ा जाता है। यह DFAT परीक्षण पर एक बड़ा लाभ है, जो एक फ्लोरेसेंस माइक्रोस्कोप और इम्यूनोफ्लोरेसेंस कंजूस, प्रशीतित परिवहन और नमूना भंडारण के साथ की आवश्यकता है । यहां तक कि डीआरआईटी परीक्षण, जिसे हल्के माइक्रोस्कोप का उपयोग करके किया जा सकता है, को एंटी-रेबीज एंटीबॉडी को स्टोर करने के लिए एक निरंतर कोल्ड चेन की आवश्यकता होती है, जो अभी तक व्यावसायिक रूप से उपलब्ध नहीं है। डीआरआईटी की तुलना में, आरआईआरटी को कोई जहरीले रसायनों की आवश्यकता नहीं है, जिन देशों में अपशिष्ट निपटान खराब विनियमित है, वहां एक विशेष लाभ है । रैपिड टेस्ट गोल्ड स्टैंडर्ड टेस्ट डीएफएटी और डीआरटी की तुलना में ज्यादा आसान व्याख्या के साथ कम समय लेने वाला होता है । यह सीमित तकनीकी विशेषज्ञता वाले कर्मियों द्वारा ऑन-साइट परीक्षण की अनुमति देता है।
इन परीक्षण गुणों के आधार पर, दूरदराज के क्षेत्रों में संदिग्ध जानवरों का त्वरित निदान संभव हो जाता है, जिससे जितनी जल्दी हो सके उजागर लोगों के लिए पोस्ट एक्सपोजर प्रोफिलैक्सिस (पीईपी) के कार्यान्वयन की सुविधा हो। इसके अलावा रेबीज के नमूनों का डिस्टेंस ट्रांसपोर्ट जरूरी नहीं है, जिसके परिणामस्वरूप जांच के समय सैंपल की गुणवत्ता बेहतर हो। हालांकि, आरआईआरटी परीक्षणों के साथ प्राप्त परिणामों की पुष्टि वर्तमान में DFAT या DRIT जैसे संदर्भ नैदानिक परीक्षण का उपयोग करके की जानी चाहिए।
आरएबीवी और अन्य lyssaviruses का पता लगाने के लिए आरआईआरटी तकनीकों का मूल्यांकन किया गया है। पहला अध्ययन कोरियाई शोधकर्ताओं ने 200710में किया था . DFAT विधि की तुलना में, ५१ पशु नमूनों और 4 RABV आइसोलेट में, RIDT ने क्रमशः ९१.७% और १००% की संवेदनशीलता और विशिष्टता दिखाई । इन परिणामों को बाद में कोरिया से ११० पशु मस्तिष्क के नमूनों के साथ पुष्टि की गई, संवेदनशीलता और विशिष्टता के साथ, DFAT की तुलना में, ९५% और ९८.९%, क्रमशः15। हाल ही में, अन्य अध्ययनों में विभिन्न भौगोलिक मूल वाले विभिन्न पशुओं से वायरस आइसोलिट और/या संक्रमित मस्तिष्क नमूनों का उपयोग करके इस आरआईआरटी के प्रदर्शन का आकलन किया गया । अफ्रीकी आरएबीवी और अन्य अफ्रीकी lyssaviruses (Duvenhage वायरस (DUVV), लागोस बैट वायरस (LBV) और Mokola वायरस (MOKV)) सहित 21 नमूनों के एक पैनल, सफलतापूर्वक पता चला, DFAT16की तुलना में १००% की संवेदनशीलता के साथ किया गया । इसी तरह की उच्च संवेदनशीलता (96.5%) और विशिष्टता (100%) वैल्यूज इथियोपिया17से 115 ब्रेन नमूनों के एक पैनल से प्राप्त किया गया . एक अन्य अध्ययन में यूरोपीय राबवी आइसोलेट्स, दो अन्य यूरोपीय lyssaviruses (यूरोपीय चमगादड़ lyssavirus प्रकार 1 (EBLV-1) और प्रकार 2 (EBLV-2)), और ऑस्ट्रेलियाई बल्ले lyssavirus (ABLV)18का मूल्यांकन किया । 172 पशु मस्तिष्क नमूनों के विश्लेषण के आधार पर, आरआईआरटी किट में डीएफएटी की तुलना में 88.3% संवेदनशीलता और 100% विशिष्टता थी, और रेबीज से संबंधित तीन lyssaviruses का सफलतापूर्वक पता लगाया गया था। इस अध्ययन में, कुछ झूठे नकारात्मक परिणाम ग्लिसेरोल बफर में संग्रहीत मस्तिष्क के नमूनों से आए, जिसमें सुझाव दिया गया कि अनुचित ग्लिसरोल हटाने ने केशिका प्रवाह या एंटीबॉडी बाइंडिंग को प्रभावित किया। ऑस्ट्रेलियाई चमगादड़ से ४३ नैदानिक नमूनों के हाल के विश्लेषण पिछले परीक्षण परिणामों की पुष्टि की, DFAT19के लिए पूर्ण सामंजस्य के साथ । भारत में सीमित संख्या में नैदानिक नमूनों (11 और 34 नमूनों) पर आरआईआरटी का उपयोग करके दो अध्ययन किए गए। डीएफएटी की तुलना में, संवेदनशीलता 85.7% और 91.7% के बीच थी और विशिष्टता 100%20,21थी। अफ्रीका, यूरोप और मध्य पूर्व से 80 पशु मस्तिष्क नमूनों का उपयोग कर इस किट का एक और मूल्यांकन विशिष्टता के लिए DFAT के साथ पूर्ण सामंजस्य प्राप्त (100%) लेकिन एक उच्च संवेदनशीलता (96.9%) पिछले अध्ययन22की तुलना में . हाल ही में 10 नमूनों के पैनल का उपयोग करके 22 विभिन्न प्रयोगशालाओं में किए गए इस आरआईआरटी की अंतर-प्रयोगशाला तुलना में, समग्र सामंजस्य 99.5%23था।
हाल ही में हुए एक बहुकेंद्रित अध्ययन में असंतोषजनक समग्र आरआईआरटी प्रदर्शन24दर्शाया गया है . तीन अलग-अलग डेटासेट के नमूनों का परीक्षण किया गया और DFAT की तुलना में परिवर्तनीय संवेदनशीलता और विशिष्टता मूल्य प्रदान किए गए। उदाहरण के लिए, संवेदनशीलता और विशिष्टता पहले पैनल (n =51) और दूसरे पैनल (n = 31) के साथ प्राप्त प्रयोगात्मक संक्रमित जानवरों से नमूनों की, सभी प्रयोगशाला ए में परीक्षण, क्रमशः 16% और ४३% की संवेदनशीलता दी, जबकि विशिष्टता दोनों के लिए १००% थी । इसके विपरीत, प्रयोगशाला बी द्वारा विश्लेषण किए गए फील्ड नैदानिक नमूनों के तीसरे पैनल (एन = 30) के परिणामों ने DFAT के परिणामों के साथ एक पूर्ण सामंजस्य प्रदान किया, जिसे प्रयोगशाला ए (85% संवेदनशीलता और 100% विशिष्टता) द्वारा लगभग पूरी तरह से पुष्टि की गई थी। बैच-टू-बैच भिन्नता को आरआईआरटी24के साथ अपेक्षाकृत कम संवेदनशीलता के उतार-चढ़ाव के लिए संभावित स्पष्टीकरण के रूप में सुझाया गया था ।
इसके साथ ही, एक अन्य अध्ययन ने उपरोक्त वर्णित आरआईआरटी की समान सत्यापन प्रक्रिया का प्रदर्शन किया, जिसमें निर्माता द्वारा अनुशंसित प्रोटोकॉल14के संशोधन के साथ। मस्तिष्क सामग्री तैयार करने के दौरान पीबीएस में पूर्व-कमजोर पड़ने वाले कदम (1:10) को छोड़ दिया गया था। इस सरल संशोधित प्रोटोकॉल के आधार पर, लेखकों ने क्रमशः 95.3% और 93.3% की संवेदनशीलता और विशिष्टता प्राप्त की, परीक्षण द्वारा DFAT की तुलना में, प्रयोगशाला की स्थिति के तहत, 73 पशु मस्तिष्क के नमूनों का एक डेटासेट, स्वाभाविक रूप से या प्रायोगिक रूप से विभिन्न आरएबीवी उपभेदों से संक्रमित। अध्ययन एक क्षेत्र की स्थापना (चाड, अफ्रीका) में इस RIDT के पहले मूल्यांकन प्रस्तुत किया । 48 नैदानिक मस्तिष्क नमूनों में, संवेदनशीलता और विशिष्टता क्रमशः 94.4% और 100% थी। DFAT और RIDT के बीच विसंगतियों DFAT के साथ झूठे सकारात्मक परिणाम के कारण थे, आरटी पीसीआर के साथ पुष्टि के बाद निर्धारित किया है । जब इन परिणामों को हटा दिया गया था, तो पूर्ण सामंजस्य था, और यह दिखा दिया कि आरआईआरटी अधिक विश्वसनीय था कि इन क्षेत्र की स्थितियों के तहतDFAT 14। संशोधित प्रोटोकॉल का उपयोग करके कोई बैच-टू-बैच भिन्नता नहीं देखी गई। जब संशोधित प्रोटोकॉल को एगरबाउर एट अल24के अध्ययन में DFAT/RIDT भिन्न नमूनों (एन = 8) की एक छोटी संख्या पर लागू किया गया था, तो सभी को सामंजस्य (100% संवेदनशीलता) पाया गया था।
आरआईआरटी का एक अन्य प्रमुख लाभ आणविक तकनीकों (जैसे आरटी-पीसीआर) और बाद में जेनोटीपिंग14, 24,24का उपयोग करके पट्टी पर तय वायरल आरएनए का पता लगाने के लिए माध्यमिक उपयोग है। एक निष्कर्षण कदम के बाद, Léchenne एट अल14 वायरल आरएनए ५१ नमूनों के एक पैनल में ८६.३% संवेदनशीलता के साथ आरटी पीसीआर का उपयोग कर Anigen डिवाइस झिल्ली पर तय का प्रदर्शन (18 नमूनों का परीक्षण किया और परिवेश के तापमान पर चाड से भेज दिया) । बाद में जेनोटीपिंग 14 नमूनों की जांच में से 93% में संभव था। लंबाई में कम से कम 500 न्यूक्लियोटाइड्स के पीसीआर एम्प्लीकॉन के सेंगर सीक्वेंसिंग का उपयोग किया गया था। आरएबीवी आइसोलेट के अलावा, परीक्षण में एक पूरी तरह से कॉनकॉर्ड इंटरनेशनल इंटर लेबोरेटरी टेस्ट14के दौरान चार अन्य lyssavirus प्रजातियों, DUVV, EBLV-1, EBLV-2 और बोकेलोह बैट lyssavirus (BBLV) का पता चला । वायरल आरएनए का पता लगाने की संवेदनशीलता भी अधिक थी (100%) एगरबाउर एट अल के अध्ययन में, प्रयोगशाला नमूनों की जांच24के आधार पर . बाद के अध्ययन से यह भी पता चला है कि आरआईआरटी किट में इस्तेमाल होने वाले बफर ने वायरस को निष्क्रिय कर दिया । इस प्रकार, उपकरणों को आणविक पुष्टि और जीनोटाइपिंग के लिए संदर्भ प्रयोगशालाओं के लिए विशिष्ट जैवसेफ्टी सावधानियों के बिना परिवेश के तापमान पर आसानी से भेज दिया जा सकता है।
पिछले मूल्यांकनों के आधार पर, आरआईआरटी टूल फील्ड सेटिंग्स में उपयोग के लिए कई फायदे प्रदान करते हैं, खासकर जब संदर्भ नैदानिक तकनीकें उपलब्ध नहीं हैं। हालांकि, इस परीक्षण में कुछ सीमाएं भी हैं, विशेष रूप से, एंटीजन डिटेक्शन14, 24,24की कम संवेदनशीलता। यह परीक्षण वायरल एंटीजन की उच्च मात्रा वाले नमूनों जैसे मस्तिष्क के नमूनों के लिए लागू होता है । हालांकि, लार या शरीर के अन्य तरल पदार्थ जैसे अन्य नमूनों के लिए यह उपयुक्त नहीं है। एक और खामी डिवाइस (यूरोप में लगभग 5-10 यूरो) की लागत है, जो DFAT, आरटी-पीसीआर या डीआरआईटी प्रदर्शन की लागत की तुलना में कम महंगा है, लेकिन जो अभी भी LMICs के लिए उच्च बना हुआ है। हालांकि, भविष्य के विकास और अन्य कंपनियों से इसी तरह के RIDTs के सत्यापन के लिए एक मूल्य में कमी का कारण बन सकता है । एक अध्ययन में बैच-टू-बैच विविधताओं की सूचना दी गई । हालांकि दूसरों द्वारा रिपोर्ट नहीं, सख्त गुणवत्ता नियंत्रण फिर भी जब एक नए बैच का परीक्षण किया जाना चाहिए, के रूप में किसी भी एक गुणवत्ता प्रबंधन के माहौल में इस्तेमाल अभिकरने वाला के लिए । विभिन्न बैचों का उपयोग करते समय संशोधित प्रोटोकॉल के उपयोगमेंकोई परिवर्तन नहीं किया गया था । एक अध्ययन को छोड़कर सभी ने यह दर्शाया कि डीएफएटी (लगभग 90%-95%) की तुलना में आरडीआईटी की संवेदनशीलता अधिक थी। क्योंकि रेबीज हमेशा घातक होता है, इसलिए डीएफएटी, डीआरटी या आरटी-पीसीआर14जैसे संदर्भ नैदानिक परीक्षण का उपयोग करके आरडीआईटी के साथ किसी भी नकारात्मक परिणाम की पुष्टि करने की अभी भी दृढ़ता से सिफारिश की जाती है।
इस पांडुलिपि में, हम निर्माता सिफारिशों (जो पहले14मान्य थे) और बाद में आणविक विश्लेषण की तुलना में मस्तिष्क नमूना संग्रह से संशोधित प्रोटोकॉल के आवेदन तक, एक व्यावसायीकृत आरआईआरटी के उदाहरण के आधार पर पशु रेबीज के क्षेत्र पोस्टमॉर्टम निदान के लिए एक पूर्ण प्रोटोकॉल प्रस्तुत करते हैं। इस प्रोटोकॉल को पश्चिम और मध्य अफ्रीका में क्षेत्र की स्थितियों के तहत कई बार लागू और मान्य किया गया था, जहां आरआईआरटी का उपयोग DFAT परीक्षण के साथ रेबीज निदान के लिए नियमित रूप से किया जाता था । हम इसके अतिरिक्त डिवाइस पर तय वायरल आरएनए के आरटी-पीसीआर का उपयोग करके निष्कर्षण और पता लगाने के लिए, प्रयोगशाला सेटिंग्स में डिवाइस के लिए एक दूसरा आवेदन प्रदर्शित करते हैं।
Protocol
1. फोरमेन मैग्नम (ऑक्सीपिटल मार्ग)25 के माध्यम से नमूना संग्रह
नोट: इस तकनीक को प्रयोगशाला की स्थिति में या क्षेत्र सेटिंग्स में लागू किया जा सकता है। नमूनों को संदिग्ध जानवर की मृत्यु के बाद जितनी जल्दी हो सके संसाधित किया जाना चाहिए या अपघटन से बचने के लिए शांत तापमान (प्रशीतित या जमे हुए, यदि संभव हो तो) पर रखा जाना चाहिए जो परिणामों को प्रभावित कर सकता है। 22014 एंटीजन डिटेक्शन जैसे डीएफएटी और डीआरटी जैसे अन्य संदर्भ तकनीकों के समान, विघटित नमूनों का परीक्षण नहीं किया जाना चाहिए क्योंकि यह परिणाम (झूठे नकारात्मक परिणाम का जोखिम) को प्रभावित कर सकता है।
सावधानी: सभी नमूनों को संभावित संक्रामक माना जाना चाहिए। सुरक्षा नियमों और प्रक्रियाओं का कड़ाई से पालन किया जाना चाहिए, यहां तक कि फील्ड सेटिंग्स4में भी । विशेष रूप से, मास्क, चश्मा, दस्ताने और एक प्रयोगशाला कोट सहित उचित व्यक्तिगत सुरक्षा उपकरण पहनें। सामग्री और नमूना परिशोधन के लिए उपयुक्त कीटाणुनाशक का उपयोग करें (उदाहरण के लिए, अनुशंसित निर्माता कमजोर पड़ने के साथ सोडियम हाइपोक्लोराइट, 70% अल्कोहल - इथेनॉल या आइसोप्रोपैनॉल, 1% साबुन समाधान)। नमूनों की संभाल करने वाले सभी कर्मियों को रेबीज के खिलाफ टीका लगाया जाना चाहिए।
- फोरमेन मैग्नम तक पहुंचने के लिए पहले सर्वाइकल कशेरुका (एटलस कशेरुका) से पहले एक चाकू के साथ पशु सिर निकालें।
नोट: संक्रमित एयरोसोल को कम करने के लिए, मैन्युअल आरी या इसी तरह के उपकरण का उपयोग करने से बचें। - डिस्पोजेबल प्लास्टिक पिपेट(चित्रा 2ए),एक ड्रिंकिंग स्ट्रॉ (चित्रा 2बी),एक क्लैंप(चित्रा 2सी)या एक ड्रॉपर (आरआईडीटी के साथ आपूर्ति)(चित्रा 2Figure 2डी)का उपयोग करके ब्रेनस्टेम (मेडुला ओब्लोंगटा) नमूना एकत्र करें।
नोट: नमूना एकत्र करते समय विशेष ध्यान दिया जाना चाहिए, क्योंकि यह परिणामों की विश्वसनीयता के लिए एक अत्यंत महत्वपूर्ण कदम है। संबद्ध वीडियो के अलावा जो एक सरल तरीके से दिखाता है कि ब्याज के ब्रेनस्टेम का हिस्सा कैसे इकट्ठा किया जाए, सही शारीरिक अनुभाग को इकट्ठा करना सुनिश्चित करने के लिए एक प्रशिक्षण कदम की अत्यधिक सिफारिश की जाती है। - वैकल्पिक रूप से और मस्तिष्क स्टेम (मेडुला ओब्लोंगटा) के अलावा, एक ही ऑक्सीपिटल मार्ग द्वारा ब्रेनस्टेम या मस्तिष्क (सेरिबैलम, हिप्पोकैम्पस, थैलेसीमिया और कॉर्टेक्स) के अन्य हिस्सों को धक्का देकर और प्लास्टिक पिपेट या स्ट्रॉ को आंखों के सॉकेट(चित्रा 3)की ओर घुमाकर इकट्ठा करें।
- यदि एक भूसे या पिपेट का उपयोग कर रहे हैं, तो धीरे-धीरे इसे मस्तिष्क के नमूने (0.5-2 ग्राम) को बाद के विश्लेषण और/या बायोबैंकिंग के लिए एक ट्यूब में जमा करने के लिए निचोड़ें ।
नोट: ग्लाइसरोल में नमूना भंडारण की सिफारिश नहीं की जाती है, क्योंकि यह केशिका प्रवाह या आरआईटी18के एंटीबॉडी बाध्यकारी कदम को प्रभावित करने लगता है।
2. संशोधित आरआईटी प्रोटोकॉल का निष्पादन14
नोट: यह संशोधन पीबीएस में एक कमजोर पड़ने के कदम (1:10) को छोड़ देता है, जैसा कि निर्माता प्रोटोकॉल (सभी संस्करणों) में निर्दिष्ट है, और प्रयोगशाला या फील्ड सेटिंग्स के तहत लागू किया जा सकता है।
- मस्तिष्क सामग्री के आधे मूंगफली या मटर (0.1-0.5 ग्राम) के बराबर इकट्ठा करने के लिए झाड़ू/ड्रॉपर का उपयोग करें और इसे बफर नमूना ट्यूब में रखें।
नोट: संशोधित प्रोटोकॉल के लिए, सभी अभिकर्ण/उपभोग्य सामग्री किट में शामिल हैं (कोई पीबीएस या अतिरिक्त ट्यूब की आवश्यकता नहीं है)(चित्रा 4)। किट के बैच नंबर को दस्तावेज करें और समाप्ति तिथि की वैधता की जांच करें। - ध्यान से एक सजातीय निलंबन प्राप्त होने तक लगभग 30 एस के लिए झाड़ू या ड्रॉपर के साथ ट्यूब में सीधे मस्तिष्क सामग्री को कुचल दें।
नोट: बफर प्रतिक्रिया निर्माता के प्रोटोकॉल24की स्थितियों में वायरस की संक्रामकता को निष्क्रिय करती है । - ड्रॉपर का उपयोग करके, परीक्षण डिवाइस पर नमूना प्रवेश में निलंबन की चार बूंदें (लगभग 100 माइक्रोन) जमा करें।
- परीक्षण डिवाइस पढ़ने से पहले पूर्ण नमूना माइग्रेशन (1-5 मिनट) की प्रतीक्षा करें। नमूना (1-5 मिनट) जमा करने के बाद माइग्रेशन तेजी से शुरू होना चाहिए।
- देरी के मामले में (उच्च चिपचिपाहट निलंबन के कारण) या माइग्रेशन की शुरुआत में तेजी लाने के लिए, धीरे-धीरे डिवाइस की जमा साइट के नीचे ड्रॉपर (1-5 बार) के साथ खरोंच करें और अंततः 1-2 और बूंदें जोड़ें। इसके तुरंत बाद माइग्रेशन शुरू होना चाहिए।
- माइग्रेशन खत्म होने के बाद 5-10 मिनट के बाद डिटेक्शन विंडो में परीक्षा परिणाम पढ़ें, और 20 मिनट से अधिक नहीं ।
- चित्रा 5के अनुसार, डिटेक्शन विंडो में नियंत्रण रेखा (सी-लाइन) और परीक्षण लाइन (टी-लाइन) (बैंगनी लाइनों) की उपस्थिति या अनुपस्थिति के आधार पर परिणाम की व्याख्या करें । नमूना सकारात्मक पर विचार करें जब दो लाइनें दिखाई दे रही हैं(चित्रा 5ए),नकारात्मक यदि केवल सी-लाइन मौजूद है(चित्रा 5बी)और अमान्य यदि केवल टी-लाइन मौजूद है या यदि कोई लाइन दिखाई नहीं दे रही है(चित्रा 5सी)।
नोट: अमान्य परिणाम कम से कम एक बार दोहराए जाने चाहिए. यदि परिणाम अमान्य रहते हैं तो अन्य तकनीकों का प्रदर्शन किया जाना चाहिए। आरआईआरटी के साथ प्राप्त नकारात्मक परिणामों को बाद में DFAT, डीआरआईटी और आणविक विधियों (पॉलीमरेज चेन रिएक्शन या पीसीआर) जैसे स्वर्ण मानक संदर्भ विधि का उपयोग करके पुष्टि करने की आवश्यकता होती है। हालांकि इस परीक्षा की संवेदनशीलता अधिक है (प्रतिनिधि परिणाम देखें), यह 100% नहीं है। - स्टोर कमरे के तापमान पर उपकरणों का इस्तेमाल किया, या सर्द/फ्रीज जब संभव हो, बाद में आणविक विश्लेषण के लिए (धारा 4 देखें) । यदि आवश्यक हो तो परीक्षण दोहराने के लिए या बाद में आणविक विश्लेषण के लिए-20 डिग्री सेल्सियस/-80 डिग्री सेल्सियस पर शेष नमूना निलंबन फ्रीज ।
3. आरएनए निष्कर्षण और आरआईआरटी डिवाइस से आरटी-क्यूपीसीआर द्वारा पता लगाना
नोट: यह कदम केवल अनुकूलित वातावरण और आणविक निदान के लिए उपयुक्त उपकरणों के साथ प्रयोगशाला की स्थिति के तहत लागू किया जा सकता है । यह जल्द ही आरआईआरटी परीक्षण के बाद या संग्रहीत आरआईआरटी उपकरणों पर भूतलक्षी प्रभाव से किया जा सकता है, जो कमरे के तापमान (15-30 डिग्री सेल्सियस), रेफ्रिजरेटेड या जमे हुए पर संग्रहीत होता है।
- आरएनए निष्कर्षण
नोट: निष्कर्षण चरण की निगरानी के लिए, एक आंतरिक नियंत्रण का उपयोग करने की सिफारिश की जाती है जो एक अंतर्जात एमआरएनए (जैसे-ऐक्टिन) या एक्सोजेनस नियंत्रण (जैसे ईजीएफपी सिंथेटिक आरएनए) हो सकताहै,जो सीधे निष्कर्षण26, 27के पहले चरणों केदौराननमूने में नुकीला हो सकता है।- ध्यान से डिवाइस खोलें और फिल्टर पेपर निकाल दें।
- नमूने के जमा क्षेत्र को काटें और इसे त्रि-रीएजेंट एलएस के 1 एमएल युक्त ट्यूब में रखें। कोमल नियमित मैनुअल आंदोलन के साथ 1 घंटे के लिए आरटी में इनक्यूबेट।
- निर्माता सिफारिशों के अनुसार निष्कर्षण करें, जैसा कि पहले27वर्णित है। इस कदम पर, बहिर्जात आंतरिक नियंत्रण जोड़ा जा सकता है।
- इस प्रक्रिया के दौरान, निर्माता की सिफारिशों के अनुसार, आरएनए की वर्षा को सुविधाजनक बनाने के लिए ग्लाइकोजन के 2 माइक्रोल जोड़ें।
- नाभिक मुक्त पानी में आरएनए पुनर्पेंशन के लिए अंतिम मात्रा को समायोजित करें, जिसमें आम तौर पर उपयोग किए जाने वाले 50 माइक्रोन की मात्रा होती है।
नोट: जलीय और कार्बनिक चरण जुदाई के लिए अपकेंद्रित्र चरण के अंत में (त्रिकोणीय-रिएजेंट एलएस में क्लोरोफॉर्म के 200 माइक्रोन के अलावा के बाद), डिवाइस से झिल्ली का टुकड़ा ट्यूब के नीचे होगा और ऊपरी जलीय चरण के संग्रह में हस्तक्षेप नहीं करेगा। वैकल्पिक रूप से, अन्य आसान और तेजी से प्रोटोकॉल का उपयोग किया जा सकता है, उदाहरण के लिए, फिनॉल-आधारित रिएजेंट और सिलिका झिल्ली28का उपयोग करके।
- आरटी-क्यूपीसीआर26 द्वारा डिटेक्शन
नोट: निकाले गए नमूनों में मौजूद संभावित वायरल आरएनए का पता लगाना विभिन्न आणविक तकनीकों का उपयोग करके किया जा सकता है, जैसे रिवर्स-ट्रांसक्रिप्शन पीसीआर, पारंपरिक (एंडपॉइंट) या रियल टाइम पीसीआर (क्यूपीसीआर)। वायरल न्यूक्लियोप्रोटीन या पॉलीमरेज जीन को लक्षित करते हुए पारंपरिक आरटी-पीसीआर27,,29 या आरटी-क्यूपीसीआर26,,30 जैसे कई तरीके उपलब्ध हैं। वायरल पॉलीमरेज के बीच एक संरक्षित क्षेत्र को लक्षित करने वाले दोहरे संयुक्त पैन-lyssavirus RT-qPCR के आधार पर एक उदाहरण नीचे प्रस्तुत किया जाएगा । यह आरटी-क्यूपीसीआर तकनीक दो अलग-अलग आरटी-क्यूपीसीआर को जोड़ती है: एक TaqMan जांच प्रौद्योगिकी (पैन-राब वी आरटी-क्यूपीसीआर) पर आधारित है और दूसरा सिबीआर ग्रीन डिटेक्शन (पैन-लिस्सा आरटी-क्यूपीसीआर) का उपयोग कर रहा है। इसके अलावा, निष्कर्षण प्रक्रिया के दौरान सीधे नुकीला एक बहिर्जात आंतरिक नियंत्रण (eGFP आरएनए) का पता लगाने के लिए एक विशिष्ट TaqMan जांच आधारित आरटी-qPCR (eGFP आरटी-qPCR) द्वारा किया जाता है । वायरल आरएनए का पता लगाने के लिए चयनित आणविक तकनीकों का सावधानीपूर्वक ऑन-साइट सत्यापन महत्वपूर्ण है, विशेष रूप से, यह सत्यापित करने के लिए कि प्राइमर, और वास्तविक समय आरटी-पीसीआर के लिए जांच, ब्याज4के क्षेत्र में घूम रहे उपभेदों का पता लगाने के लिए अनुकूलित हैं।- नाभिक मुक्त पानी में 1:10 के लिए पतला आरएनए नमूना। 96-अच्छी प्रतिक्रिया प्लेट या अन्य प्रारूपों का उपयोग करके, डुप्लिकेट में प्रत्येक आरएनए नमूने का परीक्षण करें। प्रत्येक परख के लिए सकारात्मक और नकारात्मक नियंत्रण का उपयोग करें और कम से कम डुप्लिकेट में परीक्षण करें।
- टेबल 1के अनुसार तीन अलग-अलग आरटी-क्यूपीसीआर काख के लिए मास्टर मिक्स रिएक्शन समाधान तैयार करें, और टेबल 2में दर्शाए गए प्राइमर/प्रोब के साथ।
- पतला आरएनए नमूनों के 5 माइक्रोन और तीन अलग-अलग परख में से प्रत्येक में मास्टर मिश्रण के 15 माइक्रोन जोड़ें। पैन-आरएबीवी आरटी-क्यूपीसीआर परख और ईजीएफपी आरटी-क्यूपीसीआर परख एक ही प्लेट में साइकिल कर सकते हैं ।
- तालिका 3में दर्शाए गए थर्मल साइकिलिंग स्थितियों के बाद विभिन्न परखें चलाएं । यदि केवल एक पीसीआर थर्मल साइकिलर उपलब्ध है, तो पैन-आरएबीवी आरटी-क्यूपीसीआर से शुरू करें और पैन-रबवी आरटी-क्यूपीसीआर के अंत तक 4 डिग्री सेल्सियस पर पैन-lyssa आरटी-क्यूपीसीआर के लिए प्लेट रखें।
- तालिका 4के अनुसार तीन परख के साथ प्राप्त परिणामों का विश्लेषण करें ।
4. आरआईआरटी डिवाइस से आरएनए निष्कर्षण के बाद जेनोटीपिंग
- रिवर्स ट्रांसक्रिप्शन आरटी27,,29
- आरएनए के 6 माइक्रोन के साथ एक मास्टर मिश्रण तैयार करें, पीडी (एन) के 2 माइक्रोन (एन) 6 यादृच्छिक प्राइमर (200 माइक्रोग्राम/माइक्रोन) और 10 माइक्रोन की अंतिम मात्रा के लिए नाभिक मुक्त पानी के 2 माइक्रोन तैयार करें।
- हीट-ब्लॉक में 10 मिनट के लिए 65 डिग्री सेल्सियस पर इनक्यूबेट करें और फिर बर्फ पर स्टोर करें।
- 5x फर्स्ट-स्ट्रैंड बफर के 6 माइक्रोन के साथ एक मास्टर मिक्स तैयार करें, 0.1 एम डिइयोथरेइटॉल (डीटीटी) का 2 माइक्रोन, सुपरस्क्रिप्ट II रिवर्स ट्रांसक्रिप्टेस का 1 माइक्रोन (200 यू), आरएनएनएसिन का 2 माइक्रोन (80 यू), डीएनटीपी मिश्रण (10 माइक्रोन) का 2 माइक्रोन और प्रत्येक नमूने के लिए 20 माइक्रोन की अंतिम मात्रा प्राप्त करने के लिए नाभिक-मुक्त पानी के साथ पूरा करें।
- नमूना (10 माइक्रोल) (30 माइक्रोन की अंतिम मात्रा) में मास्टर मिक्स (20 माइक्रोल) जोड़ें और हीट-ब्लॉक में 90 मिनट के लिए 42 डिग्री सेल्सियस पर इनक्यूबेट करें।
- पीसीआर प्रवर्धन के साथ अगले चरण पर आगे बढ़ें या सीडीएनए को -20 डिग्री सेल्सियस पर स्टोर करें।
- पारंपरिक पीसीआर27,29,31
नोट: पारंपरिक पीसीआर की विभिन्न तकनीकें जीनोटाइपिंग के लिए उपलब्ध हैं। दो प्रस्तुत कर रहे हैं, दोनों हेमी नेस्टेड पीसीआर, न्यूक्लियोप्रोटीन के एक हिस्से या lyssavirus के वायरल प्रोटीन का एक हिस्सा को निशाना बना । प्रोटोकॉल इनमें से प्रत्येक परख के लिए एक ही है, प्राइमर और साइकिल चालन की स्थिति को छोड़कर। सकारात्मक (सकारात्मक आरएनए) और नकारात्मक (नकारात्मक सीडीएनए और/या नाभिक मुक्त पानी) नियंत्रण प्रत्येक श्रृंखला और पीसीआर के प्रत्येक दौर में शामिल किया जाना चाहिए ।- पहले पीसीआर चरण के लिए 0.2 एमएल माइक्रोट्यूब में प्रत्येक नमूने के लिए मास्टर मिक्स रिएक्शन समाधान तैयार करें। इस मिश्रण में 10x NH4 रिएक्शन बफर के 5 माइक्रोल होते हैं, एमजीसीएल 2 समाधान(50 mm), डीएनटीपी मिक्स (10 माइक्रोन) का 1 माइक्रोन, प्रत्येक प्राइमर (10 माइक्रोन) का 1 माइक्रोन, बायोटाक डीएनए पॉलीमरेज का 0.2 माइक्रोन (1 यू) और नाभिक मुक्त पानी का 37.3 एसएल (48 माइक्रोन माइक्रोन की अंतिम मात्रा)। प्राइमर को तालिका 5में दर्शाया गया है।
- तालिका 6के अनुसार, प्रत्येक परख के लिए एक अलग पारंपरिक पीसीआर थर्मल साइकिलर पर हर ट्यूब और साइकिल में सीडीएनए के 2 माइक्रोन जोड़ें ।
- हेमी-नेस्टेड पीसीआर प्रतिक्रिया के लिए उपयुक्त प्राइमर(टेबल 5)का उपयोग करने के साथ पिछले एक के समान एक दूसरा मास्टर मिक्स रिएक्शन समाधान तैयार करें।
- तालिका 6में दर्शाए गए साइकिलिंग मापदंडों का उपयोग करके पारंपरिक पीसीआर थर्मल साइकिल पर पहले दौर के पीसीआर उत्पाद और साइकिल के 2 माइक्रोल जोड़ें।
- एथिडियम ब्रोमाइड (0.01% के आसपास अंतिम एकाग्रता) के साथ 1% एगरेज जेल (ट्राइज़-एसीटेट ईडीएएफ 1x - टीएई 1x) पर लोड करने के बाद विभिन्न पीसीआर उत्पादों (पहले और दूसरे दौर की पीसीआर) की कल्पना करें। और 120 वी पर 30 मिनट के दौरान जेल चलाते हैं। अपेक्षित आकार (तालिका 5) के उज्ज्वल बैंड के रूप में एक सकारात्मक पीसीआर परिणाममनाया जाता है।
- सेंगर अनुक्रमण
- पैन-लिसावस हेमी-नेस्टेड पीसीआर के साथ प्राप्त एम्प्लीकोन्स का सेंगर अनुक्रमण करें और जेनोटिंग विश्लेषण को पूरा करें।
Representative Results
किसी भी नैदानिक विधि के साथ, परिणामों की विश्वसनीयता के लिए नमूना संग्रह सर्वोपरि महत्व का है, खासकर जब क्षेत्र सेटिंग्स में प्रदर्शन किया जाता है। उच्च गुणवत्ता वाले नमूनों के संग्रह की गारंटी देने के लिए संग्रह प्रक्रिया यथासंभव सरल होने की आवश्यकता है। पशु रेबीज के पोस्टमॉर्टम निदान के लिए फोरमेन मैग्नम मार्ग के माध्यम से मस्तिष्क बायोप्सी (मेडुला ओब्लोंडा के साथ ब्रेनस्टेम) का संग्रह इस आवश्यकता को पूरा करता है, जैसा कि चित्रा 2ए-डी25में इंगित किया गया है।
संग्रह के बाद, मस्तिष्क का नमूना आरआईडीटी के संशोधित प्रोटोकॉल में प्रस्तुत किया जाता है, जो चित्र 6में संक्षेप में प्रस्तुत किया जाता है। जैसा कि प्रोटोकॉल अनुभाग में इंगित किया गया है, निर्माता द्वारा प्रदान किए गए प्रोटोकॉल से प्रमुख अनुकूलन पीबीएस में कमजोर पड़ने के कदम की चूक है, जो प्रक्रिया और आवश्यक उपभोग्य सामग्रियों/अभिकर्षकों को सरल बनाता है, इस प्रकार सभी किट(चित्रा 4)में शामिल हैं।
इस संशोधित प्रोटोकॉल को पांच विभिन्न प्रयोगशालाओं में लागू और मूल्यांकन किया गया था, जिसमें रेबीज (लैब 1, फ्रांस), रेबीज के लिए एक एफएओ संदर्भ केंद्र (लैब 5, इटली) और एन्जोटिक अफ्रीकी देशों में स्थित तीन संदर्भ प्रयोगशालाएं, चाड (लैब 2), आइवरी कोस्ट (लैब 3) और माली (लैब 4) शामिल हैं। चाड में, आरआईआरटी का मूल्यांकन प्रयोगशाला और फील्ड सेटिंग्स दोनों में किया गया था।
संदर्भ तकनीक DFAT की तुलना में, आरडीआईटी की संवेदनशीलता और विशिष्टता सभी प्रयोगशालाओं के लिए उच्च थी, जिसमें क्रमशः 96% से 100% और 93.7% से 100%,(तालिका 7)। प्रयोगशाला सत्यापन चरण के दौरान प्रयोगशाला 1 (फ्रांस) के लिए आरडीआईटी की सबसे कम संवेदनशीलता और विशिष्टता प्राप्त की गई थी। परीक्षण नमूनों की संचयी संख्या (एन = 162)(अनुपूरक तालिका 1)के आधार पर, डीएफएटी की तुलना में समग्र संवेदनशीलता और विशिष्टता क्रमशः 98.2% और 95.8%,(तालिका 7)थी। हालांकि, इन प्रारंभिक लेकिन आशाजनक परिणामों को एक सीमित नमूना डेटासेट पर प्राप्त किया गया था और विशेष रूप से एंटज़ोिक क्षेत्रों में परीक्षण किए गए लोगों के लिए बड़ी संख्या में सकारात्मक और नकारात्मक नमूनों पर आगे पुष्टि करने की आवश्यकता है, ताकि वर्तमान विषम डेटासेट के कारण किसी भी संभावित कम करके आंका जा सके या पूर्वाग्रह से बचा जा सके।
आरआईआरटी परीक्षण संक्रमित जानवरों से मस्तिष्क बायोप्सी में lyssavirus का पता लगाने के लिए उपयुक्त है, जहां lyssavirus एंटीजन का स्तर महत्वपूर्ण है। हालांकि, टिटरेटेड वायरस निलंबन(तालिका 8)का परीक्षण करते समय पता लगाने की परीक्षण सीमा अधिक रहती है। चित्रा 7)।
तालिका 9 (लेचेर्न 201614से) ग्लिसावियर के वायरल पॉलीमरेज को लक्षित करते हुए दोहरी संयुक्त पैन-लिसावियर आरटी-क्यूपीसीआर द्वारा आरएनए डिटेक्शन के बाद प्राप्त परिणामों का एक उदाहरण दिखाता है। प्रयोगशाला स्थितियों (लैब 1, एन = 32) या चाड (लैब 2, एन = 19) में किए गए 51 सकारात्मक आरआईआरटी परीक्षणों का एक पैनल और फिर परिवेश के तापमान पर प्रयोगशाला 1 में भेज दिया गया, परीक्षण किया गया। 18 (94.7%), 26 (81.2%) और 44 (86.3%) लैब 1, लैब 2 और दो संयुक्त से नमूने क्रमशः । इसके अलावा, इनमें से 14 नमूनों (लैब 1 से 10 और लैब 2 से 4) के लिए जेनोटीपिंग की गई थी, जिसमें आंशिक न्यूक्लियोप्रोटीन जीन को लक्षित करते हुए हेमी-नेस्टेड पीसीआर का उपयोग किया गया था और उनमें से 13 (93%) (लेचेर्न एट अल से 201614)।
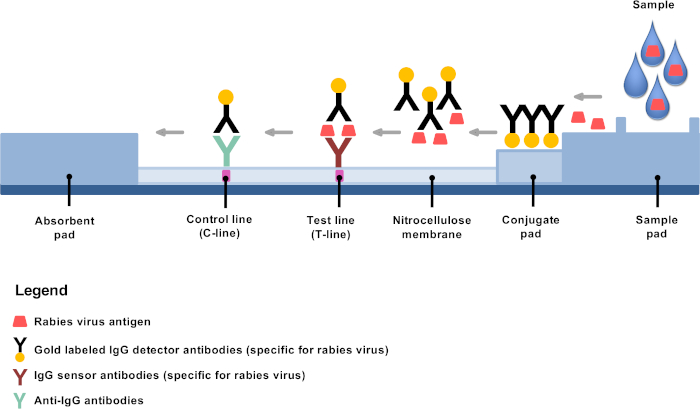
चित्रा 1: रेबीज निदान के लिए एक आरआईआरटी की संरचना का योजनाबद्ध प्रतिनिधित्व। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।

चित्रा 2: क्षेत्र सेटिंग्स (माली) में ऑक्सीपिटल फोरमैन के माध्यम से जानवरों (यहां दिखाए गए कुत्ते) में मस्तिष्क के नमूनों (मेडुला ओब्लोंगाटा के साथ ब्रेनस्टेम) के संग्रह के लिए तेजी से सरल तकनीकों के उदाहरण। (A)आरआईआरटी किट में दिए गए डिस्पोजल ड्रॉपर के साथ प्लास्टिक ड्रिंकिंग स्ट्रॉ(सी)कलेक्शन के साथ एक डिस्पोजेबल प्लास्टिक पिपेट(बी)कलेक्शन के साथ क्लैंप(डी)कलेक्शन के साथ कलेक्शन । कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
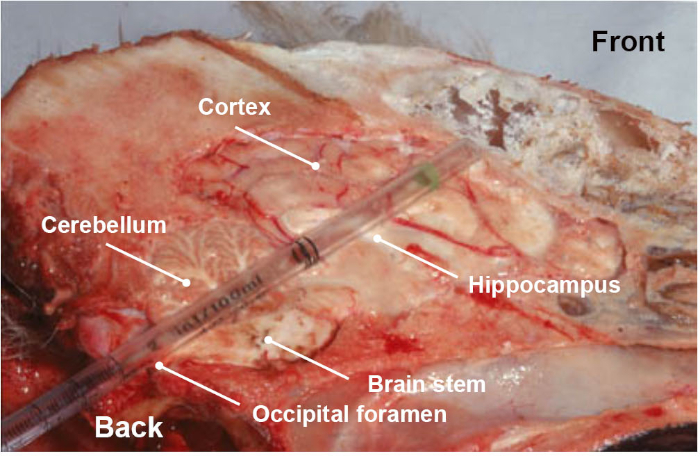
चित्रा 3: कुत्ते के सिर के देशांतर शारीरिक खंड, मस्तिष्क के विभिन्न भागों (ब्रेनस्टेम, सेरिबैलम, हिप्पोकैम्पस, थैलेसीमिया और कॉर्टेक्स) को दिखाते हुए, एक घूर्णन आंदोलन में, ऑक्सीपिटल फोरमेन मार्ग के माध्यम से एक डिस्पोजेबल प्लास्टिक पिपेट एकत्र किया गया। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।

चित्र 4: डिवाइस, एक डिस्पोजेबल प्लास्टिक ड्रॉपर, एक डिस्पोजेबल झाड़ू, और परख मंद सहित RIDT किट की सामग्री का विवरण। जिस ट्यूब से सैंपल एकत्र कर उसे स्टोर किया जाएगा, वहां उपलब्ध नहीं कराई जाएगी। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
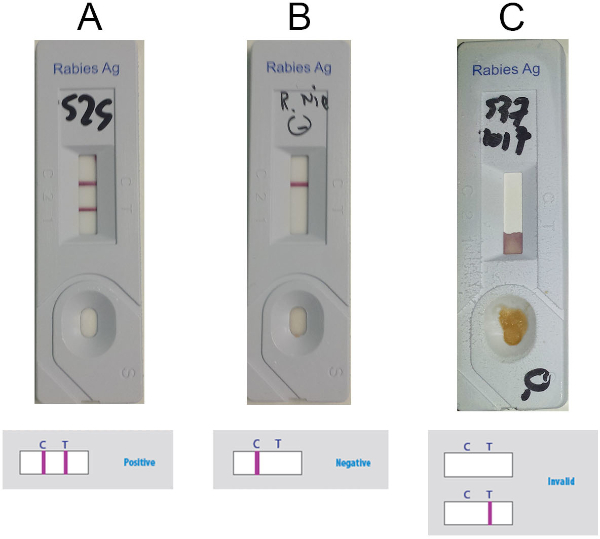
चित्रा 5: एनीमेन आरआईआरटी की व्याख्या के लिए प्रतिनिधि परिणाम। (ए)सकारात्मक परिणाम (दो लाइनों की दृश्य उपस्थिति, सी-लाइन और टी-लाइन)(बी)नकारात्मक परिणाम (केवल सी-लाइन की दिखाई उपस्थिति)(सी)अमान्य परिणाम (दृश्यमान सी-लाइन की अनुपस्थिति) । कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।

चित्र 6: आरआईटी प्रोटोकॉल का योजनाबद्ध प्रतिनिधित्व, निर्माता निर्देशों से अनुकूलित। (A)प्रोटोकॉल का संशोधित संस्करण, निर्माता द्वारा अनुशंसित कमजोर पड़ने वाले कदम को हटाने के साथ(बी)निर्माता द्वारा अनुशंसित प्रारंभिक प्रोटोकॉल, मस्तिष्क के नमूनों के पीबीएस में पूर्व 1:10 कमजोर पड़ने के कदम के साथ। प्रोटोकॉल के संशोधित संस्करण में हटाए गए चरण (चित्र 6एमें प्रस्तुत) को लाल रेखा के साथ इंगित किया गया है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
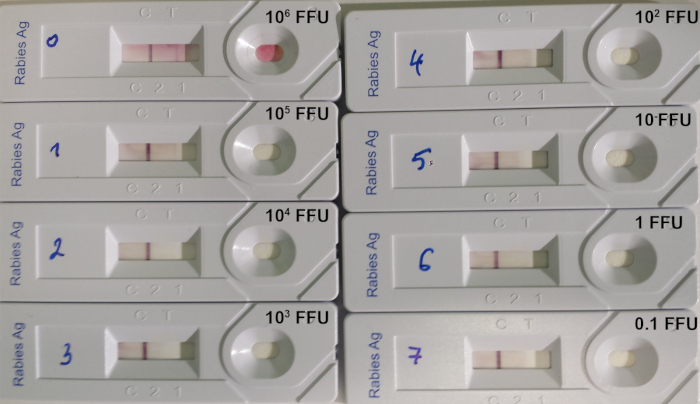
चित्र 7: आरआईआरटी14का पता लगाने की सीमा के निर्धारण का उदाहरण । तनाव 9704ARG के एक टाइटेटेड रेबीज वायरस के एक धारावाहिक 10:1 कमजोर पड़ने का इस्तेमाल किया गया था । प्रत्येक डिवाइस पर जमा वायरस की मात्रा FFU (फ्लोरोसेंट फोकस बनाने वाली इकाइयों) में इंगित की गई है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
| पैन-राबव आरटी-क्यूपीसीआर परख | |
| अभिकर्मक | μL/प्रतिक्रिया |
| 2X रिएक्शन मिक्स (प्रत्येक डीएनटीपी का 0.4 एमएम और 6 एमएम एमजीएसओ 4 वाला बफर) | 10 |
| नाभिक मुक्त पानी | 1.5 |
| Taq3long (आगे) [10 μM] | 1 |
| Taq17revlong (रिवर्स) [10 μM] | 1 |
| RABV4 [10 μM] | 0.3 |
| RABV5 [10 μM] | 0.3 |
| MgSO4 [50-mM] (किट में प्रदान की) | 0.25 |
| रॉक्स रेफरेंस डाई (25 माइक्रोन) (किट में प्रदान किया गया) | 0.05 |
| RNasin (40U/μL) (प्रोमेगा) | 0.2 |
| सुपरस्क्रिप्ट III आरटी/प्लेटिनम Taq मिक्स | 0.4 |
| प्रतिक्रिया के अनुसार कुल | 15 |
| eGFP आरटी-qPCR परख | |
| अभिकर्मक | μL/प्रतिक्रिया |
| 2X रिएक्शन मिक्स (प्रत्येक डीएनटीपी का 0.4 एमएम और 6 एमएम एमजीएसओ 4 वाला बफर) | 10 |
| नाभिक मुक्त पानी | 2.8 |
| EGFP1F (फॉरवर्ड) [10 μM] | 0.5 |
| EGFP2R (रिवर्स) [10 μM] | 0.5 |
| eGFP जांच [10 μM] | 0.3 |
| MgSO4 [50-mM] (किट में प्रदान की) | 0.25 |
| रॉक्स रेफरेंस डाई (25 माइक्रोन) (किट में प्रदान किया गया) | 0.05 |
| RNasin (40U/μL) (प्रोमेगा) | 0.2 |
| सुपरस्क्रिप्ट III आरटी/प्लेटिनम Taq मिक्स | 0.4 |
| प्रतिक्रिया के अनुसार कुल | 15 |
| पैन-lyssa आरटी-qPCR परख | |
| अभिकर्मक | μL/प्रतिक्रिया |
| 2x SYBR ग्रीन रिएक्शन मिक्स | 10 |
| नाभिक मुक्त पानी | 2.1 |
| Taq5long (आगे) [10 μM] | 1 |
| Taq16revlong (रिवर्स) [10 μM] | 1 |
| MgSO4 [50-mM] (किट में प्रदान की) | 0.25 |
| रॉक्स रेफरेंस डाई (25 माइक्रोन) | 0.05 |
| RNasin (40U/μL) (प्रोमेगा) | 0.2 |
| सुपरस्क्रिप्ट III आरटी/प्लेटिनम Taq मिक्स | 0.4 |
| प्रतिक्रिया के अनुसार कुल | 15 |
तालिका 1: तीन अलग-अलग आरटी-क्यूपीसीआर परख (पैन-राबवी आरटी-क्यूपीसीआर, पैन-lyssa आरटी-क्यूपीसीआर और ईजीएफपी आरटी-क्यूपीसीआर) के लिए मास्टर मिक्स रिएक्शन समाधान का विवरण।
| आरटी-क्यूपीसीआर परख | नाम | प्रकार | लंबाई | अनुक्रम (5'-3') | भावना | स्थिति |
| पैन-आरएबीवी आरटी-क्यूपीसीआर परख | Taq3long | प्राइमर | 22 | एटीजी अगा एजीटी जीगा अया एएसी एटीसी एटीसी एटीसी एए | एस | 7273-7294ए |
| Taq17revlong | प्राइमर | 25 | GAT CTG TCT GAA TAA टैग AYC कार जी | के रूप में | 7390-7414ए | |
| राबवे4 | जांच (FAM/TAMRA) | 29 | AAC ACY TGA TCB AGK ACA GAR AAY एसीए टीसी | के रूप में | 7314-7342क | |
| राबवे5 | जांच (FAM/TAMRA) | 32 | एजीआर जीटीजी टीटीटीटीटी टीसी एजीआर एसीडब्ल्यू सीएवाई गैग टीटीटीवाई सीए | एस | 7353-7384क | |
| पैन-lyssa आरटी-qPCR परख | Taq5long | प्राइमर | 23 | TAT झूठ AAA TGG AAC AAY CAY CA | एस | 7272-7294ए |
| Taq16revlong | प्राइमर | 25 | गैट टीटीटी टीजीए एएजी एएसी टीसीए टीजीके जीटी सी | के रूप में | 7366-7390ए | |
| eGFP आरटी-qPCR परख | ईजी एफपी1एफ | प्राइमर | 20 | जीएसी सीएसी टीएसी कैग कैग एएसी एसी | एस | 637-656बी |
| ईजीएफपी2आर | प्राइमर | 19 | GAA सीटीसी कैग कैग GAC कैट जी | के रूप में | 768-750बी | |
| ईजीएफपी | जांच (FAM/TAMRA) | 22 | एजीसी एसीसी कैग टीसीसी जीसीसी सीटीजी एजीसी ए | एस | 703-724बी |
तालिका 2: तीन अलग आरटी-क्यूपीसीआर परख (पैन-राबवी आरटी-क्यूपीसीआर, पैन-lyssa आरटी-क्यूपीसीआर और ईजीएफपी आरटी-क्यूपीसीआर) के लिए प्राइमर/प्रोब का विवरण। क पाश्चर वायरस (पीवी) राबवी जीनोम सीक्वेंस (जेनबैंक परिग्रहण संख्या M13215) के अनुसार । ख क्लोनिंग वेक्टर pEGFP-1 अनुक्रम (GenBank परिग्रहण संख्या U55761) के अनुसार ।
| पैन-आरएबीवी आरटी-क्यूपीसीआर और ईजीएफपी आरटी-क्यूपीसीआर परख | ||||
| चरण | चक्र | Temp | समय | डेटा संग्रह |
| रिवर्स ट्रांसक्रिप्शन | 1 | 45 डिग्री सेल्सियस | 15 मिनट | |
| आर टी निष्क्रियता/प्रारंभिक denaturation | 1 | 95 डिग्री सेल्सियस | 3 मिनट | |
| प्रवर्धन | 40 | 95 डिग्री सेल्सियस | 15 एस | |
| 61 डिग्री सेल्सियस | 1 मिनट | अंतिम बिंदु | ||
| पैन-lyssa आरटी-qPCR परख | ||||
| चरण | चक्र | Temp | समय | डेटा संग्रह |
| रिवर्स ट्रांसक्रिप्शन | 1 | 45 डिग्री सेल्सियस | 15 मिनट | |
| आर टी निष्क्रियता/प्रारंभिक denaturation | 1 | 95 डिग्री सेल्सियस | 3 मिनट | |
| प्रवर्धन | 40 | 95 डिग्री सेल्सियस | 15 एस | |
| 55 डिग्री सेल्सियस | 1 मिनट | अंतिम बिंदु | ||
| वियोजन वक्र | 1 | 95 डिग्री सेल्सियस | 15 एस | 0.1 डिग्री सेल्सियस/ |
| 55 डिग्री सेल्सियस | 1 मिनट | |||
| 95 डिग्री सेल्सियस | 15 एस | |||
| 55 डिग्री सेल्सियस | 15 एस | |||
तालिका 3: तीन अलग-अलग आरटी-क्यूपीसीआर परख (पैन-आरएबीवी आरटी-क्यूपीसीआर, पैन-lyssa आरटी-क्यूपीसीआर और ईजीएफपी आरटी-क्यूपीसीआर) के लिए थर्मल साइकिलिंग स्थितियों का विवरण।
| परख | विश्लेषण | परिणाम | व्याख्या |
| ईजीएफपी आरटी-क्यूपीसीआर | स्वीकृति के अंतराल में सीक्यू | निष्कर्षण मान्य | अन्य परख का विश्लेषण किया जा सकता है |
| स्वीकृति के अंतराल से बाहर Cq | निष्कर्षण मान्य नहीं | नमूने को फिर से जांचें (रन या/और निष्कर्षण दोहराएं), यदि आवश्यक हो तो एक और नमूना अनुरोध करें | |
| पैन-राबव आरटी-क्यूपीसीआर | सीक्यू एंड एलटी;38 | सकारात्मक | वायरल आरएनए का सकारात्मक पता लगाना |
| सीक्यू ‧38 | नकारात्मक | विश्लेषण पैन-lyssa आरटी-qPCR परख | |
| पैन-lyssa आरटी-क्यूपीसीआर | पिघलने वक्र सकारात्मक के रूप में माना जाता है | सकारात्मक | वायरल आरएनए का सकारात्मक पता लगाना |
| पिघलने वक्र नकारात्मक के रूप में माना जाता है | नकारात्मक | वायरल आरएनए का पता न लगाना |
तालिका 4: दोहरी संयुक्त पैन-lyssavirus आरटी-qPCR परख की समग्र व्याख्या।
| हेमी-नेस्टेड पारंपरिक पीसीआर परख | पीसीआर राउंड | नाम | लंबाई | अनुक्रम (5'-3') | भावना | स्थितिएक | एम्प्लिकॉन आकार (बीपी) |
| हेमी-नेस्टेड पीसीआर पॉलीमरेज जीन को निशाना बना रही है | पहला दौर | PVO5m | 20 | एटीजी एसीए जीएसी एएवाई YTG AAC एए ए. | एस | 7170-7189 | 320 |
| पीवो9 | 19 | टीजीए सीसीए टीटीसी कार कार जीटीएन जी | के रूप में | 7471-7489 | |||
| दूसरा दौर | PVO5m | 20 | ATGA CAG ACA AyY TGA एसीए एक | एस | 7170-7189 | 250 | |
| पीवीओ8 | 22 | जीजीटी सीटीजी एटीसी टीआरटी सीडब्ल्यूजी आरे एट एएटी एएटी एएटी ए | के रूप में | 7398-7419 | |||
| हेमी-नेस्टेड पीसीआर न्यूक्लियोप्रोटीन जीन को निशाना बना रही है | पहला दौर | N127 | 20 | ATG TAA सीएसी सीटीसी टीएसी AAT GG | एस | 55-74 | 1532 |
| N8m | 19 | कैग आईसीटी सीएनजी सीसीए आईसीटी सी | के रूप में | 1568-1586 | |||
| दूसरा दौर | N127 | 20 | ATG TAA सीएसी सीटीसी टीएसी AAT GG | एस | 55-74 | 845 | |
| N829 | 19 | जीसीसी सीटीजी जीटीटी सीजीए एसीए टीटीसी टी | के रूप में | 881-899 |
तालिका 5: पारंपरिक हेमी-नेस्टेड पीसीआर के लिए उपयोग किए जाने वाले प्राइमर का विवरण।
| हेमी-नेस्टेड पीसीआर पॉलीमरेज जीन को निशाना बना रही है | ||||
| चरण | चक्र | तापमान | समय | |
| पहला और दूसरा राउंड | प्रारंभिक विकृति | 1 | 94 डिग्री सेल्सियस | 3 मिनट |
| डेनैचेशन | 35 | 94 डिग्री सेल्सियस | 30 एस | |
| हाइब्रिडेशन | 56 डिग्री सेल्सियस | 45 एस | ||
| बढ़ाव | 72 डिग्री सेल्सियस | 40 एस | ||
| अंतिम विस्तार | 1 | 72 डिग्री सेल्सियस | 3 मिनट | |
| हेमी-नेस्टेड पीसीआर न्यूक्लियोप्रोटीन जीन को निशाना बना रही है | ||||
| चरण | चक्र | तापमान | समय | |
| पहला दौर | प्रारंभिक विकृति | 1 | 94 डिग्री सेल्सियस | 3 मिनट |
| डेनैचेशन | 35 | 94 डिग्री सेल्सियस | 30 एस | |
| हाइब्रिडेशन | 56 डिग्री सेल्सियस | 30 एस | ||
| बढ़ाव | 72 डिग्री सेल्सियस | 45 एस | ||
| अंतिम विस्तार | 1 | 72 डिग्री सेल्सियस | 3 मिनट | |
| दूसरा दौर | प्रारंभिक विकृति | 1 | 94 डिग्री सेल्सियस | 3 मिनट |
| डेनैचेशन | 35 | 94 डिग्री सेल्सियस | 30 एस | |
| हाइब्रिडेशन | 58 डिग्री सेल्सियस | 30 एस | ||
| बढ़ाव | 72 डिग्री सेल्सियस | 30 एस | ||
| अंतिम विस्तार | 1 | 72 डिग्री सेल्सियस | 3 मिनट | |
तालिका 6: पारंपरिक हेमी-नेस्टेड पीसीआर के लिए थर्मल साइकिलिंग स्थितियों का विवरण।
| प्रयोगशाला | देश | मूल्यांकन की अवधि | नमूनों का एनबी | DFAT परिणाम | आरआईआरटी परिणाम | संवेदनशीलता | विशिष्टता | ||
| स्थिति | नेग | स्थिति | नेग | ||||||
| लैब 1 | फ़्रांस | 2015 | 82 | 50 | 32 | 50 | 32 | 96% | 93.7% |
| लैब 2 | चाड | 2012-2015 | 44 | 33 | 11 | 33 | 11 | 100% | 100% |
| लैब 3 | आइवरी कोस्ट | 2017 | 10 | 8 | 2 | 8 | 2 | 100% | 100% |
| लैब 4 | माली | 2017 | 18 | 15 | 3 | 15 | 3 | 100% | 100% |
| लैब 6 | इटली | 2016 | 8 | 8 | 0 | 8 | 0 | 100% | - |
| सभी | 2015-2017 | 162 | 114 | 48 | 114 | 48 | 98.2% | 95.8% | |
तालिका 7: कुल 162 नमूनों के विश्लेषण और 5 विभिन्न प्रयोगशालाओं की भागीदारी के आधार पर संदर्भ DFAT विधि की तुलना में आरआईआरटी परीक्षण के आंतरिक मापदंडों (संवेदनशीलता, विशिष्टता) का निर्धारण।
| वायरस तनावएक | मूल मेजबान | स्थान | प्रारंभिक एकाग्रता (FFU/mL)b | डिटेक्शन की सीमा (FFU/mL)c |
| 9147फ्रा | लाल लोमड़ी | फ़्रांस | 3.1 x 107 | 106 |
| Cvs | लैब आइसो अलग | - | 1.6 x 107 | 106 |
| 8743THA | मानव | थाईलैंड | 8.1 x 107 | 8.1 x 106 |
| 9508CZK (एसएडी) | लैब आइसो अलग | - | 5.4 x 108 | 107 |
| Pv | लैब आइसो अलग | - | 4.3 x 107 | 106 |
| 9001फ्रा | कुत्ता | फ्रेंच गयाना | 2.4 x 106 | 2.4 x 105 |
| 9704एआरजी | चमगादड़ | अर्जेंटीना | 9.5 x 107 | 105 |
| 04030 पीएचआई | मानव | फिलीपींस | 2.5 x 107 | 105 |
तालिका 8: 8 अलग-अलग टिटरेटेड रेबीज वायरस निलंबन (लेचेन एट अल से) का14उपयोग करके आरआईआरटी का पता लगाने की सीमा। क सीवीएस: चैलेंज वायरस तनाव, उदास: स्ट्रीट अलबामा डफरिन, पीवी: पाश्चर वायरस। ख प्रति एमएल फ्लोरोसेंट फोकस-फॉर्मिंग इकाइयों (फ्यूयू) की संख्या। ग पट्टी पर जमा फ्लोरोसेंट फोकस-फॉर्मिंग इकाइयों (एफएफयू) की संख्या।
| आरआईआरटी में प्रदर्शन किया | ||||||||||
| लैब 1 | लैब 2 | संयुक्त | ||||||||
| सकारात्मक | नकारात्मक | कुल | सकारात्मक | नकारात्मक | कुल | सकारात्मक | नकारात्मक | कुल | ||
| वायरल आरएनए डिटेक्शन | सकारात्मक | 18 | 1 | 19 | 26 | 0 | 32 | 44 | 7 | 51 |
| नकारात्मक | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 3 | 3 | |
| कुल | 18 | 1 | 19 | 26 | 0 | 35 | 44 | 10 | 54 | |
तालिका 9: प्रयोगशाला की स्थिति (लैब 1) में उपयोग की जाने वाली एनीजन टेस्ट स्ट्रिप पर आरटी-क्यूपीसीआर के साथ वायरल आरएनए का पता लगाना और परिवेश के तापमान (लैब 2) या संयुक्त (लेचेर्न एट अल से) में भेज दियागया।
अनुपूरक तालिका 1: तालिका 7 में प्रस्तुत अपने आंतरिक मापदंडों के निर्धारण के लिए आरआईआरटी परीक्षण के साथ परीक्षण किए गए 162 नमूनों का विवरण। कृपया इस तालिका को देखने के लिए यहां क्लिक करें (डाउनलोड करने के लिए सही क्लिक करें)।
Discussion
आरआईआरटी पोस्टमॉर्टम रेबीज निदान के लिए एक सरल, तेजी से और कम लागत वाली विधि है और प्रयोगशाला परीक्षण के लिए एक आशाजनक क्षेत्र विकल्प है। इस तरह के परीक्षण के आवेदन, विशेष रूप से कम और मध्यम आय वाले देशों के विकेंद्रीकृत क्षेत्रों के लिए, रेबीज वायरस की व्यापकता और एक स्थानीय और संभावित राष्ट्रीय पैमाने पर संचरण की समझ में सुधार होगा । जब तेजी से मस्तिष्क नमूना संग्रह विधि (पूर्ण necropsy के बिना) के साथ संयुक्त, एक बड़ा लाभ यह है कि परीक्षण पूरी तरह से क्षेत्र की स्थापना में किया जा सकता है, प्रयोगशाला सुविधाओं से दूर । फोरमेन मैग्नम के माध्यम से एकत्र किए गए मस्तिष्क के नमूनों का उपयोग परीक्षण के लिए किया जा सकता है, इस प्रकार जानवरों की खोपड़ी को पूरी तरह से खोलने की आवश्यकता नहीं है। यह परीक्षण प्रदर्शन और व्याख्या करने के लिए सरल है और यह विशेष रूप से फील्ड निगरानी गतिविधियों के लिए उपयुक्त है14. DFAT या DRIT पर RIDT के अन्य फायदे कमरे के तापमान पर सकारात्मक और नकारात्मक नियंत्रण और किट भंडारण की कोई आवश्यकता नहीं है। इसके अलावा, संशोधित प्रोटोकॉल, जहां पीबीएस में कमजोर पड़ने के कदम (1:10) को छोड़ दिया जाता है, परीक्षण करने के लिए अतिरिक्त अभिकर्षकों की आवश्यकता नहीं होती है और क्षेत्र की स्थितियों के तहत प्रक्रिया को और सरल बनाता है।
एक महत्वपूर्ण बिंदु मस्तिष्क के नमूनों की गुणवत्ता है। नमूनों को एकत्र किया जाना चाहिए और संदिग्ध जानवर की मृत्यु के बाद जितनी जल्दी हो सके परीक्षण किया जाना चाहिए, या परीक्षण से पहले शांत तापमान पर रखा जाना चाहिए, ताकि गिरावट से बचा जा सके। विघटित नमूनों का परीक्षण नहीं किया जाना चाहिए क्योंकि यह परिणाम (झूठे नकारात्मक परिणाम का जोखिम) को प्रभावित कर सकता है। हालांकि मस्तिष्क के नमूनों के लिए समय के साथ आरआईआरटी की संवेदनशीलता के नुकसान के बारे में अभी तक कोई डेटा उपलब्ध नहीं है, हम परिकल्पना करते हैं कि यह DFAT परीक्षण32की तुलना में समान है। हालांकि, जानवर की मौत और परीक्षण करने के बीच समय को कम किया जा सकता है, क्योंकि परीक्षण जल्दी और सीधे क्षेत्र में किया जा सकता है। इस प्रकार, सामान्य रूप से विघटित नमूनों का खतरा कम होता है।
प्रोटोकॉल के भीतर एक और महत्वपूर्ण कदम नमूना निलंबन माइग्रेशन है। नमूना (1-5 मिनट) जमा करने के बाद सीधे माइग्रेशन शुरू होना चाहिए। इसलिए निलंबन की उच्च चिपचिपाहट माइग्रेशन को नकारात्मक रूप से प्रभावित कर सकती है। धीरे-धीरे ड्रॉपर के साथ डिवाइस जमा साइट के नीचे खरोंच और 1-2 अधिक बूंदों को जोड़ने से अक्सर इस समस्या को हल होता है, और माइग्रेशन तुरंत बाद शुरू होता है।
अफ्रीकी प्रयोगशालाओं (चाड, आइवरी कोस्ट और माली) में किए गए अधिकांश आरआईआरटी परीक्षण परिवेश के तापमान पर किए गए थे जो 30 डिग्री सेल्सियस से अधिक हो सकते हैं, जबकि निर्माता द्वारा अनुशंसित भंडारण और उपयोग के लिए तापमान की सीमा 15 डिग्री सेल्सियस - 30 डिग्री सेल्सियस है। हालांकि हमने आरआईआरटी परीक्षण प्रदर्शन पर उच्च तापमान के किसी भी प्रभाव की पहचान नहीं की, लेकिन इसका मूल्यांकन अधिक सावधानी से करना आवश्यक है। इसी तरह, वायरल आरएनए डिटेक्शन और जेनोटीपिंग के लिए उपयोग के बाद डिवाइस के भंडारण और परिवहन के दौरान उच्च तापमान के प्रभाव को अतिरिक्त मूल्यांकन की आवश्यकता है। आरआईआरटी पट्टी से आरटी-क्यूपीसीआर द्वारा वायरल आरएनए डिटेक्शन की संवेदनशीलता शुरू में परीक्षण में उपयोग किए जाने वाले मस्तिष्क के नमूने की गुणवत्ता से प्रभावित हो सकती है, लेकिन उपयोग के बाद आरआईआरटी परीक्षणों के भंडारण की स्थिति से भी प्रभावित हो सकती है। उदाहरण के लिए, आरएनए डिटेक्शन की संवेदनशीलता अधिक थी जब उपयोग किए गए आरआईआरटी परीक्षणों को नियंत्रित प्रयोगशाला स्थितियों (94.7%) अंडर फील्ड कंडीशन (जैसे, चाड) (81.2%)14की तुलना में । ये स्थितियां पट्टी पर तय आरएनए की अखंडता (विशेष रूप से लंबाई) को भी प्रभावित कर सकती हैं, संभवतः लंबे पीसीआर एम्प्लिकोन्स (जैसे, और जीटी; 500 न्यूक्लियोटाइड)14के आधार पर जीनोटाइपिंग के लिए मध्यम संवेदनशीलता को समझाती हैं। परीक्षण पट्टी पर किए गए आरटी-क्यूपीसीआर की संवेदनशीलता एफटीए Whatman कार्ड (80.6%)14का उपयोग करके प्राप्त की तुलना में कम थी। अन्य आणविक तकनीकों के समान, वायरल लोड आरडीआईटी स्ट्रिप्स के आधार पर जीनोटाइपिंग की सफलता को भी प्रभावित कर सकता है, जिसमें कम वायरल लोड14वाले नमूनों के लिए संभावित नकारात्मक परिणाम हैं।
परीक्षण वर्तमान में नियमित निदान और रोग निगरानी के लिए डब्ल्यूएचओ और OIE द्वारा सिफारिश नहीं है, और एक परिणाम अपने दम पर इस्तेमाल के लिए पीईपी निर्णय लेने का मार्गदर्शन नहीं किया जा सकता है । आगे परीक्षण सत्यापन अभी भी जरूरत है । हालांकि, सटीक त्वरित रेबीज निदान अच्छी तरह से काम कर रहे सतत रेबीज निगरानी प्रणालियों का एक महत्वपूर्ण तत्व है और राजनीतिक प्रतिबद्धता को बढ़ाने के लिए महत्वपूर्ण है, जो सफल टिकाऊ रेबीज नियंत्रण33के लिए बेहद महत्वपूर्ण है। आरआईटी परीक्षण इस संदर्भ में नए रेबीज नैदानिक अवसर प्रदान करते हैं और कम या मध्यम आय वाले एन्जोटिक क्षेत्रों में क्षेत्र में पशु रेबीज निगरानी का विस्तार करने के लिए एक उपयोगी उपकरण हैं ।
Acknowledgements
इस काम को ग्लोबल एलायंस फॉर टीकों और प्रतिरक्षण (जीएवीआई), वोल्फर्मन नेगेली फाउंडेशन, स्विस अफ्रीकन रिसर्च कोऑपरेशन (सरेको), एसडब्ल्यूएफ स्टिफतुंग फ्यूर विस्सेन्स्टलिचे फोर्स्चुंग, फ्रीविलिग अकादमचे गेसेल्चफ्ट (एफएजी) बेसल, एशिया के साथ स्विट्जरलैंड के द्विपक्षीय विज्ञान और प्रौद्योगिकी सहयोग कार्यक्रम और बायोवार्टिस फाउंडेशन के साथ समर्थन दिया गया था।
हम विशेष रूप से कुत्ते के मालिकों, पशु चिकित्सा कर्मियों और प्रयोगशाला कर्मचारियों को उनकी महान प्रतिबद्धता के लिए धन्यवाद देते हैं । हम भाषा संपादन के लिए लिसा Crump को भी स्वीकार करना चाहते हैं।
Materials
| Name | Company | Catalog Number | Comments |
| Anti-Rabies Nucleocapsid Conjugate (lyophilizied, adsorbed) | Bio-Rad, France | 3572112 | Fluorescein-5-isothiocyanate (FITC) conjugated polyclonal antibody against the nucleocapsid of rabies virus. Use for the DFAT reference tecnnique. |
| Applied Biosystems 7500 Real-Time PCR System | Applied Biosystems, France | 4351104 | Amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| Disposable plastic pipette, drinking straw, clamp, dropper | - | - | Equipment used for the collection of the brain stem (medulla oblongata) via the foramen magnus (occipital route). |
| Evans Blue Solution 1% | Bio-Rad, France | 3574911 | Counter-coloration used for the DFAT to facilite the reading under UV microscope. |
| Primer eGFPF1 | Eurofins Genomics, Germany | - | Forward primer for the amplification of the internal control eGFP by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-GACCACTACCAGCAGAACAC-3'. |
| Primer eGFPR2 | Eurofins Genomics, Germany | - | Reverse primer for the amplification of the internal control eGFP by RT-qPCR after extraction from the RIDT device, sequence: 5'-GAACTCCAGCAGGACCATG-3'. |
| Primer Taq17 revlong | Eurofins Genomics, Germany | - | Reverse primer for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-ATGAGAAGTGG AAYAAYCATCA-3'. |
| Primer Taq3 long | Eurofins Genomics, Germany | - | Forward primer for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-GATCTGTCTGAA TAATAGAYCCARG-3'. |
| Probe eGFP FAM/TAMRA | Eurofins Genomics, Germany | - | Forward primer for the amplification of the internal control by RT-qPCR after extraction from the RIDT device, sequence: 5'-AGCACCCAGT CCGCCCTGAGCA-3'. |
| Probe RABV4 FAM/TAMRA | Eurofins Genomics, Germany | - | Probe for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-AACACYTGATCBA GKACAGARAAYACATC-3'. |
| Probe RABV5 FAM/TAMRA | Eurofins Genomics, Germany | - | Probe for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-AGRGTGTTTTCYAG RACWCAYGAGTTTTTYCA-3'. |
| Rapid Rabies Ag Test Kit | BioNote Inc., Republic of Korea | RG18-01DD | Rapid immunochromatographic diagnostic test (RIDT, also named lateral flow device or LFD) for the post-mortem diagnosis of rabies. |
| Recombinant RNasin Ribonuclease Inhibitor | Promega, USA | N2515 | Enzyme used with the kit for the amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| SuperScript III Platinum One-Step qRT-PCR Kit | Invitrogen, France | 11732-020 | Kit for the amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| TRIzol Reagent | Invitrogen, France | 15596026 | Phenol/chloroforme based total RNA extraction using the cellulose membrane of the RIDT. |
References
- Hampson, K., et al. Correction: Estimating the Global Burden of Endemic Canine Rabies. PLoS Neglected Tropical Diseases. 9 (5), e0003786 (2015).
- Rupprecht, C., Kuzmin, I., Meslin, F. Lyssaviruses and rabies: current conundrums, concerns, contradictions and controversies. F1000Research. 6, 184 (2017).
- Walker, P. J., et al. ICTV Virus Taxonomy Profile: Rhabdoviridae. The Journal of General Virology. 99 (4), 447-448 (2018).
- World Health Organization (WHO). WHO Expert Consultation on Rabies, third report. HO Technical Report Series, No. 1012. , (2018).
- Dacheux, L., et al. More Accurate Insight into the Incidence of Human Rabies in Developing Countries through Validated Laboratory Techniques. PLoS Neglected Tropical Diseases. 4 (11), e765 (2010).
- Welburn, S. C., Beange, I., Ducrotoy, M. J., Okello, A. L. The Neglected Zoonoses - The Case for Integrated Control and Advocacy. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. , (2015).
- Dacheux, L., Bourhy, H. Diagnostic tests for human rabies. Revue Scientifique Et Technique (International Office of Epizootics). 37 (2), 581-593 (2018).
- Kasempimolporn, S., Saengseesom, W., Lumlertdacha, B., Sitprija, V. Detection of rabies virus antigen in dog saliva using a latex agglutination test. Journal of Clinical Microbiology. 38 (8), 3098-3099 (2000).
- Kang, B., et al. Evaluation of a rapid immunodiagnostic test kit for rabies virus. Journal of Virological Methods. 145 (1), 30-36 (2007).
- Nishizono, A., et al. A simple and rapid immunochromatographic test kit for rabies diagnosis. Microbiology and Immunology. 52 (4), 243-249 (2008).
- Kasempimolporn, S., Saengseesom, W., Huadsakul, S., Boonchang, S., Sitprija, V. Evaluation of a rapid immunochromatographic test strip for detection of Rabies virus in dog saliva samples. Journal of Veterinary Diagnostic Investigation: Official Publication of the American Association of Veterinary Laboratory Diagnosticians, Inc. 23 (6), 1197-1201 (2011).
- Ahmed, K., et al. Evaluation of a monoclonal antibody-based rapid immunochromatographic test for direct detection of rabies virus in the brain of humans and animals. The American Journal of Tropical Medicine and Hygiene. 86 (4), 736-740 (2012).
- Léchenne, M., et al. Validation of a Rapid Rabies Diagnostic Tool for Field Surveillance in Developing Countries. PLoS Neglected Tropical Diseases. 10 (10), e0005010 (2016).
- Yang, D. K., et al. Comparison of four diagnostic methods for detecting rabies viruses circulating in Korea. Journal of Veterinary Science. 13 (1), 43-48 (2012).
- Markotter, W., et al. Evaluation of a rapid immunodiagnostic test kit for detection of African lyssaviruses from brain material. The Onderstepoort Journal of Veterinary Research. 76 (2), 257-262 (2009).
- Reta, T., et al. Evaluation of Rapid Immunodiagnostic Test for Rabies Diagnosis Using Clinical Brain Samples in Ethiopia. Journal of Veterinary Science & Medical Diagnosis. 2 (3), 1-3 (2013).
- Servat, A., Picard-Meyer, E., Robardet, E., Muzniece, Z., Must, K., Cliquet, F. Evaluation of a Rapid Immunochromatographic Diagnostic Test for the detection of rabies from brain material of European mammals. Biologicals: Journal of the International Association of Biological Standardization. 40 (1), 61-66 (2012).
- Certoma, A., et al. Assessment of a Rabies Virus Rapid Diagnostic Test for the Detection of Australian Bat Lyssavirus. Tropical Medicine and Infectious Disease. 3 (4), (2018).
- Ahmad, A., Singh, C. K. Comparison of rapid immunodiagnosis assay kit with molecular and immunopathological approaches for diagnosis of rabies in cattle. Veterinary World. 9 (1), 107-112 (2016).
- Sharma, P., Singh, C. K., Narang, D. Comparison of immunochromatographic diagnostic test with Hheminested Reverse transcriptase polymerase chain reaction for detection of rabies virus from brain samples of various species. Veterinary World. 8 (2), 135-138 (2015).
- Voehl, K. M., Saturday, G. A. Evaluation of a rapid immunodiagnostic rabies field surveillance test on samples collected from military operations in Africa, Europe, and the Middle East. U.S. Army Medical Department Journal. , 27-32 (2014).
- Servat, A., Robardet, E., Cliquet, F. An inter-laboratory comparison to evaluate the technical performance of rabies diagnosis lateral flow assays. Journal of Virological Methods. 272, 113702 (2019).
- Eggerbauer, E., et al. Evaluation of Six Commercially Available Rapid Immunochromatographic Tests for the Diagnosis of Rabies in Brain Material. PLoS Neglected Tropical Diseases. 10 (6), e0004776 (2016).
- Barrat, J., Meslin, F. X., Kaplan, M. M., Koprowski, H. Simple technique for the collection and shipment of brain specimens for rabies diagnosis. Laboratory techniques in rabies. , 425-432 (1996).
- Dacheux, L., et al. Dual Combined Real-Time Reverse Transcription Polymerase Chain Reaction Assay for the Diagnosis of Lyssavirus Infection. PLoS Neglected Tropical Diseases. 10 (7), e0004812 (2016).
- Dacheux, L., et al. A reliable diagnosis of human rabies based on analysis of skin biopsy specimens. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 47 (11), 1410-1417 (2008).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Application of next generation sequencing to rabies virus and other lyssaviruses. Laboratory techniques in rabies. 2, 49-61 (2019).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Conventional pan-lyssavirus reverse transcriptase polymerase chain reaction. Laboratory techniques in rabies. 2, 1-16 (2019).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Rabies real-time reverse transcriptase polymerase chain reaction. Laboratory techniques in rabies. 2, 17-34 (2019).
- Talbi, C., et al. Evolutionary history and dynamics of dog rabies virus in western and central Africa. The Journal of General Virology. 90 (Pt 4), 783-791 (2009).
- McElhinney, L. M., Marston, D. A., Brookes, S. M., Fooks, A. R. Effects of carcase decomposition on rabies virus infectivity and detection. Journal of Virological Methods. 207, 110-113 (2014).
- Vigilato, M. A. N., et al. Progress towards eliminating canine rabies: policies and perspectives from Latin America and the Caribbean. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 368 (1623), 20120143 (2013).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved