フィールド死後狂犬病は、さらなる分子用途を用いた資源限定設定のための迅速な免疫クロマトグラフィー診断試験
In This Article
Summary
脳生検サンプリングから最終解釈まで、迅速な免疫クロマトグラフィー診断検査(RIDT)を用いて、現場条件下での動物狂犬病の死後診断のための完全なプロトコルを提示する。また、分子解析やウイルス遺伝子作成用の装置を用いたさらなる応用についても説明する。
Abstract
機能的狂犬病監視システムは、信頼性の高いデータを提供し、疾病管理に必要な政治的コミットメントを高めるために重要です。現在までに、狂犬病陽性と疑われる動物は、古典的または分子的な実験室の方法を使用して死後の確認に提出されなければならない。しかし、ほとんどの流行地域は、動物狂犬病の診断が中央獣医研究所に制限されている低所得国と中所得国にあります。監視インフラストラクチャの可用性が低いと、遠隔地からの深刻な病気の過少報告につながります。近年、低い技術的専門知識を必要とする複数の診断プロトコルが開発され、分散型の実験室で狂犬病診断を確立する機会が得られた。ここでは、脳生検サンプリングから最終解釈まで、迅速な免疫クロマトグラフィー診断検査(RIDT)を用いた動物狂犬病のフィールド死後診断のための完全なプロトコルを提示する。我々は、分子解析およびウイルス遺伝子生成のための装置のさらなる使用を記述することによって、プロトコルを完了する。RIDTは、脳サンプル中の狂犬病ウイルスやその他のリサウイルスを容易に検出します。このようなテストの原理は簡単です:脳材料は、金共役抗体が狂犬病抗原に特異的に結合するテストストリップに適用されます。抗原抗体複合体は、試験ライン上の固定抗体にさらに結合し、明らかに見える紫色の線をもたらす。ウイルスはテストストリップで不活性化されるが、ウイルスRNAはその後抽出することができる。これにより、感染性脳サンプルではなくテストストリップを安全かつ簡単に確認と分子タイピングのために装備された実験室に送ることができます。メーカーのプロトコルの変更に基づいて、我々は、テスト感度が増加し、ゴールドスタンダード基準法、直接免疫蛍光抗体試験と比較して98%に達することを発見しました。テストの利点は数多くあります:迅速で使いやすい、低コストで、顕微鏡やコールドチェーンのコンプライアンスなどの実験室のインフラストラクチャの要件はありません。RIDT は、参照診断メソッドが使用できない領域に対して便利な代替手段となります。
Introduction
犬の狂犬病は、人間の狂犬病の主な原因であり、年間約59,000人の人間の死亡を世界的に担当し、アジアおよびアフリカの低所得国および中所得国(MIC)でほぼすべての人が発生しています1.主な病因は、神経刺激性犬関連の古典的狂犬病ウイルス(RABV、家族ラブドウイルス、リッサウイルス属、種狂犬病リサウイルス)である。しかし、他の狂犬病関連のリサウイルスは、主にコウモリ種で循環し、また疾患22、33を引き起こす。影響を受ける地域では、信頼性の高,いデータ4、5、65が不足している可能性が高いため、4疾病監視と管理が低レベルの政治的コミットメントによって妨げられることが多い。病気の過少報告の理由の1つは、設備の整った実験室や訓練を受けたスタッフへのアクセスが制限され、検体の出荷が困難なため、実験室での診断がないことです。臨床検査診断は狂犬病の症例を確認するために必要であり、さらに、関連株の遺伝的特徴を可能にし、地域レベル44、5、75,7でウイルス感染に関する洞察を提供する。
世界保健機関(WHO)と世界動物衛生機構(OIE)の両方によって承認された死後狂犬病診断のための現在の金基準は、直接蛍光抗体検査(DFAT)、直接迅速な免疫組織化学検査(DRIT)および分子法(例えば、逆転写ポリメラーゼ連鎖反応(RT-PCR))4、8である。4,8しかし、LICの適切な適用は、電源の不整合、冷却されていないサンプル輸送、品質マネジメントシステムの欠如を伴う実験室設備が不十分であるため、依然として限られています。動物狂犬病の診断は通常、LmICの中央獣医研究所でのみ行われるため、既存の監視データは主に都市部の狂犬病状況を反映しています。
最近開発された低技術診断の代替は、遠隔地や分散した狂犬病研究所44、8、98で狂犬病の診断を確立する機会を9提供しています。急速な免疫クロマトグラフィー診断試験(RIDT)は、金共役検出器抗体を用いたイムノクロマトグラフィーに基づく横流れ試験であり、非常に有望な狂犬病診断ツール10、11、12、1311,12,13である。10原則は簡単です:希釈後、脳材料は提供されたバッファーに混合され、数滴がテストストリップに適用され、金結合モノクローナル抗体は狂犬病抗原、主にヌクレオタンパク質に特異的に結合する(図1)。抗原抗体複合体は、次いで横流移動を受け、試験ライン(T線)で狂犬病抗原に対する固定抗体に結合し、明らかに見える紫色の線を生じる。狂犬病抗原に結合していない残りの金共役抗体は、さらなる標的抗体を介して膜に移行し、固定し続け、明らかに見える紫色の対照ライン(C線)をもたらす。
ワンステップ、低コストの方法は、迅速で、非常に簡単であり、高価な機器や特殊な保管条件を必要としません。希釈工程を排除するメーカープロトコルの変更により、試験を行うために必要なほぼすべての装置および試薬がキット14に含まれる。結果は顕微鏡なしで5-10分後に読み取られる。これは、冷蔵輸送およびサンプル貯蔵と共に蛍光顕微鏡と免疫蛍光コンジュゲートを必要とするDFAT試験に対する大きな利点です。軽顕微鏡を用いて行えるDRIT試験でも、抗狂犬病抗体を保存するために連続的なコールドチェーンが必要であり、これはまだ市販されていない。DRITと比較して、RIDTは有毒な化学物質を必要としません, 廃棄物処理が十分に規制されていない国で特に利点.迅速なテストは、ゴールドスタンダードテストDFATおよびDRITと比較して、はるかに簡単な解釈で時間のかかる。これにより、限られた技術的専門知識を持つ担当者によるオンサイトテストが可能になります。
これらの検査特性に基づいて、遠隔地での疑いのある動物の迅速な診断が可能となり、できるだけ早く暴露後予防(PEP)の実施を容易にする。また、狂犬病サンプルの距離輸送は必要なくなくなり、試験時のサンプル品質が向上します。ただし、RIDT テストで得られた結果は、DFAT や DRIT などの参照診断テストを使用して現在確認する必要があります。
RABVおよび他のリサウイルスの検出のためのRIDT技術が評価されている。最初の研究の一つは、2007年に韓国の研究者によって行われました10.DFAT法と比較して、51の動物サンプルおよび4つのRABV分離株において、RIDTはそれぞれ91.7%および100%の感度および特異性を示した。これらの結果は、後に韓国からの110の動物の脳試料で確認されたが、感度と特異性を有し、DFATと比較して、それぞれ95%および98.9%、それぞれ15である。最近では、他の研究は、異なる地理的起源を持つ様々な動物からのウイルス分離物および/または感染した脳サンプルを使用して、このRIDTの性能を評価した。アフリカRABVおよび他のアフリカのリサウイルス(デュベンゲージウイルス(DUVV)、ラゴスコウモリウイルス(LBV)およびモコラウイルス(MOKV)を含む21サンプルのパネルが正常に検出され、DFAT16と比較して感度は100%であった。同様の高感度 (96.5%)特異性(100%)値は、エチオピア17から 115 の脳サンプルのパネルから得た。別の研究は、ヨーロッパのRABV分離株、他の2つのヨーロッパのリサウイルス(ヨーロッパのコウモリリサウイルス1型(EBLV-1)および2型(EBLV-2))、およびオーストラリアのコウモリリサウイルス(ABLV)18を評価した。172の動物の脳サンプルの分析に基づいて、RIDTキットはDFATと比較して88.3%の感受性と100%の特異性を有し、3つの狂犬病関連のリサウイルスが正常に検出された。本研究では、グリセロールバッファーに保存された脳試料から偽陰性の結果が生じ、不適切なグリセロール除去が毛細血管流動または抗体結合に影響を及ぼすことが示唆された。オーストラリアのコウモリからの43の臨床サンプルの最近の分析は、DFAT19に完全な一緒に、以前のテスト結果を確認しました。インドでは、限定された数の臨床サンプル(11および34サンプル)に対してRIDTを用いて2つの研究を行った。DFATと比較すると、感度は85.7%から91.7%、特異度は100%20、21,21であった。アフリカ、ヨーロッパ、中東の80の動物脳サンプルを用いたこのキットの別の評価は、特異性(100%)に対してDFATと完全に一緒に得たしかし、より高い感度(96.9%)以前の研究22と比較して.10サンプルのパネルを使用して22の異なる実験室で行われたこのRIDTの最近の実験室間比較では、全体的な一部は99.5%23であった。23
最近の1つの多心研究だけが不十分な全体的なRIDTパフォーマンス24を示した。3 つの異なるデータセットのサンプルをテストし、DFAT と比較して可変感度と特異度の値を提供しました。例えば、実験感染動物からの第1パネル(n=51)および第2のパネル(n=31)と第2のパネル(n=31)で得られた感度と特異性は、すべて実験室Aで試験され、それぞれ16%および43%の感度を与えたが、その特異性は両方に対して100%であった。逆に、実験室Bによって分析された第3のパネル(n=30)の結果は、DFATの結果と完全に一緒に、さらに完全に検査室A(85%感度および100%特異性)によってほぼ完全に確認された。バッチからバッチへの変動は、RIDT24での感度の変動が比較的低い場合の説明として提案されました。
同時に、別の研究は、上記のRIDTの同様の検証プロセスを行い、製造業者が推奨するプロトコル14を変更した。PBSにおける希釈前工程(1:10)は、脳材料の調製中に省略した。このより単純な改変プロトコルに基づいて、著者らは、実験条件下で、73の動物脳サンプルのデータセットを、自然にまたは実験的に様々なRABV株に感染させたDFATと比較して、それぞれ95.3%および93.3%の感度と特異性を得た。この研究は、フィールド設定(チャド、アフリカ)でこのRIDTの最初の評価を提示しました。48の臨床脳サンプルでは、感受性および特異性はそれぞれ94.4%および100%であった。DFAT と RIDT の間の不一致は、DFAT による偽陽性の結果によるもので、RT-PCR による確認後に決定されました。これらの結果が削除されると、完全な一覧が作成され、これらのフィールド条件14の下での RIDT の信頼性が高いことが示されました。変更されたプロトコルを使用してバッチからバッチへの変動は観察されなかった。Eggerbauerらの研究で、DFAT/RIDT発散サンプル(n=8)の少数に変更されたプロトコルが適用された場合、すべて一致する(100%感度)が見つかった。
RIDTのもう一つの大きな利点は、分子技術(RT-PCRなど)およびそれに続くジェノタイピング14、24,24を用いてストリップに固定されたウイルスRNAを検出するための二次的な使用である。抽出ステップの後、Léchenneら14は、51サンプルのパネル(試験され、周囲温度でチャドから出荷された18サンプルを含む)の86.3%の感度を有するRT-PCRを用いてアニゲンデバイス膜に固定されたウイルスRNAを実証した。その後のジェノタイピングは、試験した14サンプルのうち93%で可能であった。少なくとも500ヌクレオチド長のPCRアンプリコンのサンガーシーケンシングが使用された。RABV分離株に加えて、試験は、他の4種のリサウイルス種、DUVV、EBLV-1、EBLV-2およびボケロコウモリリサウイルス(BBLV)を検出し、完全に一致した国際実験間試験14の間に。ウイルスRNA検出の感度はさらに高かった(100%)エッガーバウアーらの研究では、実験室サンプル検査24に基づく。後者の研究はまた、RIDTキットで使用されるバッファが不活性化ウイルスであることを実証した。それによって、装置は分子確認およびジェノタイピングのために、参照実験室への特定の生物安全の注意なしで周囲温度で容易に出荷することができる。
以前の評価に基づいて、RIDT ツールは、特に参照診断手法が使用できない場合に、フィールド設定で使用できる多くの利点を提供します。しかし、この試験はまたいくつかの制限を有し、特に、抗原検出14、24,24の低感度である。このテストは、脳サンプルなどのウイルス抗原を大量に含むサンプルに適用できます。しかし、唾液や他の体液などの他のサンプルには適していません。もう一つの欠点は、DFAT、RT-PCRまたはDRITを実行するコストに比べて安価であるが、LmICのためにまだ高いままであるデバイスのコスト(ヨーロッパでは約5〜10ユーロ)です。しかし、他社からの同様のRIDの将来の開発と検証は、価格の低下につながる可能性があります。ある研究では、バッチ間の変動が報告されています。他の人から報告されていませんが、品質管理環境で使用される試薬については、新しいバッチをテストする際に厳格な品質管理を行う必要があります。異なるバッチ14を使用する場合、変更されたプロトコルの使用は変更されませんでした。1つの研究を除いて、RDITの感受性がDFAT(約90%-95%)と比較して高いことを実証しました。狂犬病は常に致命的であるため、DFAT、DRITまたはRT-PCR14などの参照診断テストを使用してRDITで否定的な結果を確認することを強くお勧めします。
本稿では、市販されたRIDTの例に基づく動物狂犬病のフィールド死後診断のための完全なプロトコルを提示し、脳サンプル採取から、製造業者の勧告(以前に検証された14)とその後の分子分析と比較して修正されたプロトコルの適用までを行う。このプロトコルは、DFAT検査と共に狂犬病の診断のためにRIDTが日常的に使用された西アフリカおよび中央アフリカのフィールド条件下で何度も適用され、検証されました。我々はさらに、デバイス上に固定されたウイルスRNAのRT-PCRを用いた抽出および検出のための、実験室の設定で、デバイスの第2のアプリケーションを実証する。
Protocol
1. 前門マグナム(後頭経路)を介したサンプルコレクション25
注: この手法は、実験室の条件下で、またはフィールド設定で実装できます。サンプルは、疑わしい動物の死後できるだけ早く処理するか、結果に影響を与える可能性のある分解を避けるために、冷たい温度(可能であれば冷蔵または凍結)に保つ必要があります。DFATやDRITなどのリサウイルス抗原検出に基づく他の参照技術と同様に、分解されたサンプルは結果に影響を与える可能性があるため、試験すべきではありません(偽陰性の結果のリスク)。
注意: すべてのサンプルは、感染の可能性があると考える必要があります。安全規則と手順は、フィールド設定4でも、厳密に従う必要があります。特に、マスク、眼鏡、手袋、ラボコートなど、適切な個人用保護具を着用してください。材料およびサンプル除染に適した消毒剤を使用してください(例えば、推奨メーカー希釈剤を有する次亜塩素酸ナトリウム、70%アルコール-エタノールまたはイソプロパノール、1%石鹸溶液)。サンプルを取り扱うすべての担当者は、狂犬病の予防接種を受ける必要があります。
- 最初の頸椎(アトラス椎骨)の前にナイフで動物の頭を取り除き、前部マグナムにアクセスします。
注: 感染性エアロゾルを最小限に抑えるには、手動のこぎりや同様のツールを使用しないでください。 - 使い捨てプラスチックピペット(図2A)、飲むわら(図2B)、クランプ(図2C)またはスポイト(RIDTに付属)を使用して、脳幹(延髄延細)サンプルをC収集する(図2D)。Figure 2
注: 結果の信頼性を最大限に引き出す上で、サンプルを収集する際には、特に注意が必要です。興味のある脳幹の一部を収集する方法を簡単な方法で示す関連ビデオに加えて、トレーニングステップは、正しい解剖学的セクションを収集することを確認するために強くお勧めします。 - 必要に応じて、脳幹(髄質延髄)に加えて、眼窩に向かってプラスチックピペットまたはストローを押して回転させることによって、脳幹または脳(小脳、海馬、視床および皮質)の他の部分を同じ後頭経路で収集する(図3)。
- ストローまたはピペットを使用する場合は、その後の分析および/またはバイオバンキングのために、脳サンプル(0.5-2 g)をチューブに沈着させるために静かに絞ります。
注:グリセロール中のサンプル貯蔵は、毛細管の流れまたはRIDT18の抗体結合ステップに影響を与えるようなので、推奨されません。
2. 変更された RIDT プロトコルの実行14
注: この変更は、メーカープロトコル(すべてのバージョン)で指定されているように、PBSへの希釈ステップ(1:10)を省略し、実験室またはフィールドの設定で実装することができます。
- 綿棒/スポイトを使用して、脳材料の半分のピーナッツまたはエンドウ豆(0.1〜0.5 g)に相当するものを収集し、バッファーサンプルチューブに入れます。
メモ:変更されたプロトコルでは、すべての試薬/消耗品がキットに含まれています(PBSまたは追加のチューブは必要ありません)。Figure 4キットのバッチ番号を文書化し、有効期限の有効性を確認します。 - 均質な懸濁液が得られるまで、綿棒またはスポイトを約30秒チューブで直接脳材料を慎重に粉砕する。
メモ:バッファ反応は、メーカーのプロトコル24の条件でウイルスの感染性を不活性化します。 - スポイトを使用して、試験装置のサンプル入口に懸濁液の4滴(約100μL)を入金します。
- テスト デバイスを読み取る前に、完全なサンプル移行 (1 ~ 5 分) を待ちます。サンプルの沈着後(1-5分)の移行は急速に開始する必要があります。
- 遅延(高粘度懸濁液による)の場合、または移行の開始を加速するために、デバイスの下端をドロッパー(1〜5回)で緩やかに引っ掻き、最終的に1〜2滴を加えます。移行は、その直後に開始する必要があります。
- 5~10分後、移行終了後20分以下の検出ウィンドウでテスト結果を読み取ります。
- 図 5に従って、検出ウィンドウ内の制御ライン (C ライン) とテストライン (T 線) (紫色の線) の有無に基づいて結果を解釈します。2 つの線が見える場合 (図 5A)、C線のみが存在する場合は負の値 ( 図5B) 、 T 行のみが存在する場合、または行が表示されない場合は無効である場合は、サンプルの正の値を考慮してください (図 5C)。
注: 無効な結果は、少なくとも 1 回繰り返す必要があります。結果が無効な場合は、他の手法を実行する必要があります。RIDTで得られた否定的な結果は、DFAT、DRITおよび分子法(ポリメラーゼ連鎖反応またはPCR)のような金標準基準法を使用して、後で確認される必要がある。このテストの感度が高いにもかかわらず(代表結果を参照)、100%ではありません。 - 使用済みデバイスを室温で保存するか、可能な場合は冷蔵/凍結して、その後の分子解析を行います(セクション4を参照)。残りのサンプル懸濁液を-20°C/-80°Cのバッファチューブで凍結し、必要に応じて、あるいはその後の分子分析のためにテストを繰り返します。
3. RIDTデバイスからのRT-qPCRによるRNA抽出と検出
注:このステップは、適応された環境と分子診断のための適切な機器を備えた実験室条件下でのみ実施することができます。これは、RIDTテスト後すぐに行うか、アーカイブされたRIDTデバイス上で遡及的に行うことができます, 室温(15-30 °C)で保存され、冷蔵または凍結.
- RNA抽出
注: 抽出ステップを監視するには、抽出26,,27の最初のステップで直接サンプルにスパイクされる内因性 mRNA (ß-actin など) または外因性制御 (eGFP RNA など) を使用することが推奨されます。- デバイスを慎重に開き、フィルターペーパーを取り外します。
- 試料の堆積領域をカットし、トリ試薬LSの1 mLを含むチューブに入れる。穏やかな規則的な手動の動揺と1時間RTでインキュベート。
- 前に説明した27のように、製造業者の推奨事項に従って抽出を実行します。このステップでは、外因性内部制御を追加できます。
- 製造者の推奨に従って、2 μL のグリコーゲンを添加して、RNA の沈殿を促進します。
- ヌクレアーゼを含まない水中のRNA再懸濁液の最終容積を調整し、通常使用される50 μLの体積を使用します。
注:水相および有機相分離のための遠心分離ステップの終わりに(トリ試薬LSに200 μLのクロロホルムを添加した後)、デバイスからの膜片はチューブの底にあり、上部水相の収集を妨げない。あるいは、他の容易かつ迅速なプロトコルを、例えばフェノール系試薬およびシリカ膜28を用いて使用することができる。
- RT-qPCR26による検出
注: 抽出されたサンプルに存在する潜在的なウイルスRNAの検出は、逆転写 PCR、従来の(エンドポイント)、リアルタイム PCR (qPCR) などの異なる分子技術を使用して行うことができます。ウイルスヌクレオプロテインまたはポリメラーゼ遺伝子を標的とする従来のRT-PCR27、29,29またはRT-qPCR26、30,30など、いくつかの方法が利用可能である。一例は、ウイルスポリメラーゼの中で保存された領域を標的とするデュアル結合汎リサウイルスRT-qPCRに基づいて以下に提示される。この RT-qPCR 技術は、TaqMan プローブ 技術 (汎 RABV RT-qPCR) に基づく 2 つの異なる RT-qPCR と SyBR グリーン検出 (汎リッサ RT-qPCR) を使用して 2 つの異なる RT-qPCR を関連付けます。さらに、抽出プロセス中に直接スパイクされた外因性内部制御(eGFP RNA)の検出は、特定のTaqManプローブベースのRT-qPCR(eGFP RT-qPCR)によって行われます。ウイルスRNAの検出のために選択された分子技術の現場での検証が重要であり、特に、プライマー、およびリアルタイムRT−PCR用プローブが、対象領域4で循環する株の検出に適合していることを検証する。- RNAサンプルをヌクレアーゼフリー水で1:10に希釈する。96ウェル反応プレートまたはその他の形式を使用して、各RNAサンプルを重複してテストします。各アッセイに正と負のコントロールを使用し、少なくとも重複してテストします。
- 表1に従う3つの異なるRT-qPCRアッセイに対するマスターミックス反応液を準備し、表2に示すプライマー/プローブを用いて準備する。
- 希釈したRNAサンプル5μLと15μLのマスターミックスを3つの異なるアッセイのそれぞれに加えます。汎RABV RT-qPCRアッセイおよびeGFP RT-qPCRアッセイは、同じプレート内でサイクルすることができます。
- 表3に示すサーマルサイクリング条件に従って、異なるアッセイを実行します。PCR サーマルサイクラーが 1 つだけの場合は、pan-RABV RT-qPCR から始め、パン・ラブヴ RT-qPCR の終わりまで 4 °C のプレートを 4 °C に保ちます。
- 表4に従って3つのアッセイで得られた結果を分析する。
4. RIDTデバイスからのRNA抽出後のジェノタイピング
- 逆転写 RT27,29
- 6 μLのRNA、2 μLのpd(N)6ランダムプライマー(200 μg/μL)、および2 μLのヌクレアーゼフリー水でマスターミックスを調製し、最終体積10 μLを得ます。
- ヒートブロックで65°Cで10分間インキュベートし、氷の上に保存します。
- 6 μLの5xファーストストランドバッファ、0.1 Mジチオスライトール(DTT)の2μL、上付きII逆転写酵素の1 μL(200 U)、RNasinの2 μL(80 U)、2 μLのdNTPミックス(10μM)の2μLを含むマスターミックスを調製し、各μLの最終体積に対して2μLの最終体積に対して、核アーゼフリー水を得る。
- サンプル(10 μL)(最終容積30μL)にマスターミックス(20 μL)を加え、ヒートブロックで90分間42°Cでインキュベートします。
- PCR増幅で次のステップに進むか、cDNAを-20°Cに保存します。
- 従来の PCR27、29、31 ,
注: 従来の PCR の異なる手法は、ジェノタイピングに使用できます。2つは、ヘミネストPCRの両方とも、リサウイルスの核タンパク質の一部またはウイルスタンパク質の一部を標的とする。このプロトコルは、プライマーおよびサイクリング条件を除き、これらのアッセイのそれぞれについて同じです。陽性(正のRNA)および陰性(負のcDNAおよび/またはヌクレアーゼフリー水)コントロールは、各シリーズおよびPCRの各ラウンドに含まれるべきです。- 各サンプルを0.2 mLマイクロチューブで、最初のPCRステップ用のマスターミックス反応液を調製します。この混合液は、5 μLの10x NH4反応バッファー、2.5 μLのMgCl2溶液(50 mM)、1 μLのdNTPミックス(10 μM)、各プライマー(10 μM)の1μL、ビオタクDNAポリメラーゼの0.2 μL(1U)、ヌクレアーゼフリー水の37.3 μL(最終体積48μL)を含む。プライマーは表 5に示されています。
- 表6に従って、各アッセイ用の別々の従来のPCRサーマルサイクラーに、すべてのチューブとサイクルに2μLのcDNAを追加する。
- 前のマスターミックスと同じ2番目のマスターミックス反応液を準備し、適切なプライマー(表5)を使用してヘミネストPCR反応を行います。
- 表6に示すサイクリングパラメータを使用して、第1ラウンドPCR産物の2μLを加え、従来のPCRサーマルサイクラーでサイクルします。
- 1%アガロースゲル(トリスアセテートEDTAバッファー1x - TAE 1x)に1%のアガロースゲル(100 mL - TAE 1x)をエチジウムブロマイド(最終濃度約0.01%)でロードした後、異なるPCR産物(第1および第2ラウンドPCR)を視覚化する120 Vで30分の間にゲルを動かします。陽性PCR結果は、予想サイズの明るいバンドの形で観察される(表5)。
- サンガーシーケンシング
- パンリサウイルスヘミネストPCRで得られたアンプリコンのサンガーシーケンシングを実行し、ジェノタイピング分析を完了します。
Representative Results
他の診断方法と同様に、サンプル収集は、特にフィールド設定で実行する場合、結果の信頼性にとって最も重要です。収集プロセスは、高品質のサンプルの収集を保証するために、できるだけ簡単である必要があります。動物狂犬病の死後診断のための頭門マグナム経路を介した脳生検(髄腔延髄を有する脳幹)の収集は、図2A-D2525に示すように、この要件を満たす。
収集後、脳サンプルは、RIDTの変更されたプロトコルに送信され、図6に要約される。プロトコルセクションに示されているように、プロトコル提供の製造業者からの主要な適応は、手順および必要な消耗品/試薬を簡素化するPBSの希釈ステップの省略であり、したがって、キットに含まれるすべて(図4)。
この変更されたプロトコルは、狂犬病に関するWHO共同センター(ラボ1、フランス)、狂犬病のためのFAO参照センター(ラボ5、イタリア)、アフリカの動物園の3つの参照研究所、チャド(ラボ2)、コートジボワール(ラボ3)、マリ(ラボ4)を含む5つの異なる研究所で実装され、評価されました。チャドでは、研究室とフィールドの両方の設定でRIDTの評価が行われました。
参照技術DFATと比較して、RDITの感度と特異性は、すべての研究室で高く、それぞれ96%〜100%と93.7%から100%であった(表7)。RDITの最も低い感度および特異性は実験室の検証のステップの間に実験室1(フランス)のために得られた。試験サンプルの累積数(n=162)(補足表1)に基づいて、DFATと比較した全体的な感度と特異性はそれぞれ98.2%と95.8%であった(表7)。しかし、これらの予備的だが有望な結果は限られたサンプルデータセットで得られ、特に異種データセットによる潜在的な過小評価や偏りを避けるために、特に動物園でテストされたサンプルの数に対して、さらに確認する必要があります。
RIDT試験は、リサウイルス抗原のレベルが重要である感染動物からの脳生検のリサウイルスを検出するのに適しています。しかし、滴定されたウイルス懸濁液をテストする場合、検出のテスト限界は依然として高いままである(表8;図 7)。
表9(レシェンヌ201614より)は、リサウイルスのウイルスポリメラーゼを標的としたデュアル結合汎リサウイルスRT-qPCRによるRNA検出後の結果の一例を示す。実験室の条件(実験室1、n=32)またはチャド(ラボ2、n=19)で行われた51の陽性RIDTテストのパネルをラボ1に周囲温度で出荷し、テストしました。陽性検出は18(94.7%)、26(81.2%)に対して得られたおよび 44 (86.3%)ラボ 1、ラボ 2、および 2 つの組み合わせのサンプルをそれぞれ使用します。さらに、部分的な核タンパク質遺伝子を標的としたヘミネストPCRを用いてこれらのサンプルの14個(ラボ1から10、ラボ2から4)に対してジェノタイピングを行い、そのうちの13個(93%)に成功した。(レシェンヌらから 201614).
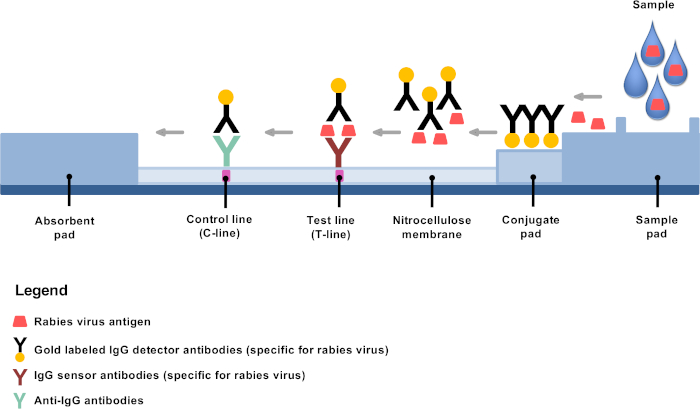
図1:狂犬病診断のためのRIDTの構造の概略図この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:フィールド設定(Mali)の後頭部を介して動物(ここに示す犬)における脳サンプル(延髄を伴う脳幹)の収集のための迅速な簡単な技術の例。(A)使い捨てのプラスチックピペットを使ったコレクション(B)プラスチック製の飲用ストロー付きコレクション(C)クランプ付きコレクション (D) RIDT キットに提供された廃棄ドロッパー付きコレクション。この図の大きなバージョンを表示するには、ここをクリックしてください。
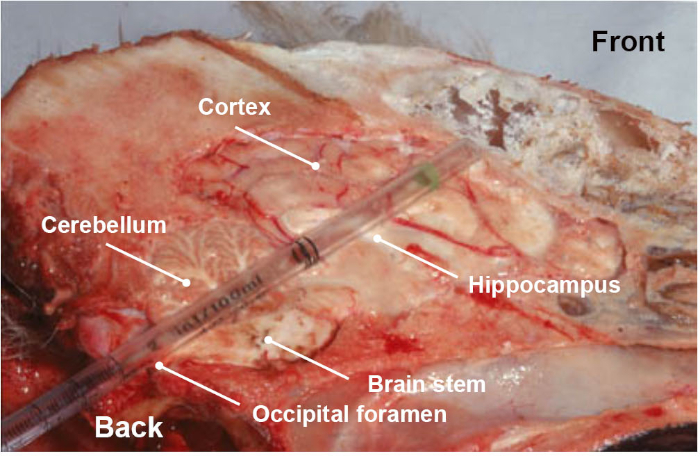
図3:犬頭の縦断解剖学的部分は、後頭部経路を通る使い捨てプラスチックピペットを押すときに集められた脳の異なる部分(脳幹、小脳、海馬、視床および皮質)を示す。この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:RIDTキットの内容物の説明は、装置、使い捨てプラスチックスポイト、使い捨て綿棒、およびアッセイ希釈剤を含む。サンプルを採取して保管するチューブは提供されません。この図の大きなバージョンを表示するには、ここをクリックしてください。
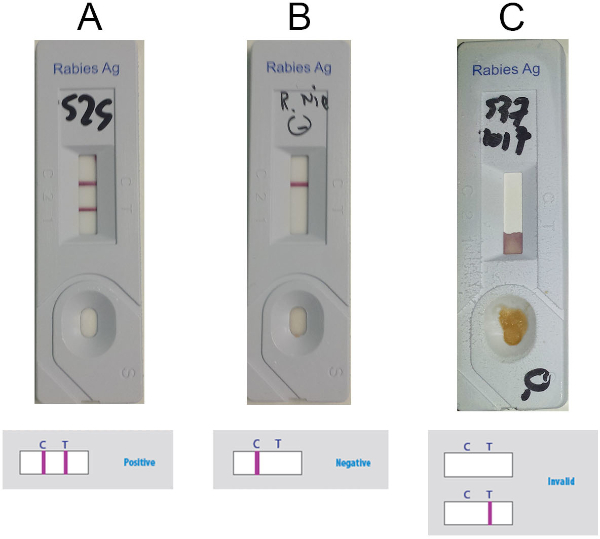
図5:アニゲンRIDTの解釈に関する代表的な結果(A) 肯定的な結果 (C ラインと T ラインの 2 つのラインの可視存在) (B) 否定的な結果 (C ラインのみ表示) (C) 無効な結果 (可視 C 行がない)。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 6: メーカーの指示から適合した RIDT プロトコルの概略表現。(A) プロトコルの修正版, メーカーが推奨する希釈ステップの削除 (B) メーカーが推奨する初期プロトコル, 脳サンプルのPBSで前の1:10希釈ステップで.変更されたプロトコル (図 6Aに示す) で削除されたステップは赤い線で示されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
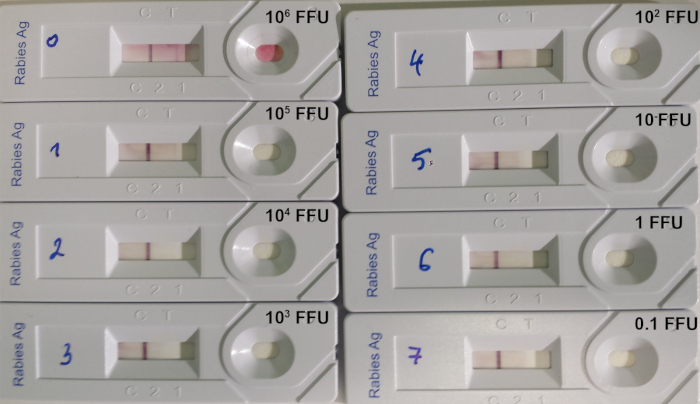
図7:RIDT14の検出限界の判定例。9704ARG株の滴定狂犬病ウイルスの連続10:1希釈が使用された。各装置に付着したウイルスの量はFFU(蛍光焦点形成単位)で示される。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 汎RABV RT-qPCRアッセイ | |
| 試薬 | μL/反応 |
| 2X反応ミックス(各dNTPの0.4 mMと6 mM MgSO4を含むバッファ) | 10 |
| ヌクレアーゼフリーウォーター | 1.5 |
| Taq3long (フォワード) [10 μM] | 1 |
| Taq17revlong (逆) [10 μM] | 1 |
| RABV4 [10 μM] | 0.3 |
| RABV5 [10 μM] | 0.3 |
| MgSO4 [50 mM] (キットに付属) | 0.25 |
| ROX リファレンスダイ(25 μM) (キットに付属) | 0.05 |
| ルナシン (40U/μL) (前メガ) | 0.2 |
| スーパースクリプト III RT/プラチナ タクミックス | 0.4 |
| 反応ごとの合計 | 15 |
| eGFP RT-qPCR アッセイ | |
| 試薬 | μL/反応 |
| 2X反応ミックス(各dNTPの0.4 mMと6 mM MgSO4を含むバッファ) | 10 |
| ヌクレアーゼフリーウォーター | 2.8 |
| EGFP1F (フォワード) [10 μM] | 0.5 |
| EGFP2R (逆) [10 μM] | 0.5 |
| eGFP プローブ [10 μM] | 0.3 |
| MgSO4 [50 mM] (キットに付属) | 0.25 |
| ROX リファレンスダイ(25 μM) (キットに付属) | 0.05 |
| ルナシン (40U/μL) (前メガ) | 0.2 |
| スーパースクリプト III RT/プラチナ タクミックス | 0.4 |
| 反応ごとの合計 | 15 |
| 汎リッサRT-qPCRアッセイ | |
| 試薬 | μL/反応 |
| 2x SYBRグリーン反応ミックス | 10 |
| ヌクレアーゼフリーウォーター | 2.1 |
| Taq5long (フォワード) [10 μM] | 1 |
| Taq16revlong (逆) [10 μM] | 1 |
| MgSO4 [50 mM] (キットに付属) | 0.25 |
| ROX リファレンスダイ(25 μM) | 0.05 |
| ルナシン (40U/μL) (前メガ) | 0.2 |
| スーパースクリプト III RT/プラチナ タクミックス | 0.4 |
| 反応ごとの合計 | 15 |
表1:3種類のRT-qPCRアッセイ(汎RABV RT-qPCR、汎リッサRT-qPCRおよびeGFP RT-qPCR)のマスターミックス反応溶液の説明。
| RT-qPCR アッセイ | 名前 | 型 | 長さ | シーケンス (5'-3') | 意味 | 位置 |
| 汎 RABV RT-qPCR アッセイ | タク3ロング | プライマー | 22 | ATG アガ AGT GGA アヤ AYC ATC A | S | 7273-7294a |
| Taq17revlong | プライマー | 25 | GAT CTG TCT GAA TAA タグ AYC カー G | As | 7390-7414a | |
| ラブ4 | プローブ(FAM/タムラ) | 29 | AACエイシーTGA TCB AGK ACA GAR AAY ACA TC | As | 7314-7342a | |
| ラブ5 | プローブ(FAM/タムラ) | 32 | AGR GTG TTT TTT TCY AGR ACW ケイガギャグ TTT TTY CA | S | 7353-7384a | |
| 汎リッサRT-qPCRアッセイ | タク5ロング | プライマー | 23 | タット ギャグ AAA TGG AAC AAY CA | S | 7272-7294a |
| Taq16revlong | プライマー | 25 | GAT TTT TGA AAG AAC TCA TGK GTY C | As | 7366-7390a | |
| eGFP RT-qPCR アッセイ | エグFP1F | プライマー | 20 | GAC CAC TAC CAG CAG AAC AC | S | 637-656b |
| エグFP2R | プライマー | 19 | GAA CTC CAG CAG GAC CAT G | As | 768-750b | |
| エグFP | プローブ(FAM/タムラ) | 22 | AGC ACC CAG TCC GCC CTG AGC A | S | 703-724b |
表 2: 3 つの異なる RT-qPCR アッセイ (汎 RABV RT-qPCR、汎リッサ RT-qPCR および eGFP RT-qPCR) のプライマー/プローブの説明。aパスツールウイルス(PV)のRABVゲノム配列(GenBankの受付番号M13215)によれば。bクローニングベクターpEGFP-1配列(GenBankアクオリティ番号U55761)に従う。
| 汎RABV RT-qPCRおよびeGFP RT-qPCRアッセイ | ||||
| ステップ | サイクル | 温度 | 時間 | データ収集 |
| 逆転写 | 1 | 45°C | 15分 | |
| RT不活性化/初期変性 | 1 | 95°C | 3分 | |
| 増幅 | 40 | 95°C | 15 s | |
| 61°C | 1分 | 終点 | ||
| 汎リッサRT-qPCRアッセイ | ||||
| ステップ | サイクル | 温度 | 時間 | データ収集 |
| 逆転写 | 1 | 45°C | 15分 | |
| RT不活性化/初期変性 | 1 | 95°C | 3分 | |
| 増幅 | 40 | 95°C | 15 s | |
| 55°C | 1分 | 終点 | ||
| 解離曲線 | 1 | 95°C | 15 s | 0.1 °C/s、55~95 °Cを増加 |
| 55°C | 1分 | |||
| 95°C | 15 s | |||
| 55°C | 15 s | |||
表3:3種類のRT-qPCRアッセイ(汎RABV RT-qPCR、汎リッサRT-qPCRおよびeGFP RT-qPCR)の熱循環条件の説明。
| アッセイ | 分析 | 結果 | 解釈 |
| eGFP RT-qPCR | 受け入れ間隔におけるCq | 抽出検証済み | 他のアッセイの分析が可能 |
| 受け入れの間隔外のCq | 抽出が検証されていません | サンプルを再テスト (実行または抽出を繰り返す)、必要に応じて別のサンプルを要求する | |
| パンラブ RT-qPCR | Cq <38 | 正 | ウイルスRNAの陽性検出 |
| Cq ≥38 | 負 | 汎ライサRT-qPCRアッセイの分析 | |
| パンリッサ RT-qPCR | 正と見なされる融解曲線 | 正 | ウイルスRNAの陽性検出 |
| 負と見なされる融解曲線 | 負 | ウイルスRNAの検出の欠如 |
表4:二重結合汎リサウイルスRT-qPCRアッセイの全般的な解釈。
| ヘミネスト化された従来のPCRアッセイ | PCRラウンド | 名前 | 長さ | シーケンス (5'-3') | 意味 | 位置a | アンプリコンサイズ (bp) |
| ポリメラーゼ遺伝子を標的としたヘミネストPCR | 第1ラウンド | PVO5m | 20 | ATG ACA GAC AAYYTG AAC AA | S | 7170-7189 | 320 |
| PVO9 | 19 | TGA CCA TTC カー・カル GTN G | As | 7471-7489 | |||
| 2回戦 | PVO5m | 20 | アトガ CAG ACA アイ・テガ ACA A | S | 7170-7189 | 250 | |
| PVO8 | 22 | GGT CTG ATC TRT CWG ARY AAT A | As | 7398-7419 | |||
| 核タンパク質遺伝子を標的としたヘミネストPCR | 第1ラウンド | N127 | 20 | ATG TAA CAC CTC TAC AAT GG | S | 55-74 | 1532 |
| N8m | 19 | CAG TCT CYT CNG CCA TCT C | As | 1568-1586 | |||
| 2回戦 | N127 | 20 | ATG TAA CAC CTC TAC AAT GG | S | 55-74 | 845 | |
| N829 | 19 | GCC CTG GTT CGA ACA TTC T | As | 881-899 |
表5:従来のヘミネストPCRに使用するプライマーの説明
| ポリメラーゼ遺伝子を標的としたヘミネストPCR | ||||
| ステップ | サイクル | 温度 | 時間 | |
| 第1ラウンドと第2ラウンド | 初期変性 | 1 | 94°C | 3分 |
| 変性 | 35 | 94°C | 30 s | |
| ハイブリダイズ | 56°C | 45 s | ||
| 伸長 | 72°C | 40 s | ||
| 最終的な伸び | 1 | 72°C | 3分 | |
| 核タンパク質遺伝子を標的としたヘミネストPCR | ||||
| ステップ | サイクル | 温度 | 時間 | |
| 1回戦 | 初期変性 | 1 | 94°C | 3分 |
| 変性 | 35 | 94°C | 30 s | |
| ハイブリダイズ | 56°C | 30 s | ||
| 伸長 | 72°C | 45 s | ||
| 最終的な伸び | 1 | 72°C | 3分 | |
| 2回戦 | 初期変性 | 1 | 94°C | 3分 |
| 変性 | 35 | 94°C | 30 s | |
| ハイブリダイズ | 58°C | 30 s | ||
| 伸長 | 72°C | 30 s | ||
| 最終的な伸び | 1 | 72°C | 3分 | |
表6:従来のヘミネストPCRのサーマルサイクル条件について説明する。
| 研究 室 | 国 | 評価期間 | サンプルのNb | DFAT の結果 | RIDT の結果 | 感度 | 特異 性 | ||
| Pos | Neg | Pos | Neg | ||||||
| ラボ 1 | フランス | 2015 | 82 | 50 | 32 | 50 | 32 | 96% | 93.7% |
| ラボ 2 | チャド | 2012-2015 | 44 | 33 | 11 | 33 | 11 | 100% | 100% |
| ラボ 3 | コートジボワール | 2017 | 10 | 8 | 2 | 8 | 2 | 100% | 100% |
| ラボ 4 | マリ | 2017 | 18 | 15 | 3 | 15 | 3 | 100% | 100% |
| ラボ 6 | イタリア | 2016 | 8 | 8 | 0 | 8 | 0 | 100% | - |
| すべての | 2015-2017 | 162 | 114 | 48 | 114 | 48 | 98.2% | 95.8% | |
表7:RIDT試験の組み込みパラメータ(感度、特異性)の決定は、参照DFAT法と比較して、合計162サンプルの分析に基づき、5つの異なる実験室の参加を得た。
| ウイルス株a | 元のホスト | 場所 | 初期濃度 (FFU/mL)b | 検出限界(FFU/mL)c |
| 9147FRA | 赤いキツネ | フランス | 3.1 x 107 | 106 |
| Cvs | ラボ分離 | - | 1.6 x 107 | 106 |
| 8743THA | 人間 | タイ | 8.1 x 107 | > 8.1 x 106 |
| 9508CZK (SAD) | ラボ分離 | - | 5.4 x 108 | 107 |
| Pv | ラボ分離 | - | 4.3 x 107 | 106 |
| 9001FRA | 犬 | フランス領ギアナ | 2.4 x 106 | > 2.4 x 105 |
| 9704ARG | バット | アルゼンチン | 9.5 x 107 | 105 |
| 04030PHI | 人間 | フィリピン | 2.5 x 107 | 105 |
表8:8種類の滴定された狂犬病ウイルス懸濁液を用いたRIDTの検出の限界(レシェンヌら2016年14月より)。aCVS:挑戦ウイルス株、SAD:ストリートアラバマダッフィン、PV:パスツールウイルス。b1 mL当たりの蛍光焦点形成単位(FFU)の数。cストリップに堆積する蛍光焦点形成単位(FFU)の数。
| で実行される RIDT | ||||||||||
| ラボ 1 | ラボ 2 | 組み合わせる | ||||||||
| 正 | 負 | 合計 | 正 | 負 | 合計 | 正 | 負 | 合計 | ||
| ウイルスRNA検出 | 正 | 18 | 1 | 19 | 26 | 0 | 32 | 44 | 7 | 51 |
| 負 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 3 | 3 | |
| 合計 | 18 | 1 | 19 | 26 | 0 | 35 | 44 | 10 | 54 | |
表9:実験室条件で使用されるアニゲン試験ストリップ上のRT-qPCRを用いたウイルスRNAの検出(Lab 1)、フィールド条件で、周囲温度(Lab 2)または組み合わせて出荷(レシェンヌら201614から)。
補足表 1: 表 7 に示されている組み込みパラメーターの決定のために RIDT テストでテストされた 162 サンプルの説明。こちらの表を表示するには、ここをクリックしてください (右クリックしてダウンロードしてください)。
Discussion
RIDTは死後の狂犬病の診断のための簡単で、速く、低コストの方法および実験室のテストに代わる有望な分野である。このようなテストの適用は、特に低所得国と中所得国の分散地域に対して、狂犬病ウイルスの蔓延と感染の局所的および潜在的に国家的規模での感染に対する理解を向上させるだろう。急速な脳サンプル採取法(完全壊死なし)と組み合わせると、検査は実験室施設から離れて、現場の設定で完全に行うことができるという大きな利点があります。頭蓋マグナムを介して収集された脳サンプルは、テストに使用することができ、したがって、完全に動物の頭蓋骨を開く必要はありません。テストは実行し、解釈するのが簡単で、フィールド監視活動14に特に適しています。DFATまたはDRITに対するRIDTの他の利点は、正と負のコントロールと室温でのキット保管の必要はありません。さらに、改質されたプロトコルは、PBSへの希釈工程(1:10)が省略される場合、試験を行うために余分な試薬を必要とせず、フィールド条件下での手順をさらに簡素化する。
重要なポイントは、脳のサンプルの品質です。サンプルは、疑わしい動物の死後できるだけ早く収集してテストするか、または分解を避けるために、テストの前に涼しい温度で保管する必要があります。分解されたサンプルは結果に影響を与える可能性があるため(偽陰性の結果のリスク)、テストしないでください。脳サンプルに対する時間の経過にとらわれたRIDTの感度の喪失に関するデータはまだ入手できませんが、DFATテスト32と比較すると類似していると仮定しています。しかし、実験は現場で迅速かつ直接的に行うことができるため、動物の死と試験の実施までの時間を短縮することができる。したがって、一般的に分解されたサンプルのリスクが低い。
プロトコル内のもう 1 つの重要なステップは、サンプルの中断移行です。移行は、サンプルのデポジットの直後に開始する必要があります (1-5 分).したがって、懸濁液の高粘度は、移動に悪影響を及ぼす可能性があります。デバイスデポジットサイトの底をドロッパーで軽く引っ掻き、さらに1〜2滴を追加すると、この問題が解決することがよくあります。
アフリカの研究所(チャド、コートジボワール、マリ)で行われたRIDT試験のほとんどは、30°Cを超え得る周囲温度で行われましたが、メーカーが推奨する貯蔵および使用のための温度範囲は15°C〜30°Cです。高温がRIDT試験性能に与える影響は特定しませんでしたが、より慎重に評価する必要があります。同様に、ウイルスRNA検出およびジェノタイピングに使用した後のデバイスの保管および輸送中の高温の影響は、追加の評価が必要です。RIDTストリップからのRT-qPCRによるウイルスRNA検出の感度は、試験で最初に使用される脳サンプルの質だけでなく、使用後のRIDT試験の保存状態によっても影響を受ける可能性がある。例えば、使用されたRIDT試験が制御された実験室条件下で保存されたとき、RNA検出の感度は高かった(94.7%)フィールド条件下(例えばチャド)(81.2%)14.14これらの条件はまた、ストリップ上に固定されたRNAの完全性(特に長さ)に影響を及ぼし、より長いPCRアンプリコン(例えば、500ヌクレオチド)14に基づく遺伝子型入力に対する中程度の感度を説明する可能性もある。テストストリップで実行されるRT-qPCRの感度はFTA Whatmanカード(80.6%)を使用して得られたものよりも低かった。他の分子技術と同様に、ウイルス負荷はRDITストリップに基づくジェノタイピングの成功にも影響を及ぼし、低ウイルス負荷14のサンプルに対して潜在的な陰性の結果を有する。
このテストは現在、WHOとOIEが日常的な診断と病気の監視のために推奨しておらず、その結果、PEPの意思決定を導くために単独で使用することはできません。さらにテスト検証が必要です。しかし、正確な迅速な狂犬病の診断は、十分に機能する連続狂犬病監視システムの重要な要素であり、政治的コミットメントを高めるために役立つものであり、持続可能な狂犬病制御の成功のために非常に重要である33。RIDT検査は、この文脈で新しい狂犬病診断の機会を提供し、低または中所得の動物園の分野で動物狂犬病の監視を拡大するための有用なツールです。
Acknowledgements
この研究は、ワクチンと予防接種のためのグローバルアライアンス(GAVI)、ヴォルファーマン・ナゲリ財団、スイスアフリカ研究協力(SARECO)、SWFスティフトゥン・フュル・ウィセンスシャフト・フォルシュン、フライウィリゲ・アカデミシェ・ゲセルシャフト(FAG)バーゼル、アジアの二国間科学技術協力プログラムを通じて支援されました。
私たちは特に犬の所有者、獣医の人員と彼らの偉大なコミットメントのための研究室のスタッフに感謝します。また、言語編集のためにリサ・クランプを認めたいと思います。
Materials
| Name | Company | Catalog Number | Comments |
| Anti-Rabies Nucleocapsid Conjugate (lyophilizied, adsorbed) | Bio-Rad, France | 3572112 | Fluorescein-5-isothiocyanate (FITC) conjugated polyclonal antibody against the nucleocapsid of rabies virus. Use for the DFAT reference tecnnique. |
| Applied Biosystems 7500 Real-Time PCR System | Applied Biosystems, France | 4351104 | Amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| Disposable plastic pipette, drinking straw, clamp, dropper | - | - | Equipment used for the collection of the brain stem (medulla oblongata) via the foramen magnus (occipital route). |
| Evans Blue Solution 1% | Bio-Rad, France | 3574911 | Counter-coloration used for the DFAT to facilite the reading under UV microscope. |
| Primer eGFPF1 | Eurofins Genomics, Germany | - | Forward primer for the amplification of the internal control eGFP by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-GACCACTACCAGCAGAACAC-3'. |
| Primer eGFPR2 | Eurofins Genomics, Germany | - | Reverse primer for the amplification of the internal control eGFP by RT-qPCR after extraction from the RIDT device, sequence: 5'-GAACTCCAGCAGGACCATG-3'. |
| Primer Taq17 revlong | Eurofins Genomics, Germany | - | Reverse primer for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-ATGAGAAGTGG AAYAAYCATCA-3'. |
| Primer Taq3 long | Eurofins Genomics, Germany | - | Forward primer for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-GATCTGTCTGAA TAATAGAYCCARG-3'. |
| Probe eGFP FAM/TAMRA | Eurofins Genomics, Germany | - | Forward primer for the amplification of the internal control by RT-qPCR after extraction from the RIDT device, sequence: 5'-AGCACCCAGT CCGCCCTGAGCA-3'. |
| Probe RABV4 FAM/TAMRA | Eurofins Genomics, Germany | - | Probe for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-AACACYTGATCBA GKACAGARAAYACATC-3'. |
| Probe RABV5 FAM/TAMRA | Eurofins Genomics, Germany | - | Probe for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-AGRGTGTTTTCYAG RACWCAYGAGTTTTTYCA-3'. |
| Rapid Rabies Ag Test Kit | BioNote Inc., Republic of Korea | RG18-01DD | Rapid immunochromatographic diagnostic test (RIDT, also named lateral flow device or LFD) for the post-mortem diagnosis of rabies. |
| Recombinant RNasin Ribonuclease Inhibitor | Promega, USA | N2515 | Enzyme used with the kit for the amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| SuperScript III Platinum One-Step qRT-PCR Kit | Invitrogen, France | 11732-020 | Kit for the amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| TRIzol Reagent | Invitrogen, France | 15596026 | Phenol/chloroforme based total RNA extraction using the cellulose membrane of the RIDT. |
References
- Hampson, K., et al. Correction: Estimating the Global Burden of Endemic Canine Rabies. PLoS Neglected Tropical Diseases. 9 (5), e0003786 (2015).
- Rupprecht, C., Kuzmin, I., Meslin, F. Lyssaviruses and rabies: current conundrums, concerns, contradictions and controversies. F1000Research. 6, 184 (2017).
- Walker, P. J., et al. ICTV Virus Taxonomy Profile: Rhabdoviridae. The Journal of General Virology. 99 (4), 447-448 (2018).
- World Health Organization (WHO). WHO Expert Consultation on Rabies, third report. HO Technical Report Series, No. 1012. , (2018).
- Dacheux, L., et al. More Accurate Insight into the Incidence of Human Rabies in Developing Countries through Validated Laboratory Techniques. PLoS Neglected Tropical Diseases. 4 (11), e765 (2010).
- Welburn, S. C., Beange, I., Ducrotoy, M. J., Okello, A. L. The Neglected Zoonoses - The Case for Integrated Control and Advocacy. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. , (2015).
- Dacheux, L., Bourhy, H. Diagnostic tests for human rabies. Revue Scientifique Et Technique (International Office of Epizootics). 37 (2), 581-593 (2018).
- Kasempimolporn, S., Saengseesom, W., Lumlertdacha, B., Sitprija, V. Detection of rabies virus antigen in dog saliva using a latex agglutination test. Journal of Clinical Microbiology. 38 (8), 3098-3099 (2000).
- Kang, B., et al. Evaluation of a rapid immunodiagnostic test kit for rabies virus. Journal of Virological Methods. 145 (1), 30-36 (2007).
- Nishizono, A., et al. A simple and rapid immunochromatographic test kit for rabies diagnosis. Microbiology and Immunology. 52 (4), 243-249 (2008).
- Kasempimolporn, S., Saengseesom, W., Huadsakul, S., Boonchang, S., Sitprija, V. Evaluation of a rapid immunochromatographic test strip for detection of Rabies virus in dog saliva samples. Journal of Veterinary Diagnostic Investigation: Official Publication of the American Association of Veterinary Laboratory Diagnosticians, Inc. 23 (6), 1197-1201 (2011).
- Ahmed, K., et al. Evaluation of a monoclonal antibody-based rapid immunochromatographic test for direct detection of rabies virus in the brain of humans and animals. The American Journal of Tropical Medicine and Hygiene. 86 (4), 736-740 (2012).
- Léchenne, M., et al. Validation of a Rapid Rabies Diagnostic Tool for Field Surveillance in Developing Countries. PLoS Neglected Tropical Diseases. 10 (10), e0005010 (2016).
- Yang, D. K., et al. Comparison of four diagnostic methods for detecting rabies viruses circulating in Korea. Journal of Veterinary Science. 13 (1), 43-48 (2012).
- Markotter, W., et al. Evaluation of a rapid immunodiagnostic test kit for detection of African lyssaviruses from brain material. The Onderstepoort Journal of Veterinary Research. 76 (2), 257-262 (2009).
- Reta, T., et al. Evaluation of Rapid Immunodiagnostic Test for Rabies Diagnosis Using Clinical Brain Samples in Ethiopia. Journal of Veterinary Science & Medical Diagnosis. 2 (3), 1-3 (2013).
- Servat, A., Picard-Meyer, E., Robardet, E., Muzniece, Z., Must, K., Cliquet, F. Evaluation of a Rapid Immunochromatographic Diagnostic Test for the detection of rabies from brain material of European mammals. Biologicals: Journal of the International Association of Biological Standardization. 40 (1), 61-66 (2012).
- Certoma, A., et al. Assessment of a Rabies Virus Rapid Diagnostic Test for the Detection of Australian Bat Lyssavirus. Tropical Medicine and Infectious Disease. 3 (4), (2018).
- Ahmad, A., Singh, C. K. Comparison of rapid immunodiagnosis assay kit with molecular and immunopathological approaches for diagnosis of rabies in cattle. Veterinary World. 9 (1), 107-112 (2016).
- Sharma, P., Singh, C. K., Narang, D. Comparison of immunochromatographic diagnostic test with Hheminested Reverse transcriptase polymerase chain reaction for detection of rabies virus from brain samples of various species. Veterinary World. 8 (2), 135-138 (2015).
- Voehl, K. M., Saturday, G. A. Evaluation of a rapid immunodiagnostic rabies field surveillance test on samples collected from military operations in Africa, Europe, and the Middle East. U.S. Army Medical Department Journal. , 27-32 (2014).
- Servat, A., Robardet, E., Cliquet, F. An inter-laboratory comparison to evaluate the technical performance of rabies diagnosis lateral flow assays. Journal of Virological Methods. 272, 113702 (2019).
- Eggerbauer, E., et al. Evaluation of Six Commercially Available Rapid Immunochromatographic Tests for the Diagnosis of Rabies in Brain Material. PLoS Neglected Tropical Diseases. 10 (6), e0004776 (2016).
- Barrat, J., Meslin, F. X., Kaplan, M. M., Koprowski, H. Simple technique for the collection and shipment of brain specimens for rabies diagnosis. Laboratory techniques in rabies. , 425-432 (1996).
- Dacheux, L., et al. Dual Combined Real-Time Reverse Transcription Polymerase Chain Reaction Assay for the Diagnosis of Lyssavirus Infection. PLoS Neglected Tropical Diseases. 10 (7), e0004812 (2016).
- Dacheux, L., et al. A reliable diagnosis of human rabies based on analysis of skin biopsy specimens. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 47 (11), 1410-1417 (2008).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Application of next generation sequencing to rabies virus and other lyssaviruses. Laboratory techniques in rabies. 2, 49-61 (2019).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Conventional pan-lyssavirus reverse transcriptase polymerase chain reaction. Laboratory techniques in rabies. 2, 1-16 (2019).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Rabies real-time reverse transcriptase polymerase chain reaction. Laboratory techniques in rabies. 2, 17-34 (2019).
- Talbi, C., et al. Evolutionary history and dynamics of dog rabies virus in western and central Africa. The Journal of General Virology. 90 (Pt 4), 783-791 (2009).
- McElhinney, L. M., Marston, D. A., Brookes, S. M., Fooks, A. R. Effects of carcase decomposition on rabies virus infectivity and detection. Journal of Virological Methods. 207, 110-113 (2014).
- Vigilato, M. A. N., et al. Progress towards eliminating canine rabies: policies and perspectives from Latin America and the Caribbean. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 368 (1623), 20120143 (2013).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved