Prueba de diagnóstico inmunocromatográfico rápido postmortem de campo para la configuración de recursos limitados con otras aplicaciones moleculares
In This Article
Summary
Presentamos un protocolo completo para el diagnóstico postmortem de la rabia animal en condiciones de campo utilizando una prueba de diagnóstico inmunocromatográfico rápido (RIDT), desde el muestreo de biopsia cerebral hasta la interpretación final. También describimos otras aplicaciones que utilizan el dispositivo para el análisis molecular y el genotipado viral.
Abstract
Los sistemas funcionales de vigilancia de la rabia son cruciales para proporcionar datos fiables y aumentar el compromiso político necesario para el control de enfermedades. Hasta la fecha, los animales sospechosos de ser rabiosos positivos deben someterse a una confirmación postmortem utilizando métodos de laboratorio clásicos o moleculares. Sin embargo, la mayoría de las zonas endémicas se encuentran en países de ingresos bajos y medianos, donde el diagnóstico de rabia animal se limita a los laboratorios veterinarios centrales. La escasa disponibilidad de la infraestructura de vigilancia conduce a la falta de información de enfermedades graves desde zonas remotas. Recientemente se han desarrollado varios protocolos de diagnóstico que requieren poca experiencia técnica, proporcionando la oportunidad de establecer el diagnóstico de la rabia en laboratorios descentralizados. Aquí presentamos un protocolo completo para el diagnóstico postmortem de campo de la rabia animal utilizando una prueba de diagnóstico inmunocromatográfico rápido (RIDT), desde el muestreo de biopsia cerebral hasta la interpretación final. Completamos el protocolo describiendo un uso adicional del dispositivo para el análisis molecular y el genotipado viral. RidT detecta fácilmente el virus de la rabia y otros lyssavirus en muestras cerebrales. El principio de tales pruebas es simple: el material cerebral se aplica en una tira reactiva donde los anticuerpos conjugados con oro se unen específicamente a los antígenos de la rabia. Los complejos antígeno-anticuerpos se unen aún más a los anticuerpos fijos en la línea de ensayo, lo que resulta en una línea púrpura claramente visible. El virus se inactiva en la tira reactiva, pero el ARN viral se puede extraer posteriormente. Esto permite que la tira de prueba, en lugar de la muestra cerebral infecciosa, se envíe de forma segura y fácil a un laboratorio equipado para su confirmación y tipificación molecular. Sobre la base de una modificación del protocolo del fabricante, encontramos una mayor sensibilidad a la prueba, alcanzando el 98% en comparación con el método de referencia estándar de oro, la prueba directa de anticuerpos de inmunofluorescencia. Las ventajas de la prueba son numerosas: rápida, fácil de usar, de bajo costo y sin necesidad de infraestructura de laboratorio, como microscopía o cumplimiento de la cadena de frío. Los RID representan una alternativa útil para las áreas donde los métodos de diagnóstico de referencia no están disponibles.
Introduction
La rabia canina es la principal causa de la rabia humana, responsable mundialmente de aproximadamente 59.000 muertes humanas al año, casi todas ocurridas en países de ingresos bajos y medianos (LMIC) en Asia y Africa1. El principal agente etiológico es un virus de rabia clásica asociado a los caninos neurotrópicos (RABV, familia Rhabdoviridae,género Lyssavirus, especies de lyssavirusde la rabia). Sin embargo, otros lyssavirus relacionados con la rabia, que circulan principalmente en especies de murciélagos, también causanenfermedades 2,,3. En las regiones afectadas, la vigilancia y el control de las enfermedades a menudo se ven obstaculizados por un compromiso político de bajo nivel probablemente debido a la falta de datos fiables4,,5,,6. Una razón para la subinformación de enfermedades es la ausencia de diagnóstico de laboratorio, debido en parte al acceso limitado a laboratorios equipados y personal capacitado, así como a las dificultades de envío de los especímenes. El diagnóstico de laboratorio es necesario para confirmar los casos de rabia y, además, permite la caracterización genética de las cepas implicadas, proporcionando información sobre la transmisión del virus a nivel regional4,,5,,7.
Las normas actuales de oro para el diagnóstico de rabia postmortem, aprobadas tanto por la Organización Mundial de la Salud (OMS) como por la Organización Mundial de Sanidad Animal (OIE), son la prueba de anticuerpos fluorescentes directos (DFAT), la prueba de inmunohistoquímica rápida directa (DRIT) y los métodos moleculares (por ejemplo, la reacción en cadena de la biomerasa de transcripción inversa (RT-PCR))4,,8. Sin embargo, la aplicación adecuada en los LMIC sigue siendo limitada debido a instalaciones de laboratorio inadecuadas con una fuente de alimentación inconsistente, transporte de muestras no refrigerados y falta de un sistema de gestión de la calidad. Debido a que el diagnóstico de rabia animal normalmente sólo se lleva a cabo en laboratorios veterinarios centrales en LMIC, los datos de vigilancia existentes reflejan principalmente la situación de la rabia en las zonas urbanas.
Las alternativas de diagnóstico de baja tecnología desarrolladas recientemente ofrecen oportunidades para establecer el diagnóstico de la rabia en áreas remotas y laboratorios descentralizados de rabia4,,8,,9. La prueba de diagnóstico inmunocromatográfico rápido (RIDT) es una prueba de flujo lateral basada en inmunocromatografía utilizando anticuerpos detectores conjugados de oro y es una herramienta de diagnóstico de rabia muyprometedora 10,11,12,13. El principio es simple: después de la dilución, el material cerebral se mezcla en el tampón proporcionado, y se aplican unas gotas en la tira reactiva donde los anticuerpos monoclonales conjugados con oro se unen específicamente a los antígenos de la rabia, principalmente las nucleoproteínas (Figura 1). Los complejos antígeno-anticuerpos se someten a una migración de flujo lateral, uniéndose en la línea de ensayo (línea T) a anticuerpos fijos contra antígenos de rabia, lo que resulta en una línea púrpura claramente visible. Los anticuerpos conjugados de oro restantes no unidos a antígenos de rabia continúan migrando y fijados a la membrana a través de anticuerpos de apuntamiento adicionales, lo que resulta en una línea de control púrpura claramente visible (línea C).
El método de un solo paso y bajo costo es rápido, extremadamente fácil y no requiere equipos costosos ni condiciones especiales de almacenamiento. Con la modificación del protocolo del fabricante para eliminar el paso de dilución, casi todos los equipos y reactivos necesarios para realizar la prueba se incluyen en el kit14. El resultado se lee después de 5-10 minutos sin un microscopio. Esta es una ventaja importante sobre la prueba DFAT, que requiere un microscopio de fluorescencia y un conjugado de inmunofluorescencia, junto con el transporte refrigerado y el almacenamiento de muestras. Incluso la prueba DRIT, que se puede realizar con un microscopio de luz, requiere una cadena de frío continua para almacenar los anticuerpos antirrábicos, que tampoco están disponibles comercialmente. En comparación con el DRIT, el RIDT no requiere productos químicos tóxicos, una ventaja particular en los países donde la eliminación de residuos está mal regulada. La prueba rápida consume menos tiempo con una interpretación mucho más fácil en comparación con las pruebas estándar de oro DFAT y DRIT. Esto permite realizar pruebas in situ por personal con experiencia técnica limitada.
En función de estas propiedades de prueba, se hace factible un diagnóstico rápido de animales sospechosos en zonas remotas, lo que facilita la implementación de la profilaxis post exposición (PEP) para las personas expuestas lo antes posible. Además, no es necesario el transporte a distancia de muestras de rabia, lo que resulta en una mejor calidad de la muestra en el momento de la prueba. Sin embargo, los resultados obtenidos con las pruebas RIDT deben confirmarse actualmente mediante una prueba de diagnóstico de referencia como DFAT o DRIT.
Se han evaluado las técnicas RIDT para la detección de RABV y otros lyssavirus. Uno de los primeros estudios fue realizado por investigadores coreanos en 200710. En comparación con el método DFAT, en 51 muestras de animales y 4 aislados rabina, el RIDT mostró una sensibilidad y especificidad del 91,7% y el 100%, respectivamente. Estos resultados se confirmaron más tarde con 110 muestras de cerebro animal de Corea, con sensibilidad y especificidad, en comparación con DFAT, de 95% y 98,9%, respectivamente15. Más recientemente, otros estudios evaluaron el rendimiento de este RIDT utilizando aislados de virus y/o muestras cerebrales infectadas de varios animales con diferentes orígenes geográficos. Se detectó con éxito un panel de 21 muestras, entre ellas el RABV africano y otros lincesávirus africanos (virus Duvenhage (DUVV), el virus del murciélago de Lagos (LBV) y el virus Mokola (MOKV), con una sensibilidad del 100% en comparación con el DFAT16. Alta sensibilidad similar (96,5%) y especificidad (100%) los valores se obtuvieron de un panel de 115 muestras cerebrales de Etiopía17. Otro estudio evaluó los aislados europeos de RABV, otros dos lissavirus europeos (lissavirus europeo de murciélagos tipo 1 (EBLV-1) y tipo 2 (EBLV-2)), y el lissavirus de murciélago australiano (ABLV)18. Basándose en el análisis de 172 muestras de cerebro animal, el kit RIDT tenía una sensibilidad del 88,3% y una especificidad del 100% en comparación con DFAT, y se detectaron con éxito los tres analvirus relacionados con la rabia. En este estudio, algunos de los falsos resultados negativos provienen de muestras cerebrales almacenadas en tampón de glicerol, lo que sugiere que la eliminación inadecuada de glicerol influyó en el flujo capilar o la unión de anticuerpos. Un análisis reciente de 43 muestras clínicas de murciélagos australianos confirmó los resultados de pruebas anteriores, con total concordancia con DFAT19. Se realizaron dos estudios en la India utilizando el RIDT en un número limitado de muestras clínicas (11 y 34 muestras). En comparación con DFAT, la sensibilidad fue entre 85,7% y 91,7% y la especificidad fue del 100%20,,21. Otra evaluación de este kit utilizando 80 muestras de cerebro animal de Africa, Europa y Oriente Medio obtuvo la concordancia completa con DFAT para la especificidad (100%) pero una mayor sensibilidad (96,9%) en comparación con los estudios anteriores22. En una reciente comparación entre laboratorios de este RIDT realizada en 22 laboratorios diferentes utilizando un panel de 10 muestras, la concordancia global fue del 99,5%23.
Sólo un estudio multicéntrico reciente mostró un rendimiento general del RID24. Se probaron muestras de tres conjuntos de datos diferentes y se proporcionaron valores variables de sensibilidad y especificidad en comparación con DFAT. Por ejemplo, la sensibilidad y especificidad obtenidas con el primer panel (n-51) y el segundo panel (n-31) de muestras de animales infectados experimentales, todas probadas en el laboratorio A, dieron una sensibilidad del 16% y del 43%, respectivamente, mientras que la especificidad fue del 100% para ambos. Por el contrario, los resultados del tercer panel (n-30) de muestras clínicas de campo analizadas por el laboratorio B proporcionaron una concordancia completa con los resultados de DFAT, que fue confirmada casi por completo por el laboratorio A (85% de sensibilidad y 100% de especificidad). Se sugirió la variación de lote a lote como una posible explicación para la sensibilidad relativamente baja fluctuante con RIDT24.
Al mismo tiempo, otro estudio realizó un proceso de validación similar al RIDT descrito anteriormente, con una modificación del protocolo14recomendado por el fabricante. El paso de pre-dilución (1:10) en PBS se omitió durante la preparación del material cerebral. Sobre la base de este protocolo modificado más simple, los autores obtuvieron sensibilidad y especificidad de 95,3% y 93,3%, respectivamente, en comparación con DFAT mediante pruebas, en condiciones de laboratorio, de un conjunto de datos de 73 muestras de cerebro animal, infectadas de forma natural o experimental con varias cepas rabV. El estudio presentó la primera evaluación de este RIDT en un entorno de campo (Chad, Africa). En 48 muestras clínicas de cerebro, la sensibilidad y especificidad fueron del 94,4% y 100%, respectivamente. Las discrepancias entre DFAT y RIDT se debieron a resultados falsos positivos con DFAT, determinados después de la confirmación con RT-PCR. Cuando se suprimieron estos resultados, hubo una concordancia completa y demostró que el RIDT era más fiable que DFAT en estas condiciones de campo14. No se observó ninguna variación de lote a lote mediante el protocolo modificado. Cuando el protocolo modificado se aplicó a un pequeño número de muestras divergentes DFAT/RIDT (n-8) en el estudio de Eggerbauer et al.24, todas fueron encontradas concordantes (100% sensibilidad).
Otra ventaja importante del RIDT es el uso secundario para la detección de ARN viral fijado en la tira utilizando técnicas moleculares (como RT-PCR) y posterior genotipado14,24. Después de un paso de extracción, Léchenne yotros 14 demostraron ARN viral fijado en la membrana del dispositivo Anigen utilizando RT-PCR con una sensibilidad del 86,3% en un panel de 51 muestras (incluidas 18 muestras probadas y enviadas desde Chad a temperatura ambiente). El genotipado posterior fue posible en el 93% de las 14 muestras analizadas. Se utilizó la secuenciación de Sanger de amplicons pcr de al menos 500 nucleótidos de longitud. Además de los aislados rabino, la prueba detectó otras cuatro especies de lissavirus, DUVV, EBLV-1, EBLV-2 y Bokeloh bat lyssavirus (BBLV), durante una prueba internacional inter-laboratorio totalmente concordante14. La sensibilidad de la detección de ARN viral fue aún mayor (100%) en el estudio de Eggerbauer et al., basado en el examen de muestras de laboratorio24. Este último estudio también demostró que el búfer utilizado en el virus inactivado del kit RIDT. De este modo, los dispositivos se pueden enviar fácilmente, a temperatura ambiente sin precauciones específicas de bioseguridad a los laboratorios de referencia, para la confirmación molecular y el genotipado.
Basándose en las evaluaciones anteriores, las herramientas RIDT ofrecen numerosas ventajas para su uso en la configuración de campo, especialmente cuando las técnicas de diagnóstico de referencia no están disponibles. Sin embargo, esta prueba también tiene algunas limitaciones, en particular, baja sensibilidad de la detección de antígenos14,24. La prueba es aplicable a muestras que contienen grandes cantidades de antígenos virales, como muestras cerebrales. Sin embargo, no es apropiado para otras muestras como saliva u otros fluidos corporales. Otro inconveniente es el costo del dispositivo (alrededor de 5-10 Euros en Europa), que es menos costoso en comparación con el costo de realizar DFAT, RT-PCR o DRIT, pero que sigue siendo alto para los LMIC. Sin embargo, el desarrollo futuro y la validación de RID similares de otras empresas podrían conducir a una disminución de los precios. Un estudio informó de variaciones de lote a lote. Aunque no son reportados por otros, los estrictos controles de calidad deben realizarse al probar un nuevo lote, como para cualquier reactivo utilizado en un entorno de gestión de calidad. El uso del protocolo modificado no se modificó cuando se utilizaron diferentes lotes14. Todos menos un estudio demostraron que la sensibilidad de RDIT era alta en comparación con DFAT (alrededor del 90%-95%). Debido a que la rabia es siempre fatal, todavía se recomienda encarecidamente confirmar cualquier resultado negativo con RDIT utilizando una prueba de diagnóstico de referencia como DFAT, DRIT o RT-PCR14.
En este manuscrito, presentamos un protocolo completo para el diagnóstico postmortem de campo de la rabia animal basado en un ejemplo de un RIDT comercializado, desde la recolección de muestras cerebrales hasta la aplicación de un protocolo modificado en comparación con las recomendaciones del fabricante (que fueron previamente validadas14) y el posterior análisis molecular. Este protocolo se aplicó y validó muchas veces en condiciones de campo en el Oeste y el Africa Central, donde el RIDT se utilizaba rutinariamente para el diagnóstico de la rabia junto con la prueba DFAT. Además, demostramos una segunda aplicación para el dispositivo, en entornos de laboratorio, para la extracción y detección utilizando RT-PCR de ARN viral fijado en el dispositivo.
Protocol
1. Recolección de muestras a través del foramen magnum (ruta occipital)25
NOTA: Esta técnica se puede implementar en condiciones de laboratorio o en entornos de campo. Las muestras deben procesarse lo antes posible después de la muerte del animal sospechoso o mantenerse a temperatura fría (refrigerada o congelada, si es posible) para evitar la descomposición que pueda afectar a los resultados. Al igual que otras técnicas de referencia basadas en la detección de antígenos de lyssavirus como DFAT y DRIT, las muestras descompuestas no deben probarse porque pueden afectar al resultado (riesgo de falso resultado negativo).
ADVERTENCIA: Todas las muestras deben considerarse potencialmente infecciosas. Las normas y procedimientos de seguridad deben seguirse estrictamente, incluso en los ajustes de campo4. En particular, use un equipo de protección personal adecuado, incluyendo máscara, gafas, guantes y una bata de laboratorio. Utilice el desinfectante adecuado para descontaminaciones de materiales y muestras (por ejemplo, hipoclorito de sodio con diluciones recomendadas del fabricante, 70% alcohol - etanol o isopropanol, 1% solución de jabón). Todo el personal que manipule muestras debe vacunarse contra la rabia.
- Retire la cabeza del animal con un cuchillo antes de la primera vértebra cervical (vértebra atlas) para acceder al foramen magnum.
NOTA: Para minimizar el aerosol infeccioso, evite utilizar una sierra manual o una herramienta similar. - Recoger la muestra de tronco encefálica (medulla oblongata) utilizando una pipeta de plástico desechable (Figura 2A), una pajita para beber ( Figura2B),una abrazadera (Figura 2C) o un cuentagotas (suministrado con el RIDT) (Figura 2D).
NOTA: Se debe prestar especial atención a la recogida de la muestra, ya que es un paso sumamente importante para la fiabilidad de los resultados. Además del vídeo asociado que muestra de una manera sencilla cómo recoger la parte del tronco encefálica de interés, un paso de entrenamiento es muy recomendable para asegurarse de recoger la sección anatómica correcta. - Opcionalmente y además del tallo cerebral (medulla oblongata), recoger otras partes del tronco encefál o el cerebro (cerebelo, hipocampo, tálamo y corteza) por la misma vía occipital empujando y girando la pipeta de plástico o paja hacia la cavidad ocular (Figura 3).
- Si utiliza una pajita o una pipeta, exprima suavemente para depositar la muestra cerebral (0,5-2 g) en un tubo para su posterior análisis y/o biobancarado.
NOTA: No se recomienda el almacenamiento de muestras en glicerol, ya que parece afectar al flujo capilar o al paso de unión de anticuerpos del RIDT18.
2. Ejecución del protocolo RIDT modificado14
NOTA: Esta modificación omite un paso de dilución (1:10) en PBS, como se especifica en el protocolo del fabricante (todas las versiones), y se puede implementar en entornos de laboratorio o de campo.
- Utilice el hisopo/gotero para recoger el equivalente de medio cacahuete o guisante (0,1-0,5 g) de material cerebral y colóquelo en el tubo de muestra tampón.
NOTA: Para el protocolo modificado, todos los reactivos/consumibles están incluidos en el kit (no se necesita PBS ni tubo adicional) (Figura 4). Documente el número de lote del kit y compruebe la validez de la fecha de caducidad. - Aplaste cuidadosamente el material cerebral directamente en el tubo con el hisopo o el gotero durante unos 30 s hasta obtener una suspensión homogénea.
NOTA: La reacción tampón inactiva la infectividad del virus en las condiciones del protocolo24del fabricante. - Con el cuentagotas, deposite cuatro gotas (aproximadamente 100 oL) de la suspensión en la entrada de la muestra en el dispositivo de prueba.
- Espere la migración completa de la muestra (1-5 min) antes de leer el dispositivo de prueba. La migración debe comenzar rápidamente después del depósito de la muestra (1-5 min).
- En caso de retraso (debido a la suspensión de alta viscosidad) o para acelerar el inicio de la migración, rasque suavemente la parte inferior del sitio de depósito del dispositivo con el cuentagotas (1-5 veces) y finalmente agregue 1-2 gotas más. La migración debe comenzar inmediatamente después.
- Lea el resultado de la prueba en la ventana de detección después de 5-10 min, y no más de 20 min, después del final de la migración.
- Interprete el resultado en función de la presencia o ausencia de la línea de control (línea C) y de la línea de prueba (línea T) (líneas púrpuras) en la ventana de detección, según la figura 5. Considere el positivo de la muestra cuando dos líneas son visibles (Figura 5A), negativas si sólo la línea C está presente ( Figura5B) y no es válida si sólo la línea T está presente o si no hay líneas visibles ( Figura5C).
NOTA: Los resultados no válidos deben repetirse al menos una vez. Se deben realizar otras técnicas si los resultados siguen siendo inválidos. Los resultados negativos obtenidos con RIDT deben confirmarse posteriormente utilizando un método de referencia estándar de oro, como DFAT, DRIT y métodos moleculares (reacción en cadena de la polimerasa o PCR). Aunque la sensibilidad de esta prueba es alta (ver resultados representativos), no es 100%. - Conservar los dispositivos usados a temperatura ambiente, o refrigerar/congelar cuando sea posible, para su posterior análisis molecular (ver sección 4). Congele la suspensión restante de la muestra a -20 oC/-80 oC en el tubo tampón para repetir la prueba si es necesario o para el análisis molecular posterior.
3. Extracción y detección de ARN por RT-qPCR desde el dispositivo RIDT
NOTA: Este paso sólo se puede implementar en condiciones de laboratorio con ambiente adaptado y equipos adecuados para el diagnóstico molecular. Se puede hacer poco después de la prueba RIDT o retrospectivamente en dispositivos RIDT archivados, almacenados a temperatura ambiente (15-30 oC), refrigerados o congelados.
- Extracción de ARN
NOTA: Para supervisar el paso de extracción, se recomienda utilizar un control interno que pueda ser un ARNm endógeno (como el de la -actina) o un control exógeno (como el ARN sintético eGFP) directamente pinchado en la muestra durante los primeros pasos de la extracción26,,27.- Abra cuidadosamente el dispositivo y retire el papel de filtro.
- Cortar el área de depósito de la muestra y colocarla en un tubo que contenga 1 ml de Tri-Reagent LS. Incubar a RT durante 1 hora con agitación manual regular suave.
- Realizar la extracción de acuerdo con las recomendaciones del fabricante, como se describió anteriormente27. En este paso, se puede agregar el control interno exógeno.
- Durante el proceso, añadir 2 l de glucógeno para facilitar la precipitación de ARN, de acuerdo con las recomendaciones del fabricante.
- Ajuste el volumen final para la resuspensión de ARN en agua sin nucleasas, con un volumen de 50 l generalmente utilizado.
NOTA: Al final del paso de centrifugación para la separación de fase acuosa y orgánica (después de la adición de 200 l de cloroformo en el Tri-Reagente LS), la pieza de membrana del dispositivo estará en la parte inferior del tubo y no interferirá con la recolección de la fase acuosa superior. Alternativamente, se pueden utilizar otros protocolos fáciles y rápidos, por ejemplo, utilizando reactivos a base de fenol y membranas de sílice28.
- Detección por RT-qPCR26
NOTA: La detección de ARN viral potencial presente en muestras extraídas se puede realizar utilizando diferentes técnicas moleculares, como PCR de transcripción inversa, PCR convencional (punto final) o PCR en tiempo real (qPCR). Existen varios métodos disponibles, como el RT-PCR27convencional,el 29 o el RT-qPCR26,,el 30 dirigido a la nucleoproteína viral o al gen de la polimerasa. A continuación se presentará un ejemplo basado en un doble pan-lisovirus combinado RT-qPCR dirigido a una región conservada entre la polimerasa viral. Esta técnica RT-qPCR asocia dos RT-qPCR diferentes: uno basado en la tecnología de sonda TaqMan (pan-RABV RT-qPCR) y el otro utilizando la detección verde SyBR (pan-lyssa RT-qPCR). Además, la detección de un control interno exógeno (ARN eGFP) directamente pinchado durante el proceso de extracción se realiza mediante un RT-qPCR específico basado en sondas TaqMan (eGFP RT-qPCR). Es importante, en particular, comprobar que las imprimaciones y sondas para RT-PCR en tiempo real están adaptadas para la detección de las cepas que circulan en la región de interés4.- Diluir la muestra de ARN a 1:10 en agua libre de nucleasas. Pruebe cada muestra de ARN por duplicado, utilizando una placa de reacción de 96 pozos u otros formatos. Utilice controles positivos y negativos para cada ensayo y pruebe al menos por duplicado.
- Prepare la solución de reacción de mezcla maestra para los tres ensayos RT-qPCR diferentes según la Tabla 1y con las imprimaciones/sondas indicadas en la Tabla 2.
- Añadir 5 l de muestras de ARN diluido y 15 ml de mezcla maestra a cada uno de los tres ensayos diferentes. El ensayo pan-RABV RT-qPCR y el ensayo eGFP RT-qPCR pueden entrar en la misma placa.
- Ejecute los diferentes ensayos siguiendo las condiciones de ciclo térmico indicadas en la Tabla 3. Si sólo hay disponible un ciclor térmico PCR, comience con el pan-RABV RT-qPCR y mantenga la placa para la pan-lyssa RT-qPCR a 4 oC hasta el final del pan-RABV RT-qPCR.
- Analizar los resultados obtenidos con los tres ensayos según la Tabla 4.
4. Genotipado después de la extracción de ARN del dispositivo RIDT
- Transcripción inversa RT27,29
- Preparar una mezcla maestra con 6 l de ARN, 2 sl de imprimaciones aleatorias pd(N)6 (200 g/l) y 2 ml de agua libre de nucleasas para un volumen final de 10 l.
- Incubar a 65oC durante 10 minutos en un bloque térmico y luego almacenar sobre hielo.
- Preparar una mezcla maestra con 6 l de 5x First-Strand Buffer, 2 l de ditiotrothreitol de 0,1 M (DT), 1 l (200 U) de la transcriptasa inversa Superíndice II, 2 l (80 U) de arnés, 2 l de mezcla de dNTP (10 oM) y completa con agua sin nucleas para obtener un volumen final de 20 l para cada muestra.
- Añadir la mezcla maestra (20 l) a la muestra (10 l) (volumen final de 30 l) e incubar a 42 oC durante 90 min en un bloque térmico.
- Continúe con el siguiente paso con la amplificación de PCR o almacene el cDNA a -20 oC.
- PCR convencional27,29,31
NOTA: Diferentes técnicas de PCR convencional están disponibles para el genotipado. Se presentan dos, ambos PCR anidados hemi, dirigidos a una parte de la nucleoproteína o una parte de la proteína viral del lissavirus. El protocolo es el mismo para cada uno de estos ensayos, excepto para las primeras y las condiciones de ciclismo. En cada serie y en cada ronda de PCR deben incluirse controles positivos (ARN positivo) y negativos (ADNr negativos y/o agua sin nucleasas).- Preparar para cada muestra en un microtubo de 0,2 ml una solución de reacción de mezcla maestra para el primer paso de PCR. Esta mezcla contiene 5 l de 10x Tampón de reacción NH4, 2,5 l de solución de MgCl2 (50 mM), 1 l de mezcla de dNTP (10 m), 1 l de cada imprimación (10 mM), 0,2 l (1 U) de biotaq DNA polymerasa y 37,3 l de agua libre de nucleas (volumen final de 48 oL). Las imprimaciones se indican en el Cuadro 5.
- Añadir 2 l de ADNc en cada tubo y ciclo en un ciclo térmico de PCR convencional separado para cada ensayo, de acuerdo con la Tabla 6.
- Preparar una segunda solución de reacción de mezcla maestra idéntica a la anterior con el uso de las imprimaciones apropiadas (Tabla 5) para la reacción de PCR hemi-anidado.
- Añada 2 l del producto PCR de primera ronda y circule en un ciclor térmico de PCR convencional utilizando los parámetros de ciclo indicados en la Tabla 6.
- Visualizar los diferentes productos de PCR (PCR de primera y segunda ronda) después de cargarlos en un gel de agarosa del 1% (100 ml de tampón EDTA de tris-acetato 1x - TAE 1x) con bromuro de etidio (concentración final alrededor de 0,01%) y ejecutar el gel durante 30 min a 120 V. Se observa un resultado positivo de la PCR en forma de una banda brillante del tamaño esperado (Tabla 5).
- Secuenciación de Sanger
- Realizar una secuenciación Sanger de los amplicons obtenidos con el PCR hemi-anidado pan-lyssavirus y completar el análisis de genotipado.
Representative Results
Al igual que con cualquier método de diagnóstico, la recopilación de muestras es de suma importancia para la confiabilidad de los resultados, especialmente cuando se realiza en la configuración de campo. El proceso de recogida debe ser lo más sencillo posible para garantizar la recogida de muestras de alta calidad. La recolección de una biopsia cerebral (tronco cerebral con médula oblongata) a través de la ruta foramen magnum para el diagnóstico postmortem de la rabia animal cumple este requisito, como se indica en la Figura 2A-D25.
Después de la recolección, la muestra cerebral se envía al protocolo modificado del RIDT, resumido en la Figura 6. Como se indica en la sección Protocolo, la principal adaptación del protocolo proporcionado por el fabricante es la omisión del paso de dilución en PBS, que simplifica el procedimiento y los consumibles/reactivos necesarios, incluidos así en el kit (Figura 4).
Este protocolo modificado se implementó y evaluó en cinco laboratorios diferentes, incluido un centro de colaboración de la OMS sobre rabia (Lab 1, Francia), un centro de referencia de la FAO para la rabia (Lab 5, Italia) y tres laboratorios de referencia ubicados en países africanos enzoóticos, Chad (Lab 2), Costa de Marfil (Lab 3) y Malí (Lab 4). En Chad, se realizó una evaluación del RIDT tanto en el laboratorio como en el de campo.
En comparación con la técnica de referencia DFAT, la sensibilidad y especificidad del RDIT fueron altas para todos los laboratorios, con 96% a 100% y 93,7% a 100%, respectivamente (Tabla 7). La sensibilidad y especificidad más bajas del RDIT se obtuvo para el laboratorio 1 (Francia) durante la etapa de validación del laboratorio. Sobre la base del número acumulado de muestras analizadas (n-162)(Tabla complementaria 1),la sensibilidad global y la especificidad en comparación con el DFAT fueron del 98,2 % y del 95,8%, respectivamente(Tabla 7). Sin embargo, estos resultados preliminares pero prometedores se obtuvieron en un conjunto de datos de muestra limitado y deben confirmarse aún más en un gran número de muestras positivas y negativas, especialmente para las analizadas en áreas enzoóticas, para evitar cualquier posible subestimación o sesgo debido a los conjuntos de datos heterogéneos actuales.
La prueba RIDT es adecuada para detectar el lyssavirus en biopsias cerebrales de animales infectados, donde el nivel de antígenos de lyssavirus es importante. Sin embargo, el límite de prueba de detección sigue siendo alto al probar la suspensión del virus valorado(Tabla 8; Figura 7).
La Tabla 9 (de Léchenne 201614) muestra un ejemplo de los resultados obtenidos después de la detección de ARN por el pan-lisovirus combinado dual RT-qPCR dirigido a la polimerasa viral del lyssavirus. Se probó un panel de 51 pruebas positivas de RIDT realizadas en condiciones de laboratorio (Lab 1, n-32) o en Chad (Lab 2, n-19) y luego se envió a temperatura ambiente al Laboratorio 1. Se obtuvo detección positiva para 18 (94,7%), 26 (81,2%) y 44 (86,3%) muestras del Laboratorio 1, Lab 2 y las dos combinadas, respectivamente. Además, se realizó el genotipado de 14 de estas muestras (10 del laboratorio 1 y 4 del laboratorio 2) utilizando el PCR anidado de hemi dirigido al gen de la nucleoproteína parcial y tuvo éxito para 13 de ellas (93%) (de Léchenne et al. 201614).
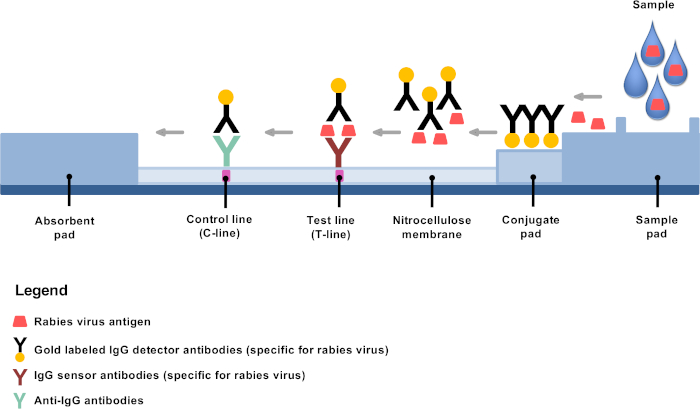
Figura 1: Representación esquemática de la estructura de un RIDT para el diagnóstico de la rabia. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Ejemplos de técnicas rápidas y sencillas para la recolección de muestras cerebrales (tronco cerebral con médula oblongata) en animales (perro mostrado aquí) a través del foramen occipital en entornos de campo (Malí). (A) Colección con pipeta de plástico desechable (B) Colección con una colección de plástico para beber (C) Con una abrazadera (D) Colección con el gotero de eliminación incluido en el kit RIDT. Haga clic aquí para ver una versión más grande de esta figura.
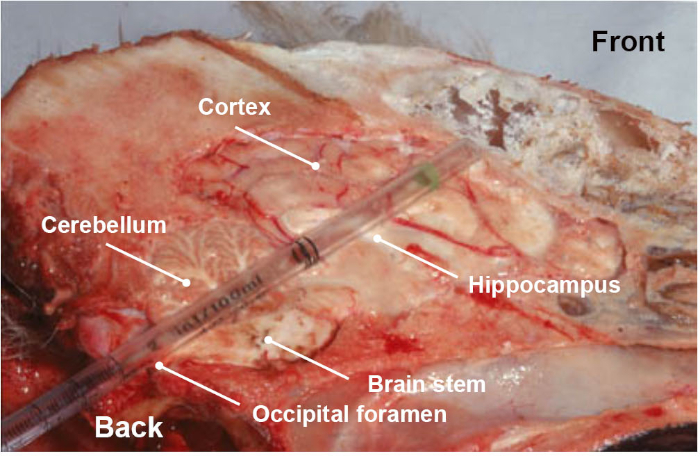
Figura 3: Sección anatómica longitudinal de la cabeza del perro, que muestra las diferentes partes del cerebro (tronco cerebral, cerebelo, hipocampo, tálamo y corteza) recogidos al empujar, en un movimiento rotacional, una pipeta de plástico desechable a través de la ruta del foramen occipital. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Descripción del contenido del kit RIDT, incluido el dispositivo, un gotero de plástico desechable, un hisopo desechable y el diluyente del ensayo. No se proporciona el tubo donde se recogerá y almacenará la muestra. Haga clic aquí para ver una versión más grande de esta figura.
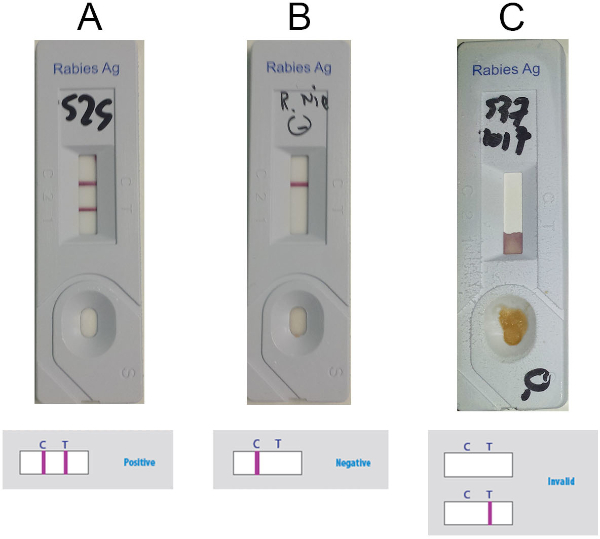
Figura 5: Resultados representativos para la interpretación del RIDT de Anigen. (A) Resultados positivos (presencia visible de dos líneas, línea C y línea T) (B) Resultados negativos (presencia visible de la línea C solamente) (C) Resultados no válidos (ausencia de línea C visible). Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Representación esquemática del protocolo RIDT, adaptada a partir de las instrucciones del fabricante. (A) Versión modificada del protocolo, con eliminación del paso de dilución recomendado por el fabricante (B) Protocolo inicial recomendado por el fabricante, con un paso de dilución anterior a 1:10 en PBS de las muestras cerebrales. Los pasos eliminados en la versión modificada del protocolo (presentados en el cuadro 6A) se indican con una línea roja. Haga clic aquí para ver una versión más grande de esta figura.
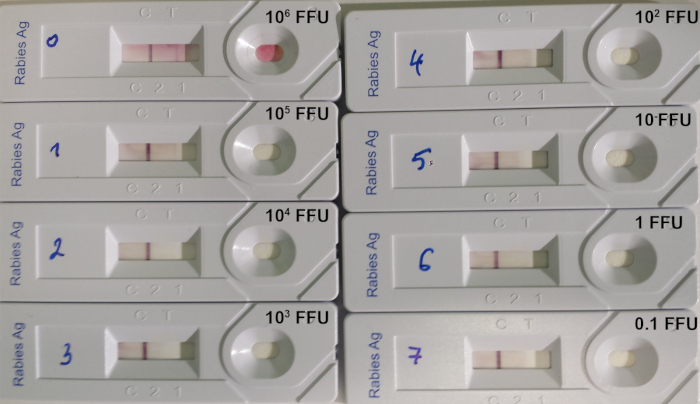
Figura 7: Ejemplo de determinación del límite de detección de RIDT14. Se utilizó una dilución en serie 10:1 de un virus de la rabia valorado de la cepa 9704ARG. La cantidad de virus depositados en cada dispositivo se indica en FFU (unidades fluorescentes de formación de enfoque). Haga clic aquí para ver una versión más grande de esta figura.
| Ensayo Pan-RABV RT-qPCR | |
| Reactivo | L/Reacción |
| 2X Reaction Mix (un búfer que contiene 0,4 mM de cada dNTP y 6 mM MgSO4) | 10 |
| Agua libre de nucleasas | 1.5 |
| Taq3long (Adelante) [10 M] | 1 |
| Taq17revlong (Invertir) [10 m] | 1 |
| RABV4 [10 m] | 0.3 |
| RABV5 [10 m] | 0.3 |
| MgSO4 [50-mM] (incluido en el kit) | 0.25 |
| Tinte de referencia ROX (25 m) (incluido en el kit) | 0.05 |
| RNasin (40U/L) (Promega) | 0.2 |
| SuperScript III RT/Platinum Taq Mix | 0.4 |
| Total por reacción | 15 |
| Ensayo eGFP RT-qPCR | |
| Reactivo | L/Reacción |
| 2X Reaction Mix (un búfer que contiene 0,4 mM de cada dNTP y 6 mM MgSO4) | 10 |
| Agua libre de nucleasas | 2.8 |
| EGFP1F (Adelante) [10 M] | 0.5 |
| EGFP2R (Inverso) [10 M] | 0.5 |
| Sonda eGFP [10 m] | 0.3 |
| MgSO4 [50-mM] (incluido en el kit) | 0.25 |
| Tinte de referencia ROX (25 m) (incluido en el kit) | 0.05 |
| RNasin (40U/L) (Promega) | 0.2 |
| SuperScript III RT/Platinum Taq Mix | 0.4 |
| Total por reacción | 15 |
| Ensayo Pan-lyssa RT-qPCR | |
| Reactivo | L/Reacción |
| 2x mezcla de reacción verde SYBR | 10 |
| Agua libre de nucleasas | 2.1 |
| Taq5long (Adelante) [10 M] | 1 |
| Taq16revlong (Invertir) [10 m] | 1 |
| MgSO4 [50-mM] (incluido en el kit) | 0.25 |
| Tinte de referencia ROX (25 m) | 0.05 |
| RNasin (40U/L) (Promega) | 0.2 |
| SuperScript III RT/Platinum Taq Mix | 0.4 |
| Total por reacción | 15 |
Tabla 1: Descripción de la solución de reacción de mezcla maestra para los tres ensayos RT-qPCR diferentes (pan-RABV RT-qPCR, pan-lyssa RT-qPCR y eGFP RT-qPCR).
| Ensayo RT-qPCR | Nombre | Tipo | Longitud | Secuencia (5'-3') | Sentido | Posición |
| ensayo pan-RABV RT-qPCR | Taq3long | Cartilla | 22 | ATG AGA AGT GGA AYA AYC ATC A | S | 7273-7294a |
| Taq17revlong | Cartilla | 25 | GAT CTG TCT GAA TAA TAG AYC CAR G | Como | 7390-7414a | |
| RABV4 | Sonda (FAM/TAMRA) | 29 | AAC ACY TGA TCB AGK ACA GAR AAY ACA TC | Como | 7314-7342a | |
| RABV5 | Sonda (FAM/TAMRA) | 32 | AGR GTG TTT TCY AGR ACW CAY GAG TTT TTY CA | S | 7353-7384a | |
| Ensayo Pan-lyssa RT-qPCR | Taq5long | Cartilla | 23 | TAT GAG AAA TGG AAC AAY CAY CA | S | 7272-7294a |
| Taq16revlong | Cartilla | 25 | GAT TTT TGA AAG AAC TCA TGK GTY C | Como | 7366-7390a | |
| Ensayo eGFP RT-qPCR | EGFP1F | Cartilla | 20 | GAC CAC TAC CAG CAG AAC AC | S | 637-656b |
| EGFP2R | Cartilla | 19 | GAA CTC CAG CAG GAC CAT G | Como | 768-750b | |
| EGFP | Sonda (FAM/TAMRA) | 22 | AGC ACC CAG TCC GCC CTG AGC A | S | 703-724b |
Tabla 2: Descripción de las imprimaciones/sondas para los tres ensayos RT-qPCR diferentes (pan-RABV RT-qPCR, pan-lyssa RT-qPCR y eGFP RT-qPCR). a Según la secuencia del genoma rabV del virus Pasteur (PV) (número de adhesión de GenBank M13215). b Según la secuencia pEGFP-1 del vector de clonación (número de adhesión de GenBank U55761).
| Ensayos Pan-RABV RT-qPCR y eGFP RT-qPCR | ||||
| Paso | Ciclo | Temp | Hora | Recopilación de datos |
| Transcripción inversa | 1 | 45 oC | 15 min | |
| Inactivación RT/desnaturalización inicial | 1 | 95 oC | 3 min | |
| Amplificación | 40 | 95 oC | 15 s | |
| 61 oC | 1 min | Punto final | ||
| Ensayo Pan-lyssa RT-qPCR | ||||
| Paso | Ciclo | Temp | Hora | Recopilación de datos |
| Transcripción inversa | 1 | 45 oC | 15 min | |
| Inactivación RT/desnaturalización inicial | 1 | 95 oC | 3 min | |
| Amplificación | 40 | 95 oC | 15 s | |
| 55 oC | 1 min | Punto final | ||
| Curva de disociación | 1 | 95 oC | 15 s | Aumentar 0,1 oC/s, de 55 a 95 oC |
| 55 oC | 1 min | |||
| 95 oC | 15 s | |||
| 55 oC | 15 s | |||
Tabla 3: Descripción de las condiciones de ciclo térmico para los tres ensayos RT-qPCR diferentes (pan-RABV RT-qPCR, pan-lyssa RT-qPCR y eGFP RT-qPCR).
| Ensayo | Análisis | Resultados | Interpretación |
| eGFP RT-qPCR | Cq en el intervalo de aceptación | Extracción validada | El análisis de otros ensayos se puede hacer |
| Cq fuera del intervalo de aceptación | Extracción no validada | Vuelva a probar la muestra (repetir la ejecución o/y la extracción), solicite otra muestra si es necesario | |
| pan-RABV RT-qPCR | Cq <38 | Positivo | Detección positiva de ARN viral |
| Cq 38 | Negativo | Análisis del ensayo pan-lyssa RT-qPCR | |
| pan-lyssa RT-qPCR | Curva de fusión considerada positiva | Positivo | Detección positiva de ARN viral |
| Curva de fusión considerada negativa | Negativo | Ausencia de detección de ARN viral |
Tabla 4: Interpretación general del ensayo de doble pan-lyssavirus RT-qPCR combinado.
| Ensayo de PCR convencional anidado por Hemi | Ronda de PCR | Nombre | Longitud | Secuencia (5'-3') | Sentido | Posicióna | Tamaño del amplificador (bp) |
| PCR anidado de Hemi dirigido al gen de la polimerasa | 1a ronda | PVO5m | 20 | ATG ACA GAC AAY YTG AAC AA | S | 7170-7189 | 320 |
| PVO9 | 19 | TGA CCA TTC CAR CAR GTN G | Como | 7471-7489 | |||
| 2a ronda | PVO5m | 20 | ATGA CAG ACA AYY TGA ACA AA | S | 7170-7189 | 250 | |
| PVO8 | 22 | GGT CTG ATC TRT CWG ARY AAT AA | Como | 7398-7419 | |||
| PCR anidado de Hemi dirigido al gen de la nucleoproteína | 1a ronda | N127 | 20 | ATG TAA CAC CTC TAC AAT GG | S | 55-74 | 1532 |
| N8m | 19 | CAG TCT CYT CNG CCA TCT C | Como | 1568-1586 | |||
| 2a ronda | N127 | 20 | ATG TAA CAC CTC TAC AAT GG | S | 55-74 | 845 | |
| N829 | 19 | GCC CTG GTT CGA ACA TTC T | Como | 881-899 |
Tabla 5: Descripción de las imprimaciones utilizadas para el PCR anidado hemi convencional.
| PCR anidado de Hemi dirigido al gen de la polimerasa | ||||
| Paso | Ciclo | Temperatura | Hora | |
| Primera y segunda rondas | Desnaturalización inicial | 1 | 94 oC | 3 min |
| Desnaturalización | 35 | 94 oC | 30 s | |
| Hibridación | 56 oC | 45 s | ||
| Alargamiento | 72 oC | 40 s | ||
| Elongación final | 1 | 72 oC | 3 min | |
| PCR anidado de Hemi dirigido al gen de la nucleoproteína | ||||
| Paso | Ciclo | Temperatura | Hora | |
| Primera ronda | Desnaturalización inicial | 1 | 94 oC | 3 min |
| Desnaturalización | 35 | 94 oC | 30 s | |
| Hibridación | 56 oC | 30 s | ||
| Alargamiento | 72 oC | 45 s | ||
| Elongación final | 1 | 72 oC | 3 min | |
| Segunda ronda | Desnaturalización inicial | 1 | 94 oC | 3 min |
| Desnaturalización | 35 | 94 oC | 30 s | |
| Hibridación | 58 oC | 30 s | ||
| Alargamiento | 72 oC | 30 s | ||
| Elongación final | 1 | 72 oC | 3 min | |
Tabla 6: Descripción de las condiciones de ciclo térmico para el PCR anidado hemi convencional.
| Laboratorio | País | Período de evaluación | Nb de muestras | Resultados de DFAT | Resultados de RIDT | Sensibilidad | Especificidad | ||
| Pos | Neg | Pos | Neg | ||||||
| Laboratorio 1 | Francia | 2015 | 82 | 50 | 32 | 50 | 32 | 96% | 93.7% |
| Laboratorio 2 | Chad | 2012-2015 | 44 | 33 | 11 | 33 | 11 | 100% | 100% |
| Laboratorio 3 | Costa de Marfil | 2017 | 10 | 8 | 2 | 8 | 2 | 100% | 100% |
| Laboratorio 4 | Malí | 2017 | 18 | 15 | 3 | 15 | 3 | 100% | 100% |
| Laboratorio 6 | Italia | 2016 | 8 | 8 | 0 | 8 | 0 | 100% | - |
| todo | 2015-2017 | 162 | 114 | 48 | 114 | 48 | 98.2% | 95.8% | |
Cuadro 7: Determinación de los parámetros intrínsecos (sensibilidad, especificidad) de la prueba RIDT en comparación con el método DFAT de referencia, basado en el análisis de un total de 162 muestras y con la participación de 5 laboratorios diferentes.
| Elvirus | Anfitrión original | Ubicación | Concentración inicial (FFU/mL)b | Límite de detección (FFU/mL)c |
| 9147FRA | Zorro rojo | Francia | 3.1 x 107 | 106 |
| Cvs | Aislado de laboratorio | - | 1,6 x 107 | 106 |
| 8743THA | Humano | Tailandia | 8.1 x 107 | > 8,1 x 106 |
| 9508CZK (SAD) | Aislado de laboratorio | - | 5.4 x 108 | 107 |
| Pv | Aislado de laboratorio | - | 4,3 x 107 | 106 |
| 9001FRA | Perro | Guayana Francesa | 2.4 x 106 | > 2,4 x 105 |
| 9704ARG | Bate | Argentina | 9,5 x 107 | 105 |
| 04030PHI | Humano | Filipinas | 2,5 x 107 | 105 |
Tabla 8: Límite de detección del RIDT utilizando 8 suspensiones diferentes de virus de rabia valorados (de Léchenne et al. 201614). a CVS: Desafía la cepa del virus, SAD: Street Alabama Dufferin, PV: Virus Pasteur. b Número de unidades fluorescentes de formación de enfoque (FFU) por ml. c Número de unidades fluorescentes de formación de enfoque (FFU) depositadas en la tira.
| RIDT realizado en | ||||||||||
| Laboratorio 1 | Laboratorio 2 | Combinado | ||||||||
| Positivo | Negativo | Total | Positivo | Negativo | Total | Positivo | Negativo | Total | ||
| Detección de ARN viral | Positivo | 18 | 1 | 19 | 26 | 0 | 32 | 44 | 7 | 51 |
| Negativo | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 3 | 3 | |
| Total | 18 | 1 | 19 | 26 | 0 | 35 | 44 | 10 | 54 | |
Tabla 9: Detección de ARN viral con RT-qPCR en la tira reactiva de Anigen utilizada en condiciones de laboratorio (Lab 1), en condiciones de campo y enviada a temperatura ambiente (Lab 2) o combinada (de Léchenne et al. 201614).
Tabla complementaria 1: Descripción de las 162 muestras analizadas con la prueba RIDT para determinar sus parámetros intrínsecos presentados en el Cuadro 7. Haga clic aquí para ver esta tabla (Haga clic con el botón derecho para descargar).
Discussion
El RIDT es un método simple, rápido y de bajo costo para el diagnóstico postmortem de rabia y una alternativa de campo prometedor a las pruebas de laboratorio. La aplicación de esta prueba, especialmente para las zonas descentralizadas de los países de ingresos bajos y medianos, mejoraría la comprensión de la prevalencia y transmisión del virus de la rabia a escala local y potencialmente nacional. Cuando se combina con el método de recolección rápida de muestras cerebrales (sin necropsía completa), una gran ventaja es que la prueba se puede realizar completamente en el entorno de campo, lejos de las instalaciones de laboratorio. Las muestras cerebrales recogidas a través del foramen magnum se pueden utilizar para las pruebas, por lo que no es necesario abrir completamente el cráneo del animal. La prueba es fácil de realizar e interpretar y es especialmente adecuada para las actividades de vigilancia sobre el terreno14. Otras ventajas del RIDT sobre el DFAT o DRIT son la necesidad de controles positivos y negativos y almacenamiento del kit a temperatura ambiente. Además, el protocolo modificado, donde se omite el paso de dilución (1:10) en PBS, no requiere reactivos adicionales para realizar la prueba y simplifica aún más el procedimiento en condiciones de campo.
Un punto clave es la calidad de las muestras cerebrales. Las muestras deben recogerse y analizarse tan pronto como sea posible después de la muerte del animal sospechoso, o mantenerse a temperatura fría antes de la prueba, para evitar la degradación. Las muestras descompuestas no deben probarse porque pueden afectar al resultado (riesgo de falso resultado negativo). Aunque todavía no hay datos disponibles sobre la pérdida de sensibilidad del RIDT a lo largo del tiempo para las muestras cerebrales, hipotetlamos que es similar en comparación con la pruebaDFAT 32. Sin embargo, el tiempo entre la muerte del animal y la realización de la prueba se puede reducir, ya que la prueba se puede hacer de forma rápida y directa en el campo. Por lo tanto, en general existe un menor riesgo de muestras descompuestas.
Otro paso crítico dentro del protocolo es la migración de suspensión de ejemplo. La migración debe comenzar directamente después del depósito de la muestra (1-5 min). Por lo tanto, la alta viscosidad de la suspensión podría influir negativamente en la migración. Rascar suavemente la parte inferior del sitio de depósito del dispositivo con el cuentagotas y agregar 1-2 gotas más a menudo resuelve este problema, y la migración comienza inmediatamente después.
La mayoría de las pruebas de RIDT realizadas en laboratorios africanos (Chad, Costa de Marfil y Malí) se realizaron a temperatura ambiente que puede superar los 30 oC, mientras que el rango de temperatura para el almacenamiento y uso recomendado por el fabricante es de 15 oC a 30 oC. Aunque no identificamos ningún impacto de alta temperatura en el rendimiento de las pruebas RIDT, es necesario evaluarlo más cuidadosamente. Del mismo modo, el impacto de la alta temperatura durante el almacenamiento y el transporte del dispositivo después de su uso para la detección de ARN viral y el genotipado necesita una evaluación adicional. La sensibilidad de la detección de ARN viral por RT-qPCR de la tira RIDT puede verse afectada por la calidad de la muestra cerebral utilizada inicialmente en la prueba, pero también por la condición de almacenamiento de las pruebas RIDT después de su uso. Por ejemplo, la sensibilidad de la detección de ARN fue mayor cuando las pruebas RIDT utilizadas se almacenaron en condiciones de laboratorio controladas (94,7%) en comparación con las condiciones de campo (por ejemplo, Chad) (81,2%)14. Estas condiciones también pueden afectar a la integridad (especialmente la longitud) del ARN fijado en la tira, posiblemente explicando la sensibilidad moderada para el genotipado basado en amplicons PCR más largos (por ejemplo, >500 nucleótidos)14. La sensibilidad de RT-qPCR realizada en la tira de prueba fue inferior a la obtenida utilizando tarjetas Whatman de TLC (80,6%)14. Al igual que otras técnicas moleculares, la carga viral también puede afectar el éxito del genotipado basado en tiras RDIT, con resultados negativos potenciales para muestras con baja carga viral14.
La OMS y la OIE no recomiendan actualmente la prueba para el diagnóstico rutinario y la vigilancia de la enfermedad, y el resultado no puede utilizarse por sí solo para guiar la toma de decisiones sobre la PEP. Todavía se necesita una validación de prueba adicional. Sin embargo, un diagnóstico rápido y preciso de la rabia es un elemento crucial de los sistemas continuos de vigilancia de la rabia que funcionan bien y es fundamental para aumentar el compromiso político, que es eminentemente importante para el control sostenible de la rabia33. Las pruebas RIDT ofrecen nuevas oportunidades de diagnóstico de la rabia en este contexto y son una herramienta útil para ampliar la vigilancia de la rabia animal en el campo en las zonas enzoóticas de ingresos bajos o medianos.
Acknowledgements
Este trabajo fue apoyado a través de la Alianza Mundial para las Vacunas y la Inmunización (GAVI), la Fundación Wolfermann N'geli, la Cooperación Africana de Investigación (SARECO), el SWF Stiftung f'r wissenschaftliche Forschung, la Freiwillige Akademische Gesellschaft (FAG) Basel, el Programa Bilateral de Cooperación Científica y Tecnológica de Suiza con Asia y la Fundación Novartis para la investigación biomédica.
Agradecemos especialmente a los dueños de perros, el personal veterinario y el personal del laboratorio por su gran compromiso. También queremos reconocer a Lisa Crump por la edición de idiomas.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-Rabies Nucleocapsid Conjugate (lyophilizied, adsorbed) | Bio-Rad, France | 3572112 | Fluorescein-5-isothiocyanate (FITC) conjugated polyclonal antibody against the nucleocapsid of rabies virus. Use for the DFAT reference tecnnique. |
| Applied Biosystems 7500 Real-Time PCR System | Applied Biosystems, France | 4351104 | Amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| Disposable plastic pipette, drinking straw, clamp, dropper | - | - | Equipment used for the collection of the brain stem (medulla oblongata) via the foramen magnus (occipital route). |
| Evans Blue Solution 1% | Bio-Rad, France | 3574911 | Counter-coloration used for the DFAT to facilite the reading under UV microscope. |
| Primer eGFPF1 | Eurofins Genomics, Germany | - | Forward primer for the amplification of the internal control eGFP by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-GACCACTACCAGCAGAACAC-3'. |
| Primer eGFPR2 | Eurofins Genomics, Germany | - | Reverse primer for the amplification of the internal control eGFP by RT-qPCR after extraction from the RIDT device, sequence: 5'-GAACTCCAGCAGGACCATG-3'. |
| Primer Taq17 revlong | Eurofins Genomics, Germany | - | Reverse primer for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-ATGAGAAGTGG AAYAAYCATCA-3'. |
| Primer Taq3 long | Eurofins Genomics, Germany | - | Forward primer for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-GATCTGTCTGAA TAATAGAYCCARG-3'. |
| Probe eGFP FAM/TAMRA | Eurofins Genomics, Germany | - | Forward primer for the amplification of the internal control by RT-qPCR after extraction from the RIDT device, sequence: 5'-AGCACCCAGT CCGCCCTGAGCA-3'. |
| Probe RABV4 FAM/TAMRA | Eurofins Genomics, Germany | - | Probe for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-AACACYTGATCBA GKACAGARAAYACATC-3'. |
| Probe RABV5 FAM/TAMRA | Eurofins Genomics, Germany | - | Probe for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-AGRGTGTTTTCYAG RACWCAYGAGTTTTTYCA-3'. |
| Rapid Rabies Ag Test Kit | BioNote Inc., Republic of Korea | RG18-01DD | Rapid immunochromatographic diagnostic test (RIDT, also named lateral flow device or LFD) for the post-mortem diagnosis of rabies. |
| Recombinant RNasin Ribonuclease Inhibitor | Promega, USA | N2515 | Enzyme used with the kit for the amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| SuperScript III Platinum One-Step qRT-PCR Kit | Invitrogen, France | 11732-020 | Kit for the amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| TRIzol Reagent | Invitrogen, France | 15596026 | Phenol/chloroforme based total RNA extraction using the cellulose membrane of the RIDT. |
References
- Hampson, K., et al. Correction: Estimating the Global Burden of Endemic Canine Rabies. PLoS Neglected Tropical Diseases. 9 (5), e0003786 (2015).
- Rupprecht, C., Kuzmin, I., Meslin, F. Lyssaviruses and rabies: current conundrums, concerns, contradictions and controversies. F1000Research. 6, 184 (2017).
- Walker, P. J., et al. ICTV Virus Taxonomy Profile: Rhabdoviridae. The Journal of General Virology. 99 (4), 447-448 (2018).
- World Health Organization (WHO). WHO Expert Consultation on Rabies, third report. HO Technical Report Series, No. 1012. , (2018).
- Dacheux, L., et al. More Accurate Insight into the Incidence of Human Rabies in Developing Countries through Validated Laboratory Techniques. PLoS Neglected Tropical Diseases. 4 (11), e765 (2010).
- Welburn, S. C., Beange, I., Ducrotoy, M. J., Okello, A. L. The Neglected Zoonoses - The Case for Integrated Control and Advocacy. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. , (2015).
- Dacheux, L., Bourhy, H. Diagnostic tests for human rabies. Revue Scientifique Et Technique (International Office of Epizootics). 37 (2), 581-593 (2018).
- Kasempimolporn, S., Saengseesom, W., Lumlertdacha, B., Sitprija, V. Detection of rabies virus antigen in dog saliva using a latex agglutination test. Journal of Clinical Microbiology. 38 (8), 3098-3099 (2000).
- Kang, B., et al. Evaluation of a rapid immunodiagnostic test kit for rabies virus. Journal of Virological Methods. 145 (1), 30-36 (2007).
- Nishizono, A., et al. A simple and rapid immunochromatographic test kit for rabies diagnosis. Microbiology and Immunology. 52 (4), 243-249 (2008).
- Kasempimolporn, S., Saengseesom, W., Huadsakul, S., Boonchang, S., Sitprija, V. Evaluation of a rapid immunochromatographic test strip for detection of Rabies virus in dog saliva samples. Journal of Veterinary Diagnostic Investigation: Official Publication of the American Association of Veterinary Laboratory Diagnosticians, Inc. 23 (6), 1197-1201 (2011).
- Ahmed, K., et al. Evaluation of a monoclonal antibody-based rapid immunochromatographic test for direct detection of rabies virus in the brain of humans and animals. The American Journal of Tropical Medicine and Hygiene. 86 (4), 736-740 (2012).
- Léchenne, M., et al. Validation of a Rapid Rabies Diagnostic Tool for Field Surveillance in Developing Countries. PLoS Neglected Tropical Diseases. 10 (10), e0005010 (2016).
- Yang, D. K., et al. Comparison of four diagnostic methods for detecting rabies viruses circulating in Korea. Journal of Veterinary Science. 13 (1), 43-48 (2012).
- Markotter, W., et al. Evaluation of a rapid immunodiagnostic test kit for detection of African lyssaviruses from brain material. The Onderstepoort Journal of Veterinary Research. 76 (2), 257-262 (2009).
- Reta, T., et al. Evaluation of Rapid Immunodiagnostic Test for Rabies Diagnosis Using Clinical Brain Samples in Ethiopia. Journal of Veterinary Science & Medical Diagnosis. 2 (3), 1-3 (2013).
- Servat, A., Picard-Meyer, E., Robardet, E., Muzniece, Z., Must, K., Cliquet, F. Evaluation of a Rapid Immunochromatographic Diagnostic Test for the detection of rabies from brain material of European mammals. Biologicals: Journal of the International Association of Biological Standardization. 40 (1), 61-66 (2012).
- Certoma, A., et al. Assessment of a Rabies Virus Rapid Diagnostic Test for the Detection of Australian Bat Lyssavirus. Tropical Medicine and Infectious Disease. 3 (4), (2018).
- Ahmad, A., Singh, C. K. Comparison of rapid immunodiagnosis assay kit with molecular and immunopathological approaches for diagnosis of rabies in cattle. Veterinary World. 9 (1), 107-112 (2016).
- Sharma, P., Singh, C. K., Narang, D. Comparison of immunochromatographic diagnostic test with Hheminested Reverse transcriptase polymerase chain reaction for detection of rabies virus from brain samples of various species. Veterinary World. 8 (2), 135-138 (2015).
- Voehl, K. M., Saturday, G. A. Evaluation of a rapid immunodiagnostic rabies field surveillance test on samples collected from military operations in Africa, Europe, and the Middle East. U.S. Army Medical Department Journal. , 27-32 (2014).
- Servat, A., Robardet, E., Cliquet, F. An inter-laboratory comparison to evaluate the technical performance of rabies diagnosis lateral flow assays. Journal of Virological Methods. 272, 113702 (2019).
- Eggerbauer, E., et al. Evaluation of Six Commercially Available Rapid Immunochromatographic Tests for the Diagnosis of Rabies in Brain Material. PLoS Neglected Tropical Diseases. 10 (6), e0004776 (2016).
- Barrat, J., Meslin, F. X., Kaplan, M. M., Koprowski, H. Simple technique for the collection and shipment of brain specimens for rabies diagnosis. Laboratory techniques in rabies. , 425-432 (1996).
- Dacheux, L., et al. Dual Combined Real-Time Reverse Transcription Polymerase Chain Reaction Assay for the Diagnosis of Lyssavirus Infection. PLoS Neglected Tropical Diseases. 10 (7), e0004812 (2016).
- Dacheux, L., et al. A reliable diagnosis of human rabies based on analysis of skin biopsy specimens. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 47 (11), 1410-1417 (2008).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Application of next generation sequencing to rabies virus and other lyssaviruses. Laboratory techniques in rabies. 2, 49-61 (2019).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Conventional pan-lyssavirus reverse transcriptase polymerase chain reaction. Laboratory techniques in rabies. 2, 1-16 (2019).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Rabies real-time reverse transcriptase polymerase chain reaction. Laboratory techniques in rabies. 2, 17-34 (2019).
- Talbi, C., et al. Evolutionary history and dynamics of dog rabies virus in western and central Africa. The Journal of General Virology. 90 (Pt 4), 783-791 (2009).
- McElhinney, L. M., Marston, D. A., Brookes, S. M., Fooks, A. R. Effects of carcase decomposition on rabies virus infectivity and detection. Journal of Virological Methods. 207, 110-113 (2014).
- Vigilato, M. A. N., et al. Progress towards eliminating canine rabies: policies and perspectives from Latin America and the Caribbean. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 368 (1623), 20120143 (2013).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved