Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Oligomerisierungsdynamik von Zelloberflächenrezeptoren in lebenden Zellen durch totale interne Reflexionsfluoreszenzmikroskopie kombiniert mit Zahlen- und Helligkeitsanalyse
In diesem Artikel
Zusammenfassung
Wir beschreiben einen bildgebenden Ansatz zur Bestimmung des durchschnittlichen oligomeren Zustands von mEGFP-getaggten Rezeptor-Oligomeren, die durch Ligandenbindung in der Plasmamembran lebender Zellen induziert werden. Das Protokoll basiert auf der Total Internal Reflection Fluorescence (TIRF) Mikroskopie in Kombination mit der Number and Brightness (N&B)-Analyse.
Zusammenfassung
Trotz der Bedeutung und Allgegenwart der Rezeptor-Oligomerisierung sind nur wenige Methoden zum Erkennen von Clustering-Ereignissen und zur Messung des Clustering-Grades anwendbar. Hier beschreiben wir einen bildgebenden Ansatz zur Bestimmung des durchschnittlichen oligomeren Zustands von mEGFP-getaggten Rezeptor-Homokomplexen in der Membran lebender Zellen. Das Protokoll basiert auf der Total Internal Reflection Fluorescence (TIRF) Mikroskopie in Kombination mit der Number and Brightness (N&B)-Analyse. N&B ist eine Methode ähnlich der Fluoreszenz-Korrelationsspektroskopie (FCS) und dem Photonenzählhistogramm (PCH), die auf der statistischen Analyse der Schwankungen der Fluoreszenzintensität von Fluorophoren basieren, die in und aus einer Beleuchtung diffundieren. Volumen während einer Beobachtungszeit. Insbesondere ist N&B eine Vereinfachung von PCH, um Informationen über die durchschnittliche Anzahl von Proteinen in oligomeren Mischungen zu erhalten. Die Intensitätsschwankungsamplituden werden durch die molekulare Helligkeit des Fluorophors und die durchschnittliche Anzahl von Fluorophoren innerhalb des Beleuchtungsvolumens beschrieben. N&B berücksichtigt daher nur den ersten und zweiten Moment der Amplitudenverteilung, nämlich die mittlere Intensität und die Varianz. Dies ist gleichzeitig die Stärke und schwächelinde Methode. Da nur zwei Momente berücksichtigt werden, kann N&B den molaren Anteil unbekannter Oligomere in einer Mischung nicht bestimmen, sondern schätzt nur den durchschnittlichen Oligomerisierungszustand der Mischung. Dennoch kann es auf relativ kleine Zeitreihen (im Vergleich zu anderen Momentmethoden) von Bildern von lebenden Zellen pixelweise angewendet werden, einfach durch die Überwachung der Zeitschwankungen der Fluoreszenzintensität. Es reduziert die effektive Zeit pro Pixel auf wenige Mikrosekunden, wodurch die Erfassung im Zeitbereich von Sekunden bis Millisekunden möglich ist, was für eine schnelle Oligomerisierungskinetik erforderlich ist. Schließlich können große Zellbereiche sowie subzelluläre Kompartimente erkundet werden.
Einleitung
Wir beschreiben einen Bildansatz der totalen inneren Reflexionfluoreszenz-Anzahl und Helligkeit (TIRF-N&B) zur Bestimmung des durchschnittlichen oligomeren Zustands von Rezeptormolekülen an der Plasmamembran lebender Zellen mit dem Ziel, die Rezeptor-Baugruppe zu verknüpfen. Dynamik zur biologischen Funktion der Proteine (Abbildung 1).
Bei extrazellulärer Ligandenbindung initiieren Rezeptoren die intrazelluläre Signaltransduktion in Abhängigkeit von ihrer Konformation, Oligomerisierung, potenziellen Co-Rezeptoren und Membranzusammensetzung. Trotz der Bedeutung und Allgegenwart der Rezeptor-Oligomerisierung, anerkannt als schlüsseleines Ereignis in der zellulären Signalisierung1,2,3,4,5,6, 7können nur wenige Methoden Clustering-Ereignisse erkennen und den Grad des Clusterings experimentell messen8,9. Das konfokale Volumen (x,y bei 300 nm, z x 900 nm) ist für den Nachweis der molekularen Interaktion und Stoichiometrie nicht ausreichend aufgelöst, auch nach der Optimierung durch Bildwiederherstellungsalgorithmen10. Die Untereinheitszusammensetzung von Proteinoligomeren kann nicht auch nur durch Superauflösungsmethoden bei einer Auflösung von 20-70 nm wie PALM11, STORM12und STED13rein räumlich gelöst werden. Darüber hinaus kann ihre zeitliche Auflösung (in der Reihenfolge von Minuten pro Bild) der Kinetik im Sekundenbereich nicht folgen. Einzelne Molekül-Stepbleichung löst die Stoichiometrie von Protein-Oligomeren nur, wenn sie unbeweglich sind14.
Eine der vielseitigsten Methoden zur Messung der Dichte und Oligomerisierung fluoreszierender Proteine in Einzelbildern ist die räumliche Intensitätsverteilungsanalyse (SpIDA), die auf räumlicher Probenahme beruht. Es ist sowohl auf chemisch fixierte als auch auf lebende Zellen anwendbar und ermöglicht die gleichzeitige Analyse mehrerer Interessenbereiche der Zelle mit Standardfluoreszenzmikroskopie15. Alternativ eignen sich Momentmethoden wie Fluoreszenz-Korrelationsspektroskopie (FCS)16, Photonenzählhistogramm (PCH)17und Zahl und Helligkeit (N&B)18,19, für quantitative oligomere Messungen. Diese Methoden analysieren die Fluoreszenzintensitätsschwankungen, die in der Zeit beobachtet werden können, wenn die Fluorophore in und aus einem Beleuchtungsvolumen diffundieren. Die Amplituden der Intensitätsschwankungen können eindeutig durch die molekulare Helligkeit des Fluorophors () und die durchschnittliche Anzahl der Fluorophore (n) innerhalb des Beleuchtungsvolumens17 (Abbildung 2) beschrieben werden. Typischerweise können der Diffusionskoeffizient der Fluorophore und die durchschnittliche Anzahl der Moleküle (umgekehrt bezogen auf den G(0)-Wert) innerhalb des Beleuchtungsvolumens durch FCS20ermittelt werden. Da die Diffusionszeit jedoch nur mit der kubischen Wurzel der Masse skaliert, ist FCS nicht empfindlich genug, um Veränderungen in der Molekularmasse21zu erkennen. In der Praxis kann einfarbiges FCS die Dimerisierung von Membranrezeptoren nicht erkennen. PCH löst Mischungen verschiedener Oligomere genau auf. Mit mehr als zwei Momenten der Amplitudenverteilung erkennt es Moleküle unterschiedlicher Helligkeit, die das gleiche Beleuchtungsvolumen belegen. Scannen von FCS22 und Entwicklungen, wie z. B. der interessante Paarkorrelationsansatz der molekularen Helligkeit (pCOMB)23, eingeführt, um den Alikatbereich der Anwendbarkeit von Fluoreszenzkorrelationsmethoden in biologischen Systemen zu erweitern24 bleiben Einzelpunktmethoden, denen die Fähigkeit zu schnellen Messungen in einem großen Zellbereich fehlt, was viele aufeinander folgende Beobachtungen an jedem Pixel und die Datenerfassung in der Reihenfolge von Sekunden erfordert.
N&B ist eine vereinfachte Version von PCH, die nur den ersten und zweiten Moment der Amplitude der Fluoreszenzverteilung berücksichtigt, nämlich die mittlere Intensität, , und die Varianz,2 (Abbildung 2)18,19 und aus diesem Grund kann sie den mollaren Anteil unbekannter Oligomere in einer Mischung nicht bestimmen, sondern schätzt nur den durchschnittlichen Oligomerisierungszustand der Mischung. Dennoch hat N&B den Vorteil, mit relativ kleineren Zeitreihen von Bildern von Lebendenzellen als PCH pixelweise zu arbeiten, indem einfach die Zeitlichen schwankungen der Fluoreszenzintensität überwacht werden. Da N&B die Zeit pro Pixel auf wenige Mikrosekunden reduziert, kann es einer schnellen Oligomerisierungskinetik über große Zellbereiche folgen und eine Bildaufnahme auf einer Zeitskala von Sekunden in der Raster-Scanmikroskopie (z. B. konfokale, 2-photon) und Millisekunden ermöglichen. in der kamerabasierten Mikroskopie (z.B. TIRFM).
Mehrere Berichte haben die Fähigkeit von N&B gezeigt, die Anzahl der Untereinheiten in Proteinclustern zu quantifizieren, indem erweiterte Zellregionen geabbildungen. Paxillin-EGFP-Cluster wurden an den Haftstellen in den CHO-K1-Zellen25nachgewiesen und die intrazelluläre Aggregation des pathogenen Httex1p-Peptids in COS-7-Zellen26beschrieben. N&B wurde nach der Liganden-gesteuerten Oligomerisierung des ErbB-Rezeptors27und der Wirkung des Liganden FGF21 auf Klothob (KLB) und FGFR1c in den HeLa-Zellen28angewendet. Die Kombination von TIRF-Bildgebung und N&B-Analyse wurde verwendet, um zu zeigen, dass Dynamin-2 in erster Linie tetramerisch in der gesamten Zellmembran29ist. Wir haben N&B sowohl auf Raster-Scanning als auch auf TIRF-Bilder angewendet, um die Liganden-gesteuerte Dimerisierung von uPAR- und FGFR1-Zellmembranrezeptoren30,31zu beweisen.
Fluoreszenzkorrelationsmethoden wie N&B, FCS und PCH basieren auf der Vorstellung, dass in einem offenen Volumen die Besatzungszahl der Teilchen einer Poisson-Verteilung folgt. Da nur die Photonen, die die Fluorophore emittieren, erkannt werden können, ist der Mittelwert 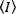 für eine gemessene Fluoreszenzintensität im Vergleich zur Zeit in einem Pixel des Bildes, das Produkt der durchschnittlichen Anzahl von Fluorophoren im Beleuchtungsvolumen, n, und molekulare Helligkeit, Nr.17:
für eine gemessene Fluoreszenzintensität im Vergleich zur Zeit in einem Pixel des Bildes, das Produkt der durchschnittlichen Anzahl von Fluorophoren im Beleuchtungsvolumen, n, und molekulare Helligkeit, Nr.17:
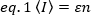
wobei die Anzahl der Photonen, die pro Zeiteinheit (konventionell pro Sekunde) pro Molekül emittiert werden, wenn sich das Molekül im Zentrum des Beleuchtungsvolumens befindet.
Helligkeit ist eine Eigenschaft jedes Fluorophors in einer bestimmten Anschaffung eingerichtet, während Intensität ist die Summe aller Beiträge aus allen Fluorophoren. In biologischen Wettbewerben wird die Helligkeit mit der Zunahme der Anzahl der Fluorophore, die zusammen schwanken, zunehmen, was Informationen über den Oligomerisierungszustand des fluoreszierend getaggten Proteins gibt. Die Fluktuationsamplituden an einem bestimmten Pixel werden anhand der Varianz des Fluoreszenzsignals gemessen,2:
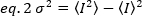
Wobei der Mittelwert des Quadrats der Intensität 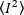 , und das
, und das  Quadrat des Mittelwerts der Intensität , aus den individuellen Intensitätswerten in jedem Pixel jedes Frames berechnet werden:
Quadrat des Mittelwerts der Intensität , aus den individuellen Intensitätswerten in jedem Pixel jedes Frames berechnet werden:
wobei K die Anzahl der Gesamtframes in der Zeitreihe ist. Experimentell ist es notwendig, für die gesamte Bildreihe die Varianz zu berechnen, die die Streuung der einzelnen Intensitätswerte an jedem Pixel eines einzelnen Bildes um den mittleren Intensitätswert beschreibt. Die Varianz umfasst alle Schwankungen unterschiedlicher Herkunft. In einer ersten Annäherung kann die Varianz durch die diffundierenden Partikel im Beleuchtungsvolumen,20, durch das Detektor-Schussrauschen von der Varianz getrennt werden,2d. Die beiden Varianzen sind unabhängig; somit wird die Gesamtabweichung durch ihre Summe angegeben:
Die Varianz aufgrund molekularer Schwankungen im und aus dem Nachweisvolumen ist linear abhängig von der molekularen Helligkeit und Intensität:
Neuanordnung eq. 6 nach 1q. 1:
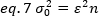
Nach dem typischen Konzept der Fluoreszenzkorrelationsspektroskopie besagt Gleichung 7, dass die Varianz aufgrund der Anzahl der Schwankungen vom Quadrat der Partikelhelligkeit abhängt.
Dann ist die Varianz aufgrund von Detektorschwankungen eine lineare Funktion der erfassten Intensität, unter der Annahme, dass der Detektor unterhalb seiner Sättigungsgrenze19betrieben wird:
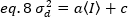
Bei Photonenzähldetektoren a=1 und c=0 entspricht die Detektorvarianz also der durchschnittlichen Intensität:
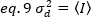
Um diese Konzepte auf reale Messungen in lebenden Zellen anzuwenden, definieren Gratton und Kollegen18 die scheinbare Helligkeit B für jedes Pixel als Verhältnis der Varianz zur durchschnittlichen Intensität:
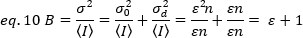
B ist der Parameter, der experimentell gemessen wird. In dieser Arbeit werden Zeitreihenbilder von FGFR1-Rezeptoren an der Plasmamembran von HeLa-Zellen durch die TIRF-Mikroskopie erfasst und die durchschnittliche scheinbare Helligkeit B wird durch die N&B-Analyse bestimmt. Dann, nach Zugabe von FGF2, werden aufeinander folgende Zeitreihen erfasst, um die Veränderungen in der Selbstmontage der Rezeptormoleküle in der Membranoberfläche nach der Stimulation des Rezeptors mit dem kanonischen Liganden zu verfolgen.
Da es sich bei dem Detektor des TIRF-Mikroskops jedoch um eine EMVD-Kamera handelt, muss der Ausdruck für die scheinbare Helligkeit als19geändert werden:
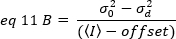
wobei der Offset der Intensitätsausgleich der Erkennungselektronik ist, der ein Merkmal der Detektoreinstellungen ist. Die Varianz und die durchschnittliche Intensität eines analogen Detektors werden jeweils angegeben durch:
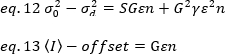
wobei G die analoge Verstärkung in digitalen Pegeln (DL/Photonen), S, die digitalen Pegel pro Photon19, durch die Steigung eines Intensitäts-Gegen-Varianzdiagramms für eine Lichtquelle mit konstanter Intensität (keine zeitlichen Schwankungen) angegeben wird. Der Faktor ist mit der Form des Pixelerkennungsvolumens verknüpft. Nach Hassler et al.32beträgt der Faktor 0,3 für die TIRF-Bildgebung, die mit der maximalen Verstärkung der Detektionskamera19arbeitet. Die Offset-, S- und G-Parameter sind Merkmale der Kamera und des Mikroskops. Die scheinbare Helligkeit B wird durch Neuanordnung von 11 nach 12 und 13 erreicht:
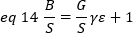
Experimentell ist die s eine komplexe Funktion der Laserintensität und der Detektionseffizienz des Systems. Da B/S jedoch linear von der Abhängigkeit von - abhängig ist, ist es nur wichtig, den relativen Wert von . für einen bestimmten Erkennungsmodus zu bestimmen:
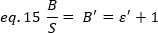
wobei das S' proportional zu . Dennoch wird eine Kalibrierung mit einem internen Verweis durchgeführt.
Protokoll
1. Probenvorbereitung
- Tag 1. Saat-HeLa-Zellen in vollständiger Medium mit einer Konzentration von 100.000-200.000 Zelle/ml in Glasbodenschalen. Samen 6-8 replizieren Gerichte.
HINWEIS: In diesem Beispiel wird das Medium durch 10% hitzeinaktiviertes Fetal Bovine Serum (FBS), 1 mM Natriumpyruvat, 100 U/100 g Penicillin/Streptomycin ergänzt. Mehrere nachgebildete Gerichte werden zubereitet. - Tag 2-3. Wenn Zellen in Subkonfluenz sind, transfezieren Sie die Hälfte der Gerichte mit dem Proteinplasmid und die zweite Hälfte mit Referenzplasmiden (Monomer und Dimer), in serumfreiem Medium.
HINWEIS: Transfektion erfolgt in serumfreiem Medium, ergänzt mit Antibiotika, 0,1% Rinderserum Albumin und 25 mM HEPES Puffer, ohne Phenol Red. - Tag 3-4. Überprüfen Sie, ob die transfizierten Zellen an der Unterseite des Geschirrs haften und die Zellmembran fluoreszierend ist. Entsorgen Sie Gerichte mit überwucherten Zellen oder mit sehr geringer Fluoreszenz.
HINWEIS: Lassen Sie Zellen nicht überwachsen. Die Zellen müssen gut verteilt sein und an der Glasfläche der Schale haften (Abbildung 1A). Vorbeschichtete Glasbodenschalen können zur Begünstigung der Zellhaftung verwendet werden. Die Zellkultur wird vor jedem Experiment auf Mykoplasmenkontamination getestet. In diesem Beispiel werden Zellen mit einem (A207K)mEGFP-FGFR1-Plasmid transfiziert und die Referenzzellen mit einem GPI-(A207K)mEGFP und einem GPI-(A207K)mEGFP-(A207K)mEGFP-plasmids unter Verwendung von Standardprotokollen transfiziert. Für die Live-Zellmikroskopie wird ein indikatorfreies Medium empfohlen; 25 mM HEPES Puffer wird hinzugefügt, um pH-Änderungen während der Bildgebung zu verhindern.
2. TIRF Imaging — Ausrichtung der Laserlinie und Optimierung der TIRF-Beleuchtung
- Aktivieren Sie vier Stunden vor dem Experiment den Temperaturinkubator des Mikroskops bei 37 °C.
- Schalten Sie das Mikroskop, Computer und Kameras ein und warten Sie, bis die Kameras die richtige Arbeitstemperatur erreichen.
HINWEIS: Die Arbeitstemperatur der in dieser Studie verwendeten Kamera beträgt -75 °C. - Legen Sie einen kleinen Tropfen Öl auf das Ziel. Legen Sie eine Probeschale an Ort und Stelle. Schließen Sie die Türen des Inkubators und lassen Sie die Temperatur der Schale ausdemadien (ca. 10 min).
- Schalten Sie die Epifluoreszenzlampe und den 488 nm-Laser ein.
- Wählen Sie den Epifluoreszenzkontrastmodus aus, um die Probe zu untersuchen, und suchen Sie eine Zelle, um sie vom Okular aus zu fokussieren.
HINWEIS: Die Verwendung einer Leuchtstofflampe zur Suche nach Zellen durch das Okular ist nicht obligatorisch. Stattdessen kann eine geeignete Laserlinie verwendet werden. - Wählen Sie den richtigen Filter für die Erfassung der grünen Emission durch die Mikroskopkamera (Band Pass Ex 490/20 (500) Band Pass Em 525/50, oder ähnlich.
- Wechseln Sie im Epifluoreszenzmodus vom Okular zum Kameraanschluss (Kamera-#1 in Abbildung 1),verfeinern Sie den Fokus und wechseln Sie in den TIRF-Modus. Epifluoreszenz- und TIRF-Modi können je nach Marke des Mikroskops mit einer anderen Nomenklatur benannt werden.
HINWEIS: Es kann Probleme beim Fokussieren oder Ausrichten des Lasers geben, wenn sich an der Deckblattschnittstelle keine Fluoreszenzmarker befinden. Um den Laser richtig auszurichten (wichtig für eine gute TIRF), konzentrieren Sie sich auf den Deckel. Es ist oft sehr schwierig festzustellen, ob der Coverslip im Fokus steht. Konzentrieren Sie sich als Vorschlag auf die Ränder der Zellen. - Aktivieren Sie die automatische Ausrichtung gemäß den Anweisungen des TIRF-Mikroskops.
HINWEIS: Kurz gesagt, für Schritte von 2.4 bis 2.8, zuerst finden Sie die Zellen durch das Okular und fokussieren Sie sich auf sie, dann senden Sie die Emission an den Kameraanschluss des TIRF-Mikroskops, fokussieren Sie die Zellen auf dem Mikroskopcomputerbildschirm neu und aktivieren Sie das Verfahren für die Laserausrichtung. Die Ausrichtung besteht darin, den kritischen Winkel zu finden, in dem die Beleuchtung verzweiumst wird (Abbildung 3). Kommerzielle Mikroskope können leicht unterschiedliche Ausrichtungsprotokolle aufweisen und auch voll automatisiert sein; andere verfügen möglicherweise über eine kleine Kamera, um die Visualisierung der kritischen Winkelbedingungen zu erleichtern. - Wählen Sie eine geeignete Beleuchtungstiefe und optimieren Sie die Richtung des Evaneszenzfeldes (Abbildung 3).
HINWEIS: Die Eindringtiefe wird für alle Kontrollen und Proben konstant gehalten.
3. TIRF Imaging: Erfassung der Zeitreihen
- Definieren Sie einen Bereich von Interesse (ROI) von mindestens 256 x 256 Pixeln.
HINWEIS: In dieser Einrichtung erfolgt die Aufnahme mit #2 unter Software, die nur die Kamera direkt steuert (siehe Abbildung 1 Legende). - Stellen Sie die Belichtungsposition auf 1 ms und die EM-Verstärkung auf 1.000 (dies ist der G-Faktor in 12 und 13). Bei einer solchen Geschwindigkeit kann es notwendig sein, die Laserleistung anzupassen oder zu erhöhen. Hier beträgt die Laserleistung 0,5 mW.
HINWEIS: Je nach Art der Kamera und den Grenzwerten, die durch den Diffusionskoeffizienten des Proteins, die Fluoreszenzintensität und den Hintergrund auferlegt werden, bestehen die allgemeinen Kriterien für die Einstellung der Laserleistung nicht darin, den Detektor zu sättigen, photobleichen zu minimieren und schnell wie möglich bei einem vernünftigen S/N. Die EM-Verstärkung wird immer auf das Maximum der Kamera eingestellt (siehe Einleitung). - Führen Sie eine erste Testsequenz unter anfangsbedingungen aus und schätzen Sie den S/N-Wert grob. Die Bedingungen sind bei S/N = 2-3 oder höher akzeptabel, gemessen im ersten Frame der ersten Zeitreihe.
- Verwenden Sie den Schieberegler des Emissionsspaltsystems, das die Kamera #2 zum Mikroskop verbindet, um eine Seite des Bildes zu maskieren (Abbildung 1B, Abbildung 4A-B)
HINWEIS: In diesem Aufbau wird ein Mehrkanal-Bildverbinder auf der Kamera installiert #2 um die Gleichzeitige Erfassung von zwei räumlich identischen Bildern zu ermöglichen. Das System ist mit Dias für die Montage verschiedener Emissionsfilter ausgestattet. Einer der Schieberegler montiert eine schwarze Maske, um eine Seite des Bildes zu bedecken. Der maskierte Bereich dient zur internen Kalibrierung jeder Zeitreihe, um die Kameraparameter (12 und 13) zu bestimmen. Auf diese Weise ist kein unabhängiger Kalibrierschritt erforderlich und, was wichtig ist, die Kalibrierung erfolgt parallel zur Erfassung jeder Zeitreihe. In Ermangelung dieses Systems kann die Kamera unter Anwendung der veröffentlichten Protokolle33kalibriert werden. - Wählen Sie die Option zum automatischen Speichern der Kameradatei aus.
- Starten Sie die Erfassung der Bildserie. Erwerben Sie mindestens 700 Frames bei einem s/N-Verhältnis von 2.
HINWEIS: Die Anzahl der für die Analyse erforderlichen Rahmen hängt von der Probenstabilität bis zum Photobleichmittel und der Streuung der Daten ab. Daher wird die Qualität jeder Zeitreihe während der N&B-Analyse bewertet. - Ohne die Schale aus dem Mikroskop zu nehmen, fügen Sie den Liganden hinzu.
- Wählen Sie eine Zelle mit einer hellen Fluoreszenzmembran aus und starten Sie schnell die erste Zeitreihe des kinetischen Laufs.
HINWEIS: Wenn die Zugabe des Ligands schnell erfolgt, legt diese erste Aufnahme den Punkt = 0 Zeit der Ligandenkinetik fest. Die Software registriert den genauen Zeitpunkt der Erfassung. - Suchen Sie eine zweite Zelle und erfassen Sie den zweiten Zeitpunkt der Kinetik.
HINWEIS: Point-Visiting-Routinen sind in einigen Mikroskopen mit x,y,z motorisierten Stufen ausgestattet. Diese ermöglichen das Auswendiglernen mehrerer Positionen auf der Zellschale und können dazu beitragen, ein konstanteres Zeitintervall zwischen Bildreihen auf verschiedenen Zellen zu halten. - Erfassen Sie eine neue Zelle für jeden Zeitpunkt des kinetischen Laufs.
HINWEIS: Nach der Aufnahme wird eine Zelle teilweise photobleached und kann nicht neu abgebildet werden. Aus diesem Grund wird die Kinetik durch die Kombination von Zeitreihen vieler Zellen erhalten, die jeweils zu einem anderen Zeitpunkt erfasst werden. - Wiederholen Sie für jedes neue Gericht das Protokoll von Schritt 2.3 bis 3.9.
HINWEIS: Für Referenzgerichte, fügen Sie ein Volumen des Fahrzeugs (PBS ergänzt mit 0,01% Rinderserumalbumin) entsprechend dem für den Liganden verwendeten.
4. Anzahl & Helligkeit (N&B): Qualitätsprüfung der Zeitreihen
- Konvertieren und speichern sie als . TIFF die Dateien mit der Kamera-Software (.sif Dateien in diesem Beispiel) erworben.
- Importieren. TIFF-Dateien in der Analysesoftware-Routine durch Aktivierung der N&B grafische benutzeroberfläche (GUI) MATLAB.
HINWEIS: Hier wird eine angepasste ausführbare Matlab-N&B-Routine verwendet (N&B-Analyse bei https://www.cnic.es/en/investigacion/2/1187/tecnologia). Durch Öffnen einer importierten . TIFF-Datei, erzeugt die Routine das durchschnittliche Intensitätsbild, das durchschnittliche Intensitätsprofil und ermöglicht die Überprüfung der Serie Frame-by-Frame (Ergänzende Abbildung 1). Für die N&B-Analyse (z.B. SimFCS-Software) stehen weitere Software zur Verfügung. - Discard-Serien, bei denen das durchschnittliche Intensitätsprofil mehr als 10% Photobleaching zeigt, und Reihen, in denen es während der Erfassung eine offensichtliche Zellmembranverzerrung oder -übersetzung gegeben hat.
- Zuschneiden von Rahmen, die offensichtlich nicht im Fokus stehen.
HINWEIS: Ein Zuschneidewerkzeug wird in der Routine implementiert, um einzelne oder mehrere Frames innerhalb der Bildreihe zu verwerfen. Dieser Vorgang ist zulässig, da die Frame-to-Frame-Zeit nicht entscheidend ist, während die Pixelverweilzeit (Belichtungszeit) (siehe Diskussion) ist. - Halten Sie für die Analyse nur Serie mit mindestens 500 Zeitrahmen.
5. Anzahl & Helligkeit (N&B): Bestimmung der Kameraparameter (Offset, B und S)
- Aktivieren Sie die Routine Calibrate Camera.
- Wählen Sie einen Bereich von mindestens 20 x 50 Pixeln im Geräuschbereich des Detektors aus (Abbildung 4).
HINWEIS: Die Routine stammt aus einem Histogramm der Werte (auch definiert digital Level, DL) und gibt ein Logarithmusdiagramm der Frequenz im Vergleich zu digitalen Ebenen zurück. - Bewegen Sie im Diagramm "Log-Frequenz- und Digitalebene" den linearen roten Cursor, um den Gaußschen und den linearen Teil der Kurve abzugrenzen.
HINWEIS: Der rote Cursor teilt die beiden Abschnitte der Kurve und aktiviert die Routine, die den Offset zurückgibt, der die Mitte der Gaußschen Funktion der Kameraantwort, das - der Gaußschen Passung und den S-Faktor ist, der die Steigung des linearen Teils der Kamera respons ist. e (Abbildung 4C-D).
6. Anzahl & Helligkeit (N&B): Berechnung der B-Werte in der ausgewählten Interessenregion (ROI)
- Aktivieren Sie die B-Taste.
HINWEIS: Diese Aktion generiert das durchschnittliche Intensitätsbild(Abbildung 5, erste Spalte) und das B-Bild, in dem jeder einzelne B-Wert dem zugehörigen Pixel im Bild zugeordnet ist (Zusätzliche Abbildung 1). - Wenden Sie eine Mindestbinning (2 2) an, um die Streuung der Daten zu reduzieren und das B-I-Histogramm zu generieren(Abbildung 5, zweite Spalte).
HINWEIS: Das B-I-Histogramm stellt die Verteilung der B-Werte aller Pixel des Bildes im Vergleich zur Pixelintensität dar. Y = B/S; X =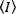 ( - Offset)/S (Ergänzende Abbildung 1 und 11 und 15).
( - Offset)/S (Ergänzende Abbildung 1 und 11 und 15). - Überprüfen Sie das B-I-Histogramm mit dem interaktiven quadratischen Cursor.
- Wählen Sie einen quadratischen ROI für die Analyse aus(Abbildung 5, dritte Spalte).
HINWEIS: Der Cursor synchronisiert eine mobile Maske auf dem durchschnittlichen Intensitätsbild und hebt die Pixel hervor, die innerhalb des quadratischen Cursorbereichs ausgewählt sind (Ergänzende Abbildung 1). Durch diese Inspektion ist es möglich, den Hintergrund und Bereiche mit sehr geringer Intensität aus der Analyse auszuschließen. - Generieren Sie die B-Karte des ausgewählten ROI(Abbildung 5, vierte Spalte).
- Speichern Sie die ASCII-Datei der B-Werte, die der Auswahl zugeordnet sind.
- Importieren Sie die ASCII-Datei in eine Grafiksoftware, um die Frequenzverteilung der Daten zu berechnen und den durchschnittlichen B-Wert s.E zu erhalten (Abbildung 5, fünfte Spalte).
HINWEIS: Wenn die Daten homogen sind, nähert sich die Frequenzverteilung der B-Werte einer Gaußschen Verteilung an. - Wenden Sie 15 an, um
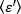 die
die 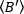 durchschnittliche Helligkeit = - 1 [(Zählungen/Molekül) pro Verweilzeit] für jede Zelle zu jedem Zeitpunkt des kinetischen Laufs abzuleiten. Normalisieren Sie die Daten nach:
durchschnittliche Helligkeit = - 1 [(Zählungen/Molekül) pro Verweilzeit] für jede Zelle zu jedem Zeitpunkt des kinetischen Laufs abzuleiten. Normalisieren Sie die Daten nach: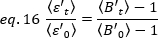
wobei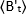 der durchschnittliche B-Wert zum Zeitpunkt "t"
der durchschnittliche B-Wert zum Zeitpunkt "t" 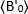 nach Ligandzugabe gemessen wird, und der durchschnittliche B-Wert, der zum Zeitpunkt t=0 (10-20 s nach Ligandenzugabe) gemessen wird.
nach Ligandzugabe gemessen wird, und der durchschnittliche B-Wert, der zum Zeitpunkt t=0 (10-20 s nach Ligandenzugabe) gemessen wird.
HINWEIS: Die Normalisierung der Ergebnisse ermöglicht den direkten Vergleich von Experimenten, die an verschiedenen Tagen durchgeführt werden. Es kompensiert Unterschiede in der gemessenen Helligkeit durch Laserleistung und technische Schwankungen. - Zeichnen Sie die normalisierte durchschnittliche Helligkeit im Vergleich zur Erfassungszeit, um den kinetischen Lauf zu erstellen (Abbildung 6).
Ergebnisse
Die Ergebnisse für zwei repräsentative HeLa-mEGFP-FGFR1-Zellen, die in derselben Kulturschale gesät sind, sind in Abbildung 5 und Ergänzender Tabelle 1dargestellt. Die beiden Zellen wurden zum Zeitpunkt 0 min(Abbildung 5A, oben) und 7 min (Abbildung 5A, unten) nach Zugabe des FGF2-Ligands erfasst.
Diskussion
N&B erfordert mehrere Vorsichtsmaßnahmen bei der Wahl des Zellmodells und der Kennzeichnungsstrategie. Sie kann nur auf lebende Zellen angewendet werden, die während der Bildaufnahmezeit stabil haften bleiben. Zusätzliche Schwankungen durch die gesamte Zelle starre Verschiebung kann mit entsprechenden Bildwiederherstellungsansätzen38behandelt werden. Wenn sich jedoch eine Zelle bewegt, verformt sich die Zellmembran ebenfalls, und die Strukturverformung führt zu einer erheblichen zusätzlichen...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die CNIC wird vom Ministerium für Ciencia, Innovacion y Universidades und der Pro CNIC Foundation unterstützt und ist ein Severo Ochoa Center of Excellence (SEV-2015-0505). Wir werden auch vom Europäischen Fonds für regionale Entwicklung (FEDER) "Una manera de hacer Europa" unterstützt. Die UC würdigt die Unterstützung der Associazione Italiana Ricerca sul Cancro, der Association for International Cancer Research (heute als Worldwide Cancer Research bekannt) und des italienischen Gesundheitsministeriums. A.T. würdigt die "Fondazione Banca del Monte di Lombardia" für die teilweise Unterstützung seiner Arbeit mit dem PV-Stipendium "Progetto Professionalit" Ivano Becchi" 2011-2012.
Materialien
| Name | Company | Catalog Number | Comments |
| 3-Colour Fast TIRF Leica AM TIRF MC inverted microscope, with smi-automatic TIRF alignment. The microscope is equipped with a diode 488 nm laser, a 100x1.46 oil TIRF objective, Ex/Em Bandpass filters at 490/20 and 525/50, temperature/CO2 incubator and Andor DU 8285 VP EMCCD camera. The microscope is operated by Leica LIF software. | Leica Microsystems, Wetzlar, Germany | ||
| Albumin from Bovine Serum 98% minimun | Sigma-Aldrich, St. Louis, MI, USA | A7906-100G | |
| DMEM without Phenol Red with 25 mM HEPES | GIBCO Thermo Fisher Scientific,Waltham, MA, USA | 21063029 | Used serum free for microscopy |
| DMEM high-glucose GlutaMAX I | GIBCO Thermo Fisher Scientific,Waltham, MA, USA | 10566-016 | Used for complete medium |
| Dulbecco's Phosphate Buffered Saline 10x (PBS) | Biowest, Nuaillé, France | X0515-500 | |
| Emission splitting system Photometrics DV2 | TeledynePhotometrics, Tucson, AZ, USA | ||
| Fetal Bovine Serum, qualified, Brazil | GIBCO Thermo Fisher Scientific,Waltham, MA, USA | 10270106 | 10% inactivated supplement for complete medium |
| Glass bottom 35-mm sterile 1.5 dishes | MatTek, Ashland, MA, USA | P35G-0.170-14-C | uncoated, glass thickness 0.17 microns |
| GraphPad Prism | GraphPad Software Inc., San Diego, CA, USA | ||
| Human cervical carcinoma (HeLa), serum-free animal component (AC) cells | Millipore-Sigma ECACC, Darmstadt, Germany | CB_08011102 | |
| iXonEM+ 897 EMCCD (back-illuminated) ANDOR camera controlled by ANDOR Solis software | Oxford Instruments, Andor TM Technology, Abingdon-on-Thames, UK | This camera, installed in an additional port of the microscope, is used for acquiring the N&B time series | |
| Matlab Executable N&B routine | Unit of Microscopy and Dynamic Imaging, CNIC, Madrid, Spain | download at https://www.cnic.es/en/investigacion/2/1187/tecnologia | |
| MatLab v.2018b | The MathWorks, Inc. Natick, MA, USA | download at https://www.mathworks.com/products/matlab.html | |
| Penicillin:Streptomycin for tissue culture 100x | Biowhittaker Inc. Walkersville, MD, USA | LONZA 17-602E | supplement for medium at Penicillin/Streptomycin 100U/100µg. |
| pN1-mEGFP-FGFR1 expression vector | Unit of Gynecological Oncology Research, European Institute of Oncology IRCCS, Milan, Italy | Zamai et al., 2019 | |
| pN1-N-Gly-mEGFP-GPI expression vector | Unit of Microscopy and Dynamic Imaging, CNIC, Madrid, Spain | Hellriegel et al., 2011 | |
| pN1-N-Gly-mEGFP-mEGFP-GPI expression vector | Unit of Microscopy and Dynamic Imaging, CNIC, Madrid, Spain | Hellriegel et al., 2011 | |
| Recombinant FGF2 | PeproTech EC, Ltd., London, UK | Ligand solution: 20ng/mL of FGF2 in PBS supplemented with 0.01%BSA. | |
| Sodium pyruvate GIBCO | ThermoFisher Scientific | 11360070 | 1mM supplement for medium |
| TransIt-LT1 Transfection Reagent | MirusBio LLC, Madison, WI, USA | MIR 2300 | |
| Trypsin-EDTA (0.25%), phenol red | GIBCO Thermo Fisher Scientific,Waltham, MA, USA | 25200056 | |
| Type F Immersion liquid 10 mL | Leica Microsystems, Wetzlar, Germany | 11513 859 | |
| UltraPure BSA (50 mg/mL) | ThermoFisher Scientific | AM2618 | 0.1% supplement for medium without phenol red used for transfections |
Referenzen
- Agwuegbo, U. C., Jonas, K. C. Molecular and functional insights into gonadotropin hormone receptor dimerization and oligomerization. Minerva Ginecologica. 70 (5), 539-548 (2018).
- Ferre, S., et al. G protein-coupled receptor oligomerization revisited: functional and pharmacological perspectives. Pharmacological Reviews. 66 (2), 413-434 (2014).
- Marsango, S., Ward, R. J., Alvarez-Curto, E., Milligan, G. Muscarinic receptor oligomerization. Neuropharmacology. 136 (Pt C), 401-410 (2018).
- Oishi, A., Cecon, E., Jockers, R. Melatonin Receptor Signaling: Impact of Receptor Oligomerization on Receptor Function. International Review of Cell and Molecular Biology. 338, 59-77 (2018).
- Thelen, M., Munoz, L. M., Rodriguez-Frade, J. M., Mellado, M. Chemokine receptor oligomerization: functional considerations. Current Opinion in Pharmacology. 10 (1), 38-43 (2010).
- Van Craenenbroeck, K. GPCR oligomerization: contribution to receptor biogenesis. Subcellular Biochemistry. 63, 43-65 (2012).
- Wnorowski, A., Jozwiak, K. Homo- and hetero-oligomerization of beta2-adrenergic receptor in receptor trafficking, signaling pathways and receptor pharmacology. Cell Signaling Technology. 26 (10), 2259-2265 (2014).
- Fricke, F., Dietz, M. S., Heilemann, M. Single-molecule methods to study membrane receptor oligomerization. Chemphyschem. 16 (4), 713-721 (2015).
- Vidi, P. A., Ejendal, K. F., Przybyla, J. A., Watts, V. J. Fluorescent protein complementation assays: new tools to study G protein-coupled receptor oligomerization and GPCR-mediated signaling. Molecular and Cellular Endocrinology. 331 (2), 185-193 (2011).
- Trussell, H. J., et al., Trussell, J., et al. . Academic Press Library in Signal Processing. 4, 3-9 (2014).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-795 (2006).
- Nagerl, U. V., Willig, K. I., Hein, B., Hell, S. W., Bonhoeffer, T. Live-cell imaging of dendritic spines by STED microscopy. Proceedings of the National Academy of Sciences of the United States of America. 105 (48), 18982-18987 (2008).
- Tsekouras, K., Custer, T. C., Jashnsaz, H., Walter, N. G., Presse, S. A novel method to accurately locate and count large numbers of steps by photobleaching. Molecular Biology of the Cell. 27 (22), 3601-3615 (2016).
- Godin, A. G., et al. Revealing protein oligomerization and densities in situ using spatial intensity distribution analysis. Proceedings of the National Academy of Sciences of the United States of America. 108 (17), 7010-7015 (2011).
- Qian, H., Elson, E. L. Distribution of molecular aggregation by analysis of fluctuation moments. Proceedings of the National Academy of Sciences of the United States of America. 87 (14), 5479-5483 (1990).
- Chen, Y., Muller, J. D., So, P. T., Gratton, E. The photon counting histogram in fluorescence fluctuation spectroscopy. Biophysical Journal. 77 (1), 553-567 (1999).
- Dalal, R. B., Digman, M. A., Horwitz, A. F., Vetri, V., Gratton, E. Determination of particle number and brightness using a laser scanning confocal microscope operating in the analog mode. Microscopy Research and Technique. 71 (1), 69-81 (2008).
- Unruh, J. R., Gratton, E. Analysis of molecular concentration and brightness from fluorescence fluctuation data with an electron multiplied CCD camera. Biophysical Journal. 95 (11), 5385-5398 (2008).
- Hess, S. T., Huang, S., Heikal, A. A., Webb, W. W. Biological and chemical applications of fluorescence correlation spectroscopy: a review. Biochemistry. 41 (3), 697-705 (2002).
- Muller, J. D., Chen, Y., Gratton, E. Fluorescence correlation spectroscopy. Methods in Enzymology. 361, 69-92 (2003).
- Levi, V., Ruan, Q., Kis-Petikova, K., Gratton, E. Scanning FCS, a novel method for three-dimensional particle tracking. Biochemical Society Transactions. 31 (Pt 5), 997-1000 (2003).
- Hinde, E., et al. Quantifying the dynamics of the oligomeric transcription factor STAT3 by pair correlation of molecular brightness. Nature Communications. 7, 11047 (2016).
- Waithe, D., et al. Optimized processing and analysis of conventional confocal microscopy generated scanning FCS data. Methods. 140-141, 62-73 (2018).
- Digman, M. A., Dalal, R., Horwitz, A. F., Gratton, E. Mapping the number of molecules and brightness in the laser scanning microscope. Biophysical Journal. 94 (6), 2320-2332 (2008).
- Ossato, G., et al. A two-step path to inclusion formation of huntingtin peptides revealed by number and brightness analysis. Biophysical Journal. 98 (12), 3078-3085 (2010).
- Nagy, P., Claus, J., Jovin, T. M., Arndt-Jovin, D. J. Distribution of resting and ligand-bound ErbB1 and ErbB2 receptor tyrosine kinases in living cells using number and brightness analysis. Proceedings of the National Academy of Sciences of the United States of America. 107 (38), 16524-16529 (2010).
- Ming, A. Y., et al. Dynamics and Distribution of Klothobeta (KLB) and fibroblast growth factor receptor-1 (FGFR1) in living cells reveal the fibroblast growth factor-21 (FGF21)-induced receptor complex. Journal of Biological Chemistry. 287 (24), 19997-20006 (2012).
- Ross, J. A., et al. Oligomerization state of dynamin 2 in cell membranes using TIRF and number and brightness analysis. Biophysical Journal. 100 (3), L15-L17 (2011).
- Hellriegel, C., Caiolfa, V. R., Corti, V., Sidenius, N., Zamai, M. Number and brightness image analysis reveals ATF-induced dimerization kinetics of uPAR in the cell membrane. FASEB J. 25 (9), 2883-2897 (2011).
- Zamai, M., et al. Number and brightness analysis reveals that NCAM and FGF2 elicit different assembly and dynamics of FGFR1 in live cells. Journal of Cell Science. 132 (1), (2019).
- Hassler, K., et al. Total internal reflection fluorescence correlation spectroscopy (TIR-FCS) with low background and high count-rate per molecule. Optics Express. 13 (19), 7415-7423 (2005).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. From fast fluorescence imaging to molecular diffusion law on live cell membranes in a commercial microscope. Journal of Visualized Experiments. (92), e51994 (2014).
- Beenken, A., Mohammadi, M. The FGF family: biology, pathophysiology and therapy. Nature Reviews Drug Discovery. 8 (3), 235-253 (2009).
- Joubert, J., Sharma, D. Light microscopy digital imaging. Current Protocols in Cytometry. , (2011).
- Gell, C., Berndt, M., Enderlein, J., Diez, S. TIRF microscopy evanescent field calibration using tilted fluorescent microtubules. Journal of Microscopy. 234 (1), 38-46 (2009).
- Burghardt, T. P. Measuring incidence angle for through-the-objective total internal reflection fluorescence microscopy. Journal of Biomedical Optics. 17 (12), 126007 (2012).
- Trullo, A., Corti, V., Arza, E., Caiolfa, V. R., Zamai, M. Application limits and data correction in number of molecules and brightness analysis. Microscopy Research and Technique. 76 (11), 1135-1146 (2013).
- Caiolfa, V. R., et al. Monomer-dimer dynamics and distribution of GPI-anchored uPAR are determined by cell surface protein assemblies. Journal of Cell Biology. 179 (5), 1067-1082 (2007).
- Campbell, R. E., et al. A monomeric red fluorescent protein. Proceedings of the National Academy of Sciences of the United States of America. 99 (12), 7877-7882 (2002).
- Cutrale, F., et al. Using enhanced number and brightness to measure protein oligomerization dynamics in live cells. Nature Protocols. 14 (2), 616-638 (2019).
- Dunsing, V., Chiantia, S. A Fluorescence Fluctuation Spectroscopy Assay of Protein-Protein Interactions at Cell-Cell Contacts. Journal of Visualized Experiments. (142), (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.