È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modello di carcinogenesi cutanea indotta dalla sostanza chimica utilizzando Dimethylbenz[a]Anthracene e 12-O-Tetradecanoyl Phorbol-13-Acetate (DMBA-TPA)
In questo articolo
Riepilogo
La carcinogenesi cutanea a due stadi è indotta da due sostanze chimiche applicate topicamente. Un mutagen 7,12-dimethylbenz[a]anthracene) provoca mutazioni nelle cellule epidermiche e una continua applicazione dello stimolatore di crescita generale 12-O-tetradecanoyl phorbol-13-acetato accelera la formazione di papilloma cutaneo.
Abstract
Il cancro è una delle malattie umane più devastanti. I modelli sperimentali di cancro sono importanti per ottenere informazioni sulla complessa interazione di diversi tipi di cellule e geni nella promozione della progressione tumorale e per fornire una piattaforma per testare l'efficacia di diversi approcci terapeutici. Uno dei modelli di carcinogenesi infiammatoria sperimentale più comunemente utilizzati è il modello di carcinogenesi cutanea a due stadi DMBA-TPA. La formazione del tumore è indotta in questo modello dall'applicazione topica di due diverse sostanze chimiche, 7,12-dimethylbenz[a]anthracene (DMBA) e 12-O-tetradecanoyl phorbol-13-acetato (TPA), che insieme causano formazione di papilloma nella pelle. Poiché il risultato principale è la formazione di papilloma nella pelle, il modello è un modo ideale, affidabile e riproducibile per affrontare sia l'inizio del tumore (sopravvivenza senza tumore) che la progressione del tumore (numero e dimensione dei tumori visibili). Gli effetti del trattamento DMBA-TPA sono trasmessi attraverso un meccanismo infiammatorio, che rende questo modello particolarmente adatto per studiare il ruolo del sistema immunitario nella formazione del tumore. Tuttavia, questo modello è limitato alla pelle e ad altre superfici su cui possono essere applicate le sostanze chimiche. In questo articolo viene fornito un protocollo dettagliato per utilizzare correttamente il modello.
Introduzione
Il cancro è una delle principali cause di morte nel mondo. Pertanto, vi è la richiesta di sviluppare modelli di malattia sperimentale affidabili per ottenere una migliore comprensione della malattia e per esplorare potenziali approcci terapeutici. Uno dei modelli sperimentali in vivo più comunemente utilizzati per studiare lo sviluppo del cancro della pelle è il modello di carcinogenesi cutanea a due stadi indotto chimicamente1,2. Il modello fornisce uno strumento per studiare l'inizio del tumore, la promozione e la progressione, oltre a eventi specifici come l'infiltrazione delle cellule immunitarie e l'angiogenesi.
Per utilizzare il modello di carcinogenesi cutanea a due stadi, la pelle posteriore dei topi viene trattata con due diverse sostanze chimiche che insieme inducono la formazione del tumore. Il modello viene avviato con una dose bassa del mutageno, DMBA, seguita da un'esposizione prolungata al promotore del tumore, TPA3 (Figura 1). DMBA muta il DNA in modo casuale formando addotti covalenti con il DNA delle cellule epidermiche e delle cellule staminali primarie cheratinociti4,5,6,7. Alcune di queste mutazioni casuali avvengono in un proto-oncogene, come Hras1 (vengono rilevate anche mutazioni in Kras e Nras) e la conversione dei proto-oncogeni in oncogeni guida la formazione del tumore sotto stimoli adeguati. TPA, a sua volta, è l'agente di promozione della crescita del tumore più comunemente usato. Il suo obiettivo molecolare è la chinasi proteica C (PKC)8. TPA attiva anche la segnalazione Wnt/z-catenin che è cruciale per la formazione del tumore nel modello9. L'esposizione ripetuta e prolungata all'agente promotore porta a una migliore segnalazione cellulare, a una maggiore produzione di fattori di crescita e a una reazione infiammatoria locale, che sono evidenti a causa di una maggiore sintesi del DNA e infiltrazione infiammatoria delle cellule nella pelle trattata.
I principali mediatori infiammatori nel modello DMBA-TPA sono stati identificati10. L'interleucina-17A (IL-17A) è noto per essere particolarmente cancerogeno nel modello DMBA-TPA11,12. Lavora in sinergia con l'interleuchino 6 (IL-6) e partecipa al reclutamento di macrofagi e neutrofi13,14. Inoltre, CD4- cellule T e neutrofili hanno dimostrato di essere cancerogeni nel modello DMBA-TPA. Infine, i macrofagi possono anche promuovere la tumorigenesi nel modello15,16,17.
Durante la fase di promozione, la proliferazione cellulare delle cellule mutate è migliorata e un'iperplasia sostenuta dell'epidermide viene mantenuta1. Questo porta allo sviluppo del papilloma nella pelle in 10-20 settimane, dopo di che i papillomi iniziano a convertirsi in tumori maligni, carcinomi a cellule squamose (SCC)2. Tuttavia, meno del 10% dei papillomi progredisce verso la malignità, anche se questa percentuale dipende anche dal background genetico dei topi2,18. Per decenni non si sapeva quale tipo di cellule fossero inizialmente mutate nei tumori che portavano alla malignità, anche se alcuni studi avevano riportato caratteristiche chiaramente distinte nei tumori maligni rispetto ai papillomi benigni19,20. Tuttavia, studi recenti hanno notevolmente aumentato la nostra comprensione sull'origine clonale della formazione del tumore nel modello DMBA-TPA21. 22. 23.È stato dimostrato che sia le cellule epiteliali derivate dal midollo osseo che le cellule staminali del follicolo pilifero contribuiscono alla formazione del tumore22. Studi di tracciamento del lignaggio specifico dello stadio hanno svelato che i papillomi benigni sono di origine monoclonale, ma reclutano nuove popolazioni di cellule epiteliali21,23. Tuttavia, solo uno dei cloni cellulari funziona come conducente della carcinogenesi; contiene una mutazione Hras23. La progressione verso la formazione di carcinoma è associata a uno sweep clonale23.
Il DMBA cancerogeno avvia la formazione del papilloma e il TPA promuove la crescita del tumore. Quindi, l'inizio del tumore può essere studiato separatamente dalla promozione interrompendo l'esperimento prima del periodo di trattamento TPA. Come la progressione del tumore è studiato settimanalmente offre una grande opportunità per l'analisi dettagliata della crescita del tumore in tutto lo studio. Poiché i tumori sono generati da sostanze chimiche esterne, una mutazione oncogenica nella linea germinale non è necessaria. Così, lo studio degli effetti di un background genetico (ad esempio, knockout/transgene vs tipo selvaggio) sulla tumorigenesi è semplice2. In sintesi, il modello di cancro della pelle DMBA/TPA è un approccio particolarmente utile per studiare il ruolo del sistema immunitario nella progressione tumorale, nonché per la valutazione delle fasi di avvio e promozione del tumore in modo indipendente o interdipendente.
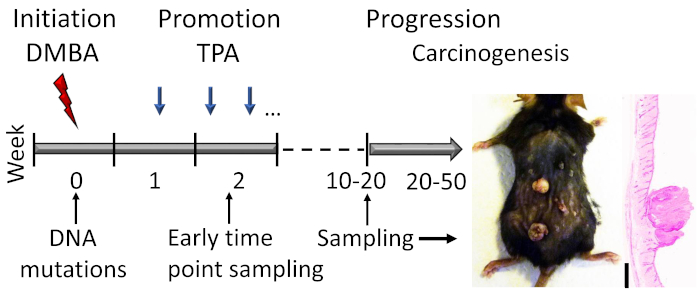
Figura 1: contorno del modello di carcinogenesi cutanea indotta da DMBA-TPA. La DMBA cancerogena è applicata topicamente per indurre mutazioni del DNA nella fase di avvio del modello. L'agente di promozione della crescita TPA viene somministrato 2volte a settimana per migliorare la proliferazione cellulare durante la fase di promozione, portando allo sviluppo di papillomi nella pelle. Gli animali vengono sacrificati dopo che la risposta al papilloma raggiunge un altopiano, di solito entro settimane 15-20, a seconda del background genetico dei topi. Una piccola parte dei papillomi può svilupparsi ulteriormente in CCN entro 20-50 settimane. Per studiare i primi eventi nella fase di avvio e promozione precoce, è possibile raccogliere campioni (ad esempio, poco dopo la seconda applicazione TPA). Una fotografia rappresentativa e ematossilina e eosina macchiato sezione trasversale di papillomi su una pelle di topo C57BL/6 dopo 19 settimane di trattamento sono mostrati. Barra di scala - 0,1 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocollo
Il protocollo qui descritto è stato approvato dal Comitato Nazionale Per l'Etica animale della Finlandia (numero di protocollo ESAVI/23659/2018).
1. Animali sperimentali, reagenti e attrezzature
- Usa l'età e i topi abbinati al sesso. Iniziare lo studio a 7-9 settimane di età, perché la pelle nella maggior parte dei topi è in telogen (la fase di riposo) intorno a quell'età2.
- Osservare il comportamento degli animali durante lo studio e se combattono, che spesso accade con i maschi, ospitarli separatamente. I combattimenti possono causare tagli nella pelle, che promuovono la formazione del tumore. I topi femminili sono preferiti a causa del loro comportamento meno aggressivo. La dimensione tipica del gruppo sperimentale varia tra 8-20 animali per gruppo24,25,26,27.
NOTA: I calcoli di potenza basati sulla varianza biologica osservata negli studi precedenti aiutano a scegliere una dimensione di gruppo sufficientemente grande. I ceppi utilizzati come esempi in questo articolo includono Balb/c e C57BL/6. Tuttavia, molti altri ceppi di mouse come SENCAR e FVB sono stati utilizzati con il modello DMBA-TPA, così come i ratti Wistar e Sprague-Dawley2,28,29. Prima dell'inizio dello studio è necessaria una licenza del comitato nazionale o locale per il lavoro sugli animali. Oltre alle considerazioni generali sul benessere, gli endpoint specifici del modello sono in genere il carcinoma a cellule squamose (SCC) e un'infezione della pelle. Graffi nella pelle a causa di prurito dopo l'applicazione delle sostanze chimiche tumorigene in acetone è tipico, ma per il resto gli animali dovrebbero non mostrare segni di disagio. La pesatura regolare (ad esempio, 2 volte al mese) aiuta a valutare il benessere degli animali. - Utilizzare il DMBA e il TPA, entrambi diluiti in acetone. La concentrazione di lavoro di DMBA è di 250 g/L. Una dose per un animale è di 50 g di DMBA in 200 -L di acetone. La concentrazione di magazzino di TPA è di 125 g/L e la concentrazione di trattamento 25 g/L. Una dose di TPA per un animale è di 5 g in 200 l di acetone.
PRUDENTE: DMBA è dannoso se ingerito e può causare il cancro. L'acetone evapora rapidamente ed è infiammabile. Può causare vertigini e irritare gli occhi. Utilizzare una maschera di respirazione e/o lavorare sotto un flusso di vuoto. Cambiare i guanti dopo aver maneggiato una qualsiasi di queste sostanze chimiche. Le gabbie ventilate individualmente impediscono la diffusione delle sostanze chimiche durante l'alloggiamento dei topi. Dopo l'applicazione, raccogliere le punte pipette utilizzate per la gestione del DMBA e smaltire come rifiuti pericolosi.
NOTA: Il DMBA deve essere protetto dalla luce. Il TPA diluito è immagazzinato in -20 gradi centigradi, preferibilmente protetto dalla luce. - Procurare la seguente attrezzatura: una scala, un rasoio ordinario per la pelliccia, pipette e punte di dimensioni appropriate, un righello ordinario, una fotocamera digitale, un blocco note e una penna o un computer per la registrazione dei papillomi, un sistema di anestesia inalato o un restrainer per topi con un'apertura sul piano posteriore, e un sistema di narcosi di anidride carbonica per sacrificare i topi.
2. Skin Papilloma Induzione e promozione
- Rasare la pelle posteriore e pesare l'animale. Successivamente, radere la pelle quando necessario, ma non al momento dell'esposizione chimica.
NOTA: Fare attenzione quando la rasatura intorno ai papillomi ed evitare di fare eventuali tagli sulla pelle. Pesare ogni animale ogni 2 settimane per notare qualsiasi potenziale perdita di peso. - Applicare 50 g di DMBA in 200 -L di acetone topicamente sulla zona rasata utilizzando una pipetta 48 h dopo aver rasato la pelliccia. Se necessario, trattenere l'animale usando anestesia per inalazione leggera o un restrainer per topi.
- Dopo 7 giorni, dare la prima dose tPA. Applicare il 5o g di TPA in 200 -L topically con una pipetta 2 volte a settimana, preferibilmente lunedì e giovedì o martedì e venerdì.
- Conta, registra e fotografa i papillomi ogni settimana. Una massa palpabile di 1 mm di diametro è considerata un papilloma se rimane più lunga di 1 settimana. Segna ogni singolo papilloma su una mappa ed elenca le sue dimensioni ogni settimana. Memorizzare fotografie digitali.
3. Sacrificio animale e collezione di campioni
- Continuare il trattamento fino a quando la risposta del tumore raggiunge un altopiano. Generalmente, il carico di papilloma dovrebbe aumentare 10-20 settimane dopo l'avvio, a seconda del ceppo del topo utilizzato. L'altopiano è atteso tra 15-20 settimane. Una piccola parte dei papillomi (sotto il 3%) possono svilupparsi in CCN entro 20-50 settimane2.
- Sacrificare gli animali 24 h dopo l'ultima applicazione TPA. Utilizzare la narcosi di anidride carbonica con lussazione cervicale o un altro metodo adatto.
- A seconda della domanda di ricerca, raccogliere il materiale campione appropriato dagli animali30,31.
- Ad esempio, prelevare campioni di sangue prima di sacrificarsi e separare il plasma.
- Tagliare pezzi della pelle per la colorazione immunoistochimica (IHC) (ad esempio, ematossialina ed eosina, cellule proliferanti o infiammatorie).
- Utilizzare punzoni di biopsia per raccogliere pezzi di pelle con tessuto papilloma o pelle non papilloma (trattata) per l'espressione genica (ad esempio, qPCR) e/o analisi proteiche (ad esempio, macchia occidentale o ELISA).
- Raccogliere un pezzo dei linfonodi che drenano la milza e della pelle per l'analisi della citometria del flusso se si desidera un'analisi più dettagliata delle popolazioni di cellule immunitarie. È inoltre possibile separare gli strati epidermici e dermici per ulteriori analisi.
4. Statistiche
- Disegna una curva di sopravvivenza Kaplan-Meier del tempo senza papilloma e usa il test di rango di log Mantel-Cox per la sopravvivenza. Disegnare una curva lineare del numero di papillomi a settimana. Poiché si tratta di dati di conteggio, utilizzare un modello di regressione non lineare. Se necessario, consultare uno statistico.
Risultati
Il risultato principale è il tempo di sopravvivenza (cioè senza papilloma) tra i gruppi di trattamento o genotipi. Il risultato secondario è il numero di papillomi a settimana in ogni gruppo (Figura 2). I risultati attesi sono una differenza statisticamente significativa nel tempo libero del papilloma e nel numero di papillomi tra i gruppi sperimentali (due o più). Si raccomanda di contare il numero di papillomi e disegnare una curva durante la fase di promozione (TPA) per avere un'idea ...
Discussione
Il cancro della pelle indotta da DMBA-TPA è uno dei modelli tumorali più comunemente usati perché è altamente riproducibile e fornisce informazioni sulla progressione del tumore dall'inizio alla malignità. La misura dei risultati chiave, la formazione del papilloma, è facilmente e in modo affidabile quantitativo. Il modello affronta sia l'inizio tumorale (sopravvivenza senza tumore) che la progressione (numeri e dimensioni del tumore) contemporaneamente. Il modello è adatto per studiare diversi composti, come pote...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato dall'Accademia di Finlandia (concede 25013080481 e 25013142041 (I.J.), 286377 e 295814 (M.P.), 287907 (T.J.)), P'ivikki e Sakari Sohlberg Foundation (M.P.), T.J.), Finnish Medical Foundation (T.P.), The Competitive State Research (Fondazione Medica Finlandese) (T.P.), The Competitive State Research (Fondazione Medica Finlandese) Finanziamento dell'Expert Responsibility Area of Tampere University Hospital (grant 9V049 e 9X044 (M.P.), 9X011 e 9V010 (T.J.), The Competitive State Research Financing of the Expert Responsibility Area of Fimlab Laboratories (Grant X51409 (I.J.)), Tays Fondazione di sostegno (I.J., M.P., T.J.), Tampere Tuberculosis Foundation (I.J., M.P., T.J.), la Fondazione Culturale Finlandese (M.V.), la Fondazione Paulo (T.P.), la Cancer Society of Finland (M.P.) e la Fondazione Emil Aalton (T.P.).
Materiali
| Name | Company | Catalog Number | Comments |
| 1000 ul RPT XL Graduated Filter Tip (Sterile), Refill | Starlab | S1182-1730-C | |
| 300 ul RTP Graduated Filter Tip (sterile), Refill | Starlab | S1180-9710-C | |
| 7,12-Dimethylbenz[a]anthracene (DMBA) | Sigma | D3254-100MG | Harmful if swallowed and may cause cancer. Store protected from light. |
| Acetone | Sigma | 1000141011 | Evaporates rapidly and is inflammable. |
| Attane vet 1000 mg/g | Piramal Critical Care Limited | Liquid isoflurane for inhalation | |
| Battery-Operated Clipper Isis | Albert Kerlb GmbH | GT421 | For shaving the fur |
| CONTRAfluran-Restgasfilter | ZeoSys GmbH | For anesthesia | |
| Linex Nature N1030 Ruler 30 cm | Staples Business Advantage | 60383 | For measuring papillomas |
| Medium CO2 Chamber 300 x 200 x 200mm - Red | VetTech Solutions Ltd | AN045AR | For sacrifice |
| Mekasoft | Mekalasi | 23008 | Table cover |
| Mice (Balb/c JRj) | Janvier labs | Other strains also possible | |
| Mice (C57BL/6JRj) | Janvier labs | Other strains also possible | |
| Panasonic Lumix DMC-FS5 Digital Camera | Panasonic | ||
| Paraformaldehyde | Merck | 30525-89-4 | For histology samples |
| Phorbol 12-myristate 13-acetate aka 12-Otetradecanoylphorbol-13-acetate (TPA) | Enzo | BML-PE160-0001 | |
| Precision balance PLJ-C/PLJ-G | KERN & SOHN GmbH | PLJ 600-3CM | |
| Pre-Set CO2 System-2 Chamber-S/S Housing | VetTech Solutions Ltd | AN044BX | For sacrifice |
| RNAlater | Qiagen | 76104 | For nucleic acid samples |
| Tacta pipette 100-1000 ul | Sartorius | LH-729070 | |
| Tacta pipette 20-200 ul | Sartorius | LH-729060 | |
| UNO Anaesthetic Key Filler | Scintica instrumentation inc. | For anesthesia | |
| UNO Face Mask for Mouse | Scintica instrumentation inc. | For anesthesia | |
| UNO FM2200 Flowmeter | Scintica instrumentation inc. | For anesthesia | |
| UNO Gas Exhaust Unit | Scintica instrumentation inc. | For anesthesia | |
| UNO Induction Box | Scintica instrumentation inc. | For anesthesia | |
| UNO200VAP Vaporizer | Scintica instrumentation inc. | For anesthesia |
Riferimenti
- DiGiovanni, J. Multistage carcinogenesis in mouse skin. Pharmacology & Therapeutics. 54 (1), 63-128 (1992).
- Abel, E. L., Angel, J. M., Kiguchi, K., DiGiovanni, J. Multi-stage chemical carcinogenesis in mouse skin: fundamentals and applications. Nature Protocols. 4 (9), 1350-1362 (2009).
- Perez-Losada, J., Balmain, A. Stem-cell hierarchy in skin cancer. Nature Reviews. Cancer. 3 (6), 434-443 (2003).
- Bonham, K., et al. Activation of the cellular Harvey ras gene in mouse skin tumors initiated with urethane. Molecular Carcinogenesis. 2 (1), 34-39 (1989).
- Quintanilla, M., Brown, K., Ramsden, M., Balmain, A. Carcinogen-specific mutation and amplification of Ha-ras during mouse skin carcinogenesis. Nature. 322 (6074), 78-80 (1986).
- Nelson, M. A., Futscher, B. W., Kinsella, T., Wymer, J., Bowden, G. T. Detection of mutant Ha-ras genes in chemically initiated mouse skin epidermis before the development of benign tumors. Proceedings of the National Academy of Sciences of the United States of America. 89 (14), 6398-6402 (1992).
- Morris, R. J. A perspective on keratinocyte stem cells as targets for skin carcinogenesis. Differentiation. 72 (8), 381-386 (2004).
- Chung, Y. W., Kim, H. K., Kim, I. Y., Yim, M. B., Chock, P. B. Dual function of protein kinase C (PKC) in 12-O-tetradecanoylphorbol-13-acetate (TPA)-inducec manganese superoxide dismutase (MnSOD) expression: activation of CREB and FOXO3a by PKC-alpha phosphorylation and by PKC-mediated inactivation of Akt, respectively. The Journal of Biological Chemistry. 286 (34), 29681-29690 (2011).
- Su, Z., et al. Tumor promoter TPA activates Wnt/β-catenin signaling in a casein kinase 1-dependent manner. Proceedings of the National Academy of Sciences of the United States of America. 115 (32), 7522-7531 (2018).
- Swann, J. B., et al. Demonstration of inflammation-induced cancer and cancer immunoediting during primary tumorigenesis. Proceedings of the National Academy of Sciences of the United States of America. 105 (2), 652-656 (2008).
- Wang, L., Yi, T., Zhang, W., Pardoll, D. M., Yu, H. IL-17 enhances tumor development in carcinogen-induced skin cancer. Cancer Research. 70 (24), 10112-10120 (2010).
- He, D., et al. IL-17 mediated inflammation promotes tumor growth and progression in the skin. PLoS One. 7 (2), 32126 (2012).
- Roussel, L., et al. IL-17 promotes p38 MAPDK-dependent endothelial activation enhancing neutrophil recruitment to sites of inflammation. Journal of Immunology. 184 (8), 4531-4537 (2010).
- Wanqiu, H., Young-Hee, J., Hyun, S. K., Byung, S. K. Interleukin-6 (IL-6) and IL-17 synergistically promote viral persistence by inhibition cellular apoptosis and cytotoxic T cell function. Journal of Virology. 88 (15), 8479-8489 (2014).
- Yusuf, N., et al. Antagonistic roles of CD4+ and CD8+ T-cells in 7,12-dimethylbenz(a)anthracene cutaneous carcinogenesis. Cancer Research. 68 (10), 3924-3930 (2008).
- Gong, L., et al. Promoting effect of neutrophils on lung tumorigenesis is mediated by CXCR2 and neutrophil elastase. Molecular Cancer. 12 (1), 154 (2013).
- Vestweber, D., Wessel, F., Nottebaum, A. F. Similarities and differences in the regulation of leukocyte extravasation and vascular permeability. Seminars in Immunopathology. 36 (2), 177-192 (2014).
- Woodworth, C. D., et al. Strain-dependent differences in malignant conversion of mouse skin tumors is an inherent property of the epidermal keratinocyte. Carcinogenesis. 25 (9), 1771-1778 (2004).
- Tennenbaum, T., et al. The suprabasal expression of alpha 6 beta 4 integrin is associated with a high risk for malignant progression in mouse skin carcinogenesis. Cancer Research. 53 (20), 4803-4810 (1993).
- Hennings, H., Shores, R., Mitchell, P., Spangler, E. F., Yuspa, S. H. Induction of papillomas with a high probability of conversion to malignancy. Carcinogenesis. 6 (11), 1607-1610 (1985).
- Auto, Y., et al. Time-Series Analysis of Tumorigenesis in a Murine Skin Carcinogenesis Model. Scientific Reports. 8 (1), 12994 (2018).
- Park, H., et al. Bone marrow-derived epithelial cells and hair follicle stem cells contribute to development of chronic cutaneous neoplasms. Nature Communications. 9 (1), 5293 (2018).
- Reeves, M. Q., Kandyba, E., Harris, S., Del Rosario, R., Balmain, A. Multicolour lineage tracing reveals clonal dynamics of squamous carcinoma evolution from initiation to metastasis. Nature Cell Biology. 20 (6), 699-709 (2018).
- Dao, V., et al. Prevention of carcinogen and inflammation-induced dermal cancer by oral rapamycin includes reducing genetic damage. Cancer Prevention Research. 5, 400-409 (2015).
- Yeong, L. T., Abdul Hamid, R., Saiful Yazan, L., Khaza’ai, H., Mohtarrudin, N. Low dose triterpene-quinone fraction from Ardisia crispa root precludes chemical-induced mouse skin tumor promotion. BMC Complementary and Alternative Medicine. 15 (1), 431 (2015).
- Kong, Y. H., Xu, S. P. Salidroside prevents skin carcinogenesis induced by DMBA/TPA in a mouse model through suppression of inflammation and promotion of apoptosis. Oncology Reports. 39 (6), 2513-2526 (2018).
- Jung, M., Bu, S. Y., Tak, K. H., Park, J. E., Kim, E. Anticarcinogenic effect of quercetin by inhibition of insulin-like growth factor (IGF)-1 signaling in mouse skin cancer. Nutrition Research and Practice. 7 (6), 439-445 (2013).
- Hu, Y. Q., Wang, J., Wu, J. H. Administration of resveratrol enhances cell-cycle arrest followed by apoptosis in DMBA-induced skin carcinogenesis in male Wistar rats. European review for medical and pharmacological sciences. 13, 2935-2946 (2016).
- Schweizer, J., Loehrke, H., Hesse, B., Goerttler, K. 7,12-Dimethylbenz[a]anthracene/12-O-tetradecanoyl-phorbol-13-acetate-mediated skin tumor initiation and promotion in male Sprague-Dawley rats. Carcinogenesis. 3 (7), 785-789 (1982).
- Vähätupa, M., et al. T-cell-expressed proprotein convertase FURIN inhibits DMBA/TPA-induced skin cancer development. Oncoimmunology. 5 (12), 1245266 (2016).
- May, U., et al. Resistance of R-Ras knockout mice to skin tumour induction. Scientific Reports. 5, 11663 (2015).
- Krajewska, M., et al. Image analysis algorithms for immunohistochemical assessment of cell death events and fibrosis in tissue sections. The Journal of Histochemistry and Cytochemistry. 57 (7), 649-663 (2009).
- Järvinen, T. A., Ruoslahti, E. Target-seeking antifibrotic compound enhances wound healing and suppresses scar formation in mice. Proceedings of the National Academy of Sciences of the United States of America. 107 (50), 21671-21676 (2010).
- Schwarz, M., Münzel, P. A., Braeuning, A. Non-melanoma skin cancer in mouse and man. Archives of Toxicology. 87 (5), 783-798 (2013).
- Slaga, T. J. SENCAR mouse skin tumorigenesis model versus other strains and stocks of mice. Environmental Health Perspectives. 68, 27-32 (1986).
- Goerttler, K., Loehrke, H., Schweizer, J., Hesse, B. Systemic two-stage carcinogenesis in the epithelium of the forestomach of mice using 7,12-dimethylbenz(a)anthracene as initiator and the phorbol ester 12-O-tetradecanoylphorbol-13-acetate as promoter. Cancer Research. 39 (4), 1293-1297 (1979).
- Topping, D. C., Nettesheim, P. Promotion-like enhancement of tracheal carcinogenesis in rats by 12-O-tetradecanoylphorbol-13-acetate. Cancer Research. 40, 4352-4355 (1980).
- Wille, J. J. Circadian rhythm of tumor promotion in the two-stage model of mouse tumorigenesis. Cancer Letters. 190 (2), 143-149 (2003).
- Lee, Y. S., et al. Inhibition of skin carcinogenesis by suppression of NF-κB dependent ITGAV and TIMP-1 expression in IL32γ overexpressed condition. Journal of Experimental & Clinical Cancer Research. 37 (1), 293 (2018).
- Kiss, A., et al. Cell type-specific p38δ targeting reveals a context-, stage-, and sex-dependent regulation of skin carcinogenesis. International Journal of Molecular Sciences. 20 (7), 1532 (2019).
- Tomo-o, I., et al. Positron emission tomography imaging of DMBA/TPA mouse skin multi-step tumorigenesis. Molecular Oncology. 4 (2), 119-125 (2010).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454 (7203), 436-444 (2008).
- Crusz, S. M., Balkwill, F. R. Inflammation and cancer: advances and new agents. Nature Reviews. Clinical Oncology. 12 (10), 584-596 (2015).
- Hennings, L., et al. Malignant conversion and metastasis of mouse skin tumors: a comparison of SENCAR and CD-1 mice. Environmental Health Perspectives. 68, 69-74 (1986).
- Gómez-Cuadrado, L., Tracey, N., Ma, R., Qian, B., Brunton, V. G. Mouse models of metastasis: progress and prospects. Disease Models & Mechanisms. 10 (9), 1061-1074 (2017).
- Ouhtit, A., Ananthaswamy, H. N. A model for UV-induction of skin cancer. Journal of Biomedicine and Biotechnology. 1 (1), 5-6 (2001).
- Day, C. -. P., Marchalik, R., Merlino, G., Michael, H. T. Mouse models of UV-induced melanoma: genetics, pathology, and clinical relevance. Laboratory Investigation. 97 (6), 698-705 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon