Method Article
蜜蜂群落花粉的采集和鉴定
摘要
我们描述了从蜜蜂中收集棒状花粉的方法,以及用于颜色分类,乙酰分解和花粉显微镜载玻片制备的方案,用于分类鉴定。此外,我们还介绍了使用花粉陷阱从五个种植系统中收集的球状花粉的颗粒颜色和分类多样性。
摘要
研究人员经常收集和分析蜜蜂的花粉,以确定它们觅食花粉的植物来源,或估计蜜蜂通过花粉接触农药。本文描述的是一种有效的花粉捕获方法,用于从蜜蜂返回其蜂巢中收集棒状花粉。这种收集方法产生大量的微粒花粉,可用于研究目的。蜜蜂从许多植物物种中收集花粉,但通常在每次收集过程中访问一个物种。因此,每个花粉颗粒主要代表一种植物物种,并且每个花粉颗粒可以用颜色来描述。这允许按颜色对棒状花粉样品进行分类,以分离植物来源。研究人员可以通过分析乙酰化花粉颗粒的形态来进一步分类花粉,以进行分类鉴定。这些方法通常用于与传粉媒介相关的研究,例如授粉效率,传粉媒介觅食动力学,饮食质量和多样性。详细介绍了使用花粉陷阱收集花粉,按颜色对花粉进行分类以及乙酰化花粉粒的方法。还介绍了与在五种不同种植系统中从蜜蜂收集的颗粒颜色和棒状花粉分类群的频率有关的结果。
引言
西部蜜蜂(蜜蜂 )是许多依赖蜜蜂授粉的农作物的重要传粉媒介1。十多年来,据报道,蜜蜂群落损失严重,2,3,4,5,6,7,8,9。包括寄生虫和疾病,营养不良和杀虫剂在内的几个因素与这些菌落下降有关10。营养不良可归因于农业集约化和觅食栖息地的丧失11.必须了解蜜蜂在不同景观中利用的花卉资源,以改善蜜蜂营养并帮助蜜蜂保护工作。花粉是蜜蜂蛋白质,脂质,维生素和矿物质的主要来源,已被用于许多农业和生态学研究,以了解蜜蜂的殖民地级觅食偏好,评估花粉捕获对蜜蜂群落的影响,并确定蜜蜂的农药暴露12,13,14。
蜜蜂从花朵中收集花粉,将花粉包装成小球上的颗粒 - 后腿上的胫骨花粉篮 - 然后返回殖民地储存。可以通过在蜂巢入口处或花朵上捕获它们,短暂冷却它们以固定它们,然后用镊子从它们的后腿上取出花粉颗粒,从它们身上去除花粉颗粒,从而从觅食者身上去除。如果需要大量花粉,从单独捕获的觅食者那里手工收集体状花粉的费力过程是缓慢而低效的。收集大量花粉的一种更简单,更有效的方法是在蜂巢入口处捕获蜜蜂的棒状花粉颗粒。花粉陷阱旨在将回流的花粉觅食者的腿部移走,因为它们进入蜂巢15。觅食者必须挤过网孔,这些网孔的大小足以让蜜蜂工人的身体通过。
当蜜蜂穿过其中一个孔时,较大的花粉颗粒从她的腿上刮下来并落入收集托盘16。研究表明,花粉捕获刺激觅食者收集更多的花粉,从而提高周围作物和植被的授粉效率17,18,19,20。花粉收集方法也可用于了解蜜蜂在景观中使用的饲料,作为确定开花植物物种的数量,质量和分类群的第一步。因此,有效的花粉捕获方法有助于授粉和蜜蜂营养研究。这些花粉收集方法的比较如 表1所示。花粉觅食行为将根据蚁群对储存花粉的需求而改变,相对于其卵和幼虫种群水平21,22。由于这些变化包括不同的收集强度,因此在同一地点的菌落之间以及同一种植系统或景观类型的不同地点之间,花粉数量通常预计会有很大变化23,24。增加菌落数量和位置以捕获花粉将有助于适应这种变化。
花粉陷阱的效率为25,26。蜜蜂收集的花粉颗粒的大小因植物物种而异,并且可以根据殖民地27,28中的花粉储存水平而变化。这有可能使较小的花粉颗粒在通过花粉陷阱收集的样本中代表性不足,而较大的颗粒被过度代表。成年蜜蜂的体型各不相同,这也会影响陷阱中收集的花粉的代表性。还有一些植物物种主要产生花蜜,如果只评估某些景观中收集的花粉,则不会被发现。捕集效率还受到觅食者漂移和定向障碍的影响,而觅食者漂移和定向障碍则受花粉捕集类型和蜂巢设备状况的影响。通过采用本文中指定的技术可以缓解此问题。研究人员可以考虑其他研究技术,例如计算觅食者的花朵访问次数,以补充殖民地级觅食偏好的结果。评估花粉多样性的一种有用方法是按颜色对花粉进行分类。虽然蜜蜂是多面手觅食者,但它们也表现出花的保真度,在任何给定的收集之旅中,它们都会在同一地点收集来自同一植物物种的花粉。基于这种觅食行为,假设任何给定的花粉颗粒主要由单个植物物种27,29,30,31表示。因此,科学家可以通过按颗粒颜色对花粉进行分类来描述花粉多样性,并报告检测到的颜色总数或每个颜色组代表的总和的比例12,32,33,34。这可以通过测量每个颜色组的质量或颗粒计数来实现。如果来自不同分类群的颗粒重量存在已知或可疑的系统差异,则建议测量每个颜色组的颗粒计数。系统性差异可能是由颗粒大小或觅食者在形成颗粒时添加到花粉中的花蜜量引起的。
颜色分选是一个省时和简单的过程,但对于一些授粉研究可能不具有可接受的准确性,因为不同的植物分类群可能具有相似的花粉颗粒颜色35,36。此外,花粉颗粒可以分离的不同颜色组的数量存在后勤限制。因此,在授粉研究中,将每个单独的植物分类群花粉分离成其自己独特的颗粒颜色组可能并不总是可能的。通过光学显微镜对花粉颗粒进行形态学表征通常通过区分相同颜色组的颗粒中两个或多个分类群的花粉来补充颗粒的颜色分离。虽然在给定的花粉颗粒颜色组中经常发现多个分类群的花粉颗粒,但蜜蜂收集的单个花粉颗粒通常包括一个主要分类群,可能与其他分类群少量一起。因此,通常假设蜜蜂的花粉颗粒的分类学保真度。来自其他传粉媒介的花粉颗粒不表现出花的保真行为,如大黄蜂,通常含有许多植物物种,可能不具有主要的分类群。在需要定量估计多花卉花粉颗粒中分类群比例的情况下,还需要包括乙酰溶解在内的微观方法进行适当的分析。
评估乙酰化花粉粒的形态特征是分类鉴定最常用的方法16.乙酰溶解程序去除花粉颗粒的原生质,以暴露可以在光学显微镜下观察到的诊断特征37,38。使用这种方法,研究人员可以报告不同的分类群,在特定种植系统中发现的分类群的频率,以及颗粒颜色的主要分类群33,36。乙酰溶解是揭示花粉形态的最佳分析技术28.然而,一些乙酰溶出的花粉颗粒,如许多蔷薇科类型,不能仅通过乙酰溶解和光学显微镜识别到属或种水平。研究人员认为扫描电子显微镜或元条形码是实现属或种级鉴定的替代方法。然而,这些替代方法仅提供定性分类群鉴定,并且无法估计不同花粉颗粒中不同花粉谷物分类群的比例36,39。此外,这些方法的费用和必要的专业知识要高得多。 表1说明了这些识别方法的比较。
| 方法 | 时间 | 费用 | 分辨率 | 专门知识 |
| 花粉收集 | ||||
| 花粉诱捕 | 低 | 温和 | 变量 | 温和 |
| 花粉觅食者收集 | 高 | 温和 | 高 | 低 |
| 花粉鉴定 | ||||
| 可视(仅限颜色排序) | 温和 | 低 | 低 | 低 |
| 乙酰溶解 | 温和 | 温和 | 温和 | 温和 |
| 扫描电子显微镜 | 高 | 高 | 高 | 高 |
| 元条形码 | 变量 | 高 | 高 | 高 |
表1:基于时间,费用,分辨率和专业知识的不同花粉收集和鉴定方法的比较。 视觉方法(仅限颜色排序)报告检测到的颜色总数或每个颜色组表示的总和比例,作为确定花粉来源的指标,但不提供分类标识。
关于捕获和分类花粉以及乙酰化花粉颗粒的可用信息是多种多样的,并且通常分布在多个来源中,对于不同领域的研究人员来说各不相同。本文详细介绍了研究人员和养蜂人可以用来有效收集大量花粉的不同类型的花粉陷阱。还提供了通过乙酰分解,染色和载玻片安装制备花粉样品的方案,用于植物分类群鉴定。这里详细介绍的方法很全面,可以作为识别蜜蜂在特定景观中觅食的主要植物物种的独特资源,特别是在种植系统中。基于先前研究的这些方法的发现已经提出,并记录了五种种植系统中蜜蜂收集的花粉颗粒颜色和植物分类群的多样性14.
研究方案
1. 使用花粉陷阱从蜜蜂群落收集花粉
- 确定何时从所需的养蜂场位置捕获花粉。
注意:理想的气候条件包括充分暴露在阳光下,低风速,低湿度,以及在花粉收集所需期间没有预测降水。 - 选择最佳的蜜蜂群落,将花粉捕获在养蜂场的位置。
- 通过计算返回菌落入口的觅食者2分钟来评估菌落强度。选择返回觅食者总数最多的蚁群。
- 选择带有木器的蜂巢,这些木器状况良好,最好没有额外的入口和扭曲的盖子。使用具有较少替代入口的菌落,因为它们增加了返回觅食者重新定向到陷阱入口的可能性。
- 尽可能选择朝南的蜂巢入口。如果对蜂巢进行码垛,则在给定托盘上朝向相同方向的每个菌落上安装花粉陷阱,以避免觅食者漂移到邻近的蜂巢入口处。
- 如果需要,通过检查框架中是否存在幼虫来评估殖民地的育雏巢。选择幼虫数量相对较大的菌落。
- 在选定的蜜蜂菌落上安装花粉陷阱。
注意:安装将根据花粉陷阱的类型而有所不同。类型包括 a) 前置、b) 底部安装、c) 顶部安装或 d) 螺旋孔入口安装。有关详细信息,请参阅讨论部分。- 对于前置式疏水阀,请使用订书钉、螺钉和胶带将疏水阀固定在入口前方,或将疏水阀连接到缠绕在蜂巢周围的蹦极绳上。对于底部安装的陷阱,将陷阱放在最低的蜂巢盒下方,并将陷阱入口固定在原始入口附近。对于螺旋孔安装疏水阀,请使用订书钉、螺钉和胶带将疏水阀直接安装在蜂巢盒的螺旋钻孔前面。对于顶部安装的疏水阀,请将疏水阀放在最上面的蜂巢盒上方和盖子下方。
- 使用非粘性和可模塑材料(如乳胶或聚氨酯泡沫)或用于螺旋孔的 #8 五金布(2.7 mm 孔径)密封所有其他可能的菌落入口。使用胶带处理小裂缝。
- 如果使用前置式疏水阀,请在收集篮和草地之间放置一道屏障,例如橡胶垫,以避免露水对水分造成损害。
- 在安装后24小时和当天觅食飞行开始之前(傍晚/清晨),使用花粉陷阱的诱捕机制。
注意:此步骤是理想的,但不是必需的。如果在整个给定时期内将花粉困在同一菌落上,则每隔一周进行花粉陷阱。 - 从收集托盘中收集棒状花粉,将其放入塑料袋或离心管中,并储存在装有冰的冷却器中。
- 为了评估花粉物种的多样性和丰度,例如景观级营养研究,每隔两到三个72小时收集花粉40。
- 对于农药残留分析,每隔24小时至96小时收集花粉,至少3g用于处理41。
- 通过清除蜂部和其他蜂巢碎屑来清洁花粉。
注意:处理花粉样品时使用一次性手套,并在样品之间更换一次性手套。使用单独的工具从每个陷阱中收集的花粉中清除碎屑。在使用工具处理另一批被困花粉之前,请冲洗并擦干。 - 如果花粉用于花粉源鉴定、数量评估或农药残留分析,则将花粉储存在-20°C或以下以保持其成分完整性41,42.
- 从蜂巢中取出疏水阀后,用5%的漂白剂溶液对所有设备进行灭菌,冲洗并在下次使用前干燥设备。
2. 花粉颗粒颜色分选,用于下游花粉源鉴定和数量评估
- 确保至少有20克花粉样本可以使用。将花粉样品在其袋子或其他适当大小的容器中彻底混合,以获得其中包含的所有颗粒的均匀混合物。为避免在下一步中出现意外偏差,请在从样品袋中取出子样品之前,将样品的颜色组成从视图中遮挡。
- 使用勺子或大勺子,舀出10克花粉作为整个花粉的代表性子样本。慢慢地将颗粒从铲子中倒到天平上,直到显示屏显示10克。如果第一勺不够大,请以相同的方式从样品中取出另一勺。
注意:这些指定的重量要求(20 克和 10 克)仅作为示例。研究人员应根据特定需求调整每个步骤中使用的花粉量。 - 从 10 g 子样本中清除所有蜜蜂部件和其他碎屑。然后,如有必要,从原始样品中再添加一点花粉,以达到10克子样品的总重量。
- 将10 g子样本中的每个花粉颗粒分类到一个颜色组中。同时使用花粉颜色和纹理来区分颜色组。
注意:预计组内会有一些变化,但在排序过程中使用 Pantone 颜色参考线可以提高一致性。 - 为了确保每个颜色组的至少0.25g用于下游步骤,请将任何不够丰富以形成至少0.25 g颜色组的颗粒放入杂项组中。使用潘通颜色参考线为每个单独的颜色组命名。标记杂项组 杂项。
- 在单独的称重纸上称量每个颜色组,和/或计算每个颜色组中的颗粒数量。在数据表上记录颜色组名称和权重或计数。
注意:选择是否称量或计算每个颜色组中的颗粒数量取决于研究人员感兴趣的指标和项目目标。 - 使用耐溶剂笔和不干性纸管标签为每个颜色组创建微量离心管标签。在标签中包括当前日期、样品标识符、样品采集日期和颜色组号。将标签涂抹在清洁、干燥的 2 mL 微量离心管上。
- 从每个颜色组中称出0.25g(±0.05g)花粉沉淀,并将该量置于适当标记的微量离心管中。
注意:如果给定颜色组的花粉中的颜色或质地略有变化,请确保每个管内都有代表性的颗粒样品。随后的试剂体积以及孵育和离心时间适用于0.25g花粉。因此,在微量离心管中使用这个数量的花粉用于乙酰化。该方案应提供充足的染色花粉,用于通过光学显微镜鉴定下游植物源。如果在乙酰分解中使用不同量的花粉,则应相应地调整试剂体积和处理时间的细节。 - 将每个颜色组中剩余的花粉放入标有颜色组名称的单个塑料袋(每种颜色一个袋子)中。将这些袋子与适当原始样品的其他部分一起储存在-20°C储存中。
- 将管中的花粉与干净的木制牙签充分混合10至15秒。
3. 乙酰化准备
- 在首次开始乙酰溶解的任何部分之前,请联系指定机构的环境健康和安全(EHS)部门,以获取有关如何处理乙酰溶解相关试剂和废物的说明。
- 获得以下试剂的储备溶液,并按照EHS化学品储存指南将其置于通风橱中:95%乙醇;蒸馏水;冰醋酸,无水;浓硫酸;甘油;和透明的指甲油。
- 准备以下试剂的储备溶液,并按照EHS化学品储存指南将其置于通风橱中:饱和碳酸氢钠(蒸馏水中8%w / v溶液);和沙夫兰宁O(1%w / v溶液在50%乙醇中)。
4. 乙酰溶解
- 进行冰醋酸洗涤的预乙酰化程序。在通风橱内使用实验室外套,护目镜和丁腈手套执行以下步骤。
- 将加热块打开至80°C。
注意:确保易于获得一瓶挤压的饱和碳酸氢钠。如果发生酸性溢出,这可用于中和通风柜中的酸性溢出物。 - 将一个玻璃烧杯标记为酸性废物,一个用于乙醇废物,一个用于乙酰化混合物。
- 使用先前制备的储备溶液,在标记的,适当大小的玻璃烧杯中产生以下试剂的工作等分试样:〜23.0mL冰醋酸;~33.0毫升蒸馏水;〜23.0毫升95%乙醇;约 25.0 mL 碳酸氢钠(用于受酸污染的固体废物)。
注意:这些是在总共10个颜色组样品(10个微量离心管)上完成以下乙酰化程序所需的体积。 - 缓慢向每个含有0.25g色基团花粉的微量离心管中加入500μL冰醋酸。在目视检查管子时,用干净的牙签搅拌花粉10-15秒,并确保管的内容物充分混合。使用后将用过的牙签放入碳酸氢钠废烧杯中;对每个管子重复此过程。
注意:每个管子使用干净的新牙签。确保每个管子的盖子都紧闭。 - 将样品以1,100× g离心3分钟。将管中的上清液倾倒到酸废烧杯中。然后,用干净的纸巾轻轻地短暂地触摸管子张开的口,以除去管边缘周围的残留冰醋酸。
注意:在倾析上清液时,请注意不要丢失花粉沉淀。
- 将加热块打开至80°C。
- 执行乙酰溶解程序。
注:在通风橱内使用实验室外套、护目镜和丁基乙烯基手套执行以下步骤。- 通过首先向烧杯中加入10.8mL冰醋酸(来自工作等分试样)来制备 乙酰化混合物(9∶1冰醋酸:硫酸)。然后,使用装有1250μL过滤移液器吸头的1000μL移液器,从储备溶液中缓慢加入1200μL(1.2mL)浓硫酸到含有冰醋酸的乙酰化混合物烧杯中。将用过的移液器吸头丢弃到碳酸氢钠烧杯中。
注意:乙酰溶性混合物烧杯可能会变热,混合物可能会变黄。有两种可能性导致混合物变成深色:(a)试剂可能已超过其有效期,或(b)可能添加了过多的硫酸。在任何情况下,如果混合物变暗,请将其丢弃在酸性废烧杯中,并制备新鲜的乙酰化混合物。 - 用玻璃棒或木制搅拌棒轻轻搅拌乙酰溶混合物,以确保其均质化。将用过的棒/棒放入碳酸氢钠烧杯中。
- 使用1000μL移液管和1250μL过滤的移液器吸头,从烧杯中缓慢加入1000μL乙酰溶混合物到每个管中。在目视检查管子时,用干净的牙签搅拌10-15秒,并确保管的内容物充分混合。使用后将用过的牙签放入碳酸氢钠废烧杯中。
注意:每个样品使用干净的新牙签。 - 将样品放在预热的(80°C)热块上。将试管孵育5分钟,在孵育过程中用干净的牙签彻底搅拌每个试管。使用后,将每个用过的牙签放入碳酸氢钠烧杯中。
注意:不要在样品中留下牙签;酸会溶解它们。
- 通过首先向烧杯中加入10.8mL冰醋酸(来自工作等分试样)来制备 乙酰化混合物(9∶1冰醋酸:硫酸)。然后,使用装有1250μL过滤移液器吸头的1000μL移液器,从储备溶液中缓慢加入1200μL(1.2mL)浓硫酸到含有冰醋酸的乙酰化混合物烧杯中。将用过的移液器吸头丢弃到碳酸氢钠烧杯中。
- 进行乙酰化后冰醋酸洗涤程序。
注:在通风橱中用实验室外套、护目镜和丁基乙烯基手套执行以下步骤。- 向每个管中缓慢加入500μL冰醋酸。在目视检查管子时,用干净的牙签搅拌10-15秒,并确保管的内容物充分混合。使用后将用过的牙签放入碳酸氢钠烧杯中。
注意:每个样品使用干净的新牙签。确保每个管子的盖子都紧闭。 - 将样品以1,100× g离心3分钟。将每个管中的上清液倾倒到酸废烧杯中。然后,用干净的纸巾轻轻地短暂地触摸管子张开的口,以除去管子边缘周围的残留酸。
- 在流水下彻底冲洗丁基乙烯基手套至少30秒,取下,然后将其晾干。
注意:请遵循制造商关于丁基乙烯基手套重复使用的指南。
- 向每个管中缓慢加入500μL冰醋酸。在目视检查管子时,用干净的牙签搅拌10-15秒,并确保管的内容物充分混合。使用后将用过的牙签放入碳酸氢钠烧杯中。
- 对每个样品进行三次水冲洗。在通风橱内使用实验室外套,护目镜和丁腈手套执行以下步骤。
- 从蒸馏水烧杯中加入1000μL蒸馏水到每个管中。在目视检查管子时,用干净的牙签搅拌10-15秒,并确保管的内容物充分混合。使用后将牙签放入碳酸氢钠废烧杯中。
注意:每个样品使用干净的新牙签。确保每个管子的盖子都紧闭。 - 将样品以1,100× g离心3分钟。将管中的上清液倾倒到碳酸氢钠烧杯中。然后,用干净的纸巾轻轻触摸管子张开的口,以除去管子边缘周围的残留水。
- 再重复步骤4.4.1-4.4.2两次,总共冲洗三次水。
- 从蒸馏水烧杯中加入1000μL蒸馏水到每个管中。在目视检查管子时,用干净的牙签搅拌10-15秒,并确保管的内容物充分混合。使用后将牙签放入碳酸氢钠废烧杯中。
- 对每个样品进行乙醇冲洗。
注意:在通风橱内使用实验室外套,护目镜和丁腈手套执行以下步骤。- 使用1000μL移液管和1250μL过滤的移液器吸头,从乙醇烧杯中向每个管中加入1000μL95%乙醇。将移液器吸头丢弃到非危险废物中。在目视检查管子时,用干净的牙签搅拌10-15秒,并确保管的内容物充分混合。
注意:使用后将牙签放入碳酸氢钠废烧杯中。为每个样品使用干净的新牙签。确保每个管子的盖子都紧闭。 - 将样品以1,100× g离心3分钟。将管中的上清液倾倒到乙醇废烧杯中,并用干净的纸巾轻轻触摸管的张口,以除去管中残留的乙醇。
- 使用1000μL移液管和1250μL过滤的移液器吸头,从乙醇烧杯中向每个管中加入1000μL95%乙醇。将移液器吸头丢弃到非危险废物中。在目视检查管子时,用干净的牙签搅拌10-15秒,并确保管的内容物充分混合。
- 戴上实验室外套、护目镜和丁腈手套对样品进行染色。使用温和的反转混合沙夫兰素O染色原液溶液。
- 使用一次性塑料转移移液器,向每管中加入5-10滴Safronin O染色剂。在目视检查管子时,用干净的牙签搅拌10-15秒,并确保管的内容物充分混合。将牙签留在管中。
- 使用1000μL移液管和1250μL过滤的移液器吸头,从乙醇烧杯中向每个管中加入1000μL95%乙醇。将移液器吸头丢弃到非危险废物中。在目视检查管子时,用牙签搅拌10-15秒,并确保管子的内容物充分混合。使用后将用过的牙签放入非危险废物中。
- 确保每个管子的盖子都紧闭。以1,100× g离心3分钟。将上清液倒入乙醇废烧杯中。
注意:这次不要用纸巾触摸管口。 - 使用塑料一次性转移移液管向每个管中加入10-15滴甘油。在目视检查管子时,用干净的牙签搅拌管的内容物10-15秒,并确保管的内容物充分混合。
注意:使用后将用过的牙签放入非危险废物中。为每个样品使用干净的新牙签。确保所有试管标签清晰可辨。
- 在通风橱中打开管子,在环境室温下蒸发乙醇至少2小时。检查样品的乙醇气味:如果可检测到,样品尚未准备好,应将其晾干,直到乙醇气味消散。
- 清洁所有材料,并处理废物。关闭离心机和加热块。按照指定机构的环境健康和安全准则处理所有固体和液体废物。
- 准备显微镜载玻片用于花粉鉴定;清晰地标记它们。为将要安装的每个颜色组/样品适当地标记干净的玻璃显微镜载玻片。在目视检查试管时,用干净的牙签将样品搅拌10-15秒,并确保试管的内容物充分混合。
注意:载玻片制备可以在实验室工作台上进行。将牙签丢弃在无害的废物中。为每个样品使用干净的新牙签。- 使用干净的一次性塑料转移移液管,从管中取出1滴花粉残留物,并将其置于其标记的显微镜载玻片的中心。让滴剂稍微扩散。在载玻片上的墨滴上放置一个干净的盖玻片。
- 载玻片干燥后,用透明指甲油将盖玻片密封在载玻片上。在盖玻片的每个角上放置一小滴抛光剂,并在盖玻片与载玻片相接的地方绘制一个抛光边缘。让指甲油完全干燥,并在盖玻片周围涂上第二层抛光剂。
结果
之前的一项研究报告了对蜜蜂在以下农作物中收集的花粉多样性的评估:杏仁,樱桃,高丛蓝莓,杂交胡萝卜和白芒花14。使用所述方法,收集棒状花粉,按颜色排序,并确定每个颗粒颜色组的植物来源以评估花粉多样性。将底部安装的花粉陷阱安装在每种作物的多个部位的菌落上(图1A)。从每个部位收集的花粉量足以满足颜色分选和乙酰分解分析方法的样品重量要求。每个花粉收集样本都有多个可区分的颜色组(图2和图3)。在一些样品中,花粉颜色组含有少至4-5个颗粒;然而,大多数组的含量明显不止于此,因此作为他们自己的标记颜色组用于乙酰溶解(图4和图5)。在乙酰分解后(图6),使用明场光学显微镜通过确认从每个研究地点周围区域收集的凭证标本的形态特征,有效地将每个颜色组识别到其可能的分类等级(图7)。

图 1:安装在蜜蜂群落上的花粉陷阱,用于收集花粉( A) 底部安装的陷阱放置在蜂巢底板上方,直接位于最低的蜂巢箱上方。其他花粉陷阱类型包括 (B) 前置式和 (C) 螺旋孔入口安装式疏水阀。 请点击此处查看此图的大图。

图2:花粉陷阱的诱捕机制和收集托盘。 返回的花粉觅食者必须在到达蜂巢之前挤过网状诱捕机制。 请点击此处查看此图的大图。

图3:花粉陷阱的收集盘。 花粉捕集器从返回的花粉觅食者的腿上刮下,落入收集盘中。 请点击此处查看此图的大图。

图 4:将棒状花粉样本分类为颜色组。 棒状花粉在被分类成颜色组后可以干燥和称重,以报告收集的不同颜色颗粒的比例。 请点击此处查看此图的大图。

图 5:使用 Pantone 颜色指南按颜色分类的四组花粉颗粒。 颜色组标记为 (A) 灰色、潘通 5855C、(B) 棕色、潘通 7557C、(C) 黄色、潘通 458C 和 (D) 浅棕色、潘通 3547C 。
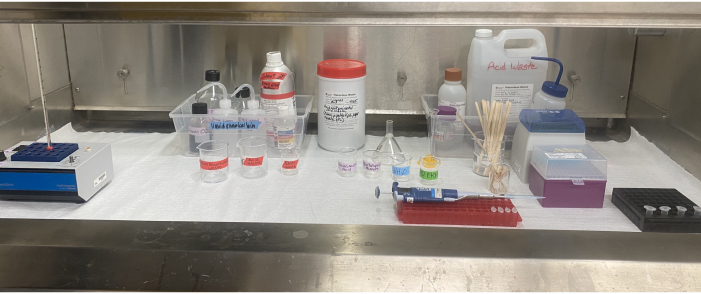
图 6:通风橱内的乙酰化设备设置。 位于通风橱内的热块、试剂、溶剂废物和酸性废物容器、带标签的烧杯、移液器吸头、搅拌棒和微量离心管。 请点击此处查看此图的大图。
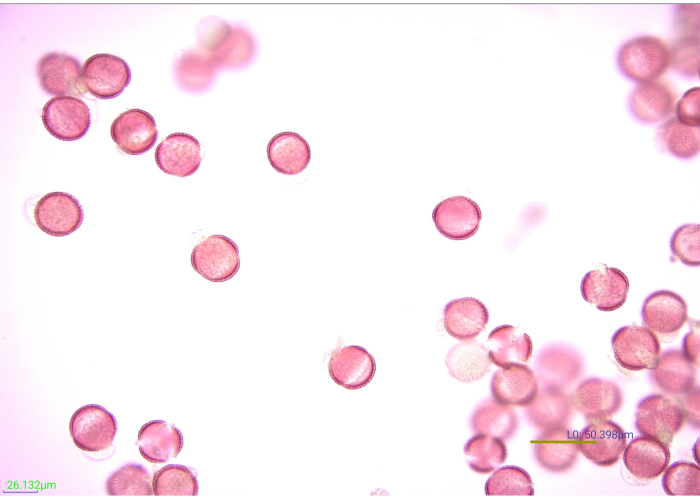
图7:染色的乙酰化花粉颗粒的显微照片。 乙酰化芥末(芸苔科)花粉颗粒的许多刻面在40倍放大倍率下。比例尺 = 50.398 μm .请点击此处查看此图的大图。
从杏仁作物位置采集的花粉多样性相对低于从其他作物采集的花粉,平均每个地点有3.0±0.5个颗粒颜色和3.2个±1.2个植物分类群(表2)14。其余4个作物体系的花粉多样性水平较高,平均为6.0±2.0粒,杂交胡萝卜每位8.0±1.5株植物类群,高丛蓝莓每位8.8±1.4粒,±2.0株植物分类群7.0±1.0粒,杂交胡萝卜每位11.0±0.0株分类群,白芒花14每位10.0±0.0粒,13.0±1.5株植物分类群。
| 作物 | 花粉颗粒颜色/位点的平均数量 (SE) | 植物分类群/地点的平均数量(标准) | 已确定的分类群总数 | ||
| 家庭 | 属 | 物种 | |||
| 杏仁 | 3.0 (0.5) | 3.2 (1.2) | 4 | 3 | 4 |
| 蓝莓 | 8.8 (1.4) | 13.5 (2.0) | 5 | 10 | 13 |
| 胡萝卜 | 7.0 (1.0) | 11.0 (0.0) | 3 | 5 | 6 |
| 樱桃 | 6.0 (2.0) | 8.0 (1.5) | 4 | 7 | 5 |
| 草甸泡沫 | 10.0 (0.0) | 13.0 (1.5) | 5 | 4 | 14 |
表2:从五种种植系统中蜜蜂收集的棒状花粉的多样性。 多样性指标包括颗粒颜色的平均数量(±SE),植物分类群的平均数量(±SE)和确定的分类群总数。此表已从14 修改而来。缩写:SE = 标准误差。
讨论
不同的花粉陷阱样式有其自身的优势和后果。下面讨论四种常用疏水阀类型((1)前置式、(2)底部安装式、(3)螺旋钻孔和(4)顶部安装花粉疏水阀的优点和局限性。前置式疏水阀是最通用的样式(图1B)。安装快速简便;它可以在不提升蜂巢箱的情况下完成,这些陷阱可以安装在任何Langstroth风格的蜂巢设备上。当收集盘位于菌落的前面时,它从菌落中收集的碎片最少。然而,收集盘也更容易暴露于外部元素 - 来自田间灌溉,多雨或潮湿天气的水分,或露水可能通过收集托盘与花粉接触,如果颗粒变得太饱和而无法分离,则可能导致花粉无法使用。通过在预测的降雨或高湿度事件期间避免捕获,可以降低花粉饱和的风险。在疏水阀下方放置橡胶垫,并在花粉陷阱顶部放置额外的覆盖材料(例如屋顶毛毡)也可以保护收集托盘免受天气影响。
底装式疏水阀用于收集本文数据的花粉(图1A)。它们安装起来不那么方便,因为它们必须放在殖民地的育雏巢下面。安装非常耗时,并导致大量碎片从蜂群落入陷阱,例如蜜蜂部位和少量蜡。大多数制造的底部安装疏水阀的收集托盘的地板由细网制成,允许适当的通风,以保护收集的花粉免受潮气的影响。如果觅食者主要使用螺旋孔作为蜂巢入口,而不是由蜂巢底板形成的入口,则螺旋孔花粉陷阱有助于最大限度地减少觅食者的定向障碍(图1C)。由于螺旋孔花粉捕集器的收集盘非常小,因此必须经常清空,以避免收集盘溢出。鉴于其上部放置在蜂巢上,顶部安装的花粉陷阱是最容易安装和移除的陷阱样式,并且收集的花粉样品没有蜂巢碎片。但是,这种疏水阀样式对损坏的蜂巢设备特别敏感,因为如果盖子、内盖和上部蜂巢盒未正确密封在一起,收集托盘将暴露在潮湿环境中。
本文描述的方案要求选择具有大量成虫和幼虫种群的菌落(步骤1.2)。这种选择方法旨在从这些菌落中产生非常大量的被捕获花粉。具有大量觅食种群的蚁群在安装陷阱时可能会在入口处遇到严重的拥堵。选择一个大型蜂巢入口将缓解拥堵。大量觅食人口也可能收集非常大量的花粉,这些花粉可能会超出收集托盘的界限。使用大量收集托盘(如大多数底部或顶部安装的陷阱样式所示),并经常使用空托盘以容纳大量捕获的花粉。如果期望的研究目标是评估蜂巢穴收集的花粉量,请选择具有代表性的菌落,而不是优化成虫和幼虫种群进行选择。所有风格的花粉陷阱都阻挡了蜂巢入口,并创建了一个与原始入口16在空间上不同的新入口。当觅食者在安装时无法重新定向到花粉陷阱的新入口时,花粉陷阱通常无法收集花粉。这些觅食者很容易漂流到邻近的蜂巢,如果它们进入另一个带有花粉陷阱的蜂巢,可能会交叉污染其他花粉收集样本。因此,应给予觅食者至少24小时的时间,通过在安装后保持诱捕装置脱离来适应新的入口。选择具有很少或没有额外蜂巢入口的菌落也可以减少定向到新的花粉陷阱入口时的混乱。
额外的蜂巢入口(例如,孔和翘曲的盖子)应密封,但觅食者漂流到邻近的荨麻疹的风险将随着陷阱安装开始时这些入口而增加。如果花粉陷阱仅安装在一组托盘蜂巢中的单个蜂巢上,觅食者也很容易漂流到其他蜂巢入口。如果托盘上所有朝向相同方向的蜂巢都安装了疏水阀,则觅食者不太可能漂移。顶部安装的花粉陷阱可能会造成更高的蜜蜂漂移风险,因为花粉陷阱入口和蜂巢的原始入口之间有很大的距离。在这项研究中,在每个实验地点的多个蜜蜂群落上安装了花粉陷阱,以解释每个蜜蜂群落之间花粉数量和分类群组成的变化。因此,花粉陷阱应安装在多个菌落上,以实现从景观中收集的花粉,因为花粉收集可能根据植物物种类型和总收集量12,13在菌落之间差异很大。每个花粉样本的收集期为7天。在未来的研究中,以两到三个连续72小时间隔收集花粉将提高花粉饲料估计40的准确性。
由于花粉采集存在较大时间波动,在目标种植系统24,27,39的花粉采集早、高峰期和晚开花期重复花粉采集过程可以提高花粉估计精度。花粉应从多个地点收集,尽管种植系统或景观类型相同,因为养蜂地点之间预计数量和植物物种类型会发生变化14,27,33,43。长期花粉捕获可能对蜜蜂群落有害。潜在影响包括减少育雏,缩短幼体生育期,以及蜂巢中卵和幼虫的同类相食19,44,45,46。较长的花粉诱捕时间,如整个生长季节,会加剧对殖民地育雏的有害影响。花粉捕获还会导致蜂蜜产量的减少和储存蜂蜜13的水分含量增加。在持续监测景观或种植系统时,在养蜂场的菌落之间旋转花粉陷阱可以减轻对用于花粉捕获的菌落的伤害。每隔一周进行花粉陷阱将减少有害影响,特别是在蜂蜜生产中的损失,如果在一段时间内将花粉捕获在同一殖民地上13.
此外,花粉陷阱最好放置在强菌落上。偶尔,花粉陷阱可能会无意中参与。当不需要花粉陷阱收集时,可以通过锁定花粉陷阱机制来避免这种情况。花粉陷阱不会从蜜蜂觅食者身上去除所有花粉。诱捕效率取决于诱捕器类型,花粉颗粒大小,蜜蜂体大小,一天中的时间和天气条件。因此,当对不同的植物物种和收集周期25,26使用花粉陷阱时,棒状花粉收集并不一致。来自 桉树 属和 柽柳 属等植物的较小花粉颗粒不太可能被花粉陷阱捕获27。值得注意的是,在这项研究中,从高丛蓝莓收集地点没有发现高丛蓝莓(越桔 )花粉,这支持了先前的证据,即高丛蓝莓花粉颗粒太小,无法收集花粉陷阱47。相比之下,在这项研究的每个种植系统中都发现了来自蒲公英的 花粉。一些植物物种的花粉颗粒也可能比其他植物物种大得多,例如 Taraxacum 属,并且在花粉陷阱27的花粉收集分析中可能被过度代表。捕获单个花粉觅食者并手动去除其球状花粉将提高花粉源评估的准确性,但与使用花粉陷阱相比,这非常耗时和资源(表1)。将花粉颗粒分类为颜色组相对简单,尽管这很耗时。除非有特定的研究目标或目的,否则花粉颗粒的数量应限制在10克或更少(对于任何给定的样品),以便分类成颜色组。对包含大于此数量的整个样品进行分类将大大增加完成分析所需的时间。然而,至关重要的是,花粉样本在取出用于颜色分类的子样本之前必须很好地混合。未能混合原始样品可能会导致子样本不能代表整体,应避免使用。
如果原始样品容器中没有足够的自由空间来允许花粉颗粒的彻底混合,则将整个样品放在大塑料袋或小纸袋中应该就足够了,即使对于大型样品也是如此。硬塑料,有盖的容器也可以工作。应轻轻混合样品,以使花粉颗粒不被压扁或以其他方式破坏。无意的偏见可能会下意识地说服人们舀出"漂亮的紫色颗粒",例如,从整体中取出子样本时。因此,在舀出子样本时,应将样品的颜色组成从视野中遮挡。通过这种方式,更有可能获得真正代表整体的子样本。然而,这种子采样方法可能无法选择样品中丰度较低的花粉颗粒。因此,如果识别样本中表示的每个植物分类群是一个研究目标,则收集子样本将不合适;必须对整个样品进行分析。因此,颗粒应在玻璃培养皿中分选。一旦分类完成,可以将Pantone颜色指南的适当页面放置在盘子下方,以使指南和排序的花粉之间的颜色匹配更容易。 图 5 说明了这方面的一个示例。
当从放置在作物中的蜜蜂菌落中捕获花粉以进行授粉时,不应使用超过十个总颜色组:九种颜色和一个由样品中少数颜色组成的"杂项"颜色组。对样品可以分成的最大颜色组数进行合理的限制,可以防止研究人员因无休止地将颗粒分离成越来越多的极其特定的组而陷入困境,当分选完成时,这些组可能单独包含足够的乙酰化量。如果从可能从非常多样化的植物物种中觅食的菌落中捕获,则可能需要更多的颜色组,并且应优化方案以反映该要求。本研究的重点是从蜜蜂群落中收集的花粉样本授粉作物,并且多个分类群通常都存在于一个颜色组中,类似于先前的研究29,30,31。
乙酰溶解从花粉颗粒表面溶解脂质,蛋白质和有机碎片,揭示exine的显着特征,从而使颗粒更容易染色和识别。这是一种古老而常见的方法,用于多种花粉研究37。一般步骤是标准化的;它们因协议而异。然而,离心速度和时间、孵育温度和持续时间、花粉量驱动的试剂体积甚至上清液去除方法(倾析与移液)的细节可能需要根据研究目标进行实验优化,在某种程度上,可能遇到的花粉类型为48。事实上,乙酰溶可以从一些分类群中去除花粉的重要诊断特征,如马尔瓦科和兰科38。因此,并非所有花粉都适合标准的乙酰溶解方法。如上所述,本研究对这些方法进行了优化,目的是确定作物授粉蜜蜂收集的花粉的主要植物分类群来源。如果花粉颗粒的精确定量是研究的一部分,则需要考虑的细节在本文中尚未解决。
使用溶剂和酸需要仔细规划、适当的个人防护装备(PPE)和负责任的废物处理(图6)。至关重要的是,研究人员在开始乙酰化的任何部分之前确定储存试剂和处理废物的正确方法。在这个实验室中,丁基手套用于涉及硫酸甚至冰醋酸的过程的任何部分,因为它们对两种酸的降解和渗透率都比丁腈手套好得多,同时不影响灵巧度49。谨慎的做法是参考各自机构的安全指南,以获取有关适当手套和其他PPE49的建议。在乙酰分解步骤之前添加冰醋酸有助于去除样品中的任何残留水分,并为重要的乙酰分解反应做好准备。乙酰化步骤中的冰醋酸 -硫酸混合物可能与水发生剧烈反应,这就是为什么所有玻璃器皿和耗材必须完全干燥,并且在乙酰化之前从样品中除去所有水分非常重要的原因。乙酰化后加入冰醋酸稀释并中和乙酰化混合物。
特别是乙醇和冰醋酸,可以溶解微量离心管标签的油墨,如果这些试剂滴在管子的外面,即使用耐溶剂笔。在整个过程中经常检查试管标签,以确保它们仍然清晰可辨。如果逻辑上可行,请考虑使用激光打印标签作为防止这种可能性的保障。倾析上清液的方式将影响试剂是否滴入微量离心管的外部。重要的是要用自信,光滑的手倾倒上清液,这是通过练习而来的。应注意避免在倾析过程中从离心管中损失花粉样品。倾析太快有失去部分或全部花粉残留物的风险;倾倒太慢可能导致上清液沿着管子流下。虽然通常建议孵育温度为100°C,但花粉在该温度下很容易变得"过度煮熟",如本研究中使用的量(0.25g),特别是如果孵育时间稍长29。事实上,即使在80°C,如果在乙酰分解混合物中放置太长时间,花粉颗粒也会破裂或以其他方式损坏。必须仔细确定孵育温度和持续时间,以避免破坏样品中的花粉颗粒。
染色花粉增加了外源性特征的清晰度和对比度,使其更容易拍摄和识别(图7)。五滴(来自塑料转移移液管)的1%沙夫拉宁O有效地染色0.25g花粉。然而,不同的花粉染色不同。如果花粉粒染色太轻或太重,则可能难以识别。如果可能,在开始处理实验样品之前,应验证对研究中预期的花粉物种进行适当染色所需的染色溶液体积。尽管如此,如果其中一个实验样品没有正确染色,则可以对其进行校正。为了减轻染色过重的花粉样品,用水冲洗样品,然后用乙醇冲洗。如果花粉的染色不够好,无法看到明显的特征,可以添加一些额外的染色液滴。在添加甘油之前,应检查这些样品的染色。同样,可能需要一些试验和错误来确定花粉残基的理想甘油体积。15滴甘油适当地保护了本研究中的样品不变干,同时还将花粉残留物稀释至通过光学显微镜进行下游鉴定的理想浓度。其他量的花粉残留物可能需要或多或少的甘油来防止干燥并促进安装。
披露声明
作者没有什么可透露的。
致谢
我们感谢格雷琴·琼斯博士(美国农业部-阿根廷比索,APMRU,德克萨斯州大学站)协助进行颜色分类和乙酰溶出分析。这项研究得到了俄勒冈州养蜂人协会向R.R.S.提供的研究基金的支持。
材料
| Name | Company | Catalog Number | Comments |
| #8 hardware cloth | 2.7 mm aperture | ||
| 10 mL graduated cylinder | |||
| 1000 uL micropipette tips | |||
| 1250 mL filter micropipette tips | |||
| 15 x 75 mm glass slides | Thickness: 0.93 mm - 1.05 mm | ||
| 2 mL microcentrifuge tubes | |||
| 250 mL graduated Borosilicate glass beakers (x3) | VWR | 10754-952 | |
| 50 mL graduated Borosilicate glass beakers (x6) | VWR | 10754-946 | |
| 95% EtOH | Pharmco AAPER | 111000200DM55 | ACS/USP/Kosher grade |
| Butyl vinyl gloves | |||
| Centrifuge | 1060 x g maximum speed; horizontal swing preferred | ||
| Chemical safety goggles | |||
| Color guide | Pantone | SKU: GP1601A | Solid coated |
| Coverslip of 1 or 1.5 | Thickness: 0.13 mm - 0.19 mm | ||
| Distilled water | |||
| Forceps | |||
| Fume hood | |||
| Glacial acetic acid | BDH Chemicals | BDH3092 | ACS grade |
| Glass funnel | |||
| Glycerin | Humco | 103196001_1 | USP grade, 99.5%, anhydrous |
| Hazardous waste containers | |||
| Hive tool | |||
| Hot block | Must reach 80 degree C | ||
| Lab coat with long sleeves | |||
| Latex or polyurethane foam | |||
| Microscope | |||
| Nailpolish, clear | |||
| Nitrile gloves | |||
| P1000 pipette | VWR | ||
| Petri dish | |||
| Plastic spoon | |||
| Safranin | Ward's Science | 470302-322 | Lab grade |
| Smoker | For pollen trap installation | ||
| Sodium bicarbonate | EMD Millipore | SX0320 | ACS grade, powder |
| Squirt bottles (x2) | |||
| Sulfuric acid | EMD Millipore | SX1244 | ACS grade |
| Sundance Bottom Mount Pollen Trap | Betterbee Beekeeping Supply | PTRAPB | |
| Tape | |||
| Wooden stir sticks | |||
| Wooden tooth picks |
参考文献
- Klein, A. M., Vaissière, B. E., Cane, J. H., Steffan-Dewenter, I., Cunningham, S. A., Kremen, C., Tscharntke, T. Importance of pollinators in changing landscapes for world crops. Proceedings of the Royal Society B: Biological Sciences. 274 (1608), 303-313 (2007).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Pettis, J. S. A survey of honey bee colony losses in the United States, fall 2008 to spring 2009. Journal of Apicultural Research. 49 (1), 7-14 (2010).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Caron, D., Pettis, J. S. A survey of managed honey bee colony losses in the USA, fall 2009 to winter 2010. Journal of Apicultural Research. 50 (1), 1-10 (2011).
- vanEngelsdorp, D., et al. A national survey of managed honey bee 2010-11 winter colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 51 (1), 115-124 (2012).
- Spleen, A. M., et al. A national survey of managed honey bee 2011-12 winter colony losses in the United States: results from the Bee Informed Partnership. Journal of Apicultural Research. 52 (2), 44-53 (2013).
- Steinhauer, N. A., et al. A national survey of managed honey bees 2012-2013 annual colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 53 (1), 1-18 (2014).
- Lee, K. V., et al. A national survey of managed honey bee 2013-2014 annual colony losses in the USA. Apidologie. 46 (3), 292-305 (2015).
- Seitz, N., et al. A national survey of managed honey bee 2014-2015 annual colony losses in the USA. Journal of Apicultural Research. 54 (4), 1-12 (2016).
- Kulhanek, K., et al. A national survey of managed honey bee 2015-2016 annual colony losses in the USA. Journal of Apicultural Research. 56 (4), 328-340 (2017).
- Steinhauer, N., et al. Drivers of colony losses. Current Opinion in Insect Science. 26, 142-148 (2018).
- Smart, M. D., Pettis, J. S., Euliss, N., Spivak, M. S. Land use in the Northern Great Plains region of the U.S. influences the survival and productivity of honey bee colonies. Agriculture, Ecosystems & Environment. 230, 139-149 (2016).
- Pettis, J. S., Lichtenberg, E. M., Andree, M., Stitzinger, J., Rose, R. Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen Nosema ceranae. PloS One. 8 (7), 70182 (2013).
- Hoover, S. E., Ovinge, L. P. Pollen collection, honey production, and pollination services: managing honey bees in an agricultural setting. Journal of Economic Entomology. 111 (4), 1509-1516 (2018).
- Topitzhofer, E., Lucas, H., Chakrabarti, P., Breece, C., Bryant, V., Sagili, R. R. Assessment of pollen diversity available to honey bees (Hymenoptera: Apidae) in major cropping systems during pollination in the western United States. Journal of Economic Entomology. 112 (5), 2040-2048 (2019).
- Judd, H. J., Huntzinger, C., Ramirez, R., Strange, J. P. A 3D printed pollen trap for bumble bee (Bombus) hive entrances. Journal of Visualized Experiments. (161), e61500 (2020).
- Delaplane, K. S., Dag, A., Danka, R. G., Freitas, B. M., Garibaldi, L. A., Goodwin, R. M., Hormaza, J. I. Standard methods for pollination research with Apis mellifera. Journal of Apicultural Research. 52 (4), 1-28 (2013).
- Barker, R. J. The influence of food inside the hive on pollen collection by a honeybee colony. Journal of Apicultural Research. 10 (1), 23-26 (1971).
- Levin, M. D., Loper, G. M. Factors affecting pollen trap efficiency. American Bee Journal. 124 (10), 721-723 (1984).
- Webster, T. C., Thorp, R. W., Briggs, D., Skinner, J., Parisian, T. Effects of pollen traps on honey bee (Hymenoptera: Apidae) foraging and brood rearing during almond and prune pollination. Environmental Entomology. 14 (6), 683-686 (1985).
- Gemeda, T. K., Li, J., Luo, S., Yang, H., Jin, T., Huang, J., Wu, J., Nascimento, F. S. Pollen trapping and sugar syrup feeding of honey bee (Hymenoptera: Apidae) enhance pollen collection of less preferred flowers. PLoS One. 13 (9), 0203648 (2018).
- Hellmich, R. L., Rothenbuhler, W. C. Relationship between different amounts of brood and the collection and use of pollen by the honey bee (Apis mellifera). Apidologie. 17 (1), 13-20 (1986).
- Weidenmüller, A., Tautz, J. In-hive behavior of pollen foragers (Apis mellifera) in honey bee colonies under conditions of high and low pollen need. Ethology. 108 (3), 205-221 (2002).
- Pernal, S. F., Currie, R. W. The influence of pollen quality on foraging behavior in honeybees (Apis mellifera L.). Behavioral Ecology and Sociobiology. 51 (1), 53-68 (2001).
- Couvillon, M. J., et al. Honey bee foraging distance depends on month and forage type. Apidologie. 46, 61-70 (2015).
- Percival, M. Pollen collection by Apis mellifera. New Phytologist. 46, 142-165 (1947).
- Synge, A. D. Pollen collection by honey bees (Apis mellifera). Journal of Animal Ecology. 16, 122-138 (1947).
- O'Neal, R. J., Waller, G. D. On the pollen harvest by the honey bee (Apis mellifera L.) near Tucson, Arizona (1976-1981). Desert Plants. 6, 81-109 (1984).
- Eckert, C. D., Winston, M. L., Ydenberg, R. C. The relationship between population size, amount of brood, and individual foraging behaviour in the honey bee, Apis mellifera. Oecologia. 97 (2), 248-255 (1994).
- Free, J. B. The flower constancy of honey bees. Journal of Animal Ecology. 32 (1), 119-132 (1963).
- van der Moezel, P. G., Delfs, J. C., Pate, J. S., Loneragan, W. A., Bell, D. T. Pollen selection by honeybees in shrublands of the Northern Sandplains of Western Australia. Journal of Apicultural Research. 26 (4), 224-232 (1987).
- Hill, P. S., Wells, P. H., Wells, H. Spontaneous flower constancy and learning in honey bees as a function of color. Animal Behaviour. 54 (3), 615-627 (1997).
- Barth, O., Munhoz, M., Luz, C. Botanical origin of Apis pollen loads using colour, weight and pollen morphology data. Acta Alimentaria. 38, 133-139 (2009).
- Colwell, M. J., Williams, G. R., Evans, R. C., Shutler, D. Honey bee-collected pollen in agro-ecosystems reveals diet diversity, diet quality, and pesticide exposure. Ecology and Evolution. 7 (18), 7243-7253 (2017).
- Stoner, K. A., Cowles, R. S., Nurse, A., Eitzer, B. D. Tracking pesticide residues to a plant genus using palynology in pollen trapped from honey bees (Hymenoptera: Apidae) at ornamental plant nurseries. Environmental Entomology. 48 (2), 351-362 (2019).
- Almeida-Muradian, L., Pamplona, L. C., Coimbra, S. I., Barth, O. M. Chemical composition and botanical evaluation of dried bee pollen pellets. Journal of Food Composition and Analysis. 18 (1), 105-111 (2005).
- Lau, P., Bryant, V., Rangel, J. Determining the minimum number of pollen grains needed for accurate honey bee (Apis mellifera) colony pollen pellet analysis. Palynology. 42 (1), 36-42 (2018).
- Erdtman, G. . Handbook of palynology: morphology, taxonomy, ecology: an introduction to the study of pollen grains and spores. , (1969).
- Jones, G. D. Pollen analyses for pollination research, acetolysis. Journal of Pollination Ecology. 13 (21), 203-217 (2014).
- Richardson, R. T., Lin, C. H., Sponsler, D. B., Quijia, J. O., Goodell, K., Johnson, R. M. Application of ITS2 metabarcoding to determine the provenance of pollen collected by honey bees in an agroecosystem. Applied Plant Science. 3 (1), 1-6 (2015).
- Dimou, M., Thrasyvoulou, A., Tsirakoglou, V. Efficient use of pollen traps to determine the pollen flora used by honey bees. Journal of Apicultural Research. 45 (1), 42-46 (2005).
- Szczesna, T., Rybak-Chmielewska, H., Chmielewski, W. Effect of infestation of pollen loads with acarid mites on amino acid content and organoleptic characteristics of the product. Pszczelnicze Zeszyty Naukowe. 43 (1), 235-245 (1999).
- Stoner, K. A., Eitzer, B. D. Using a hazard quotient to evaluate pesticide residues detected in pollen trapped from honey bees (Apis mellifera) in Connecticut. PLoS One. 8 (10), 77550 (2013).
- Garbuzov, M., Couvillon, M. J., Schürch, R., Ratnieks, F. L. Honey bee dance decoding and pollen-load analysis show limited foraging on spring-flowering oilseed rape, a potential source of neonicotinoid contamination. Agriculture, Ecosystems & Environment. 203, 62-68 (2015).
- Moeller, F. E. Managing colonies for pollen production. Proceedings of 26th International Agricultural Congress. , 232-239 (1977).
- Dustmann, J. H., Ohe, W. V. D. Einfluss von Kälteeinbrüchen auf die Frühjahresentwicklung von Bienenvölkern (Apis mellifera L). Apidologie. 19 (3), 245-254 (1988).
- Schmickl, T., Crailsheim, K. J. Cannibalism and early capping: strategy of honeybee colonies in times of experimental pollen shortages. Journal of Comparative Physiology A. 187 (7), 541-547 (2001).
- Hodges, D. . The pollen loads of the honeybee: a guide to their identification by colour and form. , (1974).
- Jones, G. D. Pollen extraction from insects. Palynology. 36 (1), 86-109 (2012).
- . Chemical resistance guide. Permeation and degradation data. 8th Ed Available from: https://ehs.unc.edu/files/2015/09/Ansell_8thEditionChemicalResistanceGuide.pdf (2020)
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。