A subscription to JoVE is required to view this content. Sign in or start your free trial.
Abstract
Biology
Isolation of Mouse Megakaryocyte Progenitors
ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …Abstract
Bone marrow megakaryocytes are large polyploid cells that ensure the production of blood platelets. They arise from hematopoietic stem cells through megakaryopoiesis. The final stages of this process are complex and classically involve the bipotent Megakaryocyte-Erythrocyte Progenitors (MEP) and the unipotent Megakaryocyte Progenitors (MKp). These populations precede the formation of bona fide megakaryocytes and, as such, their isolation and characterization could allow for the robust and unbiased analysis of megakaryocyte formation. This protocol presents in detail the procedure to collect hematopoietic cells from mouse bone marrow, the enrichment of hematopoietic progenitors through magnetic depletion and finally a cell sorting strategy that yield highly purified MEP and MKp populations. First, bone marrow cells are collected from the femur, the tibia, and also the iliac crest, a bone that contains a high number of hematopoietic progenitors. The use of iliac crest bones drastically increases the total cell number obtained per mouse and thus contributes to a more ethical use of animals. A magnetic lineage depletion was optimized using 450 nm magnetic beads allowing a very efficient cell sorting by flow cytometry. Finally, the protocol presents the labeling and gating strategy for the sorting of the two highly purified megakaryocyte progenitor populations: MEP (Lin-Sca-1-c-Kit+CD16/32-CD150+CD9dim) and MKp (Lin- Sca-1-c-Kit+CD16/32-CD150+CD9bright). This technique is easy to implement and provides enough cellular material to perform i) molecular characterization for a deeper knowledge of their identity and biology, ii) in vitro differentiation assays, that will provide a better understanding of the mechanisms of maturation of megakaryocytes, or iii) in vitro models of interaction with their microenvironment.
Erratum
Erratum: Isolation of Mouse Megakaryocyte ProgenitorsAn erratum was issued for: Isolation of Mouse Megakaryocyte Progenitors. A figure was updated.
Figure 2 was updated from:
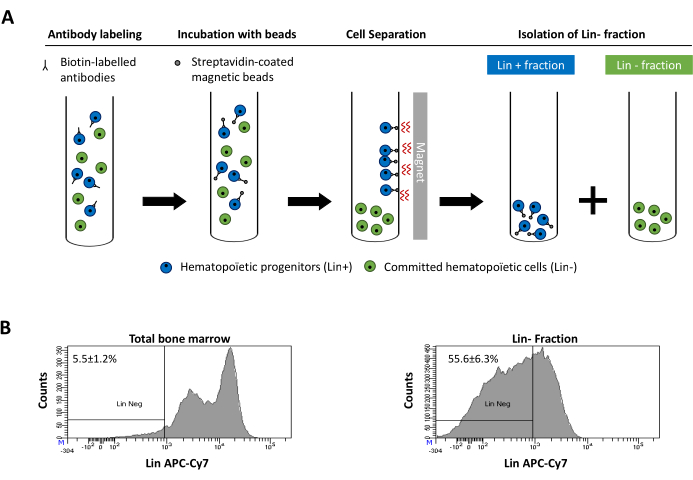
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
to:
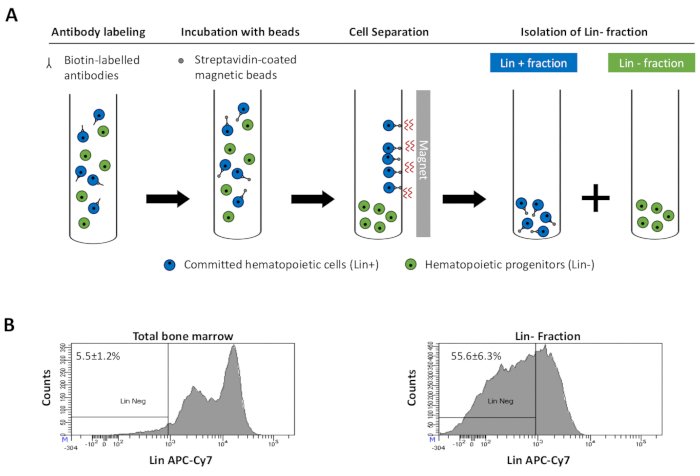
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved