一种高通量酶偶联活性测定法,用于探测小分子与 dNTP 酶 SAMHD1 的相互作用
摘要
SAMHD1 是一种脱氧核苷三磷酸三磷酸水解酶,在人类健康和疾病中起关键作用。在这里,我们提出了一种多功能的酶偶联 SAMHD1 活性测定,以 384 孔微孔板形式部署,可以评估作为 SAMHD1 底物、激活剂和抑制剂的小分子和核苷酸类似物。
摘要
无菌 α 基序和 HD 结构域含蛋白 1 (SAMHD1) 是细胞内脱氧核苷三磷酸 (dNTP) 池的关键调节因子,因为该酶可以将 dNTP 水解成相应的核苷和无机三磷酸盐。由于其在核苷酸代谢中的关键作用、与多种病理学的关联以及在治疗耐药性中的作用,目前正在进行深入的研究,以更好地了解这种酶的调节和细胞功能。因此,开发简单且廉价的高通量方法(如变构调节剂、底物或抑制剂)来探测小分子与 SAMHD1 的相互作用至关重要。为此,酶偶联孔雀石绿测定法是一种简单而稳健的比色法测定法,可以以 384 微孔板形式部署,从而间接测量 SAMHD1 活性。当 SAMHD1 从核苷酸底物中释放三磷酸基团时,我们可以将焦磷酸酶活性偶联到该反应中,从而产生无机磷酸盐,孔雀石绿试剂可以通过形成磷钼酸孔雀石绿色复合物来定量。在这里,我们展示了该方法的应用,以表征已知的SAMHD1抑制剂,并破译SAMHD1催化非经典底物和变构激活剂调节的机制,例如基于核苷的抗癌药物。因此,酶偶联孔雀石绿色测定法是研究SAMHD1的有力工具,此外,还可用于研究几种释放磷酸盐的酶。
引言
无菌 α 基序和含组氨酸-天冬氨酸结构域的蛋白 1 (SAMHD1) 是哺乳动物细胞1 中核苷酸稳态的中枢调节因子,在人类健康和疾病中起着多种作用2。该酶能够将脱氧核苷三磷酸 (dNTP) 水解成其同源脱氧核苷和无机三磷酸分子 3,4,该活性受 (d)NTP 丰度的变构调节(在参考文献5 中回顾)。每个 SAMHD1 单体包含两个变构位点(AS1 和 AS2)和一个催化位点,活性酶的形成需要在 (d)NTP 结合时有序组装同源四聚体。SAMHD1 单体的二聚化首先通过三磷酸鸟嘌呤(GTP 或 dGTP)与 AS1 的结合触发,当额外的 dNTP 分子与 AS2 结合时,实现随后的四聚化,使底物能够进入催化位点并随后水解。
SAMHD1底物包括四种经典的dNTPs3,4以及一些碱基和糖修饰的核苷酸,包括用于治疗病毒感染和癌症的几种基于核苷的药物的三磷酸代谢物,其中几种也可以作为变构激活剂6,7,8,9,10,11.因此,SAMHD1 在疾病模型7、8、9、10、11、12、13、14、15 中调节许多这些化合物的疗效,此外,在脱氧胞苷类似物阿糖胞苷 (ara-C) 的情况下,几十年来一直是急性髓系白血病 (AML) 的标准护理疗法,实际上决定了该病的治疗效果为7,8,16。因此,SAMHD1 是一种潜在的生物标志物和治疗靶点,可提高基于核苷的疗法17 的疗效,因此,我们和其他人试图确定在细胞中灭活 SAMHD1 的策略。我们建议使用病毒蛋白 X (Vpx) 作为生物抑制剂来靶向 SAMHD1 以降解癌细胞内 7,然而,这种方法有许多局限性(在参考文献12 中讨论),我们最近还报道了一种通过抑制核糖核苷酸还原酶来抑制 SAMHD1 活性的间接方法,我们在各种模型中证明了这一点 AML18.许多研究试图鉴定能够直接抑制SAMHD1的小分子,迄今为止,已经报道了几种这样的分子,然而,仅记录了体外抑制6,9,19,20,21,22。因此,缺乏有效抑制细胞中 SAMHD1 活性的小分子,再加上基于核苷的疗法的 SAMHD1 催化的复杂机制,强调了进一步研究的必要性。因此,用于探测与 SAMHD1 的小分子相互作用的稳健且理想的高通量方法对于鉴定这种临床相关酶的底物、变构调节剂和抑制剂是理想的。
有几种方法可以直接测量 SAMHD1 的 dNTP 酶活性,例如薄层色谱 (TLC)9,20,23 和高效液相色谱 (HPLC)9,21,但这些方法不适用于高通量设置。一个例外是Mauney等人报道的测定,当Mn2+用作活化阳离子时,它利用SAMHD1将双(4-硝基苯基)磷酸酯(b4NPP)水解为对硝基苯酚和对硝基苯基磷酸盐的能力,导致可以在微孔板21中轻松测量的比色变化。该测定已成功用于 SAMHD1 抑制剂的鉴定和表征,但应该注意的是,在没有 (d)NTP 激活剂和存在可能的非生理性活化阳离子的情况下,水解确实会发生,这两者都是需要考虑的重要注意事项。这也使得该测定不太适用于SAMHD1变构调节因子的研究和鉴定。
在这种情况下,如本报告所述,酶偶联方法与孔雀石绿色试剂相结合,可以成为一种通用方法,可以间接测量SAMHD1的dNTP酶活性,并进一步询问各种小分子对其的影响。孔雀石绿测定法是一种可靠可靠的比色技术,用于检测游离无机磷酸盐 (Pi),基于钼磷酸络合物的形成,导致在 620 nm 处测量的比色变化24。由于 SAMHD1 水解从核苷酸底物中释放出三磷酸基团,因此有必要在添加孔雀石绿试剂之前将该反应与(焦)磷酸酶活性偶联,该活性将产生游离的无机磷酸盐。孔雀石绿测定法灵敏且具有成本效益,已广泛用于鉴定和表征在反应中或偶联酶存在下释放无机磷酸基团的酶的抑制剂和底物。它已被广泛用于表征解旋酶的ATP酶活性25,26,27,或研究CD73酶活性,其介导AMP降解为腺苷和无机磷酸盐28。此外,当偶联时,它已被用于发现靶向 UDP-2,3-二酰基氨基葡萄糖焦磷酸酶 LpxH 的抗生素药物,这是大多数革兰氏阴性病原体中的必需酶29。在癌症研究方面,酶偶联方法已被广泛用于对抗核苷酸代谢酶家族NUDIX水解酶,用于底物30,31,32的表征以及药物和化学探针的鉴定和开发33,34,35,36。
关于dNTPase SAMHD1,这种方法已在几份报告中使用。使用 来自酿酒酵母的多磷酸外切酶 Ppx1 作为偶联酶,该测定用于测试几种核苷酸类似物作为 SAMHD1 的底物、激活剂或抑制剂,并导致鉴定抗白血病药物氯法拉滨的三磷酸代谢物作为激活剂和底物6。此外,以 来自大肠杆菌 的无机焦磷酸酶为偶联酶,它已被用于筛选针对 SAMHD1 的临床批准化合物库,以鉴定抑制剂20。在我们的研究中,我们利用这种方法表明 ara-C 的活性代谢物 ara-CTP 是 SAMHD1 底物,但不是变构激活剂7 ,随后使用该测定表明,几种可以以 SAMHD1 依赖性方式使 AML 模型对 ara-C 敏感的小分子实际上并不直接抑制 SAMHD118。在本报告中,我们将详细介绍这种通用方法,并证明其在高通量可适应设置中鉴定 SAMHD1 抑制剂、激活剂和底物的适用性。
研究方案
图 1 描述了以下方法的示意图,材料和试剂的详细列表可在材料表中找到。
1.测定缓冲液的制备。
- 储备缓冲液的制备。
注意:由于该测定对磷酸盐的检测很敏感,这可能很常见,因此用超纯水或双蒸水冲洗玻璃器皿三次以避免污染。所有缓冲液均可在室温 (RT) 下储存。- 将 4.5 g Tris Acetate、2.3 g NaCl 和 0.2 g MgCl2 溶解在大约 800 mL 水中,制备 1 L SAMHD1 反应缓冲液 (RB) 储备溶液(25 mM Tris-Acetate pH 8、40 mM NaCl、1 mM MgCl2),然后调节至 pH 8 和最终体积。
- 通过将 1 mL 0.5 M TCEP 稀释到 4 mL 水中来制备 5 mL 0.1 M TCEP 储备溶液。
- 将 5 mL 100% Tween-20 稀释到 44.5 mL 水中,制备 50 mL 11% Tween-20 储备溶液。
注意: Tween-20 对光敏感。 - 在调节至 pH 8 和最终体积之前,将 9.3 g EDTA 溶解在约 40 mL 水中,制备 50 mL 0.5 M EDTA 终止溶液。
- 通过在棕色玻璃瓶中将 60 mL 浓硫酸缓慢加入 300 mL 水中,制备孔雀石绿 (MG) 储备溶液(H2SO4 中的 3.2 mM 孔雀石绿)。将溶液冷却至室温并溶解0.44克孔雀石绿。
谨慎: 硫酸与水的反应是放热的,因此瓶子可能会升温,导致压力积聚;确保经常释放这种压力。
注意:得到的橙色溶液是光敏的(因此是棕色瓶子),并且在室温下稳定至少1年。 - 将 3.75 g 钼酸铵溶解在 50 mL 水中,制备 50 mL 7% 钼酸铵储备溶液。
注意:沉淀可能会随着时间的推移而形成,请确保仅使用上清液。
- 制备完整的检测缓冲液
注意:这应该在实验当天完成- 制备完整的SAMHD1 RB(25mM Tris-Acetate pH 8,40mM NaCl,1mM MgCl 2,0.3mM TCEP,0.005%Tween-20)。使用先前制备的 11% 吐温-20 和 0.1 M TCEP 原液,将这些组分的最终浓度为 0.005% 的 Tween-20 和 0.3 mM 的 TCEP 添加到 SAMHD1 RB 原液中。
- 制备EDTA终止溶液(25mM Tris-Acetate pH 8,40mM NaCl,1mM MgCl 2,0.3mM TCEP,0.005%吐温-20,7.9mM EDTA)。要完成SAMHD1 RB,请使用0.5M EDTA储备溶液将EDTA加入至终浓度为7.9mM。
- 将10份MG储备溶液与2.5份7%钼酸铵和0.2份11%吐温-20混合,制备MG工作溶液(2.5mM孔雀石绿,1.4%钼酸铵,0.18%吐温-20)。
2. SAMHD1抑制试验和化合物IC50的测定
注:最终测定条件如 表1所示。
- 在测定板中制备化合物
注意:小分子量化合物通常溶解在水中的100%DMSO和核苷酸类似物中。储备液浓度范围为 10 至 100 mM,受化合物的效力和溶解度以及测定的 DMSO 耐受性的影响。检查反应中的最终DMSO浓度不超过1%,以确保酶活性不受该溶剂的影响。在实验前测试测定对溶剂的耐受性是一种很好的做法。- 使用多通道移液器或自动液体处理设备,在相关溶剂(例如,用于小分子的 100% DMSO 或用于核苷酸类似物的水)中,在透明圆底聚丙烯 96 孔板中制备 100 倍终浓度的连续稀释测试化合物。
注意:根据化合物的稳定性,可以提前制备稀释板,密封并储存在-20°C。 在继续方案之前,让板平衡至室温。 - 使用完整的SAMHD1 RB,将化合物稀释至终浓度的25倍(以将终溶剂浓度保持在1%以下),并将5μL转移到透明的384孔平底测定板的适当孔中。对仅溶剂的对照样品重复该过程。
- 使用多通道移液器或自动液体处理设备,在相关溶剂(例如,用于小分子的 100% DMSO 或用于核苷酸类似物的水)中,在透明圆底聚丙烯 96 孔板中制备 100 倍终浓度的连续稀释测试化合物。
- 反应组分的制备
注意:这应该在测定当天完成。将重组人SAMHD1和 大肠杆 菌焦磷酸酶(PPase)等分试样长期储存在-80°C下,分别以9.1mg / mL和23.0mg / mL稀释,在储存缓冲液(20mM HEPES pH 7.5,300mM NaCl,10%甘油,2mM TCEP)中。解冻后,等分试样在-20°C下短期储存。- 通过将重组人 SAMHD1 蛋白和重组 PPase 在完全 SAMHD1 RB 中稀释至 4 倍所需终浓度,从而制备酶 (SAMHD1/PPase) 预混液,即 1.4 μM SAMHD1 和 50 U/mL PPase。
- 通过将完全SAMHD1 RB中的dGTP原液(通常在水中10或100mM)稀释至2x终浓度,从而制备活化剂/底物dGTP,因此为50μM dGTP。
- 进行检测
注意:所有测定组分都应平衡至室温。 液体添加可以使用多通道移液器或散装试剂液体分配器进行。- 向含有化合物稀释液和仅溶剂对照的 384 孔测定板中,分配 5 μL SAMHD1/PPase 预混液。对于无酶对照孔,分配 5 μL 完整的 SAMHD1 RB。将酶和化合物在室温下预孵育10分钟。
- 向所有孔中分配 10 μL 2x dGTP 溶液以开始反应。
- 将反应在室温下孵育20分钟。
- 通过向所有孔中分配 20 μL EDTA 终止溶液来停止反应。
注意:如果需要,可以在此处暂停实验。 - 向所有孔中加入 10 μL MG 工作溶液。
谨慎: MG工作液中含有硫酸。 - 确保使用轨道微孔板振荡器混合孔内容物,并以1,000× g 离心1分钟。
- 将板在室温下孵育20分钟。
- 在微孔酶标仪中读取 630 nm 波长的吸收。
- 数据可视化和分析
- 计算阳性和阴性对照孔的平均值和标准偏差(正性,与溶剂完全反应;负性,单独与溶剂进行dGTP)。计算 Z 因子37 作为测定质量的指标。
- 将每个吸光度值归一化为阳性和阴性对照的平均值,将阳性对照设置为 100% SAMHD1 活性,将阴性对照设置为 0% SAMHD1 活性。
- 绘制 SAMHD1 活性 (%) 作为化合物浓度的函数,并拟合四参数可变斜率剂量反应曲线,从而确定化合物IC 50。
3. SAMHD1激活剂和底物筛选
注:最终测定条件如 表2所示。将重组SAMHD1和PPase等分试样在-80°C下长期储存,分别以9.1mg / mL和23.0mg / mL稀释,在-80°C下储存缓冲液(20mM HEPES pH 7.5,300mM NaCl,10%甘油,2mM TCEP)。 解冻后,等分试样在-20°C下短期储存。
- 在测定板中制备核苷酸类似物
- 将核苷酸类似物储备液(通常在水中 10 或 100 mM)稀释至完全 SAMHD1 RB 中终浓度的 4 倍,在本例中为 800 μM 核苷酸类似物,并将 5 μL 转移到 384 孔测定板的适当孔中。
- 反应组分的制备
注意:这应该在测定当天完成- 通过将重组人 SAMHD1 蛋白和重组 大肠杆 菌 PPase 在完全 SAMHD1 RB 中稀释至 2 倍所需终浓度,从而制备酶 (SAMHD1/PPase) 预混液,从而制备 0.7 μM SAMHD1 和 25 U/mL PPase。
- 通过将完全SAMHD1 RB中的重组 大肠杆 菌PPase稀释至2x所需终浓度,从而制备单独的PPase溶液,因此25U / mL PPase。
- 制备活化剂GTP(AS1)和dGTPαS(AS1和AS2)稀释原液(通常在水中10或100mM)以完全SAMHD1 RB至4x终浓度,因此为50μM GTP或dGTPαS。
- 进行检测
注意:所有测定组分都应平衡至室温。 液体添加可以使用多通道移液器或散装试剂液体分配器进行。- 向含有核苷酸类似物的 384 孔检测板中,将 5 μL 活化剂(GTP 或 dGTPαS)或完全 SAMHD1 RB 分液至适当的孔中。
- 通过将 10 μL SAMHD1/PPase 预混液、单独 PPase 或完全 SAMHD1 RB 分配到适当的孔中来开始反应。
- 将反应在室温下孵育20分钟。
- 通过向所有孔中分配 20 μL EDTA 终止溶液来停止反应。
注意:如果需要,可以在此处暂停实验。 - 向所有孔中加入 10 μL MG 工作溶液。
谨慎: MG工作液中含有硫酸。 - 确保使用轨道微孔板振荡器混合孔内容物,并以1,000× g 离心1分钟。
- 将板在室温下孵育20分钟。
- 在微孔酶标仪中读取 630 nm 波长的吸收。
- 数据可视化和分析
- 计算仅PPase反应孔(阴性对照或背景信号)的平均吸光度值。
注意:作为 SAMHD1 变构激活剂和底物的阳性对照,dGTP 可以包含在板中。在这种情况下,您可以使用此条件来计算 Z 因子作为检测质量的指标。 - 从SAMHD1 / PPase反应中的相应孔中减去背景值。
- 在缓冲液、GTP 和 dGTPαS 条件下绘制每种核苷酸类似物的校正吸光度值。
- 计算仅PPase反应孔(阴性对照或背景信号)的平均吸光度值。
结果
图 1 中概述的方案描述了利用酶偶联孔雀石绿色测定法探测小分子与 dNTP 酶 SAMHD1 相互作用的基本工作流程,并且可以通过多种方式进行调整以询问不同的生化问题。在以下段落中讨论的代表性结果中,我们举例说明了使用该测定法确定小分子对SAMHD1的抑制特性并测试不同的核苷酸类似物是否是该酶的底物和/或激活剂的示例。
图 2 所示的结果说明了该测定的几个核心原理。孔雀石绿试剂允许通过形成磷钼酸孔雀石绿络合物来比色检测无机磷酸盐,因此,这种方法可以应用于产物为磷酸盐的酶促反应的研究。为了证明该方法检测游离无机磷酸盐的灵敏度,图2A显示了在与孔雀石绿试剂孵育20分钟后,随着Na3PO4浓度的增加而获得的吸光度值。当信号在0.25 mM Na3PO4时达到饱和,磷酸盐的线性检测范围为0.004至0.03 mM(图2A,右图),与其他研究一致,这些研究报告使用孔雀石绿色测定法38的磷酸盐线性范围高达10-20μM。
SAMHD1 是一种 dNTP 酶,在水解 dNTP 分子时释放无机三磷酸盐,因此为了生成游离的无机磷酸盐供孔雀石绿检测,需要偶联酶。来自大肠杆菌的无机焦磷酸酶(PPase)已被证明可用于此目的,无论是关于SAMHD1 7,20,还是其他核苷酸代谢酶30,33,35。此外,SAMHD1 在作为同源四聚体时是一种活性 dNTP 酶,这需要 (d)NTP 变构激活,特别是 AS1 处的三磷酸鸟嘌呤(GTP 或 dGTP)和 AS2 处的任何 dNTP。随后,催化位点变得易于底物结合并发生酶促反应。由于 dGTP 满足与 AS1 和 AS2 结合的要求,并且是一种底物,因此在抑制测定中使用该核苷酸可大大简化工作流程。图2B说明了不同测定组分实现可测量SAMHD1活性的要求,该活性由630nm处的吸光度增加表示。在dGTP存在下,SAMHD1和PPase都不能单独产生无机磷酸盐,这与这些酶的记录活性一致。然而,在所有测定组分(SAMHD1、PPase 和 dGTP 激活剂/底物)都存在的情况下,我们观察到信号增加。此处所示示例的 Z 因子37(不使用酶 + dGTP 作为阴性对照,SAMHD1/PPase + dGTP 作为阳性对照)为 0.74,表明测定稳健。
酶偶联 SAMHD1 活性测定的潜在应用之一是通过高通量筛选 (HTS) 鉴定抑制剂。因此,在本报告中,我们使用文献中已经描述的多种化合物验证了该测定中SAMHD1抑制的检测。Seamon等人使用与此处类似的测定法评估了经典核苷对SAMHD1的剂量依赖性抑制,发现脱氧鸟苷(dGuo)是唯一能够显着抑制SAMHD1的经典核苷,IC50值为488μM20。FDA 批准的药物的 HTS 使用直接 b4NPP 测定法进行,揭示了几种在微摩尔浓度下抑制 SAMHD1 活性的命中,其中洛莫芬净是在体外最有效抑制 SAMHD1 dNTP 酶活性的分子,当在 dGTP 作为底物存在下测定时,IC50 为 20.1 μM21.此外,使用MDCC-PBP传感器和与PPX活性偶联的SAMHD1,还鉴定了4种α,β-亚胺基-dNTP类似物作为SAMHD1的竞争性抑制剂,这表明dNMPNPP类似物的抑制常数在低微摩尔/高纳摩尔范围内6,22。因此,为了证明酶偶联的SAMHD1活性测定可用于鉴定SAMHD1抑制剂,使用dGuo,lomofungin和2'-脱氧胸苷-5'-[(α,β)-亚胺基]三磷酸(dTMPNPP)来验证该技术。图3A显示了这些化合物获得的剂量反应曲线,表明增加浓度可有效抑制SAMHD1活性。从三个独立实验(±标准差)获得的这些分子的平均IC50值如下:dGuo = 361.9 ± 72.8 μM,洛莫芬净 6.78 ± 3.9 μM,dTMPNPP = 2.10 ± 0.9 μM。作为阴性结果的一个例子,还确定了羟基脲(胡)对SAMHD1活性的影响。胡是核糖核苷酸还原酶的抑制剂,尽管它限制了各种AML模型中的SAMHD1 ara-CTPase活性,但胡对SAMHD1的影响被证明是间接的,并且依赖于扰乱SAMHD1的变构调节18。胡的剂量反应曲线如图3B所示,随着胡剂量的增加,SAMHD1活性没有变化,表明胡在体外不抑制SAMHD1活性。
酶偶联SAMHD1活性测定的另一个用途是询问核苷酸及其类似物是否是该酶的底物和/或变构激活剂,如 图4所示。在该实验中,测试了经典核苷酸以及几种抗癌核苷类似物的活性代谢物,如阿糖胞苷 (ara-CTP)、氯法拉滨 (Cl-F-ara-ATP) 和吉西他滨 (dF-dCTP),作为 SAMHD1 底物和激活剂。由于SAMHD1的复杂变构调节,该反应在GTP作为AS1激活剂或不可水解的dGTP类似物2'-脱氧鸟苷-5'-(α-硫代)-三磷酸(dGTPαS)存在下进行,其可以占据AS1和AS2。在被测核苷酸类似物和GTP存在下的SAMHD1活性表明核苷酸能够与次级变构位点和催化位点(即AS2激活剂和底物)结合,而SAMHD1与核苷酸类似物和dGTPαS的活性表明核苷酸只能占据催化位点(即仅占据底物)。如果核苷酸能够与 AS1 和 AS2 变构位点以及催化位点结合,则 SAMHD1 将在单独存在核苷酸的情况下具有活性,如 dGTP 所示。结果表明,所有经典的dNTPs都能够与AS2位点和催化位点结合。在核苷酸类似物的情况下,三磷酸氯法拉滨是AS2激活剂和底物,而三磷酸阿糖胞苷只能占据催化位点。另一方面,三磷酸吉西他滨没有观察到活性,这表明在测试的条件下,三磷酸吉西他滨不能充当变构效应物或底物。尽管这一结果与先前的预测一致9,但后来的结晶和动力学研究10 显示,三磷酸吉西他滨能够结合SAMHD1催化口袋,并且它确实是该酶的底物。然而,在后一项研究10中,作者表明,与其他报道的底物(如三磷酸阿糖胞苷)相比,水解速率要低得多,从而解释了为什么我们无法通过这种筛选装置观察到这一点。
总之,这些代表性结果验证了酶偶联 SAMHD1 活性测定作为鉴定和表征 SAMHD1 抑制剂、变构调节剂和底物的可靠技术。然而,与所有实验方法类似,该方法也有其注意事项,因此应使用正交测定(例如,使用不同的测定技术)来进一步验证研究结果。
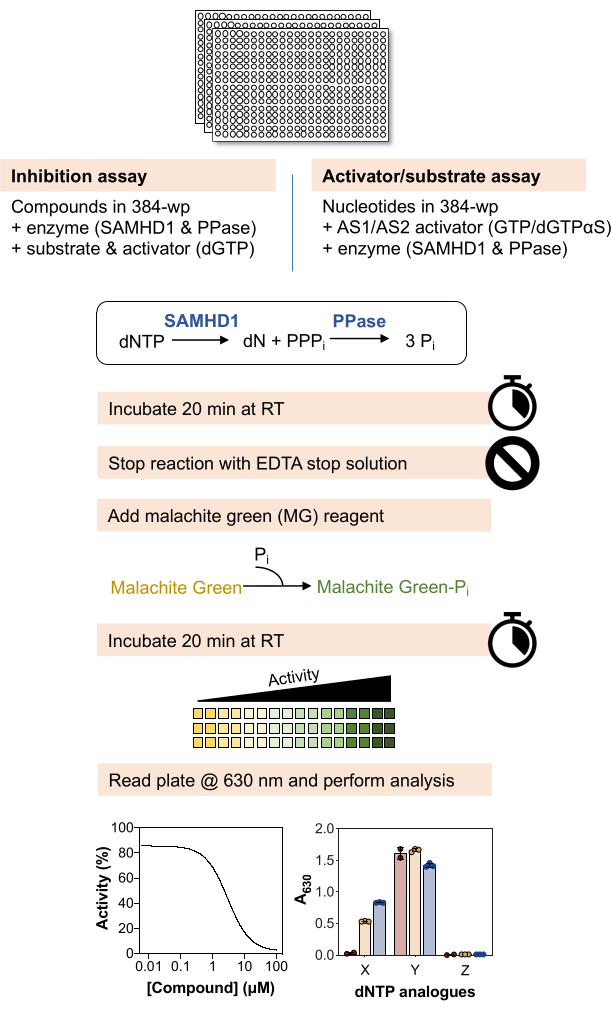
图 1:本文所述协议的示意图概述。 请点击这里查看此图的较大版本.
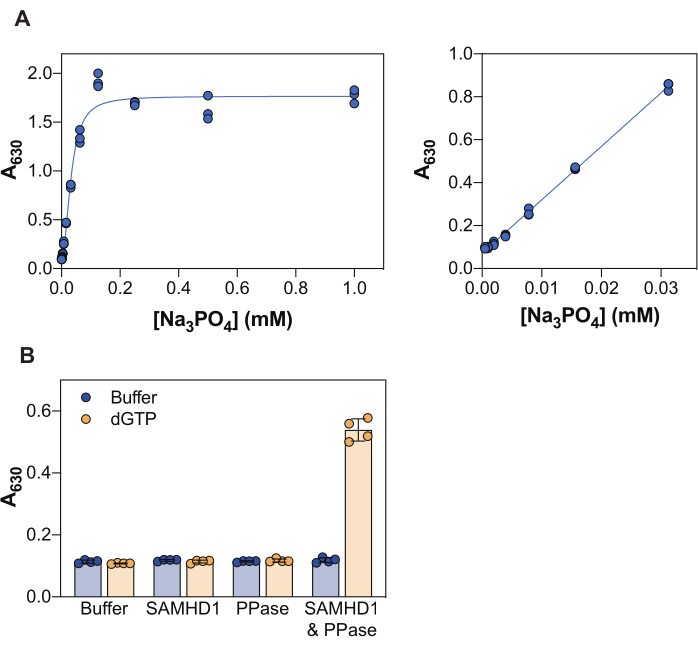
图 2:酶偶联 SAMHD1 活性测定。 (A) 孔雀石绿色测定中的Na3PO4 标准曲线。将Na3PO4 系列稀释液(2倍)从1 mM到0.004 mM一式三份制备,并与孔雀石绿试剂一起孵育20分钟。整个测试浓度范围内的原始吸光度值显示在左图中,线性范围显示在右图中。图中所示的两个独立实验的代表。(B)酶偶联活性测定的验证。SAMHD1 (0.35 μM) 和/或 PPase (12.5 U/mL) 在存在或不存在激活剂/底物 dGTP (25 μM) 的情况下在酶偶联活性测定中孵育 20 分钟。来自两个独立实验的代表的四胞胎,绘制了原始吸光度值,条形图和误差线表示平均值和标准差。 请点击这里查看此图的较大版本.
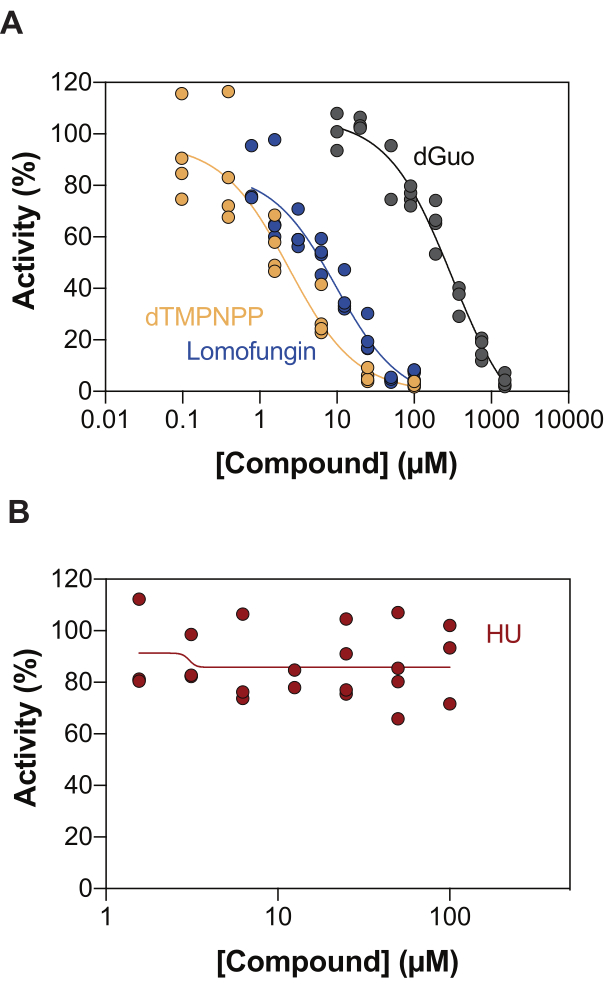
图 3:在酶偶联活性测定中评估化合物对 SAMHD1 抑制的作用。 以 dGTP (25 μM) 为激活剂/底物的酶偶联 SAMHD1 活性测定中,洛莫芬净 (0.78-100 μM)、2'-脱氧胸苷-5'-[(α,β)-亚胺基]三磷酸 (dTMPNPP, 0.01-100 μM) 和脱氧鸟苷 (dGuo, 10-1,500 μM) (A) 或羟基脲 (胡) (0.78-100 μM) (B) 的剂量反应。绘制了单个重复的反应对照的百分比活性(DMSO + SAMHD1/PPase + dGTP = 100% 活性,DMSO + dGTP = 0% 活性),显示了三个实验的代表。 请点击这里查看此图的较大版本.
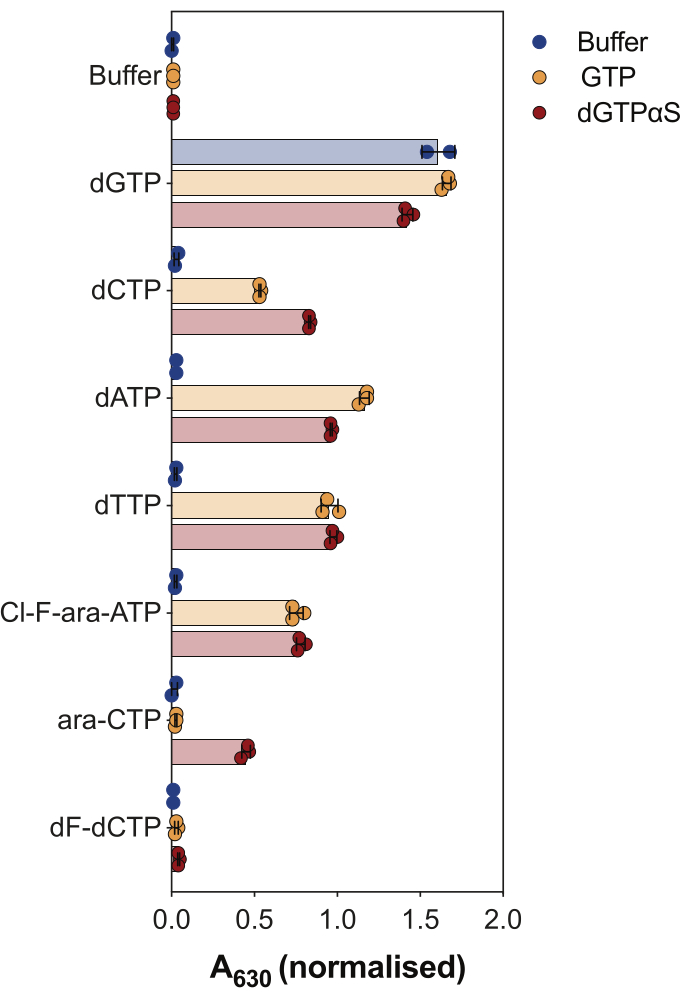
图 4:在酶偶联活性测定中评估核苷酸类似物作为 SAMHD1 变构激活剂和底物。 在存在或不存在GTP或不可水解的dGTP类似物dGTPαS(12.5μM)的情况下,在酶偶联SAMHD1活性测定中以200μM测试抗癌药物阿糖胞苷(ara-CTP),氯法拉滨(Cl-F-ara-ATP)和吉西他滨(dF-dCTP)的典型核苷酸和选定的三磷酸代谢物。标明了绘制的单个实验重复的归一化吸光度值、平均值和标准差。图中两个独立实验的代表,改编自我们之前的研究7. 请点击这里查看此图的较大版本.
| 步 | 试剂 | 分配体积 (μL) | 最终反应体积 (μL) | 分配的浓度 | 反应中的倍稀释 | 反应中的最终浓度 |
| 1 | 抑制剂 | 5 | 20 | 0.4 米 | 4 | 0.1 毫米 |
| 2 | SAMHD1+PPase混合物 | 5 | 1.4μM SAMHD1,50 U/mL PPase | 4 | 0.35μM SAMHD1,12.5 U/mL Ppase | |
| 3 | dGTP的 | 10 | 50微米 | 2 | 25微米 | |
| 4 | 孵育20分钟 | |||||
| 5 | EDTA溶液 | 20 | 40 | 7.9 毫米 | 2 | 3.95 米 |
| 6 | MG试剂 | 10 | 50 | 2.5 mM孔雀石绿,64.4 mM钼酸铵,0.18%吐温-20 | 5 | 0.5 mM孔雀石绿,12.9 mM钼酸铵,0.036%吐温-20 |
| 7 | 孵育20分钟 | |||||
| 8 | 读取 @ 630 nm | |||||
表1:用于抑制剂筛选的酶偶联试验的最终条件摘要。
| 步 | 试剂 | 分配体积 (μL) | 最终反应体积 (μL) | 分配的浓度 | 反应中的倍稀释 | 反应中的最终浓度 |
| 1 | 变构调节剂 | 5 | 20 | 800微米 | 4 | 200微米 |
| 2 | GTP 或 dGTPαS | 5 | 50微米 | 4 | 12.5微米 | |
| 3 | SAMHD1 和/或 PPase | 10 | 0.7μM SAMHD1,25U / mL PPase | 2 | 0.35 μM SAMHD1,12.5 U/mL PPase | |
| 4 | 孵育20分钟 | |||||
| 5 | EDTA溶液 | 20 | 40 | 7.9 毫米 | 2 | 3.95 米 |
| 6 | MG试剂 | 10 | 50 | 2.5 mM孔雀石绿,64.4 mM钼酸铵,0.18%吐温-20 | 5 | 0.5 mM孔雀石绿,12.9 mM钼酸铵,0.036%吐温-20 |
| 7 | 孵育20分钟 | |||||
| 8 | 读取 @ 630 nm | |||||
表2:用于变构调节因子筛选的酶偶联试验的最终条件摘要
讨论
这里详述的酶偶联活性测定是一种高通量比色测定法,允许通过 SAMHD1 间接测量 dNTP 水解。该方法利用 了来自大肠杆菌的无机 PPase 的能力,当大肠杆菌过量包含在反应混合物中时,将 SAMHD1 产生的每种无机三磷酸盐转化为三种单独的游离磷酸盐,可以使用简单且经济的孔雀石绿色试剂进行定量。我们以 384 微孔板形式提供该检测,这是筛选化合物库的理想选择,并证明了该技术在鉴定和表征 SAMHD1 抑制剂、激活剂和底物方面的适用性和多功能性。
与所有 体外 生化筛选测定一样,有许多关键步骤和重要考虑因素,其中许多步骤在免费提供的 检测指导手册39中进行了深入讨论。纯化的重组酶(SAMHD1 和偶联酶无机 PPase)的完整性极为重要,应在建立检测之前进行确认。因此,这些酶的每次新纯化都应进行一定程度的批次测试,因为批次之间的差异可能会导致结果不一致。理想情况下,应使用正交直接测定(如HPLC)来检测底物和反应产物,以验证所使用的纯化重组SAMHD1的dNTP三磷酸水解酶活性。
关于该测定法的局限性,原则之一是它以间接方式测量SAMHD1的dNTPase活性,利用无机PPase的活性,这具有许多含义。重要的是要确认 PPase 对测定中使用的核苷酸几乎没有活性,同样,鉴定出的抑制性小分子对 PPase 没有活性。因此,在筛选方面,针对PPase的反筛选可能是一个重要的考虑因素。反应中 PPase 的存在也使得使用正交测定来确认结果变得至关重要。关于直接活性测定,迄今为止已经报道了其中的一些,包括TLC 9,20,23和HPLC 9,21,它们可以准确检测底物消耗和产物形成。此外,b4NPP 检测21 也是高通量的,可用于测试潜在的抑制剂;然而,测试底物或变构激活剂并不理想。生物物理测定,例如我们之前用 SAMHD118 报道的差示扫描荧光法 (DSF),在识别和表征配体方面也特别强大。该测定的另一个局限性是使用不可水解的 dGTP 类似物 dGTPαS 作为 AS1 和 AS2 激活剂,具体如此处用于识别底物和活化剂的设置所示。虽然这允许在测定中没有观察到活性的 SAMHD1 的激活,但 dGTPαS 是 SAMHD1 的竞争性抑制剂,因此使用高浓度会使酶失活。随着我们对SAMHD1的理解不断深入,未来的研究可以利用专门占据SAMHD1每个位点的分子,从而消除这一潜在问题。
正如我们在这里所展示的,这种方法用途广泛,可用于解决许多生化问题。我们已经描述了该测定的两种变体,一种用于鉴定SAMHD1的变构调节剂和底物,另一种用于表征抑制剂,但可以进行进一步的调整。关于潜在的抑制剂,该测定基于微孔板,使其非常适合下游作用机制研究39,40。同样,为了进一步表征底物和变构调节剂,该技术可用于确定催化的动力学参数,正如我们对阿糖胞苷和氯法拉滨的活性代谢物所做的那样 7.然而,一个缺点是这里报告的酶偶联测定是终点测定,因此,尽管非常适合筛选,但连续测定更适合一些机理研究。Arnold等人报道了一种利用生物传感器MDCC-PBP6的连续酶偶联测定法,该测定依赖于使用用香豆素马来酰亚胺(MDCC)荧光团标记的周质磷酸结合蛋白(PBP),该荧光团可以与游离磷酸基团结合。MDCC-PBP非常灵敏,能够对非常低的磷酸盐浓度进行定量,传感器的响应时间在毫秒到秒的时间尺度上。
SAMHD1 在人类健康和疾病中发挥着许多重要功能2 ,其中许多可能与其在维持细胞内 dNTP 水平中的核心作用有关1。因此,鉴定针对SAMHD1的dNTP酶活性的高质量化学探针将是定义这些联系的有力工具,并且本文报道的酶偶联测定可以很容易地用于鉴定此类探针。此外,作为基于核苷的药物,其中许多受SAMHD1调节,是一组多样化且重要的治疗性药物41;化学探针可以进一步开发成药物,在临床环境中靶向SAMHD1,以提高这些疗法的疗效。了解这些基于核苷的化合物与SAMHD1相互作用的全部范围也很重要,这个问题也可以利用这种酶偶联测定来解决。综上所述,本文报道的酶偶联SAMHD1活性测定是一种低成本、多功能、高通量的测定,可用于进一步了解这种重要酶。
披露声明
作者没有什么可透露的。
致谢
我们感谢托马斯·伦巴克(Thomas Lundbäck)和托马斯·赫勒迪(Thomas Helleday)实验室成员的建议和支持。这项工作的一部分得到了卡罗林斯卡学院/SciLifeLab (http://ki.se/psf) 蛋白质科学设施的促进,我们感谢美国国家癌症研究所 (NCI)、癌症治疗和诊断部 (DCTD) 和发育治疗计划 (DTP) (http://dtp.cancer.gov) 提供了一种化合物。资金由瑞典研究委员会(2018-02114)、瑞典癌症协会(19-0056-JIA,20-0879-PJ)、瑞典儿童癌症基金会(PR2019-0014)和卡罗林斯卡学院授予SGR的赠款提供。
材料
| Name | Company | Catalog Number | Comments |
| 2'-deoxyadenosine-5'-triphosphate (dATP) | Jena bioscience | NU-1001 | Compound tested in SAMHD1 activator/substrate assay |
| 2'-deoxycytidine-5'-triphosphate (dCTP) | Jena bioscience | NU-1002 | Compound tested in SAMHD1 activator/substrate assay |
| 2'-Deoxyguanosine-5'-(α-thio)-triphosphate (dGTPαS) | Jena bioscience | NU-424 | Non-hydrolyzable dGTP analogue for SAMHD1 activator/substrate assay |
| 2'-deoxyguanosine-5'-triphosphate (dGTP) | GE Healthcare | 27-1870-04 | SAMHD1 allosteric activator and substrate used in inhibition assay and activator/substrate assay |
| 2'-Deoxythymidine-5'-[(α,β)-imido]triphosphate (dTMPNPP) | Jena bioscience | NU-907-1 | Compound tested in SAMHD1 inhibition assay |
| 2'-deoxythymidine-5'-triphosphate (dTTP) | Jena bioscience | NU-1004 | Compound tested in SAMHD1 activator/substrate assay |
| 2'Deoxyguanosine mohohydrate (dGuo) | Sigma-Aldrich | D0901 | Compound tested in SAMHD1 inhibition assay |
| 384 well clear flat-bottom microplate | Thermo Fisher Scientific | 262160 | Assay plate |
| 96 well clear U-bottom polypropylene microplate | Thermo Fisher Scientific | 267245 | Compound dilution plate |
| Ammonium heptamolybdate tetrahydrate | Sigma-Aldrich | A1343 | Reagent required for malachite green working reagent |
| ara-Cytidine-5'-triphosphate (ara-CTP) | Jena bioscience | NU-1170 | Compound tested in SAMHD1 activator/substrate assay |
| Clofarabine-5'-triphosphate (Cl-F-ara-ATP) | Jena bioscience | NU-874 | Compound tested in SAMHD1 activator/substrate assay |
| Dimethyl sulphoxide (DMSO) | VWR | 23486.297 | Solvent |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma-Aldrich | E5134 | EDTA stop solution component |
| Gemcitabine-5'-triphosphate (dF-dCTP) | Jena bioscience | NU-1607 | Compound tested in SAMHD1 activator/substrate assay |
| GraphPad Prism | GraphPad Software | Prism 8 | Data analysis and visualisation |
| Guanosine 5′-triphosphate (GTP) sodium salt hydrate | Sigma-Aldrich | G8877 | Allosteric activator for SAMHD1 activator/substrate assay |
| His-tagged E. coli inorganic pyrophosphatase (PPase) | Generated in house using Protein Science Facility, Karolinska Institutet | - | Recombinant PPase protein, hydrolises inorganic triphosphate and pyrophosphate to orthophosphate so it can form complex with malachite green |
| His-tagged human SAMHD1 | Generated in house using Protein Science Facility, Karolinska Institutet | - | Recombinant SAMHD1 protein, hydrolizes dNTPs into its corresponding nucleoside and inorganic triphosphate |
| Hydroxyurea | Sigma-Aldrich | H8627 | Compound tested in SAMHD1 inhibition assay |
| Lomofungin | National Cancer Institute (NCI)/Division of Cancer Treatment and Diagnosis (DCTD)/Developmental Therapeutics Program (DTP) | NSC106995 | Compound tested in SAMHD1 inhibition assay |
| Magnesium Chloride hexahydrate (MgCl2) | Sigma-Aldrich | M2670 | SAMHD1 reaction buffer component |
| Malachite green Carbinol hydrochloride | Sigma-Aldrich | 213020 | Malachite green stock component |
| Microplate Reader | Hidex | Hidex Sense Microplate reader | Data acquisition, absorption read at 630 nm wavelength |
| Sodium Chloride (NaCl) | Sigma-Aldrich | 31434 | SAMHD1 reaction buffer component |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | 567530 | SAMHD1 reaction buffer component |
| Sodium phosphate (Na3PO4) | Sigma-Aldrich | 342483 | Required for phosphate standard curve |
| Sulphuric acid 95-97% | Sigma-Aldrich | 84720 | Malachite green stock component |
| Tris-Acetate salt | Sigma-Aldrich | T1258 | SAMHD1 reaction buffer component |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP) | Sigma-Aldrich | C4706 | SAMHD1 reaction buffer component |
| Tween-20 | Sigma-Aldrich | P1379 | SAMHD1 reaction buffer and malachite green working reagent component |
参考文献
- Franzolin, E., et al. The deoxynucleotide triphosphohydrolase SAMHD1 is a major regulator of DNA precursor pools in mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (35), 14272-14277 (2013).
- Coggins, S. A., Mahboubi, B., Schinazi, R. F., Kim, B. SAMHD1 functions and human diseases. Viruses. 12 (4), 382 (2020).
- Goldstone, D. C., et al. HIV-1 restriction factor SAMHD1 is a deoxynucleoside triphosphate triphosphohydrolase. Nature. 480 (7377), 379-382 (2011).
- Powell, R. D., Holland, P. J., Hollis, T., Perrino, F. W. Aicardi-Goutieres syndrome gene and HIV-1 restriction factor SAMHD1 is a dGTP-regulated deoxynucleotide triphosphohydrolase. The Journal of Biological Chemistry. 286 (51), 43596-43600 (2011).
- Morris, E. R., Taylor, I. A. The missing link: Allostery and catalysis in the anti-viral protein SAMHD1. Biochemical Society Transactions. 47 (4), 1013-1027 (2019).
- Arnold, L. H., Kunzelmann, S., Webb, M. R., Taylor, I. A. A continuous enzyme-coupled assay for triphosphohydrolase activity of HIV-1 restriction factor SAMHD1. Antimicrobial Agents and Chemotherapy. 59 (1), 186-192 (2015).
- Herold, N., et al. Targeting SAMHD1 with the Vpx protein to improve cytarabine therapy for hematological malignancies. Nature Medicine. 23 (2), 256-263 (2017).
- Schneider, C., et al. SAMHD1 is a biomarker for cytarabine response and a therapeutic target in acute myeloid leukemia. Nature Medicine. 23 (2), 250-255 (2017).
- Hollenbaugh, J. A., et al. Substrates and inhibitors of SAMHD1. PloS One. 12 (1), 0169052 (2017).
- Knecht, K. M., et al. The structural basis for cancer drug interactions with the catalytic and allosteric sites of SAMHD1. Proceedings of the National Academy of Sciences of the United States of America. 115 (43), 10022-10031 (2018).
- Oellerich, T., et al. Selective inactivation of hypomethylating agents by SAMHD1 provides a rationale for therapeutic stratification in AML. Nature Communications. 10 (1), 3475 (2019).
- Herold, N., et al. SAMHD1 protects cancer cells from various nucleoside-based antimetabolites. Cell Cycle. 16 (11), 1029-1038 (2017).
- Rothenburger, T., et al. SAMHD1 is a key regulator of the lineage-specific response of acute lymphoblastic leukaemias to nelarabine. Communications Biology. 3 (1), 324 (2020).
- Ordonez, P., et al. SAMHD1 enhances nucleoside- analogue efficacy against HIV-1 in myeloid cells. Scientific Reports. 7, 42824 (2017).
- Castellví, M., et al. Pharmacological modulation of SAMHD1 activity by CDK4/6 inhibitors improves anticancer therapy. Cancers. 12 (3), 713-719 (2020).
- Rassidakis, G. Z., et al. Low-level expression of SAMHD1 in acute myeloid leukemia (AML) blasts correlates with improved outcome upon consolidation chemotherapy with high-dose cytarabine-based regimens. Blood Cancer Journal. 8 (11), 98 (2018).
- Rudd, S. G., Schaller, T., Herold, N. SAMHD1 is a barrier to antimetabolite-based cancer therapies. Molecular & Cellular Oncology. 4 (2), 1287554 (2017).
- Rudd, S. G., et al. Ribonucleotide reductase inhibitors suppress SAMHD1 ara-CTPase activity enhancing cytarabine efficacy. EMBO Molecular Medicine. 41, 10419 (2020).
- Seamon, K. J., et al. Small molecule inhibition of SAMHD1 dNTPase by tetramer destabilization. Journal of the American Chemical Society. 136 (28), 9822-9825 (2014).
- Seamon, K. J., Stivers, J. T. A high-throughput enzyme-coupled assay for SAMHD1 dNTPase. Journal of Biomolecular Screening. 20 (6), 801-809 (2015).
- Mauney, C. H., Perrino, F. W., Hollis, T. Identification of inhibitors of the dNTP triphosphohydrolase SAMHD1 using a novel and direct high-throughput assay. Biochemistry. 57 (47), 6624-6636 (2018).
- Morris, E. R., et al. Crystal structures of SAMHD1 inhibitor complexes reveal the mechanism of water-mediated dNTP hydrolysis. Nature Communications. 11 (1), 3165 (2020).
- Hansen, E. C., Seamon, K. J., Cravens, S. L., Stivers, J. T. GTP activator and dNTP substrates of HIV-1 restriction factor SAMHD1 generate a long-lived activated state. Proceedings of the National Academy of Sciences of the United States of America. 111 (18), 1843-1851 (2014).
- Baykov, A. A., Evtushenko, O. A., Avaeva, S. M. A malachite green procedure for orthophosphate determination and its use in alkaline phosphatase-based enzyme immunoassay. Analytical Biochemistry. 171 (2), 266-270 (1988).
- Hyun, M., Bohr, V. A., Ahn, B. Biochemical characterization of the WRN-1 RecQ helicase of Caenorhabditis elegans. Biochemistry. 47 (28), 7583-7593 (2008).
- Lin, H. -. H., Huang, C. -. Y. Characterization of flavonol inhibition of DnaB helicase: real-time monitoring, structural modeling, and proposed mechanism. Journal of Biomedicine & Biotechnology. 2012 (4), 735368 (2012).
- Yang, M., Wang, G. ATPase activity measurement of DNA replicative helicase from Bacillus stearothermophilus by malachite green method. Analytical Biochemistry. 509, 46-49 (2016).
- Allard, B., Cousineau, I., Spring, K., Stagg, J. Measurement of CD73 enzymatic activity using luminescence-based and colorimetric assays. Methods in Enzymology. 629, 269-289 (2019).
- Lee, M., et al. Structure-activity relationship of sulfonyl piperazine LpxH inhibitors analyzed by an LpxE-coupled malachite green assay. ACS Infectious Diseases. 5 (4), 641-651 (2019).
- Carreras-Puigvert, J., et al. A comprehensive structural, biochemical and biological profiling of the human NUDIX hydrolase family. Nature Communications. 8 (1), 1541 (2017).
- Valerie, N. C. K., et al. NUDT15 hydrolyzes 6-thio-deoxyGTP to mediate the anticancer efficacy of 6-thioguanine. Cancer Research. 76 (18), 5501-5511 (2016).
- Carter, M., et al. Human NUDT22 Is a UDP-glucose/galactose hydrolase exhibiting a unique structural fold. Structure. 26 (2), 295-303 (2018).
- Gad, H., et al. MTH1 inhibition eradicates cancer by preventing sanitation of the dNTP pool. Nature. 508 (7495), 215-221 (2014).
- Page, B. D. G., et al. Targeted NUDT5 inhibitors block hormone signaling in breast cancer cells. Nature Communications. 9 (1), 250 (2018).
- Zhang, S. M., et al. Development of a chemical probe against NUDT15. Nature Chemical Biology. 16 (10), 1120-1128 (2020).
- Michel, M., et al. In silico druggability assessment of the NUDIX hydrolase protein family as a workflow for target prioritization. Frontiers in Chemistry. 8, 443 (2020).
- Zhang, J., Chung, T., Oldenburg, K. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67 (1999).
- Baykov, A. A., Evtushenko, O. A., Avaeva, S. M. A malachite green procedure for orthophosphate determination and its use in alkaline phosphatase-based enzyme immunoassay. Analytical Biochemistry. 171 (2), 266-270 (1988).
- Markossian, S., et al. Assay guidance manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Holdgate, G. A., Meek, T. D., Grimley, R. L. Mechanistic enzymology in drug discovery: a fresh perspective. Nature Reviews Drug Discovery. 17 (2), 115-132 (2018).
- Tsesmetzis, N., Paulin, C. B. J., Rudd, S. G., Herold, N. Nucleobase and nucleoside analogues: resistance and re-sensitisation at the level of pharmacokinetics, pharmacodynamics and metabolism. Cancers. 10 (7), 240 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。