일방적 인 신장 허혈 - 재관류 손상의 효과적인 마우스 모델
요약
신장 허혈-재관류 손상은 입원 환자의 높은 이환률 및 사망률과 관련이 있다. 여기에서, 우리는 일방적 인 신장 허혈 재관류 손상의 간단하고 효과적인 마우스 모델을 제시하고 신장에서 관찰 된 대표적인 병리학 적 변화에 대한 순차적 인 개요를 제공합니다.
초록
허혈-재관류 손상(IRI)은 급성 신부전의 주요 원인이며 지연된 이식편 기능에 중요한 기여를 합니다. 동물 모델은 생체내에서 발생하는 IRI 관련 손상의 복잡성을 모방하는 유일한 가용 자원 이다. 이 논문은 재현성이 높은 데이터를 제공하는 일방적 인 신장 IRI의 효과적인 마우스 모델을 설명합니다. 허혈은 30분 동안 우측 신장 페디클을 폐색시킨 후 재관류함으로써 유도된다. 외과 적 절차 외에도, 신장 IRI 후 예상되는 생리 학적 및 조직 병리학 적 변화에 대한 순차적 개요는 7 개의 다른 재관류 시간 (4 h, 8 h, 16 h, 1 일, 2 일, 4 일 및 7 일)의 데이터를 비교함으로써 제공 될 것입니다. 평균 수술 시간, 평균 마취 소비 및 시간에 따른 체중 변화와 같은 사전 실험 계획을위한 중요한 데이터가 공유됩니다. 이 연구는 연구자가 신뢰할 수있는 신장 IRI 모델을 구현하고 의도 한 조사 목표에 부합하는 적절한 재관류 시간을 선택하는 데 도움이됩니다.
서문
신장은 신체에서 가장 높은 관류 기관 중 하나이며 혈액 관류의 변화에 매우 취약합니다1. 신장 허혈-재관류 손상(IRI)은 급성 신부전의 주요 원인으로 남아있고2,3 입원 환자4에서 높은 이환률 및 높은 사망률과 연관된다. 제한된 치료 옵션을 사용할 수 있습니다.4,5 신장 IRI는 현재 새로운 치료 목표의 개발과 신장 손상의 초기 및 민감한 마커의 특성화를 목표로하는 생물 의학 6,7에 대한 여러 연구 노력의 초점입니다 8,9,10 . 신뢰할 수 있고 시간 및 비용 효율적인 동물 모델을 식별하는 것은 이러한 요구를 충족시키는 데 필수적인 것으로 간주됩니다. 이 논문은 일방적 인 신장 IRI의 간단하고 효과적인 마우스 모델을 제시합니다. 허혈은 30분 동안 우측 신장 페디클의 클램핑에 의해 유도된다11,12. 이 모델의 중요한 부분은 관상 괴사, 다형성 핵 염증 세포 침윤 또는 섬유증과 같은 관심있는 병리학 적 사건을 재현 할 수있는 가장 적합한 재관류 시간을 선택하는 것입니다. 따라서 연구자들은 IRI 신장에서 예상되는 대표적인 병리학 적 변화에 대한이 순차적 인 개요를 제공합니다.
프로토콜
다음 프로토콜은 생존 수술을 설명합니다. 따라서 가장 높은 무균 및 외과 적 관행이 적용됩니다. 모든 동물 실험은 제도적 지침에 따라 수행되었으며 기관 동물 관리 및 사용위원회의 승인을 받았습니다. IRI 효과의 성별 및 균주 기반 차이를 제거하기 위해 수컷 C57BL6 마우스 만 연구에 사용되었습니다. 모든 동물은 나이와 체중을 매칭하여 비교 가능한 결과를 생성하였다.
1. 준비
참고: 서로 다른 실험 단계 및 개입의 타임라인은 그림 1A에 나와 있습니다.
- 각 절차 전에 수술 테이블을 청소하고 소독하십시오. 필요한 모든 재료(멸균 도구 및 면봉, 멸균 거즈 및 커튼, 미리 희석된 마취제, 가열 패드, 멸균된 혈관 클램프, 멸균 식염수, 피부 소독제 및 봉합사)를 수술 테이블에 준비하고 놓습니다( 재료 표 참조).
- 수컷 C57BL6 마우스 (연령 범위 11-13 주)를 케타민 / 자일라진 (각각 100 mg / kg 및 20 mg / kg의 체중, 이전에 멸균 식염수로 희석)의 복강 주사로 마취하십시오.
참고 : 스트레스 반응이 마취제의 작용에 부정적인 영향을 줄 수 있으므로 숙련 된 동물 취급은 동물의 스트레스를 최소화하는 데 필수적입니다. - 케타민 / 자일라진 투여 후 면도날과 비누를 사용하여 오른쪽 측면의 수술 부위를 면도하십시오.
참고 : 피부를 면도하면 상처 치유뿐만 아니라 생존 수술의 일반적인 결과가 향상됩니다. - 수술 부위의 피부를 먼저 70 % 알코올로 소독 한 다음 면봉을 사용하여 포비돈 요오드 용액으로 소독하십시오.
- 피부 준비 후, 마우스를 복부 욕창 위치의 가열 테이블 위에 놓고 37°C에서 체온을 안정화시킨다(직장 및 패드 센서 프로브를 통해 모니터링).
참고 : 신장은 측면보다는 복부 욕창구에 놓일 때 더 쉽게 접근하고 외과 적으로 노출됩니다. - 체온이 안정되는 동안 마우스의 눈에 눈 연고를 바르십시오.
참고 : 케타민과 같은 해리 마취제는 마취 중에 동물의 눈을 뜨게합니다.
2. 수술
- 통증 반사가 없으면 (핀셋으로 발가락을 꼬집는 발가락), 메스 블레이드를 사용하여 오른쪽 측면에서 약 1cm 등쪽 측면 절개를 수행하십시오. 마지막 갈비뼈 뒤의 절개를 시작하고 요추 정중선과 평행하게 약 1cm를 계속 진행하십시오.
- 복막 공간을 시각화하기 위해 가위를 사용하여 복부 근육 조직을 횡단하십시오. 멸균 면봉을 사용하여 근육을 절개하는 동안 생성 된 소량의 혈액을 제거하십시오.
참고: 등쪽 측면 접근법이 사용되기 때문에 복강이 아닌 후복막이 이 절차를 통해 접근됩니다. - 오른쪽 신장을 복강에서 밀어 내십시오. Graefe 포셉을 사용하여 신장을 조심스럽게 노출시킵니다.
참고 : 복부에 놓을 때 신장에 외상성 손상을 피하기 위해 포셉을 항상 닫아 두고, 신장을 외과 절개 및 밖으로 조심스럽게 밀고 안내하는 데에만 사용하십시오. - 천천히 오른쪽 신장을 노출하고 신장 소아를 확인하십시오. 조심스럽게 소아 주위의 지방 조직을 제거하십시오.
- 허혈을 유도하려면 신장 소아에 존재하는 신장 동맥과 정맥 위에 혈관 클램프를 놓고 인접한 요관을 클램핑하지 마십시오. 혈관 클램프를 조작하기 위해 Halsted-Mosquito 지혈제를 사용하십시오.
참고: 허혈은 신장의 색이 적색 분홍색에서 진한 보라색으로 변하는 것을 시각화하여 확인할 수 있습니다(그림 1B). - 건조를 피하기 위해 식염수에 담근 멸균 거즈로 클램핑 된 신장을 덮고 30 분 동안 그대로 두십시오.
- 이 시간 동안 정기적으로 거즈의 마취 깊이와 습도를 모니터링하십시오.
주: 마취의 유도 용량은 허혈성 사건이 끝날 때까지 진통제를 제공하기에 충분하다; 따라서 추가 마취 주사가 필요하지 않습니다. - 허혈 기간이 끝나기 직전에 거즈를 제거하고 신장을 발견하십시오. Halsted-Mosquito 지혈제를 잡고 클램프 제거 준비를하십시오.
- 분 30에서 지혈제로 혈관 클램프를 열고 신장 페디클에서 제거하여 신장의 재관류를 허용합니다.
참고: 재관류는 신장의 색이 짙은 보라색에서 적색-분홍색으로 변하는 것을 시각화하여 확인할 수 있습니다(그림 1C). - 신장 페디클을 클램핑하지 않고 가짜 동물에 대해 위에서 설명한 것과 동일한 절차를 수행하십시오.
- 신장 색 변화를 확인한 후 신장을 복강으로 되돌립니다. 십자형 패턴을 사용하여 흡수 가능한 봉합사 5-0으로 복부 근육을 닫습니다.
참고 : 근육과 피부를 봉합하는 동안 진통제를 유지하기 위해 마취제의 두 번째 주사가 필요할 수 있습니다. 초기 복용량의 절반은 수술이 끝날 때까지 진통제를 제공하는 데 효과적임이 입증되었습니다. - 수평 매트리스 패턴을 사용하여 흡수 가능한 봉합사 5-0으로 피부를 닫습니다. 면봉을 사용하여 포비돈 요오드 용액으로 상처를 닦으십시오.
3. 회복 및 수술 후
참고 : 수술 후 시간은 실제 재관류 시간이므로 적절한 수술 후 치료는 윤리적으로 필수적이며 과학적으로 관련이 있습니다. 재관류 시간은 연구자에 의해 요구되는 바에 따라 선택될 수 있다. 4 h, 8 h, 16 h, 1 일, 2 일, 4 일, 및 7 일의 재관류 시간을 비교하여 신장 IRI에 의해 유도되는 병리학 적 변화의 순차적 개요를 얻는다.
- 마우스가 마취에서 회복되기 시작할 때까지 가열 패드에 보관하십시오.
참고: 마우스가 다리를 움직이기 시작하고 움직이려고 시도할 때까지 기다리는 것이 좋습니다. 수술 중에 추가 마취 주사가 필요한 경우 회복 시간이 길어집니다. 알파-2 수용체 길항제인 아티파메졸은 자일라진 효과를 역전시키고 회복 단계를 단축하기 위해 복강내 체중 0.5mg/kg의 용량으로 투여할 수 있습니다. 통증 관리를 위해 buprenorphine (체중 0.1 mg / kg, 복강 내)은 수술 전 및 회복 및 수술 후 단계에서 6 시간마다 투여됩니다. 비 스테로이드 성 항염증제의 사용은이 가족의 여러 약물이 신 독성을 유발하므로 결과를 바꿀 수 있으므로 권장하지 않습니다. - 마취에서 회복 한 후, 마우스를 물과 음식에 자유롭게 접근 할 수있는 새장에 다시 넣으십시오.
참고 : 으깬 음식은 페트리 접시뿐만 아니라 숨기고 놀기위한 재료 (예 : 종이 시트, 종이 타월 튜브)로 제공 될 수 있습니다. - 매일 마우스를 모니터링하여 상처 치유, 음식 및 물 섭취량, 체중 및 행동을 평가하십시오.
참고: 상처 치유 상태는 다음의 척도를 사용하여 평가되었다: 1, 건조; 2, 젖은; 3, 부분적으로 열린; 4, 열었습니다. 빠른 상처 치유는이 연구에서 문서화되었으며, 2 일째 후에 건조한 상처의 90 % 이상이 문서화되었습니다.
4. 안락사 및 샘플 수집
- 마우스의 마취 용량의 두 배인 용량으로 복강내 투여된 펜토바르비탈 나트륨으로 마우스를 안락사시킨다(100 mg/kg).
- 필요에 따라 유체 및 조직 샘플을 수집합니다.
참고 : 신장, 전혈 (혈구 수), 혈청 (혈액 생화학 용), 소변, 심장 및 폐를 모두 수집했습니다. 혈액 생화학 분석 (혈액 요소 질소 (BUN), 크레아티닌, 전해질)을 위해 몇 마이크로 리터의 혈청이 필요합니다. 필요한 경우, 안락사 24 시간 전에, 마우스는 신장 기능 매개 변수의 결정을 허용하는 더 높은 소변 부피를 수집하기 위해 대사 케이지에 배치 될 수있다.
결과
생리적 파라미터
이 일방적 인 신장 IRI 수술에서 우연히 회복 된 마우스; 활발하고 경계하는 것처럼 보였다. 다음 날까지 정상적인 식사, 음주 및 행동을 보였습니다. 일부 마우스는 IRI 후 체중 감소를 가질 수 있지만 일반적으로 초기 체중의 10 % 미만입니다 (그림 2). 더 큰 체중 손실 (˃10 %)은 해로울 수 있으며 해당 동물은 연구에서 제거해야합니다. Sham-조작된 마우스는 수술 후 체중 변화를 나타내지 않았다(수술 후 24시간 측정). 대부분의 마우스는 수술 후 4일째와 7일 사이에 초기 체중을 회복시켰다(IRI 7일군 참조, 도 2). 신장 기능은 혈액 요소 질소 (BUN) 및 크레아티닌과 같은 전통적인 마커를 사용하여 평가할 수 있습니다. 추가적으로, 혈청 (나트륨, 칼륨 및 염화물)의 전해질 수준과 자동화된 차등 혈액 수가 분석에 포함되었습니다.
조직 병리학 적 변화
조직병리학적 소견의 평가는 헤마톡실린/에오신(HE), 주기적 산 쉬프, 마손의 삼색 얼룩으로 염색된 신장의 4% 파라포름알데히드 고정, 파라핀 포매된 전체 중간 시상 절편을 사용하여 수행되었다. 이 일방적 인 신장 IRI 모델에 의해 생성 된 가장 명백한 변화는 코르티코 - 수질 접합부, 특히 근위 세뇨관, Henle 루프의 두꺼운 오름차순 사지, 원위 복잡한 세뇨관 및 관형 간질에서 볼 수 있습니다 ( 그림 3의 전설 참조). 신장에서 IRI에 이어 가장 특징적인 병변을 보여주는 현미경 이미지는 도 3에서 볼 수 있다. 순차적 조직병리학적 소견의 리스트가 표 1에 제공된다.
관형 부상 점수 시스템은 시간에 따른 피해를 분류하기 위해 개발되었습니다(그림 4). 이것에서, 다섯 개의 정의된 변경은 세 개의 상이한 평가자에 의해 평가되었다: 1) 관형 상피 감쇠; 2) 브러쉬 테두리 손실; 3) 관상 괴사; 4) 발광 방해; 5) 단백질성 캐스트의 존재. "1"의 할당은 변경이 존재하고, "0"이 없다는 것을 나타냅니다.
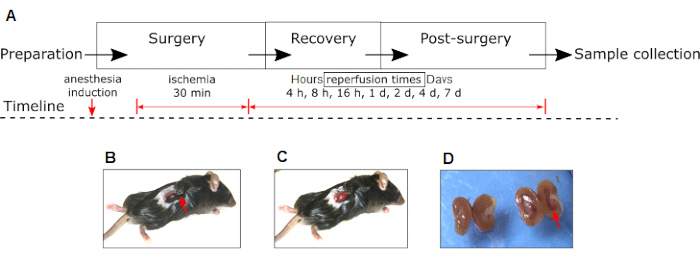
도 1: 마우스에서의 실험적 신장 IRI 모델 . (A) 실험 및 중재(마취 유도, 허혈 및 재관류)의 단계가 도시되어 있다. 허혈 중 오른쪽 신장의 색이 진한 빨간색으로 변하는 것을 주목하십시오 (B) 재관류 중 분홍색 (C). (d) 수술 후 24시간 후에 동일한 동물의 대측성 비IRI 신장과 비교한 IRI 우측 신장(적색 화살표)의 거시적 외관. (B)의 빨간색 화살표는 지혈 클램프의 위치를 나타낸다. 약어: IRI = 허혈-재관류 손상. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
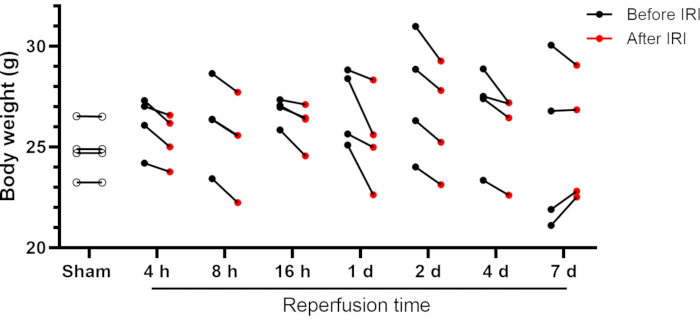
그림 2: 신장 IRI 전후의 마우스의 체중. 개별 데이터가 표시됩니다. 약어: IRI = 허혈-재관류 손상; h = 시간; d = 일. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
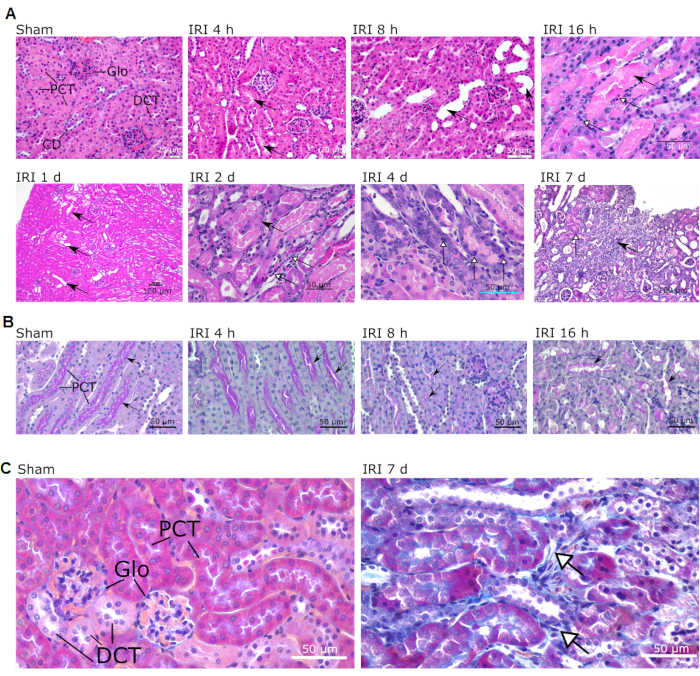
그림 3: IR-작동된 마우스의 피질 및 피질-골수 접합부에서 관찰된 전형적인 현미경적 병변. Sham과 다른 재관류 시간이 표시됩니다 (각 그림 위에 표시됨). (a) 무손상 구조는 가짜(배율 40x; 스케일 바 = 20 μm)로 표시된다. IRI 4h에서의 화살표는 관형 루멘 내의 단백질성 캐스트의 존재를 나타낸다(배율 40x; 스케일 바 = 20 μm). IRI 8 h에서의 화살표는 관형 팽창을 나타낸다(배율 40x; 스케일 바 = 50 μm). IRI 16 h에서의 검정 화살표는 수질 세그먼트에서의 관형 캐스트를 나타내고; 흰색 화살표는 세포 괴사 영역을 보여줍니다 (배율 40x, 스케일 바 = 50 μm). IRI 1d의 검정 화살표는 관형 팽창을 나타냅니다(배율 10x; 스케일 바 = 100μm). IRI2d에서의 검정 화살표는 확대된 세포 핵을 나타내고; 백색 화살촉은 림프구 및 대식세포 침윤의 영역을 보여준다(배율 40x; 스케일 바 = 50 μm). IRI 4d에서 백색 화살촉은 유사분열성 관형 세포를 나타낸다(배율 40x; 스케일 바 = 50 μm). IRI 7d에서의 검정 화살표는 초점 섬유증의 영역을 나타내고; 흰색 화살촉은 재생 영역을 나타낸다(배율 20x; 스케일 바 = 100 μm). (b) 조기 재관류 동안 마우스의 신장 피질을 보여주는 PAS 염색 (4 h, 8 h, 및 16 h). 브러시 테두리(화살표)의 점진적 감쇠에 유의하십시오. 배율 40x; 스케일 바 = 50 μm (C) 간질성 섬유증의 영역을 나타내는 가짜 및 IRI 7 d 마우스의 마손 삼색 염색 (백색 화살표). 배율 40x; 스케일 바 = 50 μm. 약어: IRI = 허혈-재관류 손상; 글로 = 사구체; PCT = 근위 복잡한 세뇨관; DCT = 원위 복잡한 세뇨관; CD = 수집 덕트; PAS = 주기성 산 쉬프; d = 일. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
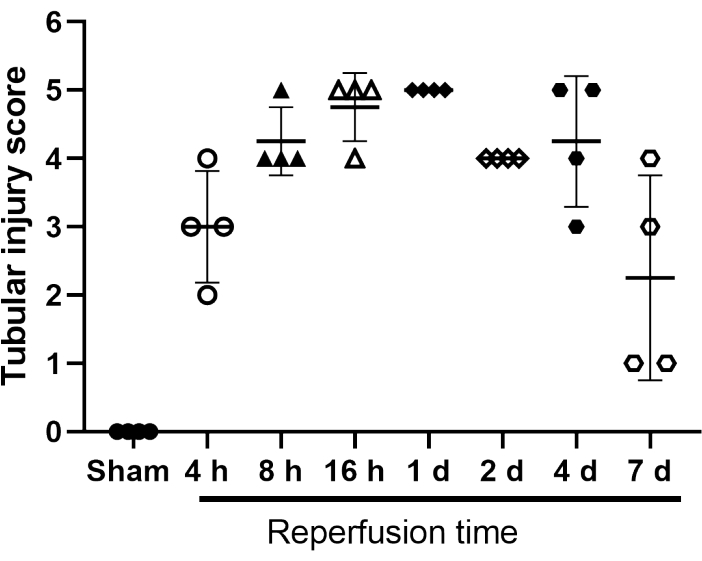
그림 4: 가짜 및 IRI 조작된 마우스의 관상 손상 점수. 관형 상피 감쇠를 위한 스코어링 시스템 스케일 1 내지 5; 브러쉬 테두리 손실; 관상 괴사; 발광 장애물; 단백질성 캐스트의 존재. "1"의 할당은 변경이 존재하고, "0"이 없다는 것을 나타냅니다. 개별 값이 표시됩니다. 막대는 평균 ± SD(n=4)를 나타냅니다. 약어: IRI = 허혈-재관류 손상. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| IRI 이후 시간 | 가장 중요한 병리학 적 변화 |
| 4시간 | 관형 장애물 |
| 루멘에 주조 된 단백질 | |
| 8시간 | 관형 팽창 |
| 초기 괴사 | |
| 상피의 감쇠 | |
| 16시간 | 세포 괴사 |
| 관형 캐스트 | |
| 호중구 침윤 | |
| 1일 | 괴 사 |
| 관형 팽창 | |
| 호중구 침윤 | |
| 2 일 | 관형 팽창 |
| 림프구 및 대식세포 침윤 | |
| 확대된 세포핵 | |
| 4일 | 세뇨관 세포에서 두드러진 유사분열 활성 |
| 7일 | 초점 섬유증 |
| 재생 영역 |
표 1: 시간에 따른 가장 중요한 병리학적 변화. 그룹 당 4-6 마리의 동물을 현미경으로 검사하여 진단했습니다.
토론
마우스 신장 IRI 모델은 상대적으로 낮은 운영 비용과 다양한 트랜스제닉 모델(12)의 가용성으로 인해 생물 의학 연구에서 인기가 있다. 여기에 제시된 일방적 신장 IRI 모델은 관상 확장, 괴사 및 섬유증과 같은 인간 신장 IRI에서 관찰되는 특징적인 병리학적 변화를 모방한다(13). 이러한 결과는 다양한 재관류 시간을 기반으로 합니다.
이 프로토콜의 중요한 단계는 일정한 체온의 유지와 신장 페디클에 혈관 클램프의 올바른 배치를 포함합니다. 체온은 동물의 신진 대사(14)에 영향을 미쳐 생리 학적 및 세포 수준15에서 실험 결과를 변경합니다. 이 모델에서, 체온은 직장 및 패드 센서 프로브를 사용하여 수술 전에 안정화되었다. 또한, 전체 수술 절차 동안 체온의 지속적인 모니터링은 특히 허혈을 유도하기 위해 혈관 클램프를 배치하기 전에 적극 권장됩니다.
신장의 노출과 혈관 클램프의 적절한 배치 또한 실험의 성공에 중요합니다. 외과 적 절개를 통해 신장의 노출 중에 포셉의 부적절한 취급에 의한 신장 캡슐의 손상은 신장 주위 출혈과 염증을 초래할 것입니다. 혈관 클램프는 요관과 상완 동맥에 영향을 미치지 않고 신장 동맥과 신장 정맥을 막는 신장 페디클에 놓아야합니다. 이 단계에서 중요한 것은 신장 힐럼14,16을 둘러싼 지방 조직의 신중한 해부입니다.
이 모델은 비용 및 시간 효율적입니다. 마우스 당 마취 소비량은 미리 희석된 케타민/자일라진 칵테일 (1:10 케타민, 1:50 크실라진, 식염수 ±중; 원액 농도, 100 mg/mL 둘 다)의 156.47 ± 37.88 μL (SD, n=17)이었다. 수술은 비교적 짧은 기간에 수행 할 수 있습니다. 마우스 당 총 수술 시간은 53 ± 5.23 분이었다 (평균 ± SD, n = 17). 숙련 된 인력을 통해 여러 수술을 동시에 수행 할 수 있습니다. 우리 그룹에서는 경험 많은 연구원 중 한 명이 클램프가 신장 소아에서 풀릴 때까지 수술을 수행했으며 두 번째 연구원은 상처 닫힘에서 마우스가 회복 될 때까지 수술을 수행했습니다. 이 접근 방식을 통해 우리는 하루에 많은 수의 수술을 수행 할 수있었습니다. 이 모델에서, 우리는 등쪽 접근법을 사용했는데, 이는 미드라인 접근법16과 비교하여 외상을 줄이고 복강으로부터의 유체 및 열 손실을 감소시켰다.
이전에 공개된 프로토콜은 마우스17,18,19에서 급성 신장 손상을 유도하기 위한 신장 페디클 클램핑 기술을 기술하였다. 그러나, 이들 연구에서, 15 내지 26 분의 허혈 시간을 갖는 일방적 IRI 이외에 대측성 신장절제술이 수행되었다. 이 프로토콜에서, 우리는 대측성 신장을 보존하면서 30 분 동안 일방적 허혈을 유도했습니다. 그 결과 생존율은 100%였다. 그러나, 이 모델은 외과적으로 개입된 대측성 신장에 의해 가해지는 보상 효과에 부분적으로 기인하는 아세트믹 신장 손상을 유도하기에 적합하지 않다. 그러나 동일한 동물에서 하나의 신장을 영향을받지 않게 유지하는 것은 더 높은 생존율로 더 긴 허혈 시간을 사용하는 이점을 제공합니다. 이 외에도 대측성 신장은 실험 절차 중에 적용된 시험 약물 또는 치료법의 가능한 부작용을 평가하고 신장 - 신장 누화 효과20,21을 연구하는 데 활용 될 수 있습니다. 예를 들어, 이 모델은 IRI 및 대측성, 비수술적으로 개입된 신장(11)에서 세포 수준 둘 다에서 반응성 산소 종-유도된 변화를 보여주는데 유용하다.
이 모델은 일방적 인 신장 손상, 신장 누화 효과, 신장 후 IRI 유도 혈역학 변화 및 신장 IRI에 사용되는 약물 후보의 잠재적 인 신 독성 효과의 마커를 확인하고 특성화하는 것을 목표로하는 연구에 잠재적 인 응용 프로그램을 가지고 있습니다. 주요 병리학 적 변화에 대한이 상세한 설명은 염증 및 괴사 (4 시간 ~ 2 일)에서 재생 (4 일) 및 섬유증 (7 일 이상)에 이르기까지 특정 세포 과정을 연구하기에 가장 적합한 시간을 선택하는 데 유용한 도구로 사용됩니다.
공개
저자는이 기사와 관련하여 이해 상충이 없다고 선언합니다.
감사의 말
이 기사에 표시된 작업의 일부는 Ross University School of Veterinary Medicine (RUSVM), Saint Kitts 및 Nevis의 통합 포유류 연구 센터에 의해 설립되었습니다. Long Island University College of Veterinary Medicine의 수의학 생물 의학과에서 제공하는 재정 지원은 크게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Atipamezole hydrochloride | Penn Veterinary Supply, Inc., PA, USA | PVS8700 | 5 mg/mL |
| Buprenorphine | Penn Veterinary Supply, Inc., PA, USA | PRMBURPEN22 | 0.3 mg/mL |
| Commercial euthanasia solution | various suppliers | na | e.g., Euthasol Virbac (sodium pentobarbital 390 mg/mL + sodium phenytoin 50 mg/mL) |
| Eye ointment Puralube | Dechra Veterinary Products, KS, USA | na | 3.5 g (1/8 oz) |
| Heating pad RightTempJr | Kent Scientific, CT, USA | RT-JR-20 | Consider the one with two temperature probes |
| Ketamine hydrochloride | Penn Veterinary Supply, Inc., PA, USA | VED1220 | 100 mg/ml |
| S&T Vascular clamp | Fine Science Tools, Inc., Germany | 00398-02 | Jaw dimensions: 5.5 x 1.5 mm; length: 11 mm |
| Sterile Disposable Towel Drapes | Kent Scientific, CT, USA | SURGI-5023-3 | Disposable, individualy packed |
| Surgical instruments (Graefe forceps, Halsted-Mosquito hemostat, scissors, etc) | Fine Science Tools, Inc., Germany | Various | Consider the extra fine straight scissor and the angled Graefe forceps |
| Vicryl suture | Ethicon US, LLC | J493G | Size 5-0 |
| Xylazine hydrochloride | Penn Veterinary Supply, Inc., PA, USA | VAM4821 | 100 mg/mL |
참고문헌
- Ray, S. C., Mason, J., O'Connor, P. M. Ischemic renal injury: can renal anatomy and associated vascular congestion explain why the medulla and not the cortex is where the trouble starts. Seminars in Nephrology. 39 (6), 520-529 (2019).
- Weight, S. C., Bell, P. R., Nicholson, M. L. Renal ischaemia--reperfusion injury. The British Journal of Surgery. 83 (2), 162-170 (1996).
- Ratliff, B. B., Abdulmahdi, W., Pawar, R., Wolin, M. S. Oxidant mechanisms in renal injury and disease. Antioxidants & Redox Signaling. 25 (3), 119-146 (2016).
- Schrier, R. W., Wang, W., Poole, B., Mitra, A. Acute renal failure: definitions, diagnosis, pathogenesis, and therapy. The Journal of Clinical Investigation. 114 (1), 5-14 (2004).
- Fernández, A. R., Sánchez-Tarjuelo, R., Cravedi, P., Ochando, J., López-Hoyos, M. Review: Ischemia reperfusion injury-a translational perspective in organ transplantation. International Journal of Molecular Sciences. 21 (22), 8549 (2020).
- Wu, C. -. L., et al. Tubular peroxiredoxin 3 as a predictor of renal recovery from acute tubular necrosis in patients with chronic kidney disease. Scientific Reports. 7 (1), 43589 (2017).
- Nishida, K., et al. Systemic and sustained thioredoxin analogue prevents acute kidney injury and its-associated distant organ damage in renal ischemia reperfusion injury mice. Scientific Reports. 10 (1), 20635 (2020).
- Mishra, J., et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury after cardiac surgery. Lancet. 365 (9466), 1231-1238 (2005).
- Han, W. K., Bailly, V., Abichandani, R., Thadhani, R., Bonventre, J. V. Kidney injury molecule-1 (KIM-1): A novel biomarker for human renal proximal tubule injury. Kidney International. 62 (1), 237-244 (2002).
- Coca, S. G. Kidney injury biomarkers with clinical utility: has Godot finally arrived. American Journal of Nephrology. 50 (5), 357-360 (2019).
- Godoy, J. R., et al. Segment-specific overexpression of redoxins after renal ischemia and reperfusion: protective roles of glutaredoxin 2, peroxiredoxin 3, and peroxiredoxin 6. Free Radical Biology & Medicine. 51 (2), 552-561 (2011).
- Wei, Q., Dong, Z. Mouse model of ischemic acute kidney injury: technical notes and tricks. American Journal of Physiology - Renal Physiology. 303 (11), 1487-1494 (2012).
- Gaut, J. P., Liapis, H. Acute kidney injury pathology and pathophysiology: a retrospective review. Clinical Kidney Journal. 14 (2), 526-536 (2021).
- Le Clef, N., Verhulst, A., D'Haese, P. C., Vervaet, B. A. Unilateral renal ischemia-reperfusion as a robust model for acute to chronic kidney injury in mice. PLoS One. 11 (3), 0152153 (2016).
- Pelkey, T. J., et al. Minimal physiologic temperature variations during renal ischemia alter functional and morphologic outcome. Journal of Vascular Surgery. 15 (4), 619-625 (1992).
- Kennedy, S. E., Erlich, J. H. Murine renal ischaemia-reperfusion injury. Nephrology. 13 (5), 390-396 (2008).
- Skrypnyk, N. I., Harris, R. C., de Caestecker, M. P. Ischemia-reperfusion model of acute kidney injury and post injury fibrosis in mice. Journal of Visualized Experiments: JoVE. (78), e50495 (2013).
- Hesketh, E. E., et al. Renal ischaemia reperfusion injury: a mouse model of injury and regeneration. Journal of Visualized Experiments: JoVE. (88), e51816 (2014).
- Wei, J., et al. New mouse model of chronic kidney disease transitioned from ischemic acute kidney injury. American Journal of Physiology. Renal Physiology. 317 (2), 286-295 (2019).
- Basile, D. P., Leonard, E. C., Tonade, D., Friedrich, J. L., Goenka, S. Distinct effects on long-term function of injured and contralateral kidneys following unilateral renal ischemia-reperfusion. American Journal of Physiology - Renal Physiology. 302 (5), 625-635 (2012).
- Polichnowski, A. J., et al. Pathophysiology of unilateral ischemia-reperfusion injury: importance of renal counterbalance and implications for the AKI-CKD transition. American Journal of Physiology. Renal Physiology. 318 (5), 1086-1099 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유