긴장성 구배와 미세 회로를 평가하기 위해 배아 닭 청각 뇌간 절단
요약
여기서 우리는 하나의 뇌간 조각 내에서 긴장성 특성과 발달 궤적을 조사하기 위해 닭 배아의 비관상 청각 뇌간 조각을 얻기 위한 프로토콜을 제시합니다. 이러한 슬라이스는 시상, 수평 및 수평/횡단면을 포함하며, 이는 전통적인 관상 섹션보다 개별 슬라이스 평면 내에서 더 큰 토노토픽 영역을 포함한다.
초록
닭 배아는 청각 뇌간을 연구하기 위해 널리 받아 들여지는 동물 모델로, 고도로 전문화 된 미세 회로와 신경 토폴로지로 구성되어 있습니다. 토노 토픽 축은 주둥이-내측 평면에서 고주파 소리의 분리 된 인코딩과 꼬리 측면 영역에서 저주파 인코딩을 허용합니다. 전통적으로, 배아 조직의 관상 뇌간 조각은 상대적인 개별 등주파 층의 연구를 허용합니다. 개별 등주파수 영역과 관련된 해부학 적 및 생리 학적 질문을 조사하기에 충분하지만, 더 큰 청각 뇌간 영역에서의 긴장 성 변이와 발달에 대한 연구는 다소 제한적입니다. 이 프로토콜은 하부 청각 뇌간에서 주파수 영역의 더 큰 구배를 포함하는 닭 배아의 뇌간 절단 기술을 보고합니다. 닭 청각 뇌간 조직에 대한 다양한 슬라이스 방법을 사용하면 하나의 뇌간 슬라이스 내에서 전기 생리 학적 및 해부학 적 실험이 가능하며, 여기서 더 큰 농도의 구배와 발달 궤적이 관상 동맥 절편보다 더 잘 보존됩니다. 다중 슬라이싱 기술을 통해 청각 뇌간 미세 회로의 다양한 해부학적, 생물물리학적 및 긴장성 특성에 대한 향상된 조사를 수행할 수 있습니다.
서문
닭 배아는 세포 생물학, 면역학, 병리학 및 발달 신경 생물학을 포함한 수많은 다양한 과학 분야에서 기본적인 생물학적 질문을 연구하는 귀중한 연구 모델입니다. 닭 청각 뇌간의 미세 회로는 청각 형태 및 생리학 측면에서 이해할 수있는 고도로 전문화 된 회로의 훌륭한 예입니다. 예를 들어, Rubel and Parks (1975)는 닭 핵 목장 세포 (NM)와 핵 층류 (NL)의 안압 방향 (즉, 주파수 구배)을 시상면에 대해 ~ 30 ° 배향 된 핵의 축을 가로 지르는 선형 함수로 처음 설명했습니다. NM과 NL의 개별 뉴런은 주둥이-내측 평면을 따라 꼬리 측면 영역으로 특성 주파수(CF)로 알려진 최상의 소리 주파수를 인코딩합니다. 고주파에 민감한 뉴런은 주둥이-내측 영역에 있고 저주파에 민감한 뉴런은 꼬리-측면으로 위치합니다. 따라서 청각 특성을 연구하기 위한 청각 뇌간 조직의 전통적인 해부 방법은 연속적인 관상 절편을 활용했습니다. 실제로, 닭 배아의 청각 미세 회로는 수십 년 동안 연속적인 꼬리에서 코로나 평면 뇌간 조각을 통해 긴장성 청각 기능의 신호 처리를 연구하기위한 모델 시스템으로 확립되었습니다 1,2,3,4,5,6.
그러나 NM과 NL의 긴장 조직은 위상 학적으로나 형태 학적으로 복잡합니다. 청각 신경 입력은 높은 CF 입력이 수지상 NM 세포의 체세포 둘레의 최소 1/4을 덮는 끝 전구와 같은 구조에서 종료되도록 분포됩니다. 반대로, 낮은 CF 입력은 엔드 전구와 같은 단자로 구성되지 않고 NM 뉴런의 수상 돌기에 여러 개의 부톤 시냅스로 구성됩니다. 중간 CF 입력은 끝 전구 및 부톤과 같은 시냅스 4,7,8,9,10,11,12로 종료됩니다. NL에서 고도로 고정 관념의 수지상 구배는 수지상 길이뿐만 아니라 수지상 폭에서도 분명합니다. 이 독특한 수지상 구배는 토노 토픽 축과 밀접하게 일치합니다. 수상 돌기는 길이가 11 배 증가하고 너비가 높은 CF에서 낮은 CF 뉴런으로 각각 5 배 증가합니다6. 관상 조각에서 이러한 핵의 복잡한 분포를 극복하기 위해 이 프로토콜은 시상면, 수평 및 수평/횡단면에서 해부 접근 방식을 설명합니다. 이러한 슬라이싱 기술은 개별 슬라이스 평면에서 최대 토픽 특성을 나타내는 청각 뇌간 조직의 예를 제공합니다.
프로토콜
모든 절차는 노스 웨스턴 대학 기관 동물 관리 및 사용위원회 (IACUC)의 승인을 받았으며 실험실 동물의 관리 및 사용에 대한 국립 보건원 지침에 따라 수행되었습니다. 뇌간 조직의 해부 및 준비를위한 프로토콜은 이전 프로토콜 5,13을 준수합니다.
1. 계란 취급
- IACUC 승인 지역 동물 공급 업체로부터 수정란 (갈 루스 갈 루스 도메 스티 쿠스)을 구입하십시오.
- 계란은 도착 즉시 14 ° C의 냉장고에 보관하고 5 일 이내에 배양하십시오.
참고: 배아 생존율은 1주일 후에 상당히 감소합니다. - 38 ± 1 ° C 및 ~ 50 % 습도에서 배양하기 전에 70 % 에탄올로 알을 살균하십시오.
2. 인공 뇌척수액(ACSF) 조성물 및 제제
- 10x ACSF 저장 용액을 만들기 위해 1 L의 18.2 MΩcm dH 2 O에 다음 화학 물질을 혼합합니다 : NaCl (염화나트륨) 130 mM, NaHCO3 (중탄산 나트륨) 26 mM, KCl (염화칼륨) 2.5 mM, NaH2PO4 (인산이 수소 나트륨) 1.25 mM, 덱 스트로스 (D- (+) - 포도당) 10 mM. 저장 용액을 냉장고에 보관하십시오.
- MgCl2(염화마그네슘) 1M과CaCl2(염화칼슘) 1M 용액을 18.2MΩcmdH2O에 별도로 준비하여 냉장고에 보관한다.
- 사용 직전에 10x ACSF를 1x로 희석하고 95 % O 2 / 5 % CO 2로 15-20 분 동안 지속적으로 거품을 내고 MgCl 2 및 CaCl 2를 첨가하십시오. ACSF 및 dACSF (ACSF 해부)를 제조하기 위해, 각각 Mg2+ 1 mM, Ca2+ 3 mM 및 Mg2+ 3 mM, Ca2+ 1 mM의 최종 농도로 조정한다.
- pH가 7.2-7.4이고 삼투압이 300에서 310mOsm/L 사이가 되도록 ACSF의 버블링 속도를 설정합니다.
참고: 버블링하는 동안 ACSF를 얼음 욕조에 두는 것은 낮은 용액 온도를 유지하는 데 도움이 되며, 이는 해부하는 동안 조직 구조적 무결성을 지원합니다.
3. 아가로스 (5 %) 블록 준비
- 100 mL의 dACSF에 5 g의 아가 로스를 섞는다. 100°C 수조 또는 전자레인지를 2-3분 동안 사용하고 아가로스가 완전히 녹고 버블링이 시작될 때까지 덩어리가 생기는 것을 방지하기 위해 30초마다 저어줍니다.
- 녹은 아가 로스를 빈 페트리 접시에 최대 5mm 두께로 붓고 실온에서 보관하십시오. 세팅 후, 파라필름을 사용하여 페트리 접시를 밀봉하고 4°C에서 보관한다.
- 날카로운 칼날로 아가 로스를 입방체 블록으로 자르고 해부시 사용하십시오.
4. 해부 프로토콜 및 청각 뇌간 분리
- 70 % 에틸 알코올 용액 스프레이를 사용하여 해부 영역을 청소하십시오.
- 지지 또는 각진 아가로스 블록을 비브라톰 트레이에 붙입니다.
- 원하는 나이의 알을 선택하십시오 (현재 프로토콜의 E20 및 E21). 1단계와 같이 위에 나열된 프로토콜에 따라 알을 처리하고 배양합니다.
- 계란을 밝은 빛(캔들링) 아래에 놓고 계란의 더 크거나 둥근 쪽에서 이 공간을 찾아 공기가 채워진 공간을 찾습니다.
- 계란을 실온에 적응시키고 공기가 채워진 공간 위에 껍질을 깨고 막 주머니를 노출시킵니다.
- 부리를 노출시키기 위해 주머니를 부드럽게 절개하십시오.
- 메스로 목과 머리를 계란에서 부드럽게 잡아 당깁니다.
- 날카로운 가위를 사용하여 머리를 빠르게 참수하십시오.
- 참수 후 얼음으로 식힌 dACSF로 머리를 청소하여 해부 패드에서 과도한 혈액을 제거하십시오.
- 얼음처럼 차가운 dACSF에서 머리를 단단히 잡고 연부 꼬리 절개를하십시오. 눈 뒤와 눈 사이의 절개를 시작하고 수확 된 목의 길이를 따르십시오.
알림: 어린 배아는 절개를하는 동안 압력이 덜 필요할 수 있습니다. - 두개골을 노출시키기 위해 피부를 분리하십시오.
- 눈 뒤의 두개골을 정중선에서 측면 방향으로 자릅니다. 두 반구 모두에 대해 이 작업을 수행합니다.
알림: 이 단계는 뇌 조직을 손상시키지 않고 부착된 뇌에서 두개골의 부분을 분리하는 데 도움이 됩니다5. - 두개골의 부분을 자릅니다. 칼날을 눈 뒤에 놓고 빠르게 자릅니다.
알림: 부착된 두개골을 깨끗하게 자르려면 노력이 필요할 수 있습니다. - 차가운 dACSF 접시에 머리를 담그십시오.
- 작은 가위를 사용하여 두개골의 꼬리 부위에 정중선에서 측면 절개를 하여 조직 손상을 일으키지 않고 두개골에서 뇌를 분리하려고 합니다.
- 뇌간과 소뇌를 부드럽게 노출시킵니다. 전체 두개골의 등쪽 영역을 수축시키고 뇌간을 조심스럽게 제거한 다음 가벼운 썰매가있는 미세한 붓으로 노출시킵니다. 구부러진 집게를 사용하여 조직과 혈관을 연결하는 뇌간을 청소하십시오. 8번째 뇌신경 영역에 특별한주의를 기울이고 양쪽에 짧은 길이의 손상되지 않은 신경 섬유를 남겨 두십시오.
- 꽃자루를 자르고 혈관을 조심스럽게 제거하여 뇌간을 소뇌에서 분리하십시오. 추가 혈관의 뇌간을 다듬습니다.
알림: 전체 절차가 탄수화물 산소 (95 % O 2 / 5 % CO2)로 지속적으로 버블 링 된 얼음 냉각 dACSF에서 수행되는지 확인하십시오.
5. 비브라톰 슬라이싱
알림: 다음 단계에서 조직의 뒷면은 입방체의 아가로스 조각으로 지지되어야 합니다.
- 비브라톰 블레이드를 수평축을 따라 놓고 슬라이스 트레이에 뇌간을 붙입니다. 쪽을 붙이고 주둥이-꼬리 축을 코로나 슬라이스의 수직으로 유지합니다.
- 시상 슬라이스의 경우 측면-내측 축을 수직으로 유지하십시오.
- 복부 쪽을 붙이고 수평 슬라이스를 위해 등쪽 - 복부 축을 수직으로 유지하십시오.
- 급성 각시상-수평면을 달성하려면 뇌간의 복부 쪽을 접착하여 45° 각도로 절단된 아가로스 블록의 빗변 표면에 복부-등쪽 축을 수직으로 유지합니다. 슬라이스 트레이를 향한 agarose 블록의 반대쪽 표면을 붙이고 주둥이-꼬리 축을 블레이드 가장자리와 평행하게 유지하십시오.
6. 깨지기 쉽거나 큰 뇌간 조직 취급
- 5단계에 대한 대안적인 접근 방식으로, 분리된 뇌간을 35mm x 10mm 페트리 접시의 ~40°C에서 4% 저융점(LMP) 아가로스에 담그십시오.
- 잠긴 뇌간에 아가로스를 부은 후 페트리 접시를 얼음 위에 올려 굳힙니다. 날카로운 면도날을 사용하여 뇌간이 내장 된 입방체 아가 로스 블록을 자릅니다.
- LMP 아가로스 블록을 쪽에 붙이고 뇌간의 주둥이-꼬리 축을 수직으로 유지합니다.
- NM 영역을 시각화 할 수있을 때까지 관상 슬라이스를 가져옵니다.
- 날카로운 칼날로 접착제에서 아가 로스 블록을 제거하십시오. 핵을 발견하려면 가는 바늘로 NM에 0.5μL의 염료(톨루이딘 블루 또는 오렌지 G)를 부드럽게 놓습니다.
- 이 블록을 시상 또는 수평 슬라이스용 슬라이스 트레이에 다시 장착하고 염색된 영역에 대해 핵을 식별합니다.
- 최상의 성능을 위해 비브라톰 슬라이싱 속도를 4 - 5(~30 ± 4mm/min), 진동 주파수를 85-87Hz, 슬라이싱 진폭을 4-6(~1 ± 0.2mm)으로 설정합니다.
- 뇌간 절편 후, 200-300 μm 순차적으로 수집된 슬라이스 챔버에 넣어 ACSF의 실온에서 1시간 동안 평형을 이루고, 95% O2/5%CO2(pH 7.2-7.4, 오스몰 농도 300-310 mOsm/L)의 혼합물로 연속적으로 버블링한다. 이러한 조건에서 슬라이스는 최대 5-6 시간까지 실행 가능합니다.
7. 전기 생리학 : 패치 클램프 절차
- 탄수화물 소화 ACSF의 연속 관류로 뇌간 슬라이스를 기록 챔버로 옮깁니다 ~ 1.5 ± 0.5 mL / 분.
- 팁 직경 1-2 μm의 마이크로피펫 풀러와 3-6 MΩ 범위의 저항으로 패치 피펫을 당깁니다.
- K-글루콘산염 기반 내부 용액으로 피펫을 채웁니다(전류 클램프 기록용).
- 슬라이스 내의 다양한 토픽 영역에서 뉴런 특성을 테스트하려면 슬라이스 평면의 양쪽 끝에 뉴런을 배치하고 기록 전극으로 접근합니다.
- 뉴런에 접근하는 동안 피펫 끝에서 양압을 유지하십시오.
- 들여쓰기가 뉴런에 시각화될 때까지 소마 쪽으로 이동합니다. 다음 두 단계를 빠르게 수행하십시오.
- 양의 기압을 방출하여 기가옴(1GΩ)을 밀봉합니다.
- 증폭기 설정을 전압 클램프 모드로 유지하고 피펫 오프셋을 제로 pA로 수정합니다. 씰 테스트(100Hz에서 10mV 테스트 펄스)를 실행합니다. 음의 공기압을 가하여 신경 막의 작은 패치를 파열시킵니다.
- 청각 뉴런의 활성 고유 특성을 테스트하려면 과분극 및 탈분극 체세포 전류 주입을 적용하십시오.
참고: 이 절차의 예는 보충 비디오 S1, S2 에서 시각화할 수 있습니다. 이 절차에 대한 자세한 내용은 비디오 범례에 나와 있습니다.
결과
여기에 표시된 모든 뇌간 조각은 뇌간 조직 (~ 200-300 μm)에서 획득되었으며 5x 대물 렌즈 및 미분 간섭 대비 (DIC) 광학을 사용하여 이미징되었습니다. 카메라를 해부 현미경에 장착하고 이미지 획득 소프트웨어가 있는 컴퓨터에 연결했습니다(재료 표 참조). 이 그림에 삽입된 위성(오른쪽 패널)은 60배 배율 수침 대물렌즈를 사용하여 이미지화되었습니다. 디지털 이미지를 얻는 동안 뇌간 조각의 모든 영역이 동일하게 확대되도록 주의를 기울였습니다. 사진은 최적의 밝기와 초점으로 촬영되었습니다. 뇌간 조각의 디지털 이미지는 겹치는 영역을 기반으로 평면 방식으로 스티칭되고 밝기, 대비 및 회색조를 추가로 조정하기 위해 데스크톱 컴퓨터로 가져왔습니다. 닭 청각 뇌간의 기본 미세 회로는 이전 작업 1,2,5,13에 따라 확인되었습니다. 현미경 (5x 대물 렌즈)에서 청각 핵은 슬라이스의 등쪽 영역을 따라 동측 및 반대측으로 각 핵 주위를 맴도는 심하게 수초화 된 신경 섬유에 인접한 영역으로 확인되었습니다.
그림 1은 E21 닭 배아에서 나온 뇌간 조직 (200-300 μm)의 전통적인 관상 절편을 보여줍니다. 여기에 표시된 4 개의 코로나 슬라이스는 가장 낮은 CF 청각 영역 (그림 1A, 꼬리 측면)에서 가장 높은 CF 청각 영역 (그림 1D, 주둥이-내측)으로 진행되는 청각 뇌간 핵의 상대적 등주파수 영역을 나타냅니다. 그림 1A-D의 4 개의 코로나 슬라이스 모두에 대해 표지 된 NM 및 NL의 확대 된 영역이 중간 열에 표시되고 그림 패널의 오른쪽 시야 (위성 삽입에서 각각 a 및 b)에 확대 (60x 대물렌즈)됩니다. 그림 1A, B의 화살표는 청각 신경 섬유의 입력을 보여주고 화살촉은 슬라이스 왼쪽의 NM 축삭의 분기를 보여줍니다. 그림 1C는 핵 각도 (NA, 왼쪽 화살표 및 오른쪽 화살표)로 알려진 또 다른 조류 달팽이관 핵 구조를 보여줍니다. 가장 두둥이 두 개의 관상 절편은 관상 절편의 복부 측면 영역을 따라 위치한 상 올리 바리 핵 (SON)을 보여줍니다 (그림 1C, D, 흰색 점선 원).
그림 2는 E21 닭 배아에서 나온 뇌간 조직 (200-300 μm)의 시상 부분을 보여줍니다. 세 개의 시상 슬라이스 모두(그림 2A-C)에 대해 레이블이 지정된 NM 및 NL의 확대된 영역이 중간 열에 표시되고 그림 패널의 오른쪽 시야(위성 이미지에서 각각 a 및 b)에 확대(60x 대물렌즈)됩니다. NM 및 NL은 청각 신경 섬유 (그림 2A, 가운데 화살표)가 더 높은 배율 (그림 2A, 중간, 작은, 흰색 점선 원 및 화살촉)에서 관찰 된 뉴런 클러스터에 들어간 곳을 확인하고 청각 영역의 시작점을 강조 표시합니다 (그림 2A, 왼쪽, 큰, 흰색 점선 원 및 화살촉). SON은 가장 측면 슬라이스의 로스트로 측면 영역에서 확인되었습니다 (그림 2A, 작은, 흰색, 점선 원). 그림 2B는 주둥이-꼬리 축을 따라 NM 및 NL에서 상대적으로 낮은 CF 및 높은 CF 청각 영역을 모두 포함하는 확장 된 긴장 영역을 보여줍니다 (흰색 윤곽선 영역, 위성 삽입 참조). 그림 2C는 가장 내측 슬라이스와 청각 영역의 끝점 (왼쪽 및 가운데 화살표)의 동측 및 반대쪽 축삭 술을 보여줍니다. 여기에 표시된 슬라이스의 방향은 그림 1에서 볼 수 있는 슬라이스의 전통적인 방향(즉, 코로나)과 대조됩니다. 이것은 전기생리학적 기록에 필요한 유리 피펫의 접근을 가장 잘 수용하는 배향을 표시하기 위해 수행되었습니다.
안압 축의 큰 영역이 도 2B에 표현되었음을 확인하기 위해, NM 뉴런으로부터 전류-클램프 전기생리학 기록을 수행하였다. 그림 3은 관상 절편(그림 3A,B)과 시상 절편(그림 3C,D, 보충 비디오 S1, S2)에서 기록된 성숙한(E21) NM 뉴런의 기능적 유사점과 차이점을 보여줍니다. 두 개의 NM 뉴런이 관상 슬라이스의 내측 및 측면 끝에서 선택되었고(그림 1B에 표시된 슬라이스와 유사), 두 개의 NM 뉴런이 시상 슬라이스의 NM의 및 꼬리 끝에서 선택되었습니다(그림 2B에 표시된 슬라이스에서와 같이). 그림 3A, B는 체세포 전류 주입과 유사한 전기 생리 학적 반응 특성을 보여줍니다 (-100 pA에서 + 200 pA, + 10 pA 증가, 100 ms 지속 시간). 이 두 NM 뉴런의 발사 패턴은 이 슬라이스 평면에서 미묘한 차이를 나타내며, 이는 중간 주파수 NM 뉴런에 대한 상대적인 등주파수 층을 나타냅니다. 그림 3C, D는 발사 패턴이 주둥이-꼬리 축에 걸쳐 실질적인 차이가 있음을 보여주며, 이는 저주파 NM 뉴런(그림 3C)에서 고주파 NM 뉴런(그림 3D)으로 상대적으로 더 높은 안압 구배를 나타냅니다. 두 뉴런 모두 이전에 보고된14,15와 같이 고정 관념적인 발사 패턴을 나타냈습니다.
그림 4는 E200 닭 배아의 뇌간 조직 (300-21 μm)의 수평 단면을 보여줍니다. 두 수평 슬라이스(그림 4A,B)의 경우 레이블이 지정된 NM 및 NL의 확대된 영역이 중간 열에 표시되고 그림 패널의 오른쪽 시야(위성 인셋에서 각각 a 및 b)에 확대(60x 대물렌즈)됩니다. 수평 슬라이스에서 NM과 NL은 정중선을 향해 확인되었고 뉴런은 측면-내측 축을 따라 퍼졌습니다(그림 4A, B, 중간, 흰색, 점선 윤곽 영역). 확대 된 이미지는 안압 구배의 넓은 범위를 보여줍니다. 저주파 뉴런은 꼬리 측면 영역에 있고 고주파 뉴런은 주둥이-내측 영역에 있습니다 (그림 4A, B, 오른쪽, 위성). 주둥이-꼬리 축을 따라 정중선을 통과하는 섬유는 청각 핵의 반대쪽 연결을 보여 주지만 이러한 섬유의 조직은 단순한 평면이 아닙니다. 그러나 수평 / 횡단면의 예리한 각진 슬라이스는 이러한 축삭 섬유를 따라 시상면을 향해 갈 수 있습니다. 수평면에서 예각(45°)에서 200-300μM 두께의 뇌간 조직 조각이 그림 5에 나와 있습니다. 청각 뇌간 핵은 가장 측면 슬라이스에서 시작하여 가장 내측 슬라이스에서 끝나는 큰 대각선 확산을 가로 질러 볼 수 있습니다 (그림 5A-C, 라벨이 붙은 중간 패널, 흰색 윤곽선 영역). 또한 NM 및 NL 영역의 각도 방향도 연속적인 비대칭 슬라이스로 시각화 할 수 있습니다 (그림 5A-C, 레이블 된 중간 패널, 흰색, 파선 윤곽선 영역). 확대 이미지(60x 대물렌즈)는 주둥이-내측에서 꼬리-측축으로 이동하는 청각 핵의 긴장 축을 보여줍니다(그림 5A-C, 오른쪽, 위성 삽입). 그림 5의 슬라이스 방향은 그림 2의 방향과 비슷합니다. 그들은 이미지의 전통적인 표현과 대조되지만 전기 생리 학적 실험에 더 적합합니다.
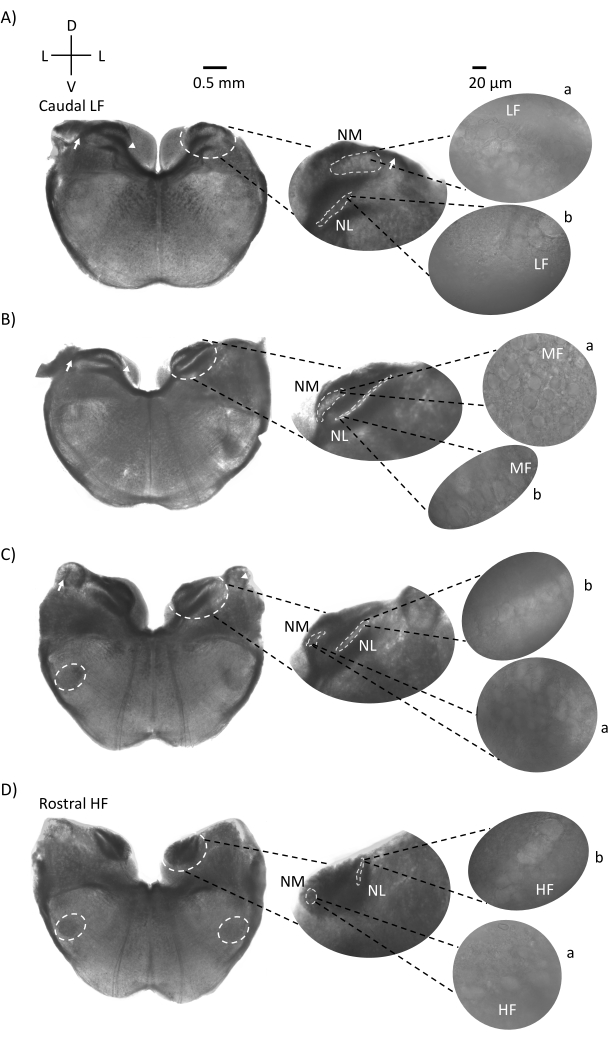
그림 1: 뇌간의 대표적인 관상 연속 섹션. (A-D) 왼쪽 : 꼬리에서 축까지의 슬라이스, 청각 핵 및 흰색 점선으로 표시된 연결 섬유. 중간 삽입물은 청각 영역의 더 큰 보기로, 핵은 흰색 점선 원 a: NM 및 b: NL 안에 표시됩니다. 화살표는 청각 신경 구 심성 섬유를 나타내고 화살촉은 A, B에서 NM 축삭 분기를 나타냅니다. 화살표는 C에서 NA를 보여줍니다. 측면 흰색 점선은 SON을 C, D로 표시합니다. 오른쪽: 위성 삽입물은 60x 대물렌즈에서 이러한 핵을 보여줍니다: a: NM 및 b: NL. 약어 : NM = 핵 마그노 셀룰라리스; NL = 핵 층류; NA = 각진 핵; SON = 우수한 올리 바리 핵; LF = 상대적으로 저주파 뉴런; MF = 중주파 뉴런; HF = 고주파 뉴런; D = 등쪽; L = 측면; V = 복부. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
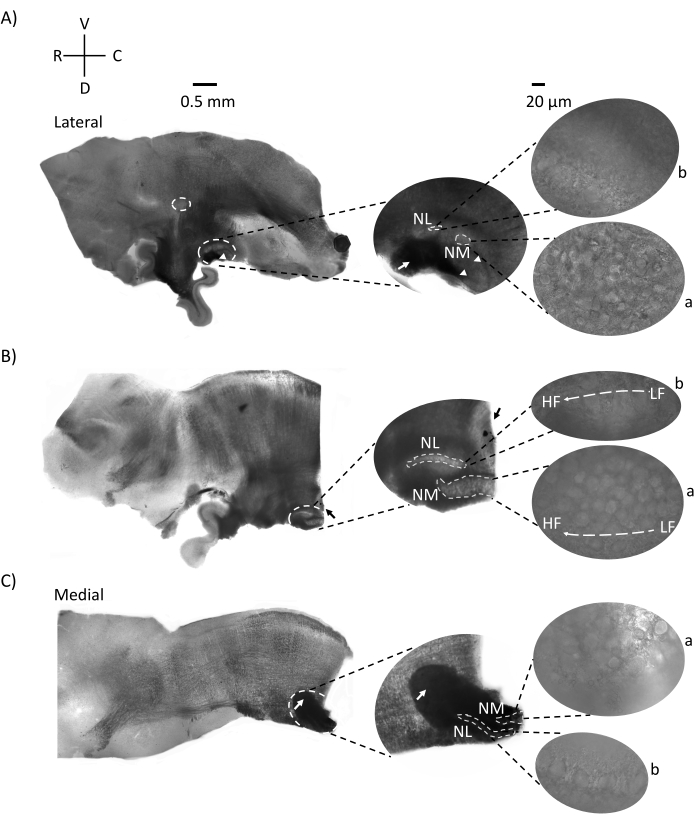
그림 2: 뇌간의 대표적인 시상 연속 부분. (A-C) 왼쪽: 흰색 점선 원으로 표시된 청각 핵이 있는 측면 축에서 내측 축으로의 슬라이스. 중간 삽입물은 흰색 점선 원 안에 표시된 동일한 청각 핵 영역을 더 크게 보여줍니다. (A) 슬라이스 중앙의 흰색 점선 원은 SON을 강조 표시합니다. 청각 신경 섬유를 보여주는 화살표와 NA를 나타내는 화살촉. 슬라이스의 오른쪽 끝에 있는 짙은 검은색 점은 이미징 아티팩트입니다. 소뇌의 영역은 왼쪽 패널의 슬라이스 A와 B 모두에서 청각 영역의 등쪽에서 볼 수 있습니다. (B) 방향이 관상 평면으로 변경된 시상 슬라이스 (슬라이스 중). 청각 영역은 파란색 염료 (검은 색 화살표)로 식별되고 시상면에서 다시 슬라이스되었습니다. (A-C) 중간 삽입 NM 및 NL 영역은 흰색 점선 아래에 표시됩니다. 오른쪽: 위성 보기는 a: NM 및 b: NL을 60배 대물 배율로 관찰한 것을 보여줍니다. 청각 핵의 LF 및 HF 긴장 구배는 로스트로 꼬리 축을 따라 표시됩니다. (C)의 어두운 영역을 가리키는 화살표는 내측 축을 통해 정중선을 가로질러 심하게 수초화된 NM 섬유를 보여줍니다. 섬유는 청각 핵의 양쪽을 연결합니다. 약어 : NM = 핵 마그노 셀룰라리스; NL = 핵 층류; NA = 각진 핵; SON = 우수한 올리 바리 핵; LF = 상대적으로 저주파 뉴런; HF = 고주파 뉴런; D = 등쪽; V = 복부; R = 주둥이; C = 꼬리. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
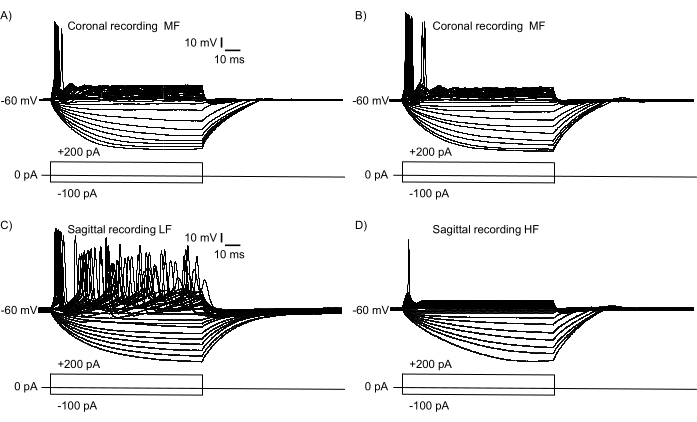
그림 3: 전류 클램프 모드에서 체세포 전류 주입(−100pA에서 +200pA, +10pA 증가, 100ms 기간)에 대한 뉴런 반응의 전기생리학적 기록. 뉴런은 동일한 슬라이스에서 기록하지만 NM의 극단적 인 반대 영역에서 기록하도록 선택되었습니다. (ᄀ,ᄂ) 단일 코로나 슬라이스의 대표적인 신경 반응은 미묘한 차이가 있는 상대적인 등주파수 특성을 나타냅니다. 반응 특성은 관상 슬라이스에서 NM의 가장 내측(A) 및 외측(B) 영역에서 기록된 두 개의 서로 다른 MF 뉴런을 나타냅니다. (씨,디) 단일 시상 슬라이스의 대표적인 신경 기록. 기록은 상대적으로 LF NM 반응 (C)과 HF NM 반응 (D)을 보여 주며, 단일 시상 섹션 내에서 긴장 구배의 실질적인 차이를 강조합니다. 약어 : NM = 핵 마그노 셀룰라리스; LF = 상대적으로 저주파 뉴런; MF = 중간 주파수 뉴런; HF = 고주파 뉴런. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
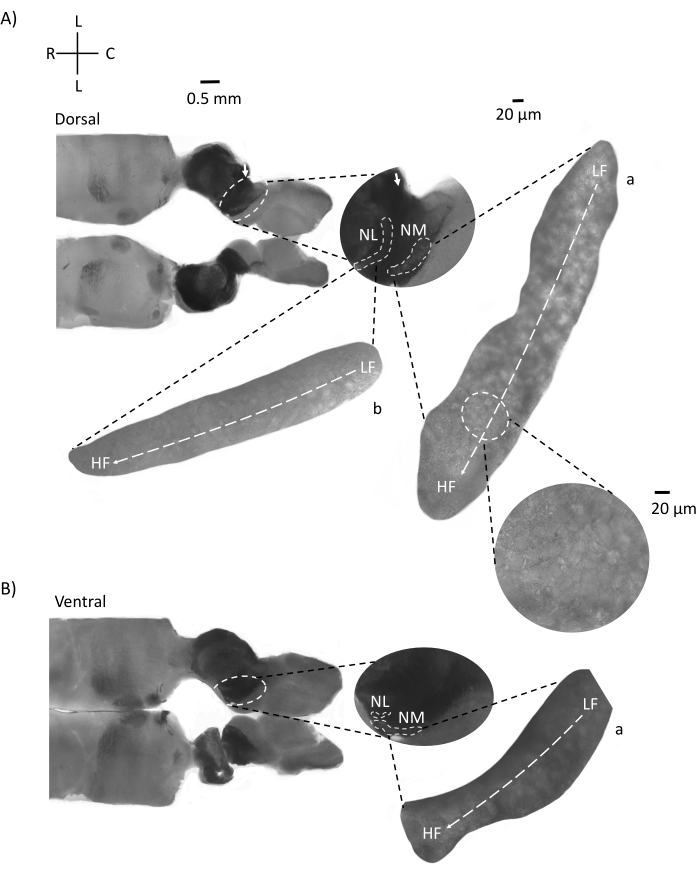
그림 4: 뇌간의 대표적인 수평 연속 섹션. (ᄀ,ᄂ) 왼쪽 : 등쪽에서 복부 축까지의 슬라이스, 청각 핵은 흰색 점선으로 표시됩니다. 8번째 뇌신경 구 심성 섬유는 화살표로 표시된 청각 핵을 연결합니다. 중간 삽입물은 흰색 점선 아래에 표시된 청각 핵 영역을 갖는 청각 핵 영역의 더 큰 보기이며 NM 및 NL 영역이 표시됩니다. 청각 핵의 명확한 토폴로지 운동은 A, B에서 볼 수 있습니다. (ᄀ,ᄂ) 오른쪽: a: NM 및 b: NL을 보여주는 대형 위성 보기. 오른쪽 삽입물은 60x 대물 배율로 관찰된 청각 핵과 꼬리 측면을 따라 LF에서 HF로 곡선 토폴로지 축을 따라 주둥이-내측 축을 보여줍니다. 약어 : NM = 핵 마그노 셀룰라리스; NL = 핵 층류; LF = 상대적으로 저주파 뉴런; HF = 고주파 뉴런; L = 측면; R = 주둥이; C = 꼬리. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
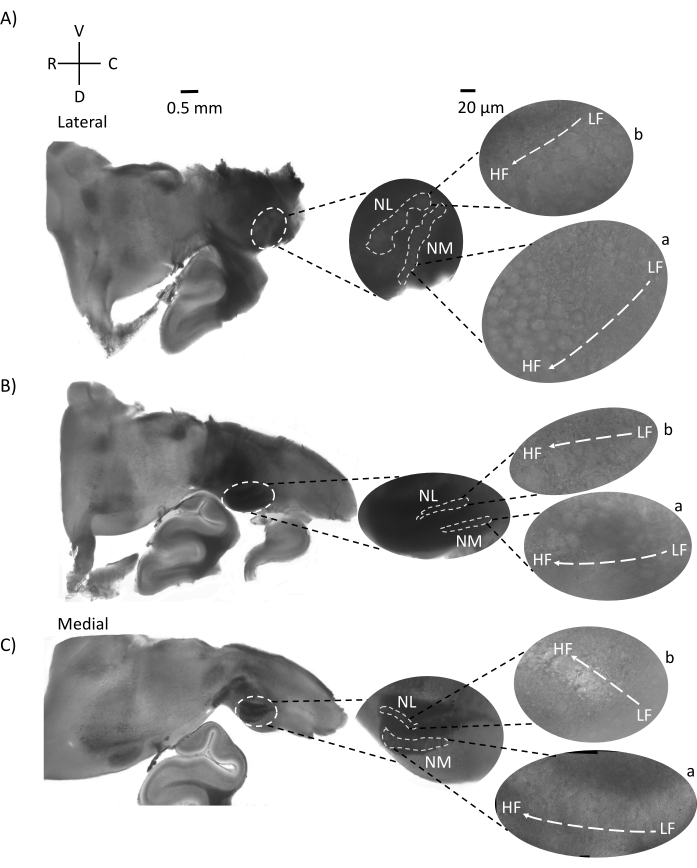
그림 5: 대표적인 수평/횡방향 예리각(45°) 연속 섹션. (A-C) 왼쪽: 뇌간의 연속 부분, 흰색 점선으로 표시된 청각 핵. 중간 인서트는 청각 영역의 더 큰 보기입니다. (A) 중간 삽입물은 이러한 절편에서 NM 및 NL 뉴런의 가장 큰 확산을 보여줍니다. (ᄃ,씨) 중간 삽입물: 흰색 점선으로 표시된 청각 핵은 (A-C)와 비교할 때 점진적인 토폴로지 변화를 보여줍니다. 오른쪽: 청각 핵 a: NM 및 b: NL을 60배 대물 배율로 보여주는 위성 삽입물. NM 및 NL의 LF에서 HF 영역으로의 안압 축은 측면에서 내측 슬라이스로 각진 방향으로 회전합니다. 약어 : NM = 핵 마그노 셀룰라리스; NL = 핵 층류; LF = 상대적으로 저주파 뉴런; HF = 고주파 뉴런; V = 복부; R = 주둥이; D = 등쪽; C = 꼬리. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 비디오 S1 : 과분극 및 탈분극 체세포 전류 주입. 저주파 및 고주파 뉴런에서 전류 클램프 모드에서 100ms 체세포 전류 주입까지의 응답 특성. 뉴런은 동일한 시상 뇌간 슬라이스로부터 선택되었다. 주입 범위는 -100에서 +200pA까지 +10pA 단위로 증가하며 시간 지속 시간은 100ms입니다. 활동 전위는 충분한 탈분극 전류 단계에 대한 응답으로 나타납니다. 비디오는 그림 3C에 표시된 최종 트레이스에 해당합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 비디오 S2 : 과분극 및 탈분극 체세포 전류 주입. 보충 비디오 S1과 유사하게 이 비디오는 전류 클램프 모드에서 저주파 및 고주파 뉴런에서 100ms 체세포 전류 주입까지의 응답 속성을 보여줍니다. 뉴런은 동일한 시상 뇌간 슬라이스로부터 선택되었다. 주입 범위는 -100에서 +200pA까지 +10pA 단위로 증가하며 시간 지속 시간은 100ms입니다. 활동 전위는 충분한 탈분극 전류 단계에 대한 응답으로 나타납니다. 비디오는 그림 3D에 표시된 최종 트레이스에 해당합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
닭 배아 뇌간 조직의 관상 동맥 절편은 수십 년 동안 상대적인 개별 등주파 층에 대한 연구를 허용했습니다 1,2,5. 그러나 닭 청각 뇌간의 안압 (즉, 빈도) 조직은 위상 학적으로 복잡하며 특정 연구 질문에 따라 다른 해부학 적 축에서 더 쉽게 접근 할 수 있습니다. 개별 등주파 영역과 관련된 해부학 적 및 생리 학적 질문을 조사하기에 충분하지만, 더 큰 청각 뇌간 영역에서의 긴장 성 변이와 발달에 대한 연구는 관상 절편에 의해 다소 제한됩니다. 이러한 한계를 극복하기 위해 이 프로토콜은 시상면, 수평 및 수평/횡단면의 접근 방식을 설명하여 개별 뇌간 섹션에서 최대 긴장성 특성과 기울기를 나타내는 청각 뇌간 조직의 추가 예를 제공합니다.
청각 뇌간 영역의 시상 절편은 관상 절편에 비해 슬라이스 내의 더 큰 영역에 걸쳐 서로 다른 안압 부위가 분포되어 있음을 보여줍니다 (시상 청각 영역 = ~ 300-600 μm, 관상 청각 영역 = ~ 200-350 μm). 예를 들어, NM 및 NL 영역은 시상 섹션 (예 : 그림 2B)에서 로스트로-꼬리 축을 따라 더 큰 영역에 걸쳐 시각화되었으며,이 해부학 적 축을 따라 실행되는 기능적 안압 구배는 주로 단일 시상 슬라이스 내에 포함되었습니다. 이것은 이전에 보고된바와 같이 주둥이-꼬리 구배를 따라 변하는 고유 뉴런 차이의 전류 클램프 기록으로 추가로 확인되었습니다(예: 그림 3C,D). 토노 토픽 축을 따라 해부학 적 및 면역 조직 화학적 특성을 강조하는 향후 실험은 단일 시상 슬라이스 평면 내에서 청각 특성의 알려진 구배를 추가로 조사 할 수 있습니다. 여기에는 MAP2 염색 및 칼륨 채널 발현 패턴이 포함되지만 이에 국한되지는 않으며, 이는 이전에 연속적인 관상 동맥 섹션16에서 보여진 수지상 아키텍처 및 NM 및 NL의 고유 특성의 알려진 구배입니다.
청각 뇌간 영역의 수평 섹션은 NM과 NL이 정중선을 향해 위치한다는 것을 보여줍니다. 청각 축삭 섬유의 일부는 수평면에 대각선 또는 수직으로 움직입니다 (그림 4). 이 섬유는 시상면에 대해 45 °의 예리한 각진 슬라이스를 만들어 따라갈 수 있습니다. 그 결과 수평 / 횡단 슬라이스는 시상 또는 수평 슬라이스보다 컸으며, 긴 축삭 섬유는 동측 및 반대측 모두에 대해 로스트로 꼬리 축을 통과했습니다. NM과 NL은 모두 더 큰 대각선 영역(~400-700μm)에서 시각화할 수 있으므로 반대쪽 연결을 측면-내측 축을 따라 시각화할 수 있습니다. 또한 수평/가로 슬라이스 평면은 청각 영역과 결과 안압 그라데이션이 각도 회전을 만드는 방법도 보여줍니다(그림 5). 더 넓은 영역에서 반대쪽 연결의 각도 노출은 이러한 슬라이스를 기존의 코로나 슬라이스보다 전기 생리 학적 자극 및 미세 회로 연구에 더 적합하게 만듭니다.
추가 이점
청각 미세 회로의 형성은 신경 세포 생존, 시냅스 형성, 축삭 분화, 수지상 구조 및 성숙을 촉진하는 단서의 시공간 조정을 필요로합니다. 따라서, 닭 배아 청각 미세 회로의 대안적인 뇌간 섹션은 다음과 같은 연구 주제에 사용될 수있다 : 지형적으로 다른 차원에서 뉴런의 형태 학적 조직; 모든 청각 및 전정 핵의 커넥톰을 조직하고 매핑하는 것; iso-frequency 및 tonotopic 평면에서 회로 구성 요소의 활동 패턴의 식별 및 특성화; 흥분성 대 억제 성 미세 회로의 지형 조직 및 특수 뉴런 집단 (핵)과의 관계; 청각 핵 뉴런의 공간적 위치 및 그의 예측 CF17; 특정 토노 토픽 신경 유형의 체계적인 표적화; 전구 세포 및 보존 된 핵으로의 발달 추적; 신경 회로의 진화에 대한 세포의 유전 적 계통18; 종 간 비교 뇌간 해부학; Deiter의 전정 복합체 (DC)와 같은 전정 회로 조사19; 그리고 전정 핵 사이의 동시성과 교차 대화.
다른 슬라이스 평면을 사용하는 다각적 인 접근 방식은 뇌간 미세 회로의 알려지지 않은 해부학 적 및 생물 물리학 적 특성에 대한 근본적인 질문에 답하는 데 도움이 될 수 있습니다. 좋은 예는 주요 청각 핵 (NM, NA, NL 및 SON)과 외측 렘니스 커스의 등쪽 핵 (LLDp), 반월 핵 (SLu) 20 및 접선 핵 (TN)3을 포함한 전정 핵 사이의 관계입니다. 그러나 이 프로토콜과 이러한 슬라이스 기반 연구에는 몇 가지 제한 사항이 있습니다.
주의 사항 및 제한 사항
실험을 수행하는 기관에 따라 윤리적 지침과 닭 배아의 취급이 다를 수 있습니다. 실험 동물의 관리 및 사용에 대한 국립 보건원 지침은 신속한 참수를 허용하지만 닭 배아 안락사에 대한 대체 방법이 있습니다21. 초기에 발달하는 닭 배아 뇌간 조직은 오래된 배아에 비해 부드럽고 섬세합니다. 표면에 여러 개의 연결부와 혈관이있어 제거 할 때 특별한주의가 필요합니다. 조직은 얼음처럼 차가운 dACSF에 보관하고 생존력을 높이기 위해 95 % O 2 / 5 % CO2로 관류해야합니다.
시상 슬라이싱 방법은 동측 안압에만 유용합니다. 이 슬라이싱 방법은 코로나 슬라이스보다 더 큰 슬라이스를 제공하며, 그 처리는 불안정할 수 있습니다. 그러나, 다른 곳에서 상세히 설명된 교차 바늘 방법을 사용하여 슬라이스를 트리밍할 수 있다(22). 4 % LMP 아가 로스 블록 내장 뇌간을 사용하면 섬세한 구조를 조각으로 저장할 수 있지만 지나치게 뜨거운 아가 로스를 붓지 않도록주의해야합니다. 아가로오스 차단 뇌간을 냉장된 환경에 ~1분 동안 배치하여 빠르게 설정하면 슬라이스가 전기생리학적 기록에 더 실용적입니다.
과량의 슈퍼 접착제를 사용하면 독성이있을 수 있습니다. 최소한으로 적용해야하며 잉여량은 dACSF를 교체하여 즉시 세척해야합니다. 예각 (45 °) 슬라이스의 경우 아가 로스 블록의 각도를 절단하는 것이 중요합니다. 거울을 사용하여 날카로운 칼날로 아가 로스 블록을 자르면서 정면을 볼 수 있습니다. 시중에서 판매되는 블레이드에는 알코올로 닦아내고 사용하기 전에 건조해야 하는 왁스 코팅이 있을 수 있습니다. 축삭 섬유 술은 피질 또는 매트릭스 조직보다 단단하기 때문에 비브라톰 절단 속도와 빈도에 대한 최적화가 필요합니다. 높은 진폭을 유지하고 냉장 해부 용액을 사용하면 조직 손상을 예방할 수 있습니다.
모든 용액은 신선하게 준비되어야하며,Ca 2+ 및 Mg 2+ 는 95 % O 2 / 5 % CO2 를 버블 링 한 후 ACSF에 첨가되어야한다. 그렇지 않으면Ca2+의 침전이있을 수 있습니다. 비브라톰 내에서 슬라이스를 부드럽게 다루려면 붓을 사용해야 합니다. 가능하면 총 슬라이싱 시간을 15분 미만으로 유지하십시오. 유리 파스퇴르 피펫은 뇌간 조각을 조작하는 데 사용할 수 있습니다.
전기 생리학에 사용되는 조각과 접촉하는 유리 제품 및 장비에 세제 또는 부식성 세척제를 사용하지 마십시오. 촬영된 이미지는 미분 간섭 대비(DIC) 광학에서 200-300μM 두께의 조직 모양을 나타냅니다. 시각적 품질은 면역 조직 화학 또는 전자 현미경보다 좋지 않지만 전기 생리 학적 기록을 수행 할 때 실험자가 보게 될 것을 정확하게 반영합니다.
등-복부, 주둥이-꼬리 또는 동측-반대측이든 대체 해부학적 축을 따라 미세 회로의 초기 발달과 관련된 연구는 닭 청각 뇌간에서 제한됩니다. 그 이유 중 하나는 뇌간에서 전사 코드의 역할과 긴장성 발달 조절이 아직 완전히 이해되지 않았기 때문입니다. 하향식 변조 및 자발적인 활동과 같은 기능적 현상은 시험관 내에서 활동을 관찰 할 때 종종 손실됩니다. 그러나 생체 내 연구는 이러한 슬라이스 조건에서만 가능한 특이적이고 직접적인 단일 뉴런 기록으로 보완됩니다. 다른 방향을 따라 뇌간 조직을 얻는 개선은 닭 청각 뇌간 미세 회로에서 긴장성 구배의 발달과 복잡성에 대한 통찰력있는 정보를 제공 할 수 있습니다.
공개
모든 저자는 연구가 상업적 또는 재정적 이익없이 수행되었으며 이해 상충이 없음을 선언합니다.
감사의 말
이 작업은 NIH/NIDCD R01 DC017167 보조금의 지원을 받습니다. 이전 버전의 원고에 대한 편집 의견을 제공한 Kristine McLellan에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Adobe photoshop 2021 | Adobe | ||
| Anti-vibration table 30"x 36" - OTMC - 63533 | TMC | ||
| Cell sens standard software | OLYMPUS | ||
| Digidata 1440A | MOLECULAR DEVICES | ||
| Digital amplifier multiclamp 700B | MOLECULAR DEVICES | ||
| DSK line-up linearslicer pro7 | TED PELLA, INC | ||
| Micromanipulator MPC-385 / OSI-MPC-385-2 | OLYMPUS AMERICA INC | ||
| Micropipette puller P-97 | SUTTER INSTRUMENTS | ||
| Microscope BX51W1 | OLYMPUS AMERICA INC | ||
| MS ICE software | Microsoft Corporation | ||
| Ohaus balance model AV212 | Ohaus Adventurer | ||
| Olympus DPSI0 /DPS80 camera | OLYMPUS | ||
| pClamp and Axoclamp data Acquisition Softwares | MOLECULAR DEVICES | ||
| pH meter lab 850 benchtop | SCHOTT INSTRUMENTS | ||
| Sharp stainless blade | Dorco/Personna | ||
| Vapor pressure osmometer model 5600 | WESCOR INC | ||
| Water purification systems Smart2pure 6UV/UF | Thermo Scientific | ||
| Chemicals- list | |||
| Agrose Low melt IB70051 | IBI SCIENTIFIC | ||
| CaCl2 (Calcium Chloride) | ACROS organics | ||
| Cynergy instant adhesive CA6001 | Resinlab | ||
| Dextrose (D-(+)-glucose) | VWR Life Science | ||
| Ethyl alcohol | IBI SCIENTIFIC | ||
| KCl (Potassium Chloride) | Amresco.Inc | ||
| MgCl2 (Magnesium Chloride) | Sigma-Aldrich | ||
| NaCl (Sodium Chloride) | Amresco.Inc | ||
| NaH2PO4 (Sodium Dihydrogen Phosphate) | Amresco.Inc | ||
| NaHCO3 (Sodium Bicarbonate) | Amresco.Inc |
참고문헌
- Rubel, E. W., Parks, T. N. Organization and development of brain stem auditory nuclei of the chicken: tonotopic organization of n. magnocellularis and n. laminaris. Journal of Comparative Neurology. 164 (4), 411-433 (1975).
- Rubel, E. W., et al. Organization and development of brain stem auditory nuclei of the chicken: ontogeny of n. magnocellularis and n. laminaris. Journal of Comparative Neurology. 166 (4), 469-489 (1976).
- Shao, M., et al. Spontaneous synaptic activity in chick vestibular nucleus neurons during the perinatal period. Neuroscience. 127 (1), 81-90 (2004).
- Fukui, I., Ohmori, H. Tonotopic gradients of membrane and synaptic properties for neurons of the chicken nucleus magnocellularis. Journal of Neuroscience. 24 (34), 7514-7523 (2004).
- Sanchez, J. T., Seidl, A. H., Rubel, E. W., Barria, A. Preparation and culture of chicken auditory brainstem slices. Journal of Visualized Experiments. (49), e2527 (2011).
- Sanchez, J. T., Lu, Y., Fay, R. R., Popper, A. N., Cramer, K., Coffin, A. Glutamate signaling in the auditory brainstem. Auditory Development and Plasticity: Springer Handbook of Auditory Research. 64 (4), 75-108 (2017).
- Parks, T. N. Morphology of axosomatic endings in an avian cochlear nucleus: nucleus magnocellularis of the chicken. Journal of Comparative Neurology. 203 (3), 425-440 (1981).
- Jhaveri, S., Morest, D. K. Sequential alterations of neuronal architecture in nucleus magnocellularis of the developing chicken: a Golgi study. Neuroscience. 7 (4), 837-853 (1982).
- Carr, C. E., Boudreau, R. E. Central projections of auditory nerve fibers in the barn owl. Journal of Comparative Neurology. 314 (2), 306-318 (1991).
- Köppl, C. Auditory nerve terminals in the cochlear nucleus magnocellularis: differences between low and high frequencies. Journal of Comparative Neurology. 339 (3), 438-446 (1994).
- Fukui, I., et al. Improvement of phase information at low sound frequency in nucleus magnocellularis of the chicken. Journal of Neurophysiology. 96 (2), 633-641 (2006).
- Wang, X., et al. Postsynaptic FMRP regulates synaptogenesis in vivo in the developing cochlear nucleus. Journal of Neuroscience. 38 (29), 6445-6460 (2018).
- Lu, T., Cohen, A. L., Sanchez, J. T. In ovo electroporation in the chicken auditory brainstem. Journal of Visualized Experiments. (124), e55628 (2017).
- Hong, H., Sanchez, J. T. Need for speed and precision: structural and functional specialization in the cochlear nucleus of the avian auditory system. Journal of Experimental Neuroscience. (12), 1-16 (2018).
- Hong, H., et al. Diverse intrinsic properties shape functional phenotype of low-frequency neurons in the auditory brainstem. Frontiers in Cellular Neuroscience. 12, 1-24 (2018).
- Wang, X., Hong, H., Brown, D. H., Sanchez, J. T., Wang, Y. Distinct neural properties in the low-frequency region of the chicken cochlear nucleus magnocellularis. eNeuro. 4 (2), 1-26 (2017).
- Tabor, K. M., et al. Tonotopic organization of the superior olivary nucleus in the chicken auditory brainstem. Journal of Comparative Neurology. 520 (7), 1493-1508 (2012).
- Lipovsek, M., Wingate, R. J. Conserved and divergent development of brainstem vestibular and auditory nuclei. Elife. 7, 40232 (2018).
- Passetto, M. F., et al. Morphometric analysis of the AMPA-type neurons in the Deiter's vestibular complex of the chick brain. Journal of Chemical Neuroanatomy. 35 (4), 334-345 (2008).
- Curry, R. J., Lu, Y. Intrinsic properties of avian interaural level difference sound localizing neurons. Brain Research. 1752, 147258 (2021).
- Aleksandrowicz, E., Herr, I. Ethical euthanasia and short-term anesthesia of the chick embryo. ALTEX - Alternatives to Animal Experimentation. 32 (2), 143-147 (2015).
- Palkovits, M. Isolated removal of hypothalamic or other brain nuclei of the rat. Brain Research. 14 (59), 449-450 (1973).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유