Perfusione Pancreatica Ex Vivo Normothermic per la Conservazione degli Allotrapianti Pancreatici prima del Trapianto
In questo articolo
Riepilogo
La perfusione macchina ex vivo normomica (NEVP) è stata scarsamente esplorata per la conservazione degli allotrapianti pancreatici. Presentiamo una tecnica di conservazione innovativa per gli allotrapianti del pancreas prima del trapianto.
Abstract
Il trapianto di pancreas (PTx) è un trattamento curativo per le persone che vivono con il peso di una diagnosi di diabete mellito (DM). Tuttavia, a causa della carenza di organi e del crescente numero di pazienti elencati per PTx, sono necessarie nuove strategie per aumentare il numero di innesti disponibili per il trapianto.
La conservazione a freddo statica (SCS) è considerata il gold standard per gli organi a criteri standard. Tuttavia, i donatori con criteri standard (SCD) stanno diventando scarsi e sono urgentemente necessarie nuove strategie che possano aumentare il tasso di accettazione di organi da donatori a criteri estesi (ECD).
La perfusione normemica ex vivo (NEVP) è una delle strategie che è diventata sempre più popolare negli ultimi due decenni. Questo metodo di conservazione è già stato utilizzato con successo in altri organi (fegato, reni e polmoni), ma è stato minimamente esplorato nel trapianto di pancreas. I pochi articoli che descrivono il metodo per il pancreas mostrano scarso successo, l'edema è uno dei problemi principali. Il seguente manoscritto descrive il metodo NEVP di successo e la configurazione sviluppata dal nostro gruppo per perfondere il pancreas suino.
Introduzione
Secondo il National Diabetes Statistics Report, un totale di 28,7 milioni di persone negli Stati Uniti vivevano con una diagnosi di diabete nel 2019. Circa 1,8 milioni di questi avevano una diagnosi di diabete di tipo 11. PTx è attualmente il trattamento più efficace e unico curativo per il diabete mellito di tipo 1 complicato2 ed è una procedura che aumenta sia l'aspettativa di vita che la qualità della vita di questi pazienti3.
Il pancreas è l'organo più spesso scartato dopo il prelievo da donatori deceduti4. Con la continua carenza di organi e l'aumento dei tempi delle liste d'attesa, i centri di trapianto utilizzano più innesti di pancreas da ECD, compresa la donazione dopo la morte circolatoria (DCD)5. Sono necessarie strategie per conservare, perfondere, valutare e riparare in modo sicuro gli allotrapianti provenienti da donatori con criteri estesi.
NEVP ha dimostrato di avere successo nella conservazione del polmone6, fegato7,8 e innesti renali 9,10. Tuttavia, il numero di gruppi che lavorano sulla perfusione della macchina per il pancreas, sia ipotermica che normotermica, e il numero di pubblicazioni, sono pochi e limitati a causa dell'edema e della lesione del trapianto11,12,13,14.
L'obiettivo di questo studio è quello di presentare un protocollo per la perfusione normotermica ex vivo del pancreas (NEVPP), utilizzando un modello suino con l'obiettivo di fornire una piattaforma per la conservazione prolungata, la valutazione degli organi e la riparazione prima del trapianto. Ciò consentirà ad altri gruppi di ricerca di stabilire un modello di perfusione per lo studio degli allotrapianti pancreatici.
Protocollo
Tutti gli animali utilizzati per questo studio hanno ricevuto cure umane in conformità con i "Principi di cura degli animali da laboratorio" formulati dalla National Society for Medical Research e la "Guida per la cura degli animali da laboratorio" pubblicata dal National Institutes of Health, Ontario, Canada. Tutti gli studi sono stati approvati dall'Animal Care Committee del Toronto General Research Institute.
NOTA: Questo protocollo di studio si basa su un modello suino. L'innesto viene conservato al freddo per 2 ore e poi subisce la perfusione normotermica della macchina per 3 ore prima del trapianto (Figura 1).
1. Animali
- Utilizzare maiali maschi dello Yorkshire (40-50 kg).
2. Approvvigionamento di organi
NOTA: La procedura preoperatoria e parte della procedura chirurgica sono le stesse dei precedenti articoli pubblicati dal nostro gruppo15 ed è la seguente:
- Ospitare i maiali nella struttura di ricerca per un minimo di 7 giorni per consentire l'acclimatazione e ridurre il loro livello di stress.
- Digiunare i maiali per un minimo di 6 ore prima dell'induzione dell'anestesia.
- Sedare il maiale con un'iniezione intramuscolare (IM) di midazolam (0,15 mg/kg), ketamina (25 mg/kg) e atropina (0,04 mg/kg).
NOTA: Questo viene fatto nella struttura abitativa. - Trasferire l'animale dalla struttura di stabulazione alla sala operatoria (OR), dove verrà eseguito il recupero dell'organo.
- Posizionare il maiale in posizione supina sul tavolo operatorio e posizionare una maschera facciale con 2 L di ossigeno e il 5% di isoflurano fino a quando la mascella non è rilassata.
- Visualizza le corde vocali usando laringoscopio e spruzzale con lidocaina al 2% per prevenire lo spasmo durante l'intubazione. Sostituire la maschera con ossigeno e isoflurano per almeno 30 s prima di tentare l'intubazione.
- Introdurre un tubo endotracheale da 7 mm e bloccare il bracciale con 5 ml di aria. Utilizzare la capnometria per assicurarsi che il tubo sia nella posizione corretta.
- Diminuire il gas isoflurano al 2,5%. Accendere il ventilatore e impostarlo a 15-20 respiri / min e il volume corrente a 10-15 ml / kg di peso corporeo. Monitorare costantemente la frequenza cardiaca e la saturazione di ossigeno.
- Utilizzando la tecnica Seldinger16, introdurre un catetere da 8,5 Fr. x 10 cm nella vena giugulare (destra o sinistra).
- Utilizzare il catetere della vena giugulare per iniziare un'infusione di fentanil (2,5 ml in 500 ml di Ringer) a 250 ml / ora.
- Controllare i riflessi muscolari per determinare la profondità dell'anestesia. Il tono della mascella è il riflesso muscolare più affidabile 17.
NOTA: Se si nota la rigidità dei muscoli mandibolari, aumentare l'infusione di isoflurano e/o fentanil.
3. Procedura chirurgica
- Disinfettare e coprire il campo chirurgico. Eseguire un'incisione della linea mediana dallo xyphoid alla sinfisi pubica. Estendere il campo chirurgico con un'incisione laterale sinistra per una migliore esposizione.
- Sezionare la vena cava inferiore (IVC) dall'aorta addominale. Liberare ulteriormente l'aorta dal tessuto circostante e ligare i piccoli rami aortici lombari. Identificare e posizionare le legature intorno a entrambe le arterie renali.
NOTA: le legature non devono essere legate in questo momento. - Una volta che la parte posteriore dell'aorta è libera, passare due legature intorno ad essa. La legatura inferiore sarà infine legata appena sopra la biforcazione dell'arteria iliaca e la legatura superiore sarà legata 5 cm sopra la cravatta precedente.
- Sezionare l'ilo epatico. Legare tutte le arterie il più vicino possibile al fegato. Identificare il dotto biliare comune, posizionare due legature vicino al fegato e dividere la struttura.
- Sezionare intorno all'aorta ma non tagliare in questo momento. Identificare e sezionare intorno alla porzione sopraepatica dell'aorta e posizionare un legame intorno ad esso.
NOTA: le legature non devono essere legate in questo momento. - Aprire la sacca minore per consentire al ghiaccio di raffreddare il pancreas. Mobilitare il pancreas il meno possibile prima di sciacquare.
- Somministrare 500 UI di eparina per kg di peso del donatore attraverso la linea centrale. Attendere 5 minuti e iniziare la raccolta del sangue in sacche di citrato, fosfato, destrosio, soluzione salina, adenina, glucosio e mannitolo (CPD / SAG-M) utilizzando il catetere giugulare.
- Legare la legatura aortica inferiore, cannulare l'aorta con una linea di filo sopra la fascetta di biforcazione iliaca e fissare la cannula con una cravatta superiore. Ligare entrambe le arterie renali.
- Legare l'aorta sopraepatica (morsetto incrociato) una volta che è stato raccolto abbastanza sangue (600 ml). Somministrare 10 ml di cloruro di potassio per il sacrificio.
- Avviare un flusso con la soluzione di conservazione dell'Università del Wisconsin (UW). Tagliare un'apertura nella vena porta (il più in alto possibile) e cava per lo sfogo. Metti il ghiaccio nella cavità addominale.
- Valutare la coda del pancreas e l'ansa C del duodeno dopo aver lavato 1 L di soluzione UW. Se adeguato lavare, iniziare la dissezione, identificare e bloccare i vasi mesenterici. Rallentare il lavaggio per il secondo litro di UW.
- Recuperare l'innesto pancreatico e un segmento di cava o vena iliaca per l'estensione della vena porta.
NOTA: L'innesto pancreatico viene rimosso con la milza. - Posizionare l'organo all'interno di una borsa d'organo che viene posta all'interno di una bacinella piena di ghiaccio.
4. Preparazione del tavolo posteriore dell'innesto pancreatico (Figura 2A)
- Rimuovere la linea di lavaggio dalla parte distale dell'aorta e chiudere con una cravatta. Riempire la sacca dell'organo con la soluzione UW rimanente. Liberare il pancreas dal tessuto aderente, compresa la milza.
- Eseguire l'estensione della vena porta utilizzando cava o vena iliaca precedentemente recuperata con 6-0 Prolene. Cannulare la vena porta e l'aorta prossimale con un riduttore di 1/4 in x 3/8.
- Cannulare la parte distale del duodeno con catetere e cravatta Malecot. Bloccare l'estremità del catetere per evitare la fuoriuscita di contenuto duodenale. Ha supervisionato i vasi mesenterici con 4-0 Prolene.
- Registrare il peso dell'innesto. Conservare l'innesto in celle frigorifere statiche (SCS) fino all'inizio del NEVPP.
5. Perfusione cerebrale ex vivo del pancreas (NEVPP)
NOTA: Il circuito di perfusione è costituito da apparecchiature di bypass cardiopolmonare neonatale (Figura 3).
- Collegare il tubo corrispondente all'ossigenatore e al serbatoio venoso, nonché la linea arteriosa al deflusso dell'ossigenatore e posizionare il filtro a bolle nel suo supporto. Collegare la linea di spurgo che va dal filtro a bolle al serbatoio venoso. Aprire il tappo del filtro a bolle per far uscire tutta l'aria.
- Collegare la linea venosa all'ingresso del serbatoio venoso. Collegare il filtro di dialisi e il tubo dove verrà infuso il dializzato. Collegare il sensore del flussometro, le linee di pressione e la sonda di temperatura. Collegare le linee di campionamento arteriose e venose alle porte del campione.
- Posizionare la camera del pancreas (Figura 3) su un tavolo Mayo e introdurre il tubo arterioso e venoso attraverso i fori destinati a questo scopo. Collegare e accendere l'unità riscaldante esterna.
- Posizionare il tubo di aspirazione all'interno della pompa a rulli e collegare un'estremità nel tubo che esce dalla camera per raccogliere i fluidi e l'altra estremità al serbatoio venoso per raccogliere tutte le perdite di organi di perfuffato.
- Collegare il tubo dell'ossigeno (verde) al serbatoio del gas contenente la miscela di carbogeno (95% O 2/5% CO2) e l'ossigenatore. Collegare il tubo dell'unità pompa del riscaldatore all'ossigenatore.
- Morsetto linee di deflusso arterioso e venoso, così come il deflusso del serbatoio venoso.
6. Preparazione del perfusato e adescamento del circuito
- Riempire il serbatoio venoso con il perfusato (Tabella 1).
- Utilizzare una pompa a siringa per la somministrazione continua del vasodilatatore (epoprostenolo) a 8 mL/h nella linea arteriosa. Utilizzare una seconda pompa a siringa per la somministrazione continua dell'inibitore enzimatico direttamente nel serbatoio venoso (15 mg, 10 ml/h).
- Accendere la macchina cuore-polmone (HLM) e avviare i pannelli di pressione, temperatura e timer. Accendere la pompa del riscaldatore per riscaldare la soluzione di perfusione a 38 °C. Aprire l'alimentazione O 2/CO2.
- Rimuovere il morsetto per tubi posto sul deflusso del serbatoio venoso, avviare la pompa centrifuga e portarla fino a 1.500 giri / min. Bloccare il tubo, bypassando il filtro arterioso e rilasciare aria dal filtro arterioso. Azzerare le linee di pressione arteriosa e venosa.
7. Perfusione dell'innesto di pancreas (Figura 2B)
- Aprire la sacca dell'organo in cui è conservato il pancreas. Sciacquare con 200 mL di albumina attraverso la cannula arteriosa. Rimuovere il pancreas dal ghiaccio e posizionarlo all'interno della camera dell'organo. Verificare che l'arteria e il tubo venoso siano privi di aria.
- Rilasciare il morsetto dal lato arterioso e bloccare la scorciatoia tra il tubo arterioso e venoso. Una volta che il sangue inizia a uscire dal tubo arterioso, collegare la linea alla cannula arteriosa. Impostare la pressione arteriosa a 20-25 mmHg, regolando la velocità della pompa centrifuga. Collegare il tubo venoso una volta che il sangue inizia a uscire dalla cannula venosa.
- Somministrare un flaconcino di verapamil (2,5 mg/ml) direttamente sul lato arterioso, quando il pancreas è completamente collegato e non si osservano sanguinamenti importanti.
- Registrare continuamente pressioni, flusso arterioso, temperatura e secrezione di duodeno. Raccogliere il sangue, registrare la produzione duodenale ogni ora e valutare macroscopicamente ogni ora per l'edema. Registrare i parametri di perfusione e prelevare campioni per l'analisi (campioni di gas di sangue venoso e arterioso, nonché campioni di amilasi, lipasi e LDH).
- Scollegare i tubi arteriosi e venosi quando la perfusione è finita, rimuovere l'innesto dalla camera dell'organo e sciacquare con UW fredda e pesare. Conservare l'innesto sul ghiaccio in una sacca sterile fino al momento del trapianto.
Risultati
I prossimi dati mostrano i risultati rappresentativi di sette esperimenti che utilizzano un modello di recupero del pancreas del donatore che batte cardiaco. Dopo l'incannulamento dell'aorta, il lavaggio con la soluzione UW e il recupero del pancreas, gli innesti sono stati tenuti su SCS per 2 ore mentre i globuli rossi venivano preparati. NEVPP è stato eseguito in questo modello per 3 ore, quello che abbiamo considerato il minor tempo necessario per la perfusione se la valutazione e la riparazione dell'innesto sono previste in futuro. I campioni e le misurazioni sono stati registrati in punti temporali orari. (0 = linea di base, subito dopo che l'organo è collegato al circuito, 1 = 1 h, 2 = 2 h, 3 = 3 h).
Gli innesti di pancreas sono stati posizionati su una camera d'organo progettata su misura per questo scopo e include un riscaldatore (file supplementare). Lo scopo di NEVPP è quello di fornire un ambiente quasi fisiologico per l'organo. A tale scopo, la pressione arteriosa è stata impostata per rimanere tra 20-25 mmHg in tutte le perfusioni. La pressione e il flusso sono stati misurati durante l'intera perfusione e sono rimasti stabili (Figura 4). L'attività metabolica è stata stimata calcolando il consumo di ossigeno dell'innesto utilizzando la seguente formula: [(pO 2art-pO2ven) * flusso / peso] (Figura 5). Le misurazioni di pH, sodio, calcio e HCO3 erano all'interno dei valori fisiologici durante l'intera perfusione (Figura 6). I livelli di lattato e potassio sono diminuiti durante la perfusione e hanno raggiunto valori vicini alla norma a 3 ore (Figura 7). Poiché il circuito è un sistema chiuso, si prevede che i livelli di amilasi e lipasi aumentino durante la perfusione (Figura 8). Tuttavia, l'aumento dei livelli non sembra essere correlato con il danno all'innesto (Figura 9). Una scala semiquantitativa è stata utilizzata per valutare la necrosi del grasso e del parenchima e l'integrità delle cellule insulari. (0 - nessun cambiamento, 1 - cambiamenti lievi, 2 - cambiamenti moderati, 3 - cambiamenti gravi). Questo è stato fatto da un patologo cieco ai gruppi sperimentali e non sono stati osservati segni di pancreatite.
Gli allotrapianti del pancreas sono stati pesati prima e dopo la perfusione per valutare l'edema (Tabella 2).
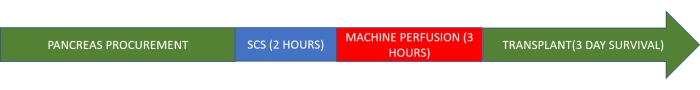
Figura 1. Protocollo di studio. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2. Pancreas prima e dopo la perfusione. (A) Prima della perfusione. (B) Dopo perfusione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
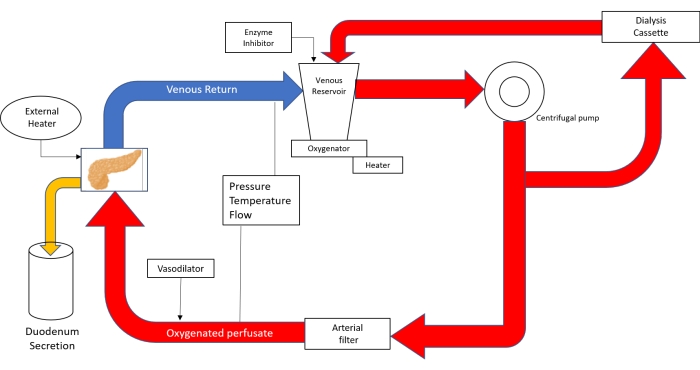
Figura 3. Disegno schematico del circuito di perfusione. Con l'uso della tecnologia di bypass cardiopolmonare neonatale; Il perfusato viene versato nel serbatoio venoso e quindi spinto con l'aiuto di una pompa centrifuga nell'ossigenatore. Dopo aver lasciato l'ossigenatore, il circuito si divide in tubi che inviano il perfustato alla cassetta di dialisi e di nuovo al serbatoio e al tubo che va al filtro arterioso. Dopo aver superato il filtro a bolle arteriose, il perfusato viene guidato con una pressione di 20-25 mmHg attraverso l'aorta nel pancreas. Il deflusso venoso riporta il perfufato nel serbatoio venoso. (Adattato da 18). Fare clic qui per visualizzare una versione ingrandita di questa figura.
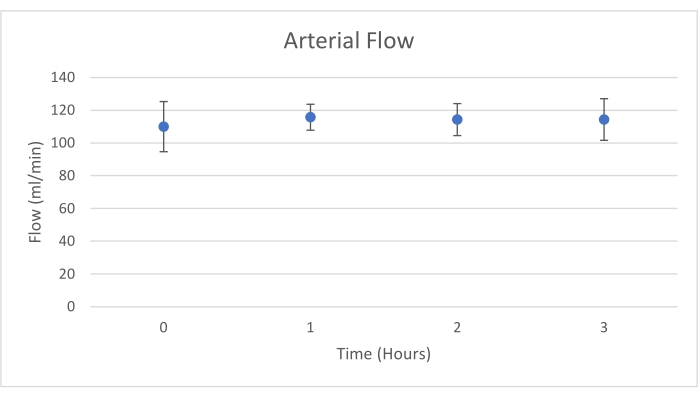
Figura 4. Flusso arterioso medio con deviazione standard (ml/min). Fare clic qui per visualizzare una versione ingrandita di questa figura.
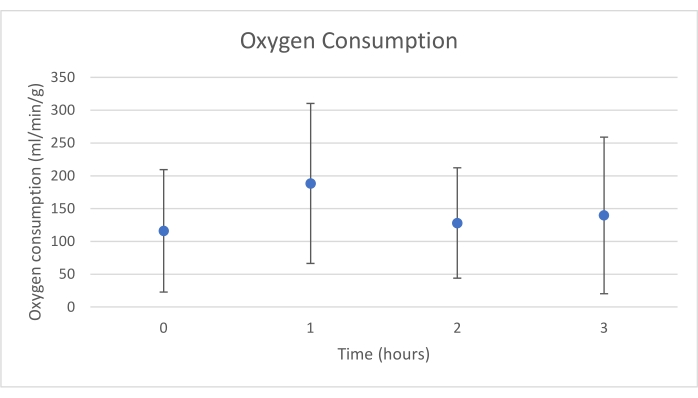
Figura 5. Consumo medio di ossigeno con deviazione standard (ml/min/g). Fare clic qui per visualizzare una versione ingrandita di questa figura.
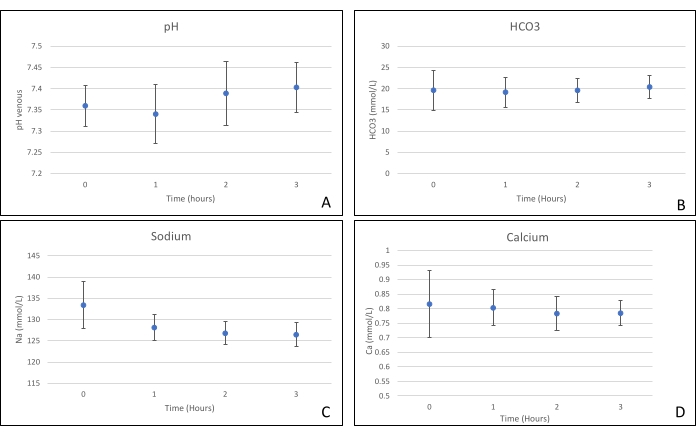
Figura 6. (A) Misurazioni medie di pH, (B)HCO 3, (C) sodio e (D) calcio con deviazioni standard. Fare clic qui per visualizzare una versione ingrandita di questa figura.
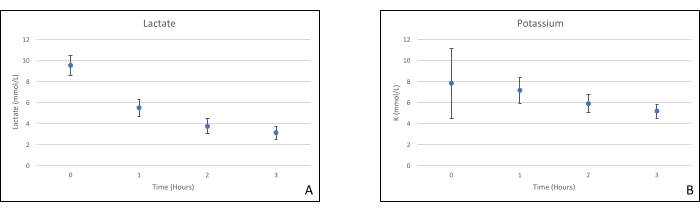
Figura 7. (A) Misurazioni medie del lattato e (B) del potassio con deviazioni standard. Fare clic qui per visualizzare una versione ingrandita di questa figura.
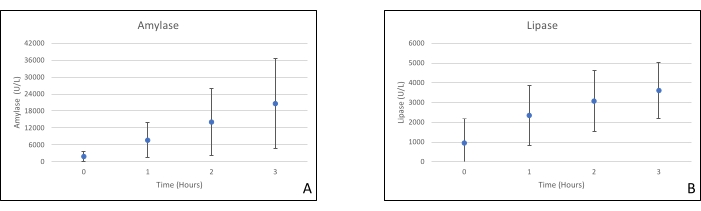
Figura 8. (A) Misurazioni medie dell'amilasi e della (B) lipasi con deviazioni standard. Fare clic qui per visualizzare una versione ingrandita di questa figura.
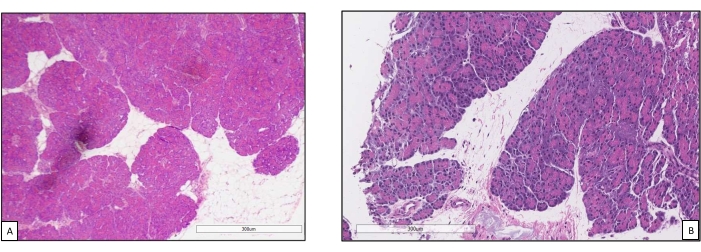
Figura 9. Biopsie core prima e dopo la perfusione. (A) Parenchima pancreatico normale prima della perfusione della macchina18. (B) Biopsia post perfusione con buona conservazione degli acini pancreatici e delle cellule insulari. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Ingrediente | Importo |
| Lattato di Ringer | 260 ml |
| Soluzione Steen | 195 ml |
| Eritrociti lavati | 162,5 ml |
| Acqua a doppia osmosi inversa (DRO) | 35 ml |
| Eparina (10000 UI / 10 ml) | 1,3 ml |
| Bicarbonato di sodio (8,4%) | 10,4 ml |
| Gluconato di calcio (10%) | 1,3 ml |
| Metylprednisolone (Solu-Medrol) | 325 mg |
| Aprotinina | 15 mg |
Tabella 1. Composizione perfusa.
| Peso prima | Peso dopo | Guadagnare | % differenza | |
| Caso 1 | 244 g | 240 g | -4 g | -1.63 |
| Caso 2 | 154 g | 164 g | 10 g | 6.49 |
| Caso 3 | 184 g | 245 g | 61 g | 33.15 |
| Caso 4 | 190 g | 226 g | 36 g | 18.94 |
| Caso 5 | 198 g | 307 g | 109 g | 55.05 |
| Caso 6 | 205 g | 315 g | 107 g | 51.44 |
| Caso 7 | 193 g | 256 g | 63 g | 32.64 |
Tabella 2. Peso prima e dopo la perfusione.
File supplementare: camera pancreatica personalizzata per la perfusione. Progettato in collaborazione con l'officina meccanica del Medical Physics - Radiation Medicine Program presso il Princess Margaret Cancer Centre. Clicca qui per scaricare questo file.
Discussione
Questo studio dimostra che è possibile ottenere un NEVPP stabile per gli allotrapianti del pancreas con danno istologico minimo dopo 3 ore di perfusione con la configurazione precedentemente presentata. I parametri di perfusione come flusso arterioso, pressione, pH, HCO3 e Na rimangono stabili durante la perfusione e abbiamo osservato una diminuzione e stabilizzazione di K e lattato.
È di fondamentale importanza manipolare l'innesto il meno possibile durante l'approvvigionamento, la preparazione del tavolo posteriore e la perfusione. È anche molto importante mantenere uno stretto controllo della pressione arteriosa. Poiché il pancreas è un organo a bassa pressione, un aumento della pressione può causare danni irreversibili all'organo.
La preparazione del back-table per questo studio è diversa dalla preparazione degli innesti umani (Figura 2A). Poiché il pancreas era l'unico organo prelevato dai maiali, siamo stati in grado di prendere la porzione dell'aorta che comprende il tronco celiaco e l'arteria mesenterica superiore. Per quanto riguarda la vena porta, è stata eseguita un'estensione utilizzando la vena iliaca. In caso di innesti umani, la preparazione del back-table dovrà essere eseguita nello stesso modo in cui viene eseguita per il trapianto, utilizzando innesti iliaci per la ricostruzione arteriosa e l'allungamento del portale19.
Questo metodo potrebbe essere limitato dalla complessità dell'installazione. Abbiamo deciso di aggiungere una cassetta di dialisi dopo aver notato un grave edema dell'innesto quando fatto senza di esso. Per questi esperimenti è stata costruita anche una camera d'organo su misura che conteneva una fonte di riscaldamento esterna che si è rivelata strumentale per la perfusione ottimale degli innesti.
Ci sono pochi studi che descrivono la perfusione normotermica ex vivo del pancreas. Nella maggior parte di questi studi, l'edema sembra essere il principale fattore limitante. Per quanto ne sappiamo, questo metodo è l'unico rapporto sull'utilizzo di una cassetta di dialisi per controllare l'edema.
La perfusione ex vivo normemica per il pancreas è ancora agli inizi rispetto ad altri organi. I protocolli attuali si stanno concentrando su donatori a criteri estesi (DCD), miglioramento del perfuffato, tempi di perfusione più lunghi e biomarcatori per valutare il danno del trapianto durante la perfusione. I livelli di amilasi e lipasi non sembrano essere marcatori affidabili, dal momento che stiamo usando un sistema chiuso, e non sembrano correlare con l'istopatologia20. Finora, il nostro gruppo è anche riuscito a trapiantare allotrapianti di pancreas dopo perfusione con buoni risultati18.
Con i continui miglioramenti di questa tecnologia, speriamo che questa tecnologia sia applicabile al trapianto clinico e consenta la valutazione e la riparazione degli allotrapianti del pancreas. Si spera che alla fine si tradurrà in un maggiore utilizzo dell'innesto, in una riduzione dei tempi di attesa per i pazienti e in migliori risultati per i pazienti.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Nessuno.
Materiali
| Name | Company | Catalog Number | Comments |
| Alburex 5 | CSL Behring AG | 187337 | 25 g of Albumin (human) in 500 mL of buffered diluent |
| Aprotinin from bovine lung | Sigma-Aldrich | A1153 | |
| Belzer UW Cold storage solution | Bridge to life Ltd | 4055 | |
| Calcium gluconate (10%) | Fresenius Kabi Canada Ltd (Toronto, ON) | C360019 | |
| Composelect (blood collection bags) | Fresenius Kabi Canada Ltd | PQ31555 | |
| Epoprostenol | GlaxoSmithKline Inc. | 218761 | |
| Heart lung machine, Stöckert S3 | Sorin Group Canada Inc. | Custom made | Centrifugal pump, roller pump, control panel (sensors for pressure, flow, temperature, bubbles, and level), oxygen blender, heater unit |
| Hemoflow, Fresenius Polysulfone | Fresenius Medical Care North America | 0520165A | |
| Heparin (10000 IU/10 mL) | Fresenius Kabi Canada Ltd | C504710 | |
| Lactated Ringer's solution | Baxter | JB2324 | |
| Neonatal cardiopulmonary bypass techonolgy | Sorin Group Canada Inc | Custom made | Dideco perfusion tubing systems, centrifugal blood pump (Revolution), arterial blood filter, microporous hollow fibre memebrane oxygenator), cannulas |
| Pancreas chamber | Custom made | With external heater | |
| Percutaneous Sheath Introducer Set with Integral Hemostasis Valve/side Port for use with 7-7.5 Fr Catheters | Arrow International LLC | SI-09880 | |
| Sodium bicarbonate (8.4%) | Fresenius Kabi Canada Ltd | C908950 | |
| Solu-Medrol | Pfizer Canada Inc. | 52246-14-2 | |
| Steen | XVIVO | 19004 | |
| Urethral catheter | Bard Inc | 86020 | 20 Fr, malecot model drain |
| Verapamil | Sandoz Canada Inc. | 8960 |
Riferimenti
- . National Diabetes Statistics Report | Diabetes | CDC Available from: https://www.cdc.gov/diabetes/data/statistics-report/index.html (2022)
- Shyr, Y. M., Wang, S. E., Chen, S. C., Shyr, B. U. Reappraisal of pancreas transplantation. Journal of the Chinese Medical Association JCMA. 82 (7), 531-534 (2019).
- Dholakia, S., et al. Pancreas transplantation: past, present, future. American Journal of Medicine. 129 (7), 667-673 (2016).
- Johnson, P., Sharples, E., Sinha, S., Friend, P. J. Pancreas and islet transplantation: pancreas and islet transplantation in diabetes mellitus. Transplantation Surgery. , 205-217 (2021).
- Kopp, W. H., et al. Pancreas transplantation with grafts from donors deceased after circulatory death: 5 years single-center experience. Transplantation. 102 (2), 333-339 (2018).
- Cypel, M., et al. Normothermic ex vivo lung perfusion in clinical lung transplantation. The New England Journal of Medicine. 364 (15), 1431-1440 (2011).
- Nasralla, D., et al. A randomized trial of normothermic preservation in liver transplantation. Nature. 557 (7703), 50-56 (2018).
- Selzner, M., et al. Normothermic ex vivo liver perfusion using steen solution as perfusate for human liver transplantation: First North American results. Liver Transplantation: Official Publication of the American Association for the Study of Liver Diseases and the International Liver Transplantation Society. 22 (11), 1501-1508 (2016).
- Hosgood, S. A., Thompson, E., Moore, T., Wilson, C. H., Nicholson, M. L. Normothermic machine perfusion for the assessment and transplantation of declined human kidneys from donation after circulatory death donors. The British Journal of Surgery. 105 (4), 388-394 (2018).
- Urbanellis, P., et al. Normothermic ex vivo kidney perfusion improves early dcd graft function compared with hypothermic machine perfusion and static cold storage. Transplantation. 104 (5), 947-955 (2020).
- Barlow, A. D., et al. Use of ex vivo normothermic perfusion for quality assessment of discarded human donor pancreases. American Journal of Transplantation: Official Journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 15 (9), 2475-2482 (2015).
- Kumar, R., et al. Ex vivo normothermic porcine pancreas: A physiological model for preservation and transplant study. International journal of surgery. 54, 206-215 (2018).
- Hamaoui, K., et al. Development of pancreatic machine perfusion: translational steps from porcine to human models. The Journal of Surgical Research. 223, 263-274 (2018).
- Prudhomme, T., et al. Successful pancreas allotransplantations after hypothermic machine perfusion in a novel diabetic porcine model: a controlled study. Transplant International: Official Journal of the European Society for Organ Transplantation. 34 (2), 353-364 (2021).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for the preservation of kidney grafts prior to transplantation. Journal of Visualized Experiments: JoVE. (101), e353 (2015).
- Graham, A. S., Ozment, C., Tegtmeyer, K., Lai, S., Braner, D. A. V. Central venous catheterization. The New England Journal of Medicine. 356 (21), 21 (2009).
- Swindle, M. M. . Swine in the Laboratory Surgery, Anesthesia, Imaging, and Experimental Techniques. , (2015).
- Mazilescu, L. I., et al. Normothermic ex situ pancreas perfusion for the preservation of porcine pancreas grafts. American Journal of Transplantation. , (2022).
- Fridell, J. A., et al. Preparation of the pancreas allograft for transplantation. Clinical transplantation. 25 (2), (2011).
- Nassar, A., Liu, Q., Walsh, M., Quintini, C. Normothermic ex vivo perfusion of discarded human pancreas. Artificial Organs. 42 (3), 334-335 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon