مسح بصري سريع لتحليل شبه عالي الإنتاجية للأورام الكروية
In This Article
Summary
أصبحت كرويات الورم تستخدم بشكل متزايد لتقييم التفاعلات بين الخلايا السرطانية والبيئة الدقيقة والاستجابة للعلاج. يصف البروتوكول الحالي طريقة قوية ولكنها بسيطة للتصوير شبه عالي الإنتاجية للكرويات 3D للورم باستخدام التطهير البصري السريع.
Abstract
أصبحت الأورام الكروية شائعة بسرعة في أبحاث السرطان الأساسية وتطوير الأدوية. يعد الحصول على البيانات المتعلقة بتعبير البروتين داخل الكروية على المستوى الخلوي أمرا مهما للتحليل ، ومع ذلك فإن التقنيات الحالية غالبا ما تكون باهظة الثمن أو شاقة أو تستخدم معدات غير قياسية أو تسبب تشويها كبيرا في الحجم أو تقتصر على كرويات صغيرة نسبيا. يقدم هذا البروتوكول طريقة جديدة لتركيب وإزالة الكرويات التي تعالج هذه القضايا مع السماح بالتحليل البؤري للبنية الداخلية للكرويات. وعلى النقيض من النهج القائمة، ينص هذا البروتوكول على التركيب السريع لعدد كبير من الكرويات وتطهيرها باستخدام المعدات القياسية ولوازم المختبرات. إن تركيب الكرويات في محلول هلام أغاروز-PBS محايد الأس الهيدروجيني قبل إدخال حل مقاصة مطابق لمؤشر الانكسار يقلل من تشويه الحجم الشائع في التقنيات المماثلة الأخرى. وهذا يسمح بإجراء تحليل كمي وإحصائي مفصل حيث تكون دقة قياسات الحجم ذات أهمية قصوى. علاوة على ذلك ، بالمقارنة مع حلول إزالة السوائل ، تحافظ تقنية هلام الأغاروز على تثبيت الكرويات في مكانها ، مما يسمح بجمع الصور البؤرية ثلاثية الأبعاد (3D). توضح هذه المقالة كيف تنتج الطريقة صورا عالية الجودة ثنائية و 3D توفر معلومات حول التباين بين الخلايا والبنية الكروية الداخلية.
Introduction
توفر مزارع الخلايا ثلاثية الأبعاد (3D) ، مثل الكرويات ، نماذج واقعية بيولوجيا وقابلة للتكرار لنمو الخلايا الكلي 1,2. أصبحت هذه النماذج شائعة بسرعة في كل من البحوث الأساسية وتطوير الأدوية ، حيث يتم فحص الاختلافات في حجم الكروية وهيكلها بين العلاجات للتأكد من فعالية الدواء 3,4. في هذه السياقات ، تعد القدرة على جمع معلومات مفصلة من عدد كبير من الكرويات مفيدة للغاية ، سواء من منظور القوة الإحصائية أو للسماح بالتقييم السريع لسلوك الخلية عبر العديد من العلاجات.
التقنيات الشائعة الاستخدام للحصول على صور مجهرية مفصلة للبنية الكروية إما تستغرق وقتا طويلا أو مكلفة أو تنتج صورا ذات جودة رديئة لا تحتفظ بالميزات الكمية الرئيسية مثل الحجم الكروي 4,5. على سبيل المثال، يمكن للتقنيات النسيجية القائمة على التقسيم بالتبريد أن توفر صورا عالية الجودة ولكنها غالبا ما تستغرق وقتا طويلا، وتتطلب عمالة ماهرة، وغالبا ما تنشئ قطعا أثرية مجزأة 6,7، في حين أن التقنيات الأنيقة، مثل مجهر الإضاءة أحادية المستوى (SPIM)8 والمجهر متعدد الفوتونات9 تتطلب مجاهر متخصصة غير متوفرة بسهولة. وقد مكنت تقنيات الفحص المجهري الحديثة مؤخرا ما يسمى بالتقسيم البصري ، حيث يتم وضع الكرويات داخل محلول إزالة مطابق لمعامل الانكسار ويتم الحصول على الصور باستخدام المجهر البؤري 4,5. في حين أن هذه التقنيات لديها القدرة على إنتاج عائد مرتفع ، فإن المشاكل الشائعة تشمل الحركة الكروية أثناء التصوير ، وتشويه الحجم أثناء التطهير ، والتكلفة العالية لحلول المقاصة الخاصة. علاوة على ذلك ، تنطبق العديد من البروتوكولات الحالية فقط على الكرويات الصغيرة نسبيا التي يقل قطرها عن 300 ميكرومتر أو عمقها حتى 100 ميكرومتر ، مما يحد من التكنولوجيا إلى المراحل المبكرة من نمو الورم5،10،11.
يسمح البروتوكول الحالي بجمع صور كروية مفصلة ذات إنتاجية عالية وإنتاجية عالية باستخدام حل مقاصة مطابق لمعامل الانكسار منخفض التكلفة مشتق من إجراءات تطهير الأعضاء بأكملها12,13. لمنع الحركة الكروية أثناء التصوير وتوفير الدعم الهيكلي لتقليل تشويه الحجم ، يتم تركيب الكرويات في هلام agarose-PBS في لوحة سفلية زجاجية 24 بئر # 1.5. نظرا لأن هذه التقنية تسمح بتركيب كرويات متعددة في كل بئر في لوحة مكونة من 24 بئرا ، يمكن تركيب ما يصل إلى 360 كرويا (15 كرويا / بئرا) بسرعة وتصويرها عبر ظروف تجريبية مختلفة. يتم استخدام حل المقاصة المطابق لمعامل الانكسار المبني من المواد الاستهلاكية المتاحة بسهولة لمسح الكرويات المثبتة والجل المحيط بها بصريا. بعد فترة استقرار مدتها 24 ساعة ، يوفر هذا البروتوكول صورا ثنائية الأبعاد و 3D عالية الجودة للبنية الكروية ، حتى بالنسبة للكرويات الكبيرة نسبيا (قطرها حوالي 700 ميكرومتر) ، مع تشويه حجم أقل من 2٪.
Protocol
يصف البروتوكول إعداد كمية كافية من الكرويات السرطانية لتركيب صفيحة واحدة من 24 بئرا (حوالي 240-360 كروية أو 10-15 كروية / بئر) عند 200 ميكرولتر من هلام الأغاروز لكل بئر و 500 ميكرولتر من محلول التطهير لكل بئر. ويوضح الشكل 1 الإجراء الكامل.
1. 2٪ إعداد هلام الأغاروز-PBS
- يزن 0.5 غرام من الأغاروز منخفض الذوبان (انظر جدول المواد) في زجاجة زجاجية ويضاف 25 مل من الملح المخزن بالفوسفات (PBS).
- قم بإذابة الأغاروز عن طريق غلي المحلول في الميكروويف لمدة 30-60 ثانية مع إغلاق الغطاء ولكن ليس مختوما ومع دوامة مستمرة. تأكد من إذابة الأغاروز بالكامل وعدم غليان المحلول.
ملاحظة: يمكن تخزين الجل في درجة حرارة الغرفة. تحقق من الحجم قبل الاستخدام لحساب التبخر. أحضره إلى الحالة السائلة (الميكروويف ؛ 20-60 ثانية مع دوامة) قبل الاستخدام.
2. إعداد حل المقاصة
- يزن 9 جم من N,N,N′,N′-Tetrakis (2-Hydroxypropyl) إيثيلينديامين، و22 جم من اليوريا، و44 جم من السكروز، و0.1 جم من Triton X-100، و24.9 جم من الماء منزوع الأيونات (انظر جدول المواد).
ملاحظة: من الأسهل وزن الكمية التقريبية ل N ، N ، N ′ ، N ′ - Tetrakis (2-Hydroxypropyl) ethylenediamine وضبط وزن المكونات الأخرى للحصول على التركيز المطلوب. - سخني المحلول في حمام مائي 56 درجة مئوية مع خلط مستمر واستمري حتى تذوب جميع البلورات.
- ضع المحلول في درجة حرارة الغرفة للسماح للفقاعات التي تشكلت أثناء الخلط بالارتفاع إلى السطح. الحل مستقر في درجة حرارة الغرفة لمدة تصل إلى 2 أشهر.
3. إعداد كروي
- قم بإنشاء كرويات باستخدام طريقة تراكب الأغاروز كما هو موضح سابقا1،3،14.
ملاحظة: الكرويات التي تم إنشاؤها بطرق أخرى متوافقة أيضا مع بروتوكول التصوير هذا. - اقطع طرف ماصة 1 مل باستخدام مشرط لتكبير الفتحة.
ملاحظة: تم التعامل مع جميع الكرويات مع ماصات 1 مل أو 200 ميكرولتر مع أطراف قطع. - باستخدام الماصة ، قم بشفط الكرويات من الآبار ونقلها إلى أنبوب مخروطي شفاف 1.5 مل. يمكن الجمع بين كرويات متعددة من نفس الظروف في نفس الأنبوب.
ملاحظة: اسمح دائما للكرويات بالاستقرار في قاع الأنبوب لشفط الوسط. - اغسل الكرويات في 1 مل PBS مرتين ، وأضف محلول بارافورمالدهيد (PFA) محايد بنسبة 4٪ ، واحتضن الكرويات عند 37 درجة مئوية لمدة 20 دقيقة.
- قم بإزالة محلول PFA واغسل الكرويات مرتين باستخدام 1 مل من PBS.
4. تلطيخ كروي
- باستخدام ماصة ، انقل ما يصل إلى 15 كرويا إلى أنبوب PCR سعة 200 ميكرولتر.
ملاحظة: بالنسبة للكرويات الهشة، قم بتركيب الكرويات في هلام (الخطوات 5.1-5.4) قبل المتابعة. - تخلل الخلايا باستخدام 200 ميكرولتر من 0.5٪ Triton X-100 في PBS. ضع أنابيب PCR داخل أنابيب ذات غطاء لولبي سعة 50 مل واحتضن الكرويات لمدة 2 ساعة في درجة حرارة الغرفة مع إثارة خفيفة.
ملاحظة: تتم جميع عمليات الحضانة بتحريض على دوار أو أسطوانة أو شاكر (انظر جدول المواد) ما لم ينص على خلاف ذلك. هذا مهم لتحقيق تلطيخ موحد. يمكن أن تلتصق الكرويات الثابتة في PBS في بعض الأحيان بجوانب طرف الماصة. شطف الطرف في 0.5٪ Triton X-100 يقلل من الكرويات من الالتصاق بالأطراف. - استبدل المحلول (الخطوة 4.2) ب 200 ميكرولتر من المخزن المؤقت لتخفيف الأجسام المضادة (ABDIL)15 واحتضنه طوال الليل في درجة حرارة الغرفة.
- إزالة ABDIL ، إضافة 75 ميكرولتر من الأجسام المضادة الأولية في ABDIL ، وحضانة في 4 درجة مئوية لمدة 2.5 يوم.
- قم بإزالة supernatant واغسله ب 200 ميكرولتر من PBS مع 0.1٪ Tween و 0.1٪ Triton X-100 (PBS-TT) مرتين واحتضنه مع 200 ميكرولتر من PBS-TT لمدة 4 ساعات في درجة حرارة الغرفة.
- قم بإزالة PBS-TT ، وأضف 100 ميكرولتر من الأجسام المضادة الثانوية في ABDIL ، واحتضنها عند 4 درجات مئوية لمدة 2.5 يوم.
ملاحظة: يمكن إضافة DAPI أو صبغة نووية أخرى في هذه المرحلة. تتطلب معظم الأصباغ وقت حضانة أقل من الأجسام المضادة. - قم بإزالة supernatant واغسله ب 200 ميكرولتر من PBS-TT مرتين واحتضنه ب 200 ميكرولتر من PBS-TT لمدة 4 ساعات. الكرويات جاهزة للتركيب.
5. تصاعد
- باستخدام ماصة 200 ميكرولتر، انقل الكرويات الثابتة والملطخة إلى أنابيب PCR سعة 500 ميكرولتر في أنبوب واحد لكل حالة (حوالي 10-15 كروية).
- استبدل المحلول ب 200 ميكرولتر من هلام الأغاروز السائل بنسبة 2٪ (ث / v) وأجهزة الطرد المركزي على الدوران السريع (بالسرعة القصوى الثابتة ، انظر جدول المواد) في درجة حرارة الغرفة لمدة 30 ثانية.
ملاحظة: ما لم يتم تركيبه على الفور، ضعه في كتلة تسخين على درجة حرارة 50 درجة مئوية لتجنب تصلب الهلام. - استنشاق الكرويات في ~ 50 ميكرولتر هلام الأغاروز السائل والاستغناء في بئر من 24 بئر الزجاج أسفل لوحة.
- قبل أن يصلب الجل ، افصل الكرويات باستخدام طرف ماصة في الجل المحيط ، وتأكد من تغطية الكرويات بالجل. اختياريا، ضع الطبق على الجليد لضبط الجل بسرعة.
ملاحظة: يعتمد عدد الكرويات لكل بئر على حجم الكرويات. يتم وضع الكرويات بعيدا عن بعضها البعض بحيث يدخل كروي واحد فقط مجال الرؤية أثناء التصوير. هذا مهم لمعالجة الصور الآلية. - أضف 500 ميكرولتر من محلول التطهير (الخطوة 2) لكل بئر ، مما يضمن غمر الجل. احتضان في RT لمدة 24 ساعة على الأقل وصور الكرويات في محلول المقاصة. الكرويات مستقرة في هذا الحل لمدة تصل إلى شهر في درجة حرارة الغرفة وعندما تكون محمية من التبخر.
6. التصوير
- اختر هدفا بمسافة عمل طويلة بما يكفي لتشمل الكروي بأكمله ، بما في ذلك ارتفاع تصاعد الكروي في السفينة.
ملاحظة: الأهداف التي تبلغ مسافة عملها 3 مم أو أكثر مطلوبة لتصوير المستوى الاستوائي للكرويات. يمكن أن تسمح أهداف التكبير الأعلى مع NA الأعلى بدقة أفضل ، ولكنها ستحد من الحد الأقصى للعمق الذي يمكن من خلاله تصوير الكرويات. - لتحديد المستوى الاستوائي، اضبط التركيز البؤري حتى يتم الوصول إلى أكبر مساحة سطح في مستوى XY والصورة باستخدام النسبة المئوية المطلوبة لطاقة الليزر، وجهد الكاشف، والكسب، وإعدادات الإزاحة.
ملاحظة: ستختلف النسبة المئوية لطاقة الليزر وجهد الكاشف والكسب والإزاحة اختلافا كبيرا اعتمادا على الفلوروفور وشدة التلطيخ وشدة الليزر وحساسية الكاشف وما إلى ذلك. - بالنسبة للصور ثلاثية الأبعاد ، اضبط بداية ونهاية الكرويات ، واختر شدة الإشارة المناسبة عند عمق z مختلف باستخدام إعدادات تصحيح كثافة z قبل التصوير.
ملاحظة: للحصول على أفضل دقة وضوح للصورة، استخدم معدل أخذ العينات Nyquist ل x و y و z (للحصول على التفاصيل، راجع المرجع16).
Representative Results
لإثبات قدرة طريقة التطهير هذه على توفير صور ثنائية وثلاثية الأبعاد عالية الجودة ، تم زراعة كرويات بأقطار تتراوح بين 300 و 600 ميكرومتر من خطوط خلايا سرطان الجلد المحولة FUCCI-WM164 و FUCCI-WM164 و FUCCI-WM983b 9,17 ، التي تعبر عن بروتين Kusabira Orange2 الأحادي (mKO2) وبروتين Azami Green الأحادي (mAG) عندما يكونان في Gap1، والمرحلة المبكرة من المرحلة S/Gap2/الانقسام الخيطي من دورة الخلية، على التوالي وفقا للإجراءات المنصوص عليها في الخطوة 31،3،14. ثم تم إصلاح الكرويات بمحلول الفورمالديهايد بنسبة 4٪ عند 37 درجة مئوية ، وتتخلل ، وتلطخ بمضاد p27kip1 / مضاد للأرانب Alexa Fluor 647 مضاد للبيمونيدازول / مضاد للفأر Alexa Fluor 647 أو DAPI أو DRAQ7 (انظر جدول المواد) (الشكل 2). يتم تحميل جميع ملفات الفحص المجهري إلى مستودع GitHub (https://github.com/ap-browning/SpheroidMounting). بالمقارنة مع الكرويات المثبتة على PBS ، يوفر حل الإزالة صورا عالية الوضوح مع الحد الأدنى من التشويش في الحجم (الشكل 2A). يسمح البروتوكول بتصوير عالي الدقة للتفاصيل الخلوية الأعمق في الكرويات دون تقسيم نسيجي ، وتم الحصول على الصورة المقطعية المستعرضة من هدف جوي 20x (0.7 NA) بدقة 4096 × 4096 بكسل دون خياطة (الشكل 2B). باستخدام هدف تكبير أقل وفتحة رقمية أقل مع مسافة عمل أطول ، يمكن الحصول على صور متحدة البؤرة ثلاثية الأبعاد توفر تفاصيل على المستوى الخلوي على عمق لا يقل عن 200 ميكرومتر (الشكل 2C). كما تم تقطيع الكرويات بالتبريد وتلطيخها وفقا للبروتوكول الذي أصدره Spoerri et al.4 ومقارنتها بالتلطيخ الكروي الكامل (الشكل 2D ، E). يوضح الشكل 2D منطقة نقص الأكسجة في الكروية الملطخة بالبيمونيدازول ، ويبين الشكل 2E تلطيخ p27kip1 الذي يميز اعتقال دورة الخلية (الأصفر) ووصمة DAPI النووية (الرمادية). يتشابه توطين البروتين ونمط التلطيخ بين التقسيم بالتبريد والتطهير ، وبالتالي لا يتأثران بطريقة التطهير هذه.
يسمح تصحيح شدة الإشارة في z بتصوير الكروي بأكمله. ومع ذلك ، فإن تشتت الضوء بسبب النواة الميتة يحد من القدرة على تصوير الجانب البعيد من الكروي. يسمح الاختراق الأعمق والتشتت الأقل للفلوروفور الأحمر البعيد ، مثل البقعة النووية DRAQ7 ، بمزيد من التمثيل المحسن للهيكل الكروي ثلاثي الأبعاد (الشكل 3). يعرض الفيلم 1 العرض ثلاثي الأبعاد للكرويات FUCCI الملطخة ب DRAQ7. قد تسمح شريحة z الأرق بدقة z أفضل ، ولكن هذا يزيد بشكل كبير من وقت التصوير والتبييض الضوئي للفلوروفورات.
لتحديد ما إذا كان محلول المقاصة يسبب تشويها في الحجم ، تم تصوير اثني عشر كرويا في هلام الأغاروز-PBS بنسبة 2٪ في 6 ساعات و 12 ساعة و 24 ساعة و 72 ساعة و 168 ساعة بعد إدخال محلول المقاصة. تم تلخيص الصور من خلال تحديد قطر الكروية ، والتي تم تعريفها بناء على كرة لها نفس مساحة المقطع العرضي مثل الكروية (الشكل 4A). في حين لوحظ أن الكرويات تزداد قليلا في الحجم خلال أول 6 ساعات ، يشار إليها بتغيير قطر الطي بين 2٪ و 6٪ (الشكل 4B) ، بعد 24 ساعة إلى 72 ساعة ، تعود الكرويات إلى حجم مساو تقريبا للحجم المقابل في PBS بعد تثبيت PFA (الشكل 4C).
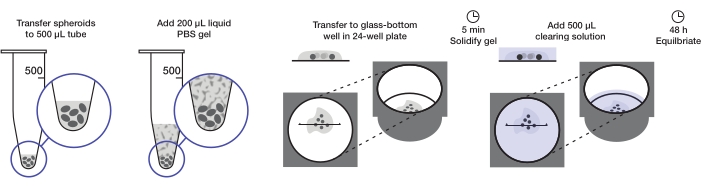
الشكل 1: رسم توضيحي لبروتوكول التركيب والمقاصة الكروي. يتم نقل الكرويات الثابتة والملطخة إلى أنبوب 500 ميكرولتر. يتم استبدال السوائل الزائدة بهلام 200 ميكرولتر من الأغاروز-PBS ويتم طرده مركزيا. ثم يتم نقل الكرويات إلى بئر زجاجي القاع في صفيحة من 24 بئرا. بعد السماح للهلام بالتصلب ، تتم إضافة محلول إزالة 500 ميكرولتر ، ويسمح للكرويات بالتوازن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
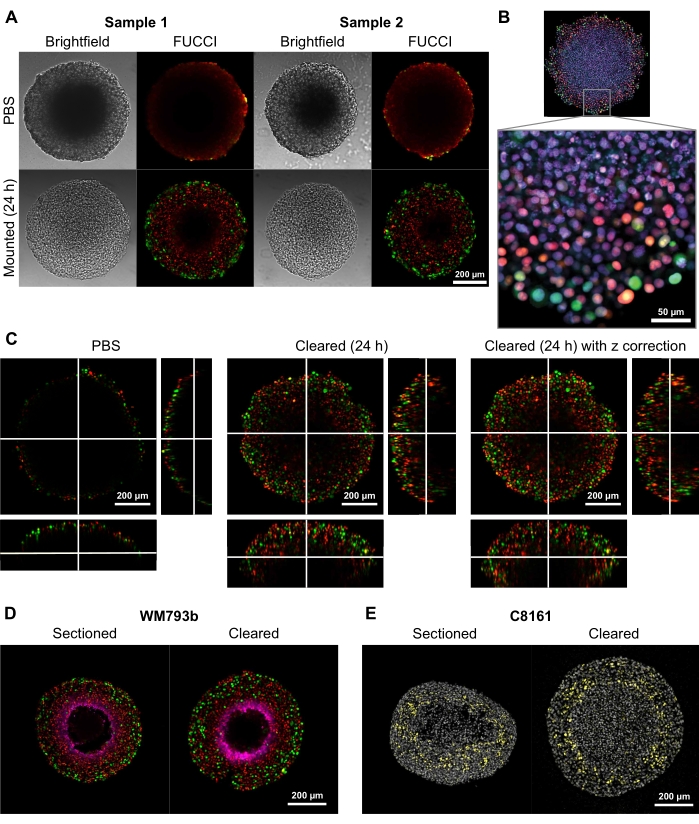
الشكل 2: مقارنة بين الكرويات الميلانينية البشرية FUCCI التي تم تطهيرها وغير المطهرة. يشير التلوين إلى نوى الخلية الإيجابية ل mKO2 (الأحمر) ، مما يشير إلى الخلايا في الفجوة 1 ؛ ونوى الخلية إيجابية ل mAG (الأخضر) ، مما يشير إلى الخلايا في الفجوة 2. (A) كروية نمت من 5000 خلية FUCCI-WM983b ، تم حصادها في اليوم 10 وصورت في هلام agarose-PBS و 24 ساعة بعد إضافة محلول التطهير. تظهر مقارنة الصور الساطعة والصور متحدة البؤرة قبل وبعد حل المسح الحد الأدنى من التشوه في الحجم ومكاسب كبيرة في الوضوح. (ب) كرويات مزروعة من خلايا FUCCI-WM164 تتخلل باستخدام Triton X-100 وتلطخ ب DRAQ7 ، مما يلطخ جميع نوى الخلايا. يتم الحصول على الصورة باستخدام هدف 20x (0.75 NA) ، مما يدل على أن حل المقاصة يسمح بتصوير عالي الدقة للتفاصيل على مستوى الخلية. (C) تم الحصول على صور ثلاثية الأبعاد (10x ، 0.4 NA) من الكرويات FUCCI-WM164 في PBS ، و 24 ساعة بعد إضافة حل المقاصة. يسمح ضبط طاقة الليزر والجهد والإزاحة عند مستوى z مختلف بالتصوير بشكل أعمق داخل الكروية. (دال، هاء) مقارنة بين التشريح بالتبريد ومسح كروي كامل ملطخ للبيمونيدازول و p27kip1. (د) يظهر تلطيخ البيمونيدازول باللون الأرجواني منطقة نقص الأكسجة في الكرويات. الأحمر والأخضر يشير إلى FUCCI. (ه) المقاطع المبردة والكروية التي تم تطهيرها والتي تظهر DAPI (رمادي) و p27kip1 (أصفر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
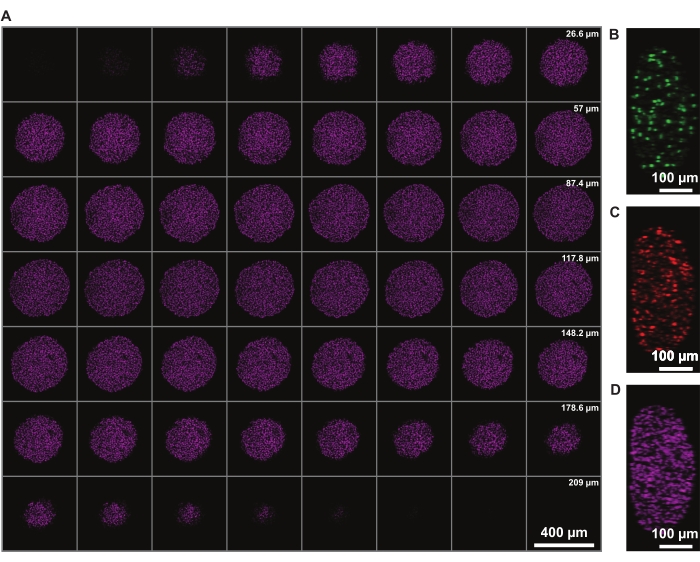
الشكل 3: يسمح التطهير بالتصوير بشكل أعمق في الكروية مع الحد الأدنى من فقدان الضوء. صور مجهرية متحدة البؤرة لسرطان الجلد البشري الكروي FUCCI عند تكبير 10x وانخفاض NA (0.4) ، مما يسمح بالتصوير على عمق z أعلى مع الحد الأدنى من فقدان الإشارة. (A) شرائح 3.88 ميكرومتر من النوى الكروية الملطخة ب DRAQ7. (B-D) y / z - الدقة في قنوات 488 (mAG) و 568 (mKO2) و 647 نانومتر (DRAQ7) ، على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
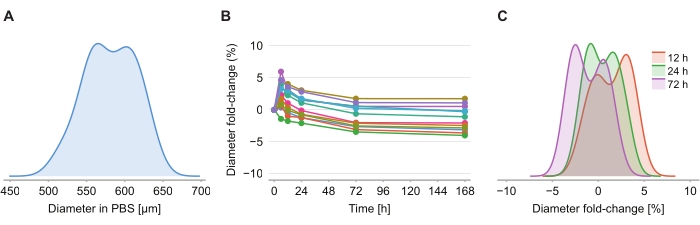
الشكل 4: حل المقاصة له تأثير ضئيل على حجم الكروي. (أ) توزيع الحجم الكروي الأولي (القطر المكافئ) في هلام PBS (n = 12 كروي). (B) تغير طية القطر بمرور الوقت منذ إضافة محلول المقاصة. في الساعة 0 ، تكون الكرويات في هلام PBS فقط. (C) توزيع تغيرات أضعاف القطر عند 12 ساعة و 24 ساعة و 72 ساعة.
الفيلم 1: تقديم ثلاثي الأبعاد لعكروي FUCCI ملطخ ب DRAQ7. يرجى النقر هنا لتنزيل هذا الفيلم.
Discussion
يتم تقديم بروتوكول للحصول على صور ثنائية وثلاثية الأبعاد عالية الجودة للكرويات السرطانية هنا. غالبا ما تتسبب الطرق الحالية ، مثل CLARITY و See deep brain (SeeDB) و ScaleS ، في تشويه الحجم بنسبة تصل إلى 30٪ ، في حين أن تقنيات مثل Benzyl Alcohol / Benzyl Benzoate (BABB) والتصوير ثلاثي الأبعاد للأعضاء التي تم تطهيرها بالمذيبات (3DISCO) يمكن أن تطفئ بروتين الفلورسنت18. تم تصميم العديد من هذه الطرق لإزالة الأنسجة ذات السلامة الهيكلية وتشويه الحجم والبنية عند تطبيقها على الكرويات18. وعلى النقيض من البروتوكولات الأخرى التي تستخدم حلول المقاصة باهظة الثمن المتاحة تجاريا، يستخدم هذا البروتوكول المواد الاستهلاكية المتاحة بسهولة مع الحفاظ على الوضوح البصري والتألق الداخلي وتقليل تشويه الحجم. يوفر تضمين الكرويات في هلام agarose-PBS دعما هيكليا للكرويات ويقلل من الصدمة التناضحية عند إضافة محلول المقاصة. هذا أمر بالغ الأهمية عند تصوير الكرويات الهشة بعد العلاج من تعاطي المخدرات. من المفترض أن طريقة التطهير البصري هذه مناسبة للكرويات التي تشكلها أي طريقة لأن هذا البروتوكول مقتبس من تطهير الأنسجة بالكامل. يعتمد الافتراض على التشابه في الكرويات التي تم الحصول عليها بطرق تكوين كروية مختلفة. يمكن أن يؤثر اختيار المثبت على حجم الكروي وكذلك التألق الداخلي. طريقة المقاصة هذه مناسبة للكرويات الثابتة بمحلول PFA محايد بنسبة 4٪. مطلوب مزيد من الاختبارات للتحقق من توافقه مع المثبتات الأخرى.
وبالنظر إلى أن هذه التقنية تسمح بتركيب كرويات متعددة في وقت واحد في صفيحة متعددة الآبار، فهي مناسبة تماما لخطوط أنابيب التحليل الكمي التي تتطلب معلومات الهيكل الكروي من ما يصل إلى 360 كرويا لكل صفيحة من 24 بئرا. يمكن للمجاهر ذات وظائف رسم خرائط المراحل والصفائح الآلية أن تجعل التصوير أقل يدويا. على الرغم من أن هذه الطريقة أسرع وأسهل من التقسيم ، إلا أنها غير مناسبة حاليا للأتمتة الكاملة. ومع ذلك ، فإن الصور التي تم الحصول عليها بهذه الطريقة مناسبة لمعالجة الصور الآلية 4,19 ، والمعدل الذي يمكن به تركيب الكرويات باستخدام هذا البروتوكول يفسح المجال للتحليل الكمي للبنية الداخلية الكروية20,21,22.
لتلطيخ الكرويات الكاملة ، يجب تحسين تركيز الأجسام المضادة وحجمها ووقت حضانتها لكل جسم مضاد. كدليل ، استخدم 2.5x من تركيز الأجسام المضادة المناعية 2D الموصى به و 100-200 ميكرولتر من الأجسام المضادة ، اعتمادا على عدد الكرويات لكل أنبوب. تأكد من تغطية جميع الكرويات بمحلول تلطيخ عندما تكون على الدوار. يعتمد وقت الحضانة على العديد من العوامل ، بما في ذلك حجم وكثافة الكرويات والأجسام المضادة ، ويمكن أن يتراوح من 16-72 ساعة. على الرغم من الطريقة التي تسمح باكتشاف الإشارة بشكل أعمق داخل الكروية ، إلا أن الفلوروفورات التي تثيرها الأشعة فوق البنفسجية تسبب تشتتا كبيرا للضوء ، مما يؤدي إلى انخفاض نسبة الإشارة إلى الضوضاء. يجب توخي الحذر عند اختيار الفلوروفورات لتصور البروتين المستهدف. على سبيل المثال ، فإن تلطيخ البروتينات الأقل وفرة والهيكلية مع الفلوروفورات ذات الطول الموجي الأطول والمزيد من البروتين أو البقع النووية مع الفلوروفورات ذات الطول الموجي الأقصر سيحقق أفضل نتيجة. وأخيرا، لا تزال الكرويات التي تم تطهيرها تظهر فقدان الضوء بسبب التشتت في النواة الميتة، وهو ما يتضح في البعد y/z للصور التي تم الحصول عليها من 600 ميكرومتر كروية (الشكل 2C).
يمكن التصوير بالتكبير العالي مع أهداف NA أعلى باستخدام الكرويات المثبتة ومسحها باستخدام هذا البروتوكول ، ولكن مسافة عمل الهدف تحد من عمق التصوير. بالنسبة لعدسة غمر الزيت ، من المهم استخدام الزيت الذي يحتوي على مثيل محجوز يبلغ 1.51 للحصول على أفضل نتيجة.
للتلخيص ، تسمح طريقة إزالة هلام agarose-PBS المضمنة بتصور الخلايا العميقة داخل الكرويات باستخدام المواد الاستهلاكية المتاحة بشكل شائع. تخضع الكرويات المثبتة والمسحة باستخدام هذه الطريقة لتشويه الحد الأدنى من الحجم والحفاظ على سلامتها الهيكلية ، مما يسمح بجمع بيانات عالية الجودة تتعلق بالهيكل الكروي الداخلي والقياس الكمي الآلي اللاحق.
Acknowledgements
تم إجراء هذا البحث في معهد البحوث الانتقالية (TRI) ، Woolloongabba ، QLD. يتم دعم TRI بمنحة من الحكومة الأسترالية. نشكر الموظفين في المرفق الأساسي للفحص المجهري في TRI على دعمهم الفني المتميز. نشكر البروفيسور أتسوشي مياواكي ، ريكين ، مدينة واكو ، اليابان ، على توفير هياكل FUCCI ، والبروفيسور مينهارد هيرلين والسيدة باتريشيا برافورد ، معهد ويستار ، فيلادلفيا ، بنسلفانيا ، على توفير خطوط الخلايا. نشكر الدكتورة لوريدانا سبويري على توفير صور الاستئصال بالتبريد C8161.
تم دعم هذا العمل من خلال منح المشاريع المقدمة إلى N.K.H.: مجلس البحوث الأسترالي (DP200100177) ومنحة مشروع Meehan (021174 2017002565).
Materials
| Name | Company | Catalog Number | Comments |
| #1.5 glass bottom 24-well plate | Celvis | P24-1.5H-N | |
| 500 µL clear PCR tubes | Sigma | HS4422 | |
| Alexa Fluor 647 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson Immuno research | 715-605-151 | Dilution used 1:500 |
| Bovine serum albumin | Sigma | A7906 | Final concentration 2% w/v |
| DAPI | Sigma | D9542-10MG | Final concentration 5 µg/mL |
| Deionized water | MILLI Q | ||
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Thermofisher | A-31573 | Dilution used 1:500 |
| DRAQ7 | Thermofisher | D15106 | Dilution used 1:250 |
| Heating block | Ratek | DBH10 | or similar equipment |
| Hypoxyprobe Kits | Hypoxyprobe | HP1-1000Kit | Antibody dilution used 1:500 |
| Low-melting agarose powder | Sigma | A9414 | Final concentration 2% w/v |
| Microwave | Sharp | ||
| N,N,N′,N′-Tetrakis(2-Hydroxypropyl)ethylenediamine | Sigma | 122262 | Final concentration 9% w/w |
| NaCl | Sigma | S9888 | Final concentration 150 mM |
| NaN3 | Sigma | S2002 | Final concentration 0.10% w/v |
| p27 Kip1 (D69C12) XP | Cell Signalling technology | 3686S | Dilution used 1:500 |
| Paraformaldehyde solution | Proscitech | C004 | Final concentration 4% w/v |
| Phosphate Buffered Saline (PBS) | Thermofisher | 18912014 | Final concentration 1x |
| Pipette | Eppendorf | ||
| Quickspin minifuge | or similar equipment | ||
| Roller | Ratek | BTR10-12V | or similar equipment |
| Rotor | Ratek | RSM7DC | or similar equipment |
| Shaker | Ratek | EOM5 | or similar equipment |
| Sucrose | Sigma | S9378 | Final concentration 44% w/w |
| Tris-HCl pH 7.4 | Sigma | T5941 | Final concentration 20 mM |
| Triton X-100 | Sigma | X100 | Final concentration 0.10% v/v |
| Triton X-100 | Sigma | X100 | Final concentration 0.1% v/v |
| Tween 20 | Sigma | P1379 | Final concentration 0.1% v/v |
| Urea | Sigma | U5379 | Final concentration 22% w/w |
References
- Beaumont, K. A., Anfosso, A., Ahmed, F., Weninger, W., Haass, N. K. Imaging- and flow cytometry-based analysis of cell position and the cell cycle in 3D melanoma spheroids. Journal of Visualized Experiments. (106), e53486 (2015).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Smalley, K. S., Lioni, M., Noma, K., Haass, N. K., Herlyn, M. In vitro three-dimensional tumor microenvironment models for anticancer drug discovery. Expert Opinion on Drug Discovery. 3 (1), 1-10 (2008).
- Spoerri, L., Gunasingh, G., Haass, N. K. Fluorescence-based quantitative and spatial analysis of tumour spheroids: A proposed tool to predict patient-specific therapy response. Frontiers in Digital Health. 3, 668390 (2021).
- Nürnberg, E., et al. Routine optical clearing of 3D-cell cultures: Simplicity forward. Frontiers in Molecular Biosciences. 7, 20 (2020).
- Kabadi, P. K., et al. Into the depths: Techniques for in vitro three-dimensional microtissue visualization. BioTechniques. 59 (5), 279-286 (2015).
- Ivanov, D. P., Grabowska, A. M. Spheroid arrays for high-throughput single-cell analysis of spatial patterns and biomarker expression in 3D. Scientific Reports. 7, 41160 (2017).
- Spoerri, L., et al. Phenotypic melanoma heterogeneity is regulated through cell-matrix interaction-dependent changes in tumor microarchitecture. bioRxiv. , (2021).
- Haass, N. K., et al. Real-time cell cycle imaging during melanoma growth, invasion, and drug response. Pigment Cell & Melanoma Research. 27 (5), 764-776 (2014).
- Ahmad, A., et al. Clearing spheroids for 3D fluorescent microscopy: combining safe and soft chemicals with deep convolutional neural network. bioRxiv. , 428996 (2021).
- Villani, T., Rossi, A. E., Sherman, H. Image-based characterization of 3-D cell culture models grown in spheroid microplates. American Laboratory. 50 (6), 12 (2018).
- Lloyd-Lewis, B., et al. Imaging the mammary gland and mammary tumours in 3D: optical tissue clearing and immunofluorescence methods. Breast Cancer Research. 18 (1), 127 (2016).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159 (4), 911-924 (2014).
- Spoerri, L., Beaumont, K. A., Anfosso, A., Haass, N. K. Real-time cell cycle imaging in a 3D cell culture model of melanoma. Methods in Molecular Biology. 1612, 401-416 (2017).
- Cold Spring Harbor. Antibody Dilution Buffer (Abdil). Cold Spring Harbor Protocols. , (2018).
- Pawley, J. B., Pawley, J. B. . Handbook Of Biological Confocal Microscopy. , 20-42 (2006).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Tian, T., Yang, Z., Li, X. Tissue clearing technique: Recent progress and biomedical applications. Journal of Anatomy. 238 (2), 489-507 (2021).
- Browning, A. P., Murphy, R. J. . Zenodo. , (2021).
- Browning, A. P., et al. Quantitative analysis of tumour spheroid structure. eLife. 10, 73020 (2021).
- Klowss, J. J., et al. A stochastic mathematical model of 4D tumour spheroids with real-time fluorescent cell cycle labelling. Journal of The Royal Society Interface. 19 (189), 20210903 (2022).
- Murphy, R. J., Browning, A. P., Gunasingh, G., Haass, N. K., Simpson, M. J. Designing and interpreting 4D tumour spheroid experiments. Communications Biology. 5 (1), 91 (2022).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved