Rapid Optical Clearing für die Semi-Hochdurchsatzanalyse von Tumorsphäroiden
In diesem Artikel
Zusammenfassung
Tumorsphäroide werden zunehmend zur Beurteilung von Tumorzell-Mikroumgebung-Interaktionen und Therapiereaktionen eingesetzt. Das vorliegende Protokoll beschreibt eine robuste, aber einfache Methode zur Semi-Hochdurchsatz-Bildgebung von 3D-Tumorsphäroiden mittels schneller optischer Clearing.
Zusammenfassung
Tumorsphäroide werden in der Krebsgrundlagenforschung und Medikamentenentwicklung schnell alltäglich. Die Gewinnung von Daten über die Proteinexpression innerhalb des Sphäroids auf zellulärer Ebene ist wichtig für die Analyse, aber bestehende Techniken sind oft teuer, mühsam, verwenden nicht standardmäßige Geräte, verursachen signifikante Größenverzerrungen oder sind auf relativ kleine Sphäroide beschränkt. Dieses Protokoll stellt eine neue Methode zur Montage und Beseitigung von Sphäroiden vor, die diese Probleme angehen und gleichzeitig eine konfokale Analyse der inneren Struktur von Sphäroiden ermöglichen. Im Gegensatz zu bestehenden Ansätzen sieht dieses Protokoll eine schnelle Montage und Klärung einer großen Anzahl von Sphäroiden mit Standardausrüstung und Laborbedarf vor. Die Montage von Sphäroiden in einer pH-neutralen Agarose-PBS-Gellösung vor der Einführung einer Brechungsindex-angepassten Clearinglösung minimiert die Größenverzerrung, die bei anderen ähnlichen Techniken üblich ist. Dies ermöglicht eine detaillierte quantitative und statistische Analyse, bei der die Genauigkeit der Größenmessungen von größter Bedeutung ist. Darüber hinaus hält die Agarosegel-Technik im Vergleich zu flüssigen Clearing-Lösungen die Sphäroide an Ort und Stelle, was die Erfassung dreidimensionaler (3D) konfokaler Bilder ermöglicht. Der vorliegende Artikel erläutert, wie die Methode qualitativ hochwertige Zwei- und 3D-Bilder liefert, die Informationen über die Variabilität zwischen den Zellen und die innere Sphäroidstruktur liefern.
Einleitung
Dreidimensionale (3D) Zellkulturen, wie Sphäroide, liefern biologisch realistische und reproduzierbare Modelle des aggregierten Zellwachstums 1,2. Diese Modelle werden sowohl in der Grundlagenforschung als auch in der Arzneimittelentwicklung schnell alltäglich, wo Unterschiede in der Sphäroidgröße und -struktur zwischen den Behandlungen untersucht werden, um die Wirksamkeit von Arzneimitteln zu ermitteln 3,4. In diesem Zusammenhang ist die Möglichkeit, detaillierte Informationen von einer großen Anzahl von Sphäroiden zu sammeln, sehr vorteilhaft, sowohl aus statistischer Sicht als auch um eine schnelle Beurteilung des Zellverhaltens über mehrere Behandlungen hinweg zu ermöglichen.
Häufig verwendete Techniken zur Gewinnung detaillierter Mikroskopiebilder der Sphäroidstruktur sind entweder zeitaufwendig, teuer oder erzeugen Bilder von schlechter Qualität, die wichtige quantitative Merkmale wie die Sphäroidgröße 4,5 nicht beibehalten. Zum Beispiel können histologische Techniken, die auf Kryosektion basieren, qualitativ hochwertige Bilder liefern, sind aber oft zeitaufwendig, erfordern qualifizierte Arbeit und erzeugen oft Schnittartefakte6,7, während elegante Technologien wie Single Plane Illumination Microscopy (SPIM) 8 und Multiphotonenmikroskopie 9 spezielle Mikroskope erfordern, die nicht ohne weiteres verfügbar sind. Moderne Mikroskopietechnologien haben kürzlich das sogenannte optische Schneiden ermöglicht, bei dem Sphäroide in eine Brechungsindex-angepasste Clearinglösung platziert werden und Bilder mittels konfokaler Mikroskopieerhalten werden 4,5. Während diese Techniken das Potenzial haben, eine hohe Ausbeute zu erzielen, gehören zu den häufigsten Problemen die Sphäroidbewegung während der Bildgebung, die Größenverzerrung während des Clearings und die hohen Kosten proprietärer Clearing-Lösungen. Darüber hinaus gelten viele bestehende Protokolle nur für relativ kleine Sphäroide mit einem Durchmesser von weniger als 300 μm oder einer Tiefe von bis zu 100 μm, wodurch die Technologie auf die frühen Stadien des Tumorwachstumsbeschränkt ist 5,10,11.
Das vorliegende Protokoll ermöglicht eine Semi-High-Throughput-High-Yield-Sammlung detaillierter Sphäroidbilder unter Verwendung einer kostengünstigen, auf den Brechungsindex abgestimmten Clearinglösung, die aus Clearingverfahren für ganze Organe abgeleitet wurde12,13. Um die Bewegung von Sphäroid während der Bildgebung zu verhindern und strukturelle Unterstützung zur Verringerung der Größenverzerrung zu bieten, sind die Sphäroide in Agarose-PBS-Gel in einer 24-Well # 1.5-Glasbodenplatte montiert. Da diese Technik es ermöglicht, mehrere Sphäroide in jedem Bohrloch in einer 24-Well-Platte zu montieren, können bis zu 360 Sphäroide (15 Sphäroide / Well) schnell montiert und unter verschiedenen experimentellen Bedingungen abgebildet werden. Eine auf den Brechungsindex abgestimmte Clearinglösung, die aus leicht verfügbaren Verbrauchsmaterialien besteht, wird verwendet, um montierte Sphäroide und das umgebende Gel optisch zu entfernen. Nach einer Einschwingzeit von 24 h liefert dieses Protokoll hochwertige 2D- und 3D-Bilder der Sphäroidstruktur, selbst für relativ große Sphäroide (ca. 700 μm Durchmesser), mit weniger als 2% Größenverzerrung.
Protokoll
Das Protokoll beschreibt die Herstellung einer ausreichenden Menge an Tumorsphäroiden, um eine 24-Well-Platte (ca. 240-360 Sphäroide oder 10-15 Sphäroide / Well) bei 200 μL Agarosegel pro Vertiefung und 500 μL Clearinglösung pro Vertiefung zu montieren. Die vollständige Prozedur ist in Abbildung 1 dargestellt.
1. 2% Agarose-PBS-Gel-Zubereitung
- Wiegen Sie 0,5 g niedrig schmelzende Agarose (siehe Materialtabelle) in einer Glasflasche und fügen Sie 25 ml phosphatgepufferte Kochsalzlösung (PBS) hinzu.
- Schmelzen Sie die Agarose, indem Sie die Lösung in einer Mikrowelle für 30-60 s kochen, wobei der Deckel geschlossen, aber nicht verschlossen ist und ständig verwirbelt wird. Stellen Sie sicher, dass Agarose vollständig gelöst ist und die Lösung nicht überkocht.
HINWEIS: Gel kann bei Raumtemperatur gelagert werden; Überprüfen Sie das Volumen vor der Verwendung, um die Verdunstung zu berücksichtigen. Vor Gebrauch in den flüssigen Zustand (Mikrowelle; 20-60 s mit Wirbelung) bringen.
2. Vorbereitung der Clearinglösung
- 9 g N,N,N′,N′-Tetrakis(2-Hydroxypropyl)-ethylendiamin, 22 g Harnstoff, 44 g Saccharose, 0,1 g Triton X-100 und 24,9 g deionisiertes Wasser (siehe Materialtabelle) wiegen.
HINWEIS: Es ist einfacher, die ungefähre Menge an N,N,N′,N′-Tetrakis(2-Hydroxypropyl)ethylendiamin zu wiegen und das Gewicht anderer Komponenten anzupassen, um die gewünschte Konzentration zu erhalten. - Erhitzen Sie die Lösung in einem 56 ° C warmen Wasserbad mit ständigem Mischen und fahren Sie fort, bis sich alle Kristalle auflösen.
- Legen Sie die Lösung bei Raumtemperatur ab, damit die beim Mischen gebildeten Blasen an die Oberfläche steigen können. Die Lösung ist bei Raumtemperatur bis zu 2 Monate stabil.
3. Sphäroidpräparation
- Erzeugen Sie Sphäroide mit der Agarose-Overlay-Methode wie zuvor beschrieben 1,3,14.
HINWEIS: Sphäroide, die mit anderen Methoden erzeugt werden, sind ebenfalls mit diesem Bildgebungsprotokoll kompatibel. - Schneiden Sie die Spitze einer 1 ml Pipettenspitze mit einem Skalpell ab, um die Öffnung zu vergrößern.
HINWEIS: Alle Sphäroide wurden mit 1 ml oder 200 μL Pipetten mit Schnittspitzen behandelt. - Mit der Pipette saugen Sie die Sphäroide aus den Vertiefungen und übertragen Sie sie in ein klares 1,5 ml konisches Rohr. Mehrere Sphäroide aus den gleichen Bedingungen können in derselben Röhre kombiniert werden.
HINWEIS: Lassen Sie die Sphäroide sich immer am Boden des Rohres absetzen, um das Medium abzusaugen. - Waschen Sie die Sphäroide zweimal in 1 ml PBS, fügen Sie neutrale 4% vorerwärmte Paraformaldehydlösung (PFA) hinzu und inkubieren Sie die Sphäroide bei 37 ° C für 20 min.
- Entfernen Sie die PFA-Lösung und waschen Sie die Sphäroide zweimal mit 1 ml PBS.
4. Sphäroid-Färbung
- Übertragen Sie mit einer Pipette bis zu 15 Sphäroide in eine 200 μL PCR-Röhre.
HINWEIS: Bei zerbrechlichen Sphäroiden montieren Sie die Sphäroide in Gel (Schritte 5.1-5.4), bevor Sie fortfahren. - Permeabilisieren Sie die Zellen mit 200 μL 0,5% Triton X-100 in PBS. Platzieren Sie PCR-Röhrchen in 50-ml-Schraubverschlussrohre und inkubieren Sie die Sphäroide 2 h lang bei Raumtemperatur mit leichtem Rühren.
HINWEIS: Alle Inkubationen erfolgen mit Bewegung auf einem Rotor, einer Walze oder einem Shaker (siehe Materialtabelle), sofern nicht anders angegeben. Dies ist wichtig, um eine gleichmäßige Färbung zu erreichen. Feste Sphäroide in PBS können manchmal an den Seiten der Pipettenspitze haften. Das Spülen der Spitze in 0,5% Triton X-100 minimiert das Anhaften der Sphäroide an den Spitzen. - Die Lösung (Schritt 4.2) wird durch 200 μL Antikörper-Verdünnungspuffer (ABDIL)15 ersetzt und über Nacht bei Raumtemperatur inkubiert.
- Entfernen Sie ABDIL, fügen Sie 75 μL primären Antikörper in ABDIL hinzu und inkubieren Sie bei 4 ° C für 2,5 Tage.
- Den Überstand entfernen und mit 200 μL PBS mit 0,1% Tween und 0,1% Triton X-100 (PBS-TT) zweimal waschen und mit 200 μL PBS-TT für 4 h bei Raumtemperatur inkubieren.
- Entfernen Sie PBS-TT, fügen Sie 100 μL sekundären Antikörper in ABDIL hinzu und inkubieren Sie bei 4 °C für 2,5 Tage.
HINWEIS: DAPI oder ein anderer Kernfarbstoff kann in diesem Stadium hinzugefügt werden. Die meisten Farbstoffe benötigen weniger Inkubationszeit als Antikörper. - Entfernen Sie den Überstand und waschen Sie ihn zweimal mit 200 μL PBS-TT und inkubieren Sie ihn mit 200 μL PBS-TT für 4 h. Die Sphäroide sind montagefertig.
5. Montage
- Mit einer 200-μL-Pipette werden fixierte und gefärbte Sphäroide bei einem Röhrchen pro Zustand (ca. 10-15 Sphäroide) auf 500-μL-PCR-Röhrchen übertragen.
- Ersetzen Sie die Lösung durch 200 μL 2% (w/v) flüssiges Agarosegel und zentrifugieren Sie auf dem Quick Spin (bei der festen maximalen Geschwindigkeit, siehe Materialtabelle) bei Raumtemperatur für 30 s.
HINWEIS: Wenn Sie nicht sofort montiert werden, legen Sie sie in einen Heizblock bei 50 ° C, um eine Gelverhärtung zu vermeiden. - Die Sphäroide in ~ 50 μL flüssigem Agarosegel absaugen und in einer 24-Well-Glasbodenplatte dosieren.
- Bevor das Gel aushärtet, trennen Sie die Sphäroide mit einer Pipettenspitze im umgebenden Gel und stellen Sie sicher, dass die Sphäroide mit Gel bedeckt sind. Optional legen Sie die Platte auf Eis, um das Gel schnell zu setzen.
HINWEIS: Die Anzahl der Sphäroide pro Bohrloch hängt von der Größe der Sphäroide ab. Sphäroide sind weit voneinander entfernt, so dass nur ein Sphäroid während der Bildgebung in das Sichtfeld eintritt. Dies ist wichtig für die automatisierte Bildverarbeitung. - Fügen Sie 500 μL Klärlösung (Schritt 2) pro Vertiefung hinzu, um sicherzustellen, dass das Gel untergetaucht ist. Inkubieren Sie bei RT für mindestens 24 h und bilden Sie die Sphäroide in der Clearinglösung ab. Sphäroide sind in dieser Lösung bis zu einem Monat bei Raumtemperatur und vor Verdunstung geschützt.
6. Bildgebung
- Wählen Sie ein Objektiv mit einem Arbeitsabstand, der lang genug ist, um das gesamte Sphäroid einschließlich der Montagehöhe des Sphäroids im Behälter zu umfassen.
HINWEIS: Objektive mit einem Arbeitsabstand von 3 mm oder mehr sind erforderlich, um die Äquatorebene der Sphäroide abzubilden. Höhere Vergrößerungsobjektive mit höherer NA können eine bessere Auflösung ermöglichen, begrenzen jedoch die maximale Tiefe, in der die Sphäroide abgebildet werden können. - Um die Äquatorialebene zu identifizieren, passen Sie den Fokus an, bis die größte Oberfläche in der XY-Ebene erreicht ist, und bilden Sie das Bild mit den erforderlichen Laserleistungsprozentsätzen, der Detektorspannung, der Verstärkung und den Offset-Einstellungen ab.
HINWEIS: Der Prozentsatz der Laserleistung, die Detektorspannung, die Verstärkung und der Versatz variieren stark in Abhängigkeit von Fluorophor, Färbeintensität, Laserintensität, Detektorempfindlichkeit usw. - Stellen Sie für 3D-Bilder den Anfang und das Ende der Sphäroide ein und wählen Sie die geeignete Signalintensität in verschiedenen Z-Tiefen, indem Sie die Z-Intensitätskorrektureinstellungen vor der Bildgebung verwenden.
HINWEIS: Für die beste Bildauflösung verwenden Sie die Nyquist-Abtastrate für x, y und z (Details siehe Referenz16).
Ergebnisse
Um die Fähigkeit dieser Clearing-Methode zu demonstrieren, qualitativ hochwertige zwei- und dreidimensionale Bilder zu liefern, wurden Sphäroide mit Durchmessern von 300-600 μm aus Fluoreszenten Ubiquitinationsbasierten C ell Cycle Indicator (FUCCI) transduzierten Melanomzelllinien FUCCI-WM164 und FUCCI-WM983b 9,17 gezüchtet. , die monomere Kusabira Orange2 (mKO2) und monomere Azami Green (mAG) Proteine exprimieren, wenn sie sich in Gap1 befinden, und frühe S-Phase / Gap2 / Mitose Phase des Zellzyklus, bzw. gemäß den in Schritt 3 1,3,14 vorgesehenen Verfahren. Die Sphäroide wurden dann mit 4%iger Formaldehydlösung bei 37 °C fixiert, permeabilisiert und mit Anti-p27Kip1/Anti-Kaninchen Alexa Fluor 647 Anti-Pimonidazol/Anti-Maus Alexa Fluor 647, DAPI oder DRAQ7 (siehe Materialtabelle) angefärbt (Abbildung 2). Alle Mikroskopiedateien werden in das GitHub-Repository (https://github.com/ap-browning/SpheroidMounting) hochgeladen. Im Vergleich zu PBS-montierten Sphäroiden liefert die Clearing-Lösung hochklare Bilder mit minimaler Größenverzerrung (Abbildung 2A). Das Protokoll ermöglicht eine hochauflösende Abbildung von Details auf zellulärer Ebene tiefer in die Sphäroide ohne histologische Schnitte, und das Querschnittsbild wurde von einem 20-fachen Luftobjektiv (0,7 NA) mit einer Auflösung von 4096 x 4096 px ohne Stitching erhalten (Abbildung 2B). Unter Verwendung eines Objektivs mit geringerer Vergrößerung und geringerer numerischer Apertur mit einem längeren Arbeitsabstand können konfokale 3D-Bilder erhalten werden, die in einer Tiefe von mindestens 200 μm Details auf zellulärer Ebene liefern (Abbildung 2C). Sphäroide wurden auch kryosektiert und gefärbt gemäß dem Protokoll von Spoerri et al.4 und verglichen mit der gesamten Sphäroidfärbung (Abbildung 2D, E). Abbildung 2D zeigt die hypoxische Region des mit Pimonidazol angefärbten Sphäroids, und Abbildung 2E zeigt p27kip1-Färbung, die den Zellzyklusstillstand (gelb) und die DAPI-Kernfärbung (grau) markiert. Proteinlokalisation und Färbemuster sind zwischen Kryosektion und Clearing ähnlich und werden daher von dieser Clearingmethode nicht beeinflusst.
Die Signalintensitätskorrektur in z ermöglicht die Abbildung des gesamten Sphäroides. Die Lichtstreuung aufgrund des nekrotischen Kerns schränkt jedoch die Fähigkeit ein, die Rückseite des Sphäroides abzubilden. Eine tiefere Penetration und geringere Streuung eines fernroten Fluorophors, wie z.B. der DRAQ7-Kernfärbung, ermöglicht eine noch weiter verbesserte Darstellung der 3D-Sphäroidstruktur (Abbildung 3). Film 1 zeigt das 3D-Rendering der mit DRAQ7 gefärbten FUCCI-Sphäroide. Eine dünnere Z-Scheibe kann eine bessere Z-Auflösung ermöglichen, aber dies erhöht die Abbildungszeit und das Photobleichen der Fluorophore erheblich.
Um festzustellen, ob die Clearinglösung eine Größenverzerrung verursacht, wurden zwölf Sphäroide in 2%igem Agarose-PBS-Gel nach der Einführung der Clearinglösung bei 6 h, 12 h, 24 h, 72 h und 168 h abgebildet. Die Bilder wurden zusammengefasst, indem der Durchmesser des Sphäroides bestimmt wurde, der auf der Grundlage einer Kugel mit der gleichen Querschnittsfläche wie das Sphäroid definiert wurde (Abbildung 4A). Während beobachtet wird, dass die Sphäroide in den ersten 6 h leicht an Größe zunehmen, was durch eine Durchmesserfaltenänderung zwischen 2% und 6% angezeigt wird (Abbildung 4B), kehren die Sphäroide nach 24 h bis 72 h zu einer Größe zurück, die ungefähr der entsprechenden Größe bei der PBS-Post-PFA-Fixierung entspricht (Abbildung 4C).
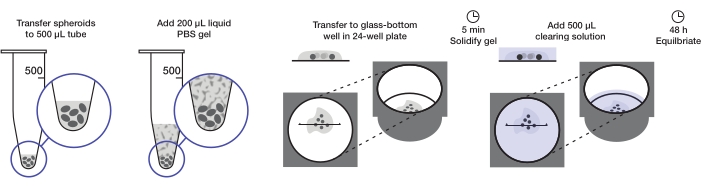
Abbildung 1: Abbildung des Sphäroid-Montage- und Clearing-Protokolls. Feste und gefärbte Sphäroide werden in eine 500-μL-Röhre überführt; überschüssige Flüssigkeit wird durch 200 μL Agarose-PBS-Gel ersetzt und zentrifugiert. Sphäroide werden dann in eine Glasbodenvertiefung in einer 24-Well-Platte übertragen. Nachdem das Gel erstarrt ist, wird 500 μL Clearinglösung zugegeben und Sphäroide werden ausgeglichen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
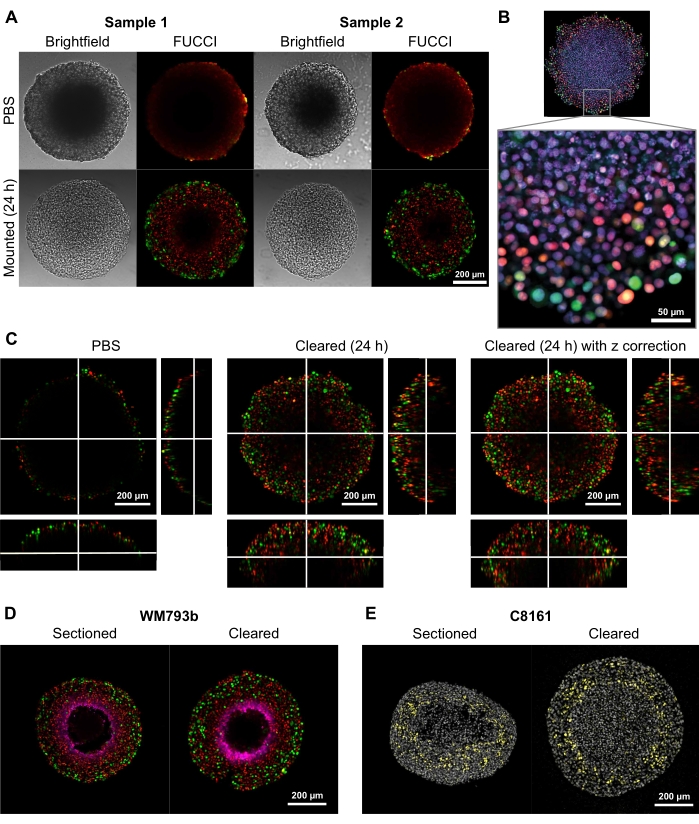
Abbildung 2: Vergleich von geclearten und ungeklärten FUCCI humanen Melanom-Sphäroiden. Die Färbung zeigt Zellkerne an, die positiv auf mKO2 (rot) sind, was auf Zellen in Lücke 1 hinweist; und Zellkerne, die positiv für mAG sind (grün), was auf Zellen in Lücke 2 hinweist. (A) Sphäroide, die aus 5000 FUCCI-WM983b-Zellen gezüchtet und am Tag 10 geerntet und in Agarose-PBS-Gel und 24 h nach Zugabe der Klärlösung abgebildet wurden. Der Vergleich von Hellfeld- und konfokalen Bildern vor und nach der Clearing-Lösung zeigt eine minimale Größenverzerrung und einen großen Gewinn an Klarheit. Die Bilder werden mit einem 10-fachen Objektiv aufgenommen. (B) Sphäroide, die aus FUCCI-WM164-Zellen gezüchtet wurden, die mit Triton X-100 permeabilisiert und mit DRAQ7 gefärbt wurden, färben alle Zellkerne. Das Bild wird mit einem 20-fachen Objektiv (0,75 NA) aufgenommen, was zeigt, dass die Clearing-Lösung eine hochauflösende Bildgebung von Details auf Zellebene ermöglicht. (C) 3D-Bilder (10x, 0,4 NA) wurden von FUCCI-WM164-Sphäroiden in PBS und 24 Stunden nach Zugabe der Clearinglösung erhalten. Die Anpassung von Laserleistung, Spannung und Offset an verschiedenen Z-Ebenen ermöglicht eine tiefere Abbildung innerhalb des Sphärosions. (D,E) Vergleich zwischen Kryosektion und gereinigtem ganzen Sphäroid, gefärbt für Pimonidazol und p27kip1. (D) Die Pimonidazol-Färbung in Magenta zeigt die hypoxische Region in den Sphäroiden. Rot und Grün stehen für FUCCI. (E) Kryosektionen und gereinigtes Sphäroid mit DAPI (grau) und p27kip1 (gelb). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
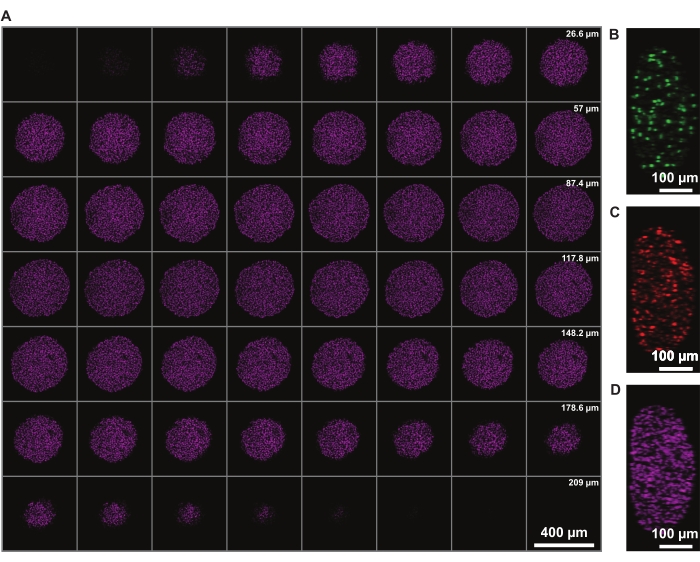
Abbildung 3: Das Clearing ermöglicht eine tiefere Abbildung in das Sphäroid mit minimalem Lichtverlust. Konfokale Mikroskopieaufnahmen eines FUCCI menschlichen Melanomsphäroids mit 10-facher Vergrößerung und niedrigerem NA (0,4), was eine Bildgebung bei höherer z-Tiefe bei minimalem Signalverlust ermöglicht. (A) 3,88 μm Scheiben von Sphäroidkernen, die mit DRAQ7 angefärbt sind. (B-D) y/z-Auflösung in den Kanälen 488 (mAG), 568 (mKO2) bzw. 647 nm (DRAQ7). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
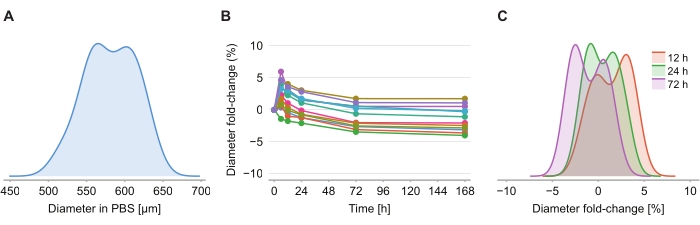
Abbildung 4: Die Clearinglösung hat nur minimale Auswirkungen auf die Sphäroidgröße. (A) Verteilung der anfänglichen Sphäroidgröße (äquivalenter Durchmesser) in PBS-Gel (n = 12 Sphäroide). (B) Durchmesserfaltenänderung im Laufe der Zeit seit Zugabe der Clearinglösung. Bei 0 h sind Sphäroide nur in PBS-Gel enthalten. (C) Verteilung der Durchmesserfaltenänderungen bei 12 h, 24 h und 72 h. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Film 1: 3D-Rendering eines mit DRAQ7 gefärbten FUCCI-Sphäroids. Bitte klicken Sie hier, um diesen Film herunterzuladen.
Diskussion
Ein Protokoll zur Gewinnung hochwertiger zwei- und dreidimensionaler Bilder von Tumorsphäroiden wird hier vorgestellt. Bestehende Methoden wie CLARITY, See deep brain (SeeDB) und ScaleS verursachen oft eine Größenverzerrung um bis zu 30%, während Techniken wie Benzylalkohol / Benzylbenzoat (BABB) und 3D-Bildgebung von lösungsmittelgeclearten Organen (3DISCO) fluoreszierendes Protein18 löschen können. Viele dieser Methoden sind darauf ausgelegt, Gewebe mit struktureller Integrität zu reinigen und die Größe und Struktur zu verzerren, wenn sie auf Sphäroide18 angewendet werden. Im Gegensatz zu anderen Protokollen, die kommerziell erhältliche teure Clearing-Lösungen verwenden, verwendet dieses Protokoll leicht verfügbare Verbrauchsmaterialien unter Beibehaltung der optischen Klarheit und der endogenen Fluoreszenz und minimiert die Größenverzerrung. Die Einbettung von Sphäroiden in Agarose-PBS-Gel bietet strukturelle Unterstützung für Sphäroide und minimiert den osmotischen Schock, wenn die Clearinglösung hinzugefügt wird. Dies ist entscheidend bei der Abbildung von zerbrechlichen Sphäroiden nach der medikamentösen Behandlung. Es wird angenommen, dass diese optische Clearingmethode für Sphäroide geeignet ist, die mit einer beliebigen Methode gebildet werden, da dieses Protokoll von der Reinigung des gesamten Gewebes übernommen wurde. Die Annahme basiert auf der Ähnlichkeit der Sphäroide, die durch verschiedene Sphäroidbildungsmethoden erhalten werden. Die Wahl des Fixativums kann die Sphäroidgröße sowie die endogene Fluoreszenz beeinflussen. Diese Clearingmethode eignet sich für Sphäroide, die mit neutraler 4%iger PFA-Lösung fixiert sind. Weitere Tests sind erforderlich, um die Kompatibilität mit anderen Fixiermitteln zu überprüfen.
Da diese Technik es ermöglicht, mehrere Sphäroide gleichzeitig in einer Multi-Well-Platte zu montieren, eignet sie sich gut für quantitative Analysepipelines, die Sphäroidstrukturinformationen von bis zu 360 Sphäroiden pro 24-Well-Platte erfordern. Mikroskope mit automatisierten Tisch- und Plattenkartierungsfunktionen können die Bildgebung weniger manuell machen. Obwohl diese Methode schneller und einfacher ist als das Schneiden, ist sie derzeit für eine vollständige Automatisierung ungeeignet. Die mit diesem Verfahren erhaltenen Bilder eignen sich jedoch für die automatisierte Bildverarbeitung 4,19, und die Geschwindigkeit, mit der Sphäroide mit diesem Protokoll montiert werden können, ermöglicht eine quantitative Analyse der Sphäroid-Innenstruktur20,21,22.
Für die Färbung ganzer Sphäroide müssen die Antikörperkonzentration, das Volumen und die Inkubationszeit für jeden Antikörper optimiert werden. Verwenden Sie als Leitfaden 2,5x der empfohlenen 2D-Immunfluoreszenz-Antikörperkonzentration und 100-200 μL Antikörper, abhängig von der Anzahl der Sphäroide pro Röhrchen. Stellen Sie sicher, dass alle Sphäroide auf dem Rotor mit Färbelösung bedeckt sind. Die Inkubationszeit hängt von vielen Faktoren ab, einschließlich der Größe und Dichte von Sphäroiden und des Antikörpers, und kann zwischen 16 und 72 h liegen. Trotz der Methode, die eine Signaldetektion tiefer im Sphäroid ermöglicht, verursachen durch UV angeregte Fluorophore eine signifikante Lichtstreuung, was zu einem niedrigen Signal-Rausch-Verhältnis führt. Bei der Auswahl von Fluorophoren ist Vorsicht geboten, um das Zielprotein sichtbar zu machen. Zum Beispiel wird die Färbung von weniger reichlich vorhandenen und strukturellen Proteinen mit längerwelligen Fluorophoren und mehr reichlich vorhandenem Protein oder Kernflecken mit kürzerwelligen Fluorophoren das beste Ergebnis erzielen. Schließlich zeigen gereinigte Sphäroide immer noch Lichtverluste aufgrund von Streuung im nekrotischen Kern, was sich in der y/z-Dimension von Bildern von 600 μm Sphäroiden zeigt (Abbildung 2C).
Bildgebung mit höherer Vergrößerung mit höheren NA-Objektiven ist mit Sphäroiden möglich, die mit diesem Protokoll montiert und gelöscht werden, aber der Arbeitsabstand des Objektivs begrenzt die Abbildungstiefe. Für eine Öltauchlinse ist es wichtig, Öl zu verwenden, das einen RI von 1,51 hat, um das beste Ergebnis zu erzielen.
Zusammenfassend lässt sich sagen, dass die eingebettete Agarose-PBS-Gel-Clearing-Methode die Visualisierung von Zellen tief in Sphäroiden mit allgemein verfügbaren Verbrauchsmaterialien ermöglicht. Sphäroide, die mit dieser Methode montiert und gelöscht werden, unterliegen einer minimalen Größenverzerrung und behalten ihre strukturelle Integrität bei, was die Erfassung hochwertiger Daten in Bezug auf die innere Sphäroidstruktur und die anschließende automatisierte Quantifizierung ermöglicht.
Offenlegungen
Olympus beteiligte sich an den Kosten der Veröffentlichung.
Danksagungen
Diese Forschung wurde am Translational Research Institute (TRI), Woolloongabba, QLD, durchgeführt. TRI wird durch einen Zuschuss der australischen Regierung unterstützt. Wir danken den Mitarbeitern in der Kerneinrichtung für Mikroskopie bei TRI für ihre hervorragende technische Unterstützung. Wir danken Prof. Atsushi Miyawaki, RIKEN, Wako-city, Japan, für die Bereitstellung der FUCCI-Konstrukte, Prof. Meenhard Herlyn und Frau Patricia Brafford, The Wistar Institute, Philadelphia, PA, für die Bereitstellung der Zelllinien. Wir danken Dr. Loredana Spoerri für die Bereitstellung von C8161-Kryosegmentbildern.
Diese Arbeit wurde durch Projektzuschüsse an N.K.H.: Australian Research Council (DP200100177) und Meehan Project Grant (021174 2017002565) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| #1.5 glass bottom 24-well plate | Celvis | P24-1.5H-N | |
| 500 µL clear PCR tubes | Sigma | HS4422 | |
| Alexa Fluor 647 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson Immuno research | 715-605-151 | Dilution used 1:500 |
| Bovine serum albumin | Sigma | A7906 | Final concentration 2% w/v |
| DAPI | Sigma | D9542-10MG | Final concentration 5 µg/mL |
| Deionized water | MILLI Q | ||
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Thermofisher | A-31573 | Dilution used 1:500 |
| DRAQ7 | Thermofisher | D15106 | Dilution used 1:250 |
| Heating block | Ratek | DBH10 | or similar equipment |
| Hypoxyprobe Kits | Hypoxyprobe | HP1-1000Kit | Antibody dilution used 1:500 |
| Low-melting agarose powder | Sigma | A9414 | Final concentration 2% w/v |
| Microwave | Sharp | ||
| N,N,N′,N′-Tetrakis(2-Hydroxypropyl)ethylenediamine | Sigma | 122262 | Final concentration 9% w/w |
| NaCl | Sigma | S9888 | Final concentration 150 mM |
| NaN3 | Sigma | S2002 | Final concentration 0.10% w/v |
| p27 Kip1 (D69C12) XP | Cell Signalling technology | 3686S | Dilution used 1:500 |
| Paraformaldehyde solution | Proscitech | C004 | Final concentration 4% w/v |
| Phosphate Buffered Saline (PBS) | Thermofisher | 18912014 | Final concentration 1x |
| Pipette | Eppendorf | ||
| Quickspin minifuge | or similar equipment | ||
| Roller | Ratek | BTR10-12V | or similar equipment |
| Rotor | Ratek | RSM7DC | or similar equipment |
| Shaker | Ratek | EOM5 | or similar equipment |
| Sucrose | Sigma | S9378 | Final concentration 44% w/w |
| Tris-HCl pH 7.4 | Sigma | T5941 | Final concentration 20 mM |
| Triton X-100 | Sigma | X100 | Final concentration 0.10% v/v |
| Triton X-100 | Sigma | X100 | Final concentration 0.1% v/v |
| Tween 20 | Sigma | P1379 | Final concentration 0.1% v/v |
| Urea | Sigma | U5379 | Final concentration 22% w/w |
Referenzen
- Beaumont, K. A., Anfosso, A., Ahmed, F., Weninger, W., Haass, N. K. Imaging- and flow cytometry-based analysis of cell position and the cell cycle in 3D melanoma spheroids. Journal of Visualized Experiments. (106), e53486 (2015).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Smalley, K. S., Lioni, M., Noma, K., Haass, N. K., Herlyn, M. In vitro three-dimensional tumor microenvironment models for anticancer drug discovery. Expert Opinion on Drug Discovery. 3 (1), 1-10 (2008).
- Spoerri, L., Gunasingh, G., Haass, N. K. Fluorescence-based quantitative and spatial analysis of tumour spheroids: A proposed tool to predict patient-specific therapy response. Frontiers in Digital Health. 3, 668390 (2021).
- Nürnberg, E., et al. Routine optical clearing of 3D-cell cultures: Simplicity forward. Frontiers in Molecular Biosciences. 7, 20 (2020).
- Kabadi, P. K., et al. Into the depths: Techniques for in vitro three-dimensional microtissue visualization. BioTechniques. 59 (5), 279-286 (2015).
- Ivanov, D. P., Grabowska, A. M. Spheroid arrays for high-throughput single-cell analysis of spatial patterns and biomarker expression in 3D. Scientific Reports. 7, 41160 (2017).
- Spoerri, L., et al. Phenotypic melanoma heterogeneity is regulated through cell-matrix interaction-dependent changes in tumor microarchitecture. bioRxiv. , (2021).
- Haass, N. K., et al. Real-time cell cycle imaging during melanoma growth, invasion, and drug response. Pigment Cell & Melanoma Research. 27 (5), 764-776 (2014).
- Ahmad, A., et al. Clearing spheroids for 3D fluorescent microscopy: combining safe and soft chemicals with deep convolutional neural network. bioRxiv. , 428996 (2021).
- Villani, T., Rossi, A. E., Sherman, H. Image-based characterization of 3-D cell culture models grown in spheroid microplates. American Laboratory. 50 (6), 12 (2018).
- Lloyd-Lewis, B., et al. Imaging the mammary gland and mammary tumours in 3D: optical tissue clearing and immunofluorescence methods. Breast Cancer Research. 18 (1), 127 (2016).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159 (4), 911-924 (2014).
- Spoerri, L., Beaumont, K. A., Anfosso, A., Haass, N. K. Real-time cell cycle imaging in a 3D cell culture model of melanoma. Methods in Molecular Biology. 1612, 401-416 (2017).
- Cold Spring Harbor. Antibody Dilution Buffer (Abdil). Cold Spring Harbor Protocols. , (2018).
- Pawley, J. B., Pawley, J. B. . Handbook Of Biological Confocal Microscopy. , 20-42 (2006).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Tian, T., Yang, Z., Li, X. Tissue clearing technique: Recent progress and biomedical applications. Journal of Anatomy. 238 (2), 489-507 (2021).
- Browning, A. P., Murphy, R. J. . Zenodo. , (2021).
- Browning, A. P., et al. Quantitative analysis of tumour spheroid structure. eLife. 10, 73020 (2021).
- Klowss, J. J., et al. A stochastic mathematical model of 4D tumour spheroids with real-time fluorescent cell cycle labelling. Journal of The Royal Society Interface. 19 (189), 20210903 (2022).
- Murphy, R. J., Browning, A. P., Gunasingh, G., Haass, N. K., Simpson, M. J. Designing and interpreting 4D tumour spheroid experiments. Communications Biology. 5 (1), 91 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten