ट्यूमर स्फेरॉइड के अर्ध-उच्च-थ्रूपुट विश्लेषण के लिए रैपिड ऑप्टिकल क्लियरिंग
In This Article
Summary
ट्यूमर सेल-माइक्रोएन्वायरमेंट इंटरैक्शन और थेरेपी प्रतिक्रिया का आकलन करने के लिए ट्यूमर स्फेरॉइड का तेजी से उपयोग किया जा रहा है। वर्तमान प्रोटोकॉल तेजी से ऑप्टिकल समाशोधन का उपयोग कर3 डी ट्यूमर स्फेरॉइड के अर्ध-उच्च-थ्रूपुट इमेजिंग के लिए एक मजबूत लेकिन सरल विधि का वर्णन करता है।
Abstract
ट्यूमर स्फेरॉइड तेजी से बुनियादी कैंसर अनुसंधान और दवा विकास में आम हो रहे हैं। सेलुलर स्तर पर गोलाकार के भीतर प्रोटीन अभिव्यक्ति के बारे में डेटा प्राप्त करना विश्लेषण के लिए महत्वपूर्ण है, फिर भी मौजूदा तकनीकें अक्सर महंगी, श्रमसाध्य होती हैं, गैर-मानक उपकरणों का उपयोग करती हैं, महत्वपूर्ण आकार विरूपण का कारण बनती हैं, या अपेक्षाकृत छोटे स्फेरॉइड तक सीमित होती हैं। यह प्रोटोकॉल स्फेरॉइड की आंतरिक संरचना के कॉन्फोकल विश्लेषण की अनुमति देते हुए इन मुद्दों को संबोधित करने वाले स्फेरॉइड को माउंट करने और समाशोधन करने की एक नई विधि प्रस्तुत करता है। मौजूदा दृष्टिकोण के विपरीत, यह प्रोटोकॉल मानक उपकरण और प्रयोगशाला आपूर्ति का उपयोग करके बड़ी संख्या में स्फेरॉइड के तेजी से बढ़ते और समाशोधन के लिए प्रदान करता है। अपवर्तक-सूचकांक-मिलान समाशोधन समाधान शुरू करने से पहले पीएच-तटस्थ एगरोज़-पीबीएस जेल समाधान में बढ़ते स्फेरॉइड अन्य समान तकनीकों के लिए आम आकार विरूपण को कम करते हैं। यह विस्तृत मात्रात्मक और सांख्यिकीय विश्लेषण की अनुमति देता है जहां आकार माप की सटीकता सर्वोपरि है। इसके अलावा, तरल समाशोधन समाधानों की तुलना में, एगरोज़ जेल तकनीक स्फेरॉइड को जगह में तय रखती है, जिससे त्रि-आयामी (3 डी) कॉन्फोकल छवियों के संग्रह की अनुमति मिलती है। वर्तमान लेख में विस्तार से बताया गया है कि विधि उच्च गुणवत्ता वाले दो- और 3 डी छवियों को कैसे उत्पन्न करती है जो अंतर-सेल परिवर्तनशीलता और आंतरिक गोलाकार संरचना के बारे में जानकारी प्रदान करती हैं।
Introduction
त्रि-आयामी (3 डी) सेल संस्कृतियां, जैसे कि स्फेरॉइड, कुल सेल विकास 1,2 के जैविक रूप से यथार्थवादी और प्रतिलिपि प्रस्तुत करने योग्य मॉडल प्रदान करती हैं। ये मॉडल बुनियादी अनुसंधान और दवा विकास दोनों में तेजी से आम हो रहे हैं, जहां दवा प्रभावकारिता 3,4 का पता लगाने के लिए उपचारके बीच गोलाकार आकार और संरचना में अंतर की जांच की जाती है। इन संदर्भों में, बड़ी संख्या में स्फेरॉइड से विस्तृत जानकारी एकत्र करने की क्षमता अत्यधिक फायदेमंद है, दोनों सांख्यिकीय शक्ति परिप्रेक्ष्य से और कई उपचारों में सेल व्यवहार के तेजी से मूल्यांकन की अनुमति देने के लिए।
स्फेरॉइड संरचना की विस्तृत माइक्रोस्कोपी छवियों को प्राप्त करने के लिए आमतौर पर उपयोग की जाने वाली तकनीकें या तो समय लेने वाली, महंगी होती हैं, या खराब गुणवत्ता वाली छवियों का उत्पादन करती हैं जो गोलाकार आकार 4,5 जैसी प्रमुख मात्रात्मक विशेषताओं को बरकरार नहीं रखती हैं। उदाहरण के लिए, क्रायोसेक्शनिंग पर आधारित हिस्टोलॉजिकल तकनीकें उच्च गुणवत्ता वाली छवियां प्रदान कर सकती हैं, लेकिन अक्सर समय लेने वाली होती हैं, कुशल श्रम की आवश्यकता होती है, और अक्सर सेक्शनिंग कलाकृतियों 6,7 का निर्माण करती हैं, जबकि सुरुचिपूर्ण प्रौद्योगिकियां, जैसे कि एकल विमान रोशनी माइक्रोस्कोपी (एसपीआईएम) 8 और मल्टीफोटॉन माइक्रोस्कोपी9 को विशेष माइक्रोस्कोप की आवश्यकता होती है जो आसानी से उपलब्ध नहीं होते हैं। आधुनिक माइक्रोस्कोपी प्रौद्योगिकियों ने हाल ही में तथाकथित ऑप्टिकल सेक्शनिंग को सक्षम किया है, जहां स्फेरॉइड को अपवर्तक सूचकांक मिलान समाशोधन समाधान के भीतर रखा जाता है और कॉन्फोकल माइक्रोस्कोपी 4,5 का उपयोग करके छवियां प्राप्त की जाती हैं। जबकि इन तकनीकों में उच्च उपज का उत्पादन करने की क्षमता है, सामान्य समस्याओं में इमेजिंग करते समय गोलाकार आंदोलन, समाशोधन करते समय आकार विरूपण और मालिकाना समाशोधन समाधानों का उच्च व्यय शामिल है। इसके अलावा, कई मौजूदा प्रोटोकॉल केवल 300 μm से कम व्यास या 100 μm तक गहराई के अपेक्षाकृत छोटे स्फेरॉइड पर लागू होते हैं, जो प्रौद्योगिकी को ट्यूमर के विकास 5,10,11 के शुरुआती चरणों तक सीमित करते हैं।
वर्तमान प्रोटोकॉल पूरे अंग समाशोधन प्रक्रियाओं12,13 से प्राप्त कम लागत अपवर्तक सूचकांक मिलान समाशोधन समाधान का उपयोग कर विस्तृत गोलाकार छवियों के अर्ध-उच्च-थ्रूपुट, उच्च उपज संग्रह की अनुमति देता है। इमेजिंग के दौरान गोलाकार आंदोलन को रोकने और आकार विरूपण को कम करने के लिए संरचनात्मक सहायता प्रदान करने के लिए, स्फेरॉइड को 24-अच्छी तरह से # 1.5 ग्लास बॉटम प्लेट में एगरोज़-पीबीएस जेल में रखा जाता है। चूंकि यह तकनीक 24-अच्छी तरह से प्लेट में प्रत्येक कुएं में कई स्फेरॉइड को घुड़सवार करने की अनुमति देती है, इसलिए 360 स्फेरॉइड (15 स्फेरॉइड / आसानी से उपलब्ध उपभोग्य सामग्रियों से निर्मित एक अपवर्तक-सूचकांक-मिलान समाशोधन समाधान का उपयोग घुड़सवार स्फेरॉइड और आसपास के जेल को ऑप्टिकल रूप से साफ करने के लिए किया जाता है। 24 घंटे की निपटान अवधि के बाद, यह प्रोटोकॉल 2% से कम आकार विरूपण के साथ अपेक्षाकृत बड़े स्फेरॉइड (व्यास में लगभग 700 μm) के लिए भी गोलाकार संरचना की उच्च गुणवत्ता वाले 2 डी और 3 डी छवियां प्रदान करता है।
Protocol
प्रोटोकॉल ट्यूमर स्फेरॉइड की पर्याप्त मात्रा की तैयारी का वर्णन करता है ताकि एक 24-अच्छी तरह से प्लेट (लगभग 240-360 स्फेरॉइड या 10-15 स्फेरॉइड / अच्छी तरह से) को 200 μL एगरोज़ जेल प्रति अच्छी तरह से और 500 μL समाशोधन समाधान प्रति अच्छी तरह से माउंट किया जा सके। पूरी प्रक्रिया चित्रा 1 में सचित्र है।
1. 2% एगरोज़-पीबीएस जेल तैयारी
- एक कांच की बोतल में कम पिघलने वाले एगरोज के 0.5 ग्राम वजन ( सामग्री की तालिका देखें) और फॉस्फेट-बफर खारा (पीबीएस) के 25 मिलीलीटर जोड़ें।
- ढक्कन बंद नहीं होने और लगातार घूमने के साथ 30-60 एस के लिए माइक्रोवेव में घोल को उबालकर एगरोज़ को पिघलाएं। सुनिश्चित करें कि एगरोज़ पूरी तरह से भंग हो गया है और समाधान उबलता नहीं है।
नोट: जेल कमरे के तापमान पर संग्रहीत किया जा सकता है; वाष्पीकरण के लिए खाते में उपयोग करने से पहले मात्रा की जांच करें। उपयोग करने से पहले तरल अवस्था (माइक्रोवेव; घुमावदार के साथ 20-60 एस) में लाएं।
2. समाशोधन समाधान की तैयारी
- एन, एन, एन', एन'-टेट्राकिस (2-हाइड्रोक्सीप्रोपिल) एथिलीनडियामाइन, 22 ग्राम यूरिया, 44 ग्राम सुक्रोज, ट्राइटन एक्स -100 के 0.1 ग्राम और 24.9 ग्राम विआयनीकृत पानी का वजन करें (सामग्री की तालिका देखें)।
नोट: एन, एन, एन', एन'-टेट्राकिस (2-हाइड्रॉक्सीप्रोपिल) एथिलीनेडियामाइन की अनुमानित मात्रा का वजन करना और वांछित एकाग्रता प्राप्त करने के लिए अन्य घटकों के वजन को समायोजित करना आसान है। - निरंतर मिश्रण के साथ 56 डिग्री सेल्सियस पानी के स्नान में समाधान को गर्म करें और सभी क्रिस्टल भंग होने तक जारी रखें।
- मिश्रण के दौरान गठित बुलबुले को सतह पर बढ़ने की अनुमति देने के लिए कमरे के तापमान पर समाधान को आराम दें। समाधान 2 महीने तक कमरे के तापमान पर स्थिर है।
3. गोलाकार तैयारी
- एगरोज़ ओवरले विधि का उपयोग करके स्फेरॉइड उत्पन्न करें जैसा कि पहले 1,3,14 वर्णित है।
नोट: अन्य तरीकों से उत्पन्न स्फेरॉइड भी इस इमेजिंग प्रोटोकॉल के साथ संगत हैं। - छिद्र को बड़ा करने के लिए एक स्केलपेल का उपयोग करके 1 एमएल पिपेट टिप की नोक काटें।
नोट: सभी स्फेरॉइड को कट युक्तियों के साथ 1 एमएल या 200 μL पिपेट के साथ संभाला गया था। - पिपेट का उपयोग करके, कुओं से स्फेरॉइड की आकांक्षा करें और उन्हें एक स्पष्ट 1.5 एमएल शंक्वाकार ट्यूब में स्थानांतरित करें। एक ही स्थिति से कई स्फेरॉइड को एक ही ट्यूब में जोड़ा जा सकता है।
नोट: हमेशा मध्यम की आकांक्षा करने के लिए स्फेरॉइड को ट्यूब के नीचे बसने की अनुमति दें। - 1 एमएल पीबीएस में स्फेरॉइड को दो बार धोएं, तटस्थ 4% पूर्व-गर्म पैराफॉर्मलडिहाइड (पीएफए) समाधान जोड़ें, और 20 मिनट के लिए 37 डिग्री सेल्सियस पर स्फेरॉइड सेते हैं।
- पीएफए समाधान निकालें और पीबीएस के 1 एमएल के साथ दो बार स्फेरॉइड धो लें।
4. गोलाकार धुंधला
- एक विंदुक का उपयोग कर, एक 200 μL पीसीआर ट्यूब में 15 स्फेरॉइड तक स्थानांतरण।
नोट: नाजुक स्फेरॉइड के लिए, आगे बढ़ने से पहले जेल (चरण 5.1-5.4) में स्फेरॉइड माउंट करें। - पीबीएस में 0.5% ट्राइटन एक्स -100 के 200 μL का उपयोग करके कोशिकाओं को पारगम्य करें। 50 एमएल स्क्रू-कैप ट्यूबों के अंदर पीसीआर ट्यूब रखें और हल्के आंदोलन के साथ कमरे के तापमान पर 2 घंटे के लिए स्फेरॉइड सेते हैं।
नोट: सभी ऊष्मायन एक रोटर, रोलर, या शेकर पर आंदोलन के साथ किए जाते हैं ( सामग्री की तालिका देखें) जब तक कि अन्यथा निर्दिष्ट न किया जाए। यह समान धुंधला प्राप्त करने के लिए महत्वपूर्ण है। पीबीएस में फिक्स्ड स्फेरॉइड कभी-कभी पिपेट टिप के किनारों से चिपक सकते हैं। 0.5% ट्राइटन एक्स -100 में टिप को धोने से स्फेरॉइड को युक्तियों से चिपकने से कम किया जाता है। - एंटीबॉडी कमजोर पड़ने बफर (एबीडीआईएल) 15 के 200 μL के साथ समाधान (चरण 4.2) को बदलें और कमरे के तापमान पर रात भर सेते हैं।
- एबीडीआईएल निकालें, एबीडीआईएल में प्राथमिक एंटीबॉडी के 75 μL जोड़ें, और 2.5 दिनों के लिए 4 डिग्री सेल्सियस पर सेते हैं।
- सतह पर तैरनेवाला निकालें और 0.1% ट्वीन और 0.1% ट्राइटन एक्स -100 (पीबीएस-टीटी) के साथ पीबीएस के 200 μL के साथ दो बार धो लें और कमरे के तापमान पर 4 घंटे के लिए पीबीएस-टीटी के 200 μL के साथ सेते हैं।
- पीबीएस-टीटी निकालें, एबीडीआईएल में माध्यमिक एंटीबॉडी के 100 μL जोड़ें, और 2.5 दिनों के लिए 4 डिग्री सेल्सियस पर सेते हैं।
नोट: डीएपीआई या अन्य परमाणु डाई को इस स्तर पर जोड़ा जा सकता है। अधिकांश रंगों को एंटीबॉडी की तुलना में कम इनक्यूबेशन समय की आवश्यकता होती है। - सतह पर तैरनेवाला निकालें और दो बार पीबीएस-टीटी के 200 μL के साथ धो लें और 4 घंटे के लिए पीबीएस-टीटी के 200 μL के साथ सेते हैं। स्फेरॉइड बढ़ते के लिए तैयार हैं।
5. बढ़ते
- एक 200 μL विंदुक का उपयोग कर, हालत प्रति एक ट्यूब (लगभग 10-15 स्फेरॉइड) पर 500 μL पीसीआर ट्यूबों के लिए तय और दाग स्फेरॉइड स्थानांतरण।
- वी) तरल एगारोज़ जेल के 200 μL के साथ समाधान को बदलें और त्वरित स्पिन पर अपकेंद्रित्र (निश्चित अधिकतम गति पर, सामग्री की तालिका देखें) 30 एस के लिए कमरे के तापमान पर।
नोट: जब तक तुरंत बढ़ते नहीं हैं, जेल सख्त होने से बचने के लिए 50 डिग्री सेल्सियस पर हीटिंग ब्लॉक में रखें। - ~ 50 μL तरल एगरोज़ जेल में स्फेरॉइड की आकांक्षा करें और 24-अच्छी तरह से ग्लास-बॉटम प्लेट के कुएं में वितरित करें।
- जेल सख्त होने से पहले, आसपास के जेल में एक पिपेट टिप का उपयोग करके स्फेरॉइड को अलग करें, और सुनिश्चित करें कि स्फेरॉइड जेल के साथ कवर किए गए हैं। वैकल्पिक रूप से, जेल को तेजी से सेट करने के लिए प्लेट को बर्फ पर रखें।
नोट: प्रति अच्छी तरह से स्फेरॉइड की संख्या स्फेरॉइड के आकार पर निर्भर करती है। स्फेरॉइड को एक दूसरे से बहुत दूर रखा जाता है ताकि इमेजिंग करते समय केवल एक गोलाकार दृश्य क्षेत्र में प्रवेश करे। यह स्वचालित छवि प्रसंस्करण के लिए महत्वपूर्ण है। - अच्छी तरह से समाशोधन समाधान (चरण 2) के 500 μL जोड़ें, यह सुनिश्चित करना कि जेल जलमग्न है। कम से कम 24 घंटे के लिए आरटी पर सेते हैं और समाशोधन समाधान में स्फेरॉइड की छवि बनाते हैं। स्फेरॉइड कमरे के तापमान पर एक महीने तक और वाष्पीकरण से संरक्षित होने पर इस समाधान में स्थिर होते हैं।
6. इमेजिंग
- पोत में गोलाकार की बढ़ती ऊंचाई सहित पूरे स्फेरॉइड को शामिल करने के लिए पर्याप्त काम करने वाली दूरी के साथ एक उद्देश्य चुनें।
नोट: स्फेरॉइड के भूमध्यरेखीय विमान की छवि बनाने के लिए 3 मिमी या उससे अधिक की कामकाजी दूरी वाले उद्देश्यों की आवश्यकता होती है। उच्च एनए के साथ उच्च आवर्धन उद्देश्य बेहतर रिज़ॉल्यूशन की अनुमति दे सकते हैं, लेकिन अधिकतम गहराई को सीमित कर देंगे जिस पर स्फेरॉइड को इमेज किया जा सकता है। - भूमध्यरेखीय विमान की पहचान करने के लिए, आवश्यक लेजर पावर प्रतिशत, डिटेक्टर वोल्टेज, लाभ और ऑफसेट सेटिंग्स के साथ एक्सवाई विमान और छवि में सबसे बड़ा सतह क्षेत्र तक पहुंचने तक फोकस समायोजित करें।
नोट: लेजर पावर प्रतिशत, डिटेक्टर वोल्टेज, लाभ, और ऑफसेट फ्लोरोफोर, धुंधला तीव्रता, लेजर तीव्रता, डिटेक्टर संवेदनशीलता, आदि के आधार पर बहुत भिन्न होगा। - 3 डी छवियों के लिए, स्फेरॉइड की शुरुआत और अंत सेट करें, और इमेजिंग से पहले जेड तीव्रता सुधार सेटिंग्स का उपयोग करके विभिन्न जेड-गहराई पर उचित सिग्नल तीव्रता चुनें।
नोट: सर्वोत्तम छवि रिज़ॉल्यूशन के लिए, एक्स, वाई और जेड के लिए नाइक्विस्ट नमूना दर का उपयोग करें (विवरण के लिए, संदर्भ16 देखें)।
Representative Results
उच्च गुणवत्ता वाले दो- और तीन आयामी छवियों को प्रदान करने के लिए इस समाशोधन विधि की क्षमता का प्रदर्शन करने के लिए, 300-600 μm के व्यास वाले स्फेरॉइड एफलुओरेसेंट यूबाइक्विटिनेशन-आधारित सीएल सीवाईकल आईएनडीकेटर (एफयूसीसीआई) ट्रांसड्यूड मेलेनोमा सेल लाइनों एफयूसीसीआई-डब्ल्यूएम 164 और एफयूसीसीआई-डब्ल्यूएम 983 बी 9,17 से उगाए गए थे , जो मोनोमेरिक कुसाबिरा ऑरेंज 2 (एमकेओ 2) और मोनोमेरिक आज़मी ग्रीन (एमएजी) प्रोटीन व्यक्त करते हैं जब गैप 1 में, और सेल चक्र के प्रारंभिक एस-चरण / गैप 2 / माइटोसिस चरण, क्रमशः चरण 31,3,14 में प्रदान की गई प्रक्रियाओं के अनुसार। स्फेरॉइड को तब 37 डिग्री सेल्सियस पर 4% फॉर्मलाडेहाइड समाधान के साथ तय किया गया था, पारगम्य, और एंटी-पी 27किप 1 / एंटी-खरगोश एलेक्सा फ्लोर 647 एंटी-पिमोनिडाज़ोल / एंटी-माउस एलेक्सा फ्लोर 647, डीएपीआई, या डीआरएक्यू 7 (सामग्री की तालिका देखें) (चित्रा 2) के साथ दाग दिया गया था। सभी माइक्रोस्कोपी फ़ाइलों को गिटहब रिपॉजिटरी (https://github.com/ap-browning/SpheroidMounting) में अपलोड किया जाता है। पीबीएस-घुड़सवार स्फेरॉइड की तुलना में, समाशोधन समाधान न्यूनतम आकार विरूपण (चित्रा 2 ए) के साथ उच्च स्पष्टता छवियां प्रदान करता है। प्रोटोकॉल हिस्टोलॉजिकल सेक्शनिंग के बिना स्फेरॉइड में गहरे सेलुलर-स्तरीय विवरणों के उच्च-रिज़ॉल्यूशन इमेजिंग की अनुमति देता है, और क्रॉस-सेक्शनल छवि सिलाई के बिना 4096 x 4096 पिक्सल के रिज़ॉल्यूशन पर 20x वायु उद्देश्य (0.7 एनए) से प्राप्त की गई थी (चित्रा 2 बी)। लंबी कामकाजी दूरी के साथ कम आवर्धन और कम संख्यात्मक एपर्चर उद्देश्य का उपयोग करके, 3 डी कॉन्फोकल छवियां जो कम से कम 200 μm की गहराई पर सेलुलर-स्तरीय विवरण प्रदान करती हैं(चित्रा 2 सी) प्राप्त की जा सकती हैं। स्फेरॉइड्स को भी क्रायोसेक्शन किया गया था और स्पोएरी एट अल .4 द्वारा प्रोटोकॉल के अनुसार दाग दिया गया था और पूरे गोलाकार धुंधला (चित्रा 2 डी, ई) की तुलना में। चित्रा 2 डी पिमोनिडाज़ोल द्वारा दाग वाले गोलाकार के हाइपोक्सिक क्षेत्र को दर्शाता है, और चित्रा 2 ई पी 27 किप 1 धुंधला दिखाता है जो सेल चक्र गिरफ्तारी (पीला) और डीएपीआई परमाणु दाग (ग्रे) को चिह्नित करता है। प्रोटीन स्थानीयकरण और धुंधला पैटर्न क्रायोसेक्शनिंग और समाशोधन के बीच समान हैं और इसलिए इस समाशोधन विधि से अप्रभावित हैं।
जेड में सिग्नल तीव्रता सुधार पूरे गोलाकार की इमेजिंग की अनुमति देता है। हालांकि, नेक्रोटिक कोर के कारण प्रकाश-बिखरने से स्फेरॉइड के दूर की ओर छवि बनाने की क्षमता सीमित हो जाती है। गहरी पैठ और डीआरएक्यू 7 परमाणु दाग जैसे दूर-लाल फ्लोरोफोर के कम बिखरने, और भी बेहतर 3 डी गोलाकार संरचना प्रतिनिधित्व (चित्रा 3) के लिए अनुमति देता है। मूवी 1 डीआरएक्यू 7 के साथ दाग वाले एफयूसीसीआई स्फेरॉइड के 3 डी प्रतिपादन को दर्शाता है। एक पतला जेड-स्लाइस बेहतर जेड-रिज़ॉल्यूशन की अनुमति दे सकता है, लेकिन यह फ्लोरोफोरस के इमेजिंग समय और फोटोब्लीचिंग को काफी बढ़ाता है।
यह निर्धारित करने के लिए कि क्या समाशोधन समाधान आकार विरूपण का कारण बनता है, समाशोधन समाधान की शुरूआत के बाद 2% अगारोज-पीबीएस जेल में बारह स्फेरॉइड को 6 घंटे, 12 घंटे, 24 घंटे, 72 घंटे और 168 घंटे पर चित्रित किया गया था। छवियों को गोलाकार के व्यास का निर्धारण करके संक्षेप में प्रस्तुत किया गया था, जिसे गोलाकार (चित्रा 4 ए) के समान क्रॉस-अनुभागीय क्षेत्र के साथ एक गोले के आधार पर परिभाषित किया गया था। जबकि स्फेरॉइड पहले 6 घंटे में आकार में थोड़ी वृद्धि के लिए मनाया जाता है, 2% और 6% (चित्रा 4 बी) के बीच व्यास गुना-परिवर्तन द्वारा इंगित किया जाता है, 24 घंटे से 72 घंटे के बाद, स्फेरॉइड पीबीएस पोस्ट पीएफए निर्धारण (चित्रा 4 सी) में इसी आकार के बराबर आकार में लौटते हैं।
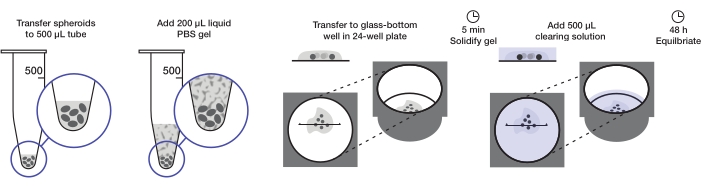
चित्रा 1: गोलाकार बढ़ते और समाशोधन प्रोटोकॉल का चित्रण। फिक्स्ड और दाग वाले स्फेरॉइड को 500 μL ट्यूब में स्थानांतरित किया जाता है; अतिरिक्त तरल पदार्थ को 200 μL एगारोज़-पीबीएस जेल और सेंट्रीफ्यूज द्वारा प्रतिस्थापित किया जाता है। स्फेरॉइड को तब 24-अच्छी तरह से प्लेट में ग्लास-बॉटम कुएं में स्थानांतरित किया जाता है। जेल को जमने की अनुमति देने के बाद, 500 μL समाशोधन समाधान जोड़ा जाता है, और स्फेरॉइड को संतुलित करने की अनुमति दी जाती है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
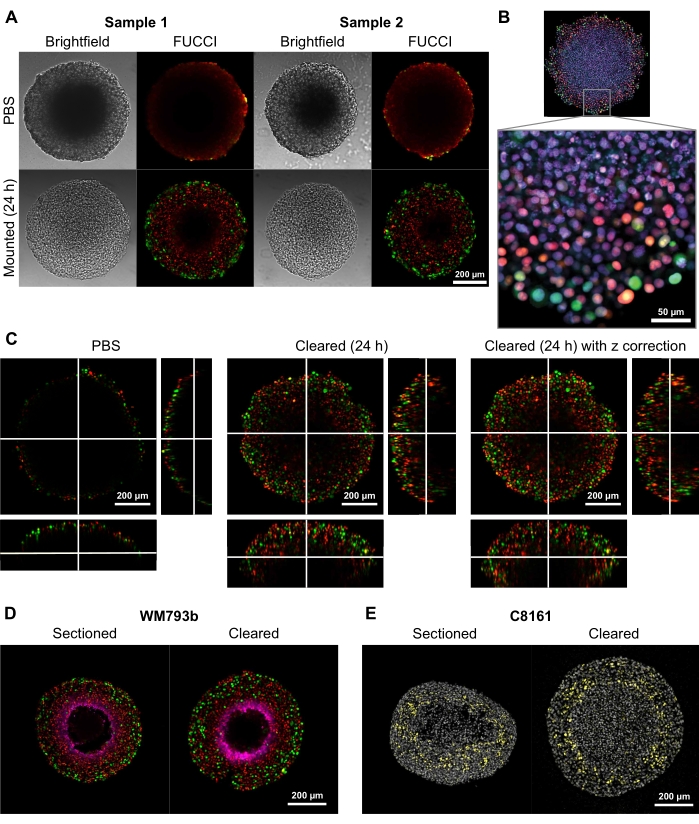
चित्रा 2: साफ़ और अस्पष्ट एफयूसीसीआई मानव मेलेनोमा स्फेरॉइड की तुलना। रंग एमकेओ 2 (लाल) के लिए सेल नाभिक सकारात्मक इंगित करता है, जो अंतराल 1 में कोशिकाओं को इंगित करता है; और एमएजी (हरा) के लिए सेल नाभिक सकारात्मक, जो अंतराल 2 में कोशिकाओं को इंगित करता है ( ए ) 5000 एफयूसीसीआई-डब्ल्यूएम 983 बी कोशिकाओं से उगाए गए स्फेरॉइड, दिन 10 में काटे जाते हैं और एगरोज़-पीबीएस जेल में चित्रित होते हैं और समाशोधन समाधान के बाद 24 घंटे जोड़े जाते हैं। समाशोधन समाधान से पहले और बाद में ब्राइटफील्ड और कॉन्फोकल छवियों की तुलना करना न्यूनतम आकार विरूपण और स्पष्टता में एक बड़ा लाभ दिखाता है। (बी) ट्राइटन एक्स -100 का उपयोग करके पारगम्य एफयूसीसीआई-डब्ल्यूएम 164 कोशिकाओं से उगाए गए स्फेरॉइड और डीआरएक्यू 7 के साथ दाग, सभी सेल नाभिक को धुंधला कर दिया। छवि 20x उद्देश्य (0.75 एनए) का उपयोग करके प्राप्त की जाती है, समाशोधन समाधान का प्रदर्शन सेल-स्तरीय विवरणों के उच्च-रिज़ॉल्यूशन इमेजिंग की अनुमति देता है। (सी) 3 डी छवियां (10x, 0.4 एनए) पीबीएस में FUCCI-WM164 स्फेरॉइड्स की प्राप्त की गईं, और समाशोधन समाधान जोड़े जाने के 24 घंटे बाद। विभिन्न जेड-प्लेन पर लेजर पावर, वोल्टेज और ऑफसेट को समायोजित करने से स्फेरॉइड के अंदर गहराई से इमेजिंग की अनुमति मिलती है। (डी, ई) क्रायोसेक्शन और पिमोनिडाज़ोल और पी 27किप 1 के लिए दाग वाले पूरे गोलाकार के बीच तुलना। (डी) मैजेंटा में पिमोनिडाज़ोल धुंधला होना स्फेरॉइड में हाइपोक्सिक क्षेत्र को दर्शाता है। लाल और हरे रंग का संकेत एफयूसीसीआई है। (ई) क्रायोसेक्शन और साफ गोलाकार डीएपीआई (ग्रे) और पी 27किप 1 (पीला) दिखा रहा है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
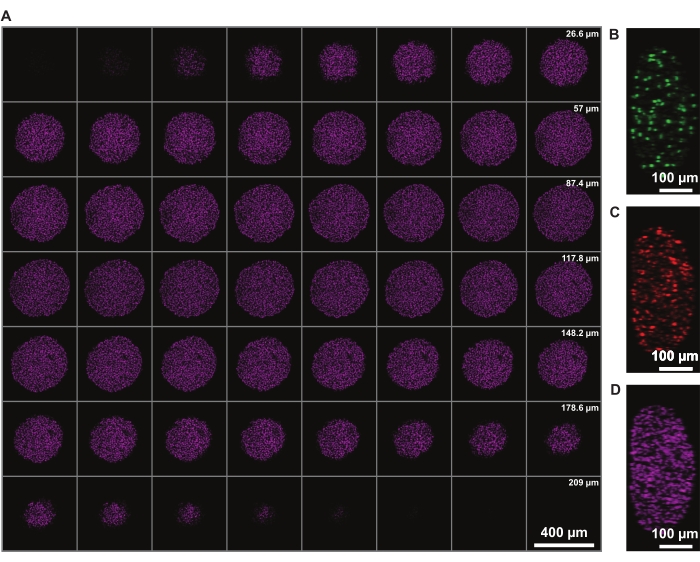
चित्रा 3: समाशोधन न्यूनतम प्रकाश हानि के साथ गोलाकार में गहराई से इमेजिंग के लिए अनुमति देता है। 10x आवर्धन और निचले एनए (0.4) पर एक FUCCI मानव मेलेनोमा स्फेरॉइड की कॉन्फोकल माइक्रोस्कोपी छवियां, न्यूनतम सिग्नल हानि के साथ उच्च जेड-गहराई पर इमेजिंग की अनुमति देती हैं। (ए) डीआरएक्यू 7 के साथ दाग वाले स्फेरॉइड नाभिक के 3.88 μm स्लाइस। (बी-डी) वाई / जेड-रिज़ॉल्यूशन 488 (एमएजी), 568 (एमकेओ 2), और 647 एनएम (डीआरएक्यू 7) चैनलों में क्रमशः कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
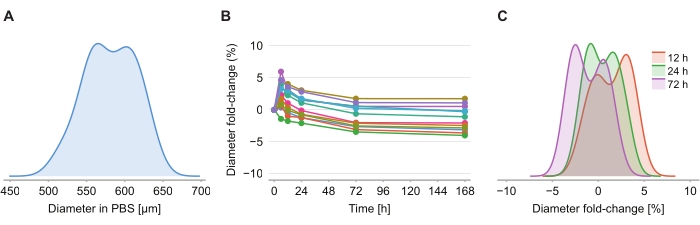
चित्रा 4: समाशोधन समाधान का गोलाकार आकार पर न्यूनतम प्रभाव पड़ता है। (ए) पीबीएस जेल (एन = 12 स्फेरॉइड) में प्रारंभिक गोलाकार आकार (समतुल्य व्यास) का वितरण। (बी) समाशोधन समाधान के अलावा समय के साथ व्यास गुना-परिवर्तन। 0 घंटे पर, स्फेरॉइड केवल पीबीएस जेल में हैं। (C) 12 घंटे, 24 घंटे और 72 घंटे पर व्यास गुना-परिवर्तन का वितरण । कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
मूवी 1: डीआरएक्यू 7 के साथ दाग वाले एक फुकी स्फेरॉइड का 3 डी प्रतिपादन। कृपया इस मूवी को डाउनलोड करने के लिए यहां क्लिक करें।
Discussion
ट्यूमर स्फेरॉइड की उच्च गुणवत्ता वाले दो- और तीन आयामी छवियों को प्राप्त करने के लिए एक प्रोटोकॉल यहां प्रस्तुत किया गया है। मौजूदा तरीके, जैसे कि स्पष्टता, गहरे मस्तिष्क (सीईडीबी), और स्केल, अक्सर 30% तक आकार विरूपण का कारण बनते हैं, जबकि बेंजिल अल्कोहल / बेंजिल बेंजोएट (बीएबीबी) और विलायक-साफ अंगों (3 डीआईएससीओ) की 3 डी इमेजिंग जैसी तकनीकें फ्लोरोसेंट प्रोटीन18 को बुझा सकती हैं। इनमें से कई विधियों को संरचनात्मक अखंडता के साथ ऊतक को साफ करने और स्फेरॉइड18 पर लागू होने पर आकार और संरचना को विकृत करने के लिए डिज़ाइन किया गया है। व्यावसायिक रूप से उपलब्ध महंगे समाशोधन समाधानों का उपयोग करने वाले अन्य प्रोटोकॉल के विपरीत, यह प्रोटोकॉल ऑप्टिकल स्पष्टता और अंतर्जात प्रतिदीप्ति को बनाए रखने और आकार विरूपण को कम करते हुए आसानी से उपलब्ध उपभोग्य सामग्रियों का उपयोग करता है। एगरोज़-पीबीएस जेल में एम्बेडिंग स्फेरॉइड स्फेरॉइड के लिए संरचनात्मक सहायता प्रदान करता है और समाशोधन समाधान जोड़े जाने पर आसमाटिक सदमे को कम करता है। दवा उपचार के बाद नाजुक स्फेरॉइड इमेजिंग करते समय यह महत्वपूर्ण है। यह माना जाता है कि यह ऑप्टिकल समाशोधन विधि किसी भी विधि द्वारा गठित स्फेरॉइड के लिए उपयुक्त है क्योंकि यह प्रोटोकॉल पूरे ऊतक समाशोधन से अनुकूलित है। धारणा विभिन्न गोलाकार गठन विधियों द्वारा प्राप्त स्फेरॉइड में समानता पर आधारित है। फिक्सेटिव की पसंद गोलाकार आकार के साथ-साथ अंतर्जात प्रतिदीप्ति को भी प्रभावित कर सकती है। यह समाशोधन विधि तटस्थ 4% पीएफए समाधान के साथ तय किए गए स्फेरॉइड के लिए उपयुक्त है। अन्य फिक्सेटिव के साथ इसकी संगतता की जांच करने के लिए आगे के परीक्षण की आवश्यकता है।
यह देखते हुए कि यह तकनीक कई स्फेरॉइड को एक बहु-अच्छी तरह से प्लेट में एक साथ घुड़सवार करने की अनुमति देती है, यह मात्रात्मक विश्लेषण पाइपलाइनों के लिए अच्छी तरह से अनुकूल है जिन्हें 24-अच्छी तरह से प्लेट प्रति 360 स्फेरॉइड तक गोलाकार संरचना जानकारी की आवश्यकता होती है। स्वचालित चरण और प्लेट मैपिंग कार्यों के साथ माइक्रोस्कोप इमेजिंग को कम मैनुअल बना सकते हैं। भले ही यह विधि सेक्शनिंग की तुलना में तेज़ और आसान है, लेकिन यह वर्तमान में पूर्ण स्वचालन के लिए अनुपयुक्त है। हालांकि, इस विधि द्वारा प्राप्त छवियां स्वचालित छवि प्रसंस्करण 4,19 के लिए उपयुक्त हैं, और जिस दर पर इस प्रोटोकॉल का उपयोग करके स्फेरॉइड को घुड़सवार किया जा सकता है, वह गोलाकार आंतरिक संरचना20,21,22 के मात्रात्मक विश्लेषण को उधार देता है।
पूरे स्फेरॉइड को धुंधला करने के लिए, एंटीबॉडी एकाग्रता, मात्रा और इनक्यूबेशन समय को प्रत्येक एंटीबॉडी के लिए अनुकूलित करने की आवश्यकता होती है। एक गाइड के रूप में, प्रति ट्यूब स्फेरॉइड की संख्या के आधार पर अनुशंसित 2 डी इम्यूनोफ्लोरेसेंस एंटीबॉडी एकाग्रता के 2.5x और एंटीबॉडी के 100-200 μL का उपयोग करें। सुनिश्चित करें कि रोटर पर होने पर सभी स्फेरॉइड धुंधला समाधान में कवर किए जाते हैं। इनक्यूबेशन समय कई कारकों पर निर्भर करता है, जिसमें स्फेरॉइड और एंटीबॉडी का आकार और घनत्व शामिल है, और 16-72 घंटे तक हो सकता है। गोलाकार के भीतर गहराई से सिग्नल का पता लगाने की अनुमति देने वाली विधि के बावजूद, यूवी द्वारा उत्साहित फ्लोरोफोरस महत्वपूर्ण प्रकाश बिखरने का कारण बनता है, जिससे कम सिग्नल-टू-शोर अनुपात होता है। लक्ष्य प्रोटीन की कल्पना करने के लिए फ्लोरोफोरस चुनते समय देखभाल की जानी चाहिए। उदाहरण के लिए, लंबे तरंग दैर्ध्य फ्लोरोफोरस के साथ कम प्रचुर मात्रा में और संरचनात्मक प्रोटीन धुंधला और कम तरंग दैर्ध्य फ्लोरोफोरस के साथ अधिक प्रचुर मात्रा में प्रोटीन या परमाणु दाग सबसे अच्छा परिणाम प्राप्त करेंगे। अंत में, साफ़ किए गए स्फेरॉइड अभी भी नेक्रोटिक कोर में बिखरने के कारण प्रकाश हानि दिखाते हैं, जो 600 μm स्फेरॉइड (चित्रा 2 सी) से प्राप्त छवियों के वाई /
उच्च एनए उद्देश्यों के साथ उच्च आवर्धन इमेजिंग इस प्रोटोकॉल का उपयोग करके घुड़सवार और मंजूरी वाले स्फेरॉइड के साथ संभव है, लेकिन उद्देश्य की कामकाजी दूरी इमेजिंग गहराई को सीमित करती है। तेल विसर्जन लेंस के लिए, तेल का उपयोग करना महत्वपूर्ण है जिसमें सर्वोत्तम परिणाम के लिए 1.51 का आरआई है।
संक्षेप में, एगरोज़-पीबीएस जेल एम्बेडेड समाशोधन विधि आमतौर पर उपलब्ध उपभोग्य सामग्रियों का उपयोग करके स्फेरॉइड के अंदर गहरी कोशिकाओं के दृश्य की अनुमति देती है। इस पद्धति का उपयोग करके घुड़सवार और साफ़ किए गए स्फेरॉइड न्यूनतम आकार विरूपण से गुजरते हैं और अपनी संरचनात्मक अखंडता को बनाए रखते हैं, जिससे आंतरिक गोलाकार संरचना और बाद में स्वचालित मात्रा का ठहराव से संबंधित उच्च गुणवत्ता वाले डेटा के संग्रह की अनुमति मिलती है।
Acknowledgements
यह शोध ट्रांसलेशनल रिसर्च इंस्टीट्यूट (टीआरआई), वूल्लोंगब्बा, क्यूएलडी में किया गया था। टीआरआई को ऑस्ट्रेलियाई सरकार से अनुदान द्वारा समर्थित किया जाता है। हम टीआरआई में माइक्रोस्कोपी कोर सुविधा में कर्मचारियों को उनके उत्कृष्ट तकनीकी समर्थन के लिए धन्यवाद देते हैं। हम प्रोफेसर अत्सुशी मियावाकी, रिकेन, वाको-सिटी, जापान को एफयूसीसीआई निर्माण प्रदान करने के लिए धन्यवाद देते हैं, प्रोफेसर मीनहार्ड हर्लिन और सुश्री पेट्रीसिया ब्रैफोर्ड, द विस्टर इंस्टीट्यूट, फिलाडेल्फिया, पीए, सेल लाइनें प्रदान करने के लिए। हम सी 8161 क्रायोसेक्शन छवियों को प्रदान करने के लिए डॉ लोरेडाना स्पोएरी को धन्यवाद देते हैं।
इस काम को एनकेएच को परियोजना अनुदान द्वारा समर्थित किया गया था: ऑस्ट्रेलियाई अनुसंधान परिषद (डीपी 200100177) और मीहान परियोजना अनुदान (021174 2017002565)।
Materials
| Name | Company | Catalog Number | Comments |
| #1.5 glass bottom 24-well plate | Celvis | P24-1.5H-N | |
| 500 µL clear PCR tubes | Sigma | HS4422 | |
| Alexa Fluor 647 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson Immuno research | 715-605-151 | Dilution used 1:500 |
| Bovine serum albumin | Sigma | A7906 | Final concentration 2% w/v |
| DAPI | Sigma | D9542-10MG | Final concentration 5 µg/mL |
| Deionized water | MILLI Q | ||
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Thermofisher | A-31573 | Dilution used 1:500 |
| DRAQ7 | Thermofisher | D15106 | Dilution used 1:250 |
| Heating block | Ratek | DBH10 | or similar equipment |
| Hypoxyprobe Kits | Hypoxyprobe | HP1-1000Kit | Antibody dilution used 1:500 |
| Low-melting agarose powder | Sigma | A9414 | Final concentration 2% w/v |
| Microwave | Sharp | ||
| N,N,N′,N′-Tetrakis(2-Hydroxypropyl)ethylenediamine | Sigma | 122262 | Final concentration 9% w/w |
| NaCl | Sigma | S9888 | Final concentration 150 mM |
| NaN3 | Sigma | S2002 | Final concentration 0.10% w/v |
| p27 Kip1 (D69C12) XP | Cell Signalling technology | 3686S | Dilution used 1:500 |
| Paraformaldehyde solution | Proscitech | C004 | Final concentration 4% w/v |
| Phosphate Buffered Saline (PBS) | Thermofisher | 18912014 | Final concentration 1x |
| Pipette | Eppendorf | ||
| Quickspin minifuge | or similar equipment | ||
| Roller | Ratek | BTR10-12V | or similar equipment |
| Rotor | Ratek | RSM7DC | or similar equipment |
| Shaker | Ratek | EOM5 | or similar equipment |
| Sucrose | Sigma | S9378 | Final concentration 44% w/w |
| Tris-HCl pH 7.4 | Sigma | T5941 | Final concentration 20 mM |
| Triton X-100 | Sigma | X100 | Final concentration 0.10% v/v |
| Triton X-100 | Sigma | X100 | Final concentration 0.1% v/v |
| Tween 20 | Sigma | P1379 | Final concentration 0.1% v/v |
| Urea | Sigma | U5379 | Final concentration 22% w/w |
References
- Beaumont, K. A., Anfosso, A., Ahmed, F., Weninger, W., Haass, N. K. Imaging- and flow cytometry-based analysis of cell position and the cell cycle in 3D melanoma spheroids. Journal of Visualized Experiments. (106), e53486 (2015).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Smalley, K. S., Lioni, M., Noma, K., Haass, N. K., Herlyn, M. In vitro three-dimensional tumor microenvironment models for anticancer drug discovery. Expert Opinion on Drug Discovery. 3 (1), 1-10 (2008).
- Spoerri, L., Gunasingh, G., Haass, N. K. Fluorescence-based quantitative and spatial analysis of tumour spheroids: A proposed tool to predict patient-specific therapy response. Frontiers in Digital Health. 3, 668390 (2021).
- Nürnberg, E., et al. Routine optical clearing of 3D-cell cultures: Simplicity forward. Frontiers in Molecular Biosciences. 7, 20 (2020).
- Kabadi, P. K., et al. Into the depths: Techniques for in vitro three-dimensional microtissue visualization. BioTechniques. 59 (5), 279-286 (2015).
- Ivanov, D. P., Grabowska, A. M. Spheroid arrays for high-throughput single-cell analysis of spatial patterns and biomarker expression in 3D. Scientific Reports. 7, 41160 (2017).
- Spoerri, L., et al. Phenotypic melanoma heterogeneity is regulated through cell-matrix interaction-dependent changes in tumor microarchitecture. bioRxiv. , (2021).
- Haass, N. K., et al. Real-time cell cycle imaging during melanoma growth, invasion, and drug response. Pigment Cell & Melanoma Research. 27 (5), 764-776 (2014).
- Ahmad, A., et al. Clearing spheroids for 3D fluorescent microscopy: combining safe and soft chemicals with deep convolutional neural network. bioRxiv. , 428996 (2021).
- Villani, T., Rossi, A. E., Sherman, H. Image-based characterization of 3-D cell culture models grown in spheroid microplates. American Laboratory. 50 (6), 12 (2018).
- Lloyd-Lewis, B., et al. Imaging the mammary gland and mammary tumours in 3D: optical tissue clearing and immunofluorescence methods. Breast Cancer Research. 18 (1), 127 (2016).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159 (4), 911-924 (2014).
- Spoerri, L., Beaumont, K. A., Anfosso, A., Haass, N. K. Real-time cell cycle imaging in a 3D cell culture model of melanoma. Methods in Molecular Biology. 1612, 401-416 (2017).
- Cold Spring Harbor. Antibody Dilution Buffer (Abdil). Cold Spring Harbor Protocols. , (2018).
- Pawley, J. B., Pawley, J. B. . Handbook Of Biological Confocal Microscopy. , 20-42 (2006).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Tian, T., Yang, Z., Li, X. Tissue clearing technique: Recent progress and biomedical applications. Journal of Anatomy. 238 (2), 489-507 (2021).
- Browning, A. P., Murphy, R. J. . Zenodo. , (2021).
- Browning, A. P., et al. Quantitative analysis of tumour spheroid structure. eLife. 10, 73020 (2021).
- Klowss, J. J., et al. A stochastic mathematical model of 4D tumour spheroids with real-time fluorescent cell cycle labelling. Journal of The Royal Society Interface. 19 (189), 20210903 (2022).
- Murphy, R. J., Browning, A. P., Gunasingh, G., Haass, N. K., Simpson, M. J. Designing and interpreting 4D tumour spheroid experiments. Communications Biology. 5 (1), 91 (2022).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved