用于肿瘤球体半高通量分析的快速光学清除
摘要
肿瘤球体越来越多地用于评估肿瘤细胞 - 微环境相互作用和治疗反应。本方案描述了一种使用快速光学清除对3D肿瘤球体进行半高通量成像的稳健但简单的方法。
摘要
肿瘤球体在基础癌症研究和药物开发中正迅速变得司空见惯。在细胞水平上获取有关球体内蛋白质表达的数据对于分析非常重要,但现有技术通常昂贵,费力,使用非标准设备,导致显着的尺寸失真,或仅限于相对较小的球体。该协议提出了一种安装和清除球体的新方法,可以解决这些问题,同时允许对球体的内部结构进行共聚焦分析。与现有方法相比,该协议提供了使用标准设备和实验室用品快速安装和清除大量球体的功能。在引入折射率匹配的透明溶液之前,将球体安装在pH中性琼脂糖- PBS凝胶溶液中,可最大限度地减少其他类似技术常见的尺寸失真。这允许进行详细的定量和统计分析,其中尺寸测量的准确性至关重要。此外,与液体清除溶液相比,琼脂糖凝胶技术将球体固定到位,从而可以收集三维(3D)共聚焦图像。本文详细介绍了该方法如何产生高质量的二维和三维图像,这些图像提供有关细胞间变异性和内部球体结构的信息。
引言
三维(3D)细胞培养物,如球状体,提供生物上真实且可重复的聚集细胞生长模型1,2。这些模型在基础研究和药物开发中迅速变得司空见惯,其中在治疗之间检查球体大小和结构的差异,以确定药物疗效3,4。在这些情况下,从大量球体收集详细信息的能力是非常有利的,无论是从统计功效的角度来看,还是允许快速评估几种治疗中的细胞行为。
用于获取球体结构的详细显微镜图像的常用技术要么耗时,要么昂贵,要么产生的质量较差的图像不保留关键定量特征,例如球体大小4,5。例如,基于冷冻切片的组织学技术可以提供高质量的图像,但通常非常耗时,需要熟练的劳动力,并且经常创建切片伪影6,7,而优雅的技术,如单平面照明显微镜(SPIM)8 和多光子显微镜9 需要不容易获得的专用显微镜。现代显微镜技术最近实现了所谓的光学切片,其中将球体放置在折射率匹配的透明溶液中,并使用共聚焦显微镜4,5获得图像。虽然这些技术有可能产生高产量,但常见问题包括成像时的球体移动,清除时的大小失真以及专有清除解决方案的高成本。此外,许多现有方案仅适用于直径小于300μm或深度高达100μm的相对较小的球体,将该技术限制在肿瘤生长的早期阶段5,10,11。
本方案允许使用源自整个器官清除程序12、13的低成本折射率匹配的清除溶液对详细的球体图像进行半高通量、高产量的收集。为了防止成像过程中的球体移动并提供结构支撑以减少尺寸变形,将球体安装在24孔#1.5玻璃底板中的琼脂糖-PBS凝胶中。由于该技术允许在24孔板的每个孔中安装多个球体,因此可以在各种实验条件下快速安装多达360个球体(15个球体/孔)并进行成像。由现成的耗材构成的折射率匹配的透明溶液用于以光学方式清除已安装的球体和周围的凝胶。在24小时的沉降期后,该协议提供高质量的球状结构的2D和3D图像,即使对于相对较大的球体(直径约700μm),尺寸失真小于2%。
研究方案
该协议描述了制备足够数量的肿瘤球体以在每孔200μL琼脂糖凝胶和每孔500μL清除溶液下安装一个24孔板(约240-360个球体或10-15个球体/孔)。完整过程如图 1 所示。
1. 2% 琼脂糖-PBS 凝胶制剂
- 在玻璃瓶中称取0.5g低熔点琼脂糖(参见 材料表),并加入25 mL磷酸盐缓冲盐水(PBS)。
- 通过将溶液在微波炉中煮沸30-60秒来融化琼脂糖,盖子关闭但不密封并且不断旋转。确保琼脂糖完全溶解,溶液不会沸腾。
注意:凝胶可以在室温下储存;使用前检查体积以考虑蒸发。使用前置于液态(微波;旋转20-60秒)。
2. 清算液的制备
- 称取9克 N,N,N′,N′-四(2-羟丙基)乙二胺,22克尿素,44克蔗糖,0.1克Triton X-100和24.9克去离子水(见 材料表)。
注意:更容易称量N,N,N′,N′-四(2-羟丙基)乙二胺的近似量,并调整其他组分的重量以获得所需的浓度。 - 在56°C水浴中加热溶液,不断混合,并继续直到所有晶体溶解。
- 将溶液在室温下静置,以使混合过程中形成的气泡上升到表面。该溶液在室温下可稳定长达2个月。
3. 球状体制备
- 使用琼脂糖覆盖方法生成球体,如前面1,3,14所述。
注意:由其他方法生成的旋转椭球体也与此成像协议兼容。 - 使用手术刀切割1 mL移液器吸头的尖端以扩大孔口。
注意:所有球状体均用1 mL或200 μL移液器处理,并带有切割尖端。 - 使用移液管,从孔中吸出球状体并将其转移到透明的1.5 mL锥形管中。来自相同条件的多个球体可以组合在同一管中。
注意:始终让球体沉降到管底部以吸出介质。 - 在1mL PBS中洗涤球状体两次,加入中性4%预热的多聚甲醛(PFA)溶液,并将球体在37°C孵育20分钟。
- 取出PFA溶液,用1 mL PBS洗涤球状体两次。
4. 球状染色
- 使用移液管,将多达15个球状体转移到200μLPCR管中。
注:对于易碎的球体,请在继续操作之前将球体安装在凝胶中(步骤5.1-5.4)。 - 在PBS中使用200μL的0.5%曲尼通X-100透化细胞。将PCR管置于50 mL螺旋盖管内,并在室温下以轻度搅拌孵育球状体2小时。
注:除非另有说明,否则所有孵育均在转子、滚筒或摇床上搅拌(参见 材料表)进行。这对于实现均匀染色非常重要。PBS中的固定球体有时会粘在移液器吸头的侧面。用0.5%Triton X-100冲洗尖端,可最大限度地减少球状体粘附在尖端上。 - 用200μL抗体稀释缓冲液(ABDIL)15 替换溶液(步骤4.2)并在室温下孵育过夜。
- 除去 ABDIL,在 ABDIL 中加入 75 μL 一抗,并在 4 °C 下孵育 2.5 天。
- 除去上清液并用200μLPBS和0.1%吐温以及0.1%曲同X-100(PBS-TT)洗涤两次,并在室温下与200μLPBS-TT一起孵育4小时。
- 除去PBS-TT,在ABDIL中加入100μL二抗,并在4°C下孵育2.5天。
注意:DAPI或其他核染料可以在此阶段添加。大多数染料需要比抗体更少的孵育时间。 - 除去上清液并用200μLPBS-TT洗涤两次,并与200μLPBS-TT一起孵育4小时。旋转椭球体已准备好进行安装。
5. 安装
- 使用200μL移液管,将固定和染色的球体转移到500μLPCR管中,每套管一个试管(约10-15个球体)。
- 用200μL2%(w / v)液体琼脂糖凝胶替换溶液,并在室温下快速旋转(以固定的最大速度,参见 材料表)离心30秒。
注意:除非立即安装,否则请置于50°C的加热块中以避免凝胶硬化。 - 在〜50μL液体琼脂糖凝胶中吸出球状体,并在24孔玻璃底板的孔中分配。
- 在凝胶硬化之前,使用移液器吸头在周围凝胶中分离球状体,并确保球体被凝胶覆盖。或者,将板放在冰上以快速凝固凝胶。
注意:每个孔中旋转椭球体的数量取决于旋转椭球体的大小。旋转椭球体彼此相距较远,因此在成像时只有一个旋转椭球体进入视野。这对于自动图像处理非常重要。 - 每孔加入500μL透明溶液(步骤2),确保凝胶浸没。在室温下孵育至少24小时,并在透明溶液中对球体进行成像。球状体在该溶液中在室温下和防止蒸发时稳定长达一个月。
6. 成像
- 选择工作距离足以覆盖整个球体的物镜,包括球体在容器中的安装高度。
注:需要工作距离为3 mm或更长的物镜来成像旋转椭球体的赤道平面。具有较高数值孔径的较高放大倍率物镜可以获得更好的分辨率,但会限制可以成像旋转椭球体的最大深度。 - 要识别赤道平面,请调整焦点,直到XY平面达到最大表面积,并使用所需的激光功率百分比,探测器电压,增益和偏移设置进行图像。
注:激光功率百分比、检测器电压、增益和偏移量将因荧光团、染色强度、激光强度、检测器灵敏度等的不同而有很大差异。 - 对于 3D 图像,请设置旋转椭球体的起点和终点,并在成像前使用 z 强度校正设置在各种 z 深度选择合适的信号强度。
注:为获得最佳图像分辨率,请对 x、y 和 z 使用奈奎斯特采样率(有关详细信息,请参见参考文献16)。
结果
为了证明这种清除方法提供高质量二维和三维图像的能力,从基于F柱状U双量子化C细胞(FUCCI)转导的黑色素瘤细胞系FUCCI-WM164和FUCCI-WM983b9,17中生长出直径为300-600μm的球体,其表达单体库萨比拉橙2(mKO2)和单体阿扎米绿(mAG)蛋白时在Gap1和早期S相/Gap2/有丝分裂阶段的细胞周期,分别按照步骤3中提供的程序1,3,14。然后将球体用4%甲醛溶液固定在37°C,透化,并用抗p27kip1 /抗兔亚历克莎氟647抗吡莫尼达唑/抗小鼠亚历克莎氟647,DAPI或DRAQ7染色(见材料表)(图2)。所有显微镜文件都将上传到 GitHub 存储库(https://github.com/ap-browning/SpheroidMounting)。与PBS安装的球体相比,该清除解决方案可提供高清晰度图像,并且尺寸失真最小(图2A)。该协议允许在不进行组织学切片的情况下对更深入球体的细胞级细节进行高分辨率成像,并且横截面图像是从20x空气物镜(0.7 NA)获得的,分辨率为4096 x 4096 px,无需拼接(图2B)。使用具有较长工作距离的较低放大倍率和较低数值孔径物镜,可以获得在至少200μm深度提供细胞级细节的3D共聚焦图像(图2C)。球状体也根据Spoerri等人的方案进行冷冻切片和染色,并与整个球体染色进行比较(图2D,E)。图2D显示了由吡莫硝唑染色的球体的缺氧区域,图2E显示了标记细胞周期停滞(黄色)和DAPI核染色(灰色)的p27kip1染色。冷冻切片和清除之间的蛋白质定位和染色模式相似,因此不受这种清除方法的影响。
z中的信号强度校正允许对整个旋转椭球体进行成像。然而,坏死核心引起的光散射限制了对球体远侧进行成像的能力。远红荧光团(如DRAQ7核染色)的穿透力更深,散射更少,可以进一步改善3D球体结构表示(图3)。 电影 1 显示了用 DRAQ7 染色的 FUCCI 球体的 3D 渲染。更薄的z切片可能允许更好的z分辨率,但这显着增加了荧光团的成像时间和光漂白。
为了确定清除溶液是否引起尺寸失真,在引入澄清溶液后6小时,12小时,24小时,72小时和168小时对2%琼脂糖 - PBS凝胶中的12个球体进行成像。通过确定球体的直径来总结图像,该直径基于与旋转椭球体具有相同横截面积的球体进行定义(图4A)。虽然观察到球体在前6小时内尺寸略有增加,由2%至6%的直径折叠变化表示(图4B),但在24小时至72小时后,球体恢复到大约等于PBS后PFA固定后相应尺寸的大小(图4C)。
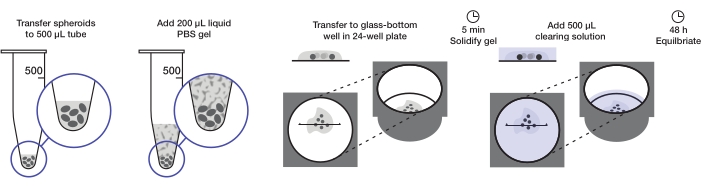
图 1:旋转椭球体安装和清除协议的示意图。 将固定和染色的球状体转移到500μL管中;用200μL琼脂糖- PBS凝胶代替多余的液体并离心。然后将球体转移到24孔板中的玻璃底孔中。凝胶固化后,加入500μL澄清液,并允许球状体平衡。 请点击此处查看此图的大图。
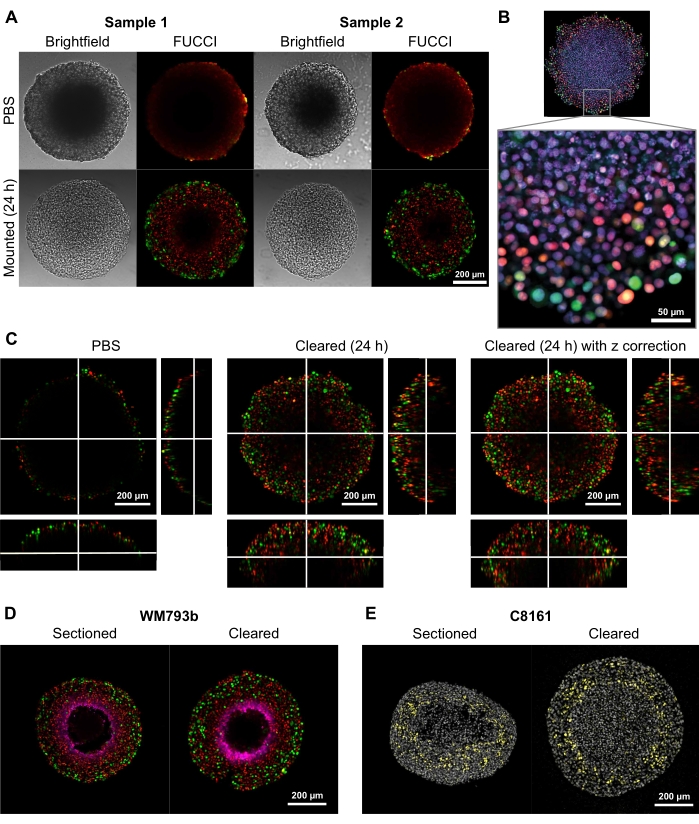
图2:清除和未清除的FUCCI人黑色素瘤球体的比较。 着色表示mKO2的细胞核阳性(红色),这表明间隙1中的细胞;和细胞核阳性为mAG(绿色),这表明间隙2.(A)从5000 FUCCI-WM983b细胞生长的球体,在第10天收获并在琼脂糖 - PBS凝胶中成像,并在加入清除溶液后24小时。比较清除解决方案前后的明场和共聚焦图像显示,尺寸失真最小,清晰度增益较大。(B)从使用Triton X-100透化的FUCCI-WM164细胞中生长的球体用DRAQ7染色,染色所有细胞核,获得图像。使用20x物镜(0.75 NA)获得图像,证明清除溶液允许对细胞水平的细节进行高分辨率成像.(C)在PBS中获得FUCCI-WM164球体的3D图像(10x,0.4 NA),并在加入透明溶液后24小时获得。在不同的z平面上调整激光功率,电压和偏移允许在球体内部更深处进行成像。(D,E)冷冻切片和清除的皮莫硝唑和p27kip1染色的整个球体的比较。(D)品红色中的哌莫硝唑染色显示球体中的缺氧区域。红色和绿色表示呋喃。(E) 冷冻切片和显示 DAPI(灰色)和 p27kip1 (黄色)的透明球体。 请点击此处查看此图的大图。
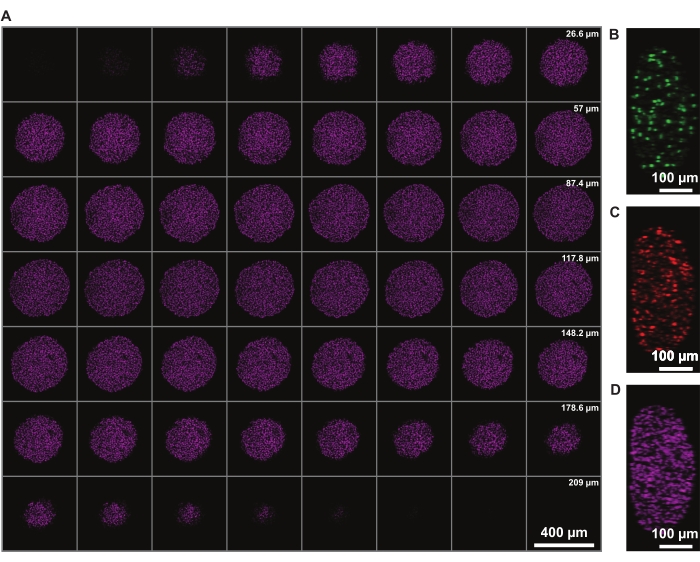
图 3:清除允许以最小的光损失更深入地成像到球体中。FUCCI人黑色素瘤球体的共聚焦显微镜图像,放大倍率为10倍,NA较低(0.4),允许以最小的信号损失在更高的z深度成像。请点击此处查看此图的大图。
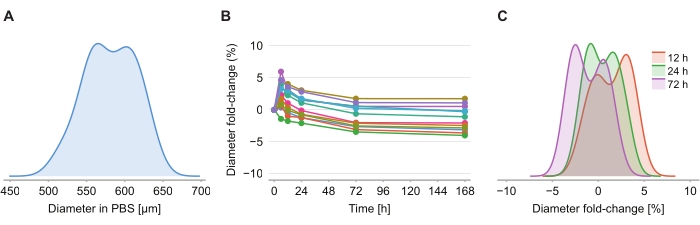
图 4:清除溶液对球体大小的影响最小。 (A)PBS凝胶中初始球体尺寸(等效直径)的分布(n = 12个球体)(B)自添加澄清溶液以来直径随时间的折叠变化。(C)直径在12小时,24小时和72小时时的折叠变化 分布。
电影 1:用 DRAQ7 染色的 FUCCI 球体的 3D 渲染。请按此下载此影片。
讨论
这里介绍了用于获得肿瘤球体的高质量二维和三维图像的方案。现有的方法,如清晰度,见深脑(SeeDB)和ScaleS,通常会导致高达30%的大小失真,而苯甲醇/苯甲酸苄酯(BABB)和溶剂清除器官的3D成像(3DISCO)等技术可以淬灭荧光蛋白18。这些方法中的许多被设计用于清除具有结构完整性的组织,并且在应用于球体18时扭曲大小和结构。与使用市售昂贵清除解决方案的其他方案相比,该方案使用现成的消耗品,同时保持光学清晰度和内源性荧光,并最大限度地减少尺寸失真。在琼脂糖-PBS凝胶中包埋球体可为球状体提供结构支持,并在添加清除溶液时最大限度地减少渗透冲击。在药物治疗后对脆弱的球体进行成像时,这一点至关重要。假设该光学清除方法适用于由任何方法形成的球体,因为该方案适用于整个组织清除。该假设基于通过不同球体形成方法获得的球体的相似性。固定剂的选择会影响球体大小以及内源性荧光。这种清除方法适用于用中性4%PFA溶液固定的球体。需要进一步测试以检查其与其他固定剂的相容性。
鉴于该技术允许在多孔板中同时安装多个球体,因此它非常适合需要每个24孔板多达360个球体结构信息的定量分析管道。具有自动载物台和板映射功能的显微镜可以减少成像的手动操作。尽管这种方法比切片更快,更容易,但它目前不适合完全自动化。然而,通过这种方法获得的图像适用于自动图像处理4,19,并且使用该协议可以安装球体的速率有助于对球体内部结构20,21,22进行定量分析。
对于整个球体的染色,需要针对每种抗体优化抗体浓度、体积和孵育时间。作为指导,使用推荐的2D免疫荧光抗体浓度的2.5倍和100-200μL抗体,具体取决于每管的球体数量。确保在转子上时所有球体都覆盖在染色溶液中。孵育时间取决于许多因素,包括球体和抗体的大小和密度,范围为16-72小时。尽管该方法允许在球体内部更深处进行信号检测,但由紫外线激发的荧光团会引起明显的光散射,从而导致低信噪比。选择荧光基团以可视化目标蛋白时必须小心。例如,染色具有较长波长荧光团的较丰富和结构蛋白以及具有较短波长荧光团的更丰富的蛋白质或核染色剂将获得最佳结果。最后,清除的球体仍然由于坏死核心中的散射而显示光损失,这在600μm球体获得的图像的y / z维中很明显(图2C)。
使用该协议安装和清除球体时,可以使用更高的数值孔径进行更高放大倍率的成像,但物镜的工作距离限制了成像深度。对于油浸式镜头,使用RI为1.51的油以获得最佳效果非常重要。
总而言之,琼脂糖-PBS凝胶包埋清除方法允许使用常用的耗材对球体深处的细胞进行可视化。使用这种方法安装和清除的球体经历最小的尺寸变形并保持其结构完整性,允许收集与内部球体结构相关的高质量数据并随后进行自动定量。
披露声明
奥林巴斯为出版成本做出了贡献。
致谢
这项研究是在昆士兰州乌龙戈巴的转化研究所(TRI)进行的。TRI由澳大利亚政府赠款支持,我们感谢TRI显微镜核心设施的工作人员提供出色的技术支持。我们感谢日本和光市RIKEN的宫亩教授提供FUCCI结构,宾夕法尼亚州费城威斯塔研究所的米恩哈德·赫林教授和帕特里夏·布拉福德女士提供细胞系。我们感谢洛雷达娜·斯波尔里博士提供C8161冷冻切片图像。
这项工作得到了向N.K.H.的项目赠款的支持:澳大利亚研究委员会(DP200100177)和Meehan项目赠款(021174 2017002565)。
材料
| Name | Company | Catalog Number | Comments |
| #1.5 glass bottom 24-well plate | Celvis | P24-1.5H-N | |
| 500 µL clear PCR tubes | Sigma | HS4422 | |
| Alexa Fluor 647 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson Immuno research | 715-605-151 | Dilution used 1:500 |
| Bovine serum albumin | Sigma | A7906 | Final concentration 2% w/v |
| DAPI | Sigma | D9542-10MG | Final concentration 5 µg/mL |
| Deionized water | MILLI Q | ||
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Thermofisher | A-31573 | Dilution used 1:500 |
| DRAQ7 | Thermofisher | D15106 | Dilution used 1:250 |
| Heating block | Ratek | DBH10 | or similar equipment |
| Hypoxyprobe Kits | Hypoxyprobe | HP1-1000Kit | Antibody dilution used 1:500 |
| Low-melting agarose powder | Sigma | A9414 | Final concentration 2% w/v |
| Microwave | Sharp | ||
| N,N,N′,N′-Tetrakis(2-Hydroxypropyl)ethylenediamine | Sigma | 122262 | Final concentration 9% w/w |
| NaCl | Sigma | S9888 | Final concentration 150 mM |
| NaN3 | Sigma | S2002 | Final concentration 0.10% w/v |
| p27 Kip1 (D69C12) XP | Cell Signalling technology | 3686S | Dilution used 1:500 |
| Paraformaldehyde solution | Proscitech | C004 | Final concentration 4% w/v |
| Phosphate Buffered Saline (PBS) | Thermofisher | 18912014 | Final concentration 1x |
| Pipette | Eppendorf | ||
| Quickspin minifuge | or similar equipment | ||
| Roller | Ratek | BTR10-12V | or similar equipment |
| Rotor | Ratek | RSM7DC | or similar equipment |
| Shaker | Ratek | EOM5 | or similar equipment |
| Sucrose | Sigma | S9378 | Final concentration 44% w/w |
| Tris-HCl pH 7.4 | Sigma | T5941 | Final concentration 20 mM |
| Triton X-100 | Sigma | X100 | Final concentration 0.10% v/v |
| Triton X-100 | Sigma | X100 | Final concentration 0.1% v/v |
| Tween 20 | Sigma | P1379 | Final concentration 0.1% v/v |
| Urea | Sigma | U5379 | Final concentration 22% w/w |
参考文献
- Beaumont, K. A., Anfosso, A., Ahmed, F., Weninger, W., Haass, N. K. Imaging- and flow cytometry-based analysis of cell position and the cell cycle in 3D melanoma spheroids. Journal of Visualized Experiments. (106), e53486 (2015).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Smalley, K. S., Lioni, M., Noma, K., Haass, N. K., Herlyn, M. In vitro three-dimensional tumor microenvironment models for anticancer drug discovery. Expert Opinion on Drug Discovery. 3 (1), 1-10 (2008).
- Spoerri, L., Gunasingh, G., Haass, N. K. Fluorescence-based quantitative and spatial analysis of tumour spheroids: A proposed tool to predict patient-specific therapy response. Frontiers in Digital Health. 3, 668390 (2021).
- Nürnberg, E., et al. Routine optical clearing of 3D-cell cultures: Simplicity forward. Frontiers in Molecular Biosciences. 7, 20 (2020).
- Kabadi, P. K., et al. Into the depths: Techniques for in vitro three-dimensional microtissue visualization. BioTechniques. 59 (5), 279-286 (2015).
- Ivanov, D. P., Grabowska, A. M. Spheroid arrays for high-throughput single-cell analysis of spatial patterns and biomarker expression in 3D. Scientific Reports. 7, 41160 (2017).
- Spoerri, L., et al. Phenotypic melanoma heterogeneity is regulated through cell-matrix interaction-dependent changes in tumor microarchitecture. bioRxiv. , (2021).
- Haass, N. K., et al. Real-time cell cycle imaging during melanoma growth, invasion, and drug response. Pigment Cell & Melanoma Research. 27 (5), 764-776 (2014).
- Ahmad, A., et al. Clearing spheroids for 3D fluorescent microscopy: combining safe and soft chemicals with deep convolutional neural network. bioRxiv. , 428996 (2021).
- Villani, T., Rossi, A. E., Sherman, H. Image-based characterization of 3-D cell culture models grown in spheroid microplates. American Laboratory. 50 (6), 12 (2018).
- Lloyd-Lewis, B., et al. Imaging the mammary gland and mammary tumours in 3D: optical tissue clearing and immunofluorescence methods. Breast Cancer Research. 18 (1), 127 (2016).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159 (4), 911-924 (2014).
- Spoerri, L., Beaumont, K. A., Anfosso, A., Haass, N. K. Real-time cell cycle imaging in a 3D cell culture model of melanoma. Methods in Molecular Biology. 1612, 401-416 (2017).
- Cold Spring Harbor. Antibody Dilution Buffer (Abdil). Cold Spring Harbor Protocols. , (2018).
- Pawley, J. B., Pawley, J. B. . Handbook Of Biological Confocal Microscopy. , 20-42 (2006).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Tian, T., Yang, Z., Li, X. Tissue clearing technique: Recent progress and biomedical applications. Journal of Anatomy. 238 (2), 489-507 (2021).
- Browning, A. P., Murphy, R. J. . Zenodo. , (2021).
- Browning, A. P., et al. Quantitative analysis of tumour spheroid structure. eLife. 10, 73020 (2021).
- Klowss, J. J., et al. A stochastic mathematical model of 4D tumour spheroids with real-time fluorescent cell cycle labelling. Journal of The Royal Society Interface. 19 (189), 20210903 (2022).
- Murphy, R. J., Browning, A. P., Gunasingh, G., Haass, N. K., Simpson, M. J. Designing and interpreting 4D tumour spheroid experiments. Communications Biology. 5 (1), 91 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
我们使用 cookie 来增强您在我们网站上的体验。
继续使用我们的网站或单击“继续”,即表示您同意接受我们的 cookie。