Формирование, ограничение и наблюдение за активной нематитикой на основе микротрубочек
In This Article
Summary
Здесь представлены методы получения активной нематики из микротрубочек и кинезиновых двигателей, включая подготовку и конструирование белка и использование скважин для активного нематического удержания.
Abstract
Формирование активных фаз на основе биополимеров стало важным методом для исследователей, заинтересованных в изучении новой области активных жидких кристаллов и их возможной роли в клеточной биологии. Эти новые системы состоят из самоуправляемых субъединиц, которые потребляют энергию локально, производя неравновесную динамическую жидкость. Для образования активной жидкокристаллической фазы, описанной в настоящем отчете, очищенные белковые компоненты, включая биополимеры и молекулярные двигатели, объединяют, и активная нематическая фаза спонтанно образуется в присутствии аденозинтрифосфата (АТФ). Чтобы наблюдать нематическое состояние, материал должен быть заключен в подходящую для микроскопии геометрию при достаточно высокой плотности. В данной статье описаны два различных способа формирования активной нематической фазы с использованием микротрубочек и кинезиновых двигателей: сборка двумерного активного слоя на границе раздела масла и воды и сборка под масляным слоем с использованием эластомерной скважины. Описаны также методики вставки активного материала в небольшие скважины различной формы.
Introduction
Активные жидкости состоят из энергетически управляемых частиц или элементов, которые извлекают топливо из своей локальной среды. При правильных условиях эти подвижные активные элементы могут действовать коллективно, чтобы произвести эмерджентную гидродинамику в больших масштабах длины. В литературе есть множество примеров такого неравновесного фазового поведения, и активные фазы можно найти по всему спектру живых систем. Некоторыми примечательными примерами являются колонии бактерий1, клеточные листы 2,3 и стая или роение организмов 4,5. Активные фазы также были широко изучены в конденсированных фазах цитоскелетных нитей, либо как часть клетки6, либо в синтетических системах, предназначенных для использования биологически экстрагированных компонентов 7,8,9. Жидкокристаллическое упорядочение и образование топологических дефектов как в природных, так и в синтетических системах, собранных из биологических экстрактов, представляют особый интерес для исследовательского сообщества. В последние годы исследовательские группы изучили такие системы, их фундаментальные физические свойства и их актуальность для биологии 2,3,10,11.
Данная работа посвящена формированию активного нематического состояния из комбинации микротрубочек и кинезин-моторных белков. Традиционный нематический жидкий кристалл представляет собой равновесную фазу вещества, в которой составляющие молекулы демонстрируют ориентационную упорядоченность. Например, жидкость, состоящая из относительно жестких палочковидных молекул, может проявлять как нематическую фазу, так и, при более высоких температурах, неориентированную изотропную жидкую фазу12. Первый экспериментальный пример активной нематической фазы был разработан Sanchez et al.13, адаптировав более ранний эксперимент in vitro 14, в котором кластеры моторных белков использовались для создания сдвигового движения между соседними пучками микротрубочек. Когда эта система микротрубочек была ограничена тонким слоем, возникло спонтанное нематическое упорядочение. В последние годы активное нематическое состояние интенсивно изучалось несколькими экспериментальными15,16 и теоретическими17,18 исследовательскими группами, уделяя особое внимание таким явлениям, как активная турбулентность — состояние, в котором жидкость производит самоуправляемые хаотические потоки19 — и мобильные топологические дефекты. В данной работе описаны способы подготовки и формирования активного нематического состояния из микротрубочек и кинезиновых двигателей в различных экспериментальных геометриях. Во-первых, описаны способы приготовления различных растворов компонентов, за которыми следуют способы формирования активного нематика с использованием двух различных геометрий проточной камеры. Показаны типичные результаты визуализации. Наконец, описаны методы ограничения активного нематита в скважинах и каналах.
Protocol
1. Подготовка активного вещества
ПРИМЕЧАНИЕ: 2D-активный немат собирается в трехэтапный процесс. Сначала готовят два отдельных раствора: а) полимеризованные, стабилизированные микротрубочки и б) МИКС (раствор, содержащий кинезиновые двигатели). Они комбинируются, и активность инициируется при добавлении аденозинтрифосфата (АТФ). Затем материал ограничивается подходящей геометрией, так что его плотность достаточно высока для возникновения нематического порядка. Включены протоколы для подготовки всех необходимых компонентов и того, как собрать активную фазу.
- Кластерный препарат кинезинового моторного белка
- Экспрессируйте и очищайте рекомбинантные моторные белки K401-BIO (двигатели K401) из кишечной палочки в соответствии с протоколом Edgar C. Young20.
ПРИМЕЧАНИЕ: Моторные белки K401-BIO являются димерными и состоят из двух головок, соединенных спиральным стеблем. Двигатели были поставлены заводом по производству биоматериалов Brandeis и использовались, как сообщалось ранее16. Для целей формирования активного нематика молекулы кинезина биотинилируют, а затем соединяют через стрептавидиновую связь с образованием кинезиновых кластеров до четырехдвигателей 13,15,21,22. Полезно экспрессировать кинезин с помощью метки зеленого флуоресцентного белка (GFP). - После очистки и инкубации стрептавидина и моторов на льду в течение 40 мин во вспышке-замораживании двигателей К401 в жидком азоте в 5 мкл аликвот в конечной концентрации 0,7 мг/мл и хранят при -80 °С.
ПРИМЕЧАНИЕ: Здесь эксперимент можно приостановить. Осторожно разморозьте кинезин, когда это необходимо, и не замораживайте повторно. - Получают кластеры меченого биотином кинезина (KSA), смешивая 24 об.% двигателей K401 0,7 мг/мл, 27 об.% стрептавидина 0,325 мг/мл и 3 об.% 5 мМ дитиотрейтола (DTT) (для предотвращения агрегации) при 4 °C в буфере M2B 46 об.м( 80 мМ PIPES [1,4-Пиперазиндиэтансульфоновая кислота, рН 6,8], 2 мМMgCl2 и 1 мМ EGTA [этиленгликоль-бис(β-аминоэтиловый эфир)-N, N,N',N'-тетрауксусная кислота]). Дайте КСА инкубироваться на льду в течение 40 минут.
- Экспрессируйте и очищайте рекомбинантные моторные белки K401-BIO (двигатели K401) из кишечной палочки в соответствии с протоколом Edgar C. Young20.
- Приготовление раствора микротрубочек
ПРИМЕЧАНИЕ: Гуанозин-5'-[(α,β)-метилено]трифосфат, натриевая соль (GMPCPP) является медленно гидролизуемым аналогом гуанозинтрифосфата (GTP), а микротрубочки, образующиеся в присутствии GMPCPP, в три раза жестче, чем микротрубочки GTP23 и короче. Использование коротких, жестких микротрубочек благоприятно для образования активной нематической фазы, поскольку эти факторы в совокупности способствуют жидкокристаллическому упорядочению.- Полимеризовать немаркированный циклированный тубулин (99%, см. Таблицу материалов) с использованием 0,6 мМ GMPCPP при концентрации тубулина 6 мг/мл.
ПРИМЕЧАНИЕ: Высококачественный тубулин также может быть очищен из коровьего или свиного мозга в соответствии с установленными протоколами или получен из другого надежного источника, такого как завод по производству биоматериалов Brandeis, где материалы могут быть отправлены замороженными для предотвращения повреждения. Для очистки тубулина из мозга крупного рогатого скота, пожалуйста, обратитесь к опубликованному протоколу Bate et al.24. Для очистки тубулина из мозга свиней обратитесь к опубликованным протоколам castoldi et al.25 и Tayar et al.26. - При подготовке к полимеризации готовят тепловую ванну при 37 °C и предварительно охлаждают центрифугу до 4 °C. Объедините немаркированный раствор тубулина в буфере M2B (стадия 1.1.3) в ультрацентрифужной трубке объемом 500 мкл с 4 моль% меченым родамином тубулином (см. Таблицу материалов) для получения 4% меченых микротрубочек после полимеризации.
- Проверьте концентрацию тубулина с помощью анализа Брэдфорда27. Общая концентрация тубулина в центрифужной трубке должна составлять 6,5-6,9 мг/мл.
- Инкубировать тубулиновую смесь на льду в течение 10 мин и ультрацентрифугу в течение 10 мин при 352 700 х г при 4 °C. Этот шаг удаляет дисфункциональный тубулин, который будет находиться в грануле.
- Используя пипетку, осторожно извлеките супернатант, содержащий функциональный тубулин, в микроцентрифужную трубку. Добавьте GMPCPP к конечной концентрации 0,6 мМ, чтобы индуцировать полимеризацию тубулина, и DTT до конечной концентрации 1 мМ для предотвращения агрегации белка.
- Инкубируют смесь в тепловой ванне при 37 °С в течение 30 мин, затем снова центрифугируют в течение 10 мин при 14 000 х г при комнатной температуре. Удалите супернатант, затем разбавьте гранулу буфером M2B, чтобы достичь конечной концентрации микротрубочек 6 мг/мл.
ПРИМЕЧАНИЕ: Этот раствор можно хранить при комнатной температуре не менее 4 ч перед использованием. - Чтобы убедиться, что микротрубочки успешно полимеризовались, разбавляют 1 мкл раствора микротрубочек 100:1 буфером M2B и пипеткой на предметном стекле микроскопа. Крышка с крышкой для визуализации с помощью флуоресцентного микроскопа (см. Таблицу материалов) с объективом 40x.
ПРИМЕЧАНИЕ: Длины волн возбуждения и излучения выбираются в соответствии с флуоресцентной маркировкой, используемой на микротрубочках. В этом протоколе используется маркировка родамина (см. шаг 1.2.2), поэтому визуализацию проводят с использованием полосы возбуждения 515-560 нм и фильтра длинных проходов 590 нм. На рисунке 1 показан репрезентативный пример. - После завершения полимеризации заморозьте микротрубочки в виде 2 мкл аликвот в жидком азоте и храните при -80 °C (при необходимости).
- Полимеризовать немаркированный циклированный тубулин (99%, см. Таблицу материалов) с использованием 0,6 мМ GMPCPP при концентрации тубулина 6 мг/мл.
- Приготовление МИКС
ПРИМЕЧАНИЕ: MIX представляет собой водный раствор, который включает в себя кинезин-стрептавидиновые кластеры (KSA). Приготовленный МИКС следует хранить при -80 °C в 4 мкл аликвотах до начала эксперимента. Когда MIX сочетается с АТФ и раствором микротрубочек, описанным на этапе 1.2 при комнатной температуре, инициируется активность. МИКС готовится следующим образом 13,19.- Приготовьте раствор для предотвращения затухания флуоресценции (ANTIFADE) путем смешивания двух антиоксидантных растворов. Комбинируйте AO1 (250 мМ DTT, 65 мМ каталазы) и AO2 (750 мкМ каталазы, 3 мМ глюкозооксидазы) в объемном соотношении 1:1. Включают 20 мМ Тролокс, еще один антиоксидант, используемый для уменьшения повреждений, вызванных флуоресцентной микроскопией.
- Готовят MIX путем приготовления раствора KSA (описанного на стадии 1.1.3), который включает 6 мас.% полиэтиленгликоля 20 кДа (ПЭГ) для индуцирования объединения микротрубочек, 3 об.% ANTIFADE и 5 об.% пируваткиназы/молочной дегидрогеназы (PKLDH) при 70 мг/мл для регенерации АТФ.
2. Создание активного немата
ПРИМЕЧАНИЕ: Активность в материале инициируется добавлением СПС. Активную сеть готовят свежей для каждого эксперимента путем добавления АТФ в концентрации, достаточно высокой, чтобы вызвать двигательную активность. Для формирования равномерной, полностью развитой активной нематической фазы микротрубочки должны иметь достаточно высокую плотность. Это может быть достигнуто путем ограничения микротрубочек между двумя несмешивающимися жидкостями с образованием двумерного (2D) активного нематического слоя. Этот метод был первоначально разработан в Университете Брандейса13 и остается популярной техникой для получения однородной, высококачественной, активной нематической фазы.
- Метод проточных клеток для активного нематического образования
- Приготовьте гидрофильные покровы с акриламидным покрытием.
- Тщательно очистите крышки мыльной водой, этанолом и 0,1 М NaOH с помощью чередующихся полосканий с использованием наночистой воды. После промывки покрывают покровные листы раствором силана, состоящим из 100 мл этанола, 1 мл уксусной кислоты и 500 мкл 3-(триметоксисилила) пропилметакрилата в течение 15 мин, затем смывают наночистой водой.
- Готовят раствор акриламида из 95 мл наночистой воды и 5 мл 40 мас.% акриламида, затем дегазируют раствор в течение 30 мин в вакуумной печи.
- Добавьте 35 мкл тетраметилэтилендиамина (TEMED) для конечной концентрации 2,3 мМ, а затем 0,07 г персульфата аммония. Вылейте раствор акриламида поверх покровов лицевой стороной вверх и высиживайте на ночь при комнатной температуре.
- Подготовьте слайды гидрофобного микроскопа. Пипетка 100 мкл водоотталкивающего раствора (см. Таблицу материалов) на предметное стекло микроскопа, затем поместите сверху еще один прозрачный стеклянный слайд. Это обеспечивает равномерное покрытие водоотталкивающего раствора на поверхности, где он находится в течение 2 мин. Через 2 мин снимите второй стеклянный слайд и тщательно промойте первый слайд наночистой водой, затем высушите газообразным азотом. Аккуратно очистите область, где будет помещена лента (вокруг рисунка) ацетоном, чтобы водоотталкивающий раствор не препятствовал адгезии к стеклу.
- Приготовьте смесь инженерного масла, которая включает 1,8% (v/v) 008-FluoroSurfactant (см. Таблицу материалов).
- Соберите стеклянную горку и крышку с гидрофобным стеклянным слайдом на нижней части проточной ячейки и гидрофильным покрытием в качестве верхней поверхности в геометрии сэндвича с помощью двухсторонних клеевых распорок длиной 40 мкм. Поместите распорки на расстоянии 1,5 мм друг от друга на слайде гидрофобного микроскопа. Затем поместите покрытую акриламидом крышку поверх распорок обработанной стороной вниз, чтобы приклеиться. Убедитесь, что адгезия завершена давлением от тупого предмета.
ПРИМЕЧАНИЕ: Цель состоит в том, чтобы собрать проточную ячейку с плоской границей раздела масло/вода внутри (рисунок 2A,B). Именно здесь будет формироваться активный слой. Альтернативные распорные ленты и пленки также могут быть использованы для получения аналогичной толщины ячейки. - После того, как проточная ячейка была построена, немедленно пипетка масляной смеси в проточную ячейку, заполняя замкнутое пространство.
- Используя пипетку, в отдельном флаконе аккуратно смешивают 6 мкл активного вещества с 3,73 мкл MIX, 1 мкл раствора микротрубочек, 0,6 мкл раствора АТФ (концентрация может варьироваться для изменения скорости микротрубочек) и 0,67 мкл буфера M2B.
- Пипетка только что смешала активный материал в один открытый конец проточной ячейки, объемы будут варьироваться, но должны превышать объем проточной ячейки (примерно 3-6 мкл). Некоторое количество масла будет вытеснено водным раствором при впрыскивании в канал; это может быть покрыто на противоположном конце проточного канала с помощью небольшого кусочка папиросной бумаги.
- После заполнения запечатайте обе стороны проточной ячейки эпоксидным клеем (см. Таблицу материалов), который затвердевает при воздействии ультрафиолетового излучения в течение 20 с.
ПРИМЕЧАНИЕ: В этот момент активный материал образует 3D-сеть, которая остается взвешенной в слое воды. - Чтобы ограничить активный слой между двумя несмешивающимися жидкостями в квази-2D-слой, поместите проточную ячейку в качающуюся центрифугу (см. Таблицу материалов) с водной фазой сверху и более плотным масляным слоем внизу. Центрифуга при 212 х г в течение 10 мин. После завершения этого шага проточную клетку можно отвести в эпифлуоресцентный микроскоп для визуализации с объективом с увеличением 10 или 20 раз. На рисунке 2C,D показаны типичные изображения до и после этого шага.
- Приготовьте гидрофильные покровы с акриламидным покрытием.
- Инвертированный метод активного нематического образования
ПРИМЕЧАНИЕ: Альтернативный способ, описанный на этапе 2.1, заключается в сборке активного нематического слоя под толстым нефтяным слоем, ограниченным глубокой скважинойPDMS 28. Этот метод дает аналогичные результаты, и его несколько легче освоить; однако качество изображения с использованием этого метода обычно не так хорошо, как у метода проточных ячеек.- Приготовьте полидиметилсилоксан (PDMS) с использованием эластомерного отверждающего агента и эластомерного основания (см. Таблицу материалов). Смешайте два компонента в соотношении 1:10 с помощью металлического шпателя. Во время перемешивания появляются крошечные пузырьки, которые трудно удалить, и смесь кажется молочной. Чтобы удалить эти пузырьки, поместите смесь под вакуум для дегазации в течение 1 ч, после чего неотвержденная PDMS должна казаться прозрачной.
ПРИМЕЧАНИЕ: PDMS теперь готов к формированию любой формы с помощью пресс-формы, или он может отверждаться в контейнере, а затем быть разрезан или пробит в нужном шаблоне. - Вылейте PDMS в подходящую форму и оставьте на ночь для отверждения при 60 °C.
ПРИМЕЧАНИЕ: Необработанная поверхность отвержденной PDMS является гидрофобной, но при обработке поверхности ее можно сделать гидрофильной. - Для получения гидрофильной поверхности PDMS покройте PDMS акриламидной полимерной щеткой29. Этот шаг также предотвращает прилипание белков к поверхности.
- Начните с очистки PDMS в течение 10 минут этанолом и изопропанолом, затем тщательно промойте деионизированной водой 3x и высушите. Используйте плазменный очиститель в течение 5 минут, чтобы очистить сухую, отвержденную PDMS. Этот шаг делает поверхность более гидрофильной.
- Затем готовят раствор силана (98,5 мас.% этанола, 1 мас.% уксусной кислоты и 0,5 мас.% триметоксисилилпропилметакрилата) и погружают субстрат в этот раствор на 15 мин для подготовки к акриламидному покрытию. Тщательно промойте субстрат деионизированной водой и погрузите в раствор акриламида (2 мас.% раствора акриламида/биса, 2,3 мМ TEMED и 3 мМ персульфата аммония).
ПРИМЕЧАНИЕ: Эти субстраты можно хранить при комнатной температуре, покрытые раствором акриламида в стеклянной чашке Петри, и следует использовать в течение 2 недель.
- Когда поверхность будет готова к использованию, промойте ее деионизированной водой и высушите азотом для немедленного использования. Добавьте активную смесь (описанную на этапе 2.1.6) в скважины и сразу же добавьте силиконовую нефть сверху толщиной приблизительно 2 мм.
ПРИМЕЧАНИЕ: На этом этапе активная смесь будет зажата между маслом и гидрофильным покрытием на PDMS, но она все равно будет несколько трехмерной. - Чтобы протолкнуть материал дальше в 2D-слой, приклейте устройство PDMS на стеклянный слайд, поместите его в центрифугу с качающимся ведром и вращайте в течение 12 минут при 212 х г. Устройство нужно будет расположить так, чтобы силиконовое масло находилось поверх водного слоя. Репрезентативные результаты показаны на рисунке 3.
- Приготовьте полидиметилсилоксан (PDMS) с использованием эластомерного отверждающего агента и эластомерного основания (см. Таблицу материалов). Смешайте два компонента в соотношении 1:10 с помощью металлического шпателя. Во время перемешивания появляются крошечные пузырьки, которые трудно удалить, и смесь кажется молочной. Чтобы удалить эти пузырьки, поместите смесь под вакуум для дегазации в течение 1 ч, после чего неотвержденная PDMS должна казаться прозрачной.
3. Подготовка активных нематик в замкнутых геометриях
ПРИМЕЧАНИЕ: Активные нематики, такие как эта квазидвумерная система, могут быть сложными для ограничения небольшими микрофлюидными геометриями, такими как колодцы или каналы. Здесь описан надежный метод ограничения материала в скважинах PDMS различной формы.
- Во-первых, спроектируйте мастер-форму для PDMS. Это может быть достигнуто путем 3D-печати столбов на подложке. После 3D-печати форму из смолы очистите изопропанолом, а затем отвержьте форму под ультрафиолетовой лампой в течение 45 минут и в духовке при 120 °C в течение 2 ч (рисунок 4).
ПРИМЕЧАНИЕ: Отверждение под ультрафиолетовым и термическим постотверждением улучшает качество репликации в PDMS путем удаления мономеров и остатков фотоингибаторов из смолы30. - Используйте мастер-форму для создания колодцев из PDMS. Подготовьте PDMS, как описано в шаге 2.2.1. Погрузите основную форму в неотвержденную PDMS и отверждайте на ночь в духовке при температуре 60 °C.
- После завершения отверждения PDMS аккуратно удалите основную форму и вырежьте PDMS по желанию для работы со скважинами (рисунок 4). Обработайте поверхность PDMS, как описано на этапе 2.2.3. Перед экспериментом поверхность может быть прикреплена к стеклянному слайду с помощью эпоксидного клея, чтобы облегчить визуализацию.
- Пипетку 1 мкл активной смеси, описанной на стадии 2.1.6, на подложку PDMS и немедленно добавляют силиконовое масло с вязкостью 100-1000 сСт28 поверх активной сетевой капли. Активная сеть переместится в скважину; этот процесс занимает до 60 мин (рисунок 4). Как описано в шаге 2.2.5, 2D-сеть может быть улучшена путем вращения скважины PDMS в центрифуге качающегося ковша в течение 12 мин при 212 x g.
Results
На рисунке 1 показано репрезентативное изображение одиночных микротрубочек, полученных из тубулина GMPCPP. На изображении изображены короткие микротрубочки одинаковой длины (с некоторой дисперсией). Достаточное разбавление раствора микротрубочек должно дать изображение хорошо разделенных микротрубочек для проверки длины. Отдельные микротрубочки могут быть сложными для изображения из-за их небольшого размера. Использование высокочувствительной камеры, предназначенной для флуоресцентной микроскопии, лучше всего подходит для этого применения. На рисунках 2 и 3 показаны примеры флуоресцентной микроскопии изображений успешных экспериментов, выполненных с использованием метода проточных клеток (раздел 2.1) и инвертированного метода (раздел 2.2) соответственно. Хорошо сформированный активный нематический слой однородн по текстуре, без значительных пустот и подвижных топологических дефектов. Обратите внимание, однако, что в дефектных сердечниках могут быть некоторые приемлемые небольшие пустоты. В дополнение к примерам, показанным на рисунках 2 и 3, были включены три дополнительных фильма (Фильм 1, Фильм 2 и Фильм 3), чтобы продемонстрировать, как активный нематик должен выглядеть в успешном эксперименте. Все фильмы демонстрируют плавное непрерывное движение активной нематической фазы. Никаких изменений в концентрации микротрубочек не наблюдается после того, как материал достиг своего устойчивого состояния. До тех пор, пока в системе присутствует достаточное количество АТФ, материал будет продолжать двигаться равномерно.
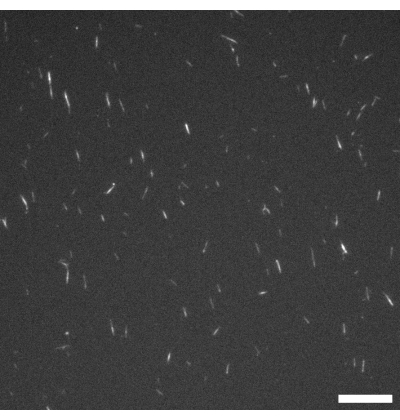
Рисунок 1: Флуоресцентный микроскоп изображения микротрубочек GMPCPP. Микротрубочки GMPCPP маркировали на 4% с помощью тубулина родамина и полимеризовали в течение 20 мин при 37 °C. Визуализацию проводили при комнатной температуре. Шкала = 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
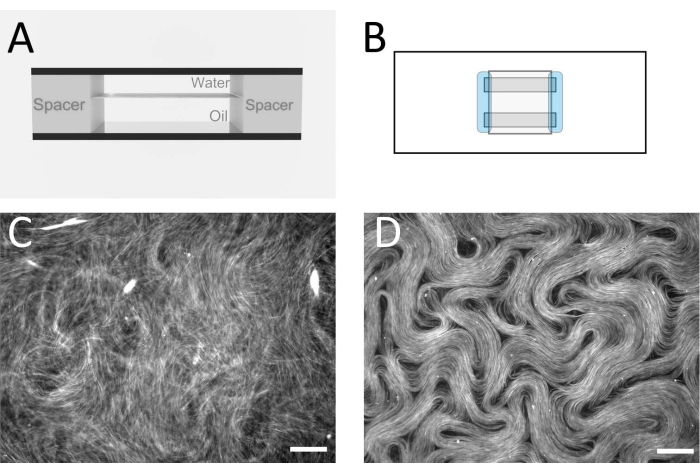
Рисунок 2: Микротрубочка нематика в проточной ячейке. (А) Схема поперечного сечения проточной ячейки, геометрия 1 мм x 18 мм. (B) Схема проточной ячейки вид сверху. (C) Изображение флуоресцентной микроскопии, демонстрирующее типичный внешний вид активного раствора перед сборкой на границе раздела масло/вода. (D) Флуоресцентное микроскопическое изображение активной нематической фазы, собранной на границе раздела масло/вода внутри проточной ячейки. Шкала = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Изображение флуоресцентного микроскопа, показывающее активный немат, приготовленный с использованием инвертированного метода. Шкала = 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
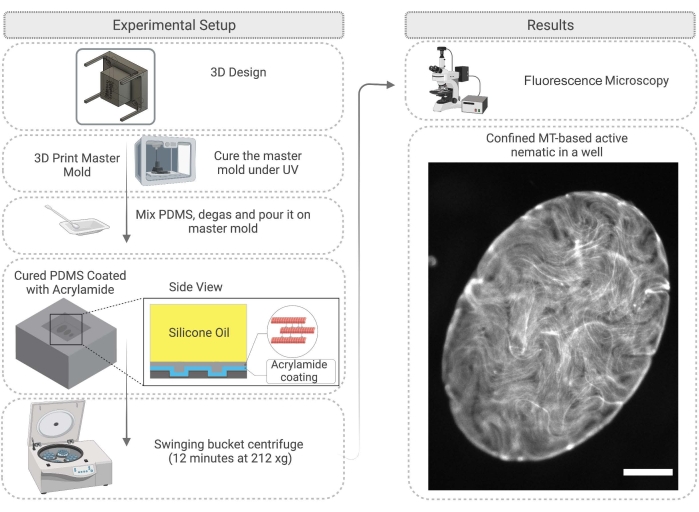
Рисунок 4: Блок-схема, иллюстрирующая метод активного нематического удержания в скважине PDMS, включая изготовление пресс-формы и обработку поверхности. Шкала на правом изображении (ограниченный активный материал) = 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Фильм 1: Репрезентативный результат для активного немата, полученный методом проточной ячейки. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 2: Репрезентативный результат для активного немата, подготовленный с использованием инвертированного метода. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 3: Репрезентативный результат для активного нематика, полученный с использованием перевернутого метода, ограниченного эллиптической скважиной. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Discussion
В протоколах есть несколько моментов, в которых экспериментатор может сделать некоторые важные проверки. Перед заполнением любого из устройств активным материалом следует использовать флуоресцентную микроскопию (см. Рисунок 1), чтобы проверить, что микротрубочки полимеризованы и в идеале ~ 2-3 мкм в длину. Если микротрубочки не видны под микроскопом, они могут деполимеризоваться и активный нематик не образуется. Поскольку отдельные микротрубочки очень малы, может быть сложно наблюдать их непосредственно через микроскоп. В этом исследовании высококачественная флуоресцентная камера, предназначенная для сложных приложений при слабом освещении, использовалась с соответствующим программным обеспечением для проверки роста нити накала. Значительные флуоресцентные агрегаты не должны присутствовать на этой стадии, так как это может указывать на деполимеризацию или наличие денатурированного белка. Также неплохо было бы сделать простой тестовый слайд микроскопа, объединив микротрубочки, MIX и АТФ в тех же соотношениях, которые описаны в протоколах. Деятельность должна начинаться с объединения компонентов, и материал должен выглядеть похожим на то, что показано на рисунке 2C , с присутствующими пучками и заметными движениями нити, видимыми повсюду.
При использовании метода проточной ячейки время центрифуги и ориентация проточной ячейки важны для формирования однородного активного слоя. Этот шаг может потребовать некоторой тонкой настройки в зависимости от типа используемой центрифуги. Центрифугирование проточной ячейки с активной плоскостью, ориентированной перпендикулярно плоскости вращения, дает наилучшие результаты, поскольку материал может быть равномерно выталкнут на границу раздела жидкости. Дважды проверьте, что проточная ячейка тщательно герметизирована перед центрифугированием.
При использовании инвертированного метода для получения замкнутой активной нематики существует несколько этапов оптимизации. Во-первых, важно использовать метод 3D-печати, который создает структуры с высоким разрешением. Неровные боковые стенки могут привести к тому, что микротрубочки зацепятся, что нарушит потоки. Скважины не должны быть слишком глубокими (в данном исследовании использовались скважины глубиной 150-200 мкм с вышележащим нефтяным слоем толщиной 2 мм). Экспериментаторам, возможно, придется немного скорректировать эти параметры методом проб и ошибок, чтобы получить наилучший результат.
Метод проточных ячеек и инвертированный метод были использованы различными авторами для изучения различных эффектов, которые влияют на активные потоки, включая различные масла12 и погружные структуры13. Выбор метода зависит от экспериментальной цели. Используя метод проточных клеток, оптическая визуализация сверху активного слоя более четкая, чем для инвертированного метода из-за различных вышележащих жидкостей. В методе проточных ячеек визуализация осуществляется через стеклянную крышку и тонкий слой воды, тогда как инвертированный метод предназначен для того, чтобы иметь масляный слой сверху. Это означает, что для инвертированного метода требуется объектив большого рабочего расстояния, а качество изображения снижается. Различия в качестве изображения можно увидеть, сравнив рисунок 2D (метод проточной ячейки) и рисунок 3 (инвертированный метод), а также фильм 1 и фильм 2 соответственно. Для рисунка 3 требовалась меньшая увеличительная линза с большим рабочим расстоянием, чем та, которая использовалась на рисунке 2. Этих недостатков визуализации для инвертированного метода можно избежать, если имеется подходящий инвертированный микроскоп в сочетании с целями с соответствующим рабочим расстоянием для подложек микроскопа. Более тонкое стекло может быть использовано в качестве подложки, чтобы обеспечить использование стандартных целей рабочего расстояния.
В качестве преимущества, перевернутая геометрия позволяет использовать более широкий диапазон вязкости масла, не обязательно требует центрифугирования качающегося ковша (если это недоступно), а подготовка системы относительно проще после подготовки формы. Однако для удержания в скважинах с использованием перевернутого метода некоторая центрифугирование может быть важной для получения материала в четко определенный 2D-слой.
Метод проточных ячеек в последнее время очень успешно используется в экспериментах, где требуется непрерывный активный слой. В нашей недавней работе рассматривалась динамика топологических дефектов в активном слое, где важно высокое качество изображения и анализа текстур19. Кроме того, метод проточных ячеек был использован для исследования влияния погруженных в масло микроструктур на активные потоки16 и столбы для улавливания дефектов в активных потоках31. Этот метод очень хорошо работает для формирования непрерывного активного слоя, а качество изображения отличное. Тем не менее, стадия центрифугирования, используемая для получения конечного 2D-активного слоя, может быть трудной для выполнения, а проточные ячейки подвержены утечкам и пузырькам воздуха. Инвертированный метод является очень полезной альтернативой с высоким уровнем успеха, прост в строительстве и может быть использован для любого рисунка подложки или геометрии при условии создания 3D-печатной формы с высоким разрешением. Этот метод также полезен для изучения влияния геометрического удержания на активную нематическую динамику, поскольку он делает заполнение скважин относительно простым.
В этой статье описаны два способа формирования активного нематика из микротрубочек и кинезиновых двигателей, а также методика ограничения материалов в скважинах. Представленная система представляет собой самый чистый пример активной нематической фазы в настоящее время в литературе и была воспроизведена несколькими группами по всему миру. Значение этого материала заключается не только в биологическом происхождении его компонентов, но и в том, что он открывает совершенно новое направление в активных упорядоченных жидкостях. Работая с этой системой и выясняя ее фундаментальные свойства, ученые могут перейти к проектированию полностью синтетических активных фаз.
Эксперименты, сосредоточенные на влиянии конфайнмента на активную нематику, могут ответить на фундаментальные вопросы, касающиеся поведения активных потоков и динамики топологических дефектов в условиях топологического удержания. Метод, представленный здесь, поможет в выполнении различных экспериментов, ориентированных на геометрию, и их анализе, включая микрофлюидику и активное смешивание.
Disclosures
Некоторые материалы, использованные в этой работе, были предоставлены бесплатно компанией Cytoskeleton Inc. (Денвер, США).
Acknowledgements
Авторы хотели бы отметить награду Национального научного фонда (NSF) DMR-1808926 за щедрое финансирование. Проект также был поддержан NSF через Центр передового опыта исследований в области науки и техники: Центр клеточных и биомолекулярных машин в Калифорнийском университете Мерсед (HRD-1547848) и Центр исследований материалов и инженерии Brandeis Biomaterials (DMR-2011486). Мы хотели бы поблагодарить доктора Бин Лю из Калифорнийского университета Merced за помощь в 3D-печати пресс-формы и доктора Жорди Игнеса за научные советы при разработке перевернутого экспериментального метода.
Materials
| Name | Company | Catalog Number | Comments |
| 20 kD PEG (polyethylene glycol)) | Sigma Aldrich | 1419109 | Depletion agent CAS Number: 125061-88-3 |
| 3-(trimethoxysilyl)propyl methacrylate | Sigma Aldrich | M6514-50ML | CAS Number: 2530-85-0 |
| 3D printer & Resin | Phrozen | Phrozen sonic mini 8K 3D printer - Aqua Gray 8K resin | |
| 40% Acrylamide Solution | BIO-RAD | 1610140 | CAS Number: 7732-18-5, 79-06-1 |
| Acetic Acid | Fisher | CAS Number: 64-19-7 | |
| Acetone | Sigma Aldrich | CAS Number: 67-64-1 | |
| Adhesive sheets (NOTE: "Parafilm" is an alternative) | Grace Bio-Labs | 620001 | SecureSeal |
| Ammonium Persulfate | Sigma Aldrich | A3678 | CAS Number: 7727-54-0 |
| Aquapel (NOTE: "RainX" is an alternative) | Aquapel Glass Treatment | hydrophobic glass treatment | |
| ATP (Adenosine triphosphate) | Sigma Aldrich | A1852 | CAS Number: 34369-07-8 |
| Beakers | VWR | ||
| Catalase | Sigma Aldrich | C9322 | CAS Number: "9001-05-2" |
| Desiccator | Bel-art | ||
| Digital CMOS camera | Hamamatsu | ORCA - Flash4.0 LT+ | |
| DTT (Dithiothreitol) | Sigma Aldrich | D9779 | CAS Number: "3483-12-3" |
| EGTA (3,12-bis(carboxymethyl)-6,9-dioxa-3,12-diazatetradecane-1,14-dioic acid) | Sigma Aldrich | MFCD00004291 | CAS Number: 67-42-5 |
| Ethanol | Sigma Aldrich | CAS Number: 64-17-5 | |
| Fluorescence microscope | Leica | DM 2500P | |
| Glass Coverslips | VWR | 48368-040 | |
| Glass Slides | VWR | 16004-430 | |
| Glucose | Sigma Aldrich | G7021 | CAS Number: 50-99-7 |
| Glucose Oxidase | Sigma Aldrich | 345386 | CAS Number: 9001-37-0 |
| GMPCPP (guanylyl 5'-α,β-methylenediphosphonate) | Jena Bioscience | NU-405S | CAS Number: 14997-54-7 |
| HFE7500 Oil | 3M | ||
| Hot Plate | Fisher Scientific | Thermix hot plate model 100M | |
| Isopropyl Alcohol | VWR | ||
| KCl (potassium chloride) | Sigma Aldrich | P5405 | CAS Number: 7447-40-7 |
| Methanol | Sigma Aldrich | CAS Number: 67-56-1 | |
| MgCl2 (Magnesium Chloride) | Sigma Aldrich | 208337 | CAS Number: 7786-30-3 |
| Microcentrifuge tubes | Eppendorf - Thermo Fisher | 1.5 mL | |
| Nanopure water purifier | Sartorius | arium mini | |
| NaOH (Sodium hydroxide) | Sigma Aldrich | SX0603 | CAS Number: 1310-73-2 |
| Petri Dishes | VWR | ||
| PH Meter | Thermo Scientist | Orion 3 STAR | |
| Phosphoenol-pyruvate (PEP) | Sigma Aldrich | MFCD00044476 | CAS Number: 4265-07-0 |
| PIPES (1,4-Piperazinediethanesulfonic acid) | Sigma Aldrich | CAS Number: 5625-37-6 | |
| Pipettes (0.2 - 1000 µl) | VWR | ||
| Pluronic F-127 | Sigma Aldrich | 2594628 | |
| RAN Surfactant (NOTE: "FluoSurf" from Emulso is an alternative) | Ran Biotechnologies | 008-FluoroSurfactant-2wtH-50G | |
| Silicon Oil (100mpa s-1000 mpa s) | Sigma Aldrich | CAS Number: 63148-52-7 | |
| Streptavidin | Thermofisher | S888 | |
| Swinging Bucket Centrifuge | Thermo Scientist | Sorvall legend RT+ | |
| Sylgard 184 Elastomer base | World Precision Instruments | SYLG184 | |
| Sylgard 184 Elastomer Curing agent | World Precision Instruments | SYLG184 | |
| Table top centrifuge | Eppendorf | MiniSpin Plus | |
| TEMED (Tetramethylethylenediamine) | BIO-RAD | 1610800 | CAS Number: 110-18-9 |
| Trolox (6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid) | Sigma Aldrich | MFCD00006846 | CAS Number: 53188-07-1 |
| Tubulin | Cytoskeleton | T240-B | |
| Tubulin (Rhodamine labeled) | Cytoskeleton | TL590M-A | |
| Ultracentrifuge | Beckman | Optima Max-TL | |
| UV Light | RapidFix | ||
| UV-curable glue (NOTE: "Norland NO81" is an alternative) | RapidFix | ||
| Water Bath | Thelco | ||
| Whatman Filter paper | Sigma Aldrich | WHA1001325 |
References
- Sokolov, A., Aranson, I. S., Kessler, J. O., Goldstein, R. E. Concentration dependence of the collective dynamics of swimming bacteria. Physics Review Letters. 98 (15), 158102 (2007).
- Saw, T. B., et al. Topological defects in epithelia govern cell death and extrusion. Nature. 544 (7649), 212-216 (2017).
- Kawaguchi, K., Kageyama, R., Sano, M. Topological defects control collective dynamics in neural progenitor cell cultures. Nature. 545 (97654), 327-331 (2017).
- Toner, J., Tu, Y. Long-range order in a two-dimensional dynamical XY model: how birds fly together. Physics Review Letters. 75 (23), 4326-4329 (1995).
- Katz, Y., Tunstrøm, K., Ioannou, C. C., Huepe, C., Couzin, I. D. Inferring the structure and dynamics of interactions in schooling fish. Proceedings of the National Academy of Sciences. 108 (46), 18720-18725 (2011).
- Needleman, D., Dogic, Z. Active matter at the interface between materials science and cell biology. Nature Reviews Materials. 2 (9), 17048 (2017).
- Weirich, K., Dasbiswas, K., Witten, T. Self-organizing motors divide active liquid droplets. Proceedings of the National Academy of Sciences. 116 (23), 11125-11130 (2019).
- Memarian, F. L., et al. Active nematic order and dynamic lane formation of microtubules driven by membrane-bound diffusing motors. Proceedings of the National Academy of Sciences. 118 (52), (2021).
- Bausch, A., Sciortino, A. R. Pattern formation and polarity sorting of driven actin filaments on lipid membranes. Proceedings of the National Academy of Sciences. 118 (6), (2021).
- Maroudas-Sacks, Y., et al. Topological defects in the nematic order of actin fibres as organization centres of Hydra morphogenesis. Nature Physics. 17 (2), 251-259 (2021).
- Liu, J., et al. Topological braiding and virtual particles on the cell membrane. Proceedings of the National Academy of Sciences. 118 (34), (2021).
- Hirst, L. S. . Fundamentals of Soft Matter Science 2nd ed. , (2019).
- Sanchez, T., Chen, D., DeCamp, S., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Nedelec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Guillamat, P., Ignés-Mullol, J., Sagués, F. Taming active turbulence with patterned soft interfaces. Nature Communications. 8, 564 (2017).
- Thijssen, K., et al. Submersed micropatterned structures control active nematic flow, topology, and concentration. Proceedings of the National Academy of Sciences. 118 (38), (2021).
- Shendruk, T. N., Doostmohammadi, A., Thijssen, K., Yeomans, J. M. Dancing disclinations in confined active nematics. Soft Matter. 13 (21), 3853-3862 (2017).
- Giomi, L. Geometry and topology of turbulence in active nematics. Physical Review X. 5 (3), 031003 (2015).
- Tan, A. J., et al. Topological chaos in active nematics. Nature Physics. 15 (10), 1033-1039 (2019).
- Young, E. C., Berliner, E., Mahtani, H. K., Perez-Ramirez, B., Gelles, J. Subunit interactions in dimeric kinesin heavy chain derivatives that lack the kinesin rod. The Journal of Biological Chemistry. 270 (8), 3926-3931 (1995).
- Gilbert, S. P., Johnson, K. A. Expression, purification, and characterization of the Drosophila kinesin motor domain produced in Escherichia coli. Biochemistry. 32 (17), 4677-4684 (1993).
- Kuznetsov, S. A., Gelfand, V. I., Vernos, I. . Kinesin Protocol. 164, (2001).
- Hawkins, T. L., Sept, D., Mogessie, B., Straube, A., Ross, J. L. Mechanical properties of doubly stabilized microtubule filaments. Biophysics Journal. 104 (7), 1517-1528 (2013).
- Bate, T. E., Jarvis, E. J., Varney, M. E., Wu, K. Controlling flow speeds of microtubule-based 3D active fluids using temperature. Journal of Visualized Experiments. (153), e60484 (2019).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Tayar, A. M., Lemma, L. M., Dogic, Z. Assembling microtubule-based active matter.. Microtubules. , 151-183 (2022).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Guillamat, P., Ignés-Mullol, J., Shankar, S., Marchetti, M. C., Sagués, F. Probing the shear viscosity of an active nematic film. Physical Review E. 94 (6), 060602 (2016).
- Rudy, A., et al. Lubricous hydrogel surface coatings on polydimethylsiloxane (PDMS). Tribology Letters. 65, 3 (2017).
- Venzac, B., et al. PDMS curing inhibition on 3D-printed molds: Why? Also, how to avoid it. Analytical Chemistry. 93 (19), 7180-7187 (2021).
- Khaladj, D. A., Hirst, L. S. Using curved fluid boundaries to confine active nematic flows. Frontiers of Physics. 10, 880941 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved