大肠杆菌中天然偶联质粒介导的水平基因转移检测
In This Article
Summary
偶联通过动员质粒DNA跨两个不同细胞来介导水平基因转移,促进有益基因的传播。这项工作描述了一种广泛使用的高效检测共轭质粒转移的方法,该方法基于在共轭质粒、供体和受体中使用差异标记来检测转缀。
Abstract
偶联是促进革兰氏阴性细菌水平基因转移的主要机制之一。这项工作描述了以两个天然存在的质粒为例,描述了研究天然存在的共轭质粒动员的方法。这些方案依赖于供体、受体和共轭质粒中可选标记物的差异存在。具体而言,所描述的方法包括1)鉴定天然偶联质粒,2)固体培养中偶联速率的定量,以及3)通过聚合酶链反应(PCR)诊断检测转缀受体中的抗生素抗性基因和质粒复制子类型。这里描述的方案是在研究水平基因转移的进化生态学的背景下开发的,以筛选环境中发现的细菌中携带抗生素抗性基因的共轭质粒的存在。在这些培养实验中观察到的共轭质粒的有效转移突出了偶联作为促进水平基因转移的机制的生物学相关性,特别是抗生素耐药性的传播。
Introduction
1946年,Lederberg和Tatum1描述了大肠杆菌K-12的性过程,现在被称为共轭。细菌偶联是细菌细胞(供体)通过直接细胞间接触将遗传物质单向转移到另一个细胞(受体)的过程。偶联广泛分布在细菌2,3中,尽管表达偶联机制的供体细胞的比例通常非常小4。
质粒是自主复制的染色体外DNA元件。除了参与质粒复制和维持的基因外,质粒还经常携带大量参与适应环境挑战的基因,例如重金属或暴露于抗生素5。共轭质粒是一类具有一组特殊基因的质粒,允许它们转移到受体细胞并支持它们在转移后的持久性6。在假单胞菌门(变形杆菌的同义词)的细菌中,共轭质粒的大小从 21.8 kb 到 1.35 Mb 不等,中位数约为 100 kb5,7。它们通常也具有低拷贝数,可能是为了保持宿主的代谢负担低8,9。
典型的偶联装置由四个组成部分组成:转移起源(oriT),松弛酶,IV型偶联蛋白和IV型分泌系统(一种称为pilus的管状结构,允许供体联系受体)6。只有极一小部分携带共轭质粒的细胞表达偶联机制4,但如果质粒提供适应性优势,转缀子可以在群体中迅速扩增。从不同栖息地收集的大 肠杆菌 分离株中有35%至80%以上具有结合质粒,其基因对至少一种抗生素具有抗性10,11;因此,由共轭质粒介导的水平基因转移是推动抗生素耐药性基因全球传播的主要机制12。
在实验室培养中进行的交配实验表明,偶联频率受多种因素影响,包括受体细胞的性质、生长期、细胞密度、供体与受体比例、偶联是在液体还是固体培养基中进行、碳、氧、胆盐、金属浓度、哺乳动物细胞的存在、温度、pH 和交配时间13,14,15.
这项工作描述了检测给定宿主菌株中偶联质粒的存在,量化固体培养物中的偶联速率以及仔细检查其向受体细胞的转移的方案。这些方案可用作鉴定适合研究的天然偶联质粒的第一步。它们使用最少数量的简化步骤,因为它们旨在大规模(数十至数百个供体)筛选从多个来源(环境、共生和致病)获得的细菌中偶联质粒的存在。
此外,还显示了检测给定偶联质粒的动员是否独立于用于检测的抗生素(即,选择的抗生素抗性基因的相关性)的测试,并比较在不同环境分离株中发现的两种偶联质粒的偶联率。
基于相关偶联质粒(质粒复制子和抗生素抗性基因组成)的遗传组成,可以修改方案的每个步骤,以研究可能影响偶联速率的各种因素的影响。
一般实验设计:
建立交配实验所需的基本组成部分是供体细胞、受体菌株和用于选择供体(抗生素 A)、受体(抗生素 B)和转缀物(抗生素 A 和 B)的固体培养基。转缀物是稳定维持供体共轭质粒的受体细胞。
供体细胞对抗生素(抗生素A)耐药,并且对用于选择受体细胞的一个或多个标记物(抗生素B)敏感。抗生素耐药性基因的基因组位置(即,它是否位于供体细胞的染色体或质粒中)不必 先验地知道,因为将抗生素耐药性标志物动员到受体(在供体-受体直接接触后)意味着供体提供的标记物在质粒中。
受体菌株(已知需要结合质粒)需要具有供体中不存在的稳定可选标记;这种可选择的标志物通常对位于染色体中的抗生素或杀菌剂具有抗药性。选择用于交配实验的受体至关重要,因为一些 大肠杆菌 菌株在取结合质粒的能力方面有所不同16。
一旦建立了这些成分,在供体-受体对接触后,在同时使用抗生素(A和B)的培养基上生长的任何菌落都是推定的转缀物(图1)。这是假设供体可以在抗生素A的培养基中生长,但不能在抗生素B的培养基中生长,并且受体能够在抗生素B的培养基中生长,但不能与抗生素A一起生长。第一项测试包括检测(通过聚合酶链反应[PCR]扩增基因或其他方法)在转缀菌落的共轭质粒中发现的基因。第二个测试涉及使用基于乳糖代谢的差异菌落颜色标记。通过使用麦康基琼脂揭示了差异菌落颜色;琼脂中的乳糖可用作乳糖发酵(lac+)微生物的发酵源。这些微生物产生有机酸,特别是乳酸,从而降低pH值。中性红色是包含在培养基中的pH指示剂,当pH值降至6.817以下时,它从灰白色变为亮红色/粉红色。因此, 大肠杆菌 乳糖阳性菌株在麦康基琼脂上产生较大的粉红色菌落,而乳糖阴性菌株在麦康基琼脂上产生淡黄色和较小的菌落。
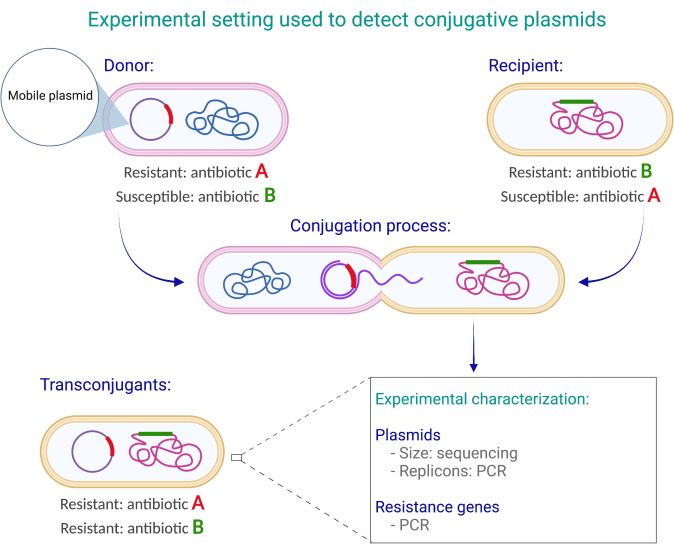
图 1:用于检测供体菌株中偶联质粒存在的实验设计。 在这个例子中,供体携带一个具有抗生素抗性基因的缀合质粒,该基因赋予对抗生素A的抗性,但他们对抗生素B敏感.相反,受体具有染色体抗性决定因素,可提供对抗生素B的保护,但它对抗生素A敏感。 因为它们具有供体的结合质粒,赋予对抗生素A的抗性,以及受体的染色体,赋予抗生素B 的保护。
供体-受体对的偶联率(在给定的实验条件下)可以通过将转缀物的数量除以供体数量或受体数量来计算;第一个速率表示供体16,18表现出偶联机制功能表达的供体细胞的比例,而第二个速率表示受体获取共轭质粒19,20的能力。在本研究中,除非另有说明,否则偶联率代表成为转缀的受体细胞的比例(即每个受体的速率)。
这里报告了两个独立的交配实验,涉及一个大肠 杆菌 接受者和两个 大肠杆菌 供体。此外,使用不同的抗生素为其中一个供体选择转缀物,以确认单个多药耐药质粒可以与结合质粒中发现的任何抗生素抗性基因一起选择。
这项工作中使用的供体和受体菌株已经过完全测序,以了解该实验系统的所有组成部分;然而,这些协议旨在筛选未知序列宿主中偶联质粒的存在,并且也可以用于该实验环境;然而,在这种情况下,首先对相关基因进行测序。
协议中使用的供体和受体菌株如下:
捐赠者 1. 大肠杆菌 SW4955是在巴吞鲁日(美国洛杉矶)的一个湖中收集的。它具有134,797 bp的偶联质粒(p134797),具有IncFIC(FII)和IncFIB(AP001918)复制子。该偶联质粒具有对第三代头孢菌素(blaCTX-M-55)、氨基糖苷类(aac(3)-IIa 和 aadA1)、苯尼科尔(catA2)、四环素(tet(A))、甲氧苄啶(dfrA14)和磺胺类(sul3)具有抗性的基因。有关p134797的完整地图,请参见 图2A。 大肠杆菌 SW4955是乳糖阳性,在麦康基琼脂上产生粉红色菌落。
捐赠者 2. 大肠杆菌 SW7037采集于伊利湖(美国俄亥俄州渥太华县)。它携带一个101,718 bp的偶联质粒(p101718),具有IncI1-I(Alpha)复制子。该偶联质粒具有对β-内酰胺类抗性(blaCMY-2)的基因。有关p101718的完整地图,请参见 图2B。 大肠杆菌 SW7037也是乳糖阳性,在麦康基琼脂上产生粉红色菌落。
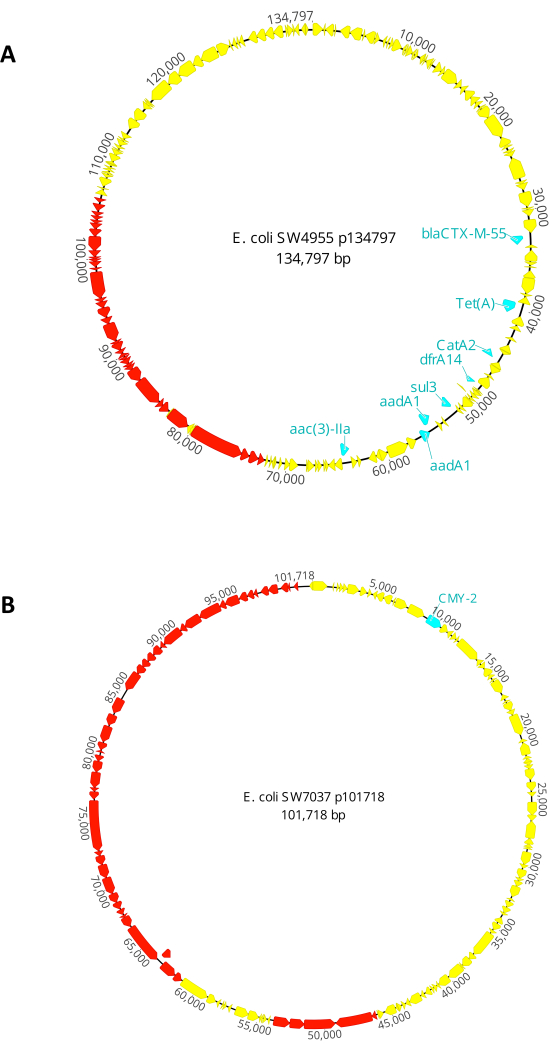
图2:本研究中使用的共 轭质粒的遗传图谱。 (A)质粒p134797,在 大肠杆菌 菌株SW4955中发现的共轭质粒。(B)质粒p101718,在 大肠杆菌 菌株SW7037中发现的共轭质粒。抗生素抗性基因以蓝色突出显示,属于偶联装置的基因以红色突出显示。 请点击此处查看此图的大图。
收件人。 大肠杆菌 LMB100 用作接收方。这是一种无质粒菌株,对利福平(100毫克/升)和链霉素(100毫克/升)耐药。对两种抗生素具有耐药性可降低供体中出现耐药性突变的可能性,从而干扰对结果的解释。此外, 大肠杆菌 LMB100是乳糖阴性的,可以与两种供体菌株区分开来,因为它在MacConkey琼脂上产生淡黄色和小菌落(而不是较大的粉红色菌落)。
当供体乳糖阴性时,我们建议使用乳糖阳性受者(例如 大肠杆菌 J53)。LMB100 和 J53 菌株可供其他实验室使用。请向 Gerardo Cortés-Cortés 博士发送请求,并提供地址和 FedEx 号码。
选择和计数供体、受体和转缀物所需的固体培养基是直径为 100 mm 的培养皿中的 MacConkey 琼脂。需要添加以下抗生素:(i)培养基A:羧苄青霉素(100毫克/升),以计算供体并确保受体不能与这种抗生素一起生长。(ii) 培养基B:利福平(100毫克/升)+链霉素(100毫克/升),以计算受者人数,并确保供体不能在这两种抗生素中生长。(三) 培养基AB:羧苄青霉素(100毫克/升)+利福平(100毫克/升)+链霉素(100毫克/升),以获得和计数转缀物。(iv) 培养基C:没有抗生素来划线所有研究的分离株。
比较了大肠杆菌SW4955和大肠杆菌SW7037与大肠杆菌LMB100的偶联质粒的偶联率。此外,在p134797结合质粒(SW4955菌株)的情况下,抗生素羧苄青霉素(100mg / L)在随后的实验中被庆大霉素(2mg / L),氯霉素(25mg / L),四环素(10mg / L),甲氧苄啶(20mg / L)或磺胺甲噁唑(100mg / L)取代,以确定用于选择的抗生素耐药性标记物是否对结果有任何影响。
Protocol
1. 方法一:共轭
- 第 1 天:对捐赠者和接受者进行条纹。与培养基C(不含抗生素的麦康基琼脂)上的甘油原液分开划线,并在37°C孵育过夜。
注意:此步骤对于确保使用纯分离株进行实验并通过菌落的颜色确认乳糖表型是必要的。 - 第 2 天:为每个供体和受体标记 14.0 mL 培养管。选择每个供体和受体的单个菌落,并在单独的14.0mL培养管中培养过夜(18小时),其中含有2mL Mueller Hinton肉汤,温度为37°C,并以200rpm振荡。
注意:在所使用的菌株中,在过夜培养18小时后达到固定相。 - 第 3 天:使用 1:10 稀释的 900 μL 盐水溶液和 100 μL 过夜培养物测量每个供体和受体的过夜培养物在 600 nm (OD 600) 处的光密度(无涡旋)。
- 用无菌盐水溶液(0.85%NaCl水溶液)将每个供体和受体的光密度调节至2.0(OD600 = 2.0)。
注意:OD600 = 2.0的大肠杆菌过夜培养物具有1.6 x 109 CFU/mL。 - 标记 1.5 mL 微量离心管“配对管”,指示供体和受体菌株。转移每个供体和受体的 500 μL 调整后 (OD600 = 2.0) 悬浮液,并将它们放入配对管中(该配对管将具有每个供体和受体的 0.8 x 109 CFU/mL)。通过倒置轻轻混合配管。
- 在室温下以500× g 离心配合管10分钟。
- 在不干扰沉淀的情况下,移出 800 μL 的共轭管。偶联管中应剩下 200 μL。
注意:将上清液丢弃到10%漂白剂容器中以灭活悬浮液中的细菌。 - 将交配管在培养箱中于37°C孵育18小时(过夜)。交配发生在孵化期间。
注意:此步骤必须在不摇晃的情况下完成,以免破坏共轭毛。 - 作为阴性对照,在培养基B上划线供体的过夜培养物,在培养基A上划线受体的过夜培养物。 将板在37°C孵育过夜
- 第 4 天:向配管中加入 800 μL 盐溶液并涡旋重悬(这会将配配混合物重新配制成 1 mL)。
注意:涡旋将交配细菌分解并匀浆培养物以定量CFU / mL。 - 准备 1:10 稀释液(从 1 x 100 到 1 x 10-7)的交配混合物。在培养基 A 和培养基 B 上培养 100 μL 稀释液 10-5 至 10-7 平板,并在培养基 AB 上所有稀释液。
注意:稀释100是指纯管。 - 让板干燥,然后再倒置放入培养箱中。将板在37°C孵育18小时(过夜)。
- 第5天:检查阴性对照,以确保供体的纯隔夜培养物条纹不会在培养基B上生长,受体的纯过夜培养物不会在培养基A上生长。
- 记录可计数的菌落和稀释液数量:
- 计算培养基A中的菌落;这些是捐助者。菌落应该是粉红色的(图3A,B)。
- 计数培养基B中的菌落;这些是受体和转缀物。菌落应为淡黄色(图3C)。
- 计算培养基AB中的菌落;这些是转缀物。菌落应为淡黄色。
注意:选择一个可数的板。可数板具有 30 到 300 个菌落(超过 300 个菌落很难计数,少于 30 个菌落被认为样本量太小,无法准确表示原始样品)。
- 计算每个供体或每个受体的缀合频率
每个供体的偶联频率 = (转缀物 [培养基 AB] 的 CFU/mL)/(供体的 CFU/mL [培养基 A]) x 100
每个受体的偶联频率 = (转缀物 [培养基 AB] 的 CFU/mL)/(受体和转缀物 [培养基 B] 的 CFU/mL) x 100
注意:此协议的偶联频率计算为转缀物除以受体数量乘以100。根据文献,所得的偶联量可命名为偶联频率、基因转移频率、偶联频率、重组产量、质粒转印效率、基于细菌总数的偶联频率、转缀物比例、受体群体中转缀物的比例、转缀频率、偶联频率、偶联速率对数、转移速率常数、每对偶联率, 共轭系数,或共轭效率20.该协议是指术语偶联效率。 - 将转缀物储存在-80°C的甘油储备液中。 按照制备甘油储备液的子步骤进行操作。
- 选择单个转缀物菌落,并在含有2mL补充有羧苄青霉素(100mg / L)的Mueller Hinton肉汤的5.0mL培养管中培养过夜(18小时),在37°C下并以200rpm振荡。
- 标记低温小瓶,指示转缀物的名称,如下所示:Tc+供体名称+培养基A中选择的抗生素(因为它们是转缀物,因此已知其背景是受体菌株,其已经对链霉素和利福平耐药,但还含有携带β-内酰胺抗性基因的质粒);例如,TcU1Carb。添加连续数字,以防需要存储来自同一供体的多个转缀物(例如,TcU1Carb1,TcU1Carb2等)。
- 将 1 mL 过夜培养物转移到 1 mL 50% 甘油(v / v;最终甘油浓度应为25%)中,并通过倒置轻轻混合。将低温小瓶放在干冰上15分钟,并将冷冻管储存在-80°C以备将来实验。
- 对于DNA提取,在补充有羧苄青霉素(100mg / L)的Mueller Hinton琼脂上划线甘油原液中的trasn缀合物,并在37°C下孵育过夜;然后,按照步骤 2.1 中的建议进行操作。
2. 方法2:聚合酶链反应(PCR)扩增大 肠杆菌 转缀物中的抗生素抗性基因和质粒复制子
注意:聚合酶链反应(PCR)由Kary Mullis博士于1983年开发。PCR取决于特定的引物(与给定DNA序列互补的一小段DNA,作为复制可以进行的点,通常长度为20-40个核苷酸,理想情况下鸟嘌呤-胞嘧啶含量为40%-60%),退火到变性双链DNA模板的相反链上,并通过热稳定的DNA聚合酶延伸, 从而为下一个反应循环生成附加模板,导致原始模板21的指数扩增。在该协议中,共轭质粒中存在的复制子和抗性基因被扩增以确认转缀受体细胞中的转移。
- 脱氧核糖核酸提取
- 为了检测共轭质粒携带的抗性基因的转移,请使用转缀DNA作为模板。使用简单的煮沸制备提取来裂解细菌细胞壁。
注意:简单的煮沸制备提取是裂解细菌细胞壁的简单方法。该提取包含与基因组DNA混合的质粒DNA,但由于引物是根据感兴趣的特定DNA序列设计的,因此该模板也可用于PCR。质粒也可以特异性纯化,尽管产量往往会随着质粒大小22的增加而下降。这是一个方便的停止点。DNA可以在-20°C下储存数月。
- 为了检测共轭质粒携带的抗性基因的转移,请使用转缀DNA作为模板。使用简单的煮沸制备提取来裂解细菌细胞壁。
- 聚合酶链反应
- 鉴于实验有阴性和阳性对照,在 1.5 mL 管中为所有反应设置一个池是有益的。将 1.5 mL 试管标记为“池”,并在所需的 PCR 管中标明基因和样品的名称(例如 OXA-U1)。
- 按以下顺序将PCR试剂移液到1.5 mL管中:无菌水,2x预混液,引物和聚合酶(模板DNA除外)(见 表1)。通过上下移液至少 10 次轻轻混合。全程在冰上。
注意:戴上手套以避免污染反应混合物或试剂。尽量避免在同一区域打开和混合试剂以及处理样品,以防止试剂污染。将试剂放入冰桶中以抑制核酸酶活性和非特异性启动。在建立反应之前让它们完全解冻。在整个实验过程中将试剂保持在冰上。最后加入Taq聚合酶,因为它对pH值变化敏感;它需要缓冲以避免退化或错误折叠。引物的序列列于表2-抗生素耐药基因-和表3-复制子23,24,25,26,27,28。 - 将模板DNA添加到相应的试管中。避免在PCR管上引入气泡并固定盖子。
- 将PCR管放入热循环仪中。
- 启动程序。请参阅 表2 (抗性基因)和 表3 (复制子)中为每个基因列出的程序设置。
注意:设置PCR程序以在运行后将样品保持在4°C。- 复制子的PCR条件:在94°C下变性5分钟,然后在94°C下变性30个循环1分钟,在60°C下退火30秒,在72°C下伸长1分钟,并在72°C下最终延长一个循环5分钟。
注意:这些是Carattoli等人标准化的条件29。
- 复制子的PCR条件:在94°C下变性5分钟,然后在94°C下变性30个循环1分钟,在60°C下退火30秒,在72°C下伸长1分钟,并在72°C下最终延长一个循环5分钟。
- 程序完成后,将PCR管储存在4°C。
注意:这是一个方便的停止点。PCR产物可在-20°C下储存数月 - 在 250 mL 烧瓶中称取 0.6 g 琼脂糖并加入 60 mL 1x Tris-乙酸酯-EDTA (TAE) 缓冲液(如果需要不同的凝胶尺寸,请调整试剂),制备 1% 琼脂糖凝胶。在微波炉中小心缓慢地融化琼脂糖,以避免琼脂糖溢出烧瓶,并使其冷却至约55°C(10-15分钟)。
- 使用超纯去离子水和分析级试剂制备所有试剂:
- TAE 50x 缓冲液(三碱、乙酸和 EDTA)(1 L):混合 121.1 克 Tris 碱 + 372.24 克 EDTA,加入 500 mL 蒸馏水。用磁力搅拌器溶解。加入 57.1 mL 乙酸,并加入蒸馏水至总体积为 1,000 mL。
- 在15psi,121°C高压灭菌15分钟,并在室温下保持直至准备好长达6个月。
- TAE 1x 缓冲液 (1 L):将 20 mL TAE 50x 缓冲液与 980 mL 蒸馏水混合。
- 在通风橱下,将 6 μL SYBR Green 加入融化的琼脂糖中,混合并倒入托盘(和梳子)中,先前用胶带密封以避免溢出。让凝胶凝固15-25分钟,直到出现浑浊。
注意:其他替代染料也可用30,31,32,33。 - 取下胶带并将凝胶放入电泳室中,加入足够的1x TAE缓冲液以覆盖凝胶。
- 将 5 μL 的 6x DNA 凝胶上样染料与每次反应的 25 μL 混合。通过上下移液至少 10 次轻轻混合。
注意:并非所有PCR产物都需要上样到凝胶中以可视化预期产物(相应地调整染料量)。剩余的PCR样品可以保存并在-20°C下储存数月。 - 将混合物装入孔中(避免引入气泡)并放下腔室盖。
注意:从阴性对照开始,将第一个样品装入第二个孔(将第一个样品保留到梯子上)。 - 将 4 μL 的 1 kb DNA 分子量标准品加载到第一个孔中。
- 在 120 V、400 mA 和 60 分钟下运行电泳。
- 在紫外光下(使用紫外照明器)可视化凝胶并记录图像。
注意:如果存在PCR产物,则可以使用标准紫外透射仪,可见光透射仪或基于激光的扫描仪检测染色的DNA条带。
| 试剂 | 储备液 | 加入到 50 μL 反应中的体积 (1x) | 最后 | 示例:音量 | 示例:音量 | 示例:添加到每个试管的体积 最终体积 50 μL | 体积添加到阳性对照 | 体积添加到阴性对照 |
| 浓度 | 添加到 1x | 添加到 3x(池) | ||||||
| 无菌水 | - | 21.5 μL (q.s. 至 50 μL) | - | 21.5 微升 | 64.5 微升 | 49 μL/管 | 49 μL/管 | 49 μL/管 |
| 预混液 | 2 倍 | 25 微升 | 1 倍 | 25 微升 | 75 微升 | |||
| 正向底漆 | 25微米 | 1 微升 | 0.5微米 | 1 微升 | 3 微升 | |||
| 反向底漆 | 25微米 | 1 微升 | 0.5微米 | 1 微升 | 3 微升 | |||
| 模板脱氧核糖核酸 | 可变 (100–200 纳克/μ升) | 可变 (1 μL) | 变量 | 0.5 微升 | 1.5 微升 | |||
| 聚合酶 | 5 单位/μL | 0.5 微升 | 2.5 单位 | - | - | 1 μL(转缀物) | 1 μL(供体) | 1 μL (收件人) |
| 注意:q.s.是量子卫星的拉丁语缩写,意思是所需的数量。 | ||||||||
表1:三种反应的PCR试剂和池(示例)。
| 引物(以 5' - 3' 方向列出的序列) | 聚合酶链反应程序 | 预期大小 |
| (bp)裁判。 | ||
| 布拉CTX-M 组 1 | 94 oC 7 分钟 | (864)23 |
| CTX-M: GGTTAAAAAATCACTGCGYC | 94 oC 50 秒(35 次循环) | |
| CTX-M: TTGGTGACGATTTTAGCCGC | 50 oC 40 秒 | |
| 68 oC 1 分钟 | ||
| 68 oC 5 分钟 | ||
| 布拉CMY-2 | 95 oC 3 分钟 | (1855)24 |
| CMY-2-F: GATTCCTTGGACTCTTCAG | 95 oC 30 秒(30 次循环) | |
| CMY-2-R: TAAAACCAGGTTCCCAGATAGC | 53 oC 30 秒 | |
| 72 oC 30 秒 | ||
| 72 oC 3 分钟 | ||
| 加气管(3')-二 | 94 oC 5 分钟 | (237)25 |
| AAC(3')-II-F: ACTGTGATGGGATACGCGTC | 94 oC 30 秒(32 个周期) | |
| AAC(3')-II-R: CTCCGTCAGCGTTTCAGCTA | 60 oC 45 秒 | |
| 72 oC 2 分钟 | ||
| 72 oC 8 分钟 | ||
| aadA | 94 oC 5 分钟 | (283)26 |
| aadA1: GCAGCGCAATGACATTCTTG | 94 oC 1 分钟(35 次循环) | |
| aadA2: ATCCTTCGGCGCGATTTTG | 60 oC 1 分钟 | |
| 72 oC 1 分钟 | ||
| 72 oC 8 分钟 | ||
| 硫-3 | 94 oC 5 分钟 | (799)27 |
| sul-3-F: GAGCAAGATTTGGAATCG | 94 oC 1 分钟 (30 个周期) | |
| sul-3-R: CATCTGCAGCTAACCTAGGGCTTTGGA | 51 oC 1 分钟 | |
| 72 oC 1 分钟 | ||
| 72 oC 5 分钟 | ||
| 茶点(A) | 95 oC 5 分钟 | (957)28 |
| TETA-1: GTAATTCTGAGCACTGTCGC | 95 oC 30 秒(23 个周期) | |
| TETA-2: CTGCCTGGACAACATTGCTT | 62 oC 30 秒 | |
| 72 oC 45 秒 | ||
| 72 oC 7 分钟 | ||
| 东风一个 | 95 oC 5 分钟 | (302) 本作品 |
| DFRA-F: cataccctggtccgcgaaag | 95 oC 1 分钟(30 个周期) | |
| 55 oC 1 分钟 | ||
| DFRA-R: CGATGTCGATCGTCGATAAGTG | 72 oC 1 分钟 | |
| 72 oC 7 分钟 | ||
| A2类 | 95 oC 5 分钟 | |
| catA2-F: GACCCGGTCTTTACTGTCTTTTCTCTCTCTC | 95 oC 1 分钟(25 个周期) | (225)本作品 |
| catA2-R: TCCGGTGATATTCAGATTAAAT | 60 oC 1 分钟 | |
| 72 oC 1 分钟 | ||
| 72 oC 7 分钟 |
表2:用于扩增诊断耐药基因的引物和PCR程序。
| Replicon | 引物(以 5' - 3' 方向列出的序列) | 目标 | 聚合酶链反应程序 | 预期大小(bp) | |||
| 英菲 | 女:TCTGTTTATTCTTTTACTGTCCAC | 代表 | 94 oC 5 分钟 | 683 | |||
| R: CTCCCGTCGCTTCAGGGCATT | 94 oC 1 分钟 (30 个周期) | ||||||
| 60 摄氏度30 秒 | |||||||
| IncFIC | 女:GTGAACTGGCAGATGAGGAAGG | repA2 | 72 oC 1 分钟 | 262 | |||
| R: TTCTCCTCGTCGCCAAACTAGAT | 72 oC 5 分钟 | ||||||
| IncI1 | 女:CGAAAGCCGGACGGCAGAA | 核糖核酸 | 139 | ||||
| R: TCGTCGTTCCGCCAAGTTCGT | |||||||
表3:用于通过基于PCR的复制子分型对质粒p134797和p101718进行分类的引物和PCR程序29。
Representative Results
鉴于供体SW4955和SW7037已经测序,预计这两种供体菌株将具有与其基因组序列中鉴定的抗性基因谱相对应的抗性表型。质粒 p134797(来自 SW4955)具有对第三代头孢菌素 (blaCTX-M-55) 产生抗性,以及对氨基糖苷类抗生素(aac(3)-IIa 和 aadA1)、苯尼科尔 (catA2)、四环素类 (tet(A))、甲氧苄啶 (dfrA14) 和磺胺类药物 (sul3) 具有抗性的基因;在SW4955染色体中未发现抗生素抗性基因。质粒p101718(来自SW7037)仅携带一个抗生素抗性基因(bla CMY-2),有望赋予对第三代头孢菌素(blaCTX-M-55)的耐药性。同样,在SW7037染色体中没有发现抗生素抗性基因。
交配后,预计可以检测携带上述所有抗性基因的两个共轭质粒的转移。阳性偶联检测意味着被鉴定为转缀物的受体应该已经获得了共轭质粒。还预期转缀物中存在共轭质粒的诊断抗性基因(通过PCR检测到)。
为了说明此处描述的方法,测试了两种 大肠杆菌 环境分离株通过偶联转移质粒DNA的能力。实验设置的示意图如图 1所示。两个供体(大肠杆菌 SW4955和SW7037)和一个受体(大肠杆菌 LMB100)独立交配。在 大肠杆菌 SW4955(p134797)和SW7037(p101718)中发现的共轭质粒的基因图谱如图 2所示。
用羧苄青霉素选择偶联质粒,并使用利福平和链霉素进行反选,其抗性决定因素在受体的染色体中。MacConkey琼脂用于区分乳糖阳性供体(产生大的粉红色菌落)与受体和转缀物(乳糖阴性并产生较小的淡黄色菌落)(图3)。
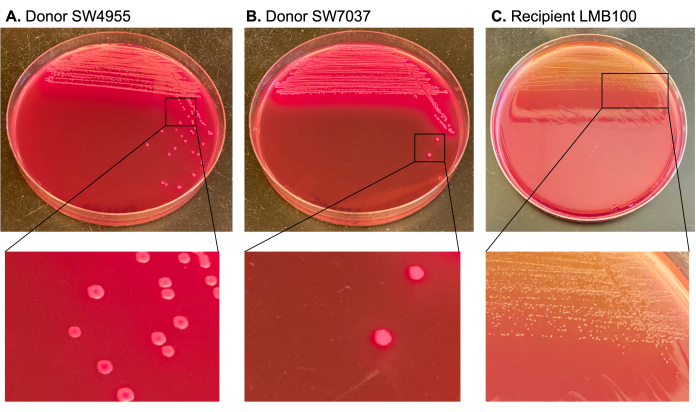
图 3:MacConkey 琼脂上供体和受体菌落的不同颜色标记图示。与供体相对应的菌落在麦康基琼脂上是粉红色的,因为它们是乳糖阳性的。这区分了供体和受体菌落,后者呈淡黄色且较小(乳糖阴性)。请点击此处查看此图的大图。
检测到偶联质粒p134797的动员,五种抗生素中的每一种对应于质粒中发现的五类不同类别的抗性基因。
给出了如何计算应变SW4955的共轭效率(CE)的示例。从菌株SW4955的测定中,从稀释10-2的平板中计数172 CFU的转缀物;相应稀释液(10-2)的受体计数为10,300,000 CFU/mL(表4)。
CE 的计算方法如下:
CE = (174 CFU/mL)/(10,300,000 CFU/mL)
CE= 1.67 x 10-5 个转缀物/受体
| LMB100 | 来自菌株SW4955的转缀物选择与卡贝利西林 | 偶联效率 | ||
| 稀释 | CFU(可数板) | 约焦密度/毫升 | CFU(可数板) | |
| 100 | 汇合的 | 1.03E+09 | ||
| 10-1 | 汇合的 | 1.03E+08 | ||
| 10-2 | 汇合的 | 10300000 | 172 | 1.67 x 10-5 个转缀物/受体 |
| 10-3 | 汇合的 | 1030000 | ||
| 10-4 | 汇合的 | 103000 | ||
| 10-5 | 汇合的 | 10300 | ||
| 10-6 | 汇合的 | 1030 | ||
| 10-7 | 103 | 103 | ||
| 用于计算CE的值以粗体突出显示。 | ||||
表 4:如何计算应变 SW4955 的共轭效率 (CE) 的示例。
结果如 表5所示,以每个受体的偶联效率表示。使用菌株SW4955作为供体获得的五种偶联效率都在同一数量级内。这些结果表明,无论用于转缀物鉴定的选择如何,都可以检测到共轭质粒的动员。
使用菌株SW7037作为供体,获得的偶联效率降低了三个数量级;这些结果允许比较不同供体和质粒类型与相同受体的偶联效率。
| 偶联效率 | |||||
| 应变 | 羧苄西林(100毫克/升) | 庆大霉素(2毫克/升) | 氯霉素(25毫克/升) | 四环素(10毫克/升) | 甲氧苄啶(20毫克/升) |
| SW4955 | 约1.67 x 10-5 | 5.67 x 10-5 | 2.17 x 10-5 | 约7.62 x 10-5 | 约1.36 x 10-5 |
| SW7037 | 2.14 x 10-6 | ||||
表5: 大肠杆菌 供体菌株SW4955和SW7037的结合效率取决于用于选择的抗生素。
在转缀物中,通过PCR检查测试的两个偶联质粒中编码的replicon和所有抗性基因的存在及其相应的复制子。用于这些诊断PCR反应的条件如 表3所示。
诊断凝胶如图4所示。这些凝胶证实了转缀物中存在预期的复制子(p1347975中的IncFIC和IncFIB,p101718中的IncI1)。他们还确认了预期的抗生素耐药基因的存在,即 blaCTX-M-55 组(β-内酰胺)、aac(3)-II 和 aadA(氨基糖苷类)、catA2(phenicol)、tet(A)(四环素)、dfrA14(甲氧苄啶)和 sul3(磺胺酰胺)用于 p1347975,bla CMY-2 用于 p101718(图 4)。
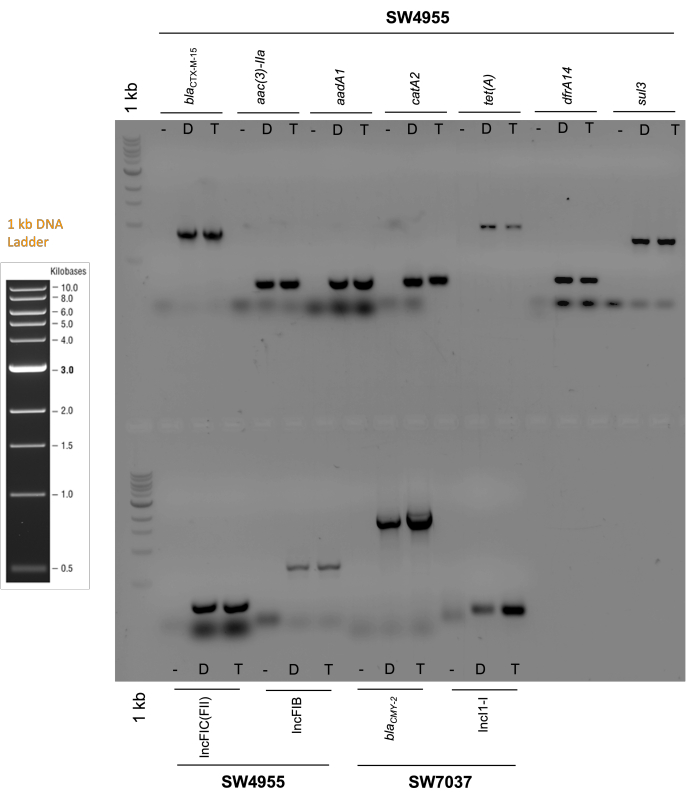
图 4:诊断电泳凝胶。在供体细胞(分别为SW4955和SW7037菌株)和相应的LMB100转缀物中的偶联质粒p134797和p101718中发现的抗生素抗性基因和质粒复制子的PCR产物的凝胶电泳。羧苄青霉素用于质粒选择。缩写。阴性对照(菌株LMB100的DNA用作阴性对照);D:供体;T:转轭。预期扩增子尺寸:布拉CTX-M-55:864 pb;AAC(3)-IIa: 237 bp;aadA1: 283 bp;catA2: 225 bp; 泰特(A): 957 bp;dfrA14: 302 bp;苏3: 799 基点;含氟氯化碳(FII): 262 bp;IncFIB: 683 bp;布拉 CMY-2: 1,855 bp;IncI1-I:139 bp。凝胶含有1%琼脂糖。请点击此处查看此图的大图。
Discussion
共轭质粒通过重组和水平基因转移提供在特定环境环境中的公共基因库的访问34。因此,共轭质粒是能够获得和赋予功能,使细菌能够在数小时内适应多种条件(包括对抗生素的耐药性、对金属的耐药性、金属的获取、生物膜形成和致病基因等)的进化实体。
这项工作提出了一种鉴定细菌中共轭质粒的方案。为了使方案起作用,使用的标记物需要区分供体和受体菌株,如培养基A和B中的对照所示。他们还需要有效地选择携带质粒的细胞。交配反应至关重要。在这种反应中,供体和受体需要长时间接触(通过绒毛)才能发生偶联。任何可能破坏细胞间接触的因素,例如孵育时间不足或摇动或搅拌培养物,都会降低偶联效率。受体的选择也很重要,因为一些受体菌株对偶联35,36难治。建议LMB100作为受体的选择,因为它能够采集多种不相容类型的质粒。
偶联率特定于每个质粒-供体染色体对、受体和环境条件。已发现特定质粒的偶联对大量变量敏感,包括生长期、细胞密度、供体与受体比例、偶联是在液体还是固体培养基中进行、碳、氧、胆盐、金属浓度、哺乳动物细胞的存在、温度、pH 值和交配时间13,14,15.这些相互作用的研究取决于对要深入研究的共轭质粒的初步检测。因此,这里描述的方案也可以修改以探索不同实验变量的影响,尽管这是以限制筛选供体数量为代价的。它还可以鉴定具有辅助质粒的宿主中的可动员质粒(即通过提供反式6中可动员质粒缺失的功能来实现偶联的质粒)。
建议了解偶联质粒的序列(但如上所述,检测偶联不是必需的)。当供体为乳糖阴性(在MacConkey琼脂上产生黄色菌落)时,乳糖阳性受体(在MacConkey琼脂上产生粉红色菌落)可用于区分真正的转缀物和能够在培养基上生长以选择转缀物的供体细胞。此处描述的方案旨在检测来自肠杆菌科的环境、共生和致病成员的偶联质粒;但是,它可以与具有合适供体、受体、抗生素和颜色标记的任何细菌物种一起使用。鉴定其他细菌中的这些关键成分需要使用多个供体、受体和标记物(抗生素和颜色)进行系统研究。该方案尚未在革兰氏阳性细菌中进行测试。
文献中已经报道了这里介绍的方法的几种变体,最近综述了20种。定性结果也可以以不同的方式(例如,偶联频率和基因转移频率)引用,并且无量纲单位可用于报告偶联效率(mL/CFU x h)20。
这里描述的协议解决了以前现有方法16,18,19,20无法解决的几个限制。首先,已经确定了合适的接受者。其次,使用两种抗生素(利福平和链霉素)来选择真正的转缀物,可以最大限度地减少供体通过自发诱变对用于选择转结合物的抗生素之一产生耐药性的可能性。假转缀物也可能是由于供体大量产生的酶(例如β-内酰胺酶)水解用于选择转缀物的抗生素来保护旁观者所致。第三,包括几个实验对照,以确保交配产物是真正的转缀物(即,已稳定掺入供体共轭质粒的受体细胞)。在这里,我们提出了两种独立的方法来测试转缀物的真实性,即MacConkey琼脂中的比色标记物,以及受体中结合质粒的复制子和抗生素抗性基因的PCR检测。此外,此处描述的方案旨在从肠杆菌科(埃希氏菌、克雷伯菌、肠杆菌、柠檬酸杆菌、沙门氏菌、志贺氏菌和其他物种)的环境、共生和致病成员中分离和表征偶联质粒。
为了理解共轭的机制,已经使用计算机模拟对实验观察进行了建模。这些预测模型估计给定供体、受体和转缀物生长密度的质粒转移频率。一种称为终点模型的模型发现了液体培养中质粒转移速率超过该阈值的阈值,并得出结论,转移速率不受细胞密度、供体:受体比例和交配时间的影响19。荧光 原位 杂交(FISH)已被用作转缀质粒检测的替代方法。FISH 允许通过 DNA 探针和靶 DNA 的杂交使用荧光显微镜进行质粒可视化。因此,FISH允许目视检测不同细胞群中的质粒流37,尽管如果通过视觉筛选而不是选择来检测转缀物,则其灵敏度与此处介绍的方法不同。
非常需要了解通过生态系统的不同组成部分(诊所、农业、污水、野生动物、家畜、土壤、河流和湖泊)传播抗生素抗性基因的共轭质粒的生物学。总之,这里描述的方案中提出的简化实验条件有助于大规模筛选供体,因此代表了研究源自各种来源的共轭质粒的水平基因转移的关键工具。它们可用于研究来自多个来源和细菌的结合质粒中抗生素抗性基因或其他临床相关基因的患病率。它们还可以适用于 体内 偶联研究(例如,在脊椎动物的肠道中)和研究调节偶联效率的条件。所有这些研究将大大有助于理解多重耐药偶联质粒的动员如何促进多重耐药性的传播。
Disclosures
作者没有什么可透露的。
Acknowledgements
LM-B,IMG,AT和IS得到了NIH授予LM-B的GM055246的支持。GC-C连续两年获得加州大学墨西哥分校-CONACYT博士后奖学金:AY 2017-18和2018-19。我们非常感谢来自基因泰克基金会赞助的学术灵感网络(GAIN)指导计划的学生Sage Chavez和Pepper St. Clair在实验中的技术支持。
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube racks | Thermo Fisher Scientific | 22-313630 | It can be replaced for another brand |
| 2.0 mL Cryogenic vials | Corning | 430659 | It can be replaced for another brand |
| 14 mL conical tubes | FALCON | 149597 | It can be replaced for another brand |
| 14 mL tube racks | Thermo Fisher Scientific | 8850 | It can be replaced for another brand |
| 1 kb DNA ladder | New England Biolabs | N0552G | |
| 250 mL sterile flasks | PYREX | 5320 | It can be replaced for another permanent marker brand |
| Acetic acid | Fisher Scientific | A38SI-212 | It can be replaced for another brand |
| Agarose (molecular biology grade, multipurpose) | Fisher Scientific | BP160-500 | It can be replaced for another brand |
| Carbenicillin | GOLD BIOTECHNOLOGY | C-103-50 | It can be replaced for another brand |
| Disposable inoculating loops: 1 µL | Fisherbrand | 22-363-595 | It can be replaced for another brand |
| DNA gel loading dye 6x | New England Biolabs | B7024S | It can be replaced for another brand |
| EDTA | Fisher Scientific | BP119-500 | It can be replaced for another brand |
| Electronic digital scale | Denver Instrument | APX-2001 | It can be replaced for another brand |
| Eppendorf conical tubes: 1.5 mL | Eppendorf | 14-282-302 | It can be replaced for another brand |
| Equipment for agarose gel electrophoresis | Fisher Scientific | FP300 | It can be replaced for another brand |
| Ethanol-resistant markers | Sharpie | 37001; 37002; 37003 | It can be replaced for another brand |
| Gel documentation systems (UVP GelSolo) | Analytakjena | SP-1108; 849-97-0936-01; 95-0612-01 | It can be replaced for another brand |
| Gloves | X-GEN | 44-100M | Any nitrile gloves brand works |
| Ice bucket | Thermo Fisher Scientific | 432128 | It can be replaced for another brand |
| MacConkey agar | BD DIFCO | 212123 | |
| Master Mix | BioLabs | M0496S | It can be replaced for another brand |
| Methanol | Fisher Scientific | A452-4 | It can be replaced for another brand |
| Microcentrifuge tubes: 2.0 mL | Fisherbrand | 05-408-138 | It can be replaced for another brand |
| Mueller Hinton agar | BD DIFCO | DF0479-17-3 | |
| Mueller Hinton broth | BD DIFCO | 275730 | |
| NucleoSpin Plasmid, Mini kit for plasmid DNA | Takara Bio USA, Inc., MACHEREY-NAGEL | 740588. 250 | |
| PCR tube racks | AXYGEN | R96PCRFSP | It can be replaced for another brand |
| PCR tubes (0.2 mL) | AXYGEN | PCR-02-C | It can be replaced for another brand |
| Rifampicin | Fisher Scientific | 50-164-7517 | |
| Set of micropipettes that dispense between 1 - 10 μL (P10), 2–20 μL (P20), 20–200 μL (P200) and 200–1000 μL (P1000) | RAININ | 17008648; 17008650; 17008652; 17008653 | Micropipettes should be calibrated; can be replaced for another brand |
| Sodium chloride | Fisher Scientific | S671-3 | It can be replaced for another brand |
| Spectrophotometer | Thermo Scientific | 335905P | It can be replaced for another brand |
| Sterilized tips for 10 μL, 200 μL and 1000 μL | Eclipse | 1011-260-000-9; 1018-260-000; 1019-260-000-9 | It can be replaced for another brand |
| Streptomycin | Fisher Scientific | BP910-50 | |
| SYBR Safe DNA gel stain | Thermo Fisher Scientific | S33102 | |
| Taq DNA Polymerase | BioLabs | M0273S | |
| Thermal cycler C1000 Touch | Bio-Rad | 1851196 | It can be replaced for another brand |
| Tris | Fisher Scientific | BP153-500 | It can be replaced for another brand |
References
- Lederberg, J., Tatum, E. Gene recombination in Escherichia coli. Nature. 158 (4016), 558 (1946).
- de la Cruz, F., Frost, L. S., Meyer, R. J., Zechner, E. L. Conjugative DNA metabolism in Gram-negative bacteria. FEMS Microbiology Reviews. 34 (1), 18-40 (2010).
- Grohmann, E., Muth, G., Espinosa, M. Conjugative plasmid transfer in gram-positive bacteria. Microbiology and Molecular Biology Reviews. 67 (2), 277-301 (2003).
- Koraimann, G., Wagner, M. A. Social behavior and decision making in bacterial conjugation. Frontiers in Cellular and Infection Microbiology. 4, 54 (2014).
- Dziewit, L., et al. Diversity and role of plasmids in adaptation of bacteria inhabiting the Lubin copper mine in Poland, an environment rich in heavy metals. Frontiers in Microbiology. 6, 152 (2015).
- Smillie, C., Garcillán-Barcia, M. P., Francia, M. V., Rocha, E. P., de la Cruz, F. Mobility of plasmids. Microbiology and Molecular Biology Reviews. 74 (3), 434-452 (2010).
- Balbuena-Alonso, M. G., et al. Genomic analysis of plasmid content in food isolates of E. coli strongly supports its role as a reservoir for the horizontal transfer of virulence and antibiotic resistance genes. Plasmid. 123-124, 102650 (2022).
- San Millan, A., MacLean, R. C. Fitness costs of plasmids: A limit to plasmid transmission. Microbiol Spectrum. 5 (5), (2017).
- Coluzzi, C., Garcillán-Barcia, M. P., de la Cruz, F., Rocha, E. P. C. Evolution of plasmid mobility: Origin and fate of conjugative and nonconjugative plasmids. Molecular Biology and Evolution. 39 (6), 1-23 (2022).
- Bevan, E. R., et al. Molecular characterization of plasmids encoding blaCTX-M from faecal Escherichia coli in travellers returning to the UK from South Asia. The Journal of Hospital Infection. 114, 134-143 (2021).
- Minja, C. A., Shirima, G., Mshana, S. E. Conjugative plasmids disseminating CTX-M-15 among human, animals and the environment in Mwanza Tanzania: a need to intensify one health approach. Antibiotics. 10 (7), 836 (2021).
- Carattoli, A. Plasmids and the spread of resistance. International Journal of Medical Microbiology. 303 (6-7), 298-304 (2013).
- Sengupta, M., Austin, S. Prevalence and significance of plasmid maintenance functions in the virulence plasmids of pathogenic bacteria. Infection and Immunity. 79 (7), 2502-2509 (2011).
- Alderliesten, J. B., et al. Effect of donor-recipient relatedness on the plasmid conjugation frequency: a meta-analysis. BMC Microbiology. 20 (1), 135 (2020).
- Neil, K., Allard, N., Rodrigue, S. Molecular mechanisms influencing bacterial conjugation in the intestinal microbiota. Frontiers in Microbiology. 12, 673260 (2021).
- Liu, G., Bogaj, K., Bortolaia, V., Olsen, J. E., Thomsen, L. E. Antibiotic-induced, increased conjugative transfer is common to diverse naturally occurring ESBL plasmids in Escherichia coli. Frontiers in Microbiology. 10, 2119 (2019).
- Suchman, E. Polymerase chain reaction protocol. American Society for Microbiology. , 1-14 (2011).
- Watanabe, T. Infective heredity of multiple drug resistance in bacteria. Bacteriological Reviews. 27 (1), 87-115 (1963).
- Simonsen, L., Gordon, D. M., Stewart, F. M., Levin, B. R. Estimating the rate of plasmid transfer: an end-point method. Journal of General Microbiology. 136 (11), 2319-2325 (1990).
- Huisman, J. S., et al. Estimating plasmid conjugation rates: A new computational tool and a critical comparison of methods. Plasmid. 121, 102627 (2022).
- Jung, B., Hoilat, G. J. MacConkey medium. StatPearls. , (2022).
- . NucleoSpin Plasmid DNA purification Available from: https://www.mn-net.com/media/pdf/45/51/02/Instruction-NucleoSpin-Plasmid.pdf (2022)
- Jiang, X., et al. Detection of extended-spectrum beta-lactamases in clinical isolates of Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy. 50 (9), 2990-2995 (2006).
- Stapleton, P. D., Shannon, K. P., French, G. L. Carbapenem resistance in Escherichia coli associated with plasmid-determined CMY-4 beta-lactamase production and loss of an outer membrane protein. Antimicrobial Agents and Chemotherapy. 43 (5), 1206-1210 (1999).
- Ben Yahia, H., et al. Detection of CTX-M-15 harboring Escherichia coli isolated from wild birds in Tunisia. BMC Microbiology. 18 (1), 26 (2018).
- Madsen, L., Aarestrup, F. M., Olsen, J. E. Characterisation of streptomycin resistance determinants in Danish isolates of Salmonella Typhimurium. Veterinary Microbiology. 75 (1), 73-82 (2000).
- Perreten, V., Boerlin, P. A new sulfonamide resistance gene (sul3) in Escherichia coli is widespread in the pig population of Switzerland. Antimicrobial Agents and Chemotherapy. 47 (3), 1169-1172 (2003).
- Guardabassi, L., Dijkshoorn, L., Collard, J. M., Olsen, J. E., Dalsgaard, A. Distribution and in-vitro transfer of tetracycline resistance determinants in clinical and aquatic Acinetobacter strains. Journal of Medical Microbiology. 49 (10), 929-936 (2000).
- Carattoli, A., et al. Identification of plasmids by PCR-based replicon typing. Journal of Microbiological Methods. 63 (3), 219-228 (2005).
- Green, M. R., Sambrook, J. Agarose gel electrophoresis. Cold Spring Harbor protocols. 2019 (1), (2019).
- Singer, V. L., Lawlor, T. E., Yue, S. Comparison of SYBR Green I nucleic acid gel stain mutagenicity and ethidium bromide mutagenicity in the Salmonella/mammalian microsome reverse mutation assay (Ames test). Mutation Research. 439 (1), 37-47 (1999).
- Tuma, R. S., et al. Characterization of SYBR Gold nucleic acid gel stain: a dye optimized for use with 300-nm ultraviolet transilluminators. Analytical Biochemistry. 268 (2), 278-288 (1999).
- Oatey, P. Imaging fluorescently stained DNA with CCD technology How to increase sensitivity and reduce integration times. Biotechniques. 42 (3), 376-377 (2007).
- Norman, A., Hansen, L. H., Sørensen, S. J. Conjugative plasmids: vessels of the communal gene pool. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 364 (1527), 2275-2289 (2009).
- Du, L., Liu, R. H., Ying, L., Zhao, G. R. An efficient intergeneric conjugation of DNA from Escherichia coli to mycelia of the lincomycin-producer Streptomyces lincolnensis. International Journal of Molecular Sciences. 13 (4), 4797-4806 (2012).
- Kirk, J. A., Fagan, R. P. Heat shock increases conjugation efficiency in Clostridium difficile. Anaerobe. 42, 1-5 (2016).
- Esteves, G. M., Pereira, J. A., Azevedo, N. F., Azevedo, A. S., Mendes, L. Friends with benefits: An inside look of periodontal microbes' interactions using fluorescence in situ hybridization-Scoping review. Microorganisms. 9 (7), 1504 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved