תרבית ראשונית קלה וניתנת לשחזור בצפיפות נמוכה באמצעות מלאי קפוא של נוירונים עובריים בהיפוקמפוס
In This Article
Summary
מלאי קפוא מוכן לשימוש של נוירונים הוא כלי רב עוצמה להערכת תפקודים סינפטיים. כאן, אנו מציגים תרבית ראשונית קלה בצפיפות נמוכה ממלאי קפוא באמצעות צלחת של 96 בארות.
Abstract
תרבית עצבית היא מערכת רבת ערך להערכת תפקודים סינפטיים ובדיקות סמים. בפרט, תרבית בצפיפות נמוכה של נוירונים ראשוניים בהיפוקמפוס מאפשרת לימוד של נוירונים בודדים או רכיבים תת-תאיים. הראינו לוקליזציה של חלבונים תת-תאיים בתוך תא עצב באמצעות אימונוציטוכימיה, קוטביות עצבית, מורפולוגיה סינפטית והשינוי ההתפתחותי שלה באמצעות תרבית היפוקמפוס ראשונית בצפיפות נמוכה. לאחרונה, מלאי קפוא מוכן לשימוש של נוירונים הפך זמין מסחרית. מאגרי תאי עצב קפואים אלה מפחיתים את הזמן הדרוש להכנת ניסויים בבעלי חיים וגם תורמים להפחתת מספר בעלי החיים שבהם נעשה שימוש. כאן, אנו מציגים שיטת תרבית ראשונית בצפיפות נמוכה הניתנת לשחזור באמצעות צלחת 96 בארות. השתמשנו במלאי קפוא זמין מסחרית של תאי עצב מההיפוקמפוס העוברי של חולדה. תאי העצב יכולים להיות בתרבית יציבה לטווח ארוך ללא שינויי מדיה על ידי הפחתת הצמיחה של תאי גלייה בנקודות זמן מסוימות. בדיקה זו בעלת תפוקה גבוהה באמצעות תרבית בצפיפות נמוכה מאפשרת הערכות מבוססות הדמיה הניתנות לשחזור של פלסטיות סינפטית.
Introduction
פיתוח מערכת ניסויית חוץ גופית שיכולה להעריך תפקודים סינפטיים המעורבים בלמידה ובזיכרון הוא חשוב. תרבית עצבית היא מערכת רבת ערך להערכת תפקודים סינפטיים במבחנה. טכניקת התרבית העצבית שימשה לראשונה בשנות השמונים, ובשנות התשעים פותחה תרבית בצפיפות נמוכה של נוירונים ראשוניים בהיפוקמפוס 1,2,3 לחקר נוירונים בודדים במונחים של לוקליזציה תת-תאית של רכיבי חלבון, סחר בחלבונים, קוטביות עצבית, מורפולוגיה של עמוד השדרה, התפתחות סינפסות ופלסטיות 4,5,6,7,8 . עם זאת, ישנם שלבים רבים המעורבים בטכניקה זו: הזדווגות בעלי חיים, ניתוח עוברים, הכנת כלי תרבית, וגידול תאים במשך 3 שבועות עם שינויי מדיה פעם בשבוע. בנוסף, זה דורש טכניקות מראש3.
פיתחנו מלאי קפוא של נוירונים מנותקים בהיפוקמפוס מעוברי חולדות 9,10. המלאי הקפוא של תאי עצב מוכן לשימוש, ואין צורך בטכניקות מתקדמות לתרבית התאים11,12. במילים אחרות, גידול הנוירונים ממלאי קפוא אינו תלוי בטכניקה של נסיין. הוא מבטל את הצורך בניסויים בבעלי חיים (למשל, אישור לניסויים בבעלי חיים, סידור בעלי חיים בהריון מתוזמנים וניתוח עוברי חולדות), ובכך מפחית את מספר בעלי החיים שבהם נעשה שימוש. לאחרונה, מלאי קפוא באיכות גבוהה ומוכן לשימוש של נוירונים הפך זמין מסחרית. כאן, השתמשנו במלאי קפוא זמין מסחרית מהיום העוברי (E) 18 היפוקמפוס חולדה13,14,15. גידול תאי עצב ממלאי קפוא אינו דורש מדיה מותנית גליה או תרבית משותפת עם תאי גלייה. ניתן להשתמש בתרבית ראשונית רגילה ללא סרום נוסף לתרבית התאים; לפיכך אנו יכולים לרכוש נתונים הניתנים לשחזור. יתר על כן, אין צורך בהחלפת מדיה במשך 3 שבועות לאחר זריעת התא, מאחר שצמיחת תאי הגליה מצטמצמת (איור 1).
קוצים דנדריטיים הם התא הפוסט-סינפטי של רוב הסינפסות המעוררות. הם מכילים חלבוני קולטן, חלבוני פיגום פוסט-סינפטיים וחלבוני אקטין ציטו-שלד. התמקדנו בחלבון קושר אקטין דרברין 5,6,7,16,17,18. דרברין מצטבר בראש עמוד השדרה בתאי עצב בוגרים19, ודיווחנו על דרברין כסמן למצב סינפטי 15,17,20,21,22,23. על ידי ביצוע ניתוח תוכן גבוה באמצעות דרברין כקריאה, דיווחנו לאחרונה על ההשפעות המעכבות של אנלוגים phencyclidine על קולטני גלוטמט מסוג N-methyl-D-aspartic acid (NMDARs)10 ואת ההשפעות תלויות NMDAR של תרכובות טבעיות ותרופות גולמיות על מצבים סינפטיים15.
כאן, אנו מפרטים כיצד לגדל בתרבית מלאי קפוא של תאי עצב בצפיפות נמוכה. בנוסף, אנו מראים הערכה מבוססת הדמיה של דרברין של המצב הסינפטי באמצעות לוחות 96 באר.
Protocol
1. ציפוי צלחת
- מצפים צלחת מיקרו 96 בארות עם פולי-L-ליזין (1 מ"ג / מ"ל, מדולל ב 0.1 M חיץ בוראט [pH: 8.5]; 100 μL / באר) ולדגור לילה ב 37 ° C.
הערה: יש לצפות רק את הבארות שיש להשתמש בהן. בניסויים שבוצעו כאן, 60 הבארות האמצעיות משמשים. חיץ הבוראט מוכן על ידי ערבוב 50 מ"מ חומצה בורית ו 12 מ"מ בוראט במים מעוקרים. - שטפו את הצלחת פעמיים במים מעוקרים (250 מיקרוליטר/באר).
- שטפו את הצלחת פעם אחת במדיום תרבית טרי ללא תוספים (250 מיקרוליטר/באר).
- יבשו את הצלחת על ספסל נקי למשך 20 דקות.
- עוטפים את הצלחת ברדיד אלומיניום ושומרים על טמפרטורה של 4°C עד לשימוש (תקף לחודש).
2. זריעת תאים
- הוסיפו 50 μL/well של מדיום התרבית לצלחת המצופה ושמרו אותו באינקובטור CO2 של 37°C, 5% למשך 30 דקות עד שעה. מלא את הבארות ההיקפיות במים מעוקרים (200 מיקרוליטר / באר).
הערה: מדיום התרבית מוכן על ידי הוספת 50x B-27, 400x Glutamax, ו 100 U/mL של פניצילין/סטרפטומיצין למדיום הנוירובזאלי (עיין בטבלת החומרים לקבלת פרטים). - הסר את הנוירון cryovial ממיכל החנקן הנוזלי. תאי העצב ששימשו כאן היו תאי עצב שמורים בהקפאה של DMSO11.
- יש לטבול את הקריוביאל בבלוק חום של 37°C למשך עד 3 דקות ולהפשיר חלקית את התכולה. אין לחמם את הקריוביאל במשך זמן רב מדי. העבר את התוכן לצינור 50 מ"ל ברגע שהוא מופשר.
- העבר באיטיות את התוכן הקריוביאלי של תא העצב לצינור סטרילי של 50 מ"ל (50 μL/s) באמצעות פיפטה של 1 מ"ל עם קצה נקבוביות רחב.
- שוטפים את הקריוביאל הריק עם 1 מ"ל של מדיום התרבית (טמפרטורת החדר; כט). העבר 1 מ"ל זה של מדיום התרבית מהטיפה הקריוביאלית (50 μL/s) לצינור 50 מ"ל המכיל את תרחיף התא.
- הוסף 9 מ"ל של מדיום התרבית (RT) לצינור 50 מ"ל מבחינת ירידה (0.5 מ"ל לשנייה) והשלם את הנפח ל- 11 מ"ל. אין לחזור על הפיפט, אלא לערבב את תרחיף התא באיטיות.
- ספירת מספר התא (השתמש במונה תאים או בהמוציטומטר).
- מעבירים את כל תרחיף התא למאגר ומחלקים את תרחיף התא לצלחת 96 בארות באמצעות פיפטה רב ערוצית עם קצוות רחבים לנקבוביות (1.0 x 10,4 תאים/באר). כדי להפחית את אידוי אמצעי התרבית, מלא את הבארות ההיקפיות במים מעוקרים (שלב 2.1).
הערה: מחקר זה מאשר כי אידוי מדיום התרבית הוא קטן עבור תרבית של 3 שבועות ללא חילופי בינוני. שיעור ההפחתה של התווך הוא 3.6% (n = 120 בארות). לפיכך, שינוי האוסמוליות לא יהיה דרסטי במהלך תקופת הדגירה בת 3 השבועות. - לדגור את הנוירונים במשך 1-2 שעות ב 37 ° C, 5% CO2 אינקובטור.
- החליפו את מדיום התרבית במדיום תרבית מחומם מראש (37°C) לבאר והחזירו אותו לחממה של 37°C, 5% CO2 אינקובטור (לא נדרש שינוי בינוני במהלך התרבית).
3. טיפול Ara-C
- לאחר 4 ימים במבחנה (DIV), הוסף ציטוזין β-D-arabino-furanoside (Ara-C) לריכוז סופי של 0.2 מיקרומטר לכל באר כדי להפחית את הצמיחה של תאי גלייה.
4. טיפולים תרופתיים
- ב 21 ימים במבחנה, לטפל בתאים עם תרופות של עניין.
- שמור על טמפרטורת הצלחת על 37 ° C במהלך טיפולים תרופתיים.
- לבקרה חיובית, יש לטפל בתאים עם 100 מיקרומטר גלוטמט (לכל באר לריכוז הסופי) במשך 10 דקות לפני הקיבוע.
5. קיבעון
- לקיבוע, יש להשתמש בפרפורמאלדהיד 4% במאגר פוספט 0.1 M (100 μL/well).
- לאחר ~20 דקות של קיבוע, שטפו את הבארות במי מלח חוצצי פוספט (PBS; 250 מיקרוליטר / באר) פעמיים למשך 5 דקות כל אחת.
6. אימונוציטוכימיה
- שטפו את התאים עם PBS (250 מיקרוליטר/באר) פעם אחת למשך 5 דקות.
- חדרו את התאים עם 0.1% Triton X-100 (100 μL/well) ב-PBS למשך 5 דקות.
- שטפו את התאים עם PBS (250 מיקרוליטר/באר) 3x למשך 5 דקות כל אחד.
- לחסימה, יש להשתמש באלבומין בסרום בקר 3% ב-PBS (PBSA; 100 μL/well) למשך שעה אחת ב-RT.
- לדגור על התאים עם נוגדנים נגד דרברין (1:1) ואנטי-מיקרוטובול הקשור לחלבון 2 (MAP2) (1:000) (60 מיקרוטובול / באר) ב -4 מעלות צלזיוס למשך הלילה.
- שטפו את התאים עם PBS (250 מיקרוליטר/באר) 4x למשך 5 דקות כל אחד.
- לדגור על התאים עם נוגדנים משניים מתאימים 4′,6-diamidino-2-phenylindole, dihydrochloride (DAPI; 1:1000) ב PBSA (60 μL / באר) במשך 2 שעות ב RT.
- שטפו את התאים עם PBS (250 מיקרוליטר/באר) 4x למשך 5 דקות כל אחד.
- אחסנו את התאים ב-PBS המכילים 0.1% נתרן אזיד (150 מיקרוליטר/באר).
7. רכישה וניתוח של תמונות
- כדי להשיג את התמונות, השתמש במיקרוסקופ מתאים.
- כדי לזהות את גופי התאים של תאי עצב, השתמש הן באזורים חיוביים ל-MAP2 והן באזורים חיוביים ל-DAPI.
- כדי לזהות את הדנדריטים של נוירונים, השתמש באותות חיוביים MAP2 ללא גופי תאים.
- כדי לזהות אשכולות דרברין, השתמשו באותות חיוביים של דרברין לאורך דנדריטים חיוביים של MAP2.
תוצאות
בהתאם לפרוטוקול, תאי העצב גודלו בתרבית בצלחת של 96 בארות במשך 21 יום, ולאחר מכן טופלו בגלוטמט (איור 1). תאי העצב התפתחו באופן נורמלי ללא החלפה של מדיום התרבית במשך 3 שבועות (איור 2). טיפלנו בתאים בכמה ריכוזים של גלוטמט (1 מיקרומטר, 3 מיקרומטר, 10 מיקרומטר, 30 מיקרומטר ו-100 מיקרומטר מדוללים במים מעוקרים) במשך 10 דקות וקיבענו אותם. אימונוציטוכימיה בוצעה, ותמונות פלואורסצנטיות של דרברין ו- MAP2 נרכשו באמצעות מיקרוסקופ פלואורסצנטי אוטומטי עם מצלמת sCMOS. כפי שניתן לראות באיור 3, קוצים דנדריטיים חיוביים לדרברין נצפים בבירור לאורך דנדריטים חיוביים ל-MAP2. הוכח כי גירוי גלוטמט מעורר זרם Ca2+ דרך NMDAR, מה שגורם ליציאת דרברין מקוצים דנדריטיים וכתוצאה מכך ירידה בצפיפות אשכול הדרברין 5,17. בהתאם לכך, ראינו ירידה תלוית מינון של צפיפות אשכול דרברין כנגד גירוי גלוטמט10 (איור 4). כפי שניתן לראות באיור 5, שיטה זו ניתנת לשחזור במידה רבה אם משתמשים בדרברין כסמן למצבים סינפטיים.
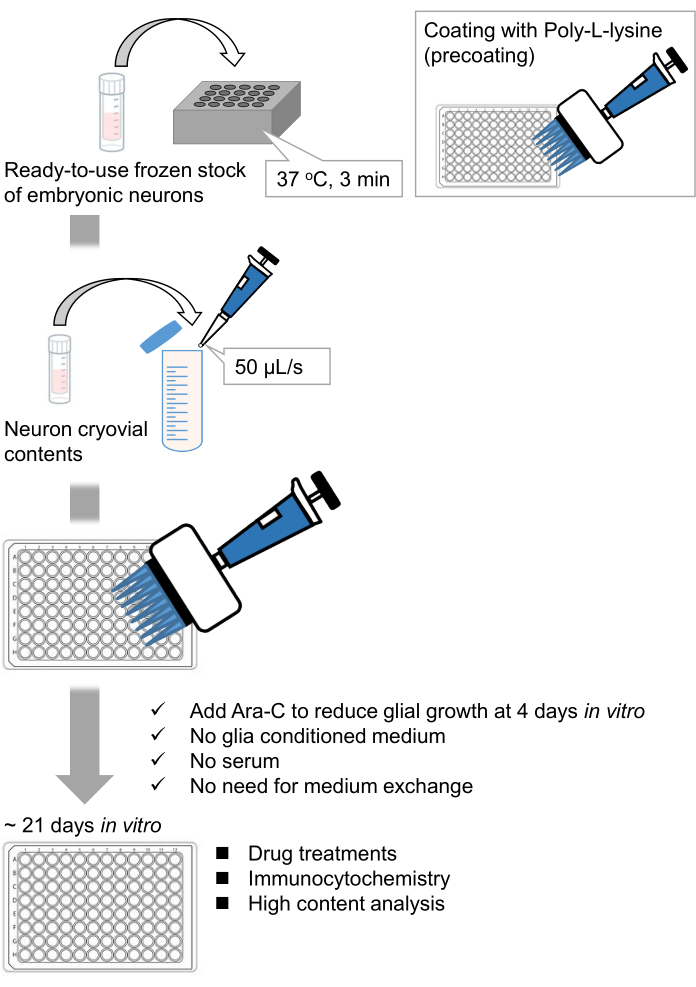
איור 1: סכימת השיטה. תאי העצב גודלו בתרבית בצלחת של 96 בארות במשך 21 יום, ולאחר מכן טופלו בגלוטמט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
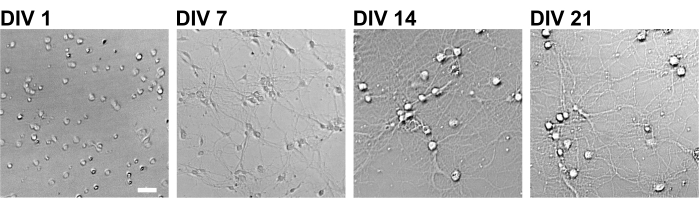
איור 2: תמונות שדה בהיר של תאי עצב בתרבית באמצעות לוח של 96 בארות. תמונות ניגודיות פאזה התקבלו מכל שלב התפתחותי (DIV 1, 7, 14, 21) באמצעות ציטומטר תמונה כמותי קונפוקלי. סרגל קנה מידה: 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
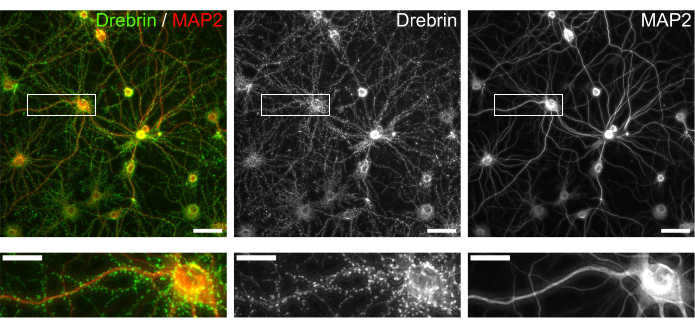
איור 3: תמונות מייצגות של תאי עצב בתרבית שהוכתמו במערכת החיסון. (משמאל) תמונות פלואורסצנטיות ממוזגות של דרברין (ירוק) ו-MAP2 (אדום). כל תמונה פלואורסצנטית של דרברין ו-MAP2 הוצגה בפאנלים האמצעיים והימניים, בהתאמה. מלבנים לבנים מראים את האזור המוגדל למטה. פסי קנה מידה; פנלים עליונים: 50 מיקרומטר, פנלים תחתונים: 20 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
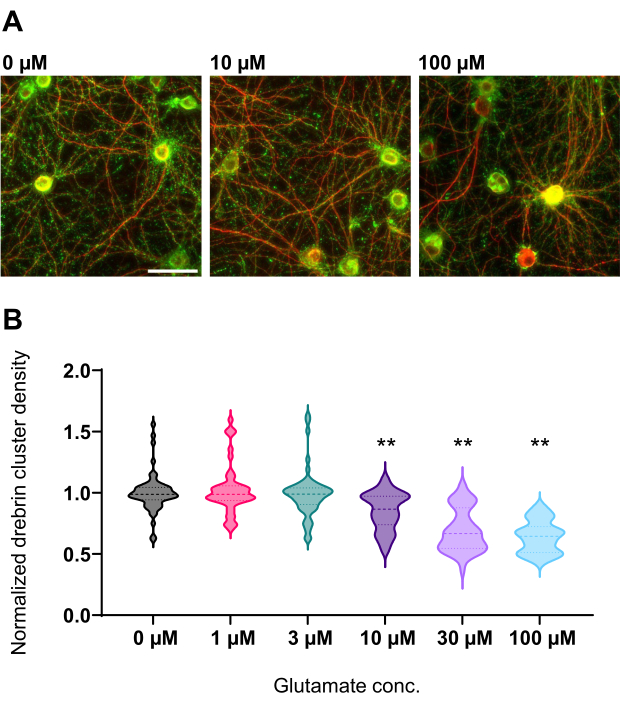
איור 4: שינויים תלויי גלוטמט בתגובת מינון בצפיפות אשכול דרברין מנורמלת. (A) תמונות פלואורסצנטיות מייצגות שהוכתמו באמצעות דרברין (ירוק) ו-MAP2 (אדום) מהבאר שטופלה בגלוטמט 0 מיקרומטר, 10 מיקרומטר ו-100 מיקרומטר גלוטמט (משמאל לימין). סרגל קנה מידה: 50 מיקרומטר. (B) צפיפות אשכול דרברין נורמלה בממוצע הבקרה (0 מיקרומטר). 0 μM, N = 58 בארות; 1 מיקרומטר, N = 46; 3 מיקרומטר, N = 54; 10 מיקרומטר, N = 45; 30 מיקרומטר, N = 54; 100 μM, N = 55, מתוך 13 ניסויים באמצעות מגרשים שונים. ** P < 0.01 לעומת בקרה (0 μM) על ידי מבחן השוואות מרובות של Dunnett לאחר ANOVA. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
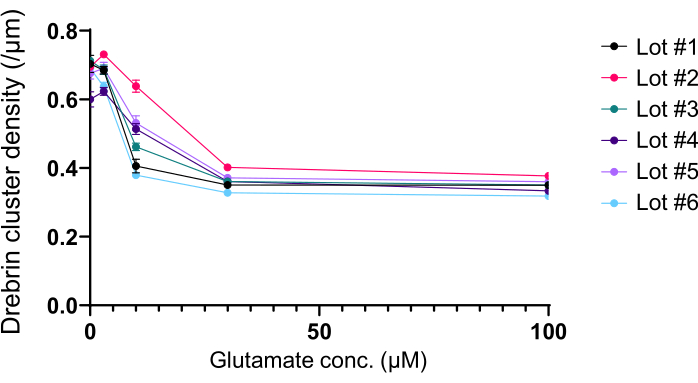
איור 5: שינויים תלויי גלוטמט במינון-תגובה בצפיפות אשכול הדרברין. הנתונים הגולמיים משישה ניסויים במגרשים שונים. N = 4 בארות לכל ריכוז (0 μM, 3 μM, 10 μM, 30 μM ו- 100 μM). הערכים מבוטאים כממוצע ± SEM. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 6: יישום המאגרים הקפואים של תאי עצב בניסויים אלקטרופיזיולוגיים. (A) פרוטוקול לניסויים אלקטרופיזיולוגיים באמצעות לוחות מערך מיקרואלקטרודות (MEA). ציפוי: יום לפני ציפוי התאים, כל צלחת MEA של 48 בארות צופתה מראש בתמיסת פוליאתילנימין (PEI: 0.1%) והודגרה במשך שעה אחת בטמפרטורה של 37°C. צלחת MEA נשטפה 3x במים מעוקרים והתייבשה במשך שעה אחת. לאחר מכן, צלחת MEA נשמרה על 4 ° C במשך הלילה. תרבית בצפיפות גבוהה: 50,000 תאים/באר של תאי העצב היו מצופים על לוחות MEA של 48 בארות. שלב זריעת התאים בוצע כמתואר בסעיף 2 של הפרוטוקול המתואר לעיל. למינין (20 מיקרוגרם/מ"ל) הוסיף מדיום תרבית (הוסף 2 v/v% B-27, 2.5 mM Glutamax, ו 100 מיקרוגרם / מ"ל של פניצילין/סטרפטומיצין למדיום הנוירובזאלי) שימש כדי צלחת את הנוירונים. לאחר מכן, תאי העצב גודלו בתרבית בטמפרטורה של 37°C, 5% CO2 בתווך התרבית. המדיה הוחלפה במלואה ב-DIV 1 עם מדיום התרבות עד DIV 3. Ara-C נוסף ב-DIV 4 (סופי 0.2 מיקרומטר). מ-DIV 5 ואילך ופעמיים בשבוע, 50% מהמדיה שונתה עם מדיום התרבות. הפעילות של תאי העצב על כל באר של צלחת MEA נרשמה עם מערכת MEA. (B) פעילות עצבית ספונטנית נרכשה ב-37°C תחת אטמוספירה של 5% CO2 באמצעות מערכת MEA בקצב דגימה של12.5 קילו-הרץ לערוץ ב-DIV 21. מוצגות הקלטות מ-4 ערוצים מתוך 16 הערוצים בתוך באר. עבור כל ההקלטות הוחל מסנן פסים של באטרוורת' (200-3,000 הרץ). ראשי חץ מראים את העיתוי של ירי פיצוץ מסונכרן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
שלב קריטי בשיטה זו הוא להפשיר את תרחיף התא. העברת תרחיף התא לפני שהוא מתחמם מדי חשובה מאוד. עם זאת, כדי למנוע את השינוי המהיר של אוסמולליות, אין להעביר את תרחיף התא לנפח גדול של המדיום בבת אחת. הוספה נפילה של מדיום התרבית חיונית גם כדי למנוע שינויים פתאומיים בלחץ האוסמוטי.
את תאי העצב ניתן לגדל בתרבית בכלי תרבית אחרים: צלחות 24 בארות, תאי 8 בארות, צלחות 60 מ"מ או גשושיות MED. עם זאת, במקרים אלה יש להתאים את הריכוז הסופי ואת העיתוי של הוספת Ara-C. בנוסף, צפיפות הנוירונים צריכה להיות אופטימלית בסוגים שונים של ניסויים. לדוגמה, תרבית בצפיפות גבוהה נדרשת עבור ניסויים אלקטרופיזיולוגיים, ובמקרה כזה יש צורך בחילופי מדיה פעמיים בשבוע (איור 6). לפיכך, תרבות בצפיפות נמוכה דורשת פחות צעדים מאשר תרבות בצפיפות גבוהה.
תרבית עצבית בצפיפות נמוכה דורשת לעתים קרובות טכניקות מתקדמות; עם זאת, שימוש במלאי קפוא מוכן לשימוש פותר בעיה זו. השיטה המתוארת אינה תלויה במיומנותו של הנסיין. איכות המלאי הקפוא יציבה וניתן לתרבית יציבה כל עוד הם מאוחסנים בחנקן נוזלי ולהימנע משינויי טמפרטורה עד 4 שנים.
גידול התאים במשך 3 שבועות ללא חילופי מדיום מעלה את השאלה האם יש שינויים משמעותיים באוסמוליות או אידוי מדיה בתרבית. עם זאת, אישרנו כי התאדות אמצעי התרבות קטנה (שיעור הפחתה של 3.6%). לוקליזציה של חלבונים סינפטיים ואת המורפולוגיה של הנוירונים נראים נורמליים לאחר 3 שבועות. לכן, תרבית של 3 שבועות ללא חילופי מדיה אינה גורמת לשינויים אוסמולליים גדולים המשפיעים על תנאי הנוירונים בתרבית. שמירת הצלחת באינקובטור לאחר טיפול Ara-C היא גם נקודה חשובה שממזערת את האידוי.
אין הגבלה לגבי השימוש בנוירוני המניות הקפואות. עם זאת, ישנן כמה מגבלות של שיטת התרבות בצפיפות נמוכה. אישרנו כי תרבית צפיפות נמוכה יכולה להיות מיושמת עבור תצפית מורפולוגית של נוירונים, הערכה של תפקוד סינפטי, ו GFP transfection. עם זאת, לא בחנו הדמיה של תאים חיים. בנוסף, כאמור, נדרשת תרבית בצפיפות גבוהה לביצוע אלקטרופיזיולוגיה.
הבשלת סינפסה אורכת בדרך כלל 3 שבועות7, ואיננו יכולים לאשר שלתאי העצב בתרבית יש סינפסות תקינות עד הסוף. אם הבשלת הסינפסה אינה טובה לאחר 3 שבועות, נצטרך לתרבית שוב. על-ידי ידיעת איכות תאי העצב לפני תחילת הניסויים, אנו יכולים לחסוך את 3 השבועות האלה. לכן, כדי לבצע ניסויים ביעילות, עדיף לבדוק את איכות הנוירונים מראש. מלאי קפוא מאפשר לבדוק את איכות הנוירונים מראש. כל אצווה של מלאי קפוא נוצרת מהמלטה אחת של חולדות, ואנחנו יכולים להשתמש באחד המלאי מכל אצווה לבדיקת איכות. דרברין הוא סמן טוב לבדיקת האיכות של הנוירונים. כפי שתואר, דרברין מצטבר בראש עמוד השדרה בנוירונים בוגרים, והוא מגיב לגירוי סינפטי. לכן, אנו יכולים לבדוק את איכות תאי העצב במלאי קפוא באמצעות דרברין כסמן.
שיטה זו יכולה להיות מיושמת כדי להעריך את ההשפעה של תרופות על המצב הסינפטי. יציאת הדרברין מקוצים דנדריטיים מתרחשת בשלבים הראשונים של פלסטיות סינפטית22. לכן, הזיהוי של הפחתת אשכול דרברין שנוצר על ידי טיפול תרופתי מראה כי התרופה מעוררת את הסינפסה וגורמת לפלסטיות סינפטית. יתר על כן, כדי לזהות אם ההפחתה היא תלוית NMDAR, ניסוי באמצעות חומצה 2-amino-5-phosphonovaleric (APV, אנטגוניסט NMDAR) הוא שימושי. אם נשתמש בדרברין כסמן, אפילו תלות NMDAR נקבעת בבירור10,15. השיטה המתוארת שימושית בבדיקות תרופות, מחקרים פרמקולוגיים בטיחותיים והערכת תפקוד סינפטי.
Disclosures
טומואקי שיראו הוא מנכ"ל AlzMed, Inc. המחקר מומן על ידי AlzMed, Inc. (500,000 JPY ל- NK עבור הפרויקט שכותרתו "ניתוח תפוקה גבוהה של תפקוד סינפטי").
Acknowledgements
אנו מודים לקאזומי קאמיאמה ולמנאמי קוואדה על הסיוע בניסויים. עבודה זו נתמכה על ידי JSPS KAKENHI (מענק מספר 19K08010 ל- N.K.) והסוכנות היפנית למחקר ופיתוח רפואי (AMED) (מענק מספר JP19bk0104077 ו- JP22bm0804024 ל- T.S.).
Materials
| Name | Company | Catalog Number | Comments |
| 96 well plate | Zeon Corporation | Gifted | |
| 96 well plate | greiner | 655986 | |
| Anti-drebrin antibody (M2F6) | MBL | D029-3 | Mouse monoclonal (dilution 1:1) |
| Anti-MAP2 antibody | Millipore | AB5622 | Rabbit (dilution 1:1000) |
| Anti-mouse Alexa Fluor 568 | Thermo Fisher Scientific | A11031 | Dilution 1: 500 |
| Anti-rabbit Alexa Fluor | Thermo Fisher Scientific | A11008 | Dilution 1: 500 |
| B-27 | Gibco | 17504-044 | 2 v/v% for MEA plates; 50x for normal plates |
| Borax | Sigma | B-9876 | Final concentration 12 mM |
| Boric acid | WAKO | 021-02195 | Final concentration 50 mM |
| Bovine serum albumin | Millipore | 12659-100G | Final concentration: 3% in PBS |
| Confocal quantitative image cytometer CellVoyager CQ1 | YOKOGAWA | Phase contrast images | |
| Cytosine β-D-arabino-furanoside (Ara-C) | Sigma | C-6645 | Diluted in dH2O (final concentration: 0.2 µM) |
| DAPI | FUJIFILM | 340-07971 | Dilution 1:1000 |
| GlutaMAX | Gibco | 35050-061 | 2.5 mM for MEA plates; 400x for normal plates |
| In Cell Analyzer 2200 | Cytiva | Fluorescence images | |
| Laminin | Sigma | 114956-81-9 | Final concentration: 20 µg/mL |
| Maestro | Axion Biosystems | MEA recordings | |
| MEA plate | Axion Biosystems | M768-tMEA-48W | |
| Neurobasal | Gibco | 21103-049 | |
| Paraformaldehyde | nacalai tesque | 26126-25 | Final concentration: 4% in PBS |
| Penicillin/Streptomycin | Gibco | 15140-122 | 100 U/mL for normal plates |
| Penicillin/Streptomycin | nacalai tesque | 26253-84 | 100 µg/mL for MEA plates |
| polyethyleimine | Sigma | 9002-98-6 | Final concentration: 0.1% |
| Poly-L-lysine | Sigma | P2636 | Diluted in the borate buffer (final concentration: 1 mg/mL) |
| SKY Neuron | AlzMed , Inc. | ARH001 | 1.0 x 106 cells/tube |
| Sodium azide | FUJIFILM | 195-11092 | 0.1% |
| SodiumL(+)-Glutamate monohydrate | WAKO | 194-02032 | Diluted in dH2O (final concentrations: 1 µM, 3 µM, 10 µM, 30 µM, 100 µM) |
References
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126 (3), 397-342 (1977).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Roppongi, R. T., Champagne-Jorgensen, K. P., Siddiqui, T. J. Low-density primary hippocampal neuron culture. Journal of Visualized Experiments. (122), e55000 (2017).
- Mizui, T., et al. Drebrin E is involved in the regulation of axonal growth through actin-myosin interactions. Journal of Neurochemistry. 109 (2), 611-622 (2009).
- Mizui, T., et al. Myosin II ATPase activity mediates the long-term potentiation-induced exodus of stable F-actin bound by drebrin A from dendritic spines. PLoS One. 9 (1), 85367 (2014).
- Takahashi, H., Mizui, T., Shirao, T. Down-regulation of drebrin A expression suppresses synaptic targeting of NMDA receptors in developing hippocampal neurons. Journal of Neurochemistry. 97, 110-115 (2006).
- Takahashi, H., et al. Drebrin-dependent actin clustering in dendritic filopodia governs synaptic targeting of postsynaptic density-95 and dendritic spine morphogenesis. The Journal of Neuroscience. 23 (16), 6586-6595 (2003).
- Yamazaki, H., Sasagawa, Y., Yamamoto, H., Bito, H., Shirao, T. CaMKIIbeta is localized in dendritic spines as both drebrin-dependent and drebrin-independent pools. Journal of Neurochemistry. 146 (2), 145-159 (2018).
- Hanamura, K., et al. High-content imaging analysis for detecting the loss of drebrin clusters along dendrites in cultured hippocampal neurons. Journal of Pharmacological and Toxicological Methods. 99, 106607 (2019).
- Mitsuoka, T., et al. Assessment of NMDA receptor inhibition of phencyclidine analogues using a high-throughput drebrin immunocytochemical assay. Journal of Pharmacological and Toxicological Methods. 99, 106583 (2019).
- Ishizuka, Y., Bramham, C. R. A simple DMSO-based method for cryopreservation of primary hippocampal and cortical neurons. Journal of Neuroscience Methods. 333, 108578 (2020).
- Pischedda, F., et al. Cryopreservation of primary mouse neurons: The benefit of neurostore cryoprotective medium. Frontiers in Cellular Neuroscience. 12, 81 (2018).
- Kobayashi, Y., et al. Impairment of ciliary dynamics in an APP knock-in mouse model of Alzheimer's disease. Biochemical and Biophysical Research Communications. 610, 85-91 (2022).
- Kobayashi, Y., et al. Properties of primary cilia in melanin-concentrating hormone receptor 1-bearing hippocampal neurons in vivo and in vitro. Neurochemistry International. 142, 104902 (2021).
- Koganezawa, N., et al. NMDA receptor-dependent and -independent effects of natural compounds and crude drugs on synaptic states as revealed by drebrin imaging analysis. The European Journal of Neuroscience. 53 (11), 3548-3560 (2021).
- Mizui, T., Takahashi, H., Sekino, Y., Shirao, T. Overexpression of drebrin A in immature neurons induces the accumulation of F-actin and PSD-95 into dendritic filopodia, and the formation of large abnormal protrusions. Molecular and Cellular Neurosciences. 30 (1), 149-157 (2005).
- Sekino, Y., et al. Activation of N-methyl-D-aspartate receptor induces a shift of drebrin distribution: disappearance from dendritic spines and appearance in dendritic shafts. Molecular and Cellular Neurosciences. 31 (3), 493-504 (2006).
- Takahashi, H., Yamazaki, H., Hanamura, K., Sekino, Y., Shirao, T. Activity of the AMPA receptor regulates drebrin stabilization in dendritic spine morphogenesis. Journal of Cell Science. 122, 1211-1219 (2009).
- Aoki, C., et al. Drebrin A is a postsynaptic protein that localizes in vivo to the submembranous surface of dendritic sites forming excitatory synapses. The Journal of Comparative Neurology. 483 (4), 383-402 (2005).
- Koganezawa, N., Hanamura, K., Sekino, Y., Shirao, T. The role of drebrin in dendritic spines. Molecular and Cellular Neurosciences. 84, 85-92 (2017).
- Shirao, T., et al. The role of drebrin in neurons. Journal of Neurochemistry. 141 (6), 819-834 (2017).
- Sekino, Y., Koganezawa, N., Mizui, T., Shirao, T. Role of drebrin in synaptic plasticity. Advances in Experimental Medicine and Biology. 1006, 183-201 (2017).
- Togo, K., et al. Postsynaptic structure formation of human iPS cell-derived neurons takes longer than presynaptic formation during neural differentiation in vitro. Molecular Brain. 14 (1), 149 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved