Ein Protokoll zur Erstellung eines Rattenwundmodells für Typ-1-Diabetes
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das Streptozotocin-induzierte diabetische Wundmodell bei männlichen SD-Ratten ist derzeit das am weitesten verbreitete Modell zur Untersuchung der Wundheilung bei Diabetes mellitus Typ I. Dieses Protokoll beschreibt die Methoden, die zum Erstellen dieses Modells verwendet werden. Darüber hinaus werden mögliche Herausforderungen vorgestellt und adressiert, und es werden die Progression und die angiogenen Eigenschaften diabetischer Wunden untersucht.
Zusammenfassung
Eine einmalige Hochdosis-Injektion von Streptozotocin, gefolgt von einer Hautexzision in voller Dicke am Rücken von Ratten, ist eine gängige Methode zur Konstruktion von Tiermodellen von diabetischen Wunden vom Typ 1. Eine unsachgemäße Manipulation kann jedoch zu Modellinstabilität und hoher Mortalität bei Ratten führen. Leider gibt es nur wenige Leitlinien zur Modellierung von Typ-1-Diabeteswunden, denen es an Details mangelt und keine spezifischen Referenzstrategien vorgestellt werden. Daher beschreibt dieses Protokoll das gesamte Verfahren zur Erstellung eines diabetischen Wundmodells vom Typ 1 und analysiert die Progression und die angiogenen Eigenschaften der diabetischen Wunden. Die Typ-1-diabetische Wundmodellierung umfasst die folgenden Schritte: Vorbereitung der Streptozotocin-Injektion, Induktion von Typ-1-Diabetes mellitus und Erstellung des Wundmodells. Die Wundfläche wurde am 7. und 14. Tag nach der Verwundung vermessen und das Hautgewebe der Ratten für histopathologische und immunfluoreszenzanalytische Analysen entnommen. Die Ergebnisse zeigten, dass Typ-1-Diabetes mellitus, der durch 55 mg/kg Streptozotocin induziert wurde, mit einer geringeren Mortalität und einer hohen Erfolgsrate assoziiert war. Die Blutzuckerwerte waren nach 5 Wochen Induktion relativ stabil. Die diabetische Wundheilungsrate war an Tag 7 und Tag 14 signifikant niedriger als bei normalen Wunden (p < 0,05), aber beide konnten an Tag 14 mehr als 90% erreichen. Im Vergleich zur Normalgruppe war der Verschluss der epidermalen Schicht diabetischer Wunden an Tag 14 unvollständig und hatte eine verzögerte Reepithelialisierung und eine signifikant geringere Angiogenese (p < 0,01). Das auf der Grundlage dieses Protokolls konstruierte Typ-1-Wundmodell für Diabetiker weist die Merkmale einer chronischen Wundheilung auf, einschließlich eines schlechten Verschlusses, einer verzögerten Reepithelialisierung und einer verminderten Angiogenese im Vergleich zu normalen Wunden von Ratten.
Einleitung
Diabetes mellitus Typ 1 (T1DM) ist eine chronische Stoffwechselerkrankung, die durch Hyperglykämie und die Zerstörung von β-Zellen der Bauchspeicheldrüse gekennzeichnetist 1. Eine T1DM-Wunde ist eine chronische, nicht heilende Wunde und die häufigste und verheerendste Komplikation von Diabetes beim Menschen 2,3. Tiermodelle sind die am besten geeigneten Prototypen, um die pathologischen Veränderungen während der Wundheilung und die Sicherheit und Wirksamkeit potenzieller Therapeutika zu untersuchen4. Im Vergleich zu anderen Typen reagieren männliche Sprague-Dawley-Ratten (SD) empfindlicher auf Streptozotocin (STZ) und weisen eine geringere Mortalitätsrate auf, was sie in der diabetischen Wundforschung beliebt macht 5,6.
Es wurden zahlreiche Methoden zur Konstruktion von T1DM-Wundmodellen beschrieben. In Bezug auf das T1DM-Modell haben sich die Studien vor allem auf den Effekt der STZ-Injektionsmethode auf die Erfolgsrate der Diabetesinduktionkonzentriert 7,8. Der Modellierungsprozess leidet jedoch unter der inkonsistenten Funktionsweise desselben Schritts. In einer Studie fasteten Ratten 18 Stunden lang vor der STZ-Injektion; Ratten mit einem Blutzuckerspiegel von mehr als 16,67 mmol/l 1 Woche nach der STZ-Injektion wurden als diabetisch eingestuft, und die diabetische Wunde wurde nach 3 Wochen eingeführt9. Umgekehrt fasteten Zhu et al. in einer verwandten Studie Ratten 12 Stunden lang vor der STZ-Injektion; Ratten mit Blutzuckerwerten von mehr als 16,7 mmol/l 72 h nach der Injektion galten als Diabetiker, und die diabetische Wunde wurde nach 4 Wochen eingeführt10. Insgesamt gibt es Unstimmigkeiten in den STZ-Injektionsprotokollen, den Kriterien für die Diabetesdiagnose und den Wundeinführungszeiten.
In Bezug auf die Wundmodellierung wird in den meisten Studien die gesamte Dicke der dorsalen Haut herausgeschnitten, um T1DM-Wunden nach erfolgreicher Diabetes-Induktion zu konstruieren11,12,13. Obwohl dieses Modell bei Ratten anfällig für Hautkontrakturen ist, ist es das am häufigsten verwendete Modell in der Wundheilungsforschung, da es weniger arbeitsintensiv und kostengünstig ist14,15. Dennoch fehlt es an methodengeleiteter Forschung zu dieser Vollschichtexzisionstechnik. Darüber hinaus gibt es in bestehenden Studien keine einheitlichen Standards bezüglich Wundgröße und -lokalisation12,16. Die Größe und Lage der Wunde kann indirekt die Konsistenz des Versuchsdesigns und die wissenschaftliche Validität der Ergebnisse beeinflussen. Daher besteht ein dringender Bedarf an einem Standardprotokoll für die T1DM-Induktion und Wundmodellierung als Referenz für die Forschung. Das Ziel dieser Studie ist es, ein spezifisches Protokoll für die T1DM-Wundmodellierung zu visualisieren, das als Referenz für T1DM-Wundstudien verwendet werden kann.
Protokoll
Das Protokoll wurde im Anschluss an die Deklaration von Helsinki durchgeführt, und alle Tierversuche wurden vom Verwaltungsausschuss der Universität für Traditionelle Chinesische Medizin Chengdu genehmigt (Akte Nr. 2021-13).
1. Vorbereitung der Streptozotocin-Injektion
- Wählen Sie 15 SD-Ratten im Alter von 8 Wochen und einem Gewicht von 220 g ± 20 g aus. Mit der einfachen Randomisierungsmethode werden die Ratten in eine Diabetikergruppe (n = 10) und eine normale Gruppe (n = 5) unterteilt.
- Messen Sie das Ausgangsgewicht der Ratten und bestimmen Sie die Dosierung von STZ durch die Verabreichung von 55 mg/kg.
HINWEIS: Basierend auf Vorexperimenten ist 55 mg/kg die optimale STZ-Dosis. - Wiegen Sie das STZ-Pulver genau ab und geben Sie es in einen lichtundurchlässigen Behälter.
- Fügen Sie eine geeignete Menge von 0,1 mol/L Natriumcitratpuffer (pH 4,5) hinzu, um die STZ auf eine Konzentration von 1 % aufzulösen.
HINWEIS: Der Natriumcitratpuffer muss vor der Verwendung 2 h im 4 °C Kühlschrank vorgekühlt werden. Die Herstellung der STZ-Lösung muss die Sterilität gewährleisten. - 30 Sekunden lang mit einem Medikamentenoszillator schütteln. In eine Eisbox geben und beiseite stellen.
Anmerkungen: Die Injektion sollte innerhalb von 15 Minuten verwendet werden.
2. Einführung des T1DM-Modells
- Vor der STZ-Injektion fasten Sie die Ratten 18 Stunden lang und lassen Sie freien Zugang zu Wasser.
- Führen Sie eine intraperitoneale Injektion von 1%iger STZ-Lösung durch.
- Fassen Sie die Ratte und legen Sie die Bauchhaut und die Injektionsstelle frei (der Schnittpunkt der Linie, die die Wurzeln der beiden Oberschenkel und die Mittellinie des Bauches verbindet).
- Desinfizieren Sie die Injektionsstelle zweimal mit einem in 75%igem Alkohol getränkten Wattebausch (einmal im Uhrzeigersinn und einmal gegen den Uhrzeigersinn). Lege den Kopf der Ratte unter den Bauch.
- Führen Sie die Nadel parallel zur Bauchmittellinie in einem Winkel von 45° ein und reduzieren Sie nach dem Durchstechen der Haut den Nadelwinkel auf 30° und führen Sie die Nadel dann 2-3 mm ein. Ziehen Sie vorsichtig am Nadelstopfen und achten Sie darauf, dass kein Blut oder Flüssigkeit in die Spritze gesaugt wird. Injizieren Sie die STZ-Lösung, ziehen Sie die Nadel heraus und stoppen Sie die Blutung mit einem Wattestäbchen.
Anmerkungen: Wenn eine gelbe Flüssigkeit in die Spritze zurückgezogen wird, kann die Nadel in die Blase eingedrungen sein, und wenn eine dunkelgrüne Flüssigkeit gezogen wird, könnte die Nadel in den Dickdarm oder Blinddarm eingedrungen sein. In jedem Fall sollte die Nadel sofort entfernt werden. Das Tier sollte von tierärztlichem Personal untersucht werden.
- Messen Sie den gelegentlichen Blutzuckerspiegel (nicht nüchtern oder nüchtern) um 09:00 Uhr an Tag 3 und Tag 7 nach STZ-Einleitung.
HINWEIS: Der Zeitpunkt für die stichprobenartige Blutzuckermessung ist festgelegt. In diesem Protokoll ist es auf 09:00 Uhr festgelegt. Es ist jedoch nicht die einzige Zeit, die verwendet wird. Blut, das durch eine Nadelpunktion aus der Schwanzvene entnommen wird, ist weniger anfällig für Gewebsflüssigkeit als Blut, das aus einem abgetrennten Schwanz entnommen wird, sodass die Blutzuckerwerte genauer sind.- Immobilisieren Sie die Ratte mit einem Rattenfixateur (Abbildung 1).
- Finde die Position der Schwanzvene. Desinfizieren Sie den Schwanz der Ratte zweimal mit einem in 75%igem Alkohol getränkten Wattebausch.
- Punktieren Sie die Schwanzvene, um eine Blutung auszulösen, und messen Sie den Blutzucker mit einem Blutzuckermessgerät. Stoppen Sie die Blutung mit einem Wattestäbchen.
HINWEIS: Ein Glukosespiegel von mehr als 16,7 mmol/l am 7. Tag nach der STZ-Injektion gilt als T1DM.
- Wiegen Sie die Ratten wöchentlich und messen Sie den Blutzuckerspiegel und andere Parameter, einschließlich Ernährung, Wasseraufnahme und Urinausscheidung.
- Füttern Sie die Tiere 8 Wochen lang nach der STZ-Induktion normal.
3. Aufbau des Wundmodells
- Rasieren Sie die Ratten 1 Tag vor der Wundmodellierung mit einem Elektrorasierer. Eine rasierte Fläche von 5 cm x 5 cm auf der Rückenseite der Ratte ist in der Regel ideal.
- Wischen Sie die rasierte Stelle mit einem warmen, normalen Kochsalz-Wattebausch ab, lassen Sie ihn trocknen und tragen Sie dann 5 Minuten lang Enthaarungscreme auf. Reinigen Sie den Bereich mit Gaze und waschen Sie alle Reste von Enthaarungscreme mit warmer normaler Kochsalzlösung.
- Wiegen Sie die Ratten und berechnen Sie die erforderliche Dosis von Nembutal auf der Grundlage des Standards von 35 mg/kg. Lösen Sie das Nembutal mit normaler Kochsalzlösung bis zu einer Konzentration von 3% auf. Für dieses Verfahren können andere Vollnarkosemittel wie Ketamin/Xylazin oder Isofluran verwendet werden. Bitte arbeiten Sie mit den Institutional Animal Care and Use Committees zusammen, um sicherzustellen, dass das Beste ist.
Anmerkungen: Um die Wirksamkeit zu gewährleisten, sollte die Lösung frisch zubereitet und das Nembutal-Pulver und die Lösung vor Licht geschützt werden. - Fasten Sie die Ratten 12 Stunden lang vor der Narkose. Injizieren Sie die Anästhesie intraperitoneal. Verwenden Sie Tetracyclin-Augensalbe oder ein allgemeines Augengleitmittel, um Augentrockenheit nach der Narkoseverabreichung zu verhindern.
ANMERKUNG: Die Anästhesie galt als moderat, wenn die Muskeln der Ratte relativ entspannt waren, die Augenbewegungen verschwanden, die Atmung regelmäßig war und die Reaktion auf schmerzhafte Reize gering war. - Desinfizieren Sie die Rückenhaut zweimal mit Wattebällchen, die mit Jod (einmal im Uhrzeigersinn und einmal gegen den Uhrzeigersinn) und 75%igem Alkohol (alternative Runden) getränkt sind.
- Schneiden Sie die Haut nach dem Trocknen mit einer zirkulären Biopsiestanze mit einem Durchmesser von 20 mm durch.
- Zelten Sie die Haut mit einer sterilen Pinzette und verwenden Sie dann eine sterile chirurgische Schere, um die Haut in voller Dicke entlang der Stanzschnittmarken zu entfernen. Stoppen Sie die Blutung mit einem normalen Kochsalz-Wattebausch.
ANMERKUNG: Der obere Rand der Wunde sollte 5-10 mm unterhalb des unteren Schulterblattrandes und 5-10 mm rechts/links von der Wirbelsäule der Ratte liegen (Abbildung 2). Die Wunden verlaufen symmetrisch entlang der Wirbelsäule, wenn zwei Wunden angelegt werden. - Verwenden Sie Vaseline-Gaze, um die Wunden abzudecken, und wickeln Sie sie mit einer Gaze und einem atmungsaktiven Verband ein, der mit Gummiband an Ort und Stelle gehalten wird. Einmal täglich Carprofen subkutan (5 mg/kg) injizieren, um postoperative Schmerzen zu lindern. Wechseln Sie den Wundverband einmal täglich (Verwendung von Carprofen zur Schmerzlinderung).
Anmerkungen: Beobachten Sie die Bewegung und Atmung der Ratte auf Anomalien, nachdem der Verband abgeschlossen ist, und stellen Sie sicher, dass der atmungsaktive Verband angemessen fest sitzt. - Legen Sie ein Lineal unter die Wunde und fotografieren Sie die Wunde mit einer Digitalkamera bis zum 14. Tag. Euthanasieren Sie die Ratten am 14. Tag gemäß den Richtlinien für die Pflege und Verwendung von Tieren in der Institution. Schneiden Sie das Wundhautgewebe 5 mm vom Wundrand entfernt ab. Teilen Sie die Gewebeprobe in zwei Teile, waschen Sie sie mit PBS, um sichtbare Blutflecken zu entfernen, und fixieren Sie sie dann mit 4%iger Paraformaldehydlösung.
4. Berechnung der Wundfläche mit der ImageJ-Software
- Klicken Sie nach dem Öffnen der Software auf die Schaltfläche Datei , und klicken Sie dann auf Öffnen , um die Wundbilder zu öffnen.
- Wählen Sie das Werkzeug Gerade und zeichnen Sie eine gerade Linie von 1 cm entlang des Lineals in den Wundbildern.
- Klicken Sie im Menü "Analysieren" auf den Befehl "Maßstab festlegen" und legen Sie den Wert "Bekannter Abstand" auf 1 fest.
- Wählen Sie das Freihandauswahl-Werkzeug aus, und skizzieren Sie den Umriss der Wunde auf dem Bild.
- Klicken Sie im Menü "Analysieren" auf den Befehl "Messen" und lesen Sie den Wert "Fläche" ab, nachdem das Ergebnis angezeigt wurde.
5. Hämatoxylin- und Eosin-Färbung (H&E)
- Entfernen Sie das Hautgewebe aus dem Fixiermittel, schneiden Sie es mit einem Skalpell in einem Abzug in dünne Abschnitte und legen Sie es in eine Dehydrierungskassette.
- Legen Sie die Dörrkassette in eine Dörrmaschine und dehydrieren Sie das Gewebe in den folgenden Schritten: 75% Alkohol für 4 Stunden; 85% Alkohol für 2 h; 90% Alkohol für 2 h; 95% Alkohol für 1 h; wasserfreies Ethanol I und II für jeweils 30 min; Alkoholbenzol für 5-10 min; Xylol I und II für jeweils 5-10 min; und Wachs I, II und III für jeweils 1 h.
- Betten Sie das Gewebe in Wachs ein. Auf einem Gefriertisch bei −20° abkühlen lassen und den Wachsblock ordentlich korrigieren.
- Schneiden Sie die Wachsblöcke in Längsrichtung mit einer Paraffin-Trennmaschine in 3 μm dicke Abschnitte.
- Den Abschnitt nacheinander für jeweils 20 Minuten in Xylol I und II, in wasserfreiem Ethanol I und II für jeweils 5 Minuten und in Leitungswasser für 5 Minuten einweichen.
- Fluten Sie das Gewebe 3-5 Minuten lang mit Hämatoxylin-Färbung, 0,5%iger wässriger Salzsäurelösungsdifferenzierung, 0,5%iger wässriger Ammoniaklösung zurück zu Blau und spülen Sie es mit Wasser ab.
- Entwässern Sie die Gewebeabschnitte mit 85%igem und 95%igem Alkohol. Fluten Sie das Gewebe 5 Minuten lang mit Eosin-Färbelösung.
Anmerkungen: Normalerweise dauert die Eosin-Färbung 30 s bis 2 Minuten, und die Zeit kann je nach Färbeergebnis und -anforderungen angepasst werden. - Dehydrieren Sie die Abschnitte nacheinander mit den folgenden Lösungen: wasserfreies Ethanol I, wasserfreies Ethanol II, wasserfreies Ethanol III, Xylol I und Xylol II, jeweils 5 Minuten lang. Zum Schluss die Objektträger mit neutralem Balsam bedecken.
- Untersuchen Sie das H&E-gefärbte Gewebe unter dem Mikroskop bei 40x, 20x und 10x und machen Sie Fotos, um repräsentative Bilder von jedem Objektträger zu erhalten.
6. CD31-Immunfluoreszenzfärbung
- Die Gewebeabschnitte werden jeweils 15 Minuten lang in Xylol I und II, in wasserfreiem Ethanol I und II jeweils 5 Minuten, 5 Minuten in 85 % Alkohol und 5 Minuten in 75 % Alkohol eingeweicht und mit destilliertem Wasser abgespült.
- Reparatur von Antigenen
- Geben Sie einen geeigneten 10 mM Zitronensäurepuffer mit einem pH-Wert von 6,0 in einen Mikrowellenbehälter, erhitzen Sie ihn auf höchster Stufe und legen Sie dann den Objektträger hinein.
- 8 Minuten bei mittlerer Hitze kochen, 8 Minuten anhalten und dann bei mittlerer Hitze erneut 7 Minuten kochen lassen.
- Lassen Sie die Objektträger abkühlen, legen Sie sie in PBS (pH 7,4) und waschen Sie sie dreimal für jeweils 5 Minuten mit einem Entfärbungsschüttler.
- Fügen Sie 5% Ziegenserum tropfenweise in den Kreis hinzu und inkubieren Sie es 30 Minuten lang.
- Schütteln Sie die Verschlusslösung (5%iges Ziegenserum) vorsichtig ab und geben Sie Kaninchen-Anti-CD31-Antikörper (verdünnt mit PBS im Verhältnis 1:200) tropfenweise auf die Abschnitte. Legen Sie die Abschnitte in eine Nassbox und inkubieren Sie sie über Nacht bei 4 °C.
- Waschen Sie die Objektträger dreimal mit PBS (pH 7,4) auf einem Entfärbungsschüttler für jeweils 5 Minuten. Schütteln Sie die Abschnitte leicht, um sie zu trocknen, und bedecken Sie sie dann mit einem kreisförmigen Tropfen FITC-markiertem Ziegen-Anti-Kaninchen-IgG. Bei Raumtemperatur 50 min bei Dunkelheit inkubieren.
- Waschen Sie die Objektträger dreimal mit PBS (pH 7,4) auf einem Entfärbungsschüttler für jeweils 5 Minuten. Trocknen Sie die Abschnitte mit leichtem Schütteln an der Luft und fügen Sie DAPI-Färbelösung hinzu. Inkubieren Sie die Schnitte im Dunkeln 10 Minuten lang bei Raumtemperatur.
- Zeichnen Sie nach dem Trocknen der Partien mit dem PepPen Kreise um das Gewebe (um den Verlust von Antikörpern zu vermeiden), geben Sie ein Autofluoreszenzlöschmittel (0,3% Sudan Black B) für 5 Minuten zu den Kreisen und spülen Sie sie anschließend 10 Minuten lang unter fließendem Wasser ab.
- Waschen Sie die Objektträger dreimal mit PBS (pH 7,4) auf einem Entfärbungsschüttler für jeweils 5 Minuten. Schütteln Sie die Abschnitte leicht und versiegeln Sie sie mit einem lichtbeständigen Eindeckmedium.
- Beobachten und fotografieren Sie die Schnitte unter einem Fluoreszenzmikroskop bei 40x, 20x und 10x.
HINWEIS: Die DAPI-UV-Anregungswellenlänge beträgt 330-380 nm und die Emissionswellenlänge 420 nm (blaues Licht). Die FITC-Anregungswellenlänge beträgt 465-495 nm und die Emissionswellenlänge 515-555 nm (grünes Licht).
7. Statistische Analyse
- Erfassen und analysieren Sie die Daten mit SPSS.
- Geben Sie die Daten als Mittelwert ± Standardabweichung an.
- Verwenden Sie einen t-Test mit unabhängigen Stichproben, um die Unterschiede zwischen der Diabetiker- und der Normalgruppe zu analysieren.
- Legen Sie die statistische Signifikanz auf **p < 0,01 und *p < 0,05 fest.
Ergebnisse
Insgesamt erhielten 10 SD-Ratten eine einzelne intraperitoneale STZ-Injektion, um das T1DM-Modell zu induzieren. Eine Ratte starb vorzeitig (10%), aber Diabetes wurde bei allen Ratten induziert (100%). Nach 3 Tagen STZ-Injektion waren die Blutzuckerwerte aller Ratten höher als 16,7 mmol/l, und die Blutzuckerwerte stabilisierten sich 5 Wochen nach der Induktion (Abbildung 3A). Das Gewicht der Diabetesgruppe nahm nach der STZ-Injektion allmählich zu, nahm aber in Woche 3 ab und nahm dann ab Woche 4 langsam wieder zu (Abbildung 3B). Im Gegensatz dazu stieg das Gewicht der Ratten in der Normalgruppe stetig an, und ihr Durchschnittsgewicht 3 Tage nach der Diabetes-Induktion war höher als das der Diabetikergruppe (Abbildung 3B). Die diabetischen Ratten zeigten alle typische Symptome wie Durst, Polyurie und Gewichtsverlust, ähnlich den Ergebnissen von Hao et al.17.
Am 7. und 14. Tag nach der Verwundung zeigte die makroskopische Analyse, dass die Reepithelialisierung bei Ratten in der Normalgruppe stärker ausgeprägt war als in der Diabetikergruppe (Abbildung 4A). Die quantitativen Ergebnisse zeigten, dass die Wundheilungsrate in der Diabetikergruppe an Tag 7 und Tag 14 signifikant niedriger war als in der Normalgruppe (p < 0,01). An Tag 14 konnten die Wundheilungsraten aber auch in der Diabetikergruppe über 90 % liegen (p < 0,05, Abbildung 4B). Dies deutet darauf hin, dass das T1DM-Wundmodell durch einen schlechten Verschluss gekennzeichnet ist, jedoch nicht in dem Ausmaß wie die chronische Nichtheilung, die bei menschlichen diabetischen Wunden beobachtet wird.
Die H&E-Färbung am 14. Tag der Wundheilung zeigte eine unvollständige Wundepidermis, eine langsame Proliferation der Keratinozyten und eine verzögerte Reepithelialisierung in der Diabetikergruppe im Vergleich zur Normalgruppe. Die diabetischen Wunden zeigten einen teilweisen Verlust der Haarfollikel und Talgdrüsen. Es gab auch weniger sichtbare Kapillaren (Abbildung 5).
Diabetes verursacht eine Dysfunktion der Endothelzellen, eine Glykosylierung der Proteine der extrazellulären Matrix und eine vaskuläre Denervierung18. Diese Komplikationen führen bei diabetischen Wunden zu einer unterdurchschnittlichen Wundangiogenese18. Die Angiogenese ist für die Wundheilung notwendig, und die Wundangiogenese wird häufig durch CD31-Immunfärbung analysiert (Abbildung 6A)19,20. Basierend auf der durchschnittlichen optischen Dichte (AOD) der CD31-Expression war die Angiogenese an der Wundstelle in der normalen Gruppe signifikant höher als in der diabetischen Gruppe (p < 0,01, Abbildung 6B).
Abbildung 1: Bild von Ratten, die durch Fixateure immobilisiert wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Abbildung 2: Diagramm der Wundlokalisation der Ratte. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
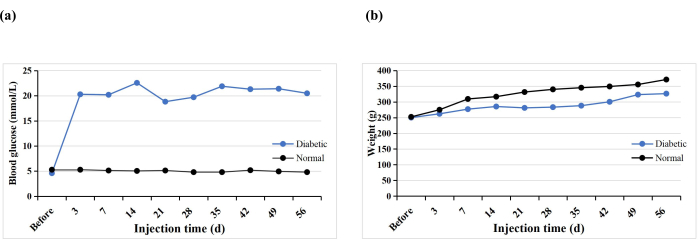
Abbildung 3: Blutzuckerwerte und -gewichte der Versuchsratten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
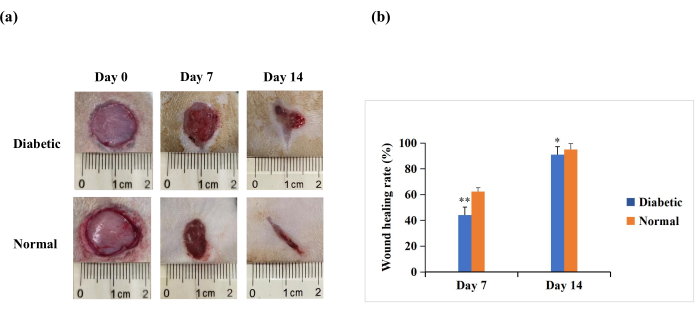
Abbildung 4: Hautwunden in voller Dicke (20 mm Durchmesser) auf dem Rücken der Versuchsratten. (A) Das makroskopische Erscheinungsbild der Wunden an Tag 0, Tag 7 und Tag 14. Die Bilder der Wundmorphologie an Tag 0, Tag 7 und Tag 14 wurden mit einer Digitalkamera aufgenommen. (B) Die Wundfläche wurde mit der ImageJ-Software gemessen und zur Berechnung der Wundheilungsrate verwendet. Die Wundheilungsrate (%) wurde wie folgt berechnet: (Wundinitialfläche − Wundfläche zum angegebenen Zeitpunkt)/Anfangswundfläche × 100. Die Werte werden als Mittelwert ± SD (n = 14) dargestellt. Die statistische Signifikanz wurde auf ** p < 0,01 und * p < 0,05 festgelegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
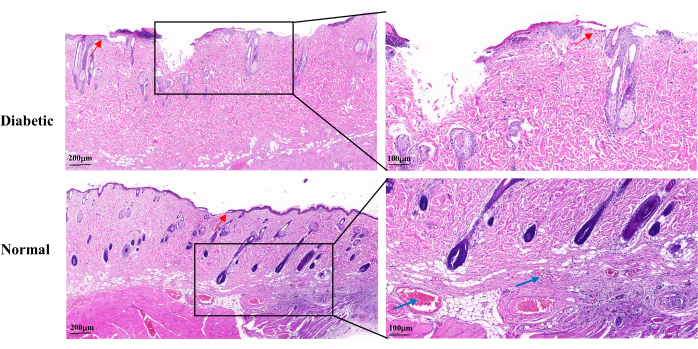
Abbildung 5: Repräsentative histopathologische H&E-Bilder am 14. Tag nach Wundbildung. Die blauen Pfeile zeigen Kapillaren an. Die roten Pfeile zeigen die Proliferation von Keratinozyten. Linke Skala: ein Balken = 200 μm; rechte Skala: ein Balken = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
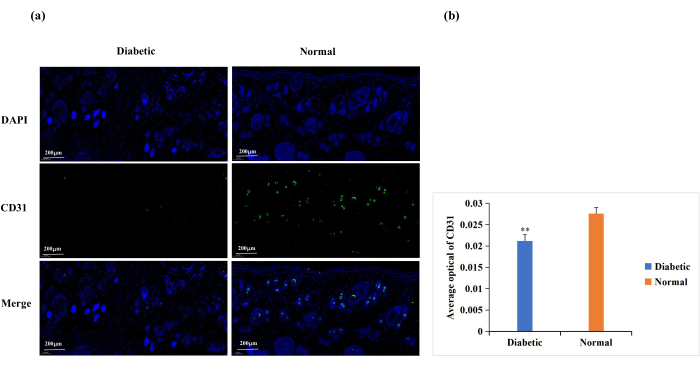
Abbildung 6: Immunfluoreszenz-Färbeanalyse zur Expression von CD31. Der CD31-Spiegel wurde verwendet, um den Zustand der Angiogenese zu bestimmen. (A) Repräsentative Bilder der CD31-Immunfluoreszenzfärbung in der Diabetiker- und Normalgruppe. Der Wert der integrierten optischen Dichte (IOD) und die Pixelfläche (AREA) für jede Hautprobe wurden mit der Software Image-Pro Plus 6.0 berechnet. Der durchschnittliche Wert der optischen Dichte (AOD) (AOD = IOD/AREA) wurde ebenfalls abgeleitet. Der AOD-Wert war direkt proportional zur positiven Expression von CD31. (B) Quantitativer Vergleich der CD31-positiven Expression in der Diabetiker- und Normalgruppe. Die Daten werden als Mittelwert ± SD angegeben. ** p < 0,01. Maßstab: ein Balken = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Dieses Protokoll klärt die umstrittenen Operationen in der T1DM-Wundmodellierung. Bedenken hinsichtlich der STZ-Injektionsprotokolle, der Erfolgskriterien für die T1DM-Induktion, der Blutzuckerstabilisierungszeit sowie der Wundlokalisation und -größe wurden in dieser Arbeit behandelt. Des Weiteren wurden die pathologischen Charakteristika und messbaren Parameter für die T1DM-Wundheilungsbeurteilung geklärt.
Die Ratten fasteten 18 Stunden vor der STZ-Injektion, um die kompetitive Bindung von Glukose oder ihren Analoga an β-Zellen zu vermeiden, die die Wirksamkeit von STZ beeinträchtigen könnte. Die am häufigsten verwendete Methode zur Induktion von T1DM ist eine einzelne hohe Dosis STZ, die den Blutzucker erhöht, indem sie die Inseln schädigt und die Insulinsekretion verringert21. Präexperimentelle Studien zeigten, dass die optimale STZ-Dosis für eine hohe Erfolgsrate und eine niedrige Mortalitätsrate bei 55 mg/kg lag, was niedriger ist als die in früheren Studien berichteten optimalen Dosen22,23,24. In diesem Protokoll wurde T1DM durch eine einmalige intraperitoneale Injektion von 55 mg/kg STZ induziert.
Die Blutzuckerwerte waren 3 Tage nach der STZ-Injektion alle höher als 16,7 mmol/l. Ein Blutzuckerspiegel von mehr als 16,7 mmol/L am Tag 7 nach STZ-Injektion ist jedoch das empfohlene Kriterium für eine erfolgreiche T1DM-Modellierung, da das Ausmaß der Inselschädigung bei Ratten unterschiedlich ist und eine entsprechende Verlängerung der Diagnosezeit die Falsch-Negativ-Rate senken kann. Darüber hinaus stabilisierten sich die Blutzuckerschwankungen 5 Wochen nach der STZ-Injektion, und die Ratten nahmen in diesem Zeitraum allmählich an Gewicht zu, was mit früheren Befunden übereinstimmt25,26. Dies deutet darauf hin, dass der Blutzuckerspiegel im T1DM-Modell für mindestens 6 Wochen stabilisiert sein sollte und eine Zunahme des Rattengewichts nach 6 Wochen die Sterblichkeitsraten während der Wundmodellierung senkt. Daher führte dieses Protokoll 8 Wochen nach der STZ-Injektion eine Wundmodellierung durch.
Die Wundverschlussrate am 7. und 14. Tag nach der Verwundung war beim Diabetiker signifikant niedriger als in der normalen Wundgruppe, was auf eine langsame Heilung hindeutet. Darüber hinaus waren die Wundreepithelialisierung und die Angiogenese beim Diabetiker signifikant geringer als in der Normalgruppe. Dies zeigt, dass das T1DM-Wundmodell eine langsamere Wundheilung und eine verzögerte Reepithelialisierung als bei normalen Ratten zeigt, was mit den pathologischen Veränderungen der reduzierten Wundangiogenese zusammenhängen könnte. An Tag 14 lag die T1DM-Wundheilungsrate jedoch ebenfalls über 90 %, was sich von der chronischen Nichtheilungscharakteristik menschlicher diabetischer Wunden unterscheidet. Dies könnte daran liegen, dass sich die physiologischen Mechanismen der Wundheilung von Nagetieren von denen des Menschen unterscheiden27. Folglich beträgt der beste Wunddurchmesser mindestens 20 mm, was groß genug ist, um Zeit zu haben, die Wirksamkeit eines Eingriffs in einer diabetischen Wundstudie zu beurteilen. Die Wundlokalisation sollte das Schulterblatt und die Wirbelsäule aussparen, da eine kontinuierliche Bewegung an diesen beiden Stellen die Wundheilung stören könnte.
Zusammenfassend lässt sich sagen, dass die Konstruktion des T1DM-Wundmodells mit der Methode dieses Protokolls effektiv ist. Das Protokoll repliziert einige der Merkmale chronischer diabetischer Wunden, wie z. B. eine langsamere Wundheilung, eine verzögerte Reepithelialisierung und eine reduzierte Angiogenese im Vergleich zu normalen Wunden von Ratten. Es ist jedoch nicht bekannt, ob das Modell andere chronische Phänotypen diabetischer Wunden replizieren kann. Darüber hinaus beschreibt dieses Protokoll die grundlegendste und am weitesten verbreitete Methode, die das Problem der Hautkontraktion bei Ratten nicht berücksichtigt. Zukünftige Forschungen können die Verwendung von Wundschienen in dieses Protokoll integrieren oder zusätzliche Modelle für chronische diabetische Wunden untersuchen, was in Zukunft eine große Herausforderung für Forscher darstellen wird.
Offenlegungen
Alle Autoren erklären, dass dieses Manuskript keine Interessenkonflikte aufweist.
Danksagungen
Diese Studie wurde von der National Natural Science Foundation of China (82104877) finanziell unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Antifade mounting medium | Southern Biotechnology Associates, Inc. | 0100-01 | |
| AutoFluo Quencher | Servicebio Technology co., Ltd. | G1221 | |
| Automatic slide stainer | Thermo Fisher Scientific Inc. | Varistain™ Gemini ES | |
| CD31 | Servicebio Technology co., Ltd. | GB11063-2 | |
| Citrate antigen retrieval solution | Servicebio Technology co., Ltd. | G1201 | |
| Cover glass | Citotest Labware Manufacturing Co., Ltd. | 10212432C | |
| DAPI | Servicebio Technology co., Ltd. | G1012 | |
| Decolorization shaker | Scilogex | S1010E | |
| Depilatory cream | Guangzhou Ruixin Biotechnology Co., Ltd. | — | |
| Dimethyl benzene | Chengdu Kelong Chemical Co., Ltd. | 64-17-5 | |
| Drug oscillator | Shenzhen Jiashi Technology Co., Ltd. | VM-370 | |
| Electric razor | Shanghai Flyco Electrical Appliance Co., Ltd. | FC5908 | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd. | JB-P5 | |
| Ethanol absolute | Chengdu Kelong Chemical Co., Ltd. | 1330-20-7 | |
| Fitc-labeled goat anti-rabbit IgG | Servicebio Technology co., Ltd. | GB22303 | |
| Goat serum | Thermo Fisher Scientific Inc. | 16210064 | |
| Hematoxylin and eosin staining solution | Beijing Regan Biotechnology Co., Ltd. | DH0020 | |
| Image J software | National Institutes of Health | — | |
| Microwave oven | Midea Group Co., Ltd. | M1-L213B | |
| Mini centrifuge | Scilogex | D1008 | |
| Neutral balsam | Sinopharm Chemical Reagent Co., Ltd | 10004160 | |
| PBS buffer | Biosharp | G4202 | |
| Portable blood glucose meter | Sinocare Inc. | GA-3 | |
| Rapid tissue processor | Thermo Fisher Scientific Inc. | STP420 ES | |
| Rat fixator | Globalebio (Beijing) Technology co., Ltd | GEGD-Q10G1 | |
| Slicing machine | Thermo Fisher Scientific Inc. | HM325 | |
| Slides glass | Citotest Labware Manufacturing Co., Ltd. | 80312-3181 | |
| sodium citrate buffer | Beijing Solarbio Science & Technology Co., Ltd. | c1013 | |
| Streptozotocin | Sigma | 57654595 |
Referenzen
- Zimmet, P., Alberti, K. G., Shaw, J. Global and societal implications of the diabetes epidemic. Nature. 414 (6865), 782-787 (2001).
- Grennan, D. Diabetic foot ulcers. Journal of the American Medical Association. 321 (1), 114 (2019).
- Eming, S. A., Martin, P., Tomic-Canic, M. Wound repair and regeneration: Mechanisms, signaling, and translation. Science Translational Medicine. 6 (265), 265sr6 (2014).
- Patel, S., Srivastava, S., Singh, M. R., Singh, D. Mechanistic insight into diabetic wounds: Pathogenesis, molecular targets and treatment strategies to pace wound healing. Biomedicine & Pharmacotherapy. 112, 108615 (2019).
- Deeds, M. C., et al. Single dose streptozotocin-induced diabetes: Considerations for study design in islet transplantation models. Laboratory Animals. 45 (3), 131-140 (2011).
- Chao, P. C., et al. Investigation of insulin resistance in the popularly used four rat models of type-2 diabetes. Biomedicine & Pharmacotherapy. 101, 155-161 (2018).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Current Protocols. 1 (4), e78 (2021).
- Wu, J., Yan, L. J. Streptozotocin-induced type 1 diabetes in rodents as a model for studying mitochondrial mechanisms of diabetic β cell glucotoxicity. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy. 8, 181-188 (2015).
- Yang, J., Chen, Z., Pan, D., Li, H., Shen, J. Umbilical cord-derived mesenchymal stem cell-derived exosomes combined pluronic F127 hydrogel promote chronic diabetic wound healing and complete skin regeneration. International Journal of Nanomedicine. 15, 5911-5926 (2020).
- Zhu, Y., Wang, Y., Jia, Y., Xu, J., Chai, Y. Roxadustat promotes angiogenesis through HIF-1α/VEGF/VEGFR2 signaling and accelerates cutaneous wound healing in diabetic rats. Wound Repair and Regeneration. 27 (4), 324-334 (2019).
- Shao, Z., et al. Wound microenvironment self-adaptive hydrogel with efficient angiogenesis for promoting diabetic wound healing. Bioactive Materials. 20, 561-573 (2022).
- Asfour, H. Z., et al. Enhanced healing efficacy of an optimized gabapentin-melittin nanoconjugate gel-loaded formulation in excised wounds of diabetic rats. Drug Delivery. 29 (1), 1892-1902 (2022).
- Wei, L., et al. Mesenchymal stem cells promote wound healing and effects on expression of matrix metalloproteinases-8 and 9 in the wound tissue of diabetic rats. Stem Cells and Development. 32 (1-2), 25-31 (2022).
- Pastar, I., et al. . Preclinical models for wound-healing studies. In Skin Tissue Models., edited by. , 223-253 (2018).
- Yang, R. H., et al. Epidermal stem cells (ESCs) accelerate diabetic wound healing via the Notch signalling pathway. Bioscience Reports. 36 (4), e00364 (2016).
- Suliman Maashi, M., Felemban, S. G., Almasmoum, H. A., Jarahian, M. Nicaraven-loaded electrospun wound dressings promote diabetic wound healing via proangiogenic and immunomodulatory functions: A preclinical investigation. Drug Delivery and Translational Research. 13 (1), 222-236 (2023).
- Hao, M., Ding, C., Sun, S., Peng, X., Liu, W. Chitosan/sodium alginate/velvet antler blood peptides hydrogel promotes diabetic wound healing via regulating angiogenesis, inflammatory response and skin flora. Journal of Inflammation Research. 15, 4921-4938 (2022).
- Kolluru, G. K., Bir, S. C., Kevil, C. G. Endothelial dysfunction and diabetes: Effects on angiogenesis, vascular remodeling, and wound healing. International Journal of Vascular Medicine. 2012, 918267 (2012).
- Okonkwo, U. A., DiPietro, L. A. Diabetes and wound angiogenesis. International Journal of Molecular Sciences. 18 (7), 1419 (2017).
- Yi, C., et al. Targeted inhibition of endothelial calpain delays wound healing by reducing inflammation and angiogenesis. Cell Death & Disease. 11 (7), 533 (2020).
- Goodson 3rd, W. H., Hung, T. K. Studies of wound healing in experimental diabetes mellitus. Journal of Surgical Research. 22 (3), 221-227 (1977).
- Luippold, G., Klein, T., Mark, M., Empagliflozin Grempler, R. a novel potent and selective SGLT-2 inhibitor, improves glycaemic control alone and in combination with insulin in streptozotocin-induced diabetic rats, a model of type 1 diabetes mellitus. Diabetes, Obesity & Metabolism. 14 (7), 601-607 (2012).
- Sayed, N., et al. Effect of dapagliflozin alone and in combination with insulin in a rat model of type 1 diabetes. The Journal of Veterinary Medical Science. 82 (4), 467-474 (2020).
- Han, Y., et al. Human umbilical cord mesenchymal stem cells implantation accelerates cutaneous wound healing in diabetic rats via the Wnt signaling pathway. European Journal of Medical Research. 24 (1), 10 (2019).
- Ansell, D. M., Marsh, C., Walker, L., Hardman, M. J., Holden, K. Evaluating STZ-induced impaired wound healing in rats. Journal of Investigative Dermatology. 138 (4), 994-997 (2018).
- Liu, Y., et al. Human umbilical cord-derived mesenchymal stem cells not only ameliorate blood glucose but also protect vascular endothelium from diabetic damage through a paracrine mechanism mediated by MAPK/ERK signaling. Stem Cell Research & Therapy. 13 (1), 258 (2022).
- Zindle, J. K., Wolinsky, E., Bogie, K. M. A review of animal models from 2015 to 2020 for preclinical chronic wounds relevant to human health. Journal of Tissue Viability. 30 (3), 291-300 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten