מיטוב תפוקת טובולין מרקמת מוח חזירית
In This Article
Summary
פרוטוקול זה מתאר טכניקה לבידוד תפוקה גבוהה של טובולין מהמוח החזירי המותאם למכשור בקנה מידה קטן. את הליכי הבידוד משלימים נהלים לקביעת פעילות פילמור טובולין במבחנה באמצעות מבחני שיקוע משותף ומיקרוסקופ אלקטרונים תמסורת.
Abstract
רקמה עצבית מכל מקור היא חומר מצוין לבידוד טובולין, שכן הדנדריטים והאקסונים של הנוירונים עשירים במיקרוטובולים. כאן, אנו מציגים הליך לחילוץ טובולין שניתן להשתמש בו, עם שינויים קלים, עבור רקמה עצבית ממקורות מרובים. בפרוטוקול המוצג הוצג שלב הבהרה חדש של הליזט הגולמי, שהוביל להפחתה משמעותית בכמות הראשונית של פסולת בלתי מסיסה לפני שלב הפילמור הראשון. צעד נוסף זה איפשר עיבוד של רקמה נוספת תוך שימוש באותו מכשור, ובכך להגדיל את הנפח היחסי של הומוגנט מעובד. לשלב החדש שהוצג אין השפעה משמעותית על איכות הטובולין המטוהר, כפי שאושר על ידי בדיקות פעילות חוץ גופית ומיקרוסקופ אלקטרונים תמסורת. ההליך המתואר מכיל את כל השלבים המכריעים, כולל איסוף רקמות, הובלה, הומוגניזציה של רקמות, מחזורי בידוד טובולין וליטוש סופי על ידי כרומטוגרפיה של חילופי יונים באמצעות FPLC ומבחני מדידת פעילות עוקבים. ההומוגניות של טובולין מטוהר הייתה יותר מ -97%, כפי שאושר על ידי ניתוח MS / MS באמצעות יינון אלקטרוספריי ו- MALDI-TOF.
Introduction
מיקרוטובולים, חוטי חלבון חלולים (בקוטר 24 ננומטר) הנוצרים על ידי הטרודימרים אלפא ובטא-טובולין, מעורבים בתהליכים תאיים חיוניים שונים. הם משתתפים ביצירת מבנים תוך-תאיים, תנועתיות, חלוקת תאים, התמיינות תאים, הובלה תאית, תחזוקת צורה והפרשת1. התפקודים התאיים של מיקרוטובולים יכולים להיות מושפעים מאינטראקציות ישירות או עקיפות עם חלבונים הקשורים למיקרוטובולים (MAPs) וחלבונים אחרים או באמצעות שינויים מורכבים לאחר התרגום המוגדרים בקוד טובולין2.
סיבי טובולין נובעים מאינטראקציות דינמיות לא קוולנטיות, בין תת-יחידות אלפא ובטא במנגנון התארכות הנוקלציה. מיקרוטובולים קצרים נוצרים, והצמיחה הבאה של סיבי טובולין מושגת על ידי התארכות הפיכה בשני הקצוות, ויוצרים גלילים המורכבים מהטרודימרים טובולין המסודרים בפרוטופילמנטים מקבילים2. אי-יציבות דינמית מתייחסת לעובדה שמיקרוטובולים מורכבים לרוב אינם נמצאים בשיווי משקל עם תת-היחידות שלהם, אך יכולים לעבור מעבר פאזה בין תקופה ממושכת של צמיחה והתכווצות תוך שמירה על מצב יציב 1,2.
חוסר היציבות הדינמי של סיבי טובולין מנוצל בעיקר בהליכי הפרדה וטיהור רבים של טובולין באמצעות מחזורים של פילמור בטמפרטורה גבוהה ודה-פולימריזציה בטמפרטורה נמוכה בסביבה של גליצרול בעל טוהר גבוה, DMSO, GTP/ATP,MG 2+ או חומרים כימיים אחרים (כגון טקסול או פוליקטיונים)3. רוב הליכי ההפרדה4 מלווים בכרומטוגרפיה של חלבונים 5,6,7,8,9, המבטיחה הפרדה של חלבונים הקשורים לטובולין עם דיפוספוקינאז נוקלאוזידי ופעילותATPase 5. תוצאות דומות ניתן להשיג על ידי שימוש במאגרי מלח גבוהים10. מקורות מרובים, כולל רקמות עצביות 11,12,13,14 ורקמות לא עצביות 15, דגים16 (מים מתוקים וימיים), שמרים או גרסאות רקומביננטיות17 שבוטאו יתר על המידה בזני ייצור שונים 11,12,13,14, ומקורות אחרים 9,18 שימשו לשבירה ו טיהור.
הפרוטוקול המוצג משתמש במשקעים ובכרומטוגרפיה של חלבונים כדי לבודד טובולין מהמוח החזירי להומוגניות גבוהה (איור 1). היתרון העיקרי הוא תפוקה גבוהה יחסית המושגת באמצעות מכשור זמין במעבדות המצוידות לניסויים שגרתיים בביולוגיה מולקולרית.
Protocol
הרכב כל הפתרונות והמכשור מתואר בטבלת החומרים. כל התמיסות הוכנו באמצעות כימיקלים בדרגת FPLC וסוננו דרך מסנן 0.22 מיקרומטר לפני השימוש. ציוד מגן אישי, כגון מעיל מעבדה, כפפות ומשקפי בטיחות, שימשו במהלך כל הפעולות. כל המכשירים היו נקיים וללא עקבות של חומרי ניקוי. במהלך ההליכים ננקטו הנחיות מתאימות לטיפול בבעלי חיים (כפי שאושרו על ידי המוסד). כל החומר הביולוגי, כולל רקמת המוח, נקנה מבית מטבחיים כחומר גלם. בשום שלב של הפרוטוקול לא נעשה שימוש בבעלי חיים חיים.
1. הפעלת עמודת פוספו-צלולוז לכרומטוגרפיה נוזלית חלבונית מהירה
- מוסיפים 700 מ"ל אתנול 50% ל-15 גרם שרף פוספו-צלולוז יבש ומערבבים אותו בעדינות בכוס עם כף.
- יוצקים את המתלה לעמודה כרומטוגרפית מתאימה בעלת נפח מתאים (700 מ"ל). סגור את העמוד עם בוכנות מצויד frits. השאירו לפחות 10% משטח הראש ריק.
הערה: ניתן להשתמש בכלי שיט אחרים, אך עמודת FPLC, בשילוב עם משאבה פריסטלטית, מפחיתה באופן משמעותי את הזמן הדרוש להפעלת שרף והפסדי שרף. - דוגרים על נדנדה-שייקר ב-60 סל"ד למשך 30 דקות.
- תן לשרף לשקוע והסר את עודף של 50% אתנול באמצעות המשאבה הפריסטלטית עם זרימה מוגדרת ל 3 מ"ל / דקה. אין לתת לשרף להתייבש.
- הסר את הבוכנה העליונה והוסף 300 מ"ל של 50% אתנול. סגרו את העמוד, נערו אותו לזמן קצר והוציאו את עודפי האתנול באמצעות משאבה פריסטלטית.
- מוציאים את יתרת האתנול. מוסיפים 300 מ"ל מים טהורים במיוחד לעמודה, סוגרים את העמוד עם הבוכנה ומטים עד שהשרף מרחף מחדש. הסר את עודפי הנוזלים באמצעות משאבה פריסטלטית. חזור על שלב זה שלוש פעמים.
- פתח את העמודה בחלק העליון, הוסף 500 מ"ל של 0.5 M HCl, סגור את העמודה והשהה מחדש את השרף על ידי הטיה עדינה. דוגרים על נדנדה-שייקר ב-60 סל"ד למשך 30 דקות.
- הסר את עודפי הנוזלים באמצעות משאבה פריסטלטית. הוסף 300 מ"ל של 0.5 M HCl, להשעות מחדש את השרף, ולהסיר את הנוזל העודף.
- הסר את ה- HCl שנותר. הוסף 300 מ"ל מים טהורים במיוחד לעמודה, סגור את העמוד עם הבוכנה והטה עד שהשרף ישהה מחדש. הסר את עודפי הנוזלים באמצעות משאבה פריסטלטית. חזור על שלב זה שלוש פעמים.
- שפכו את 700 מ"ל מאגר MES (25 mM MES, 0.1 mM EGTA, 0.5 mM MgCl2) לתוך העמוד והשהו מחדש את השרף על ידי הטיה. יוצקים את המתלים לתוך הכד, מכווננים את ה-pH ל-6.1 עם 1 M NaOH, ומניחים לדגור במשך שעתיים תחת תסיסה עדינה.
- תן לשרף לשקוע, לרוקן את הנוזל, להוסיף 300 מ"ל של מאגר MES, pH 6.4, ולדגור לילה ב 4 ° C.
- דקקו את עודפי הנוזלים, הוסיפו 96% אתנול לריכוז סופי של 20% ואחסנו בטמפרטורה של 4°C עד לשימוש.
2. אריזת עמודת פוספו-צלולוז
- יוצקים 12 מ"ל של שרף פעיל לתוך עמוד כרומטוגרפי נקי עם תקע תחתון סגור. תנו לשרף לשקוע. נפח השרף המיושב הוא כ -5 מ"ל. הסר את השכבה העליונה של השרף (כ 2-3 מ"מ) שבה עשויים לשקוע שברי מטריצה שבורים קלים יותר.
- הסר את התקע התחתון ותן לפתרון האחסון להתרוקן בחופשיות, טיפה אחר טיפה. אין לתת לשרף להתייבש.
- סגור את העמודה וחבר אותה למערכת FPLC. שטפו את העמוד עם חיץ PEM (100 mM PIPES pH 6.9, 1 mM EGTA, 1 mM MgSO4) ב-1 מ"ל/דקה (מקסימום לחץ 1 בר) למשך 30 דקות, התאימו את גובה הבוכנה, הפכו את העמוד ושטפו את העמוד באותם תנאים במשך 30 הדקות הבאות בזרימה הפוכה.
- אחסנו את העמוד המלא בפוספו-צלולוז פעיל בטמפרטורה של 4°C למשך מספר ימים.
3. הפרדת טובולין וטיהור
הערה: טובולין נוטה מאוד להתכלות, וחיוני להמשיך במהירות. את כל הפתרונות, המכשירים והציוד יש להכין, לקרר או לחמם, במידת הצורך, מראש. ההליכים רגישים לשינויים בטמפרטורות המומלצות. רקמת המוח צריכה להיות מעובדת בהקדם האפשרי לאחר נתיחה, בהתחשב בכמות הפסולת הביולוגית המיוצרת במהלך הטיהור. ההליך היה מותאם עבור הרוטור עם שש קוביות אולטרה-צנטריפוגה 75 מ"ל. כמות הרקמה המעובדת ניתן להגדיל או להקטין על פי אולטרה צנטריפוגה זמין.
- הובלת רקמות
- שים 500 גרם של מוח חזירי טרי מנותח (6-8 חתיכות) לתוך כלי הובלה 3 L ויוצקים את חיץ התחבורה קר כקרח (4.1 mM MES pH 7, 320 mM Saccharose, 1 mM EGTA) עד לטבילה מלאה. תן לעמוד על קרח במשך 5 דקות ולשנות את חיץ התחבורה עבור אחד טרי כדי להקל על פיזור חום. הובלה מהירה על קרח לעיבוד נוסף.
- הומוגניזציה של רקמות
הערה: הומוגניזציה של רקמות מתבצעת על קרח בחדר קר. כל המכשירים צריכים להיות prechilled כדי למנוע פילמור ספונטני. המקור העיקרי של טובולין הוא חומר אפור, ואת השאר מוסר בשלבים הבאים.- יוצקים 100 מ"ל של חיץ מיצוי (4.1 mM MES pH 7, 520 mM Saccharose, 1 mM EGTA, 1 mM ATP ו- 0.1 mM GTP) לתוך פלסטיק 1 L ולקבוע את המשקל W1 (g) כולל כלי השיט. ATP ו-GTP מתווספים ממש לפני השימוש.
- הוציאו את המוח החזירי מכלי ההובלה והוציאו את כל המוח הקטן, השומן, גושים גדולים של חומר לבן, קרומי המוח וכלי הדם בעזרת אצבעות על ידי הפעלת כוח צנוע. ניתן להשתמש גם במספריים או בפינצטה. מניחים מוחות חזיריים מפוספסים של רקמה לא רצויה לתוך הכד עם 100 מ"ל של חיץ מיצוי קר. המשך עד שכל הרקמה מעובדת.
- שקלו את הכד עם רקמת מוח מעובדת וקבעו את משקל W2 (g).
- הוסף חיץ מיצוי לפי הנוסחה, משקל מאגר מיצוי = W2 - W1 (למשל, עבור 400 גרם רקמה, 300 גרם של חיץ מיצוי נוסף מתווסף).
- מעבירים את רקמת המוח עם חיץ מיצוי לבלנדר המטבח המצונן מראש ומעבדים ב-4-8 פעימות קצרות של שלוש שניות.
- מעבד את הרקמה הומוגנית חלקית עם הומוגנייזר פיזור במהירות גבוהה (18,000 סל"ד) למשך דקה אחת. משאירים את התרחיף על קרח למשך 3-5 דקות, ומדי פעם מערבבים עם כף. חזור על הפעולה חמש פעמים או עד להומוגניזציה מלאה.
- יוצקים לתוך צינורות אולטרה-צנטריפוגה מקוררים מראש ומסתובבים במשך 10 דקות, בטמפרטורה של 4°C ו-50,000 x גרם. שמור את supernatant ולזרוק את הכדור. חזור על הפעולה עד 430 מ"ל של תמצית מובהרת נאסף.
- יוצקים את התמצית המזוקקת לצינורות אולטרה-צנטריפוגה מוכנים מראש (70 מ"ל כל אחד) ומסתובבים בטמפרטורה של 4°C ו-75,000 x g למשך 60 דקות. לאסוף את supernatant ולקבוע את נפח S1.
הערה: אם קיים רק רוטור אחד, חממו אותו באמבט מים חמים לשלב הצנטריפוגה הבא (37°C).
- פילמור ראשון
- הוסף חיץ MEM 10x (1 M MES pH 6.8, 10 mM EGTA, 10 mM MgCl2) לפי נוסחה V = S1/9 מ"ל (עבור 585 מ"ל של supernatant, הוסף 65 מ"ל של מאגר MEM 10x). מערבבים היטב ומוסיפים גליצרול לריכוז סופי של 3.5 M ו-GTP לריכוז סופי של 0.1 mM. יוצקים את המתלה לתוך צינורות אולטרה-צנטריפוגה (נפח הסופרנאטנט עולה על נפח הצינורות; השאר מושלך לפח).
- לדגור את הצינורות עם supernatant באמבט מים במשך 45 דקות ב 37 ° C.
- סובב את הצינורות במשך 90 דקות ב 37 ° C ו 75,000 x גרם. מדוד את עוצמת הקול של הסופרנאטנט (S2) כדי לקבוע את עוצמת הקול של מאגר MEM, הוסף אותו לכדוריות בשלב 3.3.4 ולאחר מכן השליך את הסופרנאטנט. שמור את הגלולה במקום שבו טובולין פולימרי מכיל.
- הכן נפח 0.5 x S2 של מאגר MEM 1x קר כקרח. הוסף כמות שווה של חיץ MEM 1x לכל צינור אולטרה-צנטריפוגה עם הכדור. השהה מחדש את הכדוריות במאגר MEM 1x שנוסף, העבר מתלים לצילינדר המדורג וקבע את הנפח הכולל.
- הוסף GTP לריכוז סופי של 1 mM. מעבירים את המתלה לתוך הומוגנייזר זכוכית Dounce והופכים את התמיסה להומוגנית כל 10 דקות בערך למשך 45 דקות על קרח. יש להפעיל את הבוכנה בזהירות מכיוון שהיא יכולה להישבר בקלות.
הערה: בינתיים, צננו את הרוטור במים עם קרח.
- הוסף GTP לריכוז סופי של 1 mM. מעבירים את המתלה לתוך הומוגנייזר זכוכית Dounce והופכים את התמיסה להומוגנית כל 10 דקות בערך למשך 45 דקות על קרח. יש להפעיל את הבוכנה בזהירות מכיוון שהיא יכולה להישבר בקלות.
- יוצקים את התמיסה ההומוגנית לתוך צינורות אולטרה-צנטריפוגה מקוררים מראש ומסתובבים ב 75,000 x גרם ו 4 ° C במשך 60 דקות. לאחר הצנטריפוגה, לקבוע את נפח supernatant (S3).
- פילמור שני
- ערבבו את הסופרנאטנט עם 0.35 x S3 מ"ל גליצרול והוסיפו GTP לריכוז סופי של 1 מילימול. יוצקים את supernatant לתוך צינורות ultracentrifugation ולדגור במשך 45 דקות ב 37 ° C.
הערה: בינתיים, לחמם את הרוטור ל 37 °C (77 °F) באמבט המים. - צנטריפוגה את supernatant פולימרי משלב 3.4.1 במשך 60 דקות ב 75,000 x גרם ו 37 ° C. קבע את עוצמת הקול של הסופרנאטנט (S4).
הערה: זוהי נקודת עצירה אופציונלית. הגלולה עם טובולין יכולה להיות קפואה בהלם בחנקן נוזלי ומאוחסנת ב -80 ° C. - הניחו לכדוריות הקפואות להפשיר באיטיות על קרח במשך 30 דקות. הכינו 0.25 x S4 מ"ל של חיץ PIPES (500 mM PIPES pH 6.9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0.1 mM ATP), חלקו באופן שווה לצינורות עם כדורים, השעו מחדש את הכדוריות בכפית והעבירו את התמיסה להומוגנייזר זכוכית Dounce. הומוגניזציה כל 10 דקות על קרח במשך 45 דקות.
הערה: בינתיים, צננו את הרוטור במים עם קרח. - יוצקים את התמיסה עם טובולין נטול פולימריזציה לצינורות אולטרה-צנטריפוגה ומסתובבים במשך 60 דקות ב-4°C וב-75,000 x גרם.
- ערבבו את הסופרנאטנט עם 0.35 x S3 מ"ל גליצרול והוסיפו GTP לריכוז סופי של 1 מילימול. יוצקים את supernatant לתוך צינורות ultracentrifugation ולדגור במשך 45 דקות ב 37 ° C.
- פילמור שלישי
- קבע את נפח הסופרנאטנט (S5) והוסף S5/9 מ"ל של DMSO. יוצקים את המתלה לתוך צינורות אולטרה-צנטריפוגה ודגרים במשך 20 דקות בטמפרטורה של 37°C כדי להתפלמר.
הערה: בינתיים, לחמם את הרוטור ל 30 ° C באמבט המים. - צנטריפוגה את טובולין פולימרי במשך 60 דקות ב 75,000 x גרם ו 30 ° C. לקבוע את נפח supernatant (S6) ולשמור את הכדורים.
- יש להמיס את הכדוריות ב-0.25 x S6 מ"ל של חיץ PEM (100 mM PIPES pH 6.9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0.1 mM ATP). השתמשו בהומוגנייזר זכוכית Dounce כדי לשפר את המסיסות. המשך להוסיף חיץ PEM עד שהכדורים מומסים לחלוטין (כבר לא נראים חלקיקים אטומים).
- קבע את נפח הסופרנאטנט (S5) והוסף S5/9 מ"ל של DMSO. יוצקים את המתלה לתוך צינורות אולטרה-צנטריפוגה ודגרים במשך 20 דקות בטמפרטורה של 37°C כדי להתפלמר.
- טיהור כרומטוגרפיה של החלפת יונים
הערה: כרומטוגרפיית חילופי היונים ההפוכה משמשת להסרת חלבונים הקשורים למיקרוטובולין. טובולין זורם בחופשיות דרך העמוד ב- pH הנתון, וחלבונים מזהמים נשמרים על שרף הפוספו-צלולוז. כל השלבים מבוצעים בטמפרטורות קרובות ל-4 מעלות צלזיוס או על קרח. אין להבהיר את תמצית הטובולין לפני טיהור FPLC, לא על ידי סינון ולא על ידי צנטריפוגה. - איזון FPLC ואת העמודה עם מאגר PEM (100 mM צינורות pH 6.9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0.1 mM ATP). השתמש באמצעי אחסון של 10 עמודות לפחות לצורך איזון. זרימת המשאבה לא תעלה על הזרימה המשמשת לאריזת עמודים (1 מ"ל/דקה).
- העמיסו את תרחיף הטובולין באיטיות (0.5 מ"ל/דקה) על העמוד ואספו את החלבון הלא קשור הזורם דרך השרף.
- הוסף 10 μL של 100 mM GTP לכל חלק 1 מ"ל המכיל את חלבון טובולין.
- להקפיא שברים המכילים טובולין בחנקן נוזלי ומיד להעביר אותם לתוך המיכל עם חנקן נוזלי. טובולין ניתן לאחסן במשך מספר שנים בתנאים אלה. היציבות יורדת במהירות במשך מספר חודשים אם טובולין מאוחסן ב - 80 מעלות צלזיוס.
Representative Results
במהלך שלבי ההפרדה והטיהור נלקחו דגימות עבור אלקטרופורזה SDS-PAGE ולאחר מכן נותחו באמצעות צביעה כחולה קומאסית (איור 2). 20 μL מכל דגימה עורבבו עם 10 μL של חיץ דגימת Laemmli (188 mM Tris-HCl pH 6.8, 3% SDS (w/w), 30% גליצרול (v/v), 0.01 ברומופנול כחול (w/w), 15% β-מרקפטואתנול) והודגרו ב-95°C למשך 15 דקות. 4 μL מכל דגימה הועמסו על 12.5% ג'ל SDS אקרילאמיד והופרדו תחת זרם קבוע של 30 mA לג'ל בתנאי הפחתה ודנטורציה.
התוצאות אישרו עלייה הדרגתית בריכוז הטובולין היחסי המלווה בירידה בחלבונים מזהמים. יתר על כן, לא היה אובדן משמעותי של טובולין בליזט מזוקק בצנטריפוגה הראשונה (שלב 3.2.7) בהשוואה להשמטת שלב זה (איור 2A,B).
ריכוז החלבון נקבע באמצעות שלוש שיטות עצמאיות: בדיקת BCA, בדיקת חלבון ברדפורד וניתוח דנסיטומטריה בג'ל SDS-PAGE19 (איור 3). התשואה הכוללת של טובולין באמצעות ההליך המתואר הייתה 123 מ"ג של טובולין מטוהר מ 250 גרם של רקמה עצבית. במהלך המדידות יש לקחת בחשבון שלריכוז ה-DTT הגבוה במאגר האחסון יש השפעה משמעותית על בדיקת BCA. הן מאגר PEM והן מאגר PBS, בתוספת DTT, מגדילים את ספיגת הרקע בכ- 0.900 A595, מה שמקטין באופן משמעותי את קיבולת בדיקת BCA (איור 3A). ההשפעה השלילית של DTT ניתנת לזיהוי גם לאחר דילול פי עשרה עם מים טהורים (הנתונים אינם מוצגים). נראה כי בדיקת ברדפורד לא הושפעה ממאגר האחסון (איור 3B), כפי שאושר על-ידי ניתוח צפיפות.
טוהר הכנת טובולין אומת על ידי ניתוח ספקטרומטריית מסות בשני מתקנים עצמאיים (VRI Brno, צ'כיה; CEITEC MU Brno, צ'כיה) באמצעות יינון אלקטרוספריי ו- MALDI-TOF. שני הניתוחים אישרו את נוכחותם של טובולינים חזיריים אלפא ובטא במספר איזופורמים. הטוהר הכללי היה יותר מ-97.07% (PSMs 1065), כאשר הזיהומים הנפוצים ביותר מקורם בהומו ספיינס קרטין סוג II (PSMs 246, 2.24% מהזיהומים) אשר הוכנסו ככל הנראה במהלך בידוד טובולין והכנת הדגימה לניתוח MS/MS. זיהומים אחרים המורכבים מ-322 PSMs ורק אלבומין בסרום, גמא אקטין וטריפסינוגן שמקורם ב-Sus scrofa זוהו ברזולוציה פפטידית אחת (0.0069%).
בניסויים הבאים אומת שימור יכולת הפילמור לאחר הקפאת בזק ואחסון בחנקן נוזלי. האליקוט 10 מ"ג/מ"ל הוסר מחנקן נוזלי והופשר לאט על קרח. דגימות בריכוזים שונים (10 מ"ג/מ"ל, 8 מ"ג/מ"ל, 6 מ"ג/מ"ל, 4 מ"ג/מ"ל ו-2 מ"ג/מ"ל) הוכנו על ידי דילול האליציטוטים במאגר PEM המכיל DTT, ATP ו-GTP לצורך ניסוי ההרכבה העצמית. סדרת דילול אחת הודגרה בטמפרטורה של 37 מעלות צלזיוס במשך 60 דקות, והשנייה הודגרה על קרח במשך 60 דקות. שתי הסדרות היו צנטריפוגות במשך 60 דקות בטמפרטורה של 21,000 x גרם ובטמפרטורה המתאימה (4°C או 37°C). 30 μL של supernatant הוסר ושימש עבור SDS-PAGE. הסופרנאטנט שנותר הוסר בזהירות באמצעות פיפטה והושלך לפח. הכדוריות נשטפו לזמן קצר על ידי הוספת 100 מיקרומטר של חיץ PEM, ולאחר מכן הסרה מיידית באמצעות פיפטה. לאחר מכן, הכדורים הושעו מחדש ב-50 מיקרוליטר של חיץ העמסת SDS מרוכז פי 1, כך שהריכוז היחסי של הגלולה והסופרנאטנט נשמר. 10 μL של חיץ העמסת SDS נוסף לכל סופרנטנט. כל הדגימות נותחו באמצעות SDS-PAGE וצביעת קומאסי (איור 4). נפח כל דגימה שנטענה ל- SDS-PAGE הותאם בהתאם לריכוז ההתחלתי, ולכן ההבדל במשקעים עקב הריכוז בולט יותר. בדיקת ההרכבה העצמית של טובולין במאגר PEM אישרה את היכולת ליצור סיבי טובולין באופן תלוי טמפרטורה.
בדיקת ההרכבה של טובולין20,21 המונעת על ידי MAP2c המאמתת את יכולתו של טובולין לתקשר עם חלבונים אחרים בוצעה22. הדילולים הסדרתיים של MAP2c הוכנו כאשר 100 μL של 1 מ"ג / מ"ל טובולין aliquots עורבבו עם MAP2c לריכוז הסופי שנע בין 0 μM ל 8 μM. כל הדגימות הוכנו על קרח על ידי דילול במאגר PEM טרי שהוכן עם 1 mM DTT ו- 1 mM GTP. הטובולין הודגר במשך 15 דקות בטמפרטורה של 37°C עם ריכוזים שונים של MAP2c, וצנטריפוגה במשך 60 דקות בטמפרטורה של 21,000 x גרם ו-37°C. השטיפה הסופית של הגלולה בוצעה פעמיים עם 100 μL של חיץ PEM. הניסוי אישר את יכולתו של הטובולין המוכן לעבור פילמור מונחה MAP2c, מאחר שרק הדגימה ללא MAP2c לא יצרה גלולה (איור 5).
מיקרוסקופ אלקטרונים תמסורת שימש גם כדי לאשר את נוכחותם של חוטי טובולין מניסויי פילמור משותף. תרחיפים של טובולין מטוהר עם MAP2c הוכנו למיקרוסקופ אלקטרונים שידור באמצעות צביעה שלילית. הדגימות נספגו על רשתות נחושת מצופות פורמבר ומיוצבות פחמן. לאחר מכן הוכתמו הרשתות באופן שלילי עם 2% NH4MoO4 ונבדקו תחת מיקרוסקופ אלקטרונים בהגדלה של פי 18,000 ובמתח מואץ של 80 קילו וולט. נוכחותם של מיקרוטובולים הומוגניים בעלי מבנה נימה ברור וגודל מתאים הראתה את היכולת ליצור מיקרוטובולים בקונפורמציה טבעית (איור 6).
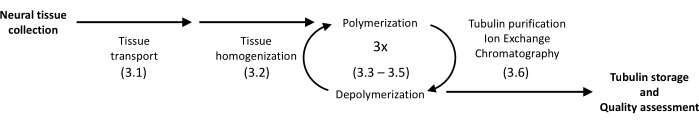
איור 1: תרשים סכמטי של הפרדה וטיהור טובולין. המספר בסוגריים מתייחס לשלב הפרוטוקול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
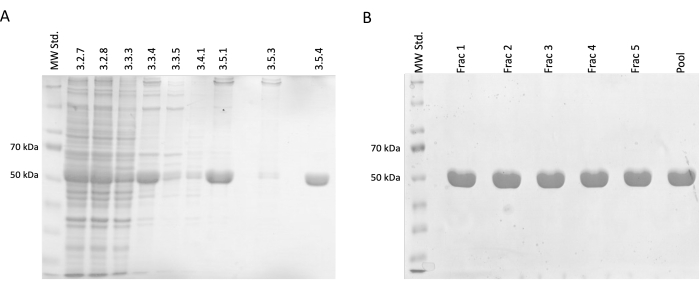
איור 2: הפרדה וטיהור טובולין. (A) ניתוח SDS-PAGE של דגימות שנלקחו במהלך הפרדת טובולין תוך שימוש בפילמור מונחה טמפרטורה (3 מיקרוליטר לשורה). ניתן לראות את הירידה בזיהומים עם עלייה יציבה בשפע טובולין יחסי (כ -50 kDa). המספרים מעל כל שורה תואמים למספר השלב בפרוטוקול. (B) ניתוח SDS-PAGE של שברים המתקבלים לאחר כרומטוגרפיה של חלבון על שרף פוספו-צלולוז (4 מיקרוליטר לשורה). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
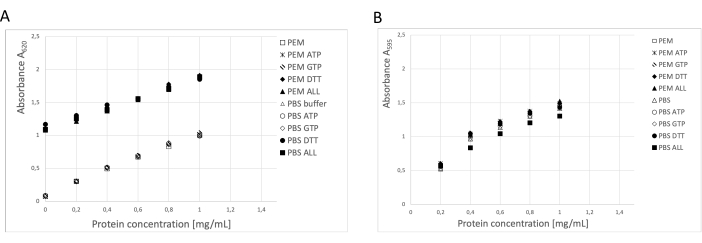
איור 3: ריכוז חלבונים. סדרת הדילול של אלבומין בסרום בקר של עד 1 מ"ג/מ"ל במאגר PEM או PBS הושוותה לסדרת דילול BSA המכילה 0.1 ATP, 1 mM GTP, 1 mM DTT בנפרד או בשילוב (0.1 mM ATP, 1 mM GTP ו-1 mM DTT) במאגר PEM או PBS. (A) כאשר נעשה שימוש בבדיקת BCA, חל שינוי משמעותי ברקע של דגימות המכילות DTT (סמלים מוצקים). (B) השפעה זו לא זוהתה כאשר נמדדו ריכוזים בבדיקת ברדפורד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
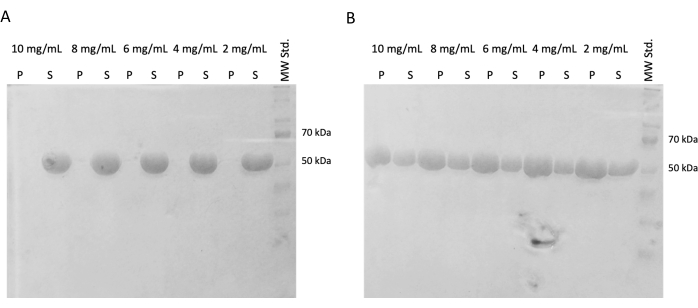
איור 4: בדיקת הרכבה עצמית של טובולין. ניתוח SDS-PAGE של בדיקת ההרכבה העצמית אישר את היכולת של טובולין מאוחסן מודגר ב (A) 4 ° C או (B) 37 ° C כדי להתפלמר באופן תלוי טמפרטורה בספקטרום רחב של ריכוזים. (P - כדור, S - סופרנטנט; ריכוז הטובולין בהתאמה מסומן מעל כל זוג שורות; כמות כל דגימה שהוטענה הייתה 10 מיקרוגרם). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
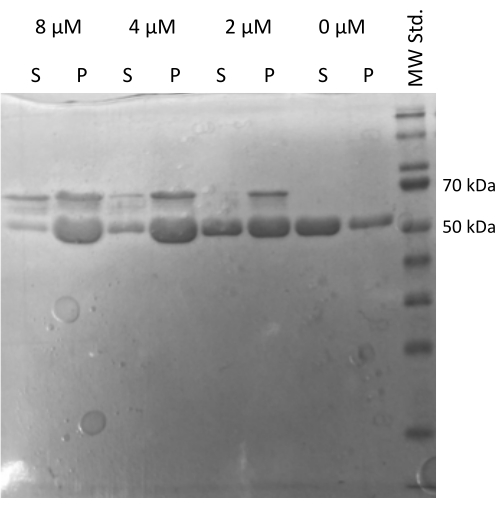
איור 5: בדיקת שיקוע משותף של טובולין. ניתוח SDS-PAGE של הרכבת טובולין בסיוע MAP2c אישר את היכולת של טובולין מאוחסן לעבור פילמור המונע על ידי אינטראקציה עם חלבון הקשור למיקרוטובולים באופן תלוי ריכוז. הריכוז המולרי של MAP2c מצוין מעל כל שורה. (P - גלולה, S - supernatant). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
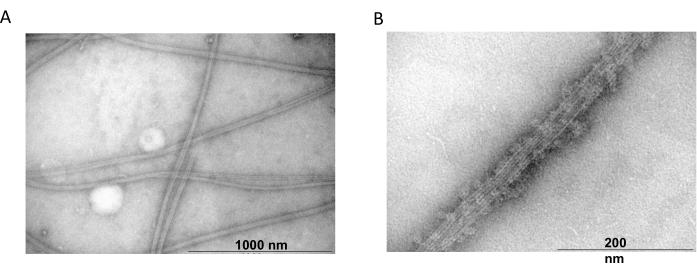
איור 6: מיקרוסקופ אלקטרונים תמסורת. המיקרו-תצלומים של TEM הראו כי טובולין מתכנס (A) למיקרוטובולים בקוטר מתאים (B) המורכבים מחוטי טובולין הומוגניים המעוטרים בחלבוני MAP2c. הסרגל מתאים ל- 1000 ננומטר (A) ו- 200 ננומטר (B). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
הרקמה העצבית מכל מקור שהיא היא חומר מצוין לבידוד טובולין, שכן הדנדריטים והאקסונים של תאי העצב עשירים במיקרוטובולים (עד 40%)23. רקמת מוח ניתן להשיג בקלות יחסית בכמויות מספיקות. החיסרון העיקרי עשוי להיות רמה לא מוגדרת של שינויים לאחר תרגום, אשר יכול להשפיע על ניסויים הבאים24,25. אחרת, הדאגה היחידה היא השפלה מהירה של חומר מוצא, במיוחד בתנאים חמים. השתמשנו במספר בורסות חיץ העברה כדי לשפר את פיזור החום לפני ההובלה והובלה מהירה לעיבוד, שמתחיל בהקדם האפשרי. הרקמה הטרייה מנותחת בתנאים המונעים חימום והומוגנית בחיץ המכיל GTP וגליצרול, המייצב עוד יותר את טובולין26.
בפרוטוקול המוצג, שלב ההבהרה (שלב 3.2.7) של הליזט הגולמי הוצג. צנטריפוגה ממושכת לפני הפילמור הראשון אינה מומלצת בדרך כלל בשל רגישות טובולין לשינויים בלתי הפיכים ופרוטאזות. מצד שני, הניסויים הנוכחיים הראו כי סיבוב קצר בכוח G גבוה מפחית את הפסולת ובכך מגדיל את הנפח היחסי של ההומוגנט המעובד מבלי להשפיע באופן משמעותי על איכות הטובולין.
קביעת ריכוז החלבונים המדויקת חיונית לניסויים נוספים, בעיקר כאשר נחקרות אינטראקציות עם חלבונים או מעכבי טובולין. במהלך החקירות נתקלנו בהבדלים משמעותיים בתוצאות בדיקות ריכוז החלבון. הסיבה העיקרית הייתה נוכחותם של DTT, GTP ו-ATP בריכוזים גבוהים שהפריעו למבחנים. בדיקת BCA הועברה לגבולות העליונים עקב הכמות הגבוהה של DTT במאגר האחסון, מה שהפחית את קיבולת הבדיקה. יתר על כן, מקסימום הספיגה הדומה של חלבונים ו- ATP או GTP גרם לחוסר עקביות בקביעת ריכוז החלבונים באמצעות ספיגה של 280 ננומטר. אותה בעיה הורגשה בקריאות מגלאי ה- UV FPLC. הבדיקה האמינה ביותר, עם תוצאות יציבות, הייתה בדיקת חלבון ברדפורד, שם לא נצפתה השפעה של תרכובות חיץ. עם זאת, חיוני להכין את סדרת הדילול הסטנדרטית של החלבון במאגר האחסון.
היכולת של טובולין מטוהר ליצור סידורים מתאימים היא תנאי מוקדם לניסויים הבאים. טובולין, מטבעו, נוטה מאוד להתכלות אפילו בסביבה עשירה בגליצרול-GTP, וכתוצאה מכך יכולת מופחתת ליצור חוטים הומוגניים. זה קריטי לעקוב אחר תהליך הטיהור ולאמת באופן ניסיוני את היכולת של טובולין מאוחסן להתפלמר לתוך חוטים קבועים יציבים. מספר שיטות עצמאיות המאמתות את מצב טובולין הוכנסו in vivo ו- in vitro. בין הבולטים שבהם, ספקטרוסקופיית הדיכרואיזם המעגלי27, בדיקת תהודה פלסמונית פני השטח28, בדיקת שינוי תרמי29, בדיקת עיכוב פילמור30, צביעת אימונופלואורסנציה31,32, משקעים22,33 וניתוח מיקרוסקופ אלקטרונים תמסורת32 ניתן להזכיר. בדיקת פילמור ומשקעים משותפים של טובולין המשמשים בפרוטוקול זה קלים לביצוע. ניתן להעריך אותם במהירות על ידי הכדוריות המתרחשות בתחתית הצינור או באמצעות SDS-PAGE. מצד שני, טובולין מושקע יכול להיות בצורה של אגרגטים. יש לכלול שיטות מתוחכמות יותר, כגון מיקרוסקופ אלקטרונים תמסורת, כדי לאשר את נוכחותם של סיבי מיקרוטובול לבקרת איכות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחקר נתמך על ידי הסוכנות הטכנולוגית של הרפובליקה הצ'כית (פרויקט nr. TN02000017 - המרכז הלאומי לביוטכנולוגיה ברפואה וטרינרית - NaCeBiVet).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | --- | --- | Common material |
| 10 mL tubes | --- | --- | Common material |
| 50 mL tubes | --- | --- | Common material |
| ATP | ROTH | HN35.2 | Analytical grade |
| DMSO | ROTH | A994.2 | Analytical grade |
| Dounce glass homogenizer | P-LAB | H244043 | Homogenizer |
| DTT | ROTH | 6908.1 | Analytical grade |
| EGTA | ROTH | 3054.3 | Analytical grade |
| Ethanol | PENTA | 70390-11001 | Analytical grade |
| Glycerol | ROTH | 6967.2 | Analytical grade |
| Graduated beakers | --- | --- | Common equipment |
| Graduated cilinders | --- | --- | Common equipment |
| GTP | MERCK | 36051-31-7 | Very high quality |
| HCl | PENTA | 19360-11000 | Analytical grade |
| Izolated box for tissue transport | --- | --- | Common equipment |
| Kitchen blender | Waring | 7011HB | Glass or plastic vessel |
| Liquid nitrogen | --- | --- | Common material |
| MES | ROTH | 6066.4 | Analytical grade |
| MgCl2 | MERCK | 814733 | Analytical grade |
| MgSO4 | PENTA | 43180-31000 | Analytical grade |
| NaOH | PENTA | 15650-11000 | Analytical grade |
| Optima XPN100 | Beckman Coulter | A94469 | Ultracentrifuge |
| Phosphocellulose column | VWR | GENO786-1291 | Empty column |
| Phosphocellulose resin | Creative - Biomart, inc | Phosphate-001C | Ion exchange resin |
| PIPES | ROTH | 9156.2 | Analytical grade |
| Saccharose | PENTA | 24970-31000 | Analytical grade |
| Scales | --- | --- | Common equipment |
| Scissors | --- | --- | Common equipment |
| Spoons | --- | --- | Plastic or glass |
| Ti45 rotor | Beckman Coulter | 339160 | Rotor for Ultracentrifuge |
| Tweezers | --- | --- | Common equipment |
| Ultra turrax IKA T18 basic | IKA | 356 1000 | Laboratory dispenser |
| Water bath 37 °C | --- | --- | Stirred |
References
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Murphy, D. B., Hiebsch, R. R. Purification of microtubule protein from beef brain and comparison of the assembly requirements for neuronal microtubules isolated from beef and hog. Anal Biochem. 96 (1), 225-235 (1979).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann NY Acad Sci. 253, 107-132 (1975).
- Weisenberg, R. C. Microtubule formation in vitro in solutions containing low calcium concentrations. Science. 177 (4054), 1104-1105 (1972).
- Roychowdhury, S., Gaskin, F. Separation of assembly-competent tubulin from brain microtubule protein preparations using a fast-performance liquid chromatography procedure. J Neurochem. 46 (5), 1399-1405 (1986).
- Weingarten, M. D., Suter, M. M., Littman, D. R., Kirschner, M. W. Properties of the depolymerization products of microtubules from mammalian brain. Biochemistry. 13 (27), 5529-5537 (1974).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nat Protoc. 14 (5), 1634-1660 (2019).
- Jacobs, M., Huitorel, P. Tubulin-associated nucleoside diphosphokinase. Eur J Biochem. 99 (3), 613-622 (1979).
- Munguía, B., et al. Purification of native M. vogae and H. contortus tubulin by TOG affinity chromatography. Exp Parasitol. 182, 37-44 (2017).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein ExpPurif. 32 (1), 83-88 (2003).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Lett. 587 (21), 3450-3455 (2013).
- Liu, C., Yao, J., Yin, J., Xue, J., Zhang, H. Recombinant α- and β-tubulin from Echinococcus granulosus: Expression, purification and polymerization. Parasite. 25, 62 (2018).
- Ti, S. -. C., Wieczorek, M., Kapoor, T. M. Purification of affinity tag-free recombinant tubulin from insect cells. STAR protoc. 1 (1), 100011 (2020).
- Bodakuntla, S., Jijumon, A. S., Janke, C., Magiera, M. M. Purification of tubulin with controlled post-translational modifications and isotypes from limited sources by polymerization-depolymerization cycles. JVisExp. (165), e61826 (2020).
- Sackett, D. L., Werbovetz, K. A., Morrissette, N. S. Isolating tubulin from nonneural sources. Methods Cell Biol. 95, 17-32 (2010).
- Modig, C., Strömberg, E., Wallin, M. Different stability of posttranslationally modified brain microtubules isolated from cold-temperate fish. Mol Cell Biochem. 130 (2), 137-147 (1994).
- Fourest-Lieuvin, A. Purification of tubulin from limited volumes of cultured cells. Protein Exp Purif. 45 (1), 183-190 (2006).
- MacRae, T. H., Gull, K. Purification and assembly in vitro of tubulin from Trypanosoma brucei. Biochem J. 265 (1), 87-93 (1990).
- Jansen, S., et al. Quantitative mapping of microtubule-associated protein 2c (MAP2c) phosphorylation and regulatory protein 14-3-3ζ-binding sites reveals key differences between MAP2c and its homolog Tau. JBiol Chem. 292 (24), 3-3 (2017).
- Melková, K., et al. Structure and functions of microtubule associated proteins Tau and MAP2c: Similarities and differences. Biomolecules. 9 (3), E105 (2019).
- Herzog, W., Weber, K. Fractionation of brain microtubule-associated proteins: Isolation of two different proteins which stimulate tubulin polymerization in vitro. Eur J Biochem. 92 (1), 1-8 (1978).
- Castle, A. G., Crawford, N. Isolation of tubulin from pig platelets. FEBS Lett. 51 (1), 195-200 (1975).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. Int J Mol Sci. 18 (10), E2207 (2017).
- Lafanechère, L., Job, D. The third tubulin pool. Neurochem Res. 25 (1), 11-18 (2000).
- Arai, T., Ihara, Y., Arai, K., Kaziro, Y. Purification of tubulin from bovine brain and its interaction with guanine nucleotides. J Biochem. 77 (3), 647-658 (1975).
- Mahaddalkar, T., et al. Structural investigations into the binding mode of a novel noscapine analogue, 9-(4-vinylphenyl) noscapine, with tubulin by biochemical analyses and molecular dynamic simulations. J Biomol Struct Dyn. 35 (11), 2475-2484 (2017).
- Chen, H., et al. Structure-activity relationship study of novel 6-Aryl-2-benzoyl-pyridines as tubulin polymerization inhibitors with potent antiproliferative properties. J Med Chem. 63 (2), 827-846 (2020).
- Yao, D., et al. Ferulin C triggers potent PAK1 and p21-mediated anti-tumor effects in breast cancer by inhibiting Tubulin polymerization in vitro and in vivo. Pharmacol Res. 152, 104605 (2020).
- Sweetnam, P. M., et al. The role of receptor binding in drug discovery. JNat Prod. 56 (4), 441-455 (1993).
- Qi, Z. -. Y., et al. Synthesis and biological evaluation of 1-(benzofuran-3-yl)-4-(3,4,5-trimethoxyphenyl)-1H-1,2,3-triazole derivatives as tubulin polymerization inhibitors. Bioorg Chem. 94, 103392 (2020).
- Sáez-Calvo, G., et al. Triazolopyrimidines are microtubule-stabilizing agents that bind the vinca inhibitor site of tubulin. Cell Chem Bio. 24 (6), 737-750 (2017).
- Bellocq, C., et al. Purification of assembly-competent tubulin from Saccharomyces cerevisiae. EurJ Biochem. 210 (1), 343-349 (1992).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved