Otimizando o rendimento da tubulina do tecido cerebral suíno
In This Article
Summary
Este protocolo descreve uma técnica para o isolamento de alto rendimento da tubulina do cérebro suíno otimizada para instrumentação em pequena escala. Os procedimentos de isolamento são complementados por procedimentos para determinação da atividade de polimerização da tubulina in vitro usando ensaios de co-sedimentação e microscopia eletrônica de transmissão.
Abstract
O tecido neural de qualquer fonte é um excelente material para o isolamento da tubulina, pois os dendritos e axônios dos neurônios são ricos em microtúbulos. Aqui, apresentamos um procedimento para extração de tubulina que pode ser empregado, com pequenas modificações, para tecido neural de múltiplas fontes. No protocolo apresentado, foi introduzida uma nova etapa de clarificação do lisado bruto, o que levou a uma redução significativa na quantidade inicial de detritos insolúveis antes da primeira etapa de polimerização. Essa etapa adicional permitiu o processamento de tecido adicional usando a mesma instrumentação e, assim, aumentando o volume relativo do homogeneizado processado. A etapa recém-introduzida não tem efeito significativo na qualidade da tubulina purificada, conforme confirmado por ensaios de atividade in vitro e microscopia eletrônica de transmissão. O procedimento descrito contém todas as etapas cruciais, incluindo coleta de tecido, transporte, homogeneização de tecidos, ciclos de isolamento de tubulina e polimento final por cromatografia de troca iônica usando FPLC e ensaios de medição de atividade subsequentes. A homogeneidade da tubulina purificada foi superior a 97%, conforme confirmado pela análise MS/MS utilizando ionização por eletrospray e MALDI-TOF.
Introduction
Os microtúbulos, filamentos de proteínas ocas (24 nm de diâmetro) formados por heterodímeros de alfa e beta-tubulina, estão envolvidos em vários processos celulares essenciais. Eles participam da formação de estruturas intracelulares, motilidade, divisão celular, diferenciação celular, transporte celular, manutenção da forma e secreção1. As funções celulares dos microtúbulos podem ser afetadas por interações diretas ou indiretas com proteínas associadas a microtúbulos (MAPs) e outras proteínas ou por meio de modificações pós-traducionais complexas definidas no código de tubulina2.
As fibras de tubulina surgem de interações dinâmicas não covalentes entre subunidades alfa e beta no mecanismo de nucleação-alongamento. Microtúbulos curtos são formados, e o crescimento subsequente das fibras da tubulina é obtido por alongamento reversível em ambas as extremidades, formando cilindros constituídos por heterodímeros de tubulina dispostos em protofilamentos paralelos2. A instabilidade dinâmica refere-se ao fato de que os microtúbulos montados muitas vezes não estão em equilíbrio com suas subunidades, mas podem sofrer transição de fase entre um período prolongado de crescimento e encolhimento, mantendo um estado estacionário 1,2.
A instabilidade dinâmica das fibras de tubulina é utilizada principalmente em muitos procedimentos de separação e purificação de tubulina usando ciclos de polimerização em alta temperatura e despolimerização em baixa temperatura no ambiente de glicerol de alta pureza, DMSO, GTP / ATP, Mg2+ ou outros agentes químicos (como taxol ou policatiões) 3. A maioria dos procedimentos de separação4 é seguida por cromatografia proteica 5,6,7,8,9, que garante a separação de proteínas associadas à tubulina com atividade de nucleosídeo difosfoquinase e ATPase5. Resultados semelhantes podem ser obtidos utilizando tampões com alto teor de sal10. Múltiplas fontes, incluindo tecidos neurais 11,12,13,14 e não neurais15, peixes16 (de água doce e marinha), leveduras ou variantes recombinantes 17 superexpressas em diferentes cepas de produção 11,12,13,14 e outras fontes 9,18 foram usadas para fracionamento e purificação.
O protocolo apresentado utiliza precipitação e cromatografia de proteínas para isolar a tubulina do cérebro suíno em alta homogeneidade (Figura 1). A principal vantagem é um rendimento relativamente alto alcançado com instrumentação disponível em laboratórios equipados para experimentos de biologia molecular de rotina.
Protocol
A composição de todas as soluções e instrumentação é descrita na Tabela de Materiais. Todas as soluções foram preparadas usando produtos químicos de grau FPLC e filtradas através de um filtro de 0,22 μm antes do uso. Equipamentos de proteção individual, por exemplo, jaleco, luvas e óculos de segurança, foram usados durante todas as operações. Todos os instrumentos estavam limpos e livres de vestígios de detergentes. Durante os procedimentos, foram seguidas as diretrizes adequadas de cuidados com os animais (aprovadas pela instituição). Todo o material biológico, incluindo tecido cerebral, foi comprado de um matadouro como matéria-prima. Nenhum animal vivo foi utilizado em nenhuma etapa do protocolo.
1. Ativação de uma coluna de fosfocelulose para cromatografia líquida rápida de proteínas
- Adicionar 700 ml de etanol a 50% a 15 g de resina fosfocelulósica seca e misturar delicadamente no copo com uma colher.
- Despejar a suspensão em uma coluna cromatográfica adequada de volume apropriado (700 mL). Feche a coluna com pistões equipados com fritas. Deixe pelo menos 10% de espaço vazio.
NOTA: Outros vasos podem ser usados, mas a coluna FPLC, em combinação com uma bomba peristáltica, reduz significativamente o tempo necessário para a ativação da resina e as perdas de resina. - Incubar em um agitador a 60 rpm por 30 min.
- Deixe a resina assentar e remova o excesso de etanol a 50% usando a bomba peristáltica com o fluxo ajustado para 3 mL/min. Não deixe a resina secar.
- Remova o pistão superior e adicione 300 mL de etanol a 50%. Feche a coluna, agite-a brevemente e remova o excesso de etanol por meio de uma bomba peristáltica.
- Remova o etanol restante. Adicione 300 mL de água ultrapura na coluna, feche a coluna com o pistão e incline até que a resina seja ressuspensa. Remova o excesso de líquido usando uma bomba peristáltica. Repita esta etapa três vezes.
- Abra a coluna na parte superior, adicione 500 mL de HCl 0,5 M, feche a coluna e ressuspenda a resina inclinando-se suavemente. Incubar em um agitador a 60 rpm por 30 min.
- Remova o excesso de líquido usando uma bomba peristáltica. Adicione 300 mL de HCl 0,5 M, ressuspenda a resina e remova o excesso de líquido.
- Adicione 300 mL de água ultrapura na coluna, feche a coluna com o pistão e incline até que a resina ressuspenda novamente. Remova o excesso de líquido usando uma bomba peristáltica. Repita esta etapa três vezes.
- Despeje os 700 mL de tampão MES (25 mM MES, 0,1 mM EGTA, 0,5 mM MgCl2) na coluna e ressuspenda a resina inclinando. Despeje a suspensão no béquer, ajuste o pH para 6,1 com NaOH 1 M e deixe incubar por 2 h sob agitação suave.
- Deixe a resina assentar, decantar o líquido, adicionar 300 ml de tampão MES, pH 6,4, e incubar durante a noite a 4 °C.
- Transvase o excesso de líquido, adicione etanol a 96% até à concentração final de 20% e conserve a 4 °C até à utilização.
2. Embalagem da coluna da Fosfo-celulose
- Despeje 12 mL de resina ativada na coluna cromatográfica limpa com um tampão de fundo fechado. Deixe a resina assentar. O volume de resina sedimentada é de cerca de 5 mL. Remova a camada superior de resina (aproximadamente 2-3 mm) onde fragmentos de matriz quebrados mais leves possam se depositar.
- Remova o bujão inferior e deixe a solução de armazenamento escorrer livremente, gota a gota. Não deixe a resina secar.
- Feche a coluna e conecte-a ao sistema FPLC. Lave a coluna com tampão PEM (100 mM PIPES pH 6.9, 1 mM EGTA, 1 mM MgSO4) a 1 mL/min (pressão máxima 1 bar) por 30 min, ajuste a altura do pistão, vire a coluna de cabeça para baixo e lave a coluna nas mesmas condições pelos próximos 30 min no fluxo reverso.
- Conservar a coluna cheia de fosfocelulose activada a 4 °C durante vários dias.
3. Separação e purificação da tubulina
NOTA: A tubulina é altamente propensa à degradação e é crucial proceder rapidamente. Todas as soluções, instrumentos e equipamentos devem ser preparados, resfriados ou aquecidos, se necessário, com antecedência. Os procedimentos são sensíveis a mudanças nas temperaturas recomendadas. O tecido cerebral deve ser processado o mais rápido possível após a dissecção, considerando a quantidade de resíduos biológicos produzidos durante a purificação. O procedimento foi otimizado para o rotor com seis cubetas de ultracentrifugação de 75 mL. A quantidade de tecido processado pode ser aumentada ou diminuída de acordo com a ultracentrífuga disponível.
- Transporte de tecidos
- Coloque 500 g de cérebros suínos recém-dissecados (6-8 peças) em um recipiente de transporte de 3 L e despeje o tampão de transporte gelado (4,1 mM MES pH 7, 320 mM de sacarose, 1 mM EGTA) até ficar totalmente imerso. Deixe repousar no gelo por 5 min e troque o buffer de transporte por um novo para facilitar a dissipação de calor. Transporte rapidamente no gelo para processamento posterior.
- Homogeneização de tecidos
NOTA: A homogeneização do tecido é realizada no gelo em uma câmara fria. Todos os instrumentos devem ser pré-resfriados para evitar a polimerização espontânea. A fonte primária de tubulina é a substância cinzenta, e o restante é removido nas etapas a seguir.- Despeje 100 mL de tampão de extração (4.1 mM MES pH 7, 520 mM de sacarose, 1 mM EGTA, 1 mM ATP e 0.1 mM GTP) em um copo de plástico de 1 L e determine o peso W1 (g) incluindo o recipiente. ATP e GTP são adicionados imediatamente antes do uso.
- Retire o cérebro suíno do vaso de transporte e remova todo o cerebelo, gordura, grandes pedaços de substância branca, meninges e vasos sanguíneos com os dedos, aplicando força modesta. Tesouras ou pinças também podem ser usadas. Coloque os cérebros suínos despojados de tecido indesejado no copo com 100 mL de tampão de extração frio. Prossiga até que todo o tecido seja processado.
- Pesar o copo com tecido cerebral processado e determinar o peso W2 (g).
- Adicione o tampão de extração de acordo com a fórmula, peso do tampão de extração = W2 - W1 (por exemplo, para 400 g de tecido, 300 g de tampão de extração adicional são adicionados).
- Transfira o tecido cerebral com tampão de extração para o liquidificador de cozinha pré-resfriado e processe em 4-8 pulsos curtos de três segundos.
- Processe o tecido parcialmente homogeneizado com um homogeneizador de dispersão de alta velocidade (18.000 rpm) por 1 min. Deixe a suspensão no gelo por 3-5 min, misturando ocasionalmente com uma colher. Repita cinco vezes ou até a homogeneização completa.
- Despeje em tubos de ultracentrifugação pré-resfriados e gire por 10 min, a 4 ° C e 50.000 x g. Guarde o sobrenadante e descarte o pellet. Repita até que 430 mL de extrato clarificado sejam coletados.
- Despeje o extrato clarificado em tubos de ultracentrifugação pré-resfriados (70 mL cada) e gire a 4 ° C e 75.000 x g por 60 min. Recolher o sobrenadante e determinar o volume S1.
NOTA: Se houver apenas um rotor, aqueça-o em banho-maria morna para a próxima etapa de centrifugação (37 °C).
- Primeira polimerização
- Adicione 10x tampão MEM (1 M MES pH 6,8, 10 mM EGTA, 10 mM MgCl2) de acordo com a fórmula V = S1/9 mL (para 585 mL de sobrenadante, adicione 65 mL de 10x tampão MEC). Misture bem e adicione glicerol a 3,5 M e GTP à concentração final de 0,1 mM. Despeje a suspensão em tubos de ultracentrifugação (o volume do sobrenadante excede o volume dos tubos; o restante é descartado).
- Incubar os tubos com o sobrenadante em banho-maria durante 45 min a 37 °C.
- Gire os tubos por 90 min a 37 °C e 75.000 x g. Meça o volume do sobrenadante (S2) para determinar o volume do tampão MEM, adicione-o aos pellets na etapa 3.3.4 e, em seguida, descarte o sobrenadante. Mantenha o pellet onde a tubulina polimerizada está contida.
- Prepare 0,5 x S2 volume de 1x tampão MEM gelado. Adicione uma quantidade igual de 1x tampão MEM em cada tubo de ultracentrífuga com o pellet. Ressuspenda os pellets no buffer 1x MEM adicionado, transfira as suspensões para o cilindro graduado e determine o volume total.
- Adicionar GTP à concentração final de 1 mM. Transfira a suspensão para um homogeneizador de vidro Dounce e homogeneize a solução a cada 10 minutos ou mais por 45 minutos no gelo. O pistão precisa ser operado com cuidado, pois pode quebrar facilmente.
NOTA: Enquanto isso, resfrie o rotor em água com gelo.
- Adicionar GTP à concentração final de 1 mM. Transfira a suspensão para um homogeneizador de vidro Dounce e homogeneize a solução a cada 10 minutos ou mais por 45 minutos no gelo. O pistão precisa ser operado com cuidado, pois pode quebrar facilmente.
- Despeje a solução homogeneizada em tubos de ultracentrifugação pré-resfriados e gire a 75.000 x g e 4 ° C por 60 min. Após centrifugação, determinar o volume sobrenadante (S3).
- Segunda polimerização
- Misturar o sobrenadante com 0,35 x S3 ml de glicerol e adicionar GTP à concentração final de 1 mM. Despeje o sobrenadante em tubos de ultracentrifugação e incube por 45 min a 37 °C.
NOTA: Enquanto isso, aqueça o rotor a 37 °C no banho-maria. - Centrifugue o sobrenadante polimerizado da etapa 3.4.1 por 60 min a 75.000 x g e 37 ° C. Determinar o volume do sobrenadante (S4).
NOTA: Este é um ponto de parada opcional. O pellet com tubulina pode ser congelado em nitrogênio líquido e armazenado a -80 °C. - Deixe os pellets congelados descongelarem lentamente no gelo por 30 min. Prepare 0,25 x S4 mL de tampão PIPES (500 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0,1 mM ATP), divida uniformemente em tubos com pellets, ressuspenda os pellets com uma colher e transfira a solução para um homogeneizador de vidro Dounce. Homogeneizar a cada 10 min no gelo por 45 min.
NOTA: Enquanto isso, resfrie o rotor em água com gelo. - Despeje a solução com tubulina despolimerizada em tubos de ultracentrifugação e gire por 60 min a 4 ° C e 75.000 x g.
- Misturar o sobrenadante com 0,35 x S3 ml de glicerol e adicionar GTP à concentração final de 1 mM. Despeje o sobrenadante em tubos de ultracentrifugação e incube por 45 min a 37 °C.
- Terceira polimerização
- Determine o volume do sobrenadante (S5) e adicione S5/9 mL de DMSO. Despeje a suspensão em tubos de ultracentrifugação e incube por 20 min a 37 ° C para polimerizar.
NOTA: Enquanto isso, aqueça o rotor a 30 °C no banho-maria. - Centrifugue a tubulina polimerizada por 60 min a 75.000 x g e 30 °C. Determinar o volume do sobrenadante (S6) e manter os sedimentos.
- Dissolva os grânulos em 0,25 x S6 mL de tampão PEM (100 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0,1 mM ATP). Use um homogeneizador de vidro Dounce para melhorar a solubilização. Continue adicionando tampão PEM até que os pellets estejam completamente dissolvidos (nenhuma partícula opalescente é mais visível).
- Determine o volume do sobrenadante (S5) e adicione S5/9 mL de DMSO. Despeje a suspensão em tubos de ultracentrifugação e incube por 20 min a 37 ° C para polimerizar.
- Purificação por cromatografia de troca iônica
NOTA: A cromatografia de troca iônica reversa é empregada para remover proteínas associadas à microtubulina. A tubulina flui livremente através da coluna no pH dado e as proteínas contaminantes são retidas na resina de fosfocelulose. Todas as etapas são realizadas em temperaturas próximas a 4° C ou no gelo. Não esclareça o extrato de tubulina antes da purificação do FPLC, seja por filtração ou centrifugação. - Equilibre o FPLC e a coluna com o tampão PEM (100 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0,1 mM ATP). Use pelo menos 10 volumes de coluna para equilibrar. O fluxo da bomba não deve exceder o fluxo usado para o empacotamento da coluna (1 mL / min).
- Carregue a suspensão de tubulina lentamente (0,5 mL / min) na coluna e colete a proteína não ligada que flui através da resina.
- Adicionar 10 μL de 100 mM de GTP a cada fração de 1 ml que contenha a proteína tubulina.
- Congelar as fracções que contêm tubulina em azoto líquido e transferi-las imediatamente para o recipiente com azoto líquido. A tubulina pode ser armazenada por vários anos nessas condições. A estabilidade diminui rapidamente ao longo de vários meses se a tubulina for armazenada a - 80 °C.
Representative Results
Durante as etapas de separação e purificação, amostras para eletroforese de SDS-PAGE foram coletadas e posteriormente analisadas por meio da coloração de azul de Coomassie (Figura 2). 20 μL de cada amostra foram misturados com 10 μL de tampão de amostra Laemmli (188 mM Tris-HCl pH 6,8, 3% SDS (p / p), 30% glicerol (v / v), 0,01 azul de bromofenol (p / p), 15% β-mercaptoetanol) e incubado a 95 ° C por 15 min. 4 μL de cada amostra foram carregados em gel SDS de acrilamida a 12,5% e separados sob uma corrente constante de 30 mA por gel em condições redutoras e desnaturantes.
Os resultados confirmaram um aumento incremental na concentração relativa de tubulina acompanhado por uma redução nas proteínas contaminantes. Além disso, não houve perda significativa de tubulina no lisado clarificado na primeira centrifugação (etapa 3.2.7) em comparação com a omissão desta etapa (Figura 2A, B).
A concentração de proteína foi determinada por meio de três métodos independentes: ensaio de BCA, ensaio de proteína de Bradford e análise de densitometria em gel SDS-PAGE19 (Figura 3). O rendimento global de tubulina utilizando o procedimento descrito foi de 123 mg de tubulina purificada a partir de 250 g de tecido neural. Durante as medições, é necessário levar em consideração que a alta concentração de TDT no tampão de armazenamento tem um impacto significativo no ensaio de BCA. Tanto o tampão PEM quanto o tampão PBS, com a adição de DTT, aumentam a absorbância de fundo em cerca de 0,900 A595, o que reduz significativamente a capacidade do ensaio BCA (Figura 3A). O efeito negativo da TDT é detectável mesmo após diluição dez vezes maior com água pura (dados não mostrados). O ensaio de Bradford não pareceu ser afetado pelo tampão de armazenamento (Figura 3B), conforme confirmado pela análise densitométrica.
A pureza da preparação da tubulina foi verificada por análise de espectrometria de massa em duas instalações independentes (VRI Brno, República Tcheca; CEITEC MU Brno, República Tcheca) usando ionização por eletrospray e MALDI-TOF. Ambas as análises confirmaram a presença de tubulinas suínas alfa e beta em várias isoformas. A pureza geral foi superior a 97,07% (PSMs 1065), com as impurezas mais prevalentes originárias da queratina do Homo sapiens tipo II (PSMs 246, 2,24% das impurezas) que foram introduzidas provavelmente durante o isolamento da tubulina e preparação da amostra para análise MS / MS. Outras impurezas compostas por 322 PSMs e apenas albumina sérica, actina gama e tripsinogênio originárias de Sus scrofa foram identificadas com resolução de um peptídeo (0,0069%).
Em experimentos subsequentes, foi verificada a preservação da capacidade de polimerização após o congelamento instantâneo e armazenamento em nitrogênio líquido. A alíquota de 10 mg/mL foi removida do nitrogênio líquido e lentamente descongelada em gelo. Amostras de diferentes concentrações (10 mg/mL, 8 mg/mL, 6 mg/mL, 4 mg/mL e 2 mg/mL) foram preparadas diluindo as alíquotas em tampão PEM contendo DTT, ATP e GTP para o experimento de automontagem. Uma série de diluições foi incubada a 37 °C por 60 min, e a segunda foi incubada em gelo por 60 min. Ambas as séries foram centrifugadas por 60 min a 21.000 x g e a temperatura correspondente (4 °C ou 37 °C). 30 μL de sobrenadante foram removidos e usados para SDS-PAGE. O sobrenadante restante foi cuidadosamente removido com pipeta e descartado. Os pellets foram lavados brevemente adicionando 100 μM de tampão PEM, seguido de remoção imediata usando uma pipeta. Posteriormente, os pellets foram ressuspensos em 50 μL de tampão de carga SDS concentrado 1x para que a concentração relativa de pellet e sobrenadante seja preservada. 10 μL de tampão de carregamento SDS foram adicionados a cada sobrenadante. Todas as amostras foram analisadas por meio do SDS-PAGE e da coloração de Coomassie (Figura 4). O volume de cada amostra carregada no SDS-PAGE foi ajustado de acordo com a concentração inicial, de modo que a diferença de precipitação devido à concentração é mais óbvia. O teste de automontagem da tubulina em tampão PEM confirmou a capacidade de formar fibras de tubulina de maneira dependente da temperatura.
O ensaio de montagem da tubulina20,21 acionado por MAP2c verificando a capacidade da tubulina de interagir com outras proteínas foi realizado22. As diluições seriadas de MAP2c foram preparadas onde 100 μL de alíquotas de tubulina de 1 mg/mL foram misturadas com MAP2c até a concentração final variando de 0 μM a 8 μM. Todas as amostras foram preparadas em gelo diluindo em tampão PEM recém-preparado com 1 mM de DTT e 1 mM de GTP. A tubulina foi incubada por 15 min a 37 °C com diferentes concentrações de MAP2c, e centrifugada por 60 min a 21.000 x g e 37 °C. A lavagem final do pellet foi realizada duas vezes com 100 μL de tampão PEM. O experimento confirmou a capacidade da tubulina preparada de sofrer polimerização acionada por MAP2c, pois apenas a amostra sem MAP2c não formou um pellet (Figura 5).
A microscopia eletrônica de transmissão foi usada para confirmar a presença de filamentos de tubulina a partir de experimentos de copolimerização. Suspensões de tubulina purificada precipitadas com MAP2c foram preparadas para microscopia eletrônica de transmissão usando coloração negativa. As amostras foram adsorvidas em grades de cobre revestidas com Formvar e estabilizadas com carbono. As grades foram então coradas negativamente com 2% NH4MoO4 e examinadas sob um microscópio eletrônico com ampliação de 18.000x e uma tensão de aceleração de 80 kV. A presença de microtúbulos homogêneos com estrutura filamentosa clara e tamanho adequado mostrou a capacidade de formar microtúbulos em conformação nativa (Figura 6).
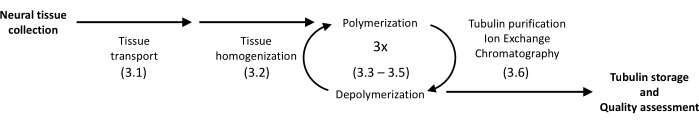
Figura 1: Um diagrama esquemático de separação e purificação da tubulina. O número entre parênteses refere-se à etapa do protocolo. Clique aqui para ver uma versão maior desta figura.
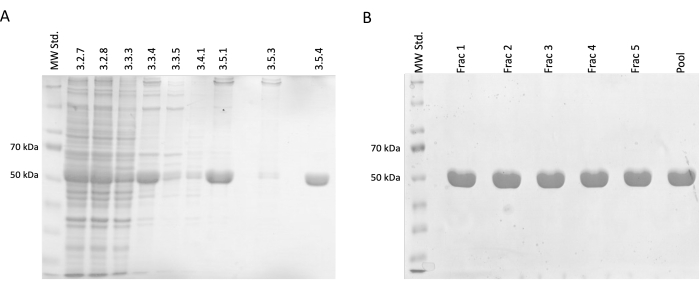
Figura 2: Separação e purificação da tubulina. (A) A análise SDS-PAGE de amostras coletadas durante a separação da tubulina utilizando polimerização acionada por temperatura (3 μL por linha). A diminuição das impurezas com um aumento estável na abundância relativa de tubulina (aproximadamente 50 kDa) é visível. Os números acima de cada linha correspondem ao número da etapa no protocolo. (B) A análise SDS-PAGE de frações obtidas após cromatografia de proteínas em resina de fosfocelulose (4 μL por linha). Clique aqui para ver uma versão maior desta figura.
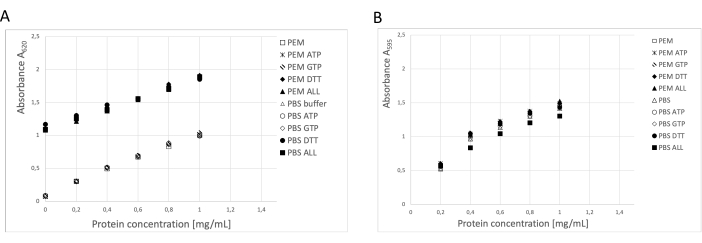
Figura 3: Concentração de proteína. A série de diluições de albumina sérica bovina de até 1 mg/mL em tampão PEM ou PBS foi comparada com séries de diluição BSA contendo 0,1 ATP, 1 mM GTP, 1 mM DTT separadamente ou em combinação (0,1 mM ATP, 1 mM GTP e 1 mM DTT) no tampão PEM ou PBS. (A) Quando o ensaio BCA foi usado, houve uma mudança significativa no fundo das amostras contendo DTT (símbolos sólidos). (B) Este efeito não foi detectado quando as concentrações foram medidas no ensaio de Bradford. Clique aqui para ver uma versão maior desta figura.
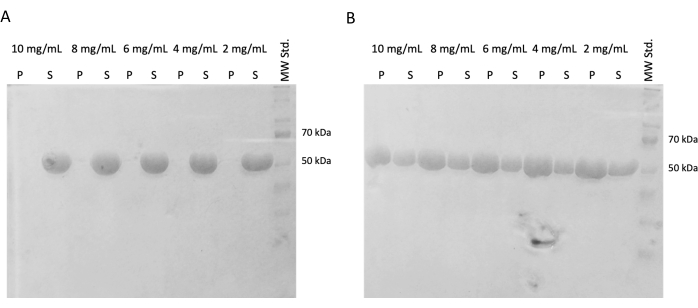
Figura 4: Ensaio de automontagem da tubulina. A análise SDS-PAGE do ensaio de automontagem confirmou a capacidade da tubulina armazenada incubada a (A) 4 °C ou (B) 37 °C para polimerizar de maneira dependente da temperatura em um amplo espectro de concentrações. (P - pellet, S - sobrenadante; a respectiva concentração de tubulina é indicada acima de cada par de linhas; a quantidade de cada amostra carregada foi de 10 μg). Clique aqui para ver uma versão maior desta figura.
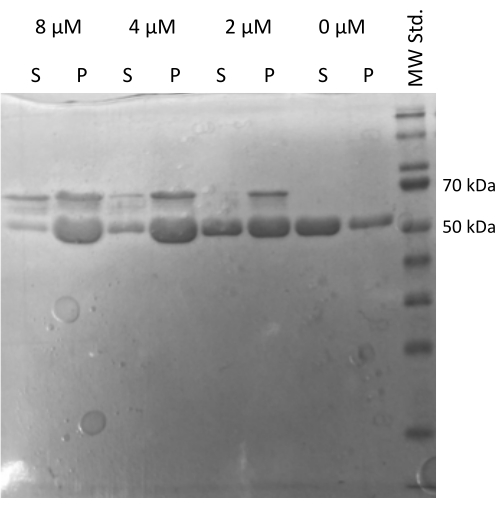
Figura 5: Ensaio de co-sedimentação de tubulina. A análise SDS-PAGE da montagem da tubulina assistida por MAP2c confirmou a capacidade da tubulina armazenada de sofrer polimerização impulsionada pela interação com a proteína associada aos microtúbulos de maneira dependente da concentração. A concentração molar de MAP2c é indicada acima de cada linha. (P - pellet, S - sobrenadante). Clique aqui para ver uma versão maior desta figura.
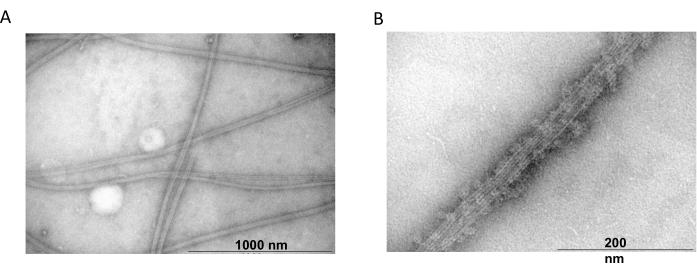
Figura 6: Microscopia eletrônica de transmissão. As microfotografias TEM mostraram que a tubulina se reúne (A) em microtúbulos de diâmetro apropriado (B) consistindo de filamentos de tubulina homogêneos decorados com proteínas MAP2c. A barra corresponde a 1000 nm (A) e 200 nm (B). Clique aqui para ver uma versão maior desta figura.
Discussion
O tecido neural de qualquer fonte é um excelente material para o isolamento da tubulina, pois os dendritos e axônios dos neurônios são ricos em microtúbulos (até 40%)23. O tecido cerebral pode ser obtido com relativa facilidade em quantidades suficientes. A principal desvantagem pode ser um nível não especificado de modificações pós-traducionais, que podem impactar experimentos subsequentes 24,25. Caso contrário, a única preocupação é a rápida degradação do material de partida, especialmente em condições quentes. Empregamos várias trocas de buffer de transferência para melhorar a dissipação de calor antes do transporte e transporte rápido para o processamento, que começa o mais rápido possível. O tecido fresco é dissecado em condições que impeçam o aquecimento e homogeneizado em um tampão contendo GTP e glicerol, que estabiliza ainda mais a tubulina26.
No protocolo apresentado, foi introduzida a etapa de clarificação (etapa 3.2.7) do lisado bruto. A centrifugação prolongada antes da primeira polimerização geralmente não é recomendada devido à suscetibilidade da tubulina a modificações irreversíveis e proteases. Por outro lado, os presentes experimentos demonstraram que um spin curto em alta força G reduz os detritos e, portanto, aumenta o volume relativo do homogeneizado processado sem afetar significativamente a qualidade da tubulina.
A determinação exata da concentração de proteínas é essencial para experimentos futuros, principalmente quando as interações com proteínas ou inibidores de ligação à tubulina são estudadas. Durante as investigações, encontramos diferenças significativas nos resultados dos ensaios de concentração de proteínas. O principal motivo foi a presença de DTT, GTP e ATP em altas concentrações interferindo nos ensaios. O ensaio de BCA foi deslocado para os limites superiores devido à alta quantidade de TDT no buffer de armazenamento, diminuindo a capacidade do ensaio. Além disso, os máximos de absorbância semelhantes de proteínas e ATP ou GTP causaram inconsistências na determinação da concentração de proteínas usando a absorbância a 280 nm. O mesmo problema foi perceptível nas leituras do detector UV FPLC. O ensaio mais confiável, com resultados estáveis, foi o ensaio de proteína de Bradford, onde não foi observada influência de compostos tampão. No entanto, é essencial preparar a série de diluições padrão de proteínas no tampão de armazenamento.
A capacidade da tubulina purificada de criar arranjos apropriados é um pré-requisito para experimentos subsequentes. A tubulina é, por natureza, altamente propensa à degradação, mesmo no ambiente rico em GTP em glicerol, resultando em uma capacidade reduzida de formar filamentos homogêneos. É fundamental seguir o processo de purificação e verificar experimentalmente a capacidade da tubulina armazenada de polimerizar em filamentos regulares estáveis. Foram introduzidos vários métodos independentes de verificação do estado da tubulina in vivo e in vitro. Entre os mais proeminentes, destacam-se a espectroscopia de dicroísmo circular27, o ensaio de ressonância plasmônica de superfície28, o ensaio de deslocamento térmico29, o ensaio de inibição da polimerização30, a coloração por imunofluorescência31,32, a coprecipitação22,33 e a análise em microscópio eletrônico de transmissão32 pode ser mencionado. O ensaio de polimerização e a coprecipitação da tubulina usados neste protocolo são fáceis de executar. Eles podem ser avaliados rapidamente pelos pellets que ocorrem no fundo do tubo ou usando SDS-PAGE. Por outro lado, a tubulina precipitada pode estar na forma de agregados. Métodos mais sofisticados, como microscopia eletrônica de transmissão, devem ser incluídos para confirmar a presença de fibras de microtúbulos para controle de qualidade.
Disclosures
Os autores não têm nada a divulgar.
Acknowledgements
O estudo foi apoiado pela Agência de Tecnologia da República Tcheca (projeto nº. TN02000017 - Centro Nacional de Biotecnologia em Medicina Veterinária - NaCeBiVet).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | --- | --- | Common material |
| 10 mL tubes | --- | --- | Common material |
| 50 mL tubes | --- | --- | Common material |
| ATP | ROTH | HN35.2 | Analytical grade |
| DMSO | ROTH | A994.2 | Analytical grade |
| Dounce glass homogenizer | P-LAB | H244043 | Homogenizer |
| DTT | ROTH | 6908.1 | Analytical grade |
| EGTA | ROTH | 3054.3 | Analytical grade |
| Ethanol | PENTA | 70390-11001 | Analytical grade |
| Glycerol | ROTH | 6967.2 | Analytical grade |
| Graduated beakers | --- | --- | Common equipment |
| Graduated cilinders | --- | --- | Common equipment |
| GTP | MERCK | 36051-31-7 | Very high quality |
| HCl | PENTA | 19360-11000 | Analytical grade |
| Izolated box for tissue transport | --- | --- | Common equipment |
| Kitchen blender | Waring | 7011HB | Glass or plastic vessel |
| Liquid nitrogen | --- | --- | Common material |
| MES | ROTH | 6066.4 | Analytical grade |
| MgCl2 | MERCK | 814733 | Analytical grade |
| MgSO4 | PENTA | 43180-31000 | Analytical grade |
| NaOH | PENTA | 15650-11000 | Analytical grade |
| Optima XPN100 | Beckman Coulter | A94469 | Ultracentrifuge |
| Phosphocellulose column | VWR | GENO786-1291 | Empty column |
| Phosphocellulose resin | Creative - Biomart, inc | Phosphate-001C | Ion exchange resin |
| PIPES | ROTH | 9156.2 | Analytical grade |
| Saccharose | PENTA | 24970-31000 | Analytical grade |
| Scales | --- | --- | Common equipment |
| Scissors | --- | --- | Common equipment |
| Spoons | --- | --- | Plastic or glass |
| Ti45 rotor | Beckman Coulter | 339160 | Rotor for Ultracentrifuge |
| Tweezers | --- | --- | Common equipment |
| Ultra turrax IKA T18 basic | IKA | 356 1000 | Laboratory dispenser |
| Water bath 37 °C | --- | --- | Stirred |
References
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Murphy, D. B., Hiebsch, R. R. Purification of microtubule protein from beef brain and comparison of the assembly requirements for neuronal microtubules isolated from beef and hog. Anal Biochem. 96 (1), 225-235 (1979).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann NY Acad Sci. 253, 107-132 (1975).
- Weisenberg, R. C. Microtubule formation in vitro in solutions containing low calcium concentrations. Science. 177 (4054), 1104-1105 (1972).
- Roychowdhury, S., Gaskin, F. Separation of assembly-competent tubulin from brain microtubule protein preparations using a fast-performance liquid chromatography procedure. J Neurochem. 46 (5), 1399-1405 (1986).
- Weingarten, M. D., Suter, M. M., Littman, D. R., Kirschner, M. W. Properties of the depolymerization products of microtubules from mammalian brain. Biochemistry. 13 (27), 5529-5537 (1974).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nat Protoc. 14 (5), 1634-1660 (2019).
- Jacobs, M., Huitorel, P. Tubulin-associated nucleoside diphosphokinase. Eur J Biochem. 99 (3), 613-622 (1979).
- Munguía, B., et al. Purification of native M. vogae and H. contortus tubulin by TOG affinity chromatography. Exp Parasitol. 182, 37-44 (2017).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein ExpPurif. 32 (1), 83-88 (2003).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Lett. 587 (21), 3450-3455 (2013).
- Liu, C., Yao, J., Yin, J., Xue, J., Zhang, H. Recombinant α- and β-tubulin from Echinococcus granulosus: Expression, purification and polymerization. Parasite. 25, 62 (2018).
- Ti, S. -. C., Wieczorek, M., Kapoor, T. M. Purification of affinity tag-free recombinant tubulin from insect cells. STAR protoc. 1 (1), 100011 (2020).
- Bodakuntla, S., Jijumon, A. S., Janke, C., Magiera, M. M. Purification of tubulin with controlled post-translational modifications and isotypes from limited sources by polymerization-depolymerization cycles. JVisExp. (165), e61826 (2020).
- Sackett, D. L., Werbovetz, K. A., Morrissette, N. S. Isolating tubulin from nonneural sources. Methods Cell Biol. 95, 17-32 (2010).
- Modig, C., Strömberg, E., Wallin, M. Different stability of posttranslationally modified brain microtubules isolated from cold-temperate fish. Mol Cell Biochem. 130 (2), 137-147 (1994).
- Fourest-Lieuvin, A. Purification of tubulin from limited volumes of cultured cells. Protein Exp Purif. 45 (1), 183-190 (2006).
- MacRae, T. H., Gull, K. Purification and assembly in vitro of tubulin from Trypanosoma brucei. Biochem J. 265 (1), 87-93 (1990).
- Jansen, S., et al. Quantitative mapping of microtubule-associated protein 2c (MAP2c) phosphorylation and regulatory protein 14-3-3ζ-binding sites reveals key differences between MAP2c and its homolog Tau. JBiol Chem. 292 (24), 3-3 (2017).
- Melková, K., et al. Structure and functions of microtubule associated proteins Tau and MAP2c: Similarities and differences. Biomolecules. 9 (3), E105 (2019).
- Herzog, W., Weber, K. Fractionation of brain microtubule-associated proteins: Isolation of two different proteins which stimulate tubulin polymerization in vitro. Eur J Biochem. 92 (1), 1-8 (1978).
- Castle, A. G., Crawford, N. Isolation of tubulin from pig platelets. FEBS Lett. 51 (1), 195-200 (1975).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. Int J Mol Sci. 18 (10), E2207 (2017).
- Lafanechère, L., Job, D. The third tubulin pool. Neurochem Res. 25 (1), 11-18 (2000).
- Arai, T., Ihara, Y., Arai, K., Kaziro, Y. Purification of tubulin from bovine brain and its interaction with guanine nucleotides. J Biochem. 77 (3), 647-658 (1975).
- Mahaddalkar, T., et al. Structural investigations into the binding mode of a novel noscapine analogue, 9-(4-vinylphenyl) noscapine, with tubulin by biochemical analyses and molecular dynamic simulations. J Biomol Struct Dyn. 35 (11), 2475-2484 (2017).
- Chen, H., et al. Structure-activity relationship study of novel 6-Aryl-2-benzoyl-pyridines as tubulin polymerization inhibitors with potent antiproliferative properties. J Med Chem. 63 (2), 827-846 (2020).
- Yao, D., et al. Ferulin C triggers potent PAK1 and p21-mediated anti-tumor effects in breast cancer by inhibiting Tubulin polymerization in vitro and in vivo. Pharmacol Res. 152, 104605 (2020).
- Sweetnam, P. M., et al. The role of receptor binding in drug discovery. JNat Prod. 56 (4), 441-455 (1993).
- Qi, Z. -. Y., et al. Synthesis and biological evaluation of 1-(benzofuran-3-yl)-4-(3,4,5-trimethoxyphenyl)-1H-1,2,3-triazole derivatives as tubulin polymerization inhibitors. Bioorg Chem. 94, 103392 (2020).
- Sáez-Calvo, G., et al. Triazolopyrimidines are microtubule-stabilizing agents that bind the vinca inhibitor site of tubulin. Cell Chem Bio. 24 (6), 737-750 (2017).
- Bellocq, C., et al. Purification of assembly-competent tubulin from Saccharomyces cerevisiae. EurJ Biochem. 210 (1), 343-349 (1992).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved