כימות שינויים גלובליים בהיסטון לאחר תרגום באמצעות ציטומטריית זרימה תוך-גרעינית במיקרוגליה מבודדת במוח עכבר
In This Article
Summary
עבודה זו מתארת פרוטוקול לכימות שינויים גלובליים בהיסטון באמצעות ציטומטריית זרימה תוך-גרעינית במיקרוגליה מבודדת במוח. העבודה מכילה גם את פרוטוקול בידוד תאי המיקרוגליה ששימש לאיסוף נתונים.
Abstract
בקרת ביטוי גנים מתרחשת באופן חלקי על ידי שינויים במבנה הכרומטין, כולל הוספה והסרה של שינויים לאחר תרגום לזנבות היסטון. שינויים לאחר תרגום היסטון (HPTM) יכולים להקל על ביטוי גנים או דיכוי. לדוגמה, אצטילציה של שאריות ליזין זנב היסטון מנטרלת את המטען החיובי ומפחיתה אינטראקציות בין הזנב לדנ"א טעון שלילית. הירידה באינטראקציות זנב-דנ"א היסטון גורמת לנגישות מוגברת של הדנ"א הבסיסי, ומאפשרת גישה מוגברת לגורמי שעתוק. סימן האצטילציה משמש גם כאתר זיהוי למפעילי שעתוק המכילים ברומודומיין, ויחד יוצרים ביטוי גנים משופר. סימני היסטון יכולים להיות מווסתים באופן דינמי במהלך התמיינות תאים ובתגובה לסביבות תאיות וגירויים שונים. בעוד שגישות ריצוף הדור הבא החלו לאפיין מיקומים גנומיים עבור שינויים בודדים בהיסטון, ניתן לבחון רק שינוי אחד במקביל. בהתחשב בכך שישנם מאות HPTM שונים, פיתחנו מדד כמותי בתפוקה גבוהה של HPTM גלובלי שניתן להשתמש בו כדי לסנן שינויים בהיסטון לפני ביצוע גישות ריצוף גנום נרחבות יותר. פרוטוקול זה מתאר שיטה מבוססת ציטומטריית זרימה לזיהוי HPTM גלובלי וניתן לבצע אותו באמצעות תאים בתרבית או תאים מבודדים מרקמות in vivo . אנו מציגים נתונים לדוגמה מתאי מיקרוגליה מבודדים במוח של עכבר כדי להדגים את הרגישות של הבדיקה לזיהוי שינויים גלובליים ב- HPTM בתגובה לגירוי חיסוני שמקורו בחיידק (lipopolysaccharide). פרוטוקול זה מאפשר הערכה מהירה וכמותית של HPTM וניתן ליישם אותו על כל וסת שעתוק או אפיגנטי שניתן לזהות על ידי נוגדן.
Introduction
אפיגנטיקה היא חקר המנגנונים המווסתים ביטוי גנים מבלי לשנות את רצף הדנ"א הבסיסי. הבקרה האפיגנטית של ביטוי גנים היא דינמית בתוך התאים ויכולה לאפשר תגובות מהירות ומתואמות לגירויים סביבתיים שונים. הוויסות הדינמי מתרחש בחלקו כתוצאה משינויים במבנה הכרומטין ברמת הנוקלאוזום, המורכב מחלבוני היסטון (H2A, H2B, H3, H4) המורכבים לליבת אוקטמר הפצועה בחוזקה על ידי DNA1. יחסי הגומלין בין חלבוני ההיסטון לבין הדנ"א יכולים לשלוט בנגישות הדנ"א למכונות שעתוק, שבסופו של דבר יכולות לשלוט בביטוי גנים ובהיבטים אחרים של ביולוגיית הכרומטין2. לחלבוני היסטון יש זנבות לא מובנים הכוללים שאריות טעונות חיובית היוצרות אינטראקציות אלקטרוסטטיות עם עמוד השדרה של הדנ"א הטעון שלילית. אינטראקציות אלה גורמות לאריזה הדוקה של הדנ"א ולנגישות מופחתת של הדנ"א. שינויים קוולנטיים בזנבות ההיסטון, המכונים שינויים פוסט-תרגומיים של היסטון (HPTM), יכולים לווסת אינטראקציות אלה 3,4. חלק מה-HPTMs המאופיינים ביותר כוללים אצטילציה ומתילציה של זנב היסטון, אשר יכולים לשנות את הזיקה של אינטראקציות אלקטרוסטטיות בין זנבות ההיסטון לדנ"א, וכתוצאה מכך נגישות דיפרנציאלית לדנ"א הבסיסי וגיוס גורמי שעתוק המזהים HPTM אלה באתרים ספציפיים. HPTMs מוסדרים על ידי שלושה סוגים חשובים של אנזימים המכונים קוראים - אשר מזהים, סופרים - אשר מפקידים, ומחקים - אשר מסירים HPTM. לפיכך, גיוס או פירוק של אנזימי קורא, כותב או מחק יכול בסופו של דבר לשנות את הנוף של HPTMs ולשלוט במבנה ובתפקוד של כרומטין, מה שהופך את הוויסות והקריאה שלהם לחיוניים להבנת הביולוגיה התאית ותפקוד 3,4.
התאים במערכת העצבים המרכזית (CNS) גמישים מבחינה אפיגנטית מכיוון שהם משנים את התעתיק שלהם כדי להסתגל לגירויים סביבתיים. עדויות מצטברות מצביעות על כך ששינויים באפיגנום, כגון מתילציה של דנ"א, רנ"א לא מקודד ו-HPTM, ממלאים תפקיד חיוני בהיווצרות זיכרון ובתפקוד סינפטי5. שיבוש הדינמיקה של HPTM באמצעות מניפולציה של הקוראים, הכותבים או המחקים הרלוונטיים יכול לחסום או לשפר למידה אסוציאטיבית והגברה לטווח ארוך 6,7,8. מיקרוגליה, התא החיסוני המקומי של מערכת העצבים המרכזית, מווסת במהירות את התעתיק שלהם בתגובה לגירוי חיסוני באמצעות שינויים דינמיים באפיגנום 9,10,11. רמה גבוהה זו של הסתגלות לסביבת המוח המקומית שלהם מקשה על בחינתם בהקשר מבודד, שכן מחקרים הראו כי האפיגנום והשעתוק של תאי מיקרוגליה משתנים לאחר שעות ספורות בלבד באמצעי התרבית לאחר הוצאתם מסביבת המוח11. בנוסף, מכיוון שתאי מיקרוגליה מהווים רק 10% מתאי המוח, מדדים הבוחנים שינויים ברמת הרקמה כולה חסרים רגישות וספציפיות12,13. כתוצאה מכך, מיקרוגליה צריכה להיות מבודדת במהירות כדי לבחון את השינויים האפיגנטיים כגון רמות HPTM, ex vivo.
השיטות הנפוצות לבחינת HPTM כוללות ריצוף כרומטין-אימונומשקעים (ChIP-seq) ומחשוף תחת מטרות וריצוף תיוג (CUT&Tag-seq)4. בעוד שטכניקות אלה הן ספציפיות מאוד ל-HPTM בודד ויכולות ליידע את נוכחותם של HPTM בהקשר גנומי ספציפי, הן יכולות לבחון רק אחד מה-HPTM האפשריים הרבים בתוך ניסוי יחיד11,14 לכן, לפני שממשיכים בניסויים כאלה, הדורשים השקעה משמעותית של זמן וכסף, חשוב מאוד לצמצם את רשימת ה-HPTM המעניינים לחקירה נוספת על ידי בחינה ראשונית של שינויים גלובליים רמות HPTM. שתי הגישות העיקריות לבחינת רמות HPTM גלובליות הן אימונוהיסטוכימיה וניתוח כתמים מערביים, אך שתי הגישות הן כמותיות למחצה בלבד, בעלות תפוקה נמוכה, ודורשות מספר רב של חלקי רקמות או תאים מבודדים15,16. לפיכך, שאפנו לפתח שיטה כמותית רגישה ביותר שתוכל לשמש לבחינת רמות HPTM העולמיות במהירות וברמת התא הבודד.
הפרוטוקול המוצג מאפשר זיהוי מהיר של רמות HPTM גלובליות באמצעות ציטומטריית זרימה תוך גרעינית. מחקרים קודמים בתאים סרטניים הצדיקו את החשיבות של בחינת הרמות העולמיות מנקודת מבט קלינית17,18. זה גם נפוץ עבור מחקרים להשתמש ברמות גלובליות כשיטת סינון לפני הערכת מיקום גנומי של HPTM ספציפיים של עניין19,20. עבור מיקרוגליה, הערכת הרמות העולמיות לאחר בידוד היא מאתגרת בשל תפוקת התאים הנמוכה; Pan et al מציגים רמות HPTM גלובליות ממיקרוגליה מבודדת, שבה מיקרוגליה משלושה בעלי חיים אוחדה כדי לאפשר זיהוי רמת חלבון על ידי כתם מערבי19. באמצעות הפרוטוקול שלנו, אנו מסוגלים לזהות שינויים גלובליים עם קלט תאים נמוך בהרבה, מה שמאפשר סינון של סימנים מרובים לכל חיה ומבטל את הצורך באיסוף דגימות.
כאן, אנו מתארים פרוטוקול לזיהוי רמות HPTM במהירות באמצעות ציטומטריית זרימה תוך-גרעינית כמותית במיקרוגליה מבודדת. בעוד שאנו מתמקדים באופן ספציפי בכימות HPTM לשם קיצור, פרוטוקול זה יכול לשמש באותו אופן לכימות רמות גלובליות של אנזימי קורא, כותב ומחק. הפרוטוקול מועבר בשני חלקים: הראשון, שיטת הבידוד למיקרוגליה, ושנית, השיטה מבוססת ציטומטריית זרימה לקביעת רמות HPTM. שיטת הבידוד מניבה תאים שניתן להשתמש בהם הן לבידוד RNA והן להערכת רמת HPTM המאפשרת הערכה של ביטוי גנים ורמות HPTM מאותה דגימה. בנוסף, ניתן להשתמש בשיטה להערכת HPTM על סוגי תאים אחרים כפי שמצוין בפרוטוקול.
Protocol
כל הפרוטוקולים לטיפול בבעלי חיים אושרו על ידי הוועדה לטיפול בבעלי חיים של אוניברסיטת קולומביה הבריטית בהתאם להנחיות המועצה הקנדית לטיפול בבעלי חיים.
1. עיכול המוח לבידוד מיקרוגליה
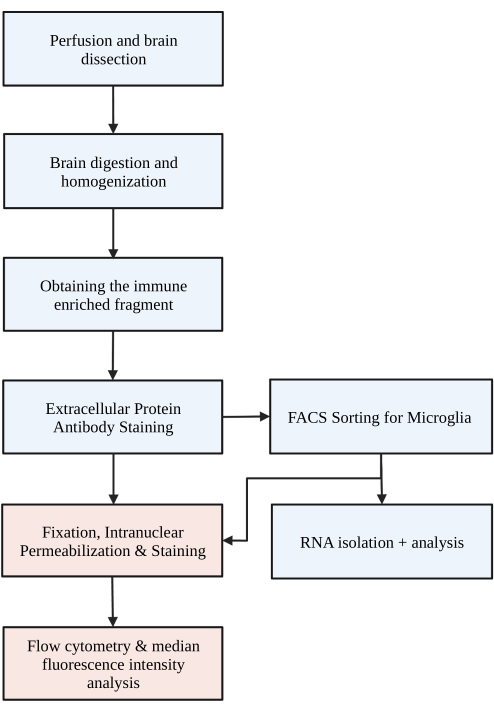
איור 1: תרשים זרימה פשוט של הפרוטוקול. העכברים מחוררים תחילה עם HBSS, והמוח מנותח. לאחר מכן המוח מנותק באמצעות עיכול כימי ושיבוש מכני כדי לגרום להומוגנט של תא יחיד. החלק המועשר במערכת החיסון נאסף באמצעות שיפוע צפיפות לא רציף, ולאחר מכן התאים מוכתמים עבור P2RY12. תאים מוכתמים הם 1) ממוינים באמצעות מיון תאים מופעלים פלואורסצנטיים (FACS) כדי להוביל לניתוח RNA או ניתוח חלבונים במורד הזרם, ו / או 2) קבועים, חדירים, ומוכתמים עבור חלבונים תוך גרעיניים. רמת החלבון מכומתת על ידי עוצמת הפלואורסצנטיות החציונית בערוץ העניין הנקבעת על ידי ציטומטריית זרימה. קופסאות צבועות בכחול הן חלק משלב פרוטוקול 1) עיכול המוח לבידוד מיקרוגליה. קופסאות צבועות באדום הן חלק משלב פרוטוקול 2) צביעת זרימה תוך גרעינית לניתוח ביטוי חלבונים. נוצר באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- הכנת ריאגנטים
הערה: אם אתה מתכנן מיצוי לאיסוף RNA ותאים עבור ניתוח HPTM, עיין בסעיף 1.7.1 לקבלת שינויים שיכללו מעכבי שעתוק ותרגום. עם זאת, זה לא נדרש אם רק מעריכים את אות החלבון, שכן התאים שקטים במידה רבה כאשר הם נשמרים על קרח.- מאגר מיון תאים מופעל פלואורסצנטי (FACS) (20 מ"ל לדגימה): יש להמיס אלבומין בסרום בקר (BSA) בתמיסת מלח מאוזנת אחת של הנקס (HBSS) ליצירת תמיסת BSA של 2%. יש להמיס את EDTA לריכוז סופי של 1 mM בתמיסת BSA של 2%. יש לסנן, לעקר באמצעות מסנן 0.2 מיקרומטר ולאחסן בטמפרטורה של 4°C עד שבוע לפני השימוש.
- חיץ עיכול (1 מ"ל לדגימה): הרכיבו מחדש בקבוקון של פפאין ב-HBSS לריכוז סופי של 20 U/mL ב-1 mM L-ציסטאין עם 0.5 mM EDTA. יש להפעיל בטמפרטורה של 37°C למשך 10 דקות לפחות או עד לקבלת רקמה מוכנה לעיכול. ממש לפני השימוש, הוסף DNase I לתמיסת הפפאין הפעילה לריכוז סופי של 200 U/mL. הכינו את זה ביום הניסוי ואל תאחסנו.
- תמיסת שיפוע צפיפות איזוטונית (5.5 מ"ל לדגימה): הוסף 10x HBSS למדיום שיפוע צפיפות קרה לריכוז סופי של 1x HBSS, והתוצאה היא צפיפות סופית של 1.117 גרם/מ"ל. יש לערבב לפחות 30 שניות לפני השימוש. מניחים על קרח עד לשימוש.
- תמיסת שיפוע צפיפות של 37% (4 מ"ל לדגימה): הוסף שיפוע צפיפות איזוטונית ל- HBSS 1x כדי להגיע לריכוז סופי של 37% עם צפיפות סופית של 1.043 גרם/מ"ל. הוסף 20 μL של פנול אדום עבור כל מ"ל של שיפוע צפיפות 37% כדי ליצור פתרון ורוד להדמיה במהלך שכבות. מערבולת לפחות 30 שניות לפני השימוש. מניחים על קרח עד לשימוש.
- תמיסת שיפוע צפיפות 70% (2 מ"ל לדגימה): הוסף שיפוע צפיפות איזוטוני ל- HBSS 1x כדי להגיע לריכוז סופי של 70% עם צפיפות סופית של 1.082 גרם/מ"ל. הוסף 5 μL של כחול טריפאן עבור כל מ"ל של מדיום צפיפות של 70% כדי ליצור פתרון כחול להדמיה במהלך שכבות. מערבולת לפחות 30 שניות לפני השימוש. מניחים על קרח עד לשימוש.
- זילוח ודיסקציה מוחית
הערה: פרוטוקול הזילוח דומה ל- Posel et al. הכולל תיאור וידאו של בית החזה של עכבר, זילוח קרום הלב והסרת המוח21. כאן, אנו משתמשים בעכברים בוגרים C57BL/6J זכרים ונקבות (בני 10-15 שבועות, 20-30 גרם), אך פרוטוקול זה יכול לשמש לביצוע ניתוח בית חזה לכל עכבר. כל ההליכים בבעלי חיים חייבים להיות מאושרים על ידי ועדת האתיקה המוסדית לפני ביצוע ניסויים.- הרדמת עכברים: מרדימים עכברים עם 4% איזופלורן ב-100% חמצן עד מעבר למישור ההרדמה הכירורגית, אשר ניתן לאשר באמצעות צביטת בוהן, או חוסר רפלקס בעת צביטה חזקה ברגל העכבר. הניחו את העכבר על גבו והצמידו בחוזקה את ארבע כפותיו מטה לתוך לוח הדיסקציה הכירורגי המונח מוטה במגש פלסטיק, כדי להבטיח שהאף מאובטח לתוך חרוט האף האיזופלואורן. לאחר ההעברה, ודא שהחיה עדיין עברה את המישור הכירורגי של ההרדמה לפני שתמשיך.
- בית החזה של עכבר: תפסו והרימו את עור הבטן באמצעות מלקחיים ובצעו חתך רדוד דרך העור ודופן הבטן כדי לחשוף את הקסיפואיד מבלי לפגוע באבי העורקים היורד או באיברים שמתחתיו.
- אחזו את הקסיפואיד במלקחיים ובצעו חתכים רוחביים מתחת לכלוב הצלעות כדי לחשוף את הסרעפת והכבד. בצע חתכים רדודים זהירים דרך הסרעפת לאורך כלוב הצלעות באמצעות מספריים עדינים ודרך כלוב הצלעות באמצעות מספריים רקמה והצמיד את עצם החזה לתחנת הניתוח ליד ראש העכבר כדי לחשוף את הלב והריאות לזילוח קרום הלב.
- זילוח קרום הלב: הכינו משאבת זילוח פריסטלטית וחברו מחט 26.5G לקצה אחד של הצינור. הכינו את הצינור להליך על ידי הכנסת קצה אחד של הצינור לבקבוקון של HBSS 1x קר והפעלת המשאבה כדי למלא את הצינור לחלוטין ב- 1x HBSS.
- תוך כדי החזקת הלב במלקחיים קהה, הכנס קצה של מחט 26.5G עם צינור הזילוח המחובר לחדר השמאלי של הלב ובצע חתך קטן באטריום הימני. הפעל את משאבת הזילוח כדי לנקב בזהירות את העכבר בקצב של ~ 2-4 מ"ל / דקה עם לפחות 15-20 מ"ל של HBSS קר 1x.
הערה: זילוח מלא מצוין לעתים קרובות כאשר הכבד מתחיל לנקות דם והופך להיות באותו צבע כמו הלב. - הסרת מוח: ערפו את ראשו של העכבר באמצעות מספריים לניתוח רקמות ובצעו חתך בקו האמצע בקרקפת מהצוואר ועד האף. מקלפים את דשי העור לצדדים כדי לחשוף את הגולגולת ולהסיר עודפי רקמות ועצמות בקצה הקאודלי של הגולגולת בעזרת מספריים מנתחים.
- החליקו בזהירות להב אחד של המספריים מתחת לגולגולת לתוך הפתח מגנום כשהצד החד פונה לעצם וחתכו בזהירות את קו האמצע לכיוון האף. בצע חתכים רוחביים הן בבסיס הגולגולת והן ליד האף באמצעות מספריים נתיחות. באמצעות מלקחיים עדינים, החיים את הגולגולת מקו האמצע החוצה כדי לפצח את חלקי הגולגולת ולחשוף את המוח. הרימו בעדינות את המוח בעזרת מרית והניחו על נייר כתם דיסקציה.
- דיסקציה מוחית: הניחו את המוח על פיסת נייר כתם דיסקציה שהורטבה עם HBSS 1x על גבי צלחת פטרי סגורה מלאה בקרח. הסר את המוח הקטן וחתך את חצי המוח באמצעות סכין גילוח נקי.
- הסר את גזע המוח, הסטריאטום והחומר הלבן מכל חצי כדור, תוך שמירה על שלמות ההיפוקמפוס וקליפת המוח השכבת-על. העבירו את ההמיספרות המכילות קליפת המוח ורקמת ההיפוקמפוס המבודדות לתוך צינור של 15 מ"ל עם 5 מ"ל של HBSS קר 1x ושמרו על קרח.
הערה: חשוב לבצע את הנתיחות במהירות האפשרית, כך שהרקמה תישאר קרה ללא יותר מ-2 דקות בין עריפת הראש לבין הנחתה הסופית של הרקמה המנותחת ב-1x HBSS על קרח. אם מבודדים מיקרוגליה מבעלי חיים מרובים, המוח יכול להיות מאוחסן על קרח ב 1x HBSS במשך ~ 1 שעה לפני שתמשיך עם עיבוד כל הקבוצה של בעלי חיים לעיכול וכו '.
- עיכול המוח והומוגניזציה
- דיסוציאציה מכנית וכימית: הניחו את רקמת המוח מכל עכבר ו-1 מ"ל של חיץ עיכול לתוך צלחות פטרי בודדות על קרח. בעזרת להב אזמל נקי, קוצצים היטב את המוח לחתיכות קטנות (<1 מ"מ).
- חותכים את הקצה מפיפטת העברה מפלסטיק ומעבירים בזהירות כל אחד מהמוחות הטחונים לבארות נפרדות בתוך צלחת של 24 בארות על קרח. מכסים את הצלחת בסרט גמיש ושקוף ודגרים על קרח במשך 30 דקות.
הערה: כאשר קצוצים נכון, רקמת המוח דומה לשום טחון היטב. - הומוגניזציה של הקפצה: העבר תמיסת מוח מעוכלת מכל באר לתוך זכוכית בודדת של 7 מ"ל הקפצת הומוגנייזרים על קרח שכל אחד מהם מלא ב-5 מ"ל של חיץ FACS קר. מקפיצים כל מוח בעדינות עם המזיק הרופף (A), בערך 30-40 פעמים, עד שמתקבל תרחיף של תא בודד. לאחר ההקפצה עם המזיק A, הקפיצו בעדינות עם המזיק ההדוק (B) 3-4 פעמים כדי להבטיח השעיה של תא בודד.
הערה: אין לדחוף את המזיק יותר מ -3/4 מהדרך למטה כדי למנוע ריסוק הרקמה בתחתית ההומוגנייזר. הפתרון הסופי צריך להיות אטום וחלבי.
הערה: אם מעכלים מספר מוחות בניסוי יחיד, יש לתזמן את העברת המוח למאגר FACS כך שכל דגימה תהיה רק במאגר העיכול למשך 30 דקות. עיכול יתר עלול לגרום לפיצול של חלבונים על פני השטח, מה שמפחית את קשירת הנוגדנים במורד הזרם ואת הסיגנל.
- השגת מקטע מועשר במערכת החיסון
- קביעת שיפוע צפיפות: העבר את ההומוגנט מכל מוח לצינורות פוליפרופילן נפרדים של 15 מ"ל והוסף 2.125 מ"ל של שיפוע צפיפות איזוטוני ולמעלה ל- 8.5 מ"ל עם חיץ FACS עבור כל אחד מהם כדי לקבל ריכוז סופי של שיפוע צפיפות של 25%. הפוך בעדינות את צינורות 15 מ"ל 20x כדי לערבב היטב.
- באמצעות פיפטת העברה צרה מדורגת, שכבה בעדינות 4 מ"ל של שיפוע צפיפות 37% לכל צינור, תוך הקפדה רבה על הקמת שכבות נקיות. מתג פיפטות העברה ושכבה עדינה של 2 מ"ל של שיפוע צפיפות של 70% (איור 2A). מעבירים לצנטריפוגה מקוררת ל-4°C ומסתובבים ב-500 x g למשך 20 דקות כשכבש הבלימה מכוון לאפס.
- איסוף פרגמנט מועשר במערכת החיסון: בעזרת פיפטות העברה נקיות, שואפים בעדינות את המיאלין מראש הנפח בצינור 15 מ"ל באמצעות פיפטת העברה נקייה ומשליכים. בזהירות לאסוף את החלק העליון של שיפוע צפיפות לתוך צינור פוליפרופילן נקי 15 מ"ל באמצעות פיפטה העברה.
- אספו בזהירות את המקטע המועשר במערכת החיסון (1.5 מ"ל מעל ו-1.5 מ"ל מתחת, היכן ששכבות שיפוע הצפיפות של 70% ו-37% נפגשות) לתוך צינור פוליפרופילן חדש של 15 מ"ל (איור 2B). הוסף 10 מ"ל של חיץ FACS לדגימה המועשרת במערכת החיסון כדי לדלל את מדיום שיפוע הצפיפות והפוך את הצינורית בעדינות פי 20 כדי לערבב היטב.
הערה: מכיוון שתאים נוטים להידבק לצידי הצינור, הקפד לאסוף את כל התאים בדגימה במהלך שלבי האיסוף על ידי הקפת פיפטה לאט לאורך צידי הצינור תוך כדי איסוף הנוזל. - גלול את התאים בדגימה המועשרת במערכת החיסון על ידי צנטריפוגה של צינורות 15 מ"ל בצנטריפוגה של 4 מעלות צלזיוס ב 500 x גרם במשך 10 דקות עם בלם הרמפה במורד מוגדר לאפס. מיד עם סיום הסיבוב, להסיר את supernatant בזהירות, משאיר כ 300 μL של נוזל בצינור 15 מ"ל, נזהר לא להפריע את הגלולה (אשר לא יכול להיות גלוי).
- אספו את הסופרנאטנט בצינור נוסף של 15 מ"ל כדי לוודא שהתאים היו מכופפים בסחרור (השליכו את החלק הזה לאחר אימות עם ספירת התאים של הגלולה המרחפת). לאחר השעיה מחדש של גלולת התא בנפח 300 μL באמצעות פיפטה P1000, ספור תאים עם המציטומטר כדי להעריך את תפוקת התא הכוללת.
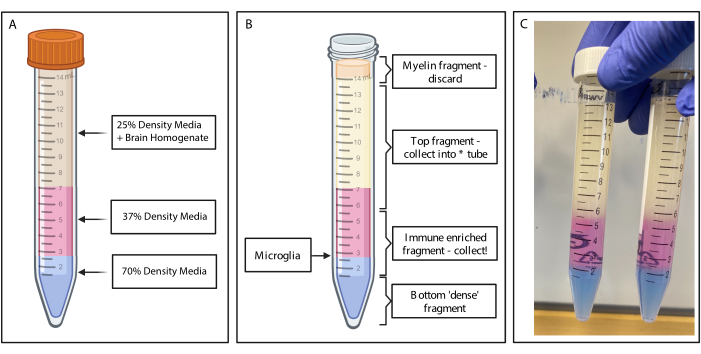
איור 2: קבלת המקטע המועשר במערכת החיסון על-ידי שיפוע צפיפות לא רציף. (A) ההומוגנט במוח מיוצר ל-25% צפיפות בינונית, מתחת ל-4 מ"ל של צפיפות 37% בצבע ורוד בינוני דרך אדום פנול ו-2 מ"ל של 70% צפיפות בינונית בצבע כחול דרך כחול טריפאן. (B) בעקבות הצנטריפוגה נפרדו השברים. מיקרוגליה נשענת על ממשק של שברי מדיה בצפיפות של 37% ו-70%. שבר המיאלין נמצא בחלק העליון של צינור 15 מ"ל ויושלכ. המקטע העליון נאסף כגיבוי למקרה שהספין נכשל, ולא מתאוששים תאים. במקרה כזה, ניתן לחזור על השיפוע באמצעות חלק זה. החלק המועשר במערכת החיסון נאסף במורד הזרם. החלק התחתון המכיל תאי דם אדומים נשאר בצינור ומושלך. (C) איור לדוגמה המתאר שכבות שלמות. נוצר באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- צביעת נוגדנים חוץ-תאיים
- חסימה: מעבירים תאים לתחתית עגולה 96 צלחת באר על קרח וצנטריפוגה ב 500 x גרם עם בלם כדי להניע את התאים. הוציאו במהירות את הסופרנאטנט שבכיור על ידי הזזת הצלחת כדי להיפטר מהסופרנטנט, והשאירו את כדורית התא שלמה בתחתית הבאר.
- השהה מחדש את התאים במאגר FACS של 50 μL עם מגיב חוסם קולטן CD16/32 FC-Receptor נגד עכבר באמצעות פיפטה P200 (ריכוז סופי 10 מיקרוגרם / מ"ל, גורם דילול 1:50) כדי למנוע קשירה לא ספציפית של נוגדנים למונוציטים או תאים נושאי FcR אחרים. דוגרים במשך 10 דקות על קרח.
- צביעת נוגדנים: הכינו את הנפח המתאים של תערובת מאסטר 2x המכילה P2RY12- Allophycocyanin (APC; מקדם דילול 1:50, ריכוז 4 מיקרוגרם/מ"ל לריכוז באר סופית של 1:100, ריכוז 2 מיקרוגרם/מ"ל) וכתם מת חי סגול 525 (מקדם דילול 1:50 לריכוז באר סופית של 1:100). הוסף 50 μL של תערובת האב מכתים לתרחיף התא (המתקבל לאחר חסימה בסעיף 1.5.1) ודגר על הצלחת במשך 30 דקות בחושך על קרח.
הערה: עבור פרוטוקול זה, אנו מציגים צביעת התאים עם P2RY12. ראשית, P2RY12 הוא סמן הומיאוסטטי למיקרוגליה שניתן לווסת אותו בהקשרים מסוימים של מחלות. לדוגמה, עכברי מודל של אלצהיימר 5XFAD הורידו את רמות P2RY12 מה שעלול להקשות עליהם לזהות22. כתמים חלופיים שניתן להשתמש בהם לבידוד כוללים Tmem119, Cd11b ו- CD4523. שנית, ניתן לכוונן את APC פלואורוכרום מצומד כך שיתאים לפאנל הנוגדנים הרצוי. עם זאת, בחירת פלואורוכרום בהיר, כגון APC או PE, תסייע להבטיח שניתן יהיה להבחין בקלות בין האוכלוסיות החיוביות והשליליות24. - לאחר הצביעה, יש להוסיף 200 μL של חיץ FACS ישירות לכל באר כדי לשטוף את התאים. סובב ב 500 x גרם ב 4 ° C כדי להסיר supernatant על ידי הבהוב. השהה מחדש תאים ב-200 מיקרוליטר של חיץ FACS עם פיפטה P200, סובב ב-500 x גרם ב-4°C, והפעל צלחת כדי להסיר חיץ מבארות.
- הכנת בקרות זרימה: לפני הצביעה, יש להפריד את נפחי התאים הדרושים מכל דגימה לאחר חסימה בשלב 1.5.1 עבור בקרות הזרימה הנדרשות.
הערה: בקרות זרימה נדרשות עבור כל ניסוי כדי לבסס את השערים. בקרות הזרימה יכולות להילקח מבעל חיים נוסף או מחלק קטן מכל אחת מבארות הניסוי. בעת פיצול תאים, הקפד להקצות מספיק תאים לכל פקד, שכן נדרשים 10,000-30,000 תאים לכל פקד כדי ליצור שערים בביטחון גבוה.- ישנן שלוש בקרות זרימה רלוונטיות: ללא כתם, מת חי ובקרת איזוטיפ P2RY12. לשליטה ללא כתמים, אין להוסיף נוגדן. בבקרת איזוטיפ P2RY12 יש לטפל בתאים באמצעות צבע כדאיות (1:100) ונוגדן בקרת איזוטיפ מצומד ל-APC (1:100).
- כדי להכין את הבקרה המתה החיה, תאי aliquot לתוך באר נפרדת ולהעביר מחצית נפח התא לתוך צינור 500 μL. הכניסו את הצינור בנפח 500 μL למקפיא בטמפרטורה של -80°C למשך 5 דקות, ולאחר מכן הכניסו אינקובטור של 37°C למשך 5 דקות כדי להרוג את התאים. להחזיר את aliquot של תאים מתים לתוך באר בקרת המתים החיים ולהכתים עם צבע קיימא קושר אמין על סגול 525 (גורם דילול 1:100) כדי לסמן תאים מתים.
הערה: הפרוטוקול נכתב עבור צביעת לוחות בשיטת פליק להסרת סופרנאטנטים. עם זאת, זה דורש להסיר את הסופרנאטנט מיד לאחר השלמת הסחרור ולבצע את הפליק-נאטנט עם מספיק כוח כדי להסיר במהירות את הסופרנאטנט מבלי להפריע לכדור. לחלופין, ניתן להשתמש בצינורות נטולי RNAse / DNase של 1.5 מ"ל עבור הצביעה, עם השינויים הבאים: העברת תאים לתוך צינור מיקרוצנטריפוגה 1.5 מ"ל גלולה ב 800 x גרם במשך 5 דקות ב 4 ° C. לשאוף supernatant עם פיפטה. טיפ: למהירות, פיפטת העברה של 5 מ"ל עם קצה P200 יכולה לשאוף במהירות ובדייקנות את הסופרנטנט. בעת שאיפה, לבדוק את הכדור. אם הגלולה אינה נראית לעין, השאירו 50 μL של supernatant והתאימו את החישובים בהתאם. בעת שטיפת נוגדנים, הוסף FACS נוסף כדי להגדיל את דילול הנוגדנים (1000 μL במקום 200 μL) כדי להסביר הסרה חלקית של supernatant. בהתאם לציטומטר, השתמש בצינורות 1.5 מ"ל למיון, תוך הפחתת כמות האספקה הנדרשת.
- מיון FACS עבור מיקרוגליה
- הכנה: יש להשהות מחדש כל באר ב-200 מיקרוליטר של חיץ FACS עם פיפטה P200 ולהעביר לצינורות מיון זרימה מסומנים ולהוסיף חיץ FACS לסך של 500 μL לריכוז של כ-5 x 105 אירועים למ"ל. יש לאחסן על קרח בחושך עד לניתוח. הכן צינורות מיון לאחר על ידי הוספת 100 μL של חיץ FACS ככרית לתאים בצינורות נטולי RNAse של 1.5 מ"ל.
- הגדרות ציטומטר: מיין תאים בממיין תאי ציטומטריה של זרימה המוגדר עם פיית 100 מיקרומטר. מיין תאים באמצעות 18-20 psi.
- גיטוט: על הציטומטר, שער עבור גודל התא באמצעות אזור פיזור צדדי (SSC) לעומת גובה פיזור קדימה (FSC) באמצעות בקרת ללא כתמים כדי לסייע בהבחנה בין פסולת, מקם את SSC-A על ציר יומן כדי להמחיש אוכלוסיית תאים ושער מקרוב כדי לבחור תאים (שער S1; איור 3). כדי להסיר כפילויות, התווה FSC-H לעומת FSC-W ושער קרוב סביב אוכלוסיית התא והסר כל פסולת וכפילים (שער S2). באמצעות בקרת האיזוטיפ P2RY12, בדוק את התאים בערוץ APC והגדר את השער לאוטופלואורסצנטיות כדי לקבוע תאי P2RY12+. באמצעות בקרות ללא כתמים ומתים חיים, שער לתאים שאינם פלואורסצנטיים על סגול 525 ננומטר כתאים חיים.
- מיון: חלקת סגול 525 ננומטר לעומת APC ולקבוע את האוכלוסייה שהיא P2RY12+ ולחיות לפי FMOs (MG). מיין את התאים האלה לתוך צינור המיון שכותרתו (איור 3). אחוז המיון הסופי הוא כ-50% מכלל האירועים כאשר רוב האובדן הכולל של האירוע הוא פסולת שהוצאה בשער S1 (~70% מהאירועים הם תאים; טבלה 1).
- בידוד וניתוח RNA
- מעכבי תמלול ותרגום: אם מתכננים מיצוי RNA, כדי למנוע את הסיכון לבידוד חתימות תמלול הקשורות, כלול מעכבי תרגום ותמלול בשלבי המאגר. הכינו את קוקטייל המעכבים כמתואר על ידי מארש ואחרים כולל אקטינומיצין D, אניסומיצין וטריפטוליד25.
- הכנת מעכבים: יש לחדש את מלאי המעכבים ולאחסן באופן הבא: לשחזר actinomycin D ב dimethylsulfoxide (DMSO) ל 5 מ"ג / מ"ל ולאחסן ב -20 ° C. צור מחדש טריפטוליד ב- DMSO ל- 10 mM ואחסן ב- -20 °C, מוגן מפני אור. צור מחדש אניסומיצין ב- DMSO ל- 10 מ"ג / מ"ל ומאוחסן ב- 4 ° C, מוגן מפני אור. אחסן את כל מלאי המעכבים למשך לא יותר מחודש אחד לאחר ההרכבה מחדש.
- שינויי חיץ: הוסף מעכבים בארבעה מאגרים שונים בפרוטוקול באופן הבא: בעת ביצוע זילוח קרום הלב, הכן HBSS עם אקטינומיצין D (5 מיקרוגרם/מ"ל, 1:1000 מהמלאי) וטריפטוליד (10 מיקרומטר, 1:1000 מהמלאי). לאחר זילוח, מעבירים מוחות למעבדה ב-HBSS המכילים אקטינומיצין D (5 מיקרוגרם/מ"ל, 1:1000 מהמלאי), טריפטוליד (10 מיקרומטר, 1:1000 מהמלאי) ואניסומיצין (27.1 מיקרוגרם/מ"ל, 1:368.5 מהמלאי). הכן מאגר FACS עם אקטינומיצין D (5 מיקרוגרם/מ"ל, 1:1000 מהמלאי), טריפטוליד (10 מיקרומטר, 1:1000 מהמלאי) ואניסומיצין (27.1 מיקרוגרם/מ"ל, 1:368.5 מהמלאי). הכינו חיץ עיכול עם אקטינומיצין D (5 מיקרוגרם/מ"ל, 1:1000 מהמלאי), טריפטוליד (10 מיקרומטר, 1:1000 מהמלאי) ואניסומיצין (27.1 מיקרוגרם/מ"ל, 1:368.5 מהמלאי). הכינו חיץ כביסה לאחר המיון, עם HBSS המכיל אקטינומיצין D (5 מיקרוגרם/מ"ל, 1:1000 מהמלאי), טריפטוליד (10 מיקרומטר, 1:1000 מהמלאי) ואניסומיצין (27.1 מיקרוגרם/מ"ל, 1:368.5 מהמלאי).
הערה: בעת הוספת המעכבים, הקפד להוסיף אותם מיד לפני השימוש והגן על כל המאגרים המוכנים מפני אור בזמן השימוש. הימנעו מהקפאה-הפשרה של תמיסות מלאי.
- שטיפות לאחר מיון: מכיוון שהתאים מוינו לצינורות חופשיים של 1.5 מ"ל RNase במאגר FACS, אשר יפריעו לבידוד RNA, יש צורך לשטוף את התאים. סובב את התאים ב 1000 x גרם ב 4 ° C במשך 5 דקות ולהסיר supernatant, משאיר כ 50 μL של נוזל.
- הוסיפו 200 מיקרוליטר של 1x HBSS המכיל אקטינומיצין D (5 מיקרוגרם/מ"ל, 1:1000 מהמלאי), טריפטוליד (10 מיקרומטר, 1:1000 מהמלאי) ואניסומיצין (27.1 מיקרוגרם/מ"ל, 1:368.5 מהמלאי) וערבבו היטב. חזור על הסחיטה והסר supernatant משאיר 50 μL של נוזל (לשטוף 1). מוסיפים 200 μL של חיץ שטיפה לאחר המיון, מערבבים היטב וחוזרים על הסחיטה ומסירים סופרנאטנט שמשאיר 25 μL של נוזל (שטיפה 2).
- מיצוי RNA: לבידוד RNA מתאי מיקרוגליה, השתמש בערכת בידוד RNA בעלת קלט נמוך לקבלת תפוקת RNA גבוהה ועקבית וציוני RIN מעל 9 (ראה להלן ורשימת חומרים לקבלת המלצות על מוצרים). לכדורית התא מוסיפים 350 μL של חיץ הליזיס מהערכה המומלצת + β-מרקפטואתנול (1:100) ומערבבים היטב.
הערה: במידת הצורך, ניתן להשעות את הפרוטוקול בשלב זה. ניתן לאחסן דגימות במאגר הליזיס בטמפרטורה של -80°C עד למיצוי RNA. אם אתם מפיקים RNA לאחר האחסון, הפשירו את הליזט על קרח והמשיכו עם ההוראות הספציפיות לערכה לבידוד. - מעבירים ליזט למגרסת תאים מבוססת עמודות (ראה טבלת חומרים לקבלת המלצות על מוצרים) ולצנטריפוגה במהירות מרבית של 4°C למשך 2 דקות. יש להקפיד על מינימום של 14 מיקרוליטר מים נטולי RNase ולקבוע את הריכוז בהתאם לצורך. RNA יכול לשמש עבור כל יישום במורד הזרם לאחר נקודה זו.
- מעכבי תמלול ותרגום: אם מתכננים מיצוי RNA, כדי למנוע את הסיכון לבידוד חתימות תמלול הקשורות, כלול מעכבי תרגום ותמלול בשלבי המאגר. הכינו את קוקטייל המעכבים כמתואר על ידי מארש ואחרים כולל אקטינומיצין D, אניסומיצין וטריפטוליד25.
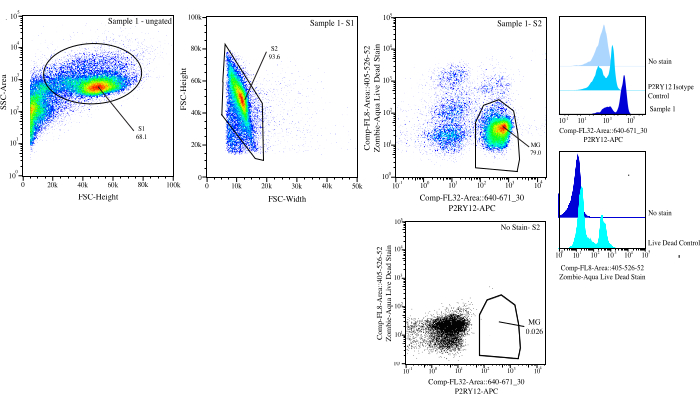
איור 3: אסטרטגיית Gating למיון זרימה. האירועים מגודרים עבור גודל התא ב- SSC-A לעומת FSC-H (S1). לאחר מכן, התאים מגודרים להיות סינגלים ב- FSC-H לעומת FSC-W (S2). תאי סינגלט ממוינים כחיים אם שליליים ב- Comp-FL8-A::405-526-52 (כתם מת חי 525) וכ- P2RY12+ אם חיוביים ב- Comp-FL32-A::640-671_30 (P2RY12-APC) באמצעות בקרת האיזוטיפ P2RY12. התאים מסומנים כ- MG וממוינים אם שניהם חיים ו- P2RY12+. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| אוכלוסייה מגודרת | תדירות ההורה | תדירות סה"כ | מנה |
| S1 | 68.10% | 68.10% | 162186 |
| S2>S1 | 93.59% | 63.70% | 151707 |
| P2Ry12+ (670+) > S2 > S1 | 83.05% | 52.90% | 125986 |
| חי (525-) > S2 > S1 | 92.78% | 59.10% | 140752 |
| MG (P2RY12+ חי) >S2>S1 | 78.96% | 50.30% | 119794 |
טבלה 1: טבלת שושלת לדוגמה לדוגמה עם אחוזי gating ומספרי אירועים צפויים.
2. צביעת זרימה תוך גרעינית לניתוח ביטוי חלבונים
הערה: ניתן להתחיל סוגי תאים אחרים בשלב זה, פרוטוקול זה נבדק עם תאים בתרבית כולל תאי HEK293, תאים דמויי מיקרוגליה BV2 ותאי מיקרוגליה אנושיים שמקורם ב- IPSC.
- קיבוע והכתמה של תאים
הערה: עבור הפרוטוקול הבא, השתמש בערכת צביעה תוך-תאית הממוטבת לצביעה גרעינית. ראה טבלת חומרים לקבלת המלצות על מוצרים.- Aliquot תאים מוכתמים מחוץ לתא מסעיף 1.5.2 לתוך צלחת באר 96 (5 x 104- 1 x 106 תאים). סובב תאים במשך 5 דקות ב- 500 x גרם ב- 4 ° צלזיוס והחלק כדי להסיר מאגר FACS.
הערה: כדי לקבל נתונים בביטחון גבוה של רמות חציון, יש להשתמש במינימום של 10,000 תאים לכל באר. אמנם אין מקסימום מומלץ, עדיף לשמור על מספר תאים עקבי לאורך כל הניסוי כדי להבטיח שאין השפעה משמעותית של מקדם שונה של וריאציות (CV). - קיבוע וחדירה: הוסף 200 μL של תרכיז תיקון 1x וערבב בעדינות עם פיפטה P200 כדי להשהות מחדש תאים. דוגרים בחושך במשך 45-60 דקות. צלחת צנטריפוגה במשך 5 דקות ב 500 x גרם בטמפרטורת החדר (RT) ו להעיף כדי להשליך supernatant.
הערה: במידת הצורך, ניתן להשעות את הפרוטוקול בשלב זה. לאחר השלכת סופרנטנט, יש להשהות מחדש תאים במאגר אחסון ארוך טווח עבור תאי מערכת החיסון (ראו טבלת חומרים להמלצות על מוצרים). ניתן לאחסן את הדגימות בטמפרטורה של 4°C למשך 12-18 שעות, להגן עליהן מפני אור ולכסות אותן בסרט שקוף כדי להגן על אידוי החיץ. - הוסיפו 200 μL של חיץ חדירה 1x לכל באר ופיפטה עם P200 לערבוב. צלחת צנטריפוגה במשך 5 דקות ב 500 x גרם ב RT ו flick כדי להשליך supernatant. יש לחזור על שטיפת חיץ חדירה בסך הכל פי 3.
- הכנת פקדי זרימה: פיצול נפח התאים מכל דגימה עבור בקרות הזרימה הנדרשות (10,000-30,000 תאים לכל באר בקרה מספיקים).
- כדי להכין את הבקרה ללא כתמים, לתקן את התאים ללא כתמים מן המיון או aliquot תאים לא מוכתמים לתוך באר נפרדת כי לא יקבל שום נוגדן.
- כדי להכין את הבקרה הפלואורסצנטית מינוס אחת (FMO), תאי aliquot עבור כל אחד מהנוגדנים בלוח למעט זה שבערוץ זה.
- עבור הערוצים הרלוונטיים, לכלול את נוגדן בקרת איזוטיפ ב- FMO עבור gating. לדוגמה, בלוח המכיל P2RY12-APC ו- H3K27Ac-AlexaFluor568 - צריכים להיות שני FMOS: (1) APC-FMO המכיל רק H3K27Ac-AlexaFluor568 ונוגדן בקרת איזוטיפ P2RY12 ו- (2) 568-FMO המכיל רק P2RY12-APC ובקרת איזוטיפ ראשית ו- 568 משנית.
הערה: פרוטוקול זה מוצג כדי לבדוק HPTM יחיד, אולם ניתן לקבוע לוחות המכילים HPTM רבים מצומדים לפלואורופורים שונים.
- צביעת נוגדנים ראשונית: יש להוסיף 50 μL של חיץ חדירה 1x עם ריכוז מתאים של נוגדן ראשוני לכל באר. דגירה במשך 30 דקות ב- RT בחושך. יש לשטוף 2x עם 200 μL של 1x permebilization buffer.
הערה: ריכוז הנוגדנים המשמש עבור כל HPTM נכלל בטבלת החומרים. הריכוז נקבע על ידי בדיקת ריכוזים שונים של נוגדנים על תאים בתרבית שטופלו בממריץ שיגרום לעלייה דרמטית, למשל מעכב HDAC לסימני אצטילציה ווידוא שגם תאים לא מטופלים וגם תאים מטופלים היו בטווח הגילוי (מעל בקרת האיזוטיפ ומתחת לטווח הגילוי המרבי של הציטומטר). ריכוז הנוגדנים האופטימלי עבור HPTM צריך להיות בעל עוצמה פלואורסצנטית חציונית ממוצעת בתעלת הפלואורופורים בין 5 x 104 ו 1 x 105. - צביעת נוגדנים משנית: לחסום עם 200 μL של 1x permeabilization buffer עם 2% סרום חמור רגיל (NDS) במשך 10 דקות ב RT. להסתובב במשך 5 דקות ב 500 x גרם ב RT ולהעיף כדי להסיר supernatant.
- הוסף 50 μL של 1x permeabilization buffer עם 2% NDS ואת הריכוז המתאים של נוגדן משני לדגור במשך 30 דקות ב RT בחושך. הוסף 200 μL של חיץ חדירה 1x לבארות כדי לדלל, צנטריפוגה את הצלחת במשך 5 דקות ב 500 x גרם ב RT, ו flick כדי להשליך supernatant. לשטוף תאים 2x עם 200 μL של 1x permeabilization buffer.
הערה: במידת הצורך, השעה את הפרוטוקול בשלב זה. יש להשהות מחדש תאים ב-200 מיקרוליטר של מאגר אחסון לטווח ארוך עבור תאי מערכת החיסון עם פיפטה P200 (ראו טבלת חומרים לקבלת המלצות) ולאחסן בטמפרטורה של 4°C למשך 12-24 שעות, כשהם מוגנים מפני אור. - הכנה לציטומטריית זרימה: לוחית צנטריפוגות למשך 5 דקות ב 500 x גרם ב RT ו flick כדי להשליך supernatant. השהה מחדש תאים במאגר FACS של 200 μL באמצעות פיפטה P200 עבור ציטומטריית זרימה. חותמים בסרט שקוף להובלה לציטומטר.
- Aliquot תאים מוכתמים מחוץ לתא מסעיף 1.5.2 לתוך צלחת באר 96 (5 x 104- 1 x 106 תאים). סובב תאים במשך 5 דקות ב- 500 x גרם ב- 4 ° צלזיוס והחלק כדי להסיר מאגר FACS.
- ציטומטריית זרימה
- כדי לנתח את לוח הנוגדנים המוצע, ודא שהציטומטר מצויד בארבעה לייזרים לפחות, כולל סגול (405 ננומטר), כחול (488 ננומטר), צהוב (561 ננומטר) ואדום (633 ננומטר). הציטומטר זקוק למסננים כדי לזהות FITC (כחול-525 ננומטר), KRO (סגול-525 ננומטר), PE (צהוב-585 ננומטר) ו-APC (אדום-660 ננומטר). הוסף נוגדנים נוספים בהתאם לציטומטר שנבחר.
- כיול ותקינה: בתחילת כל ניסוי, הריצו חרוזים פלואורסצנטיים בצבעי הקשת וכווננו את מתח צינור מכפיל האור (PMT) עד ששיאי החרוזים יהיו דומים לערכי היעד שהופעלו בניסויים קודמים. שיטה זו של סטנדרטיזציה מאפשרת לינה של ציוד להיסחף לאורך זמן.
- פיצוי: לאחר הגדרת מתח ורווח PMT לניסוי, השתמש בחרוזי פיצוי שנלכדו בנוגדנים כדי לקבוע את מטריצת הפיצוי עבור פאנל הנוגדנים. חישוב זה יבטיח שהפלואורופורים אינם תורמים לשינויי האות בערוצים אחרים. זה הכרחי יותר ויותר כאשר ריבוב נוגדנים מרובים.
- גודל גידור: בתרשים נקודה, התוויית SSC-A ביומן לעומת FSC-H בלינארי. שער החוצה פסולת ובחר עבור גודל התא באמצעות שער S1. בחר תאים בודדים בתרשים נקודה של FSC-W לעומת FSC-H ושער כ- S2. (איור 4).
- קביעת שערי פלואורופור: באמצעות ה-FMO הרלוונטי לכל ערוץ פלואורופור, קבעו את השערים כדי לקבוע מהו אות חיובי בכל ערוץ באמצעות היסטוגרמות של פרמטר יחיד (איור 4).
- מדידת הדגימות: תעד בקפידה את הדגימות באמצעות אסטרטגיית gating שנקבעה. זהה את תאי המיקרוגליה באמצעות אות P2RY12+, קבע את ביטוי החלבון בתעלות המתאימות למיקרוגליה בלבד.
- ניתוח נתוני ציטומטריה של זרימה
- הקמת שערי ניתוח: באמצעות השלבים לעיל עבור הציטומטר בממשק המשתמש של תוכנת הניתוח, השתמש באותם שערים המשמשים להקלטה לניתוח.
- קבל ערכי MFI באמצעות תוכנה לניתוח ציטומטריית זרימה (ראה טבלת חומרים לקבלת המלצות): שחזר את אסטרטגיית הציטומטריה לניתוח זרימה. באמצעות הפונקציה הוספת סטטיסטיקה, בחר חציון עבור האוכלוסייה המעניינת (לדוגמה, 568+) בגובה הערוץ המפוצה. באמצעות עורך הטבלה, יצא את ערכי העוצמה הפלואורסצנטית החציונית (MFI) עבור הערוצים המתאימים לגיליון אלקטרוני כדי להמשיך בניתוח סטטיסטי (טבלה 2).
הערה: קובץ משלים S1 כולל נתונים לדוגמה מעכברים מוזרקים מסוג lipopolysaccharide (LPS) ו-phosphate buffered saline (PBS) וקובץ ניתוח לדוגמה עם אסטרטגיית gating וערכי MFI. - ניתוח ערכי MFI לשינוי קיפול חלבון: לאחר קבלת ערכי ה- MFI, חשב את שינוי הקיפול של ה- MFI ביחס לאוכלוסיית הביקורת או האוכלוסייה הלא מטופלת (משוואה 1). שינוי הקיפול MFI משקף את השינוי בקיפול ברמות החלבון. באמצעות ערכי שינוי הקיפול, הערך את השינוי בביטוי וחשב את המובהקות הסטטיסטית באמצעות מבחן t או ANOVA.
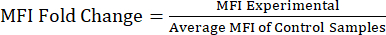 משוואה 1
משוואה 1
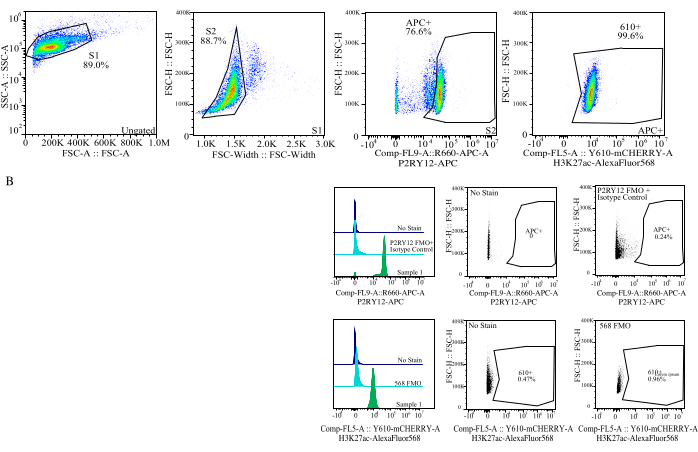
איור 4: אסטרטגיית Gating להערכת MFI של חלבונים. האירועים מגודרים תחילה עבור גודל התא ב- SSC-A לעומת FSC-H (S1). לאחר מכן התאים מגודרים עבור סינגלים ב- FSC-H לעומת FSC-W (S2). תאי סינגלט מזוהים כמיקרוגליה על ידי אות P2RY12-APC (APC+) כאשר השער נקבע על בסיס פלואורסצנטיות בבקרת APC-FMO המכילה נוגדן בקרת איזוטיפ. לאחר מכן התאים מגודרים עבור אות H3K27Ac-AlexaFluor568 ב- Comp-FL5-A::Y610-mCherry. העוצמה הפלואורסצנטית של 610+ התאים נקבעת כפרוקסי לביטוי חלבון. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Representative Results
עכברים בוגרים עברו טרנסקרדיליזציה והוקרבו לבידוד מיקרוגליה. תאי מיקרוגליה בודדו על קרח והוכתמו בנוגדנים מתים חיים P2RY12-APC וסגול 525. תאים שנקבעו כחיוביים עבור P2RY12 ושליליים עבור כתם מת חי 525 סגול מוינו כתאי מיקרוגליה חיים. התפוקה הממוצעת של תאי מיקרוגליה ממוח עכבר מנותח הייתה 1.28 x 105 ± 0.05 (ממוצע ± שגיאת תקן של ממוצע (SEM), N=100). אין הבדל ביבול תאי מיקרוגליה מעכברים נקביים (1.25 x 10,5 ± 0.09 [ממוצע ± SEM, N=46]) ומזכרים (1.32 x 10,5 ± 0.07 [ממוצע ± SEM, N=54]) עכברים (t(98)=0.6365, p=0.526). כאשר מבודדים מאזורי מוח ספציפיים, התפוקה הממוצעת של מיקרוגליה מקליפות המוח של עכברים היא 8.3 x 104 ± 0.08 (ממוצע ± SEM, N = 15) ומהיפוקמפוס עכבר היא 4.1 x 104 ± 0.02 (ממוצע ± SEM, N = 16). כצפוי, קיים הבדל משמעותי בתפוקת תאי המיקרוגליה מכל אזור במוח (F(2, 128)=25.25, P<0.0001). לאחר בידוד מיקרוגליה, RNA הופק מהתאים המבודדים באמצעות ערכת בידוד RNA בעלת קלט נמוך. באופן עקבי, ציון שלמות הרנ"א (RIN) היה מעל 9.0 (9.62 ±-0.05) והתשואה הממוצעת של RNA לתא הייתה 0.25 ±-0.01 pg (ממוצע ± SEM, N=32; קובץ משלים S2).
עכברים בוגרים הוזרקו תוך צפקית עם 1 מ"ג / ק"ג lipopolysaccharide (LPS) 24 שעות לפני ההקרבה. העכברים עברו טרנסקרדיליזציה של HBSS, ותאי מיקרוגליה בודדו מכל המוח בהתאם לפרוטוקול המתואר (איור 5A). לכל כתם הוקצו 20,000-30,000 תאים לכל פאנל נוגדנים. הרמות העולמיות של היסטון 3 ליזין 27 אצטילציה (H3K27Ac) הוערכו במיקרוגליה מבודדת באמצעות ציטומטריית זרימה. עבור עכברים זכרים ונקבות, טיפול LPS גרם לעלייה ב- H3K27Ac כאשר ה- MFI מנורמל בתוך המין (t(6)=9.676, p<0.0001; איור 5B). כאשר בוחנים את ההיסטוגרמות של התאים המוכתמים, האוכלוסיות נשארות מפוזרות באופן נורמלי עם שונות דומה; אולם התאים עברו לפלואורסצנטיות מוגברת וכתוצאה מכך חלה עלייה ב-MFI (איור 5C). כאשר בוחנים H3K9Ac באותו טיפול, יש עלייה דומה ב- H3K9Ac (t(6)=7.299, p=0.0003; איור 5D,E), אולם שינוי הקיפול של LPS ביחס לאות PBS של H3K9Ac קטן מהאות H3K27Ac.
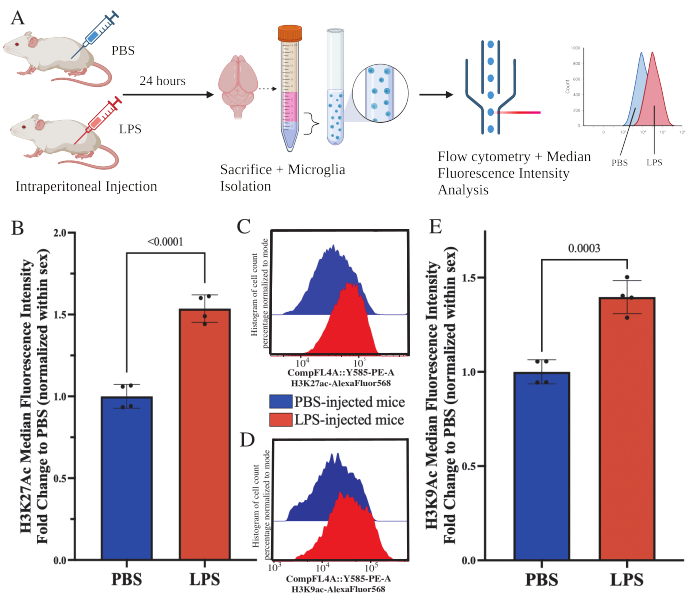
איור 5: שינויים גלובליים באצטילציה של היסטון בתאי מיקרוגליה מבודדים. (A) עכברים מוזרקים תוך צפקית עם מלח חוצץ פוספט (PBS) או 1 מ"ג/ק"ג ליפופוליסכריד (LPS) 24 שעות לפני ההקרבה. תאי המיקרוגליה נאספים מהמקטע המועשר במערכת החיסון ומקובעים לציטומטריית זרימה ולהערכת היסטון גלובלית לאחר שינוי תרגומי. העוצמה הפלואורסצנטית החציונית מוערכת כפרוקסי לביטוי חלבון. נוצר באמצעות BioRender.com. (B) הרמות העולמיות של H3K27Ac עלו בתגובה לטיפול ב-LPS. שינוי קפל ל-PBS מנורמל בתוך ניסוי ומין. מבחן t דו-זנבי לא מזווג, t(6)=9.676, p<0.0001. גרף עמודות מתאר את הממוצע ± SEM. N=8 בעלי חיים; 2 לכל תנאי ב-2 ניסויים בלתי תלויים. (C) היסטוגרמות לדוגמה המתארות שינוי של עוצמת פלורסנט H3K27Ac. מודאל מתאר היסטוגרמות מעכברים המוזרקים על ידי PBS לעומת עכברים המוזרקים על ידי LPS. (D) היסטוגרמות לדוגמה המתארות שינוי של עוצמת פלואורסצנטית H3K9Ac. מודאל מתאר היסטוגרמות מעכברים המוזרקים על ידי PBS לעומת עכברים המוזרקים על ידי LPS. (E) רמות גלובליות של H3K9Ac עלו בתגובה לטיפול ב-LPS. שינוי קפל ל-PBS מנורמל בתוך ניסוי ומין. מבחן t דו-זנבי לא מזווג, t(6)=7.299, p=0.0003. גרף עמודות מתאר את הממוצע ± SEM. N=8 בעלי חיים; 2 לכל תנאי ב-2 ניסויים בלתי תלויים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כדי לאשר שהשיטה המתוארת דומה לשיטות אחרות ששימשו בעבר לכימות גלובלי של שינוי היסטון, שאפנו להשתמש באימונובלוט ככלי השוואתי. עם זאת, התשואה מתאי המיקרוגליה המבודדים פשוט נמוכה מכדי לאפשר הערכה סבירה. לכן, השתמשנו בתאי BV2 בתרבית כדי להשוות את שיטת ציטומטריית הזרימה התוך-תאית לכתם מערבי (WB). תאי BV2 גודלו במדיה מלאה (DMEMF12, 10% FBS, 1x פניצילין/סטרפטמיצין ו-1x L-גלוטמין) ב-37°C, 5% CO2. התאים עברו עם 0.25% טריפסין-EDTA וצופו בצפיפות של 250,000 תאים/באר וטופלו במדיה מופחתת בסרום (DMEM F12, 2% FBS, 1x פניצילין/סטרפטמיצין ו-1x L-גלוטמין) והורשו להתאושש במשך 12 שעות ב-37°C, 5% CO2. התאים טופלו ב-LPS של 25 ננוגרם/מ"ל במשך 24 שעות לפני הקיבוע כמתואר לעיל או בליזה עם חיץ ליזה WB. האות של H3K27Ac בוצע בשתי השיטות כאשר GAPDH שימש כבקרת טעינה עבור WB. ניתוח עוצמת הפלואורסצנט המנורמלת בהשוואה לבקרת PBS נקבע עבור כל קבוצה (איור 6A). כאשר בחנו את השינוי באות H3K27Ac המנורמל על ידי WB, חלה עלייה של פי 1.527 במצב הטיפול ב- LPS ביחס לבקרת H2O שנקבעה כמשמעותית על ידי מבחן t לא מזווג (t=3.024, df=5; p=0.0293). כאשר בחנו את השינוי באמצעות ציטומטריית זרימה, חלה עלייה של פי 1.482 במצב הטיפול ב-LPS שנקבע כמשמעותי (t=7.843, df=10; p<0.0001). באמצעות ANOVA דו-כיווני להשוואת השיטות, נקבע שיש השפעה משמעותית של הטיפול (F(1,15)=45.21,p<0.0001), אך לא השיטה (F(1,15)=0.05545, p=0.8697) או אינטראקציה (F(1,15)=0.02785, p=0.8697). בנוסף, אנו מוודאים כאן כי אין שינוי ברמות H3 של היסטון הן על ידי כתם מערבי והן על ידי ציטומטריית זרימה מכיוון ש- ANOVA דו-כיווני לא הראה השפעה משמעותית של הטיפול ב- LPS (F(1,7)=0.02170,p=0.8870), השיטה (F(1,7)=0.01191, p=0.9162) או האינטראקציה (F(1,7=0.01191, p=0.9162; איור 6B). כתמים לדוגמה והזזות היסטוגרמה עבור נתונים אלה מוצגים גם כן (איור 6C,D).
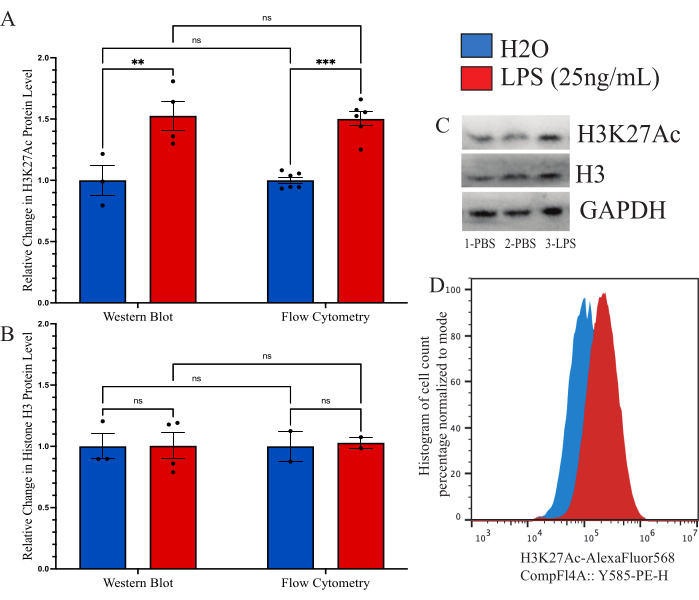
איור 6: השוואת שיטות לכימות שינוי ההיסטון העולמי בין ציטומטריית זרימה לכתם מערבי. (A) תאי BV2 מטופלים בליפופוליסכריד 25 ננוגרם/מ"ל (LPS) או H2O במשך 24 שעות לפני הניתוח. עוצמת הפלואורסצנט של H3K27Ac מתוארת כשינוי קיפול לבקרת הרכב, מלח חוצץ פוספט (PBS), הן עבור ציטומטריית זרימה והן עבור כתם מערבי. ANOVA דו-כיווני גילה השפעה משמעותית של הטיפול ב-LPS (F(1,15)=45.21, p<0.0001), אך לא השיטה (F(1,15)=0.05545, p=0.8697) או אינטראקציה (F(1,15)=0.02785, p=0.8697). התיקון של טוקי לבדיקת השערות מרובות הוחל על השאריות. * מציג 0.0332, ** מציג 0.0021. (B) עוצמת הפלואורסצנטיות של היסטון H3 מתוארת כשינוי קיפול ל-PBS הן עבור ציטומטריית זרימה והן עבור כתם מערבי. ANOVA הדו-כיווני לא גילה השפעה משמעותית של הטיפול ב- LPS (F(1,7)=0.02170, p=0.8870) או השיטה (F(1,7)=0.01191, p=0.9162) או האינטראקציה (F(1,7=0.01191, p=0.9162). (C) כתמים לדוגמה ו-(D) שינויי ציטומטריה של זרימה מתוארים. גודל ההיסטוגרמה מנורמל לאחוזים בהתבסס על מספר התאים הנמצאים במצב עוצמת פלואורסצנטי. גרף עמודות מתאר את ממוצע SEM. n = 2 ניסויים עצמאיים, 2 לכל תנאי לכל ניסוי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
בסך הכל, תוצאות אלה מראות כי טכניקה זו יכולה לשמש כדי להעריך כמותית את רמות HPTM העולמי במיקרוגליה מבודדת. בנוסף, השיטה הוכחה כדומה לטכניקות קודמות אך דורשת קלט תאים נמוך בהרבה. בנוסף, למרות שלא הוצג, עם פיצוי הולם, ניתן להשתמש בטכניקה הנוכחית עם נוגדנים מרובים באותו פאנל המעריך HPTM שונים.
קובץ משלים S1: קבצי ניתוח לדוגמה. קובץ זה מכיל קובץ ניתוח wsp ו-7 קבצי fcs כולל ללא כתם, P2RY12FMO, 568FMO, שני בעלי חיים שטופלו ב-PBS ושני בעלי חיים שטופלו ב-LPS מוכתמים ב-H3K27Ac. מטרת הקובץ הזה היא להדגים את הניתוח וההסתבכות על ניסוי שיכול לתאר איך נראה ניסוי מוצלח. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים S2: נתוני בידוד. הקובץ המצורף מכיל את הנתונים הרלוונטיים לאחר מיון מיקרוגליה, המכיל את תפוקת המיקרוגליה והרנ"א מהפרוטוקול המתואר. אנא לחץ כאן כדי להוריד קובץ זה.
| אוכלוסייה מגודרת | תדירות ההורה | תדירות סה"כ | מנה |
| S1 | 89.00% | 89.00% | 25672 |
| S2>S1 | 88.73% | 78.97% | 22779 |
| APC+ > S2 > S1 | 76.61% | 60.50% | 17452 |
| 610+ > APC+ > S2 > S1 | 99.56% | 60.24% | 17376 |
טבלה 2: תרשים שושלת לדוגמה לדוגמה מתאר אחוזים ומספרי אירועים הדרושים לזיהוי מדויק של חלבונים.
Discussion
הפרוטוקול המוצג מאפשר הערכה כמותית של רמות HPTM גלובליות באמצעות ציטומטריית זרימה. בעוד פרוטוקול זה מציג שיטה חדשנית, מחקרים קודמים ביצעו הערכה כמותית של חלבונים בגישה דומה26. שיטות קודמות ששימשו להערכת רמות HPTM גלובליות כוללות אימונוהיסטוכימיה וכתם מערבי 16,17,19,20. השיטה המבוססת על ציטומטריית זרימה המוצגת היא שיטה הניתנת לכימות בקלות, בעוד שהכתם המערבי והאימונוהיסטוכימיה הם כמותיים למחצה ובעלי תפוקה נמוכה יותר. הכתם המערבי מסתמך על ליזה של התא ולכן דורש גם נורמליזציה של חלבונים וגם חלבון בקרת העמסה שמניחים שהוא ללא שינוי בתנאי הניסוי27. אימונוהיסטוכימיה היא כמותית למחצה ותפוקה נמוכה מאוד מכיוון שקשה להעריך כמותית את כמות החלבון מבלי לבחון ברמת תא בודד16. באופן דומה, עבור מיקרוגליה מבודדת, יש יתרון לשימוש בשיטת ציטומטריית זרימה בשל התפוקה המוגבלת מכיוון שכתם מערבי דורש קלט חלבון גדול בהרבה19. דרישות מספר התאים הנמוך מאפשרות להפעיל לוחות צביעה מרובים מאותה חיה.
עם זאת, כמו בכל שיטה אחרת, ישנן מגבלות לטכניקה זו כולל עלות נוגדנים וזמינות, שכן לא כל הנוגדנים פועלים היטב בהגדרת ציטומטריית זרימה. בנוסף, בהשוואה לאימונובלוט, ריכוז הנוגדנים הנדרש גבוה בהרבה. בעוד ריבוב מאפשר שימוש בנוגדנים מרובים על אותו פאנל של תאים, לא ניתן להסיר את התאים מהנוגדן לאחר הניתוח, ובכך להגביל את השימוש בתאים לאחד לכל מין נוגדנים. זה שונה מאימונובלוט שבו ניתן להשתמש באותו כתם שוב ושוב. עם זאת, בהתאם לזמינות הנוגדנים ומספר ערוצי הגילוי על ציטומטר, ניתן יהיה לבחון עד תריסר סימנים בו זמנית.
השיטה הנוכחית לוכדת רק את הרמות העולמיות של ביטוי חלבונים ולא את המיקום הגנומי הספציפי, ושינויים ברמות העולמיות עשויים שלא לשקף שינויים באתרים גנומיים בודדים. באופן דומה, היעדר שינוי ברמות העולמיות לא אומר שאין שינויים באתרים גנומיים, אלא פשוט שהשינויים הגלובליים מסתכמים בכך שאין הבדלים בין הטיפולים. ככזו, טכניקה זו נועדה לשמש כמסך לזיהוי HPTM בעלי עניין לניתוח גנומי. בנוסף, שיטה זו אינה מאפשרת השוואה בין סימני חלבון שונים למעט כאשר היא מוערכת כשינוי קיפול לשליטה. לכן, זה מוגבל בהשוואה לשיטה סטנדרטית מבוססת עקומה כגון ELISA לקביעת חלבונים.
הפרוטוקול שהוצג מציע אסטרטגיה לבידוד תאי מיקרוגליה חיים במוח. פרוטוקול זה מסתמך על ביטוי חלבון P2RY12 לבידוד מיקרוגליה. עם זאת, P2RY12 הוא סמן הומיאוסטטי במיקרוגליה וניתן להפחית אותו במודלים של מחלות, כגון 5XFAD22. לכן, בעת שימוש בחיית מודל מחלה הקפד לבחור חלבוני סמן אחרים כגון TMEM119, CD11b או CD45 כדי לסייע בבידוד של מיקרוגליה23. באופן דומה, אנו מציגים את הפרוטוקול הזה כבידוד מההיפוקמפוס ו/או מקליפת המוח. פרוטוקול זה יפעל לבודד מיקרוגליה מאזורי מוח אחרים, כולל אזורי חומר לבן, אולם בעלי חיים רבים עשויים להידרש להשיג מספיק מיקרוגליה בהתאם לגודל האזורים המעניינים.
הפרוטוקול המוצג יכול לבודד תאי מיקרוגליה חיים במוח, אך ישנם מספר שלבים, המתוארים להלן, בשלב הבידוד שיכולים להפחית את תפוקת התאים אם הם מבוצעים בצורה שגויה.
זילוח לפרוטוקול זה גורם לאחוז גבוה יותר של מיקרוגליה במקטע המועשר במערכת החיסון, מה שיפחית את משך הזמן במיון. עם זאת, זילוח אינו נדרש, ושיטות אחרות של המתת חסד ניתן להשתמש במידת הצורך.
במהלך בידוד מיקרוגליה, המיאלין צריך להיות מוסר לחלוטין. ציטומטרים של זרימה מסתמכים על כך שתאים מסוגלים לנוע דרך צינורות צרים בקצב מהיר. בשל צמיגותו ונטייתו לגוש, המיאלין גורם לבעיות עם ציטומטרים, לעתים קרובות גורם לסתימות אשר יכולות גם לפגוע בציוד וגם להרוס את הדגימה, מה שמקטין את התשואה באופן דרסטי. היזהר להסיר את כל המיאלין במהלך איסוף של שברים מועשרים במערכת החיסון כדי למנוע בעיות במורד הזרם.
צביעת פלטות לעומת צביעת צינורות: בפרוטוקול זה תיארנו שתי אפשרויות להכתמת תאים בצינורות של 1.5 מ"ל או בצלחת באר 96. מקרה השימוש עבור כל אחד מהם תלוי בניסוי; עם זאת, באופן כללי, צביעת צינור היא סיכון נמוך יותר להשפעה על התשואה מאשר צביעת פלטות, שכן הפליק מסתכן באובדן תאים אם נעשה בצורה לא נכונה. צביעת הצלחת מהירה הרבה יותר מכיוון ששאיפת הסופרנאטנט עבור כל צינור גוזלת זמן. לפני הקיבוע (למיון וכו'), השתמשו בצביעת צינור כדי למקסם את התשואה ולהפחית את הסיכון לאובדן. עם זאת, עבור ניתוח HPTM, ברגע שהתאים קבועים לצביעה תוך גרעינית, הגלולה יציבה יותר, ויש סיכון מופחת לאובדן עם הבהוב.
קביעת שיפוע הצפיפות הבלתי רציף: בעת קביעת השכבות, הגדרת השכבות כראוי חיונית לקבלת החלק המועשר במערכת החיסון. אם השכבות מופרעות או מעורבבות ונראות עכורות, התאים לא ימוינו למיקומם הרצוי, ויהיה קושי להשיג את מקטע התאים המועשר במערכת החיסון. אם זה קורה, ספין עם מדיום הצפיפות כדי להסיר מיאלין ולאחר מכן לאסוף את כל השברים הנותרים, לדלל עם 3 מ"ל של חיץ FACS ל 1 מ"ל של צפיפות בינונית ולערבב היטב (זה ידרוש צינורות מרובים). סובב ב 500 x גרם במשך 10 דקות עם הבלם על 0. השליכו את הסופרנטנט, והשאירו רק ~ 300 מיקרוליטר תמיסה. אספו את כל הדגימה והכתם. זה יניב באחוזי מיון מופחתים ובכמות זמן גבוהה יותר בציטומטר, אך עדיין ניתן להשוות את התשואה.
בעת שימוש בשיטת הבידוד, מועיל להיות מסוגל לאסוף תאים עבור RNA ועבור הערכת HPTM מאותו מוח עכבר. במצב זה, לאחר מיון תאי המיקרוגליה החיים, ניתן לחלק את התאים כדי להקצות חלק להערכת RNA (מספר קלט מינימלי של תאים לקבלת תפוקת RNA סבירה הוא 75,000 תאים) וחלק לניתוח ציטומטריית זרימה נוספת (מינימום 10,000 תאים לבאר לקביעה טובה של MFI). במקרה זה, נדרש מיון ציטומטר זרימה. עם זאת, כאשר מתכננים להשתמש רק בתאים לניתוח HPTM, אין צורך במיון, וניתן להכתים את החלק החיסוני בנוגדן P2RY12 ובנוגדן HPTM. לאחר מכן ניתן להגדיר Gating על הציטומטר עבור מיקרוגליה P2RY12+, כפי שנעשה עבור מיון זרימה, לנתח רק אות HPTM בתוך מיקרוגליה. ביטול המיון מאפשר לפרוטוקול להיות מהיר וחסכוני יותר. נוסף על כך, אם מעריכים HPTM מתאים בתרבית, די להתחיל בפרוטוקול הצביעה ואין צורך בנוגדנים לסמן התא כפי שמודגם באיור 6. פרוטוקול הערכת HPTM יכול לשמש עבור סוגי תאים רבים, כולל תאים בתרבית, תאים ראשוניים ותאים הנגזרים מ- IPSC.
לבסוף, בעוד שהצגנו רק שני שימושים פוטנציאליים של מיקרוגליה במורד זרם הבידוד, ישנם רבים אחרים כולל טכניקות אפיגנטיות כגון ChIP, CUT&Tag ו- CUT&RUN. במקרה של טכניקות אפיגנטיות גנומיות, שבהן אפיון שינויים במוקדים ספציפיים הוא עניין, בחר מעכבים ספציפיים עבור כותבים ומחקים של סימני כרומטין11 המותאמים לניסויים כדי להבטיח שכל השינויים האפיגנטיים במיקרוגליה שצוינו אינם ממצאים טכניים מכל שלב בתהליך הבידוד כגון עיכול אנזימטי. בעת הערכת שינויים ברמות גלובליות של סימנים אפיגנטיים, כגון באמצעות ציטומטריית זרימה כמותית, כל השינויים הנגרמים על ידי הליך אינם צפויים להיות גדולים כל כך שהם מזוהים ברמה העולמית.
בסך הכל, השיטות הנדונות מספקות שיטה חדשנית של תא בודד לכימות רמות גלובליות של שינויים בהיסטון ושינויים אפיגנטיים אחרים על ידי ציטומטריית זרימה. הדגמנו כי שיטה זו רגישה מספיק כדי לזהות שינויים גלובליים בסמן המשפר H3K27ac במיקרוגליה בתגובה ל- LPS in vivo. זה עולה בקנה אחד עם ריצוף ChIP קודם של H3K27ac בעקבות גירוי LPS המראה שיפוץ דרמטי של משפרים המגיבים LPS28. יישומים של שיטה זו יאפשרו לבחון שינויים אפיגנטיים גלובליים על פני סוגים שונים של תאי מוח בהתפתחות ובמחלות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
תודה ל-Yanyang Bai על העזרה עם האימונובלוט באיור 5. עבודה זו נתמכה על ידי המכונים הקנדיים לחקר הבריאות [CRC-RS 950-232402 to AC]; מועצת המחקר למדעי הטבע וההנדסה של קנדה [RGPIN-2019-04450, DGECR-2019-00069 ל- AC]; Scottish Rite Charitable Foundation [21103 to AC] ו-Brain Canada Foundation [AWD-023132 to AC]; מלגת בוגר אבוריג'יני של אוניברסיטת קולומביה הבריטית (6481 עד MT); מלגת בוגר קולומביה הבריטית (6768 ל- MT); פרס Canadian Open Neuroscience Platform Student Scholar Award (10901 ל-JK); מלגת ארבע שנים לדוקטורט באוניברסיטת קולומביה הבריטית (6569 ל-JK). למממנים לא היה כל תפקיד בעיצוב המחקר, באיסוף הנתונים ובניתוחם, בהחלטה על פרסומם או בהכנת כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5M EDTA | Invitrogen | AM9260G | |
| 15 mL Falcon Centrifuge Tubes, Polypropylene, Sterile | Falcon | 352196 | |
| 24-well Clear Not Treated Plates | Costar | 3738 | |
| 2-Mercaptoethanol | Gibco | 21985023 | |
| 96 Well Clear Polystyrene Microplate, clear round bottom, non treated surface | Corning | 3788 | |
| Acetyl Histone 3 K9 (C5B11) | Cell Signalling Technology | 9649S | Dilution: 1:100 |
| Acetyl Histone H4 K8 (2594) | Cell Signalling Technology | 2594S | Dilution: 1:100 |
| Acetyl-Histone H3 K27 (D5E4) | Cell Signalling Technology | 8173S | Dilution: 1:100 |
| Acetyl-Histone H3 Lys27 (MA523516) | Invitrogen | MA523516 | Dilution: 1:100 |
| Actinomycin D | New England Biolabs | 15021S | |
| Anisomycin | New England Biolabs | 2222S | |
| Anti-Histone H3 (tri methyl K4) | Abcam | ab213224 | Dilution: 1:100 |
| Anti-Lactyl-Histone H4 (Lys 12) Rabbit mAb | PTM Biolabs | PTM-1411RM | Dilution: 1:250 |
| Anti-L-Lactyllysine Rabbit pAb | PRM Biolabs | PTM-1401RM | Dilution: 1:250 |
| Apc anti-P2RY12 Antibody, Clone: S16007D | BioLegend | 848006 | |
| BSA | Tocris | 5217 | |
| Cyto-Last Buffer | BioLegend | 422501 | |
| dimethylsulfoxide, sterile | Cell Signalling Technology | 12611S | |
| DNAse I | STEMCELL Technologies | 07900 | |
| Donkey Anti Mouse AlexaFluor488 | Jackson ImmunoResearch | 715-546-150 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor488 | ABclonal | AS035 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor568 | Invitrogen | A10042 | Dilution: 1:500 |
| Donkey Anti Rabbit Brilliant Violet 421 | BioLegend | 406410 | Dilution: 1:500 |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisherbrand | 13-711-9AM | |
| Fisherbrand Disposable PES Filter Unit, 250mL | Fisherbrand | FB12566502 | |
| H3K18ac Polyclonal Antibody | Invitrogen | 720095 | Dilution: 1:100 |
| HBSS (10X), no calcium, no magnesium, no phenol red | Gibco | 14185052 | |
| HBSS, no calcium, no magnesium, no phenol red | Gibco | 14175103 | |
| Histone 3 Trimethyl K27 (ab6002) | Abcam | ab6002 | Dilution: 1:100 |
| KONTES Dounce Tissue Grinders 125mm 7mL | VWR | 885300-0007 | |
| Lactyl-Histone H3 (Lys 18) Rabbit mAb | PTM BIolabs | PTM-1406RM | Dilution: 1:250 |
| Lipopolysacharide | Sigma-Aldrich | L5418 | |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-121 | |
| OneComp eBeads Compensation Beads | Invitrogen | 01-1111-41 | |
| PDS Kit, Papain Vial - Worthington Biochemical | Cedarlane | LK003178 | |
| Percoll | Sigma-Aldrich | GE17-0891-02 | |
| Phenol Red | VWR | RC57004 | |
| QIAshredder | Qiagen | 79656 | |
| Rainbow Fluorescent Particles, 1 peak (3.0-3.4 uM - Mid Range Intensity | BioLegend | 422905 | |
| RNase-free Microfuge Tubes, 1.5 mL | Invitrogen | AM12400 | |
| Rneasy Plus Micro Kit | Qiagen | 74034 | |
| Round Bottom Polypropylene Tubes with Caps, 5 mL | Corning | 352063 | |
| Triptolide | New England Biolabs | 97539 | |
| True Nuclear Transcription Factor Buffer Set | BioLegend | 424401 | |
| TruStain FcX PLUS (anti-mouse CD16/32) Antibody | BioLegend | 156604 | |
| Trypan Blue | VWR | 97063-702 | |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 |
References
- Miller, J. L., Grant, P. A. The Role of DNA Methylation and Histone Modifications in Transcriptional Regulation in Humans. Epigenetics: Development and Disease. 61, 289-317 (2013).
- Kouzarides, T. Chromatin Modifications and Their Function. Cell. 128 (4), 693-705 (2007).
- Bannister, A. J., Kouzarides, T. Regulation of chromatin by histone modifications. Cell Research. 21 (3), 381-395 (2011).
- Barski, A., et al. High-resolution profiling of histone methylations in the human genome. Cell. 129 (4), 823-837 (2007).
- Vogel Ciernia, A., LaSalle, J. The landscape of DNA methylation amid a perfect storm of autism aetiologies. Nature Reviews. Neuroscience. 17 (7), 411-423 (2016).
- Keiser, A. A., et al. Systemic HDAC3 inhibition ameliorates impairments in synaptic plasticity caused by simulated galactic cosmic radiation exposure in male mice. Neurobiology of Learning and Memory. 178, 107367 (2021).
- McQuown, S. C., et al. HDAC3 is a critical negative regulator of long-term memory formation. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31 (2), 764-774 (2011).
- Barrett, R. M., et al. Hippocampal Focal Knockout of CBP Affects Specific Histone Modifications, Long-Term Potentiation, and Long-Term Memory. Neuropsychopharmacology. 36 (8), 1545-1556 (2011).
- Datta, M., et al. Histone Deacetylases 1 and 2 Regulate Microglia Function during Development, Homeostasis, and Neurodegeneration in a Context-Dependent Manner. Immunity. 48 (3), 514.e6-529.e6 (2018).
- Belhocine, S., et al. Context-dependent transcriptional regulation of microglial proliferation. Glia. 70 (3), 572-589 (2022).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science (New York, N.Y.). 356 (6344), eaal3222 (2017).
- Kettenmann, H., Hanisch, U. -. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiological Reviews. 91 (2), 461-553 (2011).
- Sullivan, O., Ciernia, A. V. Work hard, play hard: how sexually differentiated microglia work to shape social play and reproductive behavior. Frontiers in Behavioral Neuroscience. 16, 989011 (2022).
- Das, P. M., Ramachandran, K., vanWert, J., Singal, R. Chromatin immunoprecipitation assay. BioTechniques. 37 (6), 961-969 (2004).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. North American Journal of Medical Sciences. 4 (9), 429-434 (2012).
- Crowe, A., Yue, W. Semi-quantitative Determination of Protein Expression Using Immunohistochemistry Staining and Analysis: An Integrated Protocol. BIO-PROTOCOL. 9 (24), (2019).
- Seligson, D. B., et al. Global histone modification patterns predict risk of prostate cancer recurrence. Nature. 435 (7046), 1262-1266 (2005).
- Liu, B., et al. Global Histone Modification Patterns as Prognostic Markers to Classify Glioma Patients. Cancer Epidemiology, Biomarkers & Prevention. 19 (11), 2888-2896 (2010).
- Pan, R. Y., et al. Positive feedback regulation of microglial glucose metabolism by histone H4 lysine 12 lactylation in Alzheimer's disease. Cell Metabolism. 34 (4), 634.e6-648.e6 (2022).
- Zhang, D., et al. Metabolic regulation of gene expression by histone lactylation. Nature. 574 (7779), 575-580 (2019).
- Pösel, C., Möller, K., Boltze, J., Wagner, D. C., Weise, G. Isolation and Flow Cytometric Analysis of Immune Cells from the Ischemic Mouse Brain. Journal of Visualized Experiments. (108), 53658 (2016).
- Oblak, A. L., et al. Comprehensive Evaluation of the 5XFAD Mouse Model for Preclinical Testing Applications: A MODEL-AD Study. Frontiers in Aging Neuroscience. 13, 713726 (2021).
- Bohlen, C. J., Bennett, F. C., Bennett, M. L. Isolation and Culture of Microglia. Current Protocols in Immunology. 125 (1), e70 (2019).
- McKinnon, K. M. Multiparameter Conventional Flow Cytometry. Flow Cytometry Protocols. 1678, 139-150 (2018).
- Marsh, S. E., et al. Dissection of artifactual and confounding glial signatures by single-cell sequencing of mouse and human brain. Nature Neuroscience. 25 (3), 306-316 (2022).
- Wang, L., Gaigalas, A. K., Marti, G., Abbasi, F., Hoffman, R. A. Toward quantitative fluorescence measurements with multicolor flow cytometry. Cytometry Part A. 73A (4), 279-288 (2008).
- Rumbaugh, G., Miller, C. A. Epigenetic changes in the brain: measuring global histone modifications. Methods in Molecular Biology (Clifton, N.J). 670, 263-274 (2011).
- Xavier, A. M., et al. Systematic delineation of signaling and epigenomic mechanisms underlying microglia inflammatory activity in acute and chronic brain pathologies. BioRvix. , (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved