Saggi indipendenti dall'ossigeno per misurare la funzione mitocondriale nei mammiferi
In This Article
Summary
Qui, presentiamo una raccolta di saggi per misurare direttamente la funzione mitocondriale nelle cellule di mammifero indipendentemente dalla loro capacità di consumare ossigeno molecolare.
Abstract
Il flusso di elettroni nella catena di trasporto degli elettroni mitocondriali (ETC) supporta funzioni biosintetiche, bioenergetiche e di segnalazione multiformi nelle cellule di mammifero. Poiché l'ossigeno (O 2) è l'accettore di elettroni terminale più diffuso per l'ETC dei mammiferi, il tasso di consumo di O2 viene spesso utilizzato come proxy per la funzione mitocondriale. Tuttavia, la ricerca emergente dimostra che questo parametro non è sempre indicativo della funzione mitocondriale, poiché il fumarato può essere impiegato come accettore di elettroni alternativo per sostenere le funzioni mitocondriali nell'ipossia. Questo articolo compila una serie di protocolli che consentono ai ricercatori di misurare la funzione mitocondriale indipendentemente dal tasso di consumo di O2. Questi test sono particolarmente utili quando si studia la funzione mitocondriale in ambienti ipossici. In particolare, descriviamo metodi per misurare la produzione mitocondriale di ATP, la biosintesi de novo delle pirimidine, l'ossidazione del NADH da parte del complesso I e la produzione di superossido. In combinazione con i classici esperimenti di respirometria, questi saggi ortogonali ed economici forniranno ai ricercatori una valutazione più completa della funzione mitocondriale nel loro sistema di interesse.
Introduction
La funzione mitocondriale è una metrica critica della salute cellulare, in quanto sostiene le principali funzioni biosintetiche, bioenergetiche e di segnalazione nelle cellule di mammifero1. La stragrande maggioranza delle funzioni mitocondriali richiede il flusso di elettroni attraverso la catena di trasporto degli elettroni (ETC) e le interruzioni del flusso di elettroni nell'ETC causano gravi malattie mitocondriali2. L'ETC è composto da una serie di reazioni di riduzione e ossidazione (redox) che sono incorporate nella membrana mitocondriale interna e queste reazioni di trasferimento di elettroni rilasciano energia libera che può essere sfruttata per supportare la sintesi di ATP, processi fisiologici come la termogenesi, vie biosintetiche come la biosintesi de novo delle pirimidine e l'equilibrio dello stato redox di co-fattori come il NADH. I complessi I e III di ETC producono specie reattive dell'ossigeno (ROS)3,4,5, che, a loro volta, regolano le vie chiave di segnalazione come HIF, PI3K, NRF2, NFκB e MAPK 6. Di conseguenza, le metriche del flusso di elettroni nell'ETC sono classicamente utilizzate come proxy per la funzione mitocondriale nelle cellule di mammifero.
Gli esperimenti di respirometria sono frequentemente impiegati per misurare la funzione mitocondriale nelle cellule di mammifero. Poiché O2 è l'accettore di elettroni terminale più diffuso per l'ETC dei mammiferi, la sua riduzione viene utilizzata come proxy per la funzione mitocondriale. Tuttavia, prove emergenti dimostrano che i mitocondri dei mammiferi possono impiegare il fumarato come accettore di elettroni per sostenere le funzioni mitocondriali che dipendono dall'ETC, tra cui la biosintesi de novo della pirimidina 7, l'ossidazione del NADH7 e la disintossicazione dell'idrogeno solforato8. Pertanto, in alcuni contesti, specialmente in ambienti ipossici, le misurazioni del tasso di consumo di O2 (OCR) non forniscono un'indicazione precisa o accurata della funzione mitocondriale.
Qui, delineiamo una serie di saggi che possono essere impiegati per misurare la funzione mitocondriale indipendentemente dall'OCR. Forniamo saggi per misurare direttamente l'ossidazione complessa del NADH I-mediata, la biosintesi de novo pirimidina mediata dalla diidroorotato deidrogenasi, la sintesi complessa di ATP V-dipendente, la direzionalità netta del complesso succinato deidrogenasi (SDH) e i ROS derivati dai mitocondri. Questi test sono pensati per essere eseguiti su cellule di mammifero in coltura, anche se molti possono essere adattati per studiare le funzioni mitocondriali in vivo. In particolare, i saggi descritti in questo protocollo sono misurazioni più dirette delle funzioni mitocondriali rispetto all'OCR. Inoltre, consentono la misurazione della funzione mitocondriale nell'ipossia, un contesto in cui l'OCR non è una misurazione indicativa. Nel loro insieme, questi test, in combinazione con i classici esperimenti di respirometria, forniranno ai ricercatori una valutazione più completa della funzione mitocondriale nelle cellule di mammifero.
Protocol
1. Saggi di proliferazione per misurare l'attività del complesso I, della diidroorotato deidrogenasi (DHODH) e del complesso V
- Cellule di semina per saggi di proliferazione
NOTA: Questo protocollo utilizza la linea cellulare di osteosarcoma umano 143B acquistata commercialmente da ATCC. Questa linea cellulare è stata utilizzata secondo le linee guida del nostro protocollo approvato dal Comitato istituzionale per la biosicurezza (IBC).- Rimuovere le piastre dall'incubatore di coltura tissutale. Aspirare il mezzo dalle piastre e lavare con 1x soluzione salina tamponata con fosfato (PBS) per rimuovere eventuali residui di terreno. Aspirare il PBS e coprire il piatto con tripsina 0,05%-0,25% per sollevare le cellule dal fondo della piastra.
- Attendere 3-5 minuti affinché la tripsina rilasci le cellule dalla piastra, quindi spegnere la tripsina con 10 ml del terreno di crescita desiderato contenente il 10% di siero bovino fetale (FBS).
- Raccogliere le celle in un tubo conico e centrifugare a 1.000 × g per 5 minuti per pellettare le cellule.
- Aspirare il mezzo dal tubo senza disturbare il pellet. Risospendere il pellet con mezzo completo.
- Contare le cellule e quantificare il volume necessario per seminare tra 10.000 e 25.000 cellule in una piastra a 6 pozzetti.
NOTA: Ogni linea cellulare dovrà essere ottimizzata per il numero di cellule da seminare. La confluenza ideale raggiunta è ~10% all'inizio dell'esperimento e ~80% alla fine dell'esperimento. - Pipettare le celle in una piastra a 6 pozzetti e aggiungere 2 ml di mezzo completo ai pozzetti. Lasciare riposare per 24 ore prima di passare alle condizioni sperimentali del mezzo.
NOTA: seminare almeno tre repliche per condizione e abbastanza pozzetti per testare la condizione di controllo non trattata, la condizione di controllo trattata con inibitore, la condizione sperimentale non trattata e la condizione sperimentale trattata con inibitore.
- Variazione media per valutare l'attività V complessa per proliferazione
NOTA: Le cellule che proliferano in un mezzo con galattosio dipendono dall'attività V complessa per la sintesi di ATP 9,10. A differenza del glucosio, che produce due ATP netti dalla glicolisi, il galattosio non ne produce, costringendo le cellule a dipendere dal complesso V per la sintesi di ATP (Figura 1). Il complesso inibitore V oligomicina è usato come controllo.- Produrre 10 mM di terreno contenente glucosio (vedere Tabella 1).
- Produrre un mezzo contenente galattosio da 10 mM (vedere Tabella 1).
- Cambiare il mezzo in ciascun pozzetto in DMEM contenente glucosio o DMEM contenente galattosio. Aggiungere 5 μM di oligomicina (l'inibitore del complesso V) ai pozzetti pertinenti e lo stesso volume di DMSO ai pozzetti non trattati. Lo stock di oligomicina è 10 mM risospeso in DMSO. Rimettere la piastra nell'incubatore di coltura tissutale per 2 giorni.
- Variazione media per valutare l'attività complessa I per proliferazione
NOTA: Le cellule che proliferano in un mezzo privo di piruvato dipendono maggiormente dall'attività del complesso I11,12. Senza piruvato, le cellule in coltura richiedono il complesso I per facilitare la maggior parte della riossidazione del NADH a NAD+ (Figura 2). Il complesso I inibitore rotenone è usato come controllo.- Rendere il mezzo DMEM privo di piruvato integrato con 10% FBS e 1% penicillina-streptomicina.
- Fare una soluzione 1 M di piruvato (vedi Tabella 1).
- Cambiare il mezzo in ciascun pozzetto in un mezzo privo di piruvato o in un mezzo contenente piruvato. Aggiungere 2 μM di rotenone (l'inibitore del complesso I) ai pozzetti trattati e lo stesso volume di DMSO ai pozzetti non trattati. Lo stock di rotenone è 25 mM risospeso in DMSO. Rimettere la piastra nell'incubatore di coltura tissutale per 2 giorni.
- Variazione media per valutare l'attività del DHODH per proliferazione
NOTA: Le cellule che proliferano in un mezzo privo di uridina richiedono attività diidroorotato deidrogenasi (DHODH) 11,12,13. In assenza di uridina esogena, le cellule in coltura sintetizzano pirimidine attraverso la via de novo. L'inibitore DHODH brequinar è usato come controllo.- Rendere il DMEM senza uridina integrato con 10% FBS e 1% penicillina-streptomicina.
- Preparare una soluzione madre di uridina da 10 mg/ml, quindi preparare un mezzo di uridina da 100 μg/ml (vedere Tabella 1).
- Cambiare il mezzo in ciascun pozzetto in mezzo privo di uridina o mezzo contenente uridina. Aggiungere 5 μM brequinar (l'inibitore DHODH) ai pozzetti trattati e lo stesso volume di DMSO ai pozzetti non trattati. Lo stock brequinare è 10 mM risospeso in DMSO. Rimettere la piastra nell'incubatore di coltura tissutale per 2 giorni.
- Conteggio delle cellule per i saggi di proliferazione
- Per tutti gli esperimenti, ricostituire il mezzo ogni 2 giorni. Se il mezzo diventa di colore giallo, aumentare la frequenza dei cambiamenti del mezzo. Consentire alle cellule di proliferare per un massimo di 7 giorni e interrompere l'esperimento se uno qualsiasi dei pozzi inizia a sembrare troppo cresciuto. I pozzi sono considerati ricoperti di vegetazione quando la confluenza supera l'80%.
- Aspirare il mezzo, lavare con 1x PBS e coprire il fondo del pozzetto con tripsina allo 0,25% (500 μL per un piatto a 6 pozzetti).
- Attendere 5 minuti fino a quando le celle non si sono sollevate dal piatto. Controllare questo al microscopio.
- Spegnere la tripsina con 1 mL di DMEM completo contenente il 10% di FBS.
- Pipetta su e giù per rompere i grumi cellulari.
- Preparare le controtazze Coulter riempiendo ciascuna con 10 ml di tampone isotonico (una tazza per pozzetto). Contare le celle su un contatore di celle e registrare i dati. Se la lettura è di celle per millilitro (celle/ml), moltiplicare il valore registrato per 1,5 per ottenere il numero totale di celle per pozzetto.
NOTA: Altri metodi di conteggio delle cellule come un emocitometro saranno sufficienti se il laboratorio non dispone di un contatore di Coulter.
2. 13C 4-Aspartato tracciatura isotopica stabile e analisi LC-MS per misurare l'attività DHODH
- 13Tracciamento isotopico stabile C 4-aspartato in cellule aderenti
NOTA: L'attività del DHODH può essere monitorata direttamente misurando l'incorporazione di 13 C 4-aspartato in 13C3-UMP. Brequinar è usato come controllo per l'attività DHODH (Figura 3). I livelli risultanti di 13C3-UMP sono una misura dell'attività DHODH.- Semina tra 250.000 e 500.000 cellule in un piatto a 6 pozzetti per ottenere il 75% di confluenza il giorno successivo.
- Preparare una soluzione madre di 250 mM 13 C 4-aspartato e 10 mM 13C4-aspartato terreno (vedere Tabella 1).
- Cambiare il mezzo in ciascun pozzetto con un mezzo contenente 10 mM 13C 4-aspartato. Incubare per il numero appropriato di ore per ottenere uno stato stazionario per l'etichettatura delle celle di interesse.
NOTA: Lo stato stazionario è definito come l'intervallo di tempo in cui la percentuale di metaboliti etichettati si stabilizza nel tempo14. Per le cellule di osteosarcoma 143B, 13C 4-aspartato raggiunge uno stato stazionario entro 8 ore. È buona norma determinare questo lasso di tempo prima della sperimentazione facendo un esperimento nel corso del tempo con l'isotopo stabile di interesse.
- Isolamento del metabolita dalle cellule aderenti
- Prima di iniziare, preparare un secchio di ghiaccio secco e preparare MeOH di grado HPLC all'80% in acqua di grado HPLC. Raffreddare questo tampone in un congelatore a -80 °C per una notte o metterlo direttamente sul ghiaccio secco.
- Prelevare una piastra alla volta dall'incubatore, aspirare il mezzo dai pozzetti e lavare 2x con 1x PBS. Rimuovere tutto il PBS residuo dai pozzetti prima di passare alla fase successiva.
NOTA: Assicurarsi di inclinare la piastra durante l'aspirazione e la pipetta contro la parete del piatto per evitare la rottura delle celle aderenti. - Posizionare la piastra su ghiaccio secco e aggiungere immediatamente 800 μL di MeOH di grado LCMS all'80% in acqua di grado LCMS al 20% in ciascun pozzetto.
- Incubare la piastra per almeno 15 minuti in un congelatore a -80 °C per facilitare la lisi cellulare.
NOTA: A questo punto, la piastra successiva può essere estratta dall'incubatore e i passaggi 2.2.1-2.2.4 ripetuti. Continuare fino a quando tutte le piastre sono in incubazione nel congelatore a -80 °C. - Prelevando una piastra alla volta dal congelatore, raschiare ogni pozzetto sul ghiaccio secco usando un sollevatore di celle e trasferire il lisato in una provetta da microcentrifuga da 1,5 ml. Tenere il tubo su ghiaccio asciutto fino al passaggio successivo.
- Vortice tutti i tubi per 10 minuti a 4 °C, quindi centrifugare a 4 °C per 10 minuti alla massima velocità (almeno 17.000 × g).
- Trasferire il surnatante in una provetta da microcentrifuga da 1,5 mL e asciugarlo in un concentratore a vuoto da 4 °C dotato di una trappola fredda a -105 °C su una regolazione ad alto vuoto per circa 6 ore o fino a quando i campioni non sono evaporati. Una volta asciugato il lisato, conservare i pellet di metabolita a -80 °C fino al momento di prepararli per la cromatografia liquida abbinata alla spettrometria di massa (LCMS).
- Misurazione della cromatografia liquida-spettrometria di massa (LC-MS) dei metaboliti polari
NOTA: Qualsiasi flusso di lavoro cromatografico e di spettrometria di massa che consenta la rilevazione dell'aspartato, degli intermedi nella biosintesi de novo delle pirimidine e dell'UMP sarà sufficiente14.- Preparare i campioni per LCMS su ghiaccio aggiungendo 100 μL di acqua di grado HPLC ai pellet essiccati e al vortice per 10 minuti a 4 °C.
- Centrifugare i campioni a 4 °C per 10 minuti alla massima velocità (almeno 17.000 × g) e spostare 25 μL in ciascun flaconcino di LC-MS.
- Iniettare 2 μL di lisato nel sistema LC-MS. Di seguito è riportata una metodologia comunemente utilizzata:
- Preparare la fase A mobile comprendente 20 mM di carbonato di ammonio (grado LC-MS) e idrossido di ammonio allo 0,1% (grado LC-MS) disciolto in acqua di grado LC-MS.
- Scegli acetonitrile al 100% (grado LC-MS) come fase mobile B.
- Per la cromatografia, scegliere una colonna analitica da 5 μm, 150 mm x 2,1 mm dotata di una colonna di protezione da 2,1 mm x 20 mm per composti idrofili (vedere la tabella dei materiali). Impostare il forno a colonna a 25 °C.
- Utilizzare le seguenti impostazioni di cromatografia liquida: una portata costante di 0,15 ml/min; un gradiente lineare dall'80% al 20% Mobile Phase B per 20 min, seguito da un gradiente lineare dal 20% all'80% Mobile Phase B per 0,5 min, seguito da una sospensione all'80% Mobile Phase B per 7,5 min.
- Scegliere le seguenti impostazioni dello spettrometro di massa: una scansione completa tra m/z 70 Da e 1.000 Da; una risoluzione di 70.000; un obiettivo AGC di 1 × 106; e un tempo massimo di iniezione di 20 ms. Utilizzare la sorgente in modalità di commutazione di polarità. Impostare la tensione di spruzzo a 3,0 kV, il capillare riscaldato a 275 °C, la sonda HESI a 350 °C, il flusso di gas della guaina a 40 unità, il flusso di gas ausiliario a 15 unità e il flusso di gas di spazzamento a 1 unità.
- Eseguire l'analisi dei dati utilizzando qualsiasi software che si interfaccia con il flusso di lavoro LCMS.
NOTA: i software utilizzati con il flusso di lavoro di cui sopra sono XCalibur (Thermo) e TraceFinder (Thermo). Le considerazioni chiave per l'analisi dei dati sono descritte di seguito:- Tempi di conservazione previsti: Determinare il tempo di ritenzione di ciascun metabolita eseguendo gli standard per ciascun metabolita di interesse utilizzando il metodo cromatografico prima dell'esperimento.
NOTA: i tempi di ritenzione di UMP e dei suoi isotopologhi, inclusi 13C3-UMP, sono esattamente gli stessi. - M/Z atteso per i metaboliti: Se un metabolita ionizza in modalità ione negativo (come UMP), calcolare la massa esatta attesa usando la formula molecolare di UMP meno un protone [C 9 H14N2O9P]. Per i metaboliti che ionizzano in modalità ione positivo, calcolare la massa esatta utilizzando la formula molecolare più un protone.
- Precisione di massa: Quando si utilizza uno spettrometro di massa orbitrap, ci si aspetta che il metabolita di interesse e i suoi isotopologhi abbiano una precisione di massa ±5 mmu. Utilizzare il software per calcolare questo, tenendo conto dell'M / Z previsto e dell'effettivo M / Z rilevato.
- Correzione naturale dell'abbondanza: Si prevede che tutti i dati di tracciamento subiscano una correzione dell'abbondanza naturale per tenere conto degli isotopi N-13 C ~13C e ~0,5% 15 in natura 15.
- Tempi di conservazione previsti: Determinare il tempo di ritenzione di ciascun metabolita eseguendo gli standard per ciascun metabolita di interesse utilizzando il metodo cromatografico prima dell'esperimento.
3. Tracciamento isotopico stabile di 13C 5-glutammina per misurare l'attività SDH
- 13Tracciamento isotopico stabile della C 5-glutammina in cellule aderenti
NOTA: L'attività SDH può essere monitorata direttamente misurando l'interconversione di alcuni isotopologhi di fumarato e succinato su 13 C 5-glutammina tracciando 7,16,17. L'inibitore del complesso III antimicina è usato come controllo per alterare la direzionalità netta del complesso SDH (Figura 4).- Semina tra 250.000 e 500.000 cellule in un piatto a 6 pozzetti per ottenere il 75% di confluenza il giorno successivo.
- Preparare uno stock di 50 mM 13C 5-glutammina (vedi Tabella 1).
- Preparare il terreno di tracciatura contenente 2 mM 13C 5-glutammina (vedere Tabella 1).
- Cambiare il mezzo in ciascun pozzetto in mezzo contenente 2 mM 13C 5-glutammina. Incubare per il numero appropriato di ore per ottenere uno stato costante di etichettatura delle celle di interesse (vedere la nota al punto 2.1.3).
- Isolare i metaboliti seguendo il protocollo al punto 2.2.
- Analizzare i campioni su LC-MS seguendo il flusso di lavoro descritto al punto 2.3.
- Analisi dell'attività SDH in base ai modelli di etichettatura
NOTA: L'attività di ossidazione del succinato del complesso SDH può essere monitorata valutando il rapporto tra 13 C 4-fumarato e 13 C 4-succinato su 13C5-glutammina tracciante. L'attività di riduzione del fumarato del complesso SDH può essere monitorata valutando il rapporto di 13 C 3-succinato e 13 C 3-fumarato su 13C 5-glutammina tracciando.- Calcolare l'etichettatura percentuale di 13 C 3-fumarato, 13 C 4-fumarato, 13 C3-succinato e 13C 4-succinato. Ad esempio, per determinare la percentuale di 13 C 3-fumarato, sommare tutte le aree di picco integrate per gli isotopologhi del fumarato (fumarato non marcato, 13 C 1-fumarato, 13 C2-fumarato, 13 C 3-fumarato e 13 C4-fumarato) e dividere l'area del picco per 13C 3-fumarato per l'area isotopologo totale. Moltiplicare per 100.
- Per calcolare l'ossidazione del succinato, dividere la percentuale 13 C 4-fumarato per la percentuale 13C 4-succinato.
- Per calcolare la riduzione del fumarato, dividere la percentuale 13 C 3-succinato per la percentuale 13C 3-fumarato.
4. Saggio diretto dell'attività complessa I
NOTA: DCPIP è un accettore di elettroni artificiale; Cambia nella sua forma ridotta quando accetta elettroni dall'ubichinolo. In questo test, l'ubichinone viene ridotto a ubichinolo attraverso la complessa ossidazione I-mediata di NADH a NAD+. Pertanto, misurare il turnover di DCPIP ossidato in questo saggio privo di cellule è un proxy per l'attività complessa I 7,18.
- Purificare e quantificare i mitocondri dalle cellule
NOTA: Qualsiasi protocollo di purificazione mitocondriale può essere utilizzato per questo test19.- Espandi le celle fino ad ottenere 25-100 milioni di cellule. Aspirare il mezzo dai piatti, lavare con 1x PBS, aspirare il PBS e tryspinize le cellule con tripsina allo 0,25%. Spegnere la tripsina con terreno di coltura e pellettare le cellule a 1.000 × g per 5 minuti.
- Lavare i pellet cellulari 2x in 5 ml di 1x PBS e ripetere la centrifugazione a 1.000 × g per 5 minuti per pellettare le celle. Conservare i pellet lavati in un congelatore a -20 °C fino alla purificazione mitocondriale.
NOTA: Non congelare e scongelare i pellet cellulari più di una volta. - Preparare il tampone di isolamento dei mitocondri (vedere Tabella 1).
NOTA: I reagenti contenenti sodio come NaOH non devono essere utilizzati per preparare tamponi di isolamento dei mitocondri, poiché il sodio offusca il potenziale della membrana mitocondriale20 e interrompe l'omeostasi mitocondriale del calcio21. - Risospendere i pellet cellulari a 10 milioni di cellule per 1 mL di tampone di isolamento dei mitocondri. Ad esempio, risospendere 100 milioni di cellule pellettate in 10 ml di tampone di isolamento dei mitocondri.
NOTA: assicurarsi di interrompere i grumi di cellule senza introdurre bolle nel buffer. - Spostare 2 ml di sospensione cellulare in un omogeneizzatore di vetro preraffreddato con un volume di lavoro di 3-8 ml compatibile con un pestello Potter-Elvehjem PTFE. Omogeneizzare le cellule con 10-20 colpi, monitorando le cellule al microscopio per confermare la lisi cellulare durante tutto il processo di omogeneizzazione. Aumentare il numero di ictus, se necessario, per garantire un'efficiente lisi cellulare.
NOTA: Se l'omogeneizzazione delle cellule con il metodo sopra descritto non è efficace per la lisatura delle cellule, passare a un metodo di lisi a siringa22. - Trasferire 2 ml di lisato cellulare in una provetta da microcentrifuga su ghiaccio e ripetere i passaggi precedenti fino a omogeneizzare l'intera sospensione cellulare.
- Pellettare i nuclei e i detriti cellulari a 650 × g per 10 minuti in una centrifuga a 4 °C.
- Spostare il surnatante in una nuova provetta da 2,0 mL e ripetere la centrifugazione di cui sopra a 650 × g per 10 minuti a 4 °C.
- Spostare il surnatante in una nuova provetta da 2,0 ml e pellettare i mitocondri grezzi a 7.000 × g per 10 minuti in una centrifuga a 4 °C.
- Scartare il surnatante e risospendere il pellet in 1 mL di tampone di isolamento dei mitocondri. Spostare 50 μL in una nuova provetta per la quantificazione delle proteine. Ripetere la fase di centrifugazione di cui sopra sulle due aliquote del campione (il campione da 50 μL e il restante ~950 μL).
- Eliminare il surnatante e conservare il pellet in un congelatore a -80 °C fino al momento dell'uso.
- Aggiungere 200 μL di tampone RIPA ai pellet dall'aliquota da 50 μL per estrarre la proteina, vortice per 10 minuti e centrifugare a 21.000 × g per isolare la proteina. Quantificare la quantità di proteine nell'aliquota da 50 μL e utilizzare questo numero per quantificare la proteina rimanente nel campione da 950 μL. Ad esempio, se la quantificazione proteica per l'aliquota 50 μL è 1 μg/μL, la proteina totale nel pellet mitocondriale rimanente è 950 μg (1 μg/μL × 950 μL).
- Esecuzione del test di attività complessa I
NOTA: La linea cellulare di osteosarcoma 143B è stata utilizzata per questo test, ma il protocollo può essere adattato per qualsiasi cellula in coltura.- Risospendere i mitocondri purificati nel tampone di risospensione dei mitocondri (vedere Tabella 1) ad una concentrazione finale di 5 mg di proteine/ml.
- Eseguire cinque cicli di congelamento/scongelamento in un congelatore a -20 °C per permeabilizzare i mitocondri.
- Rendere il complesso buffer di analisi dell'attività I (vedere Tabella 1).
- Mescolare 50 ug dello stock di mitocondri da 5 mg/mL con 90 μL di tampone di attività I complesso. Preparare cinque repliche non trattate e cinque repliche trattate con rotenone (5 μM) per controllare l'attività I complessa.
- Leggere l'assorbanza della linea di base a 600 nm in un lettore di piastre impostato a 37 °C.
- Avviare la reazione aggiungendo NADH a una concentrazione finale di 2 mM e tracciare l'assorbanza (600 nm) nell'arco di 1 ora, misurando almeno ogni 2 minuti in tutto. La diminuzione dell'assorbanza è indicativa di una riduzione del DCPIP attraverso l'attività del complesso I.
NOTA: il NADH deve essere aggiunto utilizzando una pipetta multicanale per garantire che tutti i campioni vengano avviati contemporaneamente.
5. Saggio basato su LC-MS per misurare i livelli di superossido
NOTA: Le proprietà di fluorescenza di MitoSox Red possono cambiare indipendentemente dalla sua reazione con il superossido23. Questo test basato su LC-MS misura direttamente il prodotto dal superossido che reagisce con MitoSox Red. Il seguente test è leggermente modificato da Xiao et al.24. Il 2-idrossi-mitotetidio (2-OH MitoE2+) è il prodotto della reazione del superossido (Figura 5). La linea cellulare Caki1 è stata utilizzata per questo test, ma il protocollo può essere adattato per qualsiasi cellula in coltura.
- Trattamento delle cellule aderenti con MitoSox Red
- Semina tra 250.000 e 500.000 cellule in un piatto a 6 pozzetti per ottenere il 75% di confluenza il giorno successivo. Assicurarsi di seminare un set di piastre per il test LC-MS e un set duplicato di piastre per la normalizzazione del conteggio cellulare.
- Preparare DMEM completo contenente il 10% di FBS inattivato dal calore e l'1% di penicillina-streptomicina nel mezzo Eagle modificato di Dulbecco.
- Rinfrescare il mezzo in tutti i pozzetti per tutte le condizioni con 2 ml di DMEM completo. Assicurati di aggiungere eventuali farmaci o trattamenti di interesse a questo punto.
- Incubare le cellule in un incubatore di coltura tissutale per 1 ora.
- Preparare controlli positivi e negativi. Preparare una riserva di 50 mM di idroperossido di terz-butile diluito in PBS e una riserva di 250 mM di N-acetil cisteina (NAC) diluita in DMSO (vedere Tabella 1).
NOTA: L'idroperossido di terbutile (tBuOOH) è una potente specie reattiva dell'ossigeno che fungerà da controllo positivo e aumenterà la quantità di 2-OH MitoE2+. NAC è un potente antiossidante che agirà come un controllo negativo e neutralizzare la produzione di superossido causata da tBuOOH. - Aggiungere 1 μL di tBuOOH ai pozzetti di controllo positivo e 1 μL di tBuOOH + 100 μL di NAC ai pozzetti di controllo negativo.
NOTA: l'uso di una pipetta P2 (intervallo 0,1-2 μL) è il modo ottimale per trasferire 1 μL. - Incubare per 1 ora in un incubatore di coltura tissutale.
- Preparare 1 mM di MitoSox Red (vedere Tabella 1) e aggiungere 2 μL di 1 mM di MitoSox Red a ciascun pozzetto per ottenere una concentrazione finale di 1 μM. Incubare per 30 minuti in un incubatore di colture tissutali.
- Durante questa incubazione finale, contare una delle piastre duplicate per acquisire i conteggi delle cellule per normalizzare i dati finali LC-MS.
- Isolamento del prodotto ossidato Mitosox Red dalle cellule aderenti
- Prendi un secchio di ghiaccio secco e posiziona l'isopropanolo fresco di grado HPLC sul ghiaccio secco prima di iniziare l'isolamento.
- Estrarre una piastra alla volta, aspirare il mezzo dai pozzetti e lavare 2x con 1 mL di 1x PBS. Aspirare tutto il PBS residuo dai pozzetti prima di passare alla fase successiva.
NOTA: Assicurarsi di inclinare la piastra durante l'aspirazione e di pipettare contro la parete del piatto per evitare l'interruzione delle celle aderenti. - Posizionare la piastra su ghiaccio secco e aggiungere 800 μL di isopropanolo di grado HPLC a ciascun pozzetto.
- Incubare la piastra per almeno 15 minuti in un congelatore a -80 °C per facilitare la lisi cellulare.
NOTA: A questo punto, la piastra successiva può essere estratta dall'incubatore e ripetere i passaggi 5.2.1-5.2.4. Continuare fino a quando tutte le piastre sono in incubazione nel congelatore a -80 °C. - Prelevare una piastra alla volta dal congelatore, raschiare ogni pozzetto sul ghiaccio secco usando un sollevatore di cellule e trasferire il lisato in una provetta da microcentrifuga da 1,5 ml. Tenere il tubo su ghiaccio asciutto fino al passaggio successivo.
- Vortice tutti i tubi per 10 minuti a 4 °C, quindi centrifugare a 4 °C per 10 minuti alla massima velocità (almeno 17.000 × g).
- Trasferire il surnatante in una provetta da microcentrifuga da 1,5 ml e asciugare in un concentratore a vuoto. Una volta asciugato il lisato, conservare i pellet di metabolita a -80 °C fino al momento della presentazione della LC-MS.
- Misurazione LC-MS di MitoSox Red e 2-idrossi-mitoethidium (2-OH MitoE2+)
- Preparare i campioni per LCMS su ghiaccio aggiungendo 100 μL di una miscela 3:3:1 di MeOH:chloroform:water di grado HPLC. Vortice per 10 min a 4 °C.
- Spostare 25 μL in ciascun flaconcino di LC-MS. Conservare il campione rimanente nel congelatore a -80 °C.
- Preparare i seguenti tamponi per cromatografia liquida: i) tampone A: acqua di grado HPLC con acido formico allo 0,1%; ii) tampone B: acetonitrile di grado HPLC con acido formico allo 0,1%.
- Aprire l'app Thermo XCalibur Instrument Setup per iniziare a sviluppare il metodo.
- Cerca due caselle nella barra laterale sinistra di questa finestra: la prima casella consente lo sviluppo del metodo cromatografico e la seconda casella consente lo sviluppo del metodo di spettrometria di massa.
- Sviluppo del metodo di cromatografia liquida:
- Impostare una portata di 0,25 ml/min e iniziare il metodo al 20% B, salendo al 95% B nell'arco di 12 minuti. Nel minuto successivo, riduci il buffer B al 20% B e mantieni quel livello per i successivi 2 minuti.
NOTA: Gli ultimi 2 minuti di flusso al 20% B sono fondamentali affinché la pressione della colonna ritorni alla pressione iniziale e bilanci la colonna con i rapporti tampone appropriati. La mancata inclusione di questo passaggio di equilibrio causerà uno spostamento dei tempi di ritenzione per tutti i campioni eseguiti successivamente.
- Impostare una portata di 0,25 ml/min e iniziare il metodo al 20% B, salendo al 95% B nell'arco di 12 minuti. Nel minuto successivo, riduci il buffer B al 20% B e mantieni quel livello per i successivi 2 minuti.
- Create un Tune File con i seguenti parametri:
- Apri l'app Tune e crea un nuovo file di melodia.
- Applicare eventuali impostazioni sovrapposte dal modulo Method Setup (vedere il passaggio 5.3.9.3) anche a questo file di ottimizzazione, inclusi l'intervallo di scansione, la risoluzione, la polarità, il target AGC e l'IT massimo.
- Impostare il gas della guaina su 30, il gas Aux su 3 e anche il gas Sweep su 3. Impostare la tensione di spruzzo su 3 kV, la temperatura capillare su 300 e il livello RF dell'obiettivo S su 60.
- Sviluppo del metodo di spettrometria di massa:
- Dall'elenco in basso a sinistra delle potenziali scansioni, trascina e rilascia Full MS al centro della finestra. Assicurati di fare clic sul quadrato MS completo dopo la caduta per regolare le impostazioni. La durata totale del metodo MS è di 13 min.
NOTA: Il metodo LC è più lungo del metodo MS perché gli ultimi 2 minuti sono per il ricondizionamento della colonna e non per la quantificazione dei metaboliti. - Sul lato destro del modulo, in Proprietà del metodo, assicurarsi che la durata del metodo e il tempo di esecuzione siano impostati su 13,00 min.
- Esegui questa scansione completa in modalità positiva con una risoluzione di 70.000 e un target AGC di 1 × 106. Impostare l'IT massimo su 100 ms e l'intervallo di scansione da 300 m/z a 700 m/z.
- In File di ottimizzazione verso la parte superiore del modulo, osservare che il file di registrazione appena creato è collegato a questo metodo.
- Dall'elenco in basso a sinistra delle potenziali scansioni, trascina e rilascia Full MS al centro della finestra. Assicurati di fare clic sul quadrato MS completo dopo la caduta per regolare le impostazioni. La durata totale del metodo MS è di 13 min.
- Eseguire il metodo per il rilevamento di MitoSox Red con iniezioni di campioni da 2 μL.
Representative Results
Le attività di DHODH, complesso I e complesso V possono essere valutate utilizzando saggi di proliferazione. Dopo la privazione di uridina dal terreno di coltura, le cellule diventano più dipendenti dalla via de novo per la biosintesi della pirimidina. Pertanto, quando le cellule sono state sfidate a proliferare in un mezzo privo di uridina, erano più sensibili all'inibizione dell'attività di DHODH da parte di brequinar rispetto alle cellule coltivate in un mezzo contenente uridina (Figura 6A). Allo stesso modo, la privazione di piruvato dal terreno di coltura rende le cellule più dipendenti dall'attività complessa I per la proliferazione. Pertanto, quando le cellule sono state sfidate a proliferare in un mezzo privo di piruvato, erano più sensibili all'inibizione dell'attività del complesso I da parte del rotenone rispetto alle cellule coltivate in un mezzo contenente piruvato (Figura 6B). L'attività V complessa può essere valutata sfidando le cellule a proliferare in un mezzo contenente galattosio anziché glucosio. Poiché il galattosio produce ATP netto zero nella glicolisi, le cellule che crescono in questo combustibile dipendono maggiormente dalla sintesi di ATP mitocondriale attraverso l'attività V complessa. Pertanto, le cellule proliferanti in un mezzo contenente galattosio erano più sensibili all'inibizione del complesso V da parte dell'oligomicina rispetto alle cellule che proliferavano in un mezzo contenente glucosio (Figura 6C).
L'attività SDH può essere misurata utilizzando il tracciamento di 13C 5-glutammina e monitorando la sua incorporazione negli isotopologhi del fumarato e del succinato. In condizioni trattate con veicolo, il complesso SDH ha favorito l'attività in avanti e l'incorporazione di 13 C 4-succinato in 13 C4-fumarato è stata superiore all'incorporazione di 13 C 3-fumarato in 13C 3-succinato (Figura 7). In condizioni trattate con antimicina, il complesso SDH ha favorito l'attività inversa e l'incorporazione di 13 C 3-fumarato in 13 C3-succinato è stata maggiore dell'incorporazione di 13 C 4-succinato in 13C 4-fumarato (Figura 7).
La produzione di superossido all'interno dei mitocondri può essere misurata utilizzando il reporter fluorescente MitoSox, che genera 2-idrossi-mitoethidium dopo reazione con superossido. In questo studio, le cellule trattate con MitoSox in presenza di perossido di idrogeno terbutile avevano livelli più elevati di 2-idrossi-mitoethidium in un modo che è stato soppresso dall'aggiunta di NAC, un antiossidante che estingue i ROS cellulari (Figura 8).
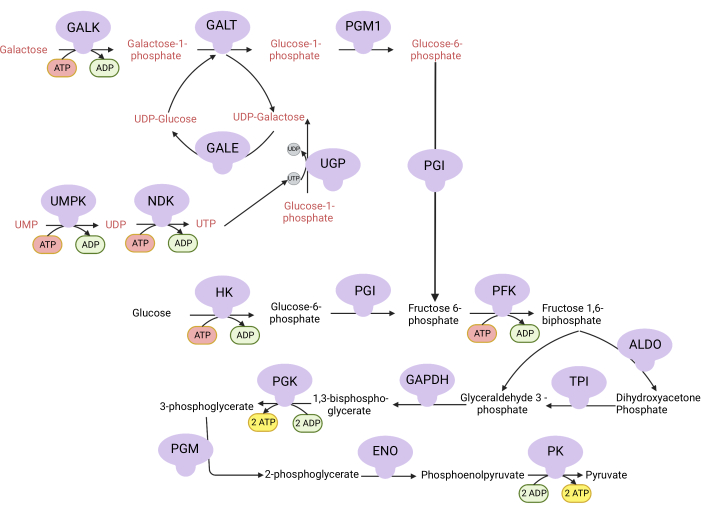
Figura 1: Basi meccanicistiche per il saggio di proliferazione V complessa. Ossidazione del glucosio e del galattosio tramite glicolisi. Il glucosio produce due ATP netti dalla glicolisi, mentre il galattosio produce ATP netto zero perché la sintesi di UTP è necessaria per UDP-galattosio. Pertanto, le cellule coltivate nel galattosio sono più dipendenti dalla sintesi mitocondriale di ATP a causa della mancanza di ATP prodotta dalla glicolisi. Abbreviazioni: GALK = galattochinasi; GALT = galattosio-1-fosfato uridiltransferasi; PGM1 = fosfoglucomutasi 1; GPI = glucosio-6-fosfato isomerasi, UGP = UDP-glucosio pirofosforilasi; GALE = UDP-galattosio-4-epimerasi; NDK = nucleotide difosfato chinasi; UMPK = uridina monofosfato chinasi; HK = esochinasi; PFK = fosfofruttochinasi; ALDO = aldolasi; TPI = triosefosfato isomerasi; GAPDH = gliceraldeide-3-fosfato deidrogenasi; PGK = fosfoglicerato chinasi; PGM = fosfoglucomutasi; ENO = enolasi; PK = piruvato chinasi. Fare clic qui per visualizzare una versione ingrandita di questa figura.
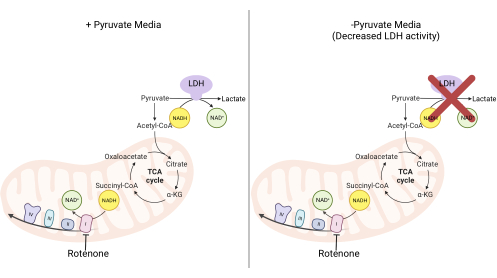
Figura 2: Basi meccanicistiche per il saggio di proliferazione I complessa. Schema delle vie metaboliche che vengono alterate in seguito all'inibizione dell'attività I complessa. Nei mezzi ad alto contenuto di piruvato, l'inibizione del complesso I viene bypassata tramite ossidazione del NADH mediata da LDH. Nei mezzi a basso contenuto di piruvato, questo adattamento è meno fattibile, rendendo le cellule più dipendenti dall'attività del complesso I per riossidare il NADH. Abbreviazioni: LDH = lattato deidrogenasi; Ciclo TCA = ciclo dell'acido tricarbossilico. Fare clic qui per visualizzare una versione ingrandita di questa figura.
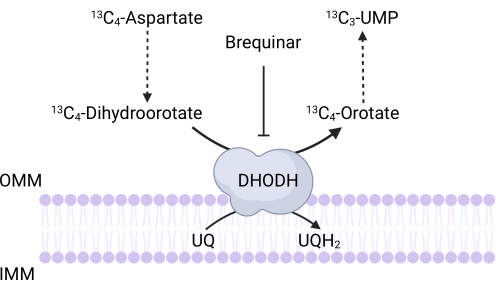
Figura 3: Schema della reazione DHODH sul tracciato di 4-aspartato 13C. Brequinar inibisce l'ossidazione del diidroorotato a orotato, impedendo così la sintesi a valle di UMP. 13Il 4-aspartato C è incorporato in 13C3-UMP tramite attività DHODH. Abbreviazioni: OMM = membrana mitocondriale esterna; IMM = membrana mitocondriale interna; DHODH = diidroorotato deidrogenasi. Fare clic qui per visualizzare una versione ingrandita di questa figura.
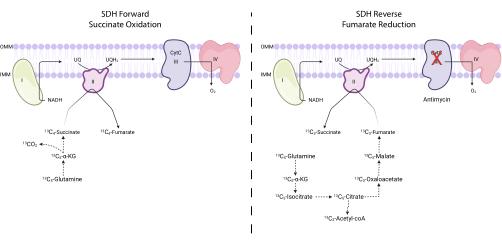
Figura 4: Misurazione dell'attività II del complesso 13C5. Per misurare l'attività del complesso II (a sinistra), viene monitorata l'incorporazione di 13 C 5-glutammina in 13 C 4-succinato e 13C 4-fumarato. Per misurare l'attività inversa del complesso II (a destra), viene monitorata l'incorporazione di 13 C 5-glutammina in 13 C 3-succinato e 13C 3-fumarato. Abbreviazioni: SDH = succinato deidrogenasi; CytC = citocromo C. Fare clic qui per visualizzare una versione ingrandita di questa figura.
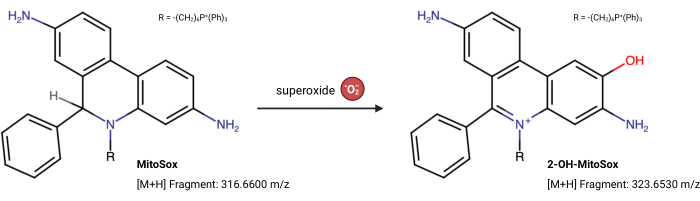
Figura 5: Reazione di MitoSox Red con superossido. La reazione di MitoSox con superossidi mitocondriali per formare 2-OH-MitoE2+. Fare clic qui per visualizzare una versione ingrandita di questa figura.
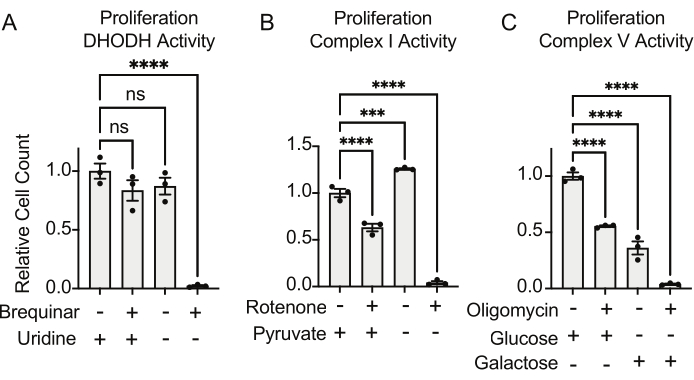
Figura 6: Saggi basati sulla proliferazione per misurare la funzione mitocondriale (A) Proliferazione di cellule di osteosarcoma 143B trattate con 5 uM brequinar, un inibitore del DHODH, in mezzo con ±100 ug/mL di uridina. I dati sono medi ± SEM; N = 3 per condizione. (B) Proliferazione di cellule di osteosarcoma 143B trattate con rotenone 2 uM, un inibitore del complesso I, in terreno con ±5 mM di piruvato. I dati sono medi ± SEM; N = 3 per condizione. (C) Proliferazione di cellule di osteosarcoma 143B trattate con l'oligomicina 5 uM, un inibitore V complesso, in mezzo con 10 mM di glucosio o 10 mM di galattosio come unica fonte centrale di carbonio. I dati sono medi ± SEM; N = 3 per condizione. * indica p < 0,05 utilizzando un test ANOVA unidirezionale in Graphpad Prism. Fare clic qui per visualizzare una versione ingrandita di questa figura.
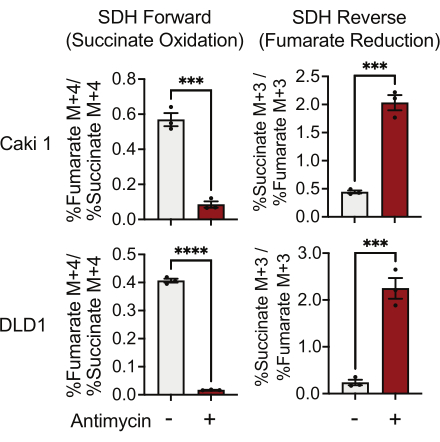
Figura 7: 13C 5-glutammina tracciante per misurare l'attività del complesso II. Ossidazione del succinato e riduzione del fumarato (SDH reverse) in DMSO e cellule Caki1 e DLD1 trattate con antimicina A 500 nM. I dati rappresentano la media ± SEM; N = 3 per condizione. indica p < 0,05 utilizzando un t-test spaiato in GraphPad Prism. Abbreviazioni: SDH = ossidazione del succinato; SDH inverso = riduzione del fumarato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
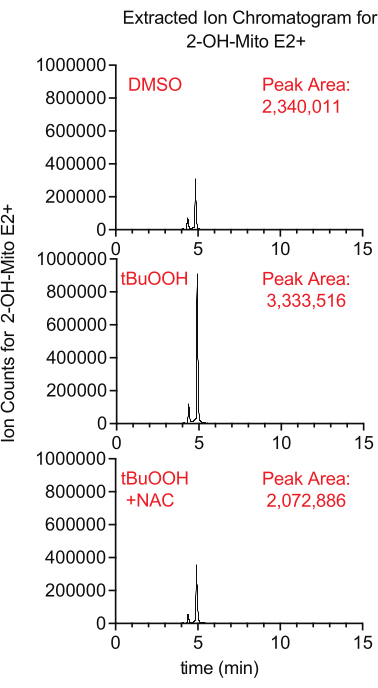
Figura 8: Saggio MitoSox basato su LCMS per rilevare il superossido. Cromatogramma ionico estratto di 2-OH-Mito E2+ isolato da cellule Caki1 trattate con MitoSox per 30 minuti in presenza di tBuOOH ± NAC. Abbreviazioni: LCMS = cromatografia liquida-spettrometria di massa; NAC = N-acetil cisteina. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Tabella 1: Composizione dei reagenti, dei tamponi e dei mezzi utilizzati in questo protocollo. Clicca qui per scaricare questa tabella.
Discussion
Poiché la ricerca emergente dimostra che i mitocondri dei mammiferi possono funzionare senza consumare ossigeno molecolare, è della massima importanza per i ricercatori impiegare saggi ortogonali, oltre alle misurazioni OCR, per quantificare con precisione la funzione mitocondriale. Qui, abbiamo compilato una serie di saggi che possono essere utilizzati per valutare direttamente le attività del complesso I, complesso II, complesso V e DHODH misurando l'equilibrio mitocondriale NAD + / NADH, l'utilizzo di accettori di elettroni terminali adattivi, la produzione di ATP, la biosintesi de novo pirimidina e ROS derivato dai mitocondri. In particolare, questi test misurano più direttamente la funzione mitocondriale rispetto alle misurazioni OCR. Inoltre, questi saggi forniscono ai ricercatori modi trattabili per quantificare la funzione mitocondriale durante l'ipossia, per la quale le misurazioni OCR sono in gran parte irrilevanti a causa del fumarato utilizzato come accettore di elettroni terminale preferito. Infine, i metodi basati sulla proliferazione qui descritti sono più convenienti rispetto ai classici esperimenti di respirometria, fornendo così un modo ampiamente accessibile per studiare la funzione mitocondriale nei sistemi dei mammiferi.
Ci sono considerazioni chiave quando si utilizzano questi saggi per misurare la funzione mitocondriale nelle cellule in coltura. Per quanto riguarda i saggi di proliferazione, è importante regolare il numero di cellule seminate per il tasso di raddoppio di ciascuna linea cellulare. Le cellule dovrebbero essere seminate ad almeno il 10% di confluenza e con spazio sufficiente per consentire tre o quattro raddoppi in modo che le differenze di proliferazione possano essere quantificate. Un'altra considerazione per ogni test è la concentrazione delle piccole molecole utilizzate come controlli per le attività di ciascun complesso ETC. Poiché diverse linee cellulari possono mostrare sensibilità diverse a questi inibitori, è fondamentale testare la dose di queste piccole molecole per identificare la concentrazione ottimale.
Una limitazione universale dei saggi che studiano la funzione mitocondriale in vitro, comprese le misurazioni OCR e tutti i saggi qui descritti, è la composizione metabolica del terreno di coltura. Il terreno di coltura cellulare standard tende a polarizzare i sistemi in livelli superficialmente elevati di funzione mitocondriale. Ad esempio, i livelli soprafisiologici di glutammina aumentano la sua anaplerosi del ciclo TCA25, che alimenta la sintesi mitocondriale di NADH e, di conseguenza, aumenta la fosforilazione ossidativa. Allo stesso modo, la pressione parziale dell'ossigeno varia tra 3 mmHg e 100 mmHg (circa 0,1%-13% O2) nei tessuti dei mammiferi, ma è atmosferica (140 mmHg, circa il 21%) in vitro26,27. Questo eccesso di O2 massimizza la capacità respiratoria mitocondriale e la produzione di superossido28. Recentemente, sono stati fatti sforzi per progettare terreni di coltura per essere più fisiologici29,30. In particolare, la coltura di cellule in terreni simili al plasma umano diminuisce la respirazione mitocondriale in alcune linee cellulari tumorali30, i ROS mitocondriali nelle cellule T 31 e gli adattamenti mitocondriali alle terapie antitumorali32. Pertanto, è fondamentale essere consapevoli della composizione dei terreni di coltura utilizzati e capire come può influire sulla funzione mitocondriale.
Un'altra limitazione importante e universale nell'interpretazione della funzione mitocondriale è il potenziale di differenze nel numero di mitocondri. È quindi fondamentale misurare il contenuto mitocondriale attraverso la quantificazione del mtDNA33, la misurazione della massa mitocondriale con coloranti insensibili al potenziale di membrana34 o il western blotting dei marcatori mitocondriali. Questo è un controllo critico in modo che una diminuzione del numero di mitocondri non venga scambiata per una diminuzione della funzione mitocondriale.
Esistono anche limitazioni specifiche e risoluzione dei problemi che si applicano ai test descritti qui. In primo luogo, dato che le cellule differenziate non proliferano, i saggi basati sulla proliferazione non saranno utili per valutare la funzione mitocondriale in questo contesto. Una limitazione chiave del protocollo di tracciamento 13C 4-aspartato per misurare l'attività DHODH è che l'assorbimento di aspartato nelle cellule può essere estremamente inefficiente35. Per superare questa potenziale limitazione, i ricercatori possono sovraesprimere il trasportatore dell'aspartato, SLC1A3, per facilitare l'assorbimento di 13C 4-aspartato35.
Una limitazione del protocollo che utilizza il tracciamento di 13C 5-glutammina per misurare l'attività SDH è che questo test richiede alle cellule di utilizzare la via di carbossilazione riduttiva per arricchire gli isotopologhi M + 3 al fine di misurare l'attività inversa. Alcune linee cellulari sono incapaci di flusso di carbossilazione riduttivo a causa della bassa espressione di ATP citrato liasi36, insufficiente stabilizzazione HIF 37 o un rapporto α-KG:citrato troppo basso38. Per superare questa limitazione, si potrebbe utilizzare il tracciamento 13C 4-aspartato per misurare le attività SDH avanti e indietro7. In questo test, l'attività diretta dell'SDH può essere misurata dal rapporto tra il fumarato M+2:succinato M+2 e la reazione inversa del succinato M+4:fumarato M+4. In particolare, questo tracciamento aggira la maggior parte degli enzimi nella via di carbossilazione riduttiva.
Una limitazione del complesso test di attività I che utilizza la riduzione DCPIP come lettura è che i mitocondri non sono strutturalmente intatti. Il processo di congelamento-scongelamento dei mitocondri per consentire il loro assorbimento di NADH per il test può certamente offuscare l'integrità strutturale della membrana mitocondriale39. Questo test deve essere eseguito in parallelo con saggi come il saggio di proliferazione del complesso I per garantire che i cambiamenti nell'attività del complesso I osservati siano veri anche con cellule intatte.
In studi futuri, alcune di queste tecniche possono essere adattate per misurare le funzioni mitocondriali in vivo utilizzando organismi modello come topi e Caenorhabditis elegans. Gli attuali metodi utilizzati per misurare la funzione mitocondriale in vivo sono centrati sull'OCR a livello di organismo, in particolare sul tasso di scambio respiratorio quando si utilizzano modelli murini. Una chiara limitazione di questo metodo è che l'ossigeno svolge molte funzioni biochimiche e di segnalazione al di là del suo ruolo di onnipresente accettore di elettroni terminali nell'ETC mitocondriale. Ad esempio, l'ossigeno viene "consumato" dall'attività catalitica degli enzimi della famiglia delle diossigenasi. Sebbene questi enzimi contribuiscano al tasso di consumo di ossigeno cellulare, non partecipano, regolano o riflettono la funzione mitocondriale. Gli esperimenti di respirometria classica in vitro controllano tipicamente l'"OCR non mitocondriale", mentre gli esperimenti sul rapporto di scambio respiratorio (RER) dell'organismo non possono controllare questo, limitando l'interpretazione della RER come metrica per la funzione mitocondriale in vivo. Tuttavia, è possibile adattare i protocolli per misurare l'attività del DHODH tramite il tracciamento di 13 C 4-aspartato, l'attività del complesso II tramite il tracciamento della 5-glutammina 13C, l'attività del complesso I sui mitocondri purificati dai tessuti e i ROS mitocondriali utilizzando composti compatibiliLC-MS come MitoB per misurare la funzione mitocondriale in vivo . Questi saggi diretti per interrogare le funzioni mitocondriali, in combinazione con i classici esperimenti di respirometria, forniscono ai ricercatori una valutazione più completa e accurata della funzione mitocondriale nelle cellule e nei tessuti dei mammiferi.
Disclosures
Gli autori non hanno conflitti di interesse da segnalare.
Acknowledgements
Le figure prodotte in questo manoscritto sono state create con BioRender.com. Siamo grati ad Amy Walker per aver fornito feedback su questo articolo. J.B.S. è stato sostenuto dalla Worcester Foundation for Biomedical Research Grant.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube | Cell Treat | 667443 | |
| 2.0 mL tube | Cell Treat | 229446 | |
| 6-well plate | Cell Treat | 229106 | |
| 12-well plate | Cell Treat | 229112 | |
| 13C4-aspartate | Sigma-Aldrich | 604852 | |
| 13C5-Glutamine | Cambridge Isotope Laboratories | 285978-14-5 | |
| 15 mL centrifuge tube | Cell Treat | 667411 | |
| 50 mL centrifuge tube | Cell Treat | 667421 | |
| 150 mm tissue culture dish | Cell Treat | 229651 | |
| 1x Phosphate-buffered saline | Gibco | 10010049 | |
| 2,6-dichlorophenolindophenol | Honeywell | 33125 | |
| Ammonium Carbonate | Sigma-Aldrich | 37999 | |
| Antimycin | Sigma-Aldrich | A8674 | |
| Ascentis Express C18 | Sigma-Aldrich | 53825-U | |
| Bottle top filter 500 mL, 0.22 µm, PES 9 9 mm membrane diameter | Cell Treat | 229717 | |
| Bovine Serum Albumin | Sigma-Aldrich | A3294 | |
| Brequinar | Sigma-Aldrich | SML0113 | |
| Cell Lifter, Double End Flat and Narrow Blade | Cell Treat | 229305 | |
| CentriVap -105 Cold Trap | Labconco | 7385020 | |
| Complete Protease Inhibitor Tablets | Sigma-Aldrich | 4693116001 | |
| Coulter Counter Cups | Fisher Scientific | 07-000-694 | |
| Decylubiquinone | Sigma-Aldrich | D7911 | |
| DMSO | Invitrogen | D12345 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 11995-065 | |
| EDTA | Sigma-Aldrich | E6758 | |
| EGTA | Sigma-Aldrich | E3889 | |
| Eppendorf Centrifuge 5425R | Eppendorf | 2231000908 | |
| Eppendorf Centrifuge 5910 Ri | Eppendorf | 5943000343 | |
| Galactose | Sigma-Aldrich | G5388 | |
| Glucose | Sigma-Aldrich | G7021 | |
| Glucose-free DMEM | Gibco | 11966025 | |
| Glutamine-free DMEM | Thermo Fisher | 11960044 | |
| Heat-Inactivated Fetal Bovine Serum | Sigma-Aldrich | F4135 | |
| Hepes | Sigma-Aldrich | H3375 | |
| HPLC-grade 35% Ammonium hydroxide | Thermo Scientific | 460801000 | |
| HPLC-grade Acetonitrile | Sigma-Aldrich | 900667 | |
| HPLC-grade Chloroform | Sigma-Aldrich | 366927 | |
| HPLC-grade formic acid | Thermo Scientific | 28905 | |
| HPLC-grade Isopropanol | Sigma-Aldrich | 563935 | |
| HPLC-grade MeOH | Sigma-Aldrich | 900688 | |
| HPLC-grade Water | Sigma-Aldrich | 270733 | |
| Human Osteosarcome Cell Line 143B | ATCC | CRL-8303 | |
| Hydrochloric Acid | Sigma-Aldrich | 320331-500ML | |
| Isotone buffer | Beckman Coulter | 8546719 | |
| K2HPO4 | Sigma-Aldrich | P2222 | |
| Mannitol | Sigma-Aldrich | M4125 | |
| MitoSox Red | Invitrogen | M36008 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Oligomycin | Sigma-Aldrich | 75351-5MG | |
| Pencillin Streptomycin | Gibco | 15140-122 | |
| Potter-Elvehjem Tissue Grinder, Size 21 | Kimble | 885502-0021 | |
| Pyruvate | Sigma-Aldrich | P5280 | |
| Pyruvate-free DMEM media | Gibco | 11965175 | |
| Q Exactive Plus Mass Spectrometer | Thermo Scientific | 726030 | |
| ReCO2ver Incubator | Baker | ||
| Refrigerated Centrivap Benchtop Vacuum Concentrator | Labconco | 7310020 | |
| RIPA Buffer | Millipore Sigma | 20188 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| SeQuant ZIC-pHILIC 5μm 150 x 2.1 mm analytical column | Sigma-Aldrich | 1.50460.0001 | |
| SeQuant ZIC-pHILIC guard kit | Millipore Sigma | 1.50438.0001 | |
| Sodium Hydroxide, Pellets | Millipore Sigma | 567530-250GM | |
| Sucrose | Sigma-Aldrich | S0389 | |
| SW, TRACEFINDER 5.1 SP3 | Thermo Scientific | OPTON-31001 | |
| Tert-butyl hydroperoxide solution | Sigma-Aldrich | 458139 | |
| Tris | Sigma-Aldrich | 93352 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25-200-114 | |
| Uridine | Sigma-Aldrich | U3003 | |
| VANQUISH HORIZON / FLEX HPLC | Thermo Scientific | VF-S01-A-02 | |
| Z2 Coulter Particle count and size analyzer | Beckman Coulter | BZ10131270 |
References
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 16080 (2016).
- Chandel, N. S., et al. Reactive oxygen species generated at mitochondrial complex III stabilize hypoxia-inducible factor-1alpha during hypoxia: A mechanism of O2 sensing. Journal of Biological Chemistry. 275 (33), 25130-25138 (2000).
- Cadenas, E., Boveris, A., Ragan, C. I., Stoppani, A. O. M. Production of superoxide radicals and hydrogen peroxide by NADH-ubiquinone reductase and ubiquinol-cytochrome C reductase from beef-heart mitochondria. Archives of Biochemistry and Biophysics. 180 (2), 248-257 (1977).
- Murphy, M. P. How mitochondria produce reactive oxygen species. Biochemical Journal. 417 (1), 1-13 (2009).
- Schieber, M., Chandel, N. S. ROS function in redox signaling and oxidative stress. Current Biology. 24 (10), 453-462 (2014).
- Spinelli, J. B., et al. Fumarate is a terminal electron acceptor in the mammalian electron transport chain. Science. 374 (6572), 1227-1237 (2021).
- Kumar, R., et al. A redox cycle with complex II prioritizes sulfide quinone oxidoreductase-dependent H(2)S oxidation. Journal of Biological Chemistry. 298 (1), 101435 (2022).
- Warburg, O., Geissler, A. W., Lorenz, S. On growth of cancer cells in media in which glucose is replaced by galactose. Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 348 (12), 1686-1687 (1967).
- Marroquin, L. D., Hynes, J., Dykens, J. A., Jamieson, J. D., Will, Y. Circumventing the Crabtree effect: replacing media glucose with galactose increases susceptibility of HepG2 cells to mitochondrial toxicants. Toxicological Sciences. 97 (2), 539-547 (2007).
- Attardi, G., King, M. P. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Bodnar, A. G., Cooper, M., Leonard, J. V., Schapira, A. H. Respiratory-deficient human fibroblasts exhibiting defective mitochondrial DNA replication. Biochemical Journal. 305, 817-822 (1995).
- Gregoire, M., Morais, R., Quilliam, M. A., Gravel, D. On auxotrophy for pyrimidines of respiration-deficient chick embryo cells. European Journal of Biochemistry. 142 (1), 49-55 (1984).
- Mackay, G. M., Zheng, L., vanden Broek, N. J., Gottlieb, E. Analysis of cell metabolism using LC-MS and isotope tracers. Methods in Enzymology. 561, 171-196 (2015).
- Heinrich, P., et al. Correcting for natural isotope abundance and tracer impurity in MS-, MS/MS- and high-resolution-multiple-tracer-data from stable isotope labeling experiments with IsoCorrectoR. Scientific Reports. 8 (1), 17910 (2018).
- Lee, P., Chandel, N. S., Simon, M. C. Cellular adaptation to hypoxia through hypoxia inducible factors and beyond. Nature Reviews Molecular Cell Biology. 21 (5), 268-283 (2020).
- Bisbach, C. M., et al. Succinate can shuttle reducing power from the hypoxic retina to the O(2)-rich pigment epithelium. Cell Reports. 31 (2), 107606 (2020).
- Angebault, C., et al. Idebenone increases mitochondrial complex I activity in fibroblasts from LHON patients while producing contradictory effects on respiration. BMC Research Notes. 4, 557 (2011).
- Liao, P. C., Bergamini, C., Fato, R., Pon, L. A., Pallotti, F. Isolation of mitochondria from cells and tissues. Methods in Cell Biology. 155, 3-31 (2020).
- Iwai, T., et al. Sodium accumulation during ischemia induces mitochondrial damage in perfused rat hearts. Cardiovascular Research. 55 (1), 141-149 (2002).
- Murphy, E., Eisner, D. A. Regulation of intracellular and mitochondrial sodium in health and disease. Circulation Research. 104 (3), 292-303 (2009).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), e52076 (2015).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Xiao, Y., Meierhofer, D. Are hydroethidine-based probes reliable for reactive oxygen species detection. Antioxidants and Redox Signaling. 31 (4), 359-367 (2019).
- DeBerardinis, R. J., et al. Beyond aerobic glycolysis: Transformed cells can engage in glutamine metabolism that exceeds the requirement for protein and nucleotide synthesis. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19345-19350 (2007).
- Keeley, T. P., Mann, G. E. Defining physiological normoxia for improved translation of cell physiology to animal models and humans. Physiological Reviews. 99 (1), 161-234 (2019).
- Ast, T., Mootha, V. K. Oxygen and mammalian cell culture: Are we repeating the experiment of Dr. Ox. Nature Metabolism. 1 (9), 858-860 (2019).
- Gu, C., Jun, J. C. Does hypoxia decrease the metabolic rate. Frontiers in Endocrinology. 9, 668 (2018).
- Voorde, J., et al. Improving the metabolic fidelity of cancer models with a physiological cell culture medium. Scientific Advances. 5 (1), 7314 (2019).
- Cantor, J. R., et al. Physiologic medium rewires cellular metabolism and reveals uric acid as an endogenous inhibitor of UMP synthase. Cell. 169 (2), 258-272 (2017).
- MacPherson, S., et al. Clinically relevant T cell expansion media activate distinct metabolic programs uncoupled from cellular function. Molecular Therapy. Methods and Clinical Development. 24, 380-393 (2022).
- Torres-Quesada, O., Doerrier, C., Strich, S., Gnaiger, E., Stefan, E. Physiological cell culture media tune mitochondrial bioenergetics and drug sensitivity in cancer cell models. Cancers. 14 (16), 3917 (2022).
- Chan, S. W., Chen, J. Z. Measuring mtDNA damage using a supercoiling-sensitive qPCR approach. Methods in Molecular Biology. 554, 183-197 (2009).
- Doherty, E., Perl, A. Measurement of mitochondrial mass by flow cytometry during oxidative stress. Reactive Oxygen Species. 4 (10), 275-283 (2017).
- Birsoy, K., et al. An essential role of the mitochondrial electron transport chain in cell proliferation is to enable aspartate synthesis. Cell. 162 (3), 540-551 (2015).
- Beigneux, A. P., et al. ATP-citrate lyase deficiency in the mouse. Journal of Biological Chemistry. 279 (10), 9557-9564 (2004).
- Gameiro, P. A., et al. In vivo HIF-mediated reductive carboxylation is regulated by citrate levels and sensitizes VHL-deficient cells to glutamine deprivation. Cell Metabolism. 17 (3), 372-385 (2013).
- Fendt, S. M., et al. Reductive glutamine metabolism is a function of the alpha-ketoglutarate to citrate ratio in cells. Nature Communications. 4, 2236 (2013).
- Lee, C. P. Biochemical studies of isolated mitochondria from normal and diseased tissues. Biochimica et Biophysica Acta. 1271 (1), 21-28 (1995).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved