Verwendung des Gehirns von Kükenembryonen als Modell für in vivo und ex vivo Analysen des Verhaltens menschlicher Glioblastomzellen
In diesem Artikel
Zusammenfassung
Kükenembryonen werden zur Untersuchung von humanen Glioblastom-Hirntumoren (GBM) in ovo - und in ex vivo-Hirnschnitt-Kokulturen verwendet. Das Verhalten von GBM-Zellen kann durch Zeitraffermikroskopie in ex vivo Kokulturen aufgezeichnet werden, und beide Präparate können am experimentellen Endpunkt durch detaillierte konfokale 3D-Analyse analysiert werden.
Zusammenfassung
Der Kükenembryo ist ein ideales Modellsystem für die Untersuchung der Entwicklung von Wirbeltieren, insbesondere für experimentelle Manipulationen. Die Verwendung des Kükenembryos wurde erweitert, um die Bildung von humanen Glioblastom-Hirntumoren (GBM) in vivo und die Invasivität von Tumorzellen in das umliegende Hirngewebe zu untersuchen. GBM-Tumoren können durch Injektion einer Suspension fluoreszenzmarkierter Zellen in den E5-Mittelhirnventrikel (optisches Tectum) in der Ovozelle gebildet werden.
Abhängig von den GBM-Zellen bilden sich nach dem Zufallsprinzip kompakte Tumore in der Herzkammer und innerhalb der Hirnwand, und Gruppen von Zellen dringen in das Hirnwandgewebe ein. Dicke Gewebeschnitte (350 μm) von fixierten E15-Tecta mit Tumoren können immungefärbt werden, um zu zeigen, dass eindringende Zellen häufig entlang von Blutgefäßen wandern, wenn sie durch 3D-Rekonstruktion von konfokalen z-Stapelbildern analysiert werden. Lebende E15-Mittelhirn- und Vorderhirnschnitte (250-350 μm) können auf Membraneinsätzen kultiviert werden, wo fluoreszenzmarkierte GBM-Zellen an nicht-zufälligen Stellen eingeführt werden können, um Ex-vivo-Kokulturen zur Analyse der Zellinvasion, die auch entlang von Blutgefäßen auftreten kann, über einen Zeitraum von etwa 1 Woche bereitzustellen. Diese ex vivo Co-Kulturen können mittels Weitfeld- oder konfokaler Fluoreszenz-Zeitraffermikroskopie überwacht werden, um das Verhalten lebender Zellen zu beobachten.
Kokultivierte Scheiben können dann fixiert, immungefärbt und durch konfokale Mikroskopie analysiert werden, um festzustellen, ob die Invasion entlang von Blutgefäßen oder Axonen erfolgte oder nicht. Darüber hinaus kann das Co-Kultursystem zur Untersuchung potenzieller Zell-Zell-Interaktionen verwendet werden, indem Aggregate verschiedener Zelltypen und -farben an verschiedenen präzisen Orten platziert und Zellbewegungen beobachtet werden. Medikamentöse Behandlungen können an Ex-vivo-Kulturen durchgeführt werden, wobei diese Behandlungen nicht mit dem In-ovo-System kompatibel sind. Diese beiden komplementären Ansätze ermöglichen detaillierte und präzise Analysen des Verhaltens menschlicher GBM-Zellen und der Tumorbildung in einer hochgradig manipulierbaren Gehirnumgebung von Wirbeltieren.
Einleitung
In-vitro-Studien des Verhaltens von Krebszellen werden häufig verwendet, um potenzielle Mechanismen zu analysieren, die während des komplexeren Verhaltens wirken, das während der Tumorbildung und Zellinvasion in In-vivo-Xenotransplantatmodellen beobachtet wird. Zum Beispiel haben In-vitro-Studien beim Glioblastom (GBM) Mechanismen aufgedeckt, wie L1CAM möglicherweise während der Tumorbildung und der Gehirninvasion in einem neuartigen Kükenembryo-Xenotransplantat-Hirntumormodellwirkt 1,2,3,4,5. Obwohl sich In-vitro- und In-vivo-Experimente auf nützliche Weise ergänzen, hinterlassen sie eine erhebliche Lücke in der Korrelation der Ergebnisse. Zum Beispiel sind mechanistische Analysen der GBM-Zellmotilität auf einer Schale eine hochgradig künstliche Situation, und In-vivo-Xenograft-Modelle können nur statische Zeitpunkt- oder Endpunktanalysen der Tumorbildung und des Zellverhaltens aufdecken. In-vivo-Studien mit Nagetieren oder Kükenembryonen eignen sich nicht ohne weiteres zur Überwachung des Zellverhaltens, während die Zellen in diesen Xenotransplantatmodellen in Hirngewebe eindringen. Nichtsdestotrotz hat das Xenotransplantatmodell des Kükenembryos gezeigt, dass das Adhäsionsprotein L1CAM eine stimulierende Rolle bei der Invasionsfähigkeit menschlicher T98G-GBM-Zellen spielt 2,5.
Eine geeignete Lösung für dieses Problem kann durch die Überbrückung sowohl von In-vivo- als auch von In-vitro-Methoden unter Verwendung eines organotypischen Hirnschnittkulturmodells, einem sogenannten Ex-vivo-Modell, erreicht werden. In diesem Ex-vivo-Modell kann lebendes Hirngewebe bis zu einigen Wochen in einer Dicke von mehreren hundert Mikrometern gehalten werden, was es ermöglicht, Krebszellen zu implantieren, ihr Verhalten im tatsächlichen Gewebe im Laufe der Zeit zu beobachten und dann am Endpunkt des Experiments eine detailliertere Markeranalyse durchzuführen.
Eine beliebte organotypische Schnittkulturmethode besteht darin, eine mehrere hundert Mikrometer dicke Hirnscheibe auf einer durchscheinenden oder transparenten porösen Membran zu kultivieren, wobei das Gewebe der Luft ausgesetzt bleibt und dennoch Nährmedien das Gewebe von unterhalb der Membran erhalten können (siehe Stoppini et al.6). Verschiedene Variationen dieser Methode wurden für verschiedene Studien verwendet, einschließlich der Verwendung unterschiedlicher Medien oder unterschiedlicher Membraneinsätze. Zu den verschiedenen Membraneinsätzen gehören ein poröser (0,4 μm) Membraneinsatz mit 30 mm Durchmesser in einer 35-mm-Kulturschale6 und Zellkultureinsätze (0,4 μm) für 6-Well-Platten7. Zu den verschiedenen Medien gehören 50 % MEM/HEPES + 25 % hitzeinaktiviertes Pferdeserum + 25 % Hanks Balanced Salt Solution (HBSS)8, 50 % reduzierte Serummedien + 25 % Pferdeserum + 25 % HBSS9 sowie andere. Wenn eine transluzente oder transparente Membran zusammen mit fluoreszenzmarkierten GBM-Zellen verwendet wird, können solche Kulturen von unten mit einem inversen Weitfeld- oder konfokalen Fluoreszenzmikroskop abgebildet werden 10,11,12,13,14,15.
Während viele in vivo orthotope Hirntumor-Xenotransplantate und ex vivo organotypische Hirnschnittkulturmodelle mit Nagetieren etabliert wurden, wurde der Kükenembryo (Gallus gallus) für diese Zwecke nicht ausreichend genutzt. Es wurde jedoch gezeigt, dass der Kükenembryo als orthotopes Xenotransplantatmodell in vivo für die Untersuchung der Invasion von Gliomen beim Menschen und bei Ratten verwendet werden kann 1,2,5. Xenotransplantierte Zellen in das Gehirn von Kükenembryonen zeigten ähnliche Invasionsmuster wie in Nagetiermodellen, was die Verwendung von Kükenembryonen als In-vivo-Modell für die Analyse von GBM-Tumorzellen weiter unterstützt. Kükenembryonen sind auch kostengünstig, können leichter gepflegt werden als Nagetiere (d. h. in ihren Eierschalen in einem Laborinkubator) und sind viel einfacher zu verarbeiten, was sie zu einer attraktiven Option für kurzfristige In-vivo-GBM-Studien macht. In einem kürzlich erschienenen Artikel wurde die Verwendung von Gehirnschnittkulturen aus Kükenembryonen für die Bildung und das Wachstum von Axonen während der normalen Gehirnentwicklung beschrieben, bei denen die Schnitte mindestens 7 Tage lang lebensfähig waren16. Die Verwendung solcher Kükenembryonen-Hirnschnittkulturen für die ex vivo Analyse des Verhaltens von GBM-Zellen in einer Gewebeumgebung fehlt jedoch. In diesem Artikel wird sowohl die Transplantation von humanen GBM-Zellen und GBM-Stammzellen (GSCs) in das Gehirn des frühen Kükenembryos in vivo beschrieben, als auch die Einführung von GBM-Zellen in lebende Kükenembryonen-Hirnschnittkulturen ex vivo. Einige repräsentative Beispiele für die resultierenden Tumore und Zellinvasionsmuster, die aus diesen Präparaten gewonnen werden, werden ebenfalls bereitgestellt.
Protokoll
Für die Durchführung dieser Arbeiten war keine Freigabe oder Genehmigung an der University of Delaware erforderlich.
1. Injektion von GBM-Zellen in das optische Tectum des Kükens
- Vorbereitung von GSCs und GBM-Zellen für die Injektion
- Kultivieren von GSCs in GSC-Medien (Tabelle 1). Kultivierte GBM-Zelllinien in GBM-Medien (Tabelle 1).
- Spülen Sie die Zellen auf Tellern mit steriler phosphatgepufferter Kochsalzlösung (PBS) ab und geben Sie 1 ml Trypsinlösung in eine 10-cm-Schale. 2-3 Minuten in einem Zellkultur-Inkubator ruhen lassen, bis sich die Zellen zu lösen beginnen.
- Inaktivieren Sie das Trypsin, indem Sie 10 ml geeignetes serumhaltiges Nährmedium in die 10-cm-Schale geben und die Zellen durch Auf- und Abpipettieren lösen. Legen Sie die Zellsuspension in ein konisches Zentrifugenröhrchen mit einem Fassungsvermögen von 15 ml.
- Die Zellen werden durch Zentrifugation bei 800 × g für 5 min bei 4 °C pelletiert.
- Saugen Sie das Medium aus dem Zellpellet mit einer Einweg-Feinglaspipette ab, die an einem Seitenarmkolben und einer Vakuumpumpe befestigt ist. Resuspendieren Sie die Zellen in geeigneten Nährmedien auf eine Konzentration von 10.000 Zellen pro Mikroliter und legen Sie sie in ein Mikrofugenröhrchen oder ein kleines Schraubröhrchen auf Eis.
- Mischen Sie die Zellen mit einer kleinen Menge sterilem 1% Fast Green FCF-Farbstoff (verwenden Sie ein Verhältnis von 5 μl Farbstoff zu 100 μl Zellsuspension).
- Injektion von GBM-Zellen in das E5-optische Tectum in ovo. Siehe ergänzende Abbildung 1.
- Die befruchteten Hühnereier werden in einem befeuchteten Ei-Inkubator mit dem spitzen Ende nach unten bei 37,5 °C bebrütet (der 1. Bruttag ist der Embryonaltag 0 [E0]). Am 6. Tag der Inkubation (E5) sterilisieren Sie die Eierschale durch Besprühen mit 70%igem Ethanol.
- Zeichnen Sie mit einem Ei-Kerzen mit einem Bleistift den Umfang des Luftraums über dem Embryo nach und bedecken Sie den umrissenen Bereich mit transparentem Klebeband.
- Schneiden Sie mit einer gebogenen Schere vorsichtig um den nachgezeichneten Bereich herum, achten Sie darauf, nicht in die embryonalen Membranen oder Blutgefäße zu schneiden, und entsorgen Sie die Oberseite der Eierschale.
- Geben Sie ein paar Tropfen Kochsalzlösung oder Zellkulturmedien auf die Luftraummembran, um sie zu benetzen, damit sie sich leicht lösen kann. Stechen Sie mit einer feinen Pinzette vorsichtig in die Luftraummembran über der Oberseite des Embryos, entfernen Sie sie und lokalisieren Sie den Kopf des Kükenembryos.
- Verwenden Sie eine feine Pinzette, um die transparente Amnionmembran zu greifen, die den Embryo unmittelbar umgibt, um den Kopf so zu positionieren, dass das optische Tectum mit Zellen injiziert werden kann. Halten Sie sich mit einer Hand mit der feinen Pinzette am Amnion fest, um den Kopf während des Injektionsvorgangs an Ort und Stelle zu halten. Achten Sie darauf, die extraembryonalen Blutgefäße in der chorioallantoischen Membran auf dem Eigelb nicht zu beschädigen.
HINWEIS: Das obige Verfahren erfordert etwas Übung, um die durchsichtige Amnionmembran, die den Embryo innig umgibt, effizient greifen zu können, da sie unsichtbar ist, bis sie gegriffen und gezogen wird. Üben Sie mit einer feinen Pinzette, um das klare Amnion zu greifen, das den Embryo unmittelbar umgibt. - Halten Sie den Kopf ruhig, indem Sie die Amnionmembran mit einer feinen Pinzette greifen. Injizieren Sie mit einer Glasmikropipette und einer pneumatischen Picopumpe ca. 50.000 Zellen in 5 μL geeignetem Zellkulturmedium in das optische Tectum (5 μL entsprechen ca. 1/2 einer gefüllten Mikropipette).
HINWEIS: Siehe Cretu et al.1 für ein Bild eines E5-Embryos, dem GBM-Zellen injiziert wurden, die mit Farbstoff gemischt wurden. - Geben Sie ein paar Tropfen 50 mg/ml Ampicillin auf den Embryo.
- Decken Sie das Loch in der Oberseite der Eier mit durchsichtigem Klebeband ab und lassen Sie es zum Sezieren bis E15 im Luftbefeuchter.
2. Präparation von Hirnregionen aus E15-Embryonen
ANMERKUNG: Die Dissektion von E15-Gehirnen hier zur Fixierung ähnelt der in Schritt 8.2 beschriebenen für lebende Hirnschnitte, aber die Dissektion hier muss nicht unter aseptischen Bedingungen durchgeführt werden.
- Schneiden Sie das Klebeband um die Oberseite der Schale ab, um den Zugang zum Embryo zu ermöglichen.
- Enthaupten Sie den Embryo am Hals und legen Sie den Kopf in eine 10-cm-Schale mit steriler kalzium- und magnesiumfreier Tyrode-Lösung (CMF Tyrode). Siehe ergänzende Abbildung 2.
- Ziehen Sie mit einer feinen Pinzette die Haut ab, die das Gehirn bedeckt, um die darunter liegende Dura mater freizulegen. Entfernen Sie die sich bildenden Schädelknochen auf der linken und rechten Seite des Gehirns. Die sich bildenden Schädelknochen bedecken noch nicht den größten Teil des Gehirns.
- Reißen Sie vorsichtig mit einer feinen spitzen Pinzette durch die Hirnhäute, die über der Mitte des Gehirns liegen, und ziehen Sie sie zu jeder Seite ab, um das Gehirn freizulegen.
- Verwenden Sie eine gebogene Pinzette, um das Gehirn von unten zu schöpfen und es vorsichtig aus seiner Höhle zu ziehen.
- Zerlegen Sie das Gehirn in seine Teile: Vorderhirn, Tecta, Kleinhirn.
- Entfernen Sie die darüber liegende Pia mater mit einer feinen Pinzette aus der Tecta. Beachten Sie, dass sich die Pia leicht von der Tecta trennt, aber nicht vom Vorderhirn oder Kleinhirn. Entfernen Sie die Pia aus dem Vorderhirn, indem Sie sie berühren oder auf einem kleinen Stück Filterpapier rollen.
- Die präparierten Hirnregionen in eine kleine Schüssel geben.
- Legen Sie die Hirnregionen zur Fixierung in eine 24-Well-Plattenvertiefung und fixieren Sie sie in 2%igem Paraformaldehyd (PFA) in 0,1 M Natriumcacodylatpuffer. Mindestens 24 h bei 4 °C ruhen lassen.
- Spülen Sie das Gewebe nach der Fixierung mindestens 1 Stunde lang in 3x PBS aus, bevor Sie es in Agar einbetten.
3. Einbetten und Schneiden von geernteten Hirnregionen
- Eine Lösung aus 3,5 % Agar und 8 % Saccharose in PBS vorwärmen, bis sie geschmolzen ist, und bei Schmelztemperatur halten.
- Nehmen Sie mit einer gebogenen Pinzette als Schaufel vorsichtig entweder das optische Tectum oder die Vorderhirnregion des Gehirns des Kükenembryos auf und tupfen Sie es leicht auf Filterpapier ab, um zusätzliche Flüssigkeit zu entfernen und die Haftung des Agars an der äußeren Gehirnoberfläche sicherzustellen.
- Füllen Sie die Form mit einer sterilen Transferpipette mit Agarlösung.
Anmerkungen: Eine einfache Form kann hergestellt werden, indem Aluminiumfolie um ein Objekt geeigneter Größe geformt wird, z. B. kleine rechteckige vibrierende Gewebeschneideblöcke aus Metall. - Legen Sie die Gehirnregion in Agar und lassen Sie den Agar vollständig erstarren.
- Entfernen Sie die Alufolie um das eingebettete Gehirn herum und schneiden Sie überschüssiges Agar mit einer Rasierklinge oder einem Skalpell an den Seiten ab.
- Geben Sie einen Tropfen Cyanacrylatkleber auf das Edelstahlquadrat der Schneideschale, legen Sie den Agaroseblock mit dem Gehirn auf den Kleber und lassen Sie den Kleber 1 Minute lang einwirken. Setzen Sie die Schale in das Spannfutter für vibrierende Tissue-Aufschnittmaschinen ein, ziehen Sie sie fest und füllen Sie die Schale mit genügend PBS, um die Oberseite des Agarblocks zu bedecken.
- Schneiden Sie die Gehirnschnitte auf einem 350 μm dicken Vibrationsgewebeschneider mit einer Rasierklinge aus Stahl.
- Wenn die Hirnscheiben geschnitten sind und frei in die Schneideschale schwimmen, verwenden Sie einen Spatel, um die Scheiben aufzunehmen und aus der Schale zu nehmen. Schieben Sie den Abschnitt vorsichtig vom Spatel und in eine beschriftete 10-cm-Petrischale mit PBS, damit die Abschnitte frei schwimmen.
Anmerkungen: Der Agar, der den Hirnschnitt umgibt, kann sich lösen, wenn das Gehirn nicht ausreichend mit Filterpapier abgetupft wird, um überschüssige Flüssigkeit vor dem Einbetten zu entfernen. In diesem Fall kann das Hirngewebe schonend aus dem erstarrten Agar entfernt und nach ordnungsgemäßem Abtupfen der überschüssigen Flüssigkeit wieder eingebettet werden.
4. Immunfärbung von Hirnschnitten mit Tumorzellen
- Untersuchen Sie mit einem Stereomikroskop, das mit Epifluoreszenz ausgestattet ist, einzelne Schichten in der 10-cm-Schale nacheinander auf das Vorhandensein oder Fehlen von Tumorzellen.
- Bereiten Sie eine ausreichende Menge phosphatgepufferter Kochsalzlösung mit 0,1 % Triton X-100 und 5 % normalem Ziegenserum (PBSTG) (siehe Tabelle 1) für die Immunfärbung vor und spülen Sie die zu immunfärbenden Scheiben ab.
- Füllen Sie die Vertiefungen zur Hälfte in eine 24-Well-Platte, die für die Färbung von Gehirnschnitten mit PBS verwendet wird.
- Schneiden Sie die Ecken des Agars um die Hirnscheiben herum mit der Kante eines Spatels oder Skalpells ab und legen Sie sie vorsichtig in die Vertiefungen, die PBS enthalten.
- Das PBS wird abgesaugt und durch 350 μl primäre Antikörper-Färbelösung in PBSTG ersetzt (z. B. 2 μg/ml UJ127 in PBSTG).
- Inkubieren Sie 24 Stunden lang in einem Kühlraum unter sanftem Rühren, so dass sich die Scheibe frei in der Vertiefung bewegen kann.
- Nach 24 h wird die primäre Antikörperlösung entfernt und 3 x 1 h mit PBSTG in einem Kühlraum mit Rühren gespült.
- Nach dem Spülen in 350 μl/Well sekundärer Antikörper-Färbelösung in PBSTG inkubieren (z. B. 1/200 Verdünnung von Biotin-GAM in PBSTG). 20 h in einem Kühlraum mit Rühren inkubieren.
Anmerkungen: Wenn Sie auf den tertiären Schritt verzichten und in diesem Schritt mit dem fluorochromhaltigen Sekundärantikörper inkubieren, decken Sie den Deckel ab sofort ab, um sich während der Inkubation vor Licht zu schützen, und fahren Sie dann mit Schritt 4.11 fort. - Entfernen Sie die sekundäre Antikörperlösung und spülen Sie 3 x 1 h in PBSTG in einem Kühlraum mit Rühren.
- Entfernen Sie das PBSTG und inkubieren Sie es in der tertiären Lösung (z. B. 1:250 Verdünnung von Alexa Fluor 647 Streptavidin in PBSTG). Falls gewünscht, färben Sie die Kerne in diesem Schritt, indem Sie der Mischung 0,1 μg/ml Bisbenzimid hinzufügen. 20 h in einem Kühlraum mit Rühren inkubieren.
- Entfernen Sie die Tertiärlösung und spülen Sie 3 x 1 h in PBSTG in einem Kühlraum mit Rühren.
- In PBS belassen, bis es auf Objektträgern montiert werden kann.
5. Scheiben auf Objektträger montieren
- Bereiten Sie so viele Objektträger vor, wie es zu montierende Abschnitte gibt.
- Legen Sie für jeden Objektträger einen 50 mm langen Streifen mit 10 mil (254 μm) dickem Vinyl-Isolierband auf ein Stück Parafilm.
- Stanzen Sie mit einem quadratischen Locher von 1 cm x 1 cm ein Loch durch die Mitte des Isolierbandes und des Parafilms.
- Ziehen Sie das Klebeband vom Parafilm ab und legen Sie es auf den Objektträger, wobei Sie Platz für das Beschriftungsband auf dem Objektträger lassen.
- Geben Sie mit einer Mikropipette ein oder zwei Tropfen des lichtbeständigen Eindeckmediums in das quadratische Loch in der Mitte des Isolierbandes.
- Verwenden Sie einen gebogenen Spatel, um den gewünschten vibrierenden Tissue-Slicer-Abschnitt vom PBSTG abzuheben und Feuchtigkeit mit einem sauberen Labortuch oder einem Stück Filterpapier gründlich abzuleiten.
- Berühren Sie den Rand der Scheibe mit dem Tropfen Eindeckmittel und schieben Sie den Abschnitt mit einem anderen Spatel vorsichtig in das Eindeckmedium.
- Decken Sie den Abschnitt mit ein paar weiteren Tropfen Eindeckmittel ab und legen Sie vorsichtig ein 24 mm x 30 mm (#1,5 Dicke) Deckglas auf den Abschnitt und das Eindeckmittel.
- Versiegeln Sie die Ränder des Deckglases mit Nagellack, um es an Ort und Stelle zu halten.
6. Konfokale Mikroskopie festsitzender Hirnschnitte
- Verwenden Sie Weitfeldfluoreszenz, um fluoreszierende Tumore in der montierten Hirnschicht zu finden, indem Sie die entsprechenden Objektivlinsen und Filtersätze verwenden.
HINWEIS: Einige Tumore können ziemlich groß sein und sind mit dem 4x-Objektiv leicht sichtbar, während einzelne Zellen das 10x-Objektiv erfordern können. - Wechseln Sie zur konfokalen Mikroskopie mit einem geeigneten Objektiv, Lasern, Lochblendengröße und Detektoreinstellungen. Um diesem Protokoll zu folgen, verwenden Sie ein 20-fach-Objektiv (numerische Apertur [N.A.] = 0,75) für die Routinebildgebung und ein 60-faches Ölobjektiv (N.A. = 1,40) für hochauflösende Bildgebung.
- Legen Sie obere und untere Grenzen der z-Achse und der Schrittweite (für die spezifische Situation gemäß den Anweisungen des Herstellers des konfokalen Mikroskops) für die Aufnahme optischer Schnitte fest. Erfassen Sie einen Z-Stapel optischer Schnitte.
- Verwenden Sie die konfokale Mikroskopsoftware, um ein 3D-Volumen-Rendering des Tumors gemäß den Anweisungen des Herstellers zu erstellen.
7. Sphäroid-Präparation
- Herstellung von Poly(2-hydroxyethylmethacrylat)-Platten (Poly-HEMA)
- Stellen Sie eine Lösung aus 10 μg/ml Poly-HEMA in 95%igem Ethanol her und beschichten Sie 35-mm-Petrischalen (oder Zellkulturschalen) mit 1 ml dieser Lösung.
- Lassen Sie das Geschirr über Nacht bei Raumtemperatur auf einer unbedeckten Wippe stehen, um eine Beschichtung der Schalenoberfläche zu entwickeln.
Anmerkungen: Das Lösungsmittel verdunstet und hinterlässt eine durchscheinende Beschichtung auf der Schale, die ungleichmäßig erscheinen kann, aber dies hat keinen Einfluss auf die Fähigkeit, Zellsphäroide zu bilden. - Nach dem Trocknen sterilisieren Sie das offene Geschirr unter UV-Licht in einer Biosicherheitswerkbank für 1 h. Setzen Sie die Deckel nach der Sterilisation wieder auf. Die beschichteten Schalen sind nun gebrauchsfertig.
- Fluoreszenz-DiD-Färbung für die Zeitraffermikroskopie
HINWEIS: Dieser Abschnitt ist für die Färbung einzelner Zellen mit DiD-Fluoreszenzfarbstoff vorgesehen, der zur Herstellung von Sphäroiden verwendet wird, wodurch die Visualisierung der Zellmotilität für Live-Zeitrafferaufnahmen optimiert wird.- Suspendieren Sie die Zellen in einem serumfreien Nährmedium.
- Fügen Sie 5 μl DiD-Stamm / ml Zellsuspension hinzu und mischen Sie vorsichtig durch Pipettieren. 20 min bei 37 °C inkubieren.
- Die markierte Zellsuspension wird bei 800 × g bei 5 °C für 5 min zentrifugiert.
- Saugen Sie den Überstand ab und resuspendieren Sie die Zellen in warmen Medien, um sie zu spülen.
- Wiederholen Sie diese Zentrifugation und spülen Sie den Schritt noch zwei weitere Male.
Anmerkungen: Falls gewünscht, fahren Sie mit Schritt 7.3.6 fort, um sofort nach diesem Vorgang Sphäroide zu erstellen.
- Herstellung von Zellsphäroiden
- 0,25%ige Trypsin/Ethylendiamintetraessigsäure (EDTA)-Lösung auf 37 °C erwärmen.
- Kultivieren Sie GSCs in GSC-Medien17 (Tabelle 1) und U-118-Malignomgloima (MG)-Zellen in U-118-Nährmedium (siehe Tabelle 1). Verwenden Sie eine konfluente 10-cm-Schale für die Zubereitung einer 35-mm-Platte mit Sphäroiden. Die Wachstumsfaktoren bFGF (10 ng/ml Endkonzentration) und TGF-α (20 ng/ml Endkonzentration) werden zunächst und dann alle 3 Tage zu den GSCs gegeben.
HINWEIS: Die in der aktuellen Studie verwendeten Zellen waren grünes GSC15-2/K72, grünes GSC16-4/K72, rotes U-118/L1LE/mCherry2x und rotes U-118/1879/mCherry2x. Eine Platte mit Sphäroiden sollte für zwei 6-Well-Platten mit Hirnschnitten auf Membraneinsätzen ausreichen. - Spülen Sie die Zellen auf den Platten mit sterilem PBS ab und geben Sie 1 ml Trypsinlösung auf eine 10-cm-Schale. Für 2-3 min in den Zellkultur-Inkubator geben, bis sich die Zellen zu lösen beginnen.
- Inaktivieren Sie das Trypsin, indem Sie 10 ml geeignetes serumhaltiges Nährmedium in die 10-cm-Schale geben und die Zellen durch Auf- und Abpipettieren lösen. Legen Sie die Zellsuspension in ein konisches Zentrifugenröhrchen mit einem Fassungsvermögen von 15 ml.
- Die Zellen werden durch Zentrifugieren bei 800 × g für 5 min bei 4 °C pelletiert.
- Saugen Sie das Medium aus dem Zellpellet ab und resuspendieren Sie die Zellen in 10 ml Medien.
- Geben Sie 2 ml Zellsuspension auf jede 35-mm-Poly-HEMA-beschichtete Schale und fügen Sie weitere 2 ml des geeigneten Mediums hinzu, um 4 ml Gesamtmedium pro Schale zu erhalten. Wenn Sie GSCs verwenden, fügen Sie Wachstumsfaktoren hinzu.
- Inkubieren Sie die Zellen in einem Zellinkubator, bis die Aggregate eine Größe von 100-200 μm erreichen, was je nach Dichte der beschichteten Zellen 1-2 Tage dauern kann.
8. Sektion des Gehirns von lebenden Küken und Schneiden von vibrierenden Gewebeschneidemaschinen
- Vorbereitung auf die Präparation
- Bereiten Sie eine 6-Well-Polyestermembran-Einlegeplatte mit 1 ml Hirnschnitt-Nährmedium (siehe Tabelle 1) unter dem Membraneinsatz vor.
- Sterilisieren Sie den Arbeitsbereich und die Werkzeuge mit 70 % Ethanol.
- Legen Sie die 6-Well-Einlegeplatte während der Präparation auf Eis.
- Bereiten Sie 100 ml vibrierendes Tissue-Slicer-Schneidemedium vor (Tabelle 1) und legen Sie es auf Eis.
- Eine Durchstechflasche mit 4 % niedrig schmelzender Agarose in PBS in ein Wasserbad stellen, bis sie zu einer Flüssigkeit schmilzt (ca. 50 °C).
- Füllen Sie die Wanne des vibrierenden Taschentuchschneiders mit Eis.
- Aseptische E14/15 Gehirndissektion des Kükenembryos
- Zeichnen Sie mit einer Eikerze mit einem Bleistift den Umfang der Lufttasche über dem E14- oder E15-Embryo nach und bedecken Sie den umrissenen Bereich mit transparentem Klebeband.
- Schneiden Sie mit einer gebogenen oder feinen Schere vorsichtig um den nachgezeichneten Bereich herum, achten Sie darauf, nicht in die Embryomembran oder die Blutgefäße zu schneiden, und werfen Sie das obere Stück der Schale weg.
- Entfernen Sie mit einer gebogenen Pinzette die Luftraummembran über der Oberseite des Embryos und lokalisieren Sie den Kopf des Kükenembryos.
- Enthaupten Sie den Embryo und legen Sie den Kopf in eine 10-cm-Schale mit kalter, steriler CMF-Lösung. Siehe ergänzende Abbildung 2.
- Ziehen Sie mit einer sterilen, feinen Pinzette die Haut ab, die das Gehirn bedeckt, um die darunter liegende Dura mater freizulegen. Entfernen Sie die sich bildenden Schädelknochen auf der linken und rechten Seite des Gehirns. Die sich bildenden Schädelknochen bedecken noch nicht den größten Teil des Gehirns.
- Reißen Sie vorsichtig mit einer feinen spitzen Pinzette (#5 oder #55) durch die Hirnhäute, die über dem Zentrum des Gehirns liegen, und schälen Sie sie zu jeder Seite, um das Gehirn freizulegen.
- Schöpfen Sie das Gehirn mit einer fein gebogenen Pinzette von unten nach oben und ziehen Sie es vorsichtig aus seiner Höhle.
- Zerlegen Sie das Gehirn in seine drei Hauptteile: Vorderhirn, Mittelhirn (optische Tecta), Kleinhirn. Konsultieren Sie bei Bedarf einen Atlas der Kükenentwicklung.
- Entfernen Sie die darüber liegende Pia mater mit einer feinen Pinzette aus der Tecta.
ANMERKUNG: Die Pia löst sich leicht von der Tecta, aber nicht vom Vorderhirn oder Kleinhirn. Die Pia kann aus dem Vorderhirn entfernt werden, indem man sie berührt oder auf steriler Gaze rollt. - Legen Sie die präparierten Gehirnregionen in eine kleine sterile Schale auf Eis.
- Das Gehirn einbetten und in Scheiben schneiden
- Nehmen Sie mit einer gebogenen Pinzette als Schaufel vorsichtig entweder das optische Tectum oder die Vorderhirnregion auf und tupfen Sie sie leicht auf sterile Gaze, um überschüssige Flüssigkeit zu entfernen und die Haftung der Agarose an der äußeren Gehirnoberfläche sicherzustellen.
- Füllen Sie die Form mit einer sterilen Transferpipette mit niedrig schmelzender Agarose. Bereiten Sie eine einfache Form vor, indem Sie Aluminiumfolie um ein Objekt entsprechend großer Größe formen. Der kleine rechteckige vibrierende Gewebeschneideblock aus Metall wird routinemäßig als Objekt verwendet. Siehe ergänzende Abbildung 3.
- Legen Sie die Gehirnregion schnell in Agarose und lassen Sie sie auf Eis erstarren (ca. 4-5 Minuten).
Anmerkungen: Das Gehirn kann auf den Boden des Schimmelpilzes sinken, bevor die Agarose aushärtet. Warten Sie in diesem Fall 1 Minute, bis der Agar fest wird, und legen Sie dann die Gehirnregion in die Agarose. Versuchen Sie, die Hirnregion direkt in der Mitte der Agarose aufzuhängen. - Entfernen Sie die Aluminiumfolie um das eingebettete Gehirn herum in der verfestigten Agarose und schneiden Sie überschüssige Agarose mit einer sterilen Rasierklinge oder einem Skalpell an den Seiten ab.
- Geben Sie einen Tropfen Cyanacrylatkleber auf das Edelstahlquadrat der Schneideschale/des Tabletts, legen Sie den Agaroseblock mit dem Gehirn und lassen Sie den Kleber 1 Minute lang einwirken. Legen Sie die Schale/das Tablett in das Spannfutter des Vibrationstuchschneiders, ziehen Sie es fest und füllen Sie das Tablett mit Schneidemedien, um die Oberseite des Agaroseblocks zu bedecken.
- Schneiden Sie die Abschnitte auf einem vibrierenden Gewebeschneider bei 250-350 μm mit einem Saphirmesser ab, von dem berichtet wurde, dass es zu weniger Schäden an lebendem Gewebe führt als eine Rasierklinge aus Stahl.
- Wenn die Hirnscheiben geschnitten sind und frei in die Schneideschale schwimmen, verwenden Sie einen sterilen Spatel, um die Scheibe aufzunehmen und aus der Schale zu nehmen. Schieben Sie den Abschnitt vorsichtig vom Spatel ab und auf einen Membraneinsatz mit einem anderen sterilen Spatel.
HINWEIS: Normalerweise können auf Wunsch zwei oder drei Hirnschnitte auf jeden Membraneinsatz gelegt werden. Die Agarose, die den Hirnschnitt umgibt, kann sich lösen, wenn das Gehirn nicht ausreichend mit steriler Gaze abgetupft wird, um überschüssige Flüssigkeit zu entfernen. Tritt dies nach ausreichendem Blotting vor dem Einbetten immer noch auf, nehmen Sie die Scheibe ohne die umgebende Agarose vorsichtig auf und schieben Sie sie auf den Membraneinsatz. - Legen Sie die 6-Well-Platte mit Hirnschnitten auf Membraneinsätze in den Zellkulturinkubator bei 37 °C und 5 % CO2.
- Verwenden Sie am Tag nach dem Plattieren eine sterile Pasteurpipette, um das Medium von unterhalb des Einsatzes abzusaugen (an den Seiten der Einsätze befinden sich Lücken, damit eine Pipette Zugang zu dem darunter liegenden Medium erhält). Geben Sie 1 ml frisches Schneidemedium in jede Vertiefung unter dem Membraneinsatz. Wechseln Sie danach jeden zweiten Tag das Medium.
- Warten Sie ein paar Tage, bis die Hirnschnitte fest an den Membraneinsätzen haften und sich etwas abzuflachen scheinen. Dies ist ein Zeichen dafür, dass die Scheiben lebensfähig und bereit für die Einführung von GBM-Zellen sind.
9. GBM-Zelleinschleusung in Hirnschnitte
- Sphäroid-Methode
- Nachdem die Zellsphäroide eine Größe von 150-200 μm erreicht haben, verwenden Sie eine 20-μl-Mikropipette, die auf 5 μl eingestellt ist, um ein bis mehrere Sphäroide aus ihrer Kulturschale zu entfernen. Siehe ergänzende Abbildung 3.
- Stoßen Sie das Medium vorsichtig mit Sphäroiden auf die gewünschte Hirnscheibe aus.
Anmerkungen: Die Zellkugeln sollten in der Pipettenspitze sichtbar sein. Wenn Sie eine durchsichtige Pipettenspitze verwenden, sind sie in der Spitze leichter zu erkennen. Wenn das Sphäroid bei der Freisetzung der Flüssigkeit von der Hirnscheibe abfällt, sollte eine ethanolsterilisierte Wimper verwendet werden, die auf einen dünnen Holzapplikatorstab geklebt ist, um das Sphäroid vorsichtig wieder auf die Hirnscheibe zu schieben. - Lassen Sie die Sphäroide 2-5 Tage lang auf den Hirnschnitten kultivieren.
HINWEIS: Die Einschränkung scheint hier der eventuelle Abbau von Blutgefäßen und Gehirnzellen in der Scheibe zu sein. Abgebaute Blutgefäße erscheinen als diskontinuierliche Kugeln in der Scheibe, wenn sie für Laminin gefärbt werden.
- Biopsie-Stanz-Methode
- Lassen Sie die Hirnschnitte anhaften, indem Sie sich auf dem Membraneinsatz abzuflachen scheinen (kann in Kultur 2-5 Tage dauern).
- Tauen Sie die Zellmatrix auf Eis auf.
- Schließen Sie in der Biosicherheitswerkbank für Zellkulturen eine sterile Biopsiestanze mit einem Durchmesser von 1 mm an ein Vakuum-Aspiratorrohr an.
- Berühren Sie die Hirnscheibe vorsichtig mit der Biopsiestanze, um ein 1 mm großes Loch in der Mitte der Hirnscheibe zu erzeugen.
HINWEIS: Das Gewebe in der Biopsiestanze wird durch das Vakuum in die Stanze abgesaugt. - Bereiten Sie eine Zellmatrixsuspension vor, indem Sie eine 60%-70% konfluente 10-cm-Schale mit Zellen trypsinieren und in 10 ml Medium resuspendieren; Mischen Sie dann 1 ml dieser Suspension mit 100 μl Matrix.
- Geben Sie mit einer 20-μl-Mikropipette 1 μl der Zellmatrixmischung in jedes Loch in den Hirnschnitten.
- Nachdem die Platzierung der Zellmischung abgeschlossen ist, stellen Sie die Schale mit den Hirnschnitten mit eingebetteten Zellen zurück in den Inkubator und lassen Sie die Matrix erstarren und die Zellen möglicherweise in den umgebenden Gehirnschnitt eindringen.
10. Weitfeld-Fluoreszenz-Zeitraffermikroskopie
- Legen Sie abnehmbares Klebeband um den Rand der 6-Well-Platte, um ein Verdampfen des Mediums zu verhindern, und lassen Sie auf einer Seite einen kleinen Spalt für den Gasaustausch.
- Platzieren Sie die Platten in einer maßgeschneiderten Kulturkammer auf einem einstellbaren automatisierten Tisch auf einem inversen Epifluoreszenzmikroskop.
HINWEIS: Die Kammer wurde mit einem Gasinjektionsregler unter atmosphärischen Bedingungen von 5 % CO2 und 95 % Luft gehalten, und die Temperatur wurde mit einem Warmlufttemperaturregler und einem temperaturgesteuerten Tischeinsatz auf 37 °C gehalten. Siehe Fotos et al.18 für Details über das hier verwendete System. - Erstellen Sie mit einer geeigneten Mikroskopsteuerungssoftware einen Zeitraffer-Aufnahmeplan, der 20 Stunden lang alle 10 Minuten Fluoreszenzbilder der interessierenden Bereiche aufnimmt.
HINWEIS: Wenn in Zellen eine grün fluoreszierende Markierung verwendet wird (z. B. grün fluoreszierendes Protein [GFP]), verwenden Sie die minimale Menge an blauem Anregungslicht, die zur Visualisierung der Zellen erforderlich ist, um Phototoxizität zu vermeiden. Rote (z. B. mCherry) und dunkelrote (z. B. DiD) Markierungen scheinen dieses potenzielle Problem aufgrund der Anregung längerer Wellenlängen nicht zu haben.
11. Immunfärbung von Hirnschnitten nach Zeitraffermikroskopie
HINWEIS: Dieses Immunfärbeprotokoll ist für die Färbung von Blutgefäßen mit Laminin und Zellkernen mit Bisbenzimid optimiert. Verwenden Sie geeignete Antikörper für das/die gewünschte(n) Molekül(e) von Interesse.
- Saugen Sie das Medium mit einer Pasteurpipette von unterhalb des Membraneinsatzes ab und geben Sie 1 ml 2%iges PFA in 0,1 M Natriumcacodylatpuffer unter den Einsatz und 1 ml auf den Einsatz, um die Hirnscheibe zu bedecken. Die Scheiben über Nacht bei 4 °C fest werden lassen.
- Entfernen Sie das Fixiermittel von der Unterseite des Membraneinsatzes und alle Fixiermittel, die auf der Hirnscheibe verbleiben (das Fixiermittel neigt dazu, durch den Membraneinsatz in die darunter liegende Vertiefung zu gelangen).
- Nehmen Sie den Einsatz mit den Scheiben aus der 35-mm-Vertiefung und legen Sie sie in eine größere Plastikschale.
- Bereiten Sie eine 24-Well-Platte vor, indem Sie 350 μl PBS in so viele Wells geben, wie Hirnschnitte vorhanden sind (eine Scheibe/Well bei Immunfärbung).
- Entfernen Sie die Agarose vorsichtig mit einem dünnen Spatel um die Hirnscheibe herum, ohne die Hirnscheibe vom Membraneinsatz zu lösen. Achten Sie darauf, dass sich die Agarose leicht vom äußeren Rand des Hirnschnitts löst. Wenn nicht, lassen Sie die Agarose an der Gehirnscheibe haften.
- Schneiden Sie mit einem scharfen Skalpell durch die Membran um den Hirnschnitt, bis der Schnitt mit der darunter liegenden Membran frei vom Rest des Einsatzes ist. Nehmen Sie die Membran mit dem angebrachten Hirnschnitt auf, greifen Sie die Membran mit einer feinen Pinzette und legen Sie sie in eine Vertiefung der 24-Well-Platte in PBS.
- Spülen Sie die Scheiben 3x mit PBS über 1 h im Kühlraum unter ständigem sanftem Rühren oder Schaukeln, so dass sich die Scheibe innerhalb der Vertiefung bewegt.
- Bereiten Sie während des Spülens die primäre Antikörperlösung vor.
- Antilaminin in PBSTG auf 2 μg/ml verdünnen (siehe Tabelle 1).
- Entfernen Sie das PBS aus den Vertiefungen und inkubieren Sie es über Nacht in primärer Antikörperlösung in einem Kühlraum unter sanftem Rühren.
- Nach mindestens 20 h Inkubation wird die primäre Antikörperlösung abgesaugt und die Abschnitte 3x für 1 h in PBSTG gespült.
- Bereiten Sie während des Spülens die sekundäre Antikörperlösung vor.
- Verdünnen Sie Fluoreszenz-GAM mit dem spezifischen Fluorochrom, das für eine Verdünnung von 1:200 in PBSTG zusammen mit einer Bisbenzimidkonzentration von 0,1 μg/ml benötigt wird.
- Entfernen Sie PBSTG und inkubieren Sie es über Nacht in einem Kühlraum unter Rühren in der fluoreszierenden sekundären Antikörperlösung.
- Entfernen Sie den Sekundärantikörper und spülen Sie ihn 2x über 1 h in PBSTG und 1x über 1 h in PBS aus.
- Lassen Sie es in PBS, bis Sie bereit sind, es auf Objektträger (Abschnitt 5) zu montieren und zu betrachten.
Ergebnisse
Hier sind mehrere Abbildungen dargestellt, die einige repräsentative Ergebnisse zeigen, die bei der Durchführung von In-vivo-Injektionen in das optische Tectum (Abbildung 1 und Abbildung 2), der Kultivierung lebender Hirnschnitte und der Beurteilung ihrer Lebensfähigkeit (Abbildung 3), der Erzeugung von Ex-vivo-Hirnschnittkulturen und der Implantation fluoreszenzmarkierter Zellen mit der Biopsie-Stanzmethode (Abbildung 4), der Erzeugung von Zellsphäroiden durch Kultivierung von Zellen auf Poly-HEMA (Abbildung 5)), die Erzeugung von Ex-vivo-Hirnschnitt-Kokulturen mit Zellsphäroiden und die Aufzeichnung des invasiven Zellverhaltens mittels konfokaler 4D-Zeitraffermikroskopie (Abbildung 6) und die Analyse des invasiven Zellverhaltens von Sphäroiden im Vergleich zu Blutgefäßen in fixierten Hirnschnittpräparaten (Abbildung 7 und Abbildung 8). Diese Ergebnisse sind keineswegs vollständig, sondern liefern gute Beispiele dafür, was mit dem Gehirn des Kükenembryos als Xenotransplantatmodell für die GBM-Forschung am Menschen gewonnen werden kann.
Abbildung 1 zeigt einige repräsentative Ergebnisse von Tumoren, die sich im optischen Tectum in vivo nach der Injektion von GFP-exprimierenden GSCs gebildet haben. GSCs heften sich an die Ventrikeloberfläche und bilden invasive Tumore in der Hirnwand. GSCs befinden sich eindeutig in der Nähe von Blutgefäßen und scheinen entlang dieser zu wandern. Filme mit rotierenden 3D-Volumen-Renderings von fixierten und immungefärbten Schnitten von In-vivo-GSC-Tumoren sind in Supplementary Video S1, Supplementary Video S2, Supplementary Video S3 und Supplementary Video S4 zu sehen. In diesem Experiment wurden vier Farben verwendet, um fünf Merkmale zu identifizieren (grüne GSCs, weiße Kerne, weiße Blutgefäße, blaues Integrin alpha-6 und entweder rotes Sox2 oder rotes Nestin).
Abbildung 2 zeigt einige repräsentative Ergebnisse von Tumoren, die sich im optischen Tectum in vivo nach der Injektion von GSCs, die GFP exprimieren, gemischt mit U-118/L1LE-Zellen2 , die mCherry exprimieren, aufgrund retroviraler Vektortransduktion gebildet haben. Diese Experimente zeigten, dass, wenn sich diese Tumore aus einer gemischtzelligen Suspension bildeten, die Aussortierung so erfolgte, dass sich die GSCs entweder in der Peripherie oder im Zentrum befanden, während die U-118-Zellen je nach spezifischer GSC-Linie entweder einen inneren Kern oder einen äußeren Kortex umfassten.
Abbildung 3 zeigt die Viabilitätsergebnisse von ex vivo Hirnschnittkulturen. Nach 1 Woche in Kultur zeigten die Fixierung und Immunfärbung von Laminin viele intakte Blutgefäße und die Expression von Sox2, die beide hier verwendet wurden, um die Lebensfähigkeit des Hirnschnitts nachzuweisen. Dies zeigte, dass Gehirnschnitte von Kükenembryonen für etwa 2 Wochen auf Membraneinsätzen kultiviert werden konnten und mit normal erscheinenden Blutgefäßen und Transkriptionsfaktorexpression lebensfähig blieben.
Abbildung 4 zeigt die Ergebnisse der Einführung von "Pfropfen" aus roten U-118/L1LE/mCherry-Zellen (gemischt mit Matrix) in Ex-vivo-Hirnschnitte , nachdem mit der Biopsie-Stanzmethode Hohlräume in den Schnitten erzeugt wurden. U-118-Zellen drangen deutlich in das Hirngewebe ein, manchmal großflächig und oft entlang der Blutgefäße. Die Zellinvasion verlief jedoch nicht gleichmäßig über den Umfang der eingeführten Zellen. In bestimmten Schnitten schienen manchmal auch Blutgefäße beschädigt zu sein oder fehlten, vermutlich aufgrund des zusätzlichen Traumas der Stanzmethode oder der Dauer der Kultur. Dies zeigte, dass die Biopsie-Stanz-/Zellpfropfen-Methode verwendet werden kann, um GBM-Zellen an bestimmten Stellen in einen kultivierten ex vivo Hirnschnitt einzubringen, woraufhin die Zellen in den Hirnschnitt eindringen.
Abbildung 5 zeigt lebende Sphäroide in Kultur und mehrere Beispiele für Weitfeldfluoreszenz von lebenden GBM-Zellsphäroiden, die für Zeitrafferexperimente in ex vivo Hirnschnitte eingebracht wurden. Filme über die Zellinvasion von den Sphäroiden in den Hirnschnitt sind in Supplementary Video S5 und Supplementary Video S6 zu sehen. Dies zeigte, dass Zellsphäroide eine weitere erfolgreiche Methode sind, um GBM-Zellen oder GSCs an bestimmten Stellen eines ex vivo Hirnschnitts einzubringen, und dass invasives Zellverhalten durch Weitfeld-Fluoreszenzmikroskopie beobachtet werden kann, obwohl die Auflösung einzelner Zellen schlecht sein kann.
Abbildung 6 zeigt statische Bilder von konfokalen Zeitrafferexperimenten der lebenden Invasion von GSC16-4/GFP- und U-118/L1LE/mCherry-Zellen in Hirnschnitte. Konfokale Z-Stapel-Bilder wurden alle 10 Minuten über einen Zeitraum von 20 Stunden in einem Mehrpunkt-Zeitraffer-Experiment aufgenommen. Filme der Zellinvasion von den Sphäroiden in Hirnschnitte, die als konfokale Z-Stapel im Laufe der Zeit aufgenommen wurden, werden in Supplementary Video S7, Supplementary Video S8, Supplementary Video S9, Supplementary Video S10 und Supplementary Video S11 präsentiert. Dieses Experiment zeigte, dass die konfokale Zeitraffer-Bildgebung der Weitfeldfluoreszenz überlegen ist, wenn es darum geht, das invasive Verhalten einzelner Zellen zu verfolgen. Die U-118/L1LE-Zellen waren unter diesen Bedingungen deutlich invasiver als die GSCs. Dies zeigt sich sogar in den statischen Bildern, wobei die GSCs zentraler und die U-118-Zellen weiter verstreut sind.
Abbildung 7 zeigt mehrere Beispiele für ex vivo Hirnschnitt-/Sphäroidpräparate, bei denen zwei verschiedene, separat markierte Sphäroide (U-118/L1LE/mCherry-Sphäroide und GSC16-4/GFP-Sphäroide) auf Hirnschnitte aufgebracht, mehrere Tage lang gezüchtet und anschließend fixiert, auf Laminin immungefärbt und durch optische Schnitte auf einem konfokalen Mikroskop abgebildet wurden. Dabei zeigte sich, dass beide Zelltypen in den Hirnschnitt eindrangen und entlang der Blutgefäße wanderten. Wenn die verschiedenen Typen von Sphäroiden nahe genug waren, um sich zu berühren, schien es, wenn überhaupt, nur eine geringe Invasion eines Zelltyps in das Sphäroid des anderen Zelltyps zu geben, und die Sphäroide blieben getrennt.
Abbildung 8 zeigt mehrere Beispiele von Ex-vivo-Hirnschnitt -/Sphäroidpräparationen, bei denen Sphäroide vom "gemischten Zelltyp", die in Kultur mit zwei unterschiedlich markierten Zelltypen (U-118/L1LE/mCherry gemischt mit GSC16-4/GFP) erzeugt wurden, auf Hirnschnitte aufgebracht, mehrere Tage lang gezüchtet und anschließend fixiert, auf Laminin immungefärbt und durch optische Schnitte auf einem konfokalen Mikroskop abgebildet wurden. Dabei zeigte sich, dass die roten U-118/L1LE/mCherry-Zellen aus den Sphäroiden auswanderten und sich viel deutlicher verteilten als die grünen GSC16-4/GFP-Zellen, die dazu neigten, in Klumpen nahe dem Zentrum der Sphäroide zu bleiben. Zusätzlich wurden auch U-118/L1LE/mCherry-Zellen mit DiD gefärbt, so dass die beiden separaten Markierungen (mCherry und DiD) direkt in den fixierten ex vivo Präparaten verglichen werden konnten. Die DiD-Markierung konnte noch nachgewiesen werden, selbst in einzelnen Zellen, die in den Hirnschnitt eingedrungen waren; Dies geschah jedoch als intrazelluläre Puncta.
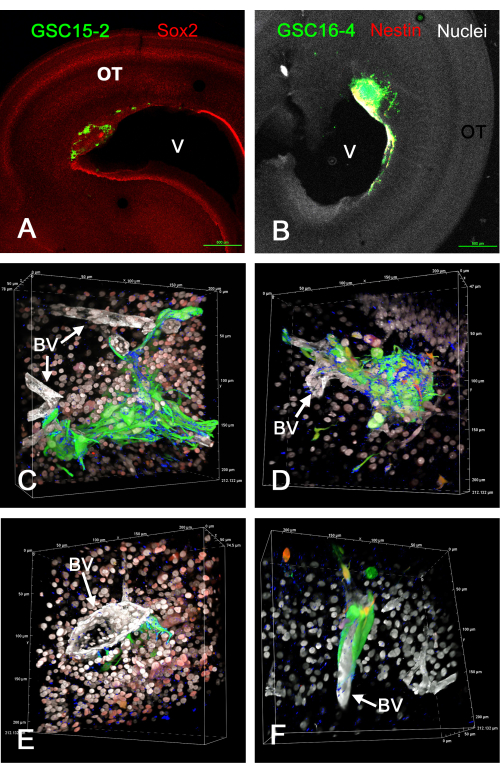
Abbildung 1: Tumoren an E15, die durch Injektion von GSCs in das E5-optische Tectum in vivo entstanden sind. GSCs sind aufgrund der GFP-Expression grün. GSC15-2-Zellen sind in den Feldern A, C und E und GSC16-4-Zellen in den Feldern B, D und F dargestellt. (A) Schwach vergrößerte Ansicht des optischen Tectums mit einem Tumor in der Nähe des Ventrikels (V). Die Sox2-Färbung ist rot dargestellt, wodurch die meisten Kerne von OT-Zellen gefärbt werden. (B) Ähnliches Bild wie A, jedoch mit GSC16-4-Zellen, die ebenfalls auf Nestin in Rot gefärbt sind, das im Bild aufgrund von Farbmischung und Bildbelichtung gelb oder weiß erscheinen kann. OT-Kerne erscheinen aufgrund der Gegenfärbung mit Bisbenzimid weiß. (C-F) Verschiedene Perspektiven von Volumen-Renderings, die aus Z-Stapeln mit einem 60-fachen Ölimmersionsobjektiv generiert wurden. Die Zellkerne erscheinen aufgrund der Bisbenzimid-Färbung weiß, und einige erscheinen in den Panels C und E aufgrund der Immunfärbung für Sox2 rot. Die Rotfärbung in den Tafeln D und F stammt von der Färbung für Nestin. Beachten Sie, dass aufgrund des "Alpha-Blendings" für Volumen-Renderings in der konfokalen Mikroskop-Software die Farben nicht wie bei einer Projektion mit maximaler Intensität gemischt werden und die vorherrschende Farbe die weniger intensive Farbe überwiegt und verdeckt. Die Blutgefäße werden aufgrund der Immunfärbung für Laminin weiß gefärbt. Die Färbung des GSC-Marker-Integrins alpha-6 ist blau dargestellt und erscheint punktförmig auf GSC-Oberflächen. Mikrometer-Skalen werden entlang der Ränder der Volumen-Renderings angezeigt. Videos von Rotationen von Volumen-Renderings in den Panels C-F werden in Supplementary Video S1, Supplementary Video S2, Supplementary Video S3 und Supplementary Video S4 präsentiert. Maßstabsbalken = 500 μm (A,B). Abkürzungen: GSCs = Glioblastom-Stammzellen; OT = optisches Tectum; GFP = grün fluoreszierendes Protein; BV = Blutgefäß. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
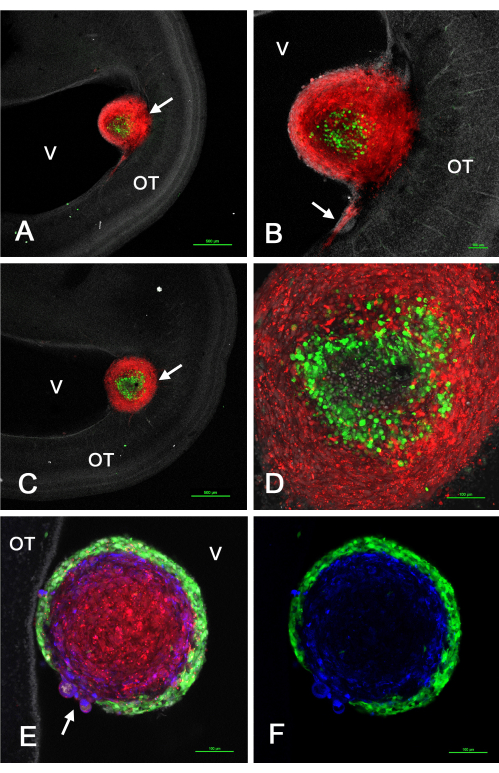
Abbildung 2: Tumoren an E15, die aus einer Mischung von GSCs und U-118 GBM-Zellen resultieren, die in das E5-Optikus-Tectum injiziert wurden. GSCs sind aufgrund der GFP-Expression grün und U-118/L1LE-Zellen sind aufgrund der mCherry-Expression rot. GSC15-2 sind in den Feldern A-D und GSC16-4 in den Feldern E und F dargestellt. (A) Konfokale einzelne z-Ebene eines gemischtzelligen Tumors (Pfeil) in der Nähe des Ventrikels mit geringer Vergrößerung. Die Zellkerne werden mit Bisbenzimid gegengefärbt. (B) Höhere Vergrößerung (10-faches Objektiv) des in A gezeigten Tumors mit Invasion roter U-118-Zellen in den OT nahe der Ventrikeloberfläche. (C) Eine etwas andere Ebene des optischen Schnitts als die in A, die den Tumor (Pfeil) zeigt, der tiefer in die OT-Wand eingebettet ist. (D) Maximale Projektion (20-faches Objektiv) mehrerer z-Ebenen des Tumors in C, die Details der sortierten Zellen innerhalb des Tumors zeigen. (E) Einzelbild der Z-Ebene (20-faches Objektiv) eines gemischten Tumors mit GSC16-4-Zellen, das zeigt, dass die Sortierung innerhalb des Tumors in einem entgegengesetzten Muster wie bei GSC15-2-Zellen erfolgte, wobei die grünen GSCs einen dünnen und gleichmäßigen Kortex bildeten, der die roten U-118-Zellen umgab. Der Bereich der Befestigung des Tumors an der OT-Wand ist in dieser z-Ebene nicht dargestellt. Man beachte den Bereich des Tumors, in dem es eine Diskontinuität des GSC-Kortex mit U-118/L1LE-Zellen gibt, die sich wölben (Pfeil). Die Immunfärbung für L1CAM ist blau dargestellt. (F) Gleiches Bild wie in E, aber nur die grüne GSCs und die blaue L1CAM-Färbung. Maßstabsbalken = 500 μm (A,C), 100 μm (B,D,E,F). Abkürzungen: GSCs = Glioblastom-Stammzellen; OT = optisches Tectum; GFP = grün fluoreszierendes Protein; V = Ventrikel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
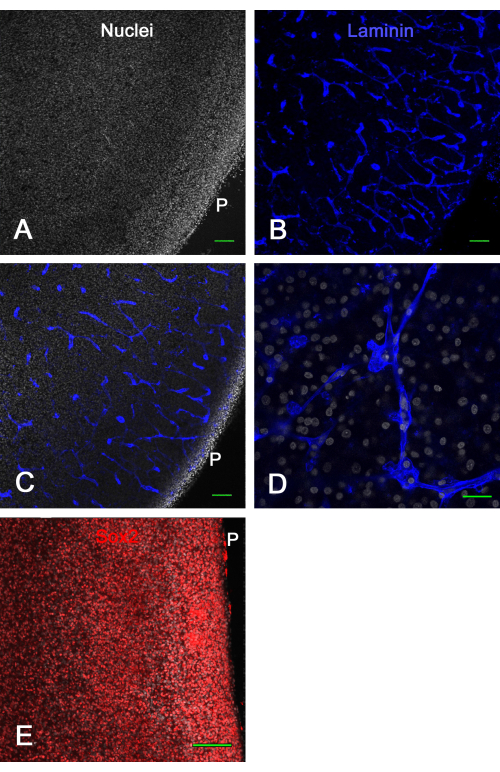
Abbildung 3: Viabilität von ex vivo optischen Tectumschnitten nach 1 Woche in Kultur. E14 optische Tectumschnitte wurden 1 Woche lang auf Membraninserts kultiviert und anschließend fixiert und immungefärbt. In A und B sind konfokale Aufnahmen (10x-Objektiv) eines mit Bisbenzimid (A) auf Zellkerne gefärbten und mit Laminin (B) immungefärbten Hirnschnitts dargestellt, der aufgrund der Lamininfärbung deutlich normale, intakte Blutgefäße zeigt, die optisch in verschiedenen Konfigurationen geschnitten sind. (C) Ein konfokales Bild, ähnlich dem, das in den Tafeln A und B gezeigt wird, wo sowohl Kern- als auch Lamininfärbung sichtbar sind. (D) Ein konfokales Bild mit höherer Vergrößerung (60-faches Ölobjektiv), das Details der Kern- und Lamininfärbung zeigt. (E) Maximales Projektionsbild des konfokalen z-Stapels (20-faches Objektiv) eines Hirnschnitts, der für den Sox2-Transkriptionsfaktor in Rot und Gesamtkerne mit Bisbenzimid in Weiß gefärbt wurde. Beachten Sie, dass die Mehrzahl der Kerne eine Sox2-Färbung aufweist, wie in vivo gezeigt (siehe Abbildung 1). Maßstabsbalken = 100 μm (A,B,C,E), 25 μm (D). Abkürzung: P = pial surface. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
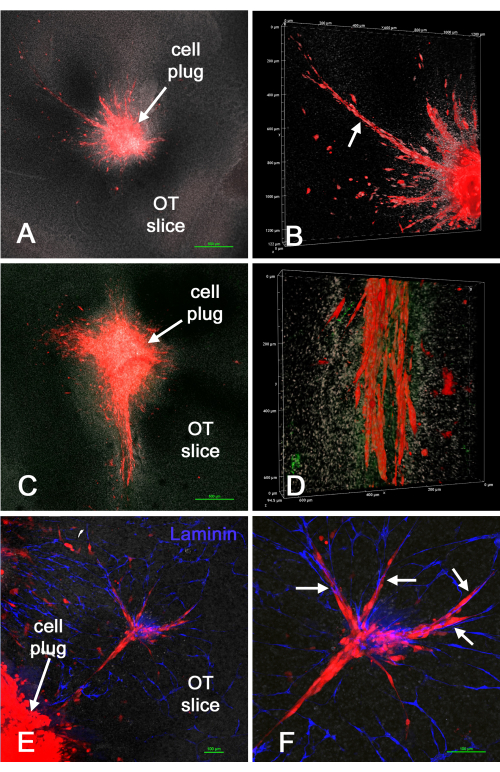
Abbildung 4: U-118/mCherry-Zellen, die mit der Biopsie-Stanzmethode in einen ex vivo Hirnschnitt eingebracht wurden. Mit einer 1-mm-Biopsiestanze wurden Hohlräume in Hirnschnitten erzeugt, und dann wurden rote U-118/L1LE/mCherry-Zellen, gemischt mit Matrix, als "Pfropfen" implantiert. Nach einigen Tagen wurden die Hirnschnitte fixiert, auf Laminin immungefärbt und für die konfokalmikroskopische Analyse auf Objektträger montiert. Die Tafeln A und C zeigen konfokale Einzelbilder der Z-Ebene (4-faches Objektiv) mit geringer Vergrößerung des resultierenden "Tumors" und der umgebenden Zellen, die in den Hirnschnitt eingedrungen sind. (B) Ein Volumen-Rendering eines z-Stapels aus der Präparation in Tafel A bei einer höheren Vergrößerung (20-faches Objektiv), das eine ausgedehnte Invasion von U-118-Zellen zeigt (Pfeil). (D) Das Bild zeigt ein ähnliches Volumenrendering des unteren Teils der extensiv eindringenden Zellen, die in Tafel C gezeigt sind. Die Lamininfärbung ist grün dargestellt, aber es sind keine klaren Blutgefäße erkennbar. (E) Das Bild zeigt einen Teil eines Zellpfropfens und eine Gruppe von Zellen, die in den Hirnschnitt eingedrungen sind, zusammen mit einer Lamininfärbung für Blutgefäße in Blau. (F) Eine höhere Vergrößerung der eindringenden Zellen, die in Tafel E gezeigt wird, und die Zellen sind deutlich entlang der Blutgefäße ausgerichtet (Pfeile). Alle Tafeln zeigen eine weiße Kerngegenfärbung mit Bisbenzimid. Maßstabsbalken = 500 μm (A,C), 100 μm (E,F). Die Skalierung für die Bedienfelder B und D erfolgt entlang der Volumen-Renderachsen. Abkürzung: OT = optisches Tectum. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Lebendzell-Sphäroide in Kultur und Weitfeld-Fluoreszenzbilder von lebenden GBM-Zellen in ex vivo Hirnschnitten. In den Panels A und B sind Phasenkontrastbilder (mit einem 10x-Objektiv an einem inversen Mikroskop) von U-118/L1LE GBM-Zellen (A) und GSCs (B) zu sehen, die als Sphäroide (Pfeile) wachsen. Im Hintergrund von Tafel A ist die unscharfe Unebenheit der Poly-HEMA-Beschichtung zu sehen, die auf der Zellkulturschale auftreten kann. In den Tafeln C-F sind Weitfeld-Fluoreszenzbilder von U-118/L1LE-Zellsphäroiden und eindringenden Zellen (Pfeile) während eines Zeitrafferexperiments zur Überwachung des Live-Verhaltens der Invasion in die Ex-vivo-Schichten (unter Verwendung eines 20-fachen Objektivs an einem speziellen Zeitraffer-Mikroskopsystem18) dargestellt. In den Panels C und E werden die Zellen mit dem dunkelrot fluoreszierenden Membranfarbstoff DiD gefärbt, in den Panels D und F werden die Zellen über ihre rote mCherry-Expression abgebildet. Maßstabsbalken = 100 μm. Videos von Weitfeld-Fluoreszenz-Zeitraffer-Experimenten, die in den Panels C und D gezeigt werden, befinden sich in Supplementary Video S5 bzw. Supplementary Video S6. Abkürzungen: GBM = Glioblastom; GSCs = GBM-Stammzellen; S = sphäroid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
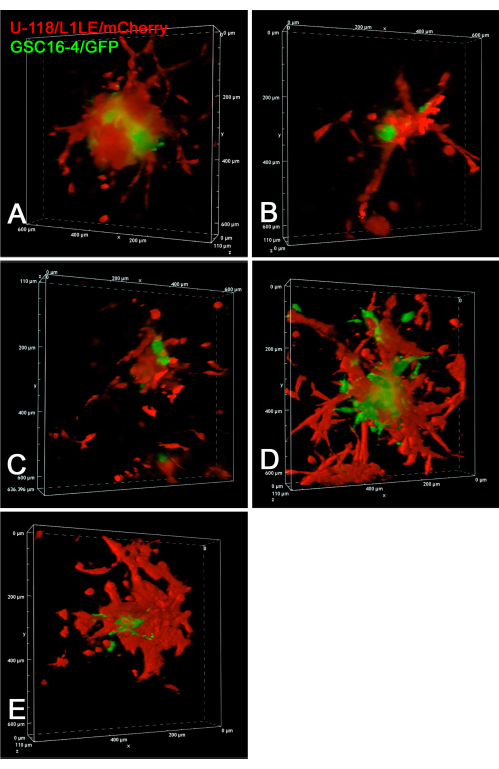
Abbildung 6: Volumen-Renderbilder von konfokalem 4D-Zeitraffer von lebenden GSCs und GBM-Zellen. In allen Panels sind die Endpunktbilder von fünf verschiedenen gemischtzelligen Sphäroid-Transplantaten auf separaten Hirnschnitten zu sehen. Für die Panels A-E wurden über einen Zeitraum von 20 Stunden konfokale z-Stapel-Bilder in 10-μm-Schritten alle 10 Minuten aufgenommen. Zu den Präparaten gehörten Hirnschnitte mit implantierten gemischtzelligen Sphäroiden aus roten U-118/L1LE/mCherry-Zellen und grünen GSC16-4/GFP-Zellen. Es wurden konfokale Bilder aufgenommen, während Hirnschnitte auf Membraneinsätzen in einer 6-Well-Kunststoff-Zellkulturschale mit einer 20-fachen Objektivlinse (0,45 NA) mit extra langem Arbeitsabstand (ELWD) kultiviert wurden, die den erforderlichen zusätzlichen Arbeitsabstand bot. Volumen-Renderings wurden mit der konfokalen Mikroskop-Software "Alpha Blending" erzeugt, die einen scheinbaren 3D-Effekt ergibt. Zeitraffervideos dieser konfokalen Volumen-Renderings im Zeitverlauf werden in Supplementary Video S7, Supplementary Video S8, Supplementary Video S9, Supplementary Video S10 und Supplementary Video S11 präsentiert. Abkürzungen: GBM = Glioblastom; GSCs = GBM-Stammzellen; GFP = grün fluoreszierendes Protein; NA = numerische Apertur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
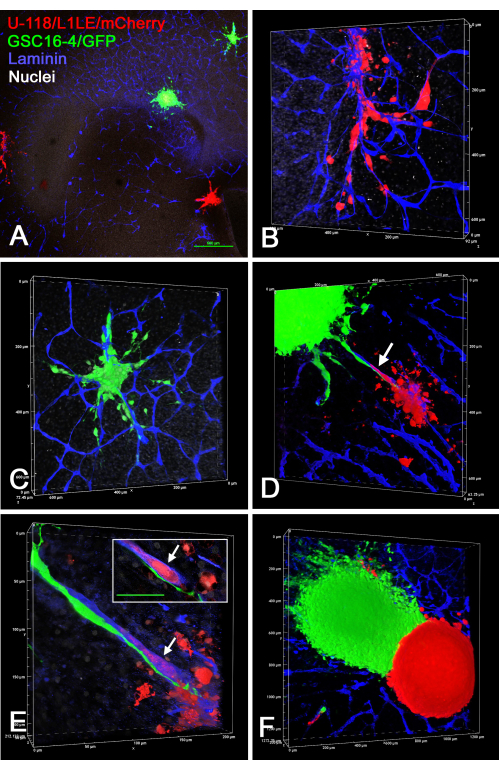
Abbildung 7: Konfokale Aufnahmen von fixierten Hirnschnitten mit invasiven GBM-Zellen von Sphäroiden verschiedener Zelltypen. Grüne Sphäroide bestanden aus GSC16-4/GFP-Zellen und rote Sphäroide aus U-118/L1LE/mCherry-Zellen. In den Panels A-F sind verschiedene Ansichten von Hirnschnitten dargestellt, auf denen mehrere rote und grüne Sphäroide mehrere Tage lang kultiviert wurden, bevor sie fixiert und auf Laminin (blau) immungefärbt wurden. Die Panels A-C stammen aus derselben OT-Schicht, in der A mit einem 4x-Objektiv aufgenommen wurde, und die Panels B und C sind Renderings mit höherem Vergrößerungsvolumen (20x-Objektiv) von Zellen, die von zwei der in Panel A gezeigten Sphäroide in den Gehirnschnitt eingedrungen sind. Beide Zelltypen drangen deutlich in Gewebe entlang der Blutgefäße ein. Tafel D zeigt ein Volumen-Rendering (20-faches Objektiv) eines anderen Hirnschnitts, in dem sich zwei verschiedene Sphäroide nahe beieinander befanden und Zellen aus beiden entlang desselben Blutgefäßes wandern, das sich zwischen ihnen befindet (Pfeil). Panel E ist ein stark vergrößertes (60-faches Ölobjektiv) Volumen-Rendering, das zeigt, dass die grünen Blutkörperchen entlang der Außenfläche des Blutgefäßes wandern, während die roten Blutkörperchen innerhalb des Blutgefäßes wandern (Pfeil). Der Ausschnitt zeigt einen einzelnen optischen Schnitt in der Z-Ebene, bei dem das rote Blutkörperchen deutlich von einer blauen Färbung des Blutgefäßes (Pfeil) umgeben ist und sich das grüne Blutkörperchen deutlich außerhalb des Blutgefäßes befindet. Maßstabsleiste im Einschub = 50 μm. Panel F zeigt ein Volumenrendering (10x Objektiv) eines Vorderhirnschnitts mit zwei eng nebeneinander liegenden verschiedenfarbigen Sphäroiden. Wenn überhaupt, kam es nur sehr wenig zu einer Zellinvasion von einem Sphäroid in das andere, und es bestand eine scharfe Grenze zwischen ihnen. Die Tafeln A, B, C und E zeigen ebenfalls eine weiße nukleare Gegenfärbung mit Bisbenzimid. Maßstabsleiste = 500 μm (A). Die Maßstäbe für die Bedienfelder B-F befinden sich entlang der Volumen-Renderachsen. Abkürzungen: GBM = Glioblastom; GSCs = GBM-Stammzellen; GFP = grün fluoreszierendes Protein; OT = optisches Tectum. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
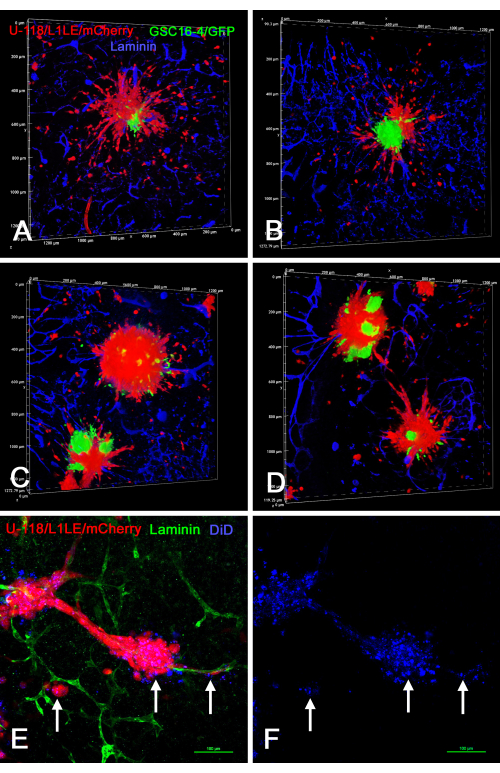
Abbildung 8: Konfokale Aufnahmen von fixierten Hirnschnitten mit invasiven GBM-Zellen aus gemischtzelligen Sphäroiden und Sphäroide, die mit DiD markiert sind. Die Tafeln A-D zeigen Volumendarstellungen von Hirnschnitten, die gemischtzellige Sphäroide enthielten, die aus grünen GSC16-4/GFP-Zellen und roten U-118/L1LE/mCherry-Zellen bestanden. Zahlreiche rote U-118-Zellen lösten sich von den Sphäroiden aus und drangen in alle Richtungen in den Hirnschnitt ein, während sich die grünen GSCs nicht auflösten und an den zentralen Stellen der Sphäroide verblieben. Die Tafeln E und F zeigen eine ex vivo Schnittpräparation mit roten U-118/L1LE/mCherry-Sphäroide, die ebenfalls mit dem dunkelroten Membranfarbstoff DiD markiert sind (blau dargestellt). Nach der Fixierung wurde die Scheibe auf Laminin in grün immungefärbt. Die DiD-Markierung war in den roten Blutkörperchen als punktförmige Färbung (Pfeile) sichtbar und war sogar in Zellen sichtbar, die sich von den Sphäroide entlang der Blutgefäße verteilt hatten. Die nukleare Gegenfärbung mit Bisbenzimid ist in dieser Abbildung nicht dargestellt, so dass die andere Färbung deutlicher sichtbar ist. Maßstabsbalken = 100 μm (E,F). Abkürzungen: GBM = Glioblastom; GSCs = GBM-Stammzellen; GFP = grün fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Medium/Lösung | Zusammensetzung | ||
| GSC-Medien | 1:1 Mischung aus DMEM/F12, 1 % fötalem Kälberserum (FBS), 15 mM HEPES-Puffer, 2 mM L-Glutamin, 100 μg/ml Penicillin-Streptomycin (Pen/Streptokokken), 2 % B27-Präparat ohne Vitamin A und 2,5 μg/ml Heparin. | ||
| GBM-Medien | DMEM (hoher Glukosegehalt), 10 % FBS, Pen/Streptokokken und 2 mM L-Glutamin. | ||
| Fixierungspuffer | 2% PFA in 0,1 M Natriumcacodylatpuffer | ||
| Einbetten von Medium | 3,5 % Agar und 8 % Saccharose in PBS | ||
| PBSTG | 0,1 % Triton X-100 + 5 % normales Ziegenserum (NGS) in PBS | ||
| U-118 MG Zellkulturmedium | DMEM + 10% FBS + Pen/Streptokokken + L-Glutamin | ||
| Brain Slice Nährmedien | 50% MEM + 25% HBSS + 25% Pferdeserum + B27 + Pen/Streptokokken + L-Glut + 15 mM HEPES-Puffer | ||
| vibrierende Tissue-Slicer-Schneidemedien | Medium 199 + Pen/Streptokokken + 15 mM HEPES-Puffer | ||
Tabelle 1: Zusammensetzung der Medien und Puffer, die in diesem Protokoll verwendet werden.
Ergänzende Abbildung 1: Injektion in das optische Tectum E5. (A) Nachdem ein Loch in die Eierschale über dem Luftraum geschnitten und die Luftraummembran mit Kochsalzlösung oder Medien benetzt wurde, wird die Membran mit einer feinen Pinzette entfernt. (B) Um Zellen in das optische Tectum zu injizieren, wird das Amnion eingeklemmt und mit einer feinen Pinzette gehalten, um den Kopf so zu positionieren, dass das optische Tectum zugänglich ist. Dann wird die Mikropipette in das optische Tectum eingeführt und die Zellen werden unter Druck injiziert. (C) Nach der Injektion der Zellen werden einige Tropfen Ampicillinlösung mit einer Spritze und einer feinen Nadel auf den Embryo gegeben. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Dissektion von E15-Hirnregionen. (A) Nach der Enthauptung wird der E15-Embryokopf in eine Schale mit steriler CMF-Lösung gelegt. (B) Die Haut, die über dem Gehirn liegt, wird dann mit einer feinen Pinzette entfernt. (C ) Die beiden Schädelknochen werden dann aus den darüber liegenden Hemisphären des Vorderhirns (FB) entfernt. (D) Die Bindegewebsdura wird dann sanft aus dem umgebenden Vorderhirn (FB), dem optischen Tectum und dem Kleinhirn entfernt. (E) Das gesamte Gehirn wird dann aus dem Kopf entfernt, indem es mit einer gebogenen Pinzette vorsichtig von unten aus der Gehirnhöhle geschöpft wird. (F ) Dargestellt ist die dorsale Ansicht des gesamten entfernten Gehirns mit Vorderhirn (FB), optischem Tectum (OT) und Kleinhirn (CB). (G ) Das isolierte Gehirn wird dann mit einer feinen Schere in Vorderhirn (FB), optische Tectum (OT) und Kleinhirn (CB) zerlegt. (H ) Die empfindliche Bindegewebspia wird dann mit einer feinen Pinzette leicht aus den Hemisphären des optischen Tectums (OT) entfernt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3: Einbettung und Schneiden des optischen Tectums E15 und Platzierung von Zellsphäroiden. (A) Eine optische Tectum-Hemisphäre wird mit Hilfe einer gekrümmten Pinzette in niedrigschmelzende Agarose getaucht. (B) Nachdem die Agarose auf Eis ausgehärtet ist, wird der Block mit dem optischen Tectum beschnitten und auf den Edelstahlsockel in der Schneideschale/Schale geklebt. (C) Nach dem Trocknen des Klebstoffs wird die Schneideschale/Schale in das Futter des Vibrationstuchschneiders gestellt und mit kaltem Schneidemedium gefüllt. Anschließend werden mit dem Saphirmesser Scheiben aus dem eingetauchten Gewebeblock geschnitten. Geschnittene Scheiben schwimmen in die Schüssel/das Tablett und können mit einem Spatel entfernt werden. (D) Geschnittene Scheiben werden aus der Schale/Schale entnommen und direkt auf Membraneinsätze mit darunter liegenden Scheibenkulturmedien in einer Multiwell-Platte gelegt. (E) Nachdem Zellsphäroide auf poly-HEMA-beschichteten Schalen gezüchtet wurden, wird ein Sphäroid in einer minimalen Menge des Mediums mit einer 20-μl-Mikropipette aus der Schale entfernt. (F) Das isolierte Sphäroid wird dann direkt auf den Hirnschnitt im Minimalmedium aufgebracht. (G) Wenn das Sphäroid aufgrund des Medienflusses von der Hirnscheibe abfällt, kann es mit einer Wimper, die auf einen hölzernen Applikatorstab geklebt ist, wieder auf die Hirnscheibe gestoßen werden. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzendes Video S1: Video eines kleinen GSC15-2-Tumors bei E15 mit hohem Vergrößerungsvolumen. GSCs sind aufgrund der GFP-Expression grün. Das Video entspricht Abbildung 1C und zeigt GSC15-2-Zellen. Das Video zeigt die Rotation eines Volumen-Renderings, das aus einem Z-Stapel mit einem 60-fachen Ölimmersionsobjektiv generiert wurde. Die Zellkerne erscheinen aufgrund der Bisbenzimid-Färbung weiß, und einige erscheinen aufgrund der Immunfärbung für Sox2 rot. Beachten Sie, dass aufgrund des "Alpha-Blendings" für Volumendarstellungen in der konfokalen Mikroskopsoftware die Farben nicht wie bei einer Projektion mit maximaler Intensität gemischt werden und die intensivste Farbe überwiegt und die weniger intensive Farbe verdeckt. Die Blutgefäße werden aufgrund der Immunfärbung für Laminin weiß gefärbt. Die Färbung des GSC-Marker-Integrins alpha-6 ist blau dargestellt und erscheint punktförmig auf grünen GSC-Oberflächen. Mikrometer-Skalen werden entlang der Ränder des Volumenrenders angezeigt. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S2: Video der Darstellung eines kleinen GSC16-4-Tumors bei E15 mit hohem Vergrößerungsvolumen. GSCs sind aufgrund der GFP-Expression grün. Das Video entspricht Abbildung 1D und zeigt GSC16-4-Zellen. Das Video zeigt die Rotation eines Volumen-Renderings, das aus einem Z-Stapel mit einem 60-fachen Ölimmersionsobjektiv generiert wurde. Zellkerne erscheinen aufgrund der Bisbenzimid-Färbung weiß, und einige GSCs erscheinen aufgrund der Immunfärbung für Nestin rot. Beachten Sie, dass aufgrund des "Alpha-Blendings" für Volumendarstellungen in der konfokalen Mikroskopsoftware die Farben nicht wie bei einer Projektion mit maximaler Intensität gemischt werden und die intensivste Farbe überwiegt und die weniger intensive Farbe verdeckt. Die Blutgefäße werden aufgrund der Immunfärbung für Laminin weiß gefärbt. Die Färbung des GSC-Marker-Integrins alpha-6 ist blau dargestellt und erscheint punktförmig auf grünen GSC-Oberflächen. Mikrometer-Skalen werden entlang der Ränder des Volumenrenders angezeigt. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S3: Video von stark vergrößerten Volumen-Renderings eines kleinen GSC15-2-Tumors bei E15. GSCs sind aufgrund der GFP-Expression grün. Das Video entspricht Abbildung 1E und zeigt GSC15-2-Zellen. Das Video zeigt die Rotation eines Volumen-Renderings, das aus einem Z-Stapel mit einem 60-fachen Ölimmersionsobjektiv generiert wurde. Die Zellkerne erscheinen aufgrund der Bisbenzimid-Färbung weiß, und einige erscheinen aufgrund der Immunfärbung für Sox2 rot. Beachten Sie, dass aufgrund des "Alpha-Blendings" für Volumendarstellungen in der konfokalen Mikroskopsoftware die Farben nicht wie bei einer Projektion mit maximaler Intensität gemischt werden und die intensivste Farbe überwiegt und die weniger intensive Farbe verdeckt. Die Blutgefäße werden aufgrund der Immunfärbung für Laminin weiß gefärbt. Die Färbung des GSC-Marker-Integrins alpha-6 ist blau dargestellt und erscheint punktförmig auf grünen GSC-Oberflächen. Mikrometer-Skalen werden entlang der Ränder des Volumenrenders angezeigt. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S4: Video von stark vergrößerten Volumen-Renderings von kleinen GSC16-4-Tumoren bei E15. GSCs sind aufgrund der GFP-Expression grün. Das Video entspricht Abbildung 1F und zeigt GSC16-4-Zellen. Das Video zeigt die Rotation eines Volumen-Renderings, das aus einem Z-Stapel mit einem 60-fachen Ölimmersionsobjektiv generiert wurde. Zellkerne erscheinen aufgrund der Bisbenzimid-Färbung weiß, und einige erscheinen aufgrund der Immunfärbung für Nestin rot. Beachten Sie, dass aufgrund des "Alpha-Blendings" für Volumendarstellungen in der konfokalen Mikroskopsoftware die Farben nicht wie bei einer Projektion mit maximaler Intensität gemischt werden und die intensivste Farbe überwiegt und die weniger intensive Farbe verdeckt. Die Blutgefäße werden aufgrund der Immunfärbung für Laminin weiß gefärbt. Die Färbung des GSC-Marker-Integrins alpha-6 ist blau dargestellt und erscheint punktförmig auf grünen GSC-Oberflächen. Mikrometer-Skalen werden entlang der Ränder des Volumenrenders angezeigt. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S5: Video von lebenden GBM-Zellen in ex vivo Hirnschnitt. Das Video entspricht Abbildung 5C und zeigt Weitfeld-Fluoreszenzbilder von U-118/L1LE-Zellsphäroiden und eindringenden Zellen während eines Zeitraffer-Experiments, um das Live-Verhalten der Invasion in die Ex-vivo-Schicht zu überwachen (unter Verwendung eines 20-fach-Objektivs auf einem speziellen Zeitraffer-Mikroskopsystem). Die U-118/L1LE-Zellen wurden mit dem dunkelrot fluoreszierenden Membranfarbstoff DiD gefärbt. Die Bilder wurden mit einer Monochromkamera aufgenommen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S6: Video von lebenden GBM-Zellen in ex vivo Hirnschnitt. Das Video entspricht Abbildung 5D und zeigt Weitfeld-Fluoreszenzbilder von U-118/L1LE-Zellsphäroiden und eindringenden Zellen während eines Zeitraffer-Experiments, um das Live-Verhalten der Invasion in die Ex-vivo-Schicht zu überwachen (unter Verwendung eines 20-fach-Objektivs auf einem speziellen Zeitraffer-Mikroskopsystem). Die Zellen wurden über ihre rote mCherry-Expression abgebildet. Die Bilder wurden mit einer Monochromkamera aufgenommen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S7: Video von Volumen-Renderbildern von konfokalen 4D-Zeitraffer von lebenden GSCs und GBM-Zellen. Das Video entspricht Abbildung 6A. Konfokale Z-Stapel-Bilder wurden in 10-μm-Schritten alle 10 Minuten über einen Zeitraum von 20 h aufgenommen. Die Präparation bestand aus einem Hirnschnitt mit implantierten gemischtzelligen Sphäroiden aus roten U-118/L1LE/mCherry-Zellen und grünen GSC16-4/GFP-Zellen. Die konfokalen Bilder wurden aufgenommen, während der Hirnschnitt auf einem Membraneinsatz in einer 6-Well-Zellkulturschale aus Kunststoff mit einer ELWD 20x-Objektivlinse (0,45 NA) kultiviert wurde, die den erforderlichen zusätzlichen Arbeitsabstand bot. Das Volumen-Rendering wurde mit der konfokalen Mikroskop-Software "Alpha Blending" erzeugt, die einen scheinbaren 3D-Effekt ergibt. Mikrometer-Skalen werden entlang der Ränder des Volumenrenders angezeigt. Das Video lässt sich am besten beobachten, indem Sie den Schieberegler für den Videofortschritt im Videoplayer manuell hin und her ziehen, um die Bewegung der Zellen zu beobachten, anstatt den Videoplayer mit seiner normalen langsamen Geschwindigkeit fortfahren zu lassen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S8: Video von Volumen-Renderbildern von konfokalen 4D-Zeitraffer von lebenden GSCs und GBM-Zellen. Das Video entspricht Abbildung 6B. Konfokale Z-Stapel-Bilder wurden in 10-μm-Schritten alle 10 Minuten über einen Zeitraum von 20 h aufgenommen. Die Präparation bestand aus einem Hirnschnitt mit implantierten gemischtzelligen Sphäroiden aus roten U-118/L1LE/mCherry-Zellen und grünen GSC16-4/GFP-Zellen. Die konfokalen Bilder wurden aufgenommen, während der Hirnschnitt auf einem Membraneinsatz in einer 6-Well-Zellkulturschale aus Kunststoff mit einer ELWD 20x-Objektivlinse (0,45 NA) kultiviert wurde, die den erforderlichen zusätzlichen Arbeitsabstand bot. Das Volumen-Rendering wurde mit der konfokalen Mikroskop-Software "Alpha Blending" erzeugt, die einen scheinbaren 3D-Effekt ergibt. Mikrometer-Skalen werden entlang der Ränder des Volumenrenders angezeigt. Das Video lässt sich am besten beobachten, indem Sie den Schieberegler für den Videofortschritt im Videoplayer manuell hin und her ziehen, um die Bewegung der Zellen zu beobachten, anstatt den Videoplayer mit seiner normalen langsamen Geschwindigkeit fortfahren zu lassen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S9: Video von Volumen-Renderbildern von konfokalen 4D-Zeitraffer von lebenden GSCs und GBM-Zellen. Das Video entspricht Abbildung 6C. Konfokale Z-Stapel-Bilder wurden in 10-μm-Schritten alle 10 Minuten über einen Zeitraum von 20 h aufgenommen. Die Präparation bestand aus einem Hirnschnitt mit implantierten gemischtzelligen Sphäroiden aus roten U-118/L1LE/mCherry-Zellen und grünen GSC16-4/GFP-Zellen. Die konfokalen Bilder wurden aufgenommen, während der Hirnschnitt auf einem Membraneinsatz in einer 6-Well-Zellkulturschale aus Kunststoff mit einer ELWD 20x-Objektivlinse (0,45 NA) kultiviert wurde, die den erforderlichen zusätzlichen Arbeitsabstand bot. Das Volumen-Rendering wurde mit der konfokalen Mikroskop-Software "Alpha Blending" erzeugt, die einen scheinbaren 3D-Effekt ergibt. Mikrometer-Skalen werden entlang der Ränder des Volumenrenders angezeigt. Das Video lässt sich am besten beobachten, indem Sie den Schieberegler für den Videofortschritt im Videoplayer manuell hin und her ziehen, um die Bewegung der Zellen zu beobachten, anstatt den Videoplayer mit seiner normalen langsamen Geschwindigkeit fortfahren zu lassen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S10: Video von Volumen-Renderbildern von konfokalen 4D-Zeitraffer von lebenden GSCs und GBM-Zellen. Das Video entspricht Abbildung 6D. Konfokale Z-Stapel-Bilder wurden in 10-μm-Schritten alle 10 Minuten über einen Zeitraum von 20 h aufgenommen. Die Präparation bestand aus einem Hirnschnitt mit implantierten gemischtzelligen Sphäroiden aus roten U-118/L1LE/mCherry-Zellen und grünen GSC16-4/GFP-Zellen. Die konfokalen Bilder wurden aufgenommen, während der Hirnschnitt auf einem Membraneinsatz in einer 6-Well-Zellkulturschale aus Kunststoff mit einer ELWD 20x-Objektivlinse (0,45 NA) kultiviert wurde, die den erforderlichen zusätzlichen Arbeitsabstand bot. Das Volumen-Rendering wurde mit der konfokalen Mikroskop-Software "Alpha Blending" erzeugt, die einen scheinbaren 3D-Effekt ergibt. Mikrometer-Skalen werden entlang der Ränder des Volumenrenders angezeigt. Das Video lässt sich am besten beobachten, indem Sie den Schieberegler für den Videofortschritt im Videoplayer manuell hin und her ziehen, um die Bewegung der Zellen zu beobachten, anstatt den Videoplayer mit seiner normalen langsamen Geschwindigkeit fortfahren zu lassen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S11: Video von Volumen-Renderbildern von konfokalen 4D-Zeitraffer von lebenden GSCs und GBM-Zellen. Das Video entspricht Abbildung 6E. Konfokale Z-Stapel-Bilder wurden in 10-μm-Schritten alle 10 Minuten über einen Zeitraum von 20 h aufgenommen. Das Präparat umfasste eine Hirnschnitte mit implantierten gemischtzelligen Sphäroiden aus roten U-118/L1LE/mCherry-Zellen und grünen GSC16-4/GFP-Zellen. Die konfokalen Bilder wurden aufgenommen, während der Hirnschnitt auf einem Membraneinsatz in einer 6-Well-Zellkulturschale aus Kunststoff mit einer ELWD 20x-Objektivlinse (0,45 NA) kultiviert wurde, die den erforderlichen zusätzlichen Arbeitsabstand bot. Das Volumen-Rendering wurde mit der konfokalen Mikroskop-Software "Alpha Blending" erzeugt, die einen scheinbaren 3D-Effekt ergibt. Mikrometer-Skalen werden entlang der Ränder des Volumenrenders angezeigt. Das Video lässt sich am besten beobachten, indem Sie den Schieberegler für den Videofortschritt im Videoplayer manuell hin und her ziehen, um die Bewegung der Zellen zu beobachten, anstatt den Videoplayer mit seiner normalen langsamen Geschwindigkeit fortfahren zu lassen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Zu den kritischen Schritten des Protokolls für die Injektion von Zellen in den Ventrikel des Mittelhirns (optisches Tectum) gehört, dass die Blutgefäße in der Chorioallantoikummembran in der Eizelle oder in der Umgebung des Embryos vor und während der Injektion nicht beschädigt werden, obwohl die Amnionmembran, die den Embryo unmittelbar umgibt, sanft gezogen und gehalten werden kann, um den Kopf zu positionieren, wenn die Zellen in das Mittelhirn injiziert werden. Das Amnion ist relativ zäh und kann mit einer feinen Pinzette gezogen werden, um den Kopf zu positionieren und mit einer Hand ruhig zu halten, um mit der anderen Hand Zellen in das optische Tectum zu injizieren, das ist die große, runde Struktur in der Mitte des Gehirns. Im Allgemeinen liegt die Lebensfähigkeit von injizierten Embryonen zwischen 25% und 75%, abhängig von unbekannten Faktoren, und praktisch jeder Embryo, der überlebt, enthält mindestens einen kleinen Tumor im optischen Tectum. Zu den entscheidenden Schritten bei der Erzeugung lebensfähiger Hirnschnitte gehört das Abtupfen des Gewebes von überschüssiger Flüssigkeit, damit die Agarose während des Schneidens am Gehirn haftet, und um Gewebe und Schnitte kalt zu halten, bis sie auf den Membraneinsatz gelegt werden. Da verschiedene Zelltypen unterschiedlich viele Sphäroide bilden (in Geschwindigkeit und Größe), sollten die plattierte Zelldichte auf Poly-HEMA-Platten und die Zeitspanne bis zur Ernte von Sphäroide für jeden Zelltyp optimiert werden.
Die Arbeit hier wurde keiner formalen Längsschnittstudie zur Lebensfähigkeit von Hirnschnitten unterzogen. Yang et al. verwendeten Kükenembryonen-Hirnschnittkulturen, die den hier verwendeten ähnlich waren, und zeigten eine gute Lebensfähigkeit der Schnitte für mindestens 7 Tage16. Frühere Arbeiten zeigten, dass, wenn OT-Gewebe in suboptimalen Medien gehalten wurde, viele pyknotische Kerne im Gewebe auftraten, die in den Schnitten in der vorliegenden Arbeit nicht auftraten. Wenn Schnitte unter suboptimalen Bedingungen degenerieren, fragmentieren sich die Blutgefäße und erscheinen als Reihen von Laminin-positiven Kugeln (nicht gezeigt). Obwohl die Viabilität hier nicht durch Methoden wie Elektrophysiologie oder aktive Caspase-3-Expression überprüft wurde, trat hier keiner der Indikatoren für Zelltod auf, die unter suboptimalen Kulturbedingungen beobachtet wurden.
Der OT wurde für In-vivo-Hirntumorexperimente in Betracht gezogen, da er die am leichtesten injizierbare Region mit dem größten Ventrikel ist. Bei E5, dem spätesten Tag, an dem der Embryo klein genug ist, um auf dem Eigelb zugänglich zu bleiben, müssen Injektionen in einen Ventrikel vorgenommen werden, da alle Gehirnregionen nichts anderes als eine dünne ventrikuläre Zone sind. Nichtsdestotrotz führen diese Injektionen erfolgreich zu eingebetteten Tumoren mit Zellen, die in das Hirnparenchym eindringen. Manchmal finden sich daraus resultierende Tumore im Vorderhirn oder Kleinhirn, was jedoch nicht häufig vorkommt. Ex vivo Scheiben des E15 opticutischen Tectums wurden hier primär für Experimente verwendet, so dass die ex vivo Co-Kulturergebnisse mit den in vivo Injektionsexperimenten korreliert werden können. Es sind jedoch auch Vorderhirnschnitte geeignet, die im Vergleich zum optischen Tectum eine größere Oberfläche und einen sehr dünnen Ventrikel aufweisen, wodurch das Vorderhirn möglicherweise besser für ex vivo Co-Kulturen geeignet ist, die nicht mit In-vivo-Injektionen korreliert werden.
Hier konnte gezeigt werden, dass In-vivo-Injektionen , gefolgt von Gewebefixierung, vibrierendem Gewebeschnitt und Immunfärbung für Laminin und andere Marker, zu hochauflösenden Bildern von GBM-Zellen und GSCs in Hirngewebe in unmittelbarer Nähe von Blutgefäßen führten. Die Möglichkeit, die Beziehungen zwischen Tumorzellen und Blutgefäßen zu bestimmen, wurde durch die Erstellung von 3D-Volumen-Renderings aus Z-Stapeln konfokaler optischer Schnitte unter Verwendung der konfokalen Software und der Anweisungen des Herstellers erheblich erleichtert. Zeitrafferaufnahmen mittels Weitfeld-Fluoreszenzmikroskopie von GFP-, mCherry- und DiD-markierten Zellen waren möglich; Wandernde Zellen, die sich in unmittelbarer Nähe der stark fluoreszierenden Sphäroide befanden, wurden jedoch manchmal durch das "Leuchten" des Sphäroids verdeckt. Dieser unerwünschte Effekt kann durch eine sorgfältige Anpassung der Belichtungszeiten für die Aufnahme von Weitfeldbildern etwas minimiert werden. Zeitrafferaufnahmen mit konfokalen Z-Stapeln über die Zeit (4D) eliminierten das unscharfe Leuchten der Sphäroide und führten zu scharf definierten wandernden Zellen mit dunklem Hintergrund. Dies wurde im Protokoll nicht beschrieben, sondern ähnlich wie bei der Weitfeld-Zeitrafferaufnahme durchgeführt, die durchgeführt wurde, während sich Gehirnschnitte auf den transparenten Membraneinsätzen in einer 6-Well-Kunststoffplatte befanden. Obwohl die konfokale Zeitrafferaufnahme zu deutlich klareren Bildern einzelner Zellen und ihres Verhaltens führt, ist ein Mehrpunkt-Zeitrafferexperiment, bei dem Z-Stapel von 10 Z-Ebenen/Punkt in 10-Minuten-Intervallen über einen Zeitraum von 20 Stunden gesammelt werden, eine umfangreiche Verwendung der Scankopf-Galvanometer. Da dies die Lebensdauer der Galvanometer erheblich verkürzen könnte, wird diese Methode mit Bedacht eingesetzt.
Obwohl das Kükenembryosystem sowohl für In-vivo-Injektions- als auch für Ex-vivo-Co-Kulturexperimente, die das Verhalten von GBM-Zellen untersuchen, sehr gut geeignet ist, gibt es einige Einschränkungen für dieses Modellsystem. Wie bei jedem Xenotransplantat-System ist die Umgebung, in der menschliche Zellen implantiert werden, nicht das menschliche Gehirn, aber das Verhalten der GBM-Zellen scheint das in Nagetiermodellen und bei menschlichen Patienten nachzuahmen. Nach Durchführung von In-vivo-Injektionsexperimenten an E5 werden Tumore normalerweise 10 Tage lang bis E15 gebildet. Dies ist eindeutig nicht genug Zeit, um alle Aspekte der Tumorentstehung und Zellinvasion zu untersuchen. Hier konnte jedoch gezeigt werden, dass sich im Hirnparenchym solide Tumore bilden, Zellen interagieren und sich innerhalb des Tumors neu anordnen und innerhalb dieses relativ kurzen Zeitraums eine signifikante Hirninvasion sowohl entlang der Blutgefäße als auch diffus auftritt. Eine weitere Einschränkung des In-vivo-Kükenembryosystems besteht darin, dass es aufgrund des großen Dotters und des extraembryonalen Kreislaufsystems, das während der Entwicklung des Kükenembryos arbeitet, nicht für Medikamente oder andere Behandlungen geeignet ist. Topische flüssige medikamentöse Behandlungen würden zu einer sehr variablen und unbekannten Konzentration im Gehirn führen, die auf die Diffusion vom Embryo weg in die viel größere Dottermasse zurückzuführen ist. In ähnlicher Weise würde die intravenöse Injektion von Medikamenten in das sehr empfindliche extraembryonale Kreislaufsystem aus den Blutgefäßen austreten oder diffundieren und ebenfalls zu unbekannten Konzentrationen im Gehirn führen. Dies ist einer der Hauptgründe für die Einführung der Ex-vivo-Schnittkulturmethode , damit nicht nur das Zellverhalten beobachtet und mittels Zeitraffermikroskopie verfolgt werden konnte, sondern auch, damit Behandlungen, die das Verhalten von GBM-Zellen in einer Schale erfolgreich verändert haben4 , in einer relevanteren Hirngewebeumgebung getestet werden konnten.
Die Entwicklung des orthotopen Hirntumormodellsystems für Kükenembryonen wird als eine bedeutende Ergänzung zu den Systemen und Werkzeugen angesehen, die für die Untersuchung der GBM-Tumorbildung und des invasiven Zellverhaltens zur Verfügung stehen. Befruchtete Hühnereier sind wahrscheinlich in den meisten Gebieten leicht verfügbar, sie sind im Vergleich zu Nagetieren kostengünstig, es fallen keine Kosten für die Tierpflege an, die Embryonen sind sehr widerstandsfähig und resistent gegen Infektionen (d. h. die meiste Arbeit wird auf einer Arbeitsplatte durchgeführt), die Embryonen sind hochgradig manipulierbar und können in schalenloser Kultur gezüchtet werden19, und Kükenembryonen gelten nicht als Wirbeltiere und benötigen daher keine IACUC-Zulassung nach NIH-Richtlinien (institutionelle Anforderungen kann variieren). Diese vielfältigen Vorteile machen das Kükenembryosystem sehr attraktiv, wenn man seine Fragen und Experimente auf diejenigen beschränkt, die in seine Grenzen fallen. Mehrere GBM-Zellstudien wurden von anderen mit dem Kükenembryo durchgeführt, aber diese haben fast ausschließlich die Chorioallantoismembran (CAM) des Embryos 20,21,22,23,24,25,26,27,28,29 und die Gliedmaßenknospe 30 verwendet, und nicht das Gehirn. Es wurde auch berichtet, dass auf E231 ein Medulloblastom in das Kükenhirn implantiert wurde. Zweifelsohne sollte die hier beschriebene Verwendung des Kükenembryos als orthotopes Xenotransplantat-Modellsystem zu Ergebnissen führen, die für die Biologie des humanen GBM-Tumors viel aussagekräftiger sind als Studien mit dem CAM.
Obwohl diese Studien gerade erst begonnen haben, das Gehirntumor-Modellsystem für Kükenembryonen für Studien des Verhaltens menschlicher GBM-Zellen und des GSC vollständig zu nutzen, besteht die Hoffnung, dass andere die Anwendungen erweitern und weitere potenzielle Anwendungen finden werden. Man könnte sich vorstellen, dass dieses System nicht nur Mechanismen aufdeckt, die die GBM-Tumorbildung und das Zellverhalten regulieren, sondern auch die präklinische Erprobung bestimmter Medikamente und Substanzen an bestimmten Patientenzellen ermöglicht. Wenn beispielsweise im Voraus Hirnschnittkulturen angelegt würden, könnten Tumorzellen, Stücke aus chirurgischen Tumorresektionen oder von Patienten stammende GBM-Organoide32 direkt in eine Ex-vivo-Kokultur eingebracht werden, und verschiedene Behandlungen könnten innerhalb weniger Tage bewertet werden. In ähnlicher Weise könnten dissoziierte Patientenzellen direkt in das E5-Mittelhirn in ovo injiziert werden, um ihre Fähigkeit zu beurteilen, Tumore zu bilden und in das Hirnparenchym einzudringen. Es ist daher zu hoffen, dass die Beschreibungen der Methoden und die repräsentativen Ergebnisse hier den verstärkten Einsatz dieses stark untergenutzten Systems für die Hirntumorforschung erleichtern und fördern.
Offenlegungen
Keiner der Autoren hat Interessenkonflikte.
Danksagungen
Diese Arbeit wurde zum Teil durch ein Stipendium des National Cancer Institute an D.S.G. (R03CA227312) und durch ein großzügiges Stipendium der Lisa Dean Moseley Foundation finanziert. Lebende GBM-Proben wurden mit Zustimmung des Patienten über das Tissue Procurement Center des Helen F. Graham Cancer Center and Research Institute gewonnen. Die Finanzierung von A.R. erfolgte durch das National Center for Research Resources und das National Center for Advancing Translational Sciences, National Institutes of Health (UL1TR003107). Sommer-Forschungsstipendien für Studenten an N.P., A.L., Z.W. und K.S. wurden vom Undergraduate Research Program der University of Delaware vergeben.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 cm x 1 cm square hole paper punch | Birabira | N/A | |
| 1 mm biopsy punch pen | Robbins Instruments | 20335 | |
| 6 well insert plate (Corning Transwell) | Millipore Sigma | CLS3450 | |
| 9" Disposable Pasteur Pipets | Fisher Scientific | 13-678-20C | |
| 15 mL centrifuge tubes | Fisher Scientific | 05-539-12 | |
| 24 well plate | Corning Costar | 3526 | |
| 50 mL centrifuge tubes | Fisher Scientific | 05-539-9 | |
| Agar | Fisher BioReagents | BP1423-500 | for embedding fixed brains |
| Alexafluor 488-conjugated GAM IgG | Jackson Immunoresearch | 115-605-146 | |
| Alexafluor 647-conjugated GAM IgG | Jackson Immunoresearch | 115-545-146 | |
| Aluminum foil | ReynoldsWrap | N/A | |
| Ampicillin | Sigma Aldrich | A-9518 | |
| anti-integrin alpha-6 monoclonal antibody GOH3 | Santa Cruz Biotechnology | sc-19622 | |
| anti-L1CAM monoclonal antibody UJ127 | Santa Cruz Biotechnology | sc-53386 | |
| anti-laminin monoclonal antibody | Developmental Studies Hybridoma Bank | 3H11 | |
| anti-nestin monoclonal antibody 10c2 | Santa Cruz Biotechnology | sc-23927 | |
| anti-Sox2 monoclonal antibody E-4 | Santa Cruz Biotechnology | sc-365823 | |
| B27 supplement without vitamin A | GIBCO | 17504-044 | |
| bisbenzimide (Hoechst 33258) | Sigma-Aldrich | B2883 | nuclear stain |
| Cell culture incubator | Forma | standard humidified CO2 incubator | |
| Centrifuge | Beckman Coulter | ||
| Confocal microscope | Nikon Instruments | C2si+ | With custom-made cell incubator chamber |
| Confocal microscope objective lenses | Nikon Instruments | Plan Apo lenses, except S Plan Fluor ELWD 20x 0.45 NA objective lens for confocal time-lapse imaging | |
| Confocal microscope software | Nikon Instruments | NIS Elements | Version 5.2 |
| Curved foreceps | World Precision Intruments | 504478 | |
| Curved scissors | Fine Science Tools | ||
| Curved spatula | Fisher Scientific | 14-375-20 | |
| Cyanoacrylate glue | Krazy Glue | KG-585 12R | |
| D-Glucose | Millipore Sigma | G8270 | |
| DiD far red fluorescent dye | Invitrogen | V22887 | Vybrant DiD |
| DMEM | Sigma Aldrich | D5671 | |
| DMEM/F12 | Sigma Aldrich | D8437 | |
| DMSO | Sigma Aldrich | D4540 | |
| Dulbecco's Phosphate buffered saline (PBS) | Sigma Aldrich | P5493-1L | |
| egg incubator | Humidaire | ||
| electrical tape (10 mil thick/254 µm) | Scotch | N/A | |
| Ethanol 200 proof | Decon Laboratories | 2701 | |
| Fast green FCF dye | Avocado Research Chemicals | 16520 | |
| FBS | Gemini Bio-products | 900-108 | |
| filter paper | Fisher Scientific | ||
| Gauze | Dynarex | 3353 | |
| Glass Capillaries for microinjection | World Precision Instruments | TW100-4 | |
| Glycerol | Fisher BioReagents | BP228-1 | for mounting media |
| GSCs (human glioblastoma stem cells) | Not applicable | Isolated from patient GBM specimens in Galileo laboratory in GSC media and then transduced with a GFP encoding lentiviral vector. Cells used were between passage 10 and 30. | |
| Hanks Balanced Salt Solution (HBSS) | Corning | 21-020-CV | |
| Hemacytometer | Hausser scientific | ||
| Heparin | Fisher Scientific | BP2524-100 | |
| HEPES buffer | Sigma Aldrich | H0887 | |
| Horse Serum (HI) | Gibco | 26050-088 | |
| Human FGF-2 | BioVision | 4037-1000 | |
| Human TGF-α | BioVision | 4339-1000 | |
| Inverted phase contrast microscope | Nikon Instruments | TMS | for routine viewing of cultured cells |
| KCl | Fisher Scientific | BP366 | |
| KH2PO4 | Fisher Scientific | P284 | |
| Laboratory film | Parafilm | ||
| Labquake Shaker | LabIndustries | T400-110 | |
| L-Glut:Pen:Strep | Gemini Bio-products | 400-110 | |
| Low-melt agarose | Fisher Scientific | BP1360 | for embedding live brains |
| Matrix | Corning Matrigel | 354234 | |
| Medium 199 | GIBCO | 11150-059 | |
| MEM | Corning | 10-010-CV | |
| Metal vibratome block | |||
| Micropipette tips (20, 200, 1,000 µL) | Fisherbrand | ||
| Micropipettors (20, 200, 1,000 µL) | Gilson | ||
| Microscope Coverglass (no. 1.5 thickness) | Fisherbrand | 12544A | |
| NaCl | Fisher Scientific | S271 | |
| NaH2PO4 + H2O | Fisher Scientific | S369 | |
| NaHCO3 | Fisher Scientific | BP328 | |
| Normal goat serum | Millipore Sigma | 526-M | |
| N-propyl gallate | Sigma Aldrich | P3130 | for mounting media |
| Parafilm | Parafilm | ||
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| PBS | Sigma Aldrich | P5493-1L | |
| Pencil | |||
| Plain Microscope slides | Fisherbrand | 12-550-A3 | |
| Plastic 35 mm Petri dish | Becton Dickinson | 351008 | |
| pneumatic picopump | World Precision Intruments | PV830 | |
| Poly(2-hydroxyethyl methacrylate) (poly-HEMA) | Sigma Aldrich | P-3932 | |
| razor blade- double edge | PACE | for cutting fixed brain slices | |
| sapphire knife | Delaware Diamond Knives | for cutting live brain slices | |
| Scalpel | TruMed | 1001 | |
| Sodium cacodylate buffer 0.2 M pH 7.4 | Electron Microscopy Sciences | 11652 | |
| Specimen chamber for vibratome | custom-made | ||
| Stereo Dissecting Microscope | Nikon Instruments | SMZ1500 | Equipped with epifluorescence |
| straight foreceps | World Precision Intruments | 500233 | |
| straight scissors | Fine Science Tools | ||
| Sucrose | Mallinckrodt | 7723 | |
| Time-lapse fluorescence microscope (widefield fluorescence) | Nikon Instruments | TE2000-E | With custom-made cell incubator chamber (see Fotos et al., 2006) |
| Tissue culture dish polystyrene 100 mm | Thermo Fisher Scientific | 130182 | for cell culturing |
| Tissue culture dish polystyrene 60 mm | Becton Dickinson | 353004 | for cell culturing |
| Transfer pipette | American Central Scientific Co. | FFP011 | |
| Transparent tape | Scotch | ||
| Triton X-100 | Sigma Aldrich | T-8787 | |
| Trypsin (0.25%) + 2.21 mM EDTA | Corning | 25-053-CI | |
| U-118 MG human GBM cell line | ATCC | HTB-15 | Cells were transduced with a lentiviral vector encoding the entire ectodomain sequence of the L1CAM adhesion protein and then with lentiviral vector pUltra-hot encoding mCherry. Passage numbers are unknown. |
| Vacuum pump | Cole-Parmer | EW-07532-40 | "Air Cadet" |
| Vibrating tissue slicer | Vibratome | 3000 | for cutting live and fixed brain slices |
Referenzen
- Cretu, A., Fotos, J. S., Little, B. W., Galileo, D. S. Human and rat glioma growth, invasion, and vascularization in a novel chick embryo brain tumor model. Clinical & Experimental Metastasis. 22 (3), 225-236 (2005).
- Yang, M., et al. L1 stimulation of human glioma cell motility correlates with FAK activation. Journal of Neuro-Oncology. 105 (1), 27-44 (2011).
- Mohanan, V., Temburni, M. K., Kappes, J. C., Galileo, D. S. L1CAM stimulates glioma cell motility and proliferation through the fibroblast growth factor receptor. Clinical & Experimental Metastasis. 30 (4), 507-520 (2013).
- Anderson, H. J., Galileo, D. S. Small-molecule inhibitors of FGFR, integrins and FAK selectively decrease L1CAM-stimulated glioblastoma cell motility and proliferation. Cellular Oncology. 39 (3), 229-242 (2016).
- Pace, K. R., Dutt, R., Galileo, D. S. Exosomal L1CAM stimulates glioblastoma cell motility, proliferation, and invasiveness. International Journal of Molecular Sciences. 20 (16), 3982 (2019).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. Journal of Neuroscience Methods. 37 (2), 173-182 (1991).
- Ohnishi, T., Matsumura, H., Izumoto, S., Hiraga, S., Hayakawa, T. A novel model of glioma cell invasion using organotypic brain slice culture. Cancer Research. 58 (14), 2935-2940 (1998).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Aaberg-Jessen, C., et al. Invasion of primary glioma- and cell line-derived spheroids implanted into corticostriatal slice cultures. International Journal of Clinical and Experimental Pathology. 6 (4), 546-560 (2013).
- Matsumura, H., Ohnishi, T., Kanemura, Y., Maruno, M., Yoshimine, T. Quantitative analysis of glioma cell invasion by confocal laser scanning microscopy in a novel brain slice model. Biochemical and Biophysical Research Communications. 269 (2), 513-520 (2000).
- Ren, B., et al. Invasion and anti-invasion research of glioma cells in an improved model of organotypic brain slice culture. Tumori. 101 (4), 390-397 (2015).
- Fayzullin, A., et al. Time-lapse phenotyping of invasive glioma cells ex vivo reveals subtype-specific movement patterns guided by tumor core signaling. Experimental Cell Research. 349 (2), 199-213 (2016).
- Jensen, S. S., et al. Establishment and characterization of a tumor stem cell-based glioblastoma invasion model. PloS One. 11 (7), e0158746 (2016).
- Marques-Torrejon, M. A., Gangoso, E., Pollard, S. M. Modelling glioblastoma tumour-host cell interactions using adult brain organotypic slice co-culture. Disease Models & Mechanisms. 11 (2), 031435 (2018).
- Tamura, R., et al. Visualization of spatiotemporal dynamics of human glioma stem cell invasion. Molecular Brain. 12 (1), 45 (2019).
- Yang, C., et al. Organotypic slice culture based on in ovo electroporation for chicken embryonic central nervous system. Journal of Cellular and Molecular Medicine. 23 (3), 1813-1826 (2019).
- Murrell, W., et al. Expansion of multipotent stem cells from the adult human brain. PloS One. 8 (8), e71334 (2013).
- Fotos, J. S., et al. Automated time-lapse microscopy and high-resolution tracking of cell migration. Cytotechnology. 51 (1), 7-19 (2006).
- Tufan, A. C., Akdogan, I., Adiguzel, E. Shell-less culture of the chick embryo as a model system in the study of developmental neurobiology. Neuroanatomy. 3 (1), 8-11 (2004).
- Shoin, K., et al. Chick embryo assay as chemosensitivity test for malignant glioma. Japanese Journal of Cancer Research. 82 (10), 1165-1170 (1991).
- Hagedorn, M., et al. Accessing key steps of human tumor progression in vivo by using an avian embryo model. Proceedings of the National Academy of Sciences. 102 (5), 1643-1648 (2005).
- Balciūniene, N., et al. Histology of human glioblastoma transplanted on chicken chorioallantoic membrane. Medicina. 45 (2), 123-131 (2009).
- De Magalhães, N., et al. Applications of a new In vivo tumor spheroid based shell-less chorioallantoic membrane 3-D model in bioengineering research. Journal of Biomedical Science and Engineering. 3 (1), 20-26 (2010).
- Szmidt, M., et al. Morphology of human glioblastoma model cultured in ovo. Journal of Veterinary Research. 56 (2), 261-266 (2012).
- Jaworski, S., et al. Comparison of tumor morphology and structure from U87 and U118 glioma cells cultured on chicken embryo chorioallantoic membrane. Journal of Veterinary Research. 57 (4), 593-598 (2013).
- Yuan, Y. J., Xu, K., Wu, W., Luo, Q., Yu, J. L. Application of the chick embryo chorioallantoic membrane in neurosurgery disease. International Journal of Medical Sciences. 11 (12), 1275-1281 (2014).
- Urbańska, K., et al. The effect of silver nanoparticles (AgNPs) on proliferation and apoptosis of in ovo cultured glioblastoma multiforme (GBM) cells. Nanoscale Research Letters. 10, 98 (2015).
- DeBord, L. C., et al. The chick chorioallantoic membrane (CAM) as a versatile patient-derived xenograft (PDX) platform for precision medicine and preclinical research. American Journal of Cancer Research. 8 (8), 1642-1660 (2018).
- Han, J. M., Jung, H. J. Synergistic anticancer effect of a combination of berbamine and arcyriaflavin A against glioblastoma stem-like cells. Molecules. 27 (22), 7968 (2022).
- Ruiz-Ontañon, P., et al. Cellular plasticity confers migratory and invasive advantages to a population of glioblastoma-initiating cells that infiltrate peritumoral tissue. Stem Cells. 31 (6), 1075-1085 (2013).
- Cage, T. A., et al. Distinct patterns of human medulloblastoma dissemination in the developing chick embryo nervous system. Clinical & Experimental Metastasis. 29 (4), 371-380 (2012).
- Darrigues, E., et al. Biobanked glioblastoma patient-derived organoids as a precision medicine model to study inhibition of invasion. International Journal of Molecular Sciences. 22 (19), 10720 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten