A subscription to JoVE is required to view this content. Sign in or start your free trial.
Analyse af fluorescerende farvede lipiddråber med 3D-rekonstruktion til vurdering af hepatisk steatose
In This Article
Summary
Heri demonstrerer vi en optimeret BODIPY 493/503 fluorescensbaseret protokol til lipiddråbekarakterisering i levervæv. Gennem brug af ortogonale projektioner og 3D-rekonstruktioner muliggør fluoroforen en vellykket skelnen mellem mikrovesikulær og makrovesikulær steatose og kan repræsentere en komplementær tilgang til de klassiske histologiske protokoller til vurdering af hepatisk steatose.
Abstract
Lipiddråber (LD'er) er specialiserede organeller, der formidler lipidopbevaring og spiller en meget vigtig rolle i undertrykkelse af lipotoksicitet og forebyggelse af dysfunktion forårsaget af frie fedtsyrer (FA'er). Leveren, givet sin kritiske rolle i kroppens fedtstofskifte, er vedvarende truet af den intracellulære akkumulering af LD'er i form af både mikrovesikulær og makrovesikulær hepatisk steatose. Den histologiske karakterisering af LD'er er typisk baseret på lipidopløselige diazofarvestoffer, såsom Oil Red O (ORO) farvning, men en række ulemper hæmmer konsekvent brugen af denne analyse med leverprøver. For nylig er lipofile fluoroforer 493/503 blevet populære til visualisering og lokalisering af LD'er på grund af deres hurtige optagelse og ophobning i den neutrale lipiddråbekerne. Selvom de fleste anvendelser er velbeskrevne i cellekulturer, er der mindre beviser, der viser pålidelig anvendelse af lipofile fluoroforprober som et LD-billeddannelsesværktøj i vævsprøver. Heri foreslår vi en optimeret bordipyrromethen (BODIPY) 493/503-baseret protokol til evaluering af LD'er i leverprøver fra en dyremodel af fedtfattig diæt (HFD)-induceret hepatisk steatose. Denne protokol dækker forberedelse af leverprøver, vævssektionering, BODIPY 493/503-farvning, billedoptagelse og dataanalyse. Vi demonstrerer et øget antal, intensitet, arealforhold og diameter af hepatiske LD'er ved HFD-fodring. Ved hjælp af ortogonale projektioner og 3D-rekonstruktioner var det muligt at observere det fulde indhold af neutrale lipider i LD-kernen, der fremstod som næsten sfæriske dråber. Desuden var vi med fluoroforen BODIPY 493/503 i stand til at skelne mikrovesikler (1 μm < d ≤ 3 μm), mellemliggende vesikler (3 μm < d ≤ 9 μm) og makrovesikler (d > 9 μm), hvilket muliggjorde en vellykket diskrimination af mikrovesikulær og makrovesikulær steatose. Samlet set er denne BODIPY 493/503 fluorescensbaserede protokol et pålideligt og simpelt værktøj til hepatisk LD-karakterisering og kan repræsentere en komplementær tilgang til de klassiske histologiske protokoller.
Introduction
Lipiddråber (LD'er), der klassisk betragtes som energidepoter, er specialiserede cellulære organeller, der formidler lipidlagring, og de omfatter en hydrofob neutral lipidkerne, som hovedsageligt indeholder kolesterolestere og triglycerider (TG'er), indkapslet af et phospholipidmonolag 1,2,3.
LD-biogenese forekommer i det endoplasmatiske retikulum (ER), begyndende med syntesen af triacylglycerol (TAG) og sterolestere. Neutrale lipider diffunderes mellem folderne i ER-dobbeltlaget ved lave koncentrationer, men samles i olielinser, der vokser og knop....
Protocol
Alle dyreforsøg udført i denne undersøgelse blev godkendt af Coimbra Institute for Clinical and Biomedical Research (iCBR) Animal Welfare Body (ORBEA, #9/2018) og overholdt Animal Care National og European Directive og ARRIVE-retningslinjerne.
1. Eksperimentelt design
- Parvis 13 uger gamle Wistar-hanrotter i ventilerede bure under kontrollerede miljøforhold med temperatur (22 °C ± 1 °C), fugtighed (50%-60%) og lys (12 timers lys-mørk cyklus) og med ad libitum adgang til postevand og standard gnaverchow.
- Efter en 2 ugers periode med akklimatisering tildeler rotterne vilkårligt i to grupper. ....
Representative Results
Den vellykkede udførelse af denne teknik bør resultere i klar lipiddråbefarvning til samtidig karakterisering af LD-morfologien (form og lipidkernetæthed baseret på 3D-rekonstruktionen) sammen med deres rumlige fordeling, antal pr. Samlet areal og gennemsnitlig størrelse (vurderet med rørledningen ovenfor beskrevet, figur 1).
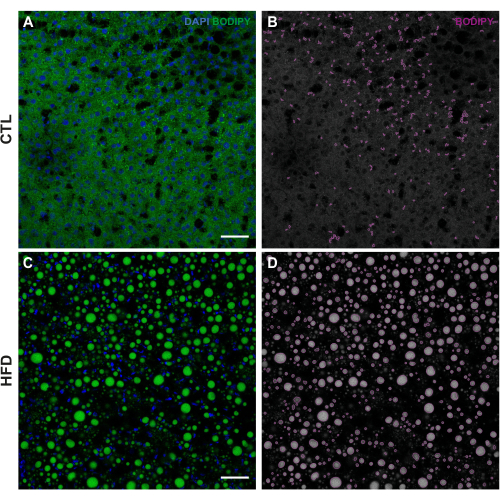
Discussion
Denne BODIPY 493/503 fluorescensbaserede protokol til LD-vurdering havde til formål at udvikle en ny billeddannelsesmetode til evaluering af hepatisk steatose. I betragtning af den stærke sammenhæng mellem fedme og fedtleversygdom blev den vestlige diæt med højt fedtindhold brugt til at etablere en dyremodel for hepatisk steatose26. En robust stigning i hepatisk TG-indhold blev bekræftet af et kvantitativt triglycerider kolorimetrisk assaykit, som foreslog et forhøjet hepatisk lipidosescena.......
Disclosures
Forfatterne har intet at afsløre.
Acknowledgements
Denne forskning blev finansieret af nationale og europæiske fonde via den portugisiske videnskabs- og teknologifond (FCT), Den Europæiske Fond for Regionaludvikling (FEDER) og Programa Operacional Factores de Competitividade (COMPETE): 2020.09481.BD, UIDP/04539/2020 (CIBB) og POCI-01-0145-FEDER-007440. Forfatterne vil gerne takke støtten fra iLAB - Microscopy and Bioimaging Lab, en facilitet ved Det Medicinske Fakultet ved University of Coimbra og medlem af den nationale infrastruktur PPBI-Portuguese Platform of BioImaging (POCI-01-0145-FEDER-022122) samt støtte fra FSE CENTRO-04-3559-FSE-000142.
....Materials
| Name | Company | Catalog Number | Comments |
| 1.6 mm I.D. silicone tubing, I.V mini drip set | Fisher Scientific | ||
| 4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno (BODIPY 493/503) | Sigma-Aldrich, Lyon, France | D3922 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Molecular Probes Inc, Invitrogen, Eugene, OR | D1306 | |
| 70% ethanol | Honeywell | 10191455 | |
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Automatic analyzer Hitachi 717 | Roche Diagnostics Inc., Mannheim, Germany | 8177-30-0010 | |
| Barrier pen (Liquid blocker super pap pen) | Daido Sangyo Co., Ltd, Japon | _ | |
| Blade | Leica | 221052145 | Used in the cryostat |
| Cell Profiler version 4.2.5 | https://cellprofiler.org/releases/ | Used to analyse the acquired images | |
| Coverslips | Menzel-Glaser, Germany | _ | |
| Cryomolds | Tissue-Tek | _ | |
| Cryostat (including specimen disc and heat extractor) CM3050 S | Leica Biosystems | _ | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich, Lyon, France | D-8418 | Used to dissolve Bodipy for the 5 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Dry ice container (styrofoam cooler) | Novolab | A26742 | |
| Dumont forceps | Fine Science Tools, Germany | 11295-10 | |
| Glass Petri dish (H 25 mm, ø 150 mm) | Thermo Scientific | 150318 | Used to weigh the liver after dissection |
| Glycergel | DAKO Omnis | S303023 | |
| GraphPad Prism software, version 9.3.1 | GraphPad Software, Inc., La Jolla, CA, USA | ||
| High-fat diet | Envigo, Barcelona, Spain | MD.08811 | |
| Ketamine (Nimatek 100 mg/mL) | Dechra | 791/01/14DFVPT | Used at a final concentration of 75 mg/kg |
| Laser scanning confocal microscope (QUASAR detection unit; ) | Carl Zeiss, germany | LSM 710 Axio Observer Z1 microscope | |
| Medetomidine (Sedator 1 mg/mL) | Dechra | 1838 ESP / 020/01/07RFVPT | Used at a final concentration of 1 mg/kg |
| Needle | BD microlance | 300635 | |
| No 15 Sterile carbon steel scalpel Blade | Swann-Morton | 205 | |
| Objectives 10x (Plan-Neofluar 10x/0.3), 20x (Plan-Apochromat 20x/0.8) and 40x (Plan-Neofluar 40x/1.30 Oil) | Carl Zeiss, Germany | ||
| Paint brushes | Van Bleiswijck Amazon B07W7KJQ2X | Used to handle cryosections | |
| Peristaltic pump (Minipuls 3) | Gilson | 1004170 | |
| Phosphate-buffered saline (PBS, pH ~ 7.4) | Sigma-Aldrich, Lyon, France | P3813 | |
| Scalpel handle, 125 mm (5"), No. 3 | Swann-Morton | 0208 | |
| Slide staining system StainTray | Simport Scientific | M920 | |
| Standard diet | Mucedola | 4RF21 | |
| Superfrost Plus microscope slides | Menzel-Glaser, Germany | J1800AMNZ | |
| Tissue-Tek OCT mounting media | VWR CHEMICALS | 361603E | |
| Triglycerides colorimetric assay kit | Cayman Chemical | 10010303 | |
| Ultrasonic bath | Bandelin Sonorex | TK 52 | |
| Vannas spring scissors - 3 mm cutting edge | Fine Science Tools, Germany | 15000-00 | |
| ZEN Black software | Zeiss |
References
- Klemm, R. W., Ikonen, E. The cell biology of lipid droplets: More than just a phase. Seminars in Cell & Developmental Biology. 108, 1-3 (2020).
- Martin, S., Parton, R. G. Lipid droplets: A unified view of a dynamic organelle.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved