ב Vivo הדמיה מוחית שלמה של זחלי דגי זברה באמצעות מיקרוסקופ פלואורסצנטי תלת מימדי
In This Article
Summary
מוצג כאן פרוטוקול להדמיית מוח שלם in vivo של דגי זברה זחלים באמצעות מיקרוסקופ פלואורסצנטי תלת ממדי. הליך הניסוי כולל הכנת דגימה, רכישת תמונה והדמיה.
Abstract
כחיית מודל של בעלי חוליות, דגי זברה זחלים נמצאים בשימוש נרחב במדעי המוח ומספקים הזדמנות ייחודית לנטר את פעילות המוח כולו ברזולוציה התאית. כאן, אנו מספקים פרוטוקול אופטימלי לביצוע הדמיה מוחית שלמה של דגי זברה זחלים באמצעות מיקרוסקופ פלואורסצנטי תלת ממדי, כולל הכנת דגימה ואימוביליזציה, הטבעה של דגימה, רכישת תמונה והדמיה לאחר הדמיה. הפרוטוקול הנוכחי מאפשר הדמיה in vivo של המבנה והפעילות העצבית של מוח זברה זחל ברזולוציה תאית במשך יותר משעה באמצעות מיקרוסקופ קונפוקלי ומיקרוסקופ פלואורסצנטי מותאם אישית. כמו כן נדונים השלבים הקריטיים בפרוטוקול, כולל הרכבה ומיקום דגימה, מניעת היווצרות בועות ואבק בג'ל האגרוז, והימנעות מתנועה בתמונות הנגרמת כתוצאה מהתמצקות לא מלאה של ג'ל האגרוז ושיתוק הדג. הפרוטוקול אומת ואושר בהגדרות מרובות. פרוטוקול זה יכול להיות מותאם בקלות להדמיית איברים אחרים של דג זברה זחל.
Introduction
דג זברה (Danio rerio) אומץ באופן נרחב כבעל חוליות מודל במדעי המוח, בשל שקיפותו האופטית בשלב הזחל, התפתחותו המהירה, עלות התחזוקה הנמוכה שלו וזמינותם של כלים גנטיים מגוונים 1,2,3,4. בפרט, השקיפות האופטית של הזחלים בשילוב עם מדווחים פלואורסצנטיים מקודדים גנטית של אירועים ביולוגיים 5,6,7,8,9 מספקת הזדמנות ייחודית לדמיין הן פעילות עצבית והן מבנה ברמת המוח כולו 10,11,12,13,14 . עם זאת, גם עם מיקרוסקופ התומך ברזולוציה תאית, התמונות שנרכשו אינן שומרות בהכרח את המידע ברמת התא הבודד; איכות התמונה האופטית עלולה להיפגע עקב הסטייה שהוכנסה על ידי ג'ל האגרוז המשמש להרכבת דגימה, הדג עשוי להיות מותקן בזווית, ולכן אזורי העניין אינם מוכלים במלואם בתוך שדה הראייה של המיקרוסקופ, והדגים עשויים לנוע במהלך ההקלטה, לגרום לתוצרי תנועה בתמונות או לעכב חילוץ אות מדויק מהתמונות.
לפיכך, יש צורך בפרוטוקול יעיל וניתן לשחזור כדי להשיג נתוני תמונה באיכות גבוהה עם מינימום רעש ותנועה. למרבה הצער, פרוטוקולים זמינים לציבור להדמיית מוח שלם של דגי זברה זחלים in vivo 15,16,17,18,19 מתארים רק בקצרה את ההליך, ומשאירים חלקים ניכרים מהפרטים, כגון התמצקות אגרוז, טכניקות הרכבה מדויקות ומיקום דגימה באמצעות מלקחיים, לכל נסיין. בנוסף, חוסר עקביות בריכוז אגרוז ובשיטות אימוביליזציה 10,11,14,15,16,17,18,19 יכול להוביל לאתגרים הנובעים מתנועת דגים במהלך תהליך ההדמיה.
כאן, פרוטוקול מפורט להדמיית מוח שלם של זברי זחל באמצעות מיקרוסקופ פלואורסצנטי תלת מימדי. איור 1 מספק סקירה גרפית של הפרוטוקול: הכנת דגימה ואימוביליזציה, הטבעה של דגימה, רכישת תמונה והדמיה לאחר הדמיה. הדימות המבני והתפקודי של מוח הזברה הזחל in vivo מודגם באמצעות מיקרוסקופ קונפוקלי מסחרי ומיקרוסקופ פלואורסצנטי בהתאמה אישית. מטפלים יכולים להתאים פרוטוקול זה לדימות מוחי עם גירויים חושיים מסוימים או הקשרים התנהגותיים בהתאם לצרכי הניסוי ולעיצובו.
Protocol
כל הניסויים בדגי זברה אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) של KAIST (KA2021-125). סה"כ 12 דגי זברה בוגרים עם ביטוי פאן-עצבי של מחוון הסידן GCaMP7a [Tg(huc:GAL4); Tg(UAS:GCaMP7a)] על רקע קספר [mitfa(w2/w2);mpv17(a9/a9)] שימשו להרבעה. קבוצה זו כללה שמונה נקבות וארבעה זכרים, בגילאים הנעים בין 3 ל-12 חודשים. ניסויי הדמיה בוצעו בדגי זברה זחלים 3-4 ימים לאחר ההפריה (d.p.f), שלב שבו לא ניתן לקבוע את מינם.
1. הכנת דגי זברה
- לאסוף עוברים לאחר גידול דגים בוגרים של קו מהונדס רצוי, כגון Tg (huc:GAL4); Tg(UAS:GCaMP7a)20,21,22, בצלוחית פטרי מלאה במי ביצה (ראו טבלת חומרים). מניחים את העוברים באינקובטור ב 28 מעלות צלזיוס ומעלים אותם ל 3-4 d.p.f. זחלים23,24,25.
- אם הרקע של דג הזברה אינו לבקנ, כדי לעכב היווצרות פיגמנטציה, העבירו את העוברים 24 שעות לאחר ההפריה (h.p.f.) לצלחת פטרי מלאה במי ביצה המכילים 200 מיקרומטר של 1-פניל 2-תיאוריאה (PTU; ראו טבלת חומרים)25,26. כל 24 שעות, מעבירים את הדג לצלחת חדשה עם מי ביצה טריים המכילים 200 מיקרומטר של PTU.
הערה: דגי הזברה נשמרים בתנאים סטנדרטיים ב 28 ° C ו 14: 10 שעות אור: מחזור כהה. טיפול PTU ידוע להשפיע על ההתנהגות ותפקוד בלוטת התריס של זברי זחל27,28. לכן, חשוב להשתמש ב-PTU בזהירות ולשלוט בזהירות בגורמים מבלבלים פוטנציאליים בכל ניסוי.
- אם הרקע של דג הזברה אינו לבקנ, כדי לעכב היווצרות פיגמנטציה, העבירו את העוברים 24 שעות לאחר ההפריה (h.p.f.) לצלחת פטרי מלאה במי ביצה המכילים 200 מיקרומטר של 1-פניל 2-תיאוריאה (PTU; ראו טבלת חומרים)25,26. כל 24 שעות, מעבירים את הדג לצלחת חדשה עם מי ביצה טריים המכילים 200 מיקרומטר של PTU.
- כדי למצוא את הדגימה המבטאת חלבונים פלואורסצנטיים בעלי עניין (למשל, GCaMP7a פאן-עצבי), סנן את הדגימה תחת מיקרוסקופ אפי-פלואורסצנטי ובחר דגימה עם ביטוי בהיר.
- הכינו את דגימת דגי הזברה 3-4 d.p.f. שנבחרה בצלחת פטרי מלאה במי ביצים (איור 2A).
הערה: כדי לתעד פעילות עצבית ספונטנית, מומלץ להשתמש בדגימות בגילאי 80-100 h.p.f., מכיוון שרמת הפעילות הספונטנית נמוכה לפני 80 h.p.f. והתפתחות פיגמנטציה, אפילו עם רקע קספר, עלולה לפגוע באיכות התמונה לאחר 100 h.p.f. - הכינו תמיסת פנקורוניום ברומיד 14,19,29,30,31 במינון 0.25 מ"ג/מ"ל על ידי הוספת 1 מ"ל של תמיסת מלאי במינון 2.5 מ"ג/מ"ל (ראו טבלת חומרים) ל-10 מ"ל מי הביצה. Aliquot תמיסת פנקורוניום ברומיד לתוך צינורות מיקרוצנטריפוגות 1.5 מ"ל.
- העבירו את הדגימה שהוקנתה מראש לצלחת הפטרי באמצעות פיפטת העברה.
הערה: נסו לשאת כמות מינימלית של מי ביצים עם הדגימה. - מעבירים 0.1 מ"ל של תמיסת פנקורוניום ברומיד לצלחת פטרי לשיתוק.
הערה: לפנקורוניום ברומיד יש השפעה מדכאת פוטנציאלית על הפעילות העצבית בדגי זברהזחלים 32. חיוני לשקול בזהירות את ריכוז ומשך החשיפה לפנקורוניום ברומיד.
2. 2% (WT/VOL) הכנת ג'ל אגרוז
- הפעל בלוק חום והגדר את טמפרטורת היעד ל -37 מעלות צלזיוס. המתן עד שהיחידה תתחמם ותתאזן בטמפרטורה שנקבעה.
- יש להמיס 0.2 גרם של אבקת אגרוז בעלת נקודת התכה נמוכה (ראו טבלת חומרים) ב-10 מ"ל מי ביצה.
- מחממים את תמיסת האגרוז במיקרוגל ומערבבים אותה על ידי ניעור וערבול עד שהאגרוז מומס לחלוטין.
- הכניסו את ג'ל האגרוז לצינורות מיקרוצנטריפוגות בנפח 1.5 מ"ל ואחסנו את צינורות המיקרוצנטריפוגות על בלוק החום (איור 2B).
הערה: בדוק אם הבועות בג'ל האגרוז נעלמו.
3. הרכבה ומיקום לדוגמה
- בדקו את הדגימה תחת סטריאומיקרוסקופ כדי לוודא שתנועת הזחלים נעצרה וכדי להעריך את בריאות הדגימה באופן חזותי על-ידי בדיקת פעימות הלב שלה (איור 2C). אם פעימות הלב איטיות מדי, השליכו את הדגימה.
הערה: אם פעימות הלב של הדג המצולם איטיות מדי (למשל, מתחת ל-60 פעימות לדקה), ייתכן שלא ניתן יהיה לבצע הדמיה לטווח ארוך. כדי להעריך את בריאות הדג, ניתן לבדוק את קצב הלב באופן חזותי על ידי השוואתו לדגים אחרים באותה צלחת פטרי. זה יעזור להבטיח כי הדג המצולם הוא בריא ויציב מספיק עבור הליך ההדמיה. - בעזרת פיפטת ההעברה, הכניסו דג זברה זחל בודד לתוך ג'ל האגרוז בצינור מיקרוצנטריפוגה בנפח 1.5 מ"ל (איור 2D).
הערה: הקפד להשליך את פיפטה לאחר העברת הדגימה. - יוצקים את ג'ל האגרוז לתוך צלחת פטרי כדי ליצור מעיל 1-2 מ"מ. מעבירים את הדגימה בצינורות המיקרוצנטריפוגות לצלחת הפטרי באמצעות פיפטת ההעברה, כך שהזחל ממוקם במרכז המנה.
הערה: אם יש אבק ובועות בג'ל האגרוז, הסר אותם באמצעות פיפטת ההעברה. - השתמשו במלקחיים כדי למקם את הדגימה בכיוון הרצוי כך שהראש והזנב יהיו שטוחים (איור 2E).
- סובבו את הדגימה באמצעות מלקחיים כך ששתי העיניים יהיו בגובה (איור 2F).
הערה: יש להשלים הליכי יישור (מיקום וסיבוב) לפני שג'ל האגרוז מתחיל להתמצק. - לאחר היישור, המתינו עד שג'ל האגרוז יתמצק (איור 2G,H).
הערה: זמן ההמתנה לג'ל האגרוז להתמצק יכול לנוע בין 5-10 דקות, תלוי בנפח ובגודל הג'ל. - לאחר התמצקות ג'ל האגרוז, מלאו את צלחת הפטרי במי ביצים והניחו את צלחת הפטרי עם הדגימה המשובצת על שלב המיקרוסקופ (איור 2I).
4. רכישת תמונות
- הפעל את מערכת המיקרוסקופ (לדוגמה, לייזרים, בקרים קונפוקליים, מיקרוסקופ ומחשב; ראה טבלת חומרים) וודא שהמערכת כולה פועלת.
- בחרו עדשה אובייקטיבית בהגדלה נמוכה ואתרו את הדגימה במרכז שדה הראייה.
- בחר עדשה אובייקטיבית לטבילה במים או טבילה במים עם הגדלה מתאימה (לדוגמה, עדשת 16x 0.8 צמצם מספרי (NA) טבילת מים; ראה טבלת חומרים). בצע התאמות עדינות בשדה הראייה.
- הגדר את פרמטרי ההדמיה (לדוגמה, גודל תמונה, עוצמת לייזר, זמן חשיפה, מספר מסגרות) באמצעות תוכנה לרכישת תמונה.
הערה: הגדר את פרמטרי ההדמיה כדי להשיג את התוצאות הטובות ביותר האפשריות לצרכים ספציפיים (עיין בהגדרה לרכישת תמונה בסעיף תוצאות מייצגות). אם התמונה רוויה, הפחיתו את עוצמת הלייזר. - מצא את המוח של הדגימה על ידי הזזת הבמה וקבע את עוביו באמצעות מצב תצוגה חיה בתוכנה על ידי שינוי מישורי המוקד באופן ידני למעלה ולמטה. הגדר את הגבול התחתון והעליון של אמצעי האחסון.
הערה: ודא שהמוח כולו נמצא בשדה הראייה לאורך שני הכיוונים הצדיים והציריים. - הגדר גודל צעד z בהתחשב ברזולוציה הצירית של המיקרוסקופ.
הערה: גודל Z-step האופטימלי לדימות מוח הזברה הזחל תלוי בשיטת ההדמיה וברזולוציה של המיקרוסקופ. לדוגמה, נעשה שימוש בגודל z-step של 5 מיקרומטר בהתחשב בעובי יריעת האור והקוטר הממוצע של גופי התא10. - המשך עם רכישת התמונה עבור שדה הראייה שנקבע.
- עבור הדמיה מבנית נפחית, קבל תמונה תלת-ממדית (x,y,z) של המוח כולו על ידי שינוי מישורי המוקד וקבלת תמונות דו-ממדיות של כל מישור z ברצף.
- עבור הדמיה תפקודית של מישור z יחיד, קבל תמונות סדרת זמן (x,y,t) של הפעילות העצבית של המוח בעומק מסוים.
- עבור דימות תפקודי נפחי, קבל תמונה 4-D (x,y,z,t) של הפעילות העצבית במוח כולו על ידי קבלת תמונות תלת-ממדיות ברצף.
הערה: הגדר את מספר המסגרות בהתחשב בגודל הזיכרון הזמין של המחשב. זמן רכישה של פחות מ 1 שעה מומלץ בשל משך ההשפעה של pancuronium ברומיד.
- לאחר קבלת תמונות, שמור את התוצאות ורשום את פרמטרי ההדמיה (למשל, גודל פיקסלים, גודל צעד z, קצב פריימים, עוצמת לייזר) לניתוח תמונה.
- ייצא את התמונות בתבנית מתאימה לעיבוד נתונים ולניתוח תמונות.
הערה: מומלץ לייצא תמונות בתבנית קובץ תמונה מתויגת (TIF). TIF תומך בדחיסת תמונה ללא אובדן נתונים ותואם לרוב תוכנות עיבוד התמונה ושפות התכנות. בנוסף, תבנית TIF תומכת בהכללת מטה-נתונים, כגון פרמטרי רכישה, רזולוציית תמונה ומידע רלוונטי אחר שיכול לסייע בפרשנות נתונים ובשחזורם.
5. הגדרה להדמיות באמצעות napari
הערה: napari הוא מציג תמונות רב-ממדי בקוד פתוח בסביבת Python עם עיבוד מבוסס יחידת עיבוד גרפי (GPU)33. תוסף napari-אנימציה מספק יצירה פרוגרמטית של סרטים. השימוש בפיג'י, תוכנת עיבוד תמונה בקוד פתוח, מומלץ לעיבוד תמונה למטרות כלליות, כגון סינון ושינוי צורה גיאומטרי (ראו טבלת חומרים). קוד המקור המשמש להדמיה באמצעות napari זמין ב- GitHub (https://github.com/NICALab/Zebrafish-brain-visualization).
- התקן napari ו napari-אנימציה באמצעות pip או conda. לאחר ההתקנה, צור קובץ מחברת jupyter חדש.
הערה: הפעלה עם מחברת jupyter, שהיא כלי אינטראקטיבי עבור Python, מומלצת על פני סקריפט Python. - ייבוא napari ו napari-אנימציה.
6. הדמיה של מבנים באמצעות napari
- כדי להמחיש תמונות וליצור סרטים של מוח דג הזברה המעובד, טען את התמונה התלת-ממדית (x,y,z) ופתח את חלון napari. חברו את תוסף ההנפשה napari (איור 3A).
- קבעו פרמטרים כגון גודל ווקסל, מפת צבע ומגבלות ניגודיות בפקדי השכבה.
- התאימו את הגדרות המציג (למשל, פרספקטיבה, זוויות) בבד הציור.
- כדי ללכוד את התמונה המעובדת, לחץ על לחצן הלכידה באשף ההנפשה.
- ליצירת סרטים באמצעי האחסון המעובד, שנו את הגדרות המציג והוסיפו מסגרות ראשיות (איור 3B).
- לאחר הוספת מסגרות ראשיות, הגדר את מספר המסגרות (שלבים) בין מסגרות ראשיות באשף ההנפשה. שמור את ההנפשה המעובדת.
7. עיבוד תמונה והדמיית פעילות עצבית באמצעות napari
הערה: כדי להמחיש את תמונות סדרות הזמן של פעילות עצבית כתמונות שכבת-על של רקע סטטי ופעילות, יש להחיל אלגוריתם פירוק על התמונות הגולמיות. השתמש ביישום MATLAB של אלגוריתם פירוק בשם BEAR24. גרסת MATLAB של BEAR זמינה ב-GitHub (https://github.com/NICALab/BEAR).
- כדי לפרק את הרקע הסטטי ואת הפעילות העצבית, יש למרוח BEAR על תמונות סדרת הזמן הגולמית (x,y,t או x,y,z,t). לאחר הפירוק, שמרו את תמונות הרקע והפעילות העצבית כקובצי TIF (איור 3C).
- טען את תמונות הרקע והפעילות העצבית ופתח את חלון הנפרי. חבר את תוסף napari-animation.
- השתמשו במפת צבע אפורה לתמונות רקע ובמפת צבעים חמה לתמונות של פעילות עצבית (איור 3C).
- קבעו פרמטרים כגון אטימות ומגבלות ניגודיות בבקרי השכבה.
- ליצירת סרטים בעלי פעילות עצבית, שנו את הגדרות המציג והוסיפו מסגרות ראשיות לעיבוד ההנפשה.
- לאחר הוספת מסגרות ראשיות, הגדר את מספר המסגרות (שלבים) בין מסגרות ראשיות באשף ההנפשה. שמור את ההנפשה המעובדת.
Representative Results
המבנה והפעילות העצבית של מוחות הזברה הזחלים המבטאים אינדיקטור סידן פאן-עצבי GCaMP7a (Tg(huc:GAL4); Tg(UAS:GCaMP7a))20,21,22 עם קספר (mitfa(w2/w2);mpv17(a9/a9))34 רקע צולם ב 3-4 d.p.f. על ידי ביצוע הפרוטוקול המתואר.
לצורך הדמיה מבנית נפחית, הדגימה צולמה באמצעות מערכת מיקרוסקופיה קונפוקלית מסחרית לסריקה נקודתית המצוידת בעדשה אובייקטיבית 16x 0.8 NA לטבילת מים. לייזר עירור 488 ננומטר שימש הן לדימות מבני והן להדמיה תפקודית. קצב המסגרות, רזולוציית התמונה, גודל הפיקסלים וגודל המדרגה הצירית היו 0.25 הרץ, 2048 x 2048, 0.34 מיקרומטר ו-1.225 מיקרומטר, בהתאמה. רכישת התמונה ארכה כשעה ו-20 דקות. שדה הראייה הנפחי של התמונה הנרכשת כיסה את אזורי המוח במוח הקדמי, במוח התיכון ובמוח האחורי (איור 4A). גופי תאים עצביים של medulla oblongata, צלחת המוח הקטן, טקטום אופטי, הבנולה וטלנספלון גבי בכל המוח של 4 דגי זברה זחלים נראו בבירור בתמונות המיקרוסקופ הקונפוקלי (איור 4B). העיבוד התלת-ממדי של תמונות המיקרוסקופ הקונפוקלי בוצע באמצעות napari27 על-ידי ביצוע הפרוטוקול הנ"ל (איור 4C ווידאו 1).
לצורך הדמיה פונקציונלית בדו-ממד, הדגימה צולמה באמצעות אותה מערכת מיקרוסקופיה קונפוקלית, המצוידת בעדשה אובייקטיבית 16x 0.8 NA לטבילת מים. קצב המסגרות, רזולוציית התמונה וגודל הפיקסלים היו 2 הרץ, 512 x 256 ו-1.5 מיקרומטר, בהתאמה. גופי התאים העצביים נראו בבירור גם ברקע וגם בפעילות העצבית (איור 5A,B).
עבור הדמיה תפקודית תלת-ממדית, נעשה שימוש במערכת מיקרוסקופיה תלת-ממדית18 שתוכננה בהתאמה אישית, אשר הייתה מסוגלת לדמיין in vivo את הפעילות העצבית של מוח זברה זחל שלם עם שדה ראייה של 1,040 מיקרומטר × 400 מיקרומטר × 235 מיקרומטר ורזולוציות רוחביות וציריות של 1.7 מיקרומטר ו-5.4 מיקרומטר, בהתאמה. קצב ההדמיה היה עד 4.2 נפחים לשנייה. בדומה לעיבוד נתוני הדימות המבני, נפארי שימש לעיבוד תלת-ממדי של נתוני דימות הסידן במוח כולו (איור 5C ווידאו 2).
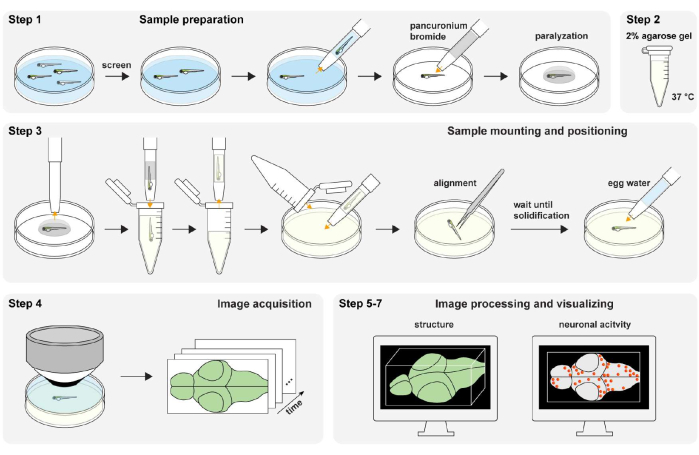
איור 1: סקירה כללית של הליך הניסוי. הכנת דגימת דג זברה ושיתוק (שלב 1). הכנת ג'ל אגרוז 2% (wt/vol) (שלב 2). הרכבה ומיקום לדוגמה (שלב 3). רכישת תמונה (שלב 4). עיבוד תמונה והדמיית מבנה ופעילות עצבית (שלב 5-7). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: הליך ניסויי להכנת דימות מוחי שלם . (A) דגימת דג זברה מוקרנת המבטאת GCaMP7a פאן-עצבי בצלוחית פטרי מלאה במי ביצה. (ב) ציוד וחומר הדרושים להרכבה ומיקום של דגימות. (1) בלוק חום ב-37°C; (2) 2% (wt/vol) ג'ל אגרוז; (3) צינור מיקרוצנטריפוגה בנפח 1.5 מ"ל; (4) מי ביצים; (5) תמיסת פנקורוניום ברומיד 0.25 מ"ג/מ"ל; (6) צלחת פטרי; (7) מלקחיים; (8) פיפטה להעברה. (C) תמונה סטריאו-מיקרוסקופית של הדגימה המשותקת. החץ השחור מצביע על לב הדגימה. (D) הדגימה בצינור מיקרוצנטריפוגה בנפח 1.5 מ"ל מועברת באמצעות פיפטה. הכניסה מציגה תצוגה מוגדלת של אזור הקופסה. (E) הדגימה (חץ שחור) ממוקמת במרכז צלחת הפטרי באמצעות מלקחיים. (F) הדגימה מיושרת באמצעות מלקחיים. (G) דוגמה לדגימה מוטבעת שאינה מיושרת. (H) דוגמה למדגם מוטבע מיושר. (I) הדגימה ממוקמת על במת מיקרוסקופ מתחת לעדשה האובייקטיבית לצורך רכישת תמונה. סרגל קנה מידה: 500 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
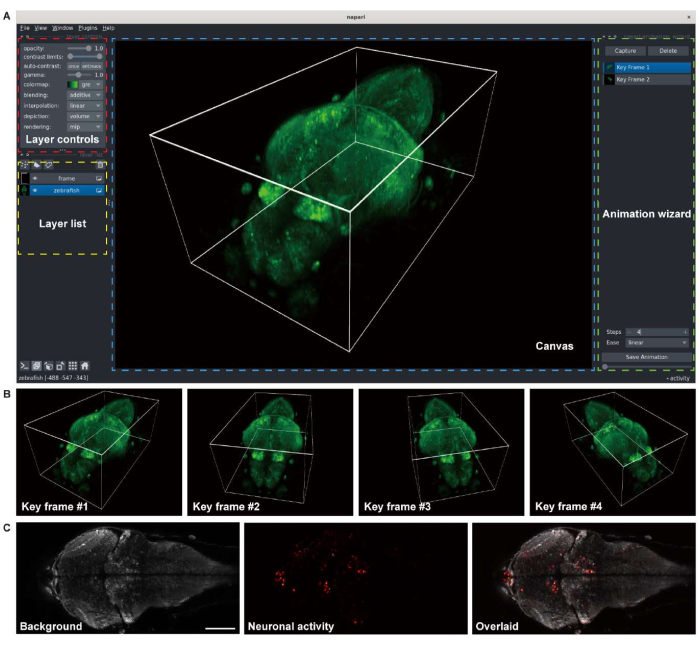
איור 3: הדמיה של תמונות מוח של דגי זברה זחליים . (A) עיבוד תלת-ממדי של תמונה במיקרוסקופ קונפוקלי של מוח זברה זחל (4 d.p.f) המבטא GCaMP7a פאן-עצבי. napari, מציג תמונות רב-ממדי בקוד פתוח בסביבת Python, שימש לרינדור. חלון napari כולל פקדי שכבות (תיבה אדומה), רשימת שכבות (תיבה צהובה), בד ציור (תיבה כחולה) ואשף הנפשה (תיבה ירוקה). (B) מסגרות ראשיות עם הגדרות מציג מרובות מתווספות לרינדור הנפשה. (C) תמונה במיקרוסקופ קונפוקלי של הדמיה דו-ממדית בהילוך מהיר של הפעילות העצבית במוח הזחל. התמונה מפורקת לרקע (משמאל) ולפעילות העצבית (באמצע), ואז לשכבת-על (מימין). סרגל קנה מידה: 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
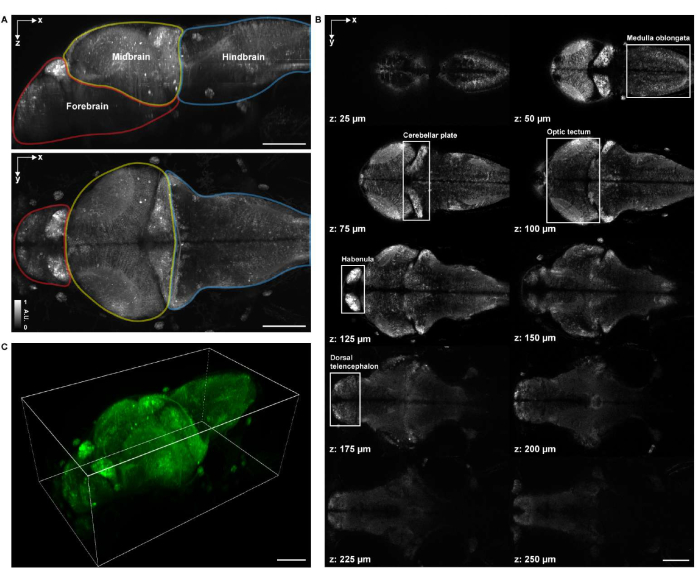
איור 4: מבנה הדמיה של מוח של דג זברה זחל. (A) הקרנה בעוצמה מרבית (MIP) של תמונה במיקרוסקופ קונפוקלי של מוח זברה זחל (4 d.p.f.) המבטא GCaMP7a פאן-עצבי. למעלה: MIP לרוחב. למטה: MIP צירי. כל גבול מכיל את המוח הקדמי (אדום), המוח התיכון (צהוב) והמוח האחורי (כחול). (B) סה"כ 10 פרוסות ציריות בעומקים מרובים מתמונה נפחית של המוח (ב-z = 25 מיקרומטר, 50 מיקרומטר, 75 מיקרומטר, 100 מיקרומטר, 125 מיקרומטר, 150 מיקרומטר, 175 מיקרומטר, 200 מיקרומטר, 225 מיקרומטר, 250 מיקרומטר, שנספרו כלפי מעלה מלמעלה למטה; z = 0 מיקרומטר מציין את פני השטח העליונים של המוח). כל קופסה לבנה מייצגת את אזור המוח (medulla oblongata, צלחת המוח הקטן, טקטום אופטי, הבנולה וטלנספלון גבי). (C) המוח כולו מעובד באמצעות napari. סרגל קנה מידה: 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
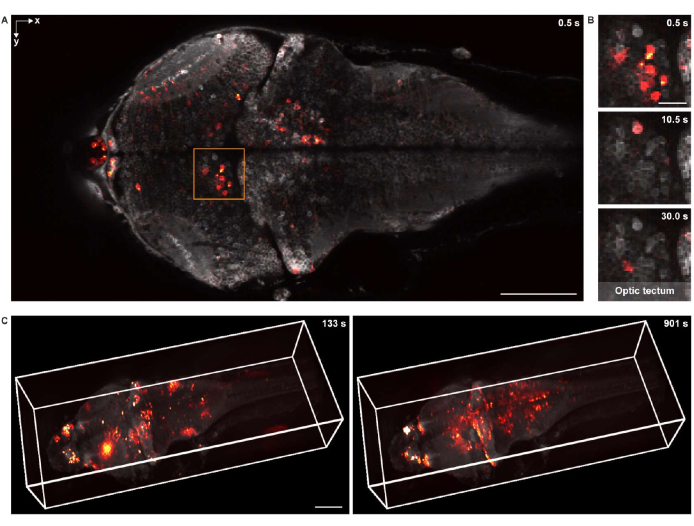
איור 5: הדמיה של פעילות עצבית במוח של דג זברה זחל. (A) תמונה במיקרוסקופ קונפוקלי של פעילות עצבית במוח של זחל זברה (4 d.p.f.) המבטא GCaMP7a פאן-עצבי. סרגל קנה מידה: 100 מיקרומטר. (B) תצוגה מוגדלת של האזור הארוז ב-A המראה את הפעילות העצבית בטקטום האופטי במספר נקודות זמן. סרגל קנה מידה: 20 מיקרומטר. (C) עיבוד תלת-ממדי של הפעילות העצבית של המוח כולו במוח הזחל של דג הזברה שנרכש באמצעות מיקרוסקופ מותאם אישית (משמאל: t = 133 שניות; ימין: t = 901 שניות). הפעילות העצבית מונחת על הרקע הסטטי. סרגל קנה מידה: 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
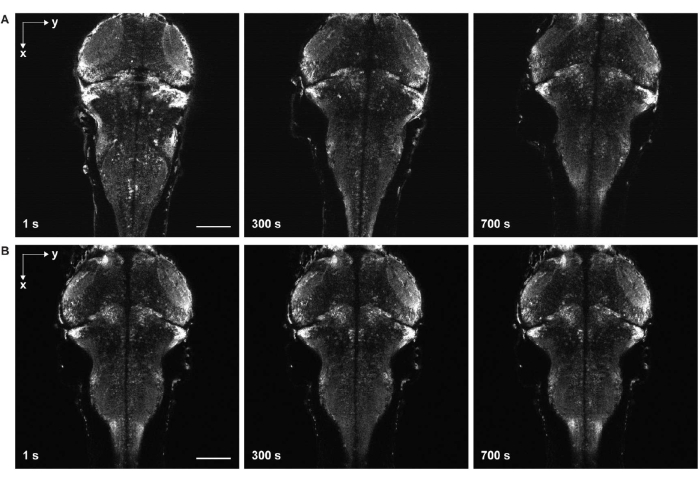
איור 6: דימות בהילוך מהיר עם ובלי סחף דגימה. (A) הדמיית קיטועי זמן של מוח הזברה הזחלני המבטא GCaMP7a פאן-עצבי עם סחף דגימה. מי ביצה נוספו לדגימה לפני התמצקות ג'ל האגרוז (שלב 3.6-3.7). הדג נע בכיוונים הרוחביים והציריים. (B) הדמיה בהילוך מהיר של מוח של דג זברה זחל ללא סחף דגימה. מי ביצים נוספו לדגימה לאחר התמצקות ג'ל האגרוז (שלב 3.6-3.7). סרגל קנה מידה: 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
וידאו 1: עיבוד תלת-ממדי של מבנה המוח כולו של זחל זברה (4 d.p.f.) מוח המבטא GCaMP7a פאן-עצבי. אנא לחץ כאן כדי להוריד סרטון זה.
וידאו 2: עיבוד תלת-ממדי של פעילות עצבית של המוח כולו במוח זחל של דג זברה (4 d.p.f.) המבטא GCaMP7a פאן-עצבי. אנא לחץ כאן כדי להוריד סרטון זה.
Discussion
הפרוטוקול הנוכחי מאפשר in vivo הדמיה מוחית שלמה של דגי זברה זחלים לאורך תקופה ממושכת (למשל, יותר משעה) והדמיות של נתוני הדימות המבניים והתפקודיים שנרכשו.
השלבים הקריטיים ביותר הם הרכבה ומיקום דגימה. במהלך הטמעת הדגימה, חיוני למנוע היווצרות בועות ולמנוע אבק בג'ל האגרוז. אם הג'ל מכיל בועות אוויר ואבק, איכות התמונה עלולה להיפגע קשות. בעת מיקום הדגימה באמצעות מלקחיים, חשוב לוודא כי הדגימה היא ישרה הן אופקית והן אנכית. אחרת, ייתכן שאזורי העניין לא ייכללו בשדה הראייה של המיקרוסקופ. בנוסף, מיקום זה צריך להיעשות בתוך חלון זמן קצר לפני התמצקות של ג'ל אגרוז כדי למנוע גרימת נזק על פני השטח שלה, כמו נזק כזה פוגע באיכות התמונה.
אתגר מרכזי נוסף הוא להימנע מתנועה בתמונות שמקורן בהתמצקות חלקית של ג'ל האגרוז (איור 6) ושיתוק של דג הזברה. כאשר מוסיפים מי ביצה לדגימה לפני התמצקות מלאה של ג'ל האגורס, דגים נעים לאט הן לרוחב והן באופן אקסיאלי, מה שמתבטא בהיסחפות דגימה בתמונות מסדרות הזמן (איור 6A). אם מינון המשותקים אינו מספיק או שמשך ההשפעה מסתיים, הדגימה עשויה לנסות לזוז, מה שנראה כעוויתות מהירות בתמונות קיטועי הזמן.
למרות חשיבותם של הצעדים הנ"ל לרכישת תמונות באיכות גבוהה ללא תוצרי תנועה, פרוטוקולים זמינים לציבור 15,16,17,18,19 מספקים רק סקירה קצרה של הליך הניסוי, וחסרים פרטים אלה. לדוגמה, התמונות שנרכשו ללא פרוטוקולי אימוביליזציה11 סובלות מארטיפקטים תנועתיים משמעותיים שהופכים את ניתוח התמונה במורד הזרם למאתגר. על ידי שילוב רכיבים חיוניים, כגון התמצקות ג'ל אגרוז ושיתוק דגימה, הפרוטוקול שלנו משפר באופן משמעותי את העקביות באיכות התמונות הנרכשות תוך מזעור תוצרי תנועה.
לסיכום, מתואר הליך ניסיוני אופטימלי וניתן לשחזור עבור הדמיה in vivo של מוח דג הזברה הזחל. תוקפו ויכולת השחזור של פרוטוקול זה לדימות in vivo של פעילות המוח ומבנהו אושרו במספר הגדרות 14,18,29,30,31. תהליך העבודה הנוכחי התמקד בדימות מוחי שלם של דגי זברה זחליים, אך ניתן ליישם אותו בקלות להדמיית איברים אחרים של דגי זברה זחלים35,36.
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
קווי דגי הזברה המשמשים להדמיית סידן סופקו על ידי מרכז דגי הזברה למידול מחלות (ZCDM), קוריאה. מחקר זה נתמך על ידי הקרן הלאומית למחקר של קוריאה (2020R1C1009869, NRF2021R1A4A102159411, RS-2023-00209473).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | SciLab | SL.Tub3513 | To aliquot agarose gel and pancuronium bromide solution |
| 15 mL Falcon tubes | Falcon | 352096 | To prepare agarose gel and pancuronium bromide solution |
| 16× 0.8NA water dipping objective lens | Nikon | CFI75 LWD 16×W | Objective lens for whole-brain imaging |
| 1-phenyl 2-thiourea (PTU) | Sigma-Aldrich | P7629-10G | 200 μM of 1-phenyl 2-thiourea (PTU) |
| 50 mL Falcon tubes | Falcon | 352070 | To prepare egg water |
| Disposable transfer pipette | SciLab | SL.Pip3032 | To transfer zebrafish larvae |
| Egg water | N/A | N/A | 0.6 g sea salt in 10 L deionized water |
| Forceps | Karl Hammacher GmbH | HSO 010-10 | Forceps used for sample positioning |
| Low melting point agarose | Thermo Scientific | R0801 | 2% (wt/vol) agarose gel |
| Napari | Napari | N/A | To visualize microscopy images in 3-D |
| NIS-Elements C | Nikon | N/A | Imaging software for confocal microscope |
| Pancuronium bromide | Sigma-Aldrich | P1918-10MG | 0.25 mg/mL of pancuronium bromide solution |
| Petri dish, 35 mm | SPL Life Sciences | 11035 | Petri dish used for sample embedding |
| Petri dish, 55 mm | SPL Life Sciences | 11050 | To prepare zebrafish larvae after screening |
| Point-scanning confocal microscopy system (C2 Plus) | Nikon | N/A | Confocal microscope for whole-brain imaging |
| Sea salt | Sigma-Aldrich | S9883-500G | Sea salt used for preparing egg water |
References
- Choi, T. -. Y., Choi, T. -. I., Lee, Y. -. R., Choe, S. -. K., Kim, C. -. H. Zebrafish as an animal model for biomedical research. Experimental & Molecular Medicine. 53 (3), 310-317 (2021).
- Ahrens, M. B., et al. Brain-wide neuronal dynamics during motor adaptation in zebrafish. Nature. 485 (7399), 471-477 (2012).
- Panier, T., et al. Fast functional imaging of multiple brain regions in intact zebrafish larvae using selective plane illumination microscopy. Frontiers in Neural Circuits. 7, 65 (2013).
- Bianco, I. H., Kampff, A. R., Engert, F. Prey capture behavior evoked by simple visual stimuli in larval zebrafish. Frontiers in Systems Neuroscience. 5, 101 (2011).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Piatkevich, K. D., et al. A robotic multidimensional directed evolution approach applied to fluorescent voltage reporters. Nature Chemical Biology. 14 (4), 352-360 (2018).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Looger, L., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Biorxiv. , (2021).
- Ahrens, M. B., Orger, M. B., Robson, D. N., Li, J. M., Keller, P. J. Whole-brain functional imaging at cellular resolution using light-sheet microscopy. Nature Methods. 10 (5), 413-420 (2013).
- Prevedel, R., et al. Simultaneous whole-animal 3D imaging of neuronal activity using light-field microscopy. Nature Methods. 11 (7), 727-730 (2014).
- Chhetri, R. K., et al. Whole-animal functional and developmental imaging with isotropic spatial resolution. Nature Methods. 12 (12), 1171-1178 (2015).
- Ahrens, M. B., Engert, F. Large-scale imaging in small brains. Current Opinion in Neurobiology. 32, 78-86 (2015).
- Yoon, Y. -. G., et al. Sparse decomposition light-field microscopy for high speed imaging of neuronal activity. Optica. 7 (10), 1457-1468 (2020).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Cong, L., et al. Rapid whole brain imaging of neural activity in freely behaving larval zebrafish (Danio rerio). eLife. 6, e28158 (2017).
- Bruzzone, M., et al. Whole brain functional recordings at cellular resolution in zebrafish larvae with 3D scanning multiphoton microscopy. Scientific Reports. 11 (1), 11048 (2021).
- Cho, E. -. S., Han, S., Lee, K. -. H., Kim, C. -. H., Yoon, Y. -. G. 3DM: deep decomposition and deconvolution microscopy for rapid neural activity imaging. Optics Express. 29 (20), 32700-32711 (2021).
- Zhang, Z., et al. Imaging volumetric dynamics at high speed in mouse and zebrafish brain with confocal light field microscopy. NatureBiotechnology. 39 (1), 74-83 (2021).
- Muto, A., Ohkura, M., Abe, G., Nakai, J., Kawakami, K. Real-time visualization of neuronal activity during perception. Current Biology. 23 (4), 307-311 (2013).
- Köster, R. W., Fraser, S. E. Tracing transgene expression in living zebrafish embryos. Developmental Biology. 233 (2), 329-346 (2001).
- Park, H. C., et al. Analysis of upstream elements in the HuC promoter leads to the establishment of transgenic zebrafish with fluorescent neurons. Developmental Biology. 227 (2), 279-293 (2000).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). 4th edition. , (2000).
- Morsch, M., et al. Triggering cell stress and death using conventional UV laser confocal microscopy. Journal of Visualized Experiments. (120), e54983 (2017).
- Antinucci, P., Hindges, R. A crystal-clear zebrafish for in vivo imaging. Scientific Reports. 6, 29490 (2016).
- Parker, M. O., Brock, A. J., Millington, M. E., Brennan, C. H. Behavioral phenotyping of casper mutant and 1-pheny-2-thiourea treated adult zebrafish. Zebrafish. 10 (4), 466-471 (2013).
- Elsalini, O. A., Rohr, K. B. Phenylthiourea disrupts thyroid function in developing zebrafish. Development Genes and Evolution. 212 (12), 593-598 (2003).
- Han, S., Cho, E. -. S., Park, I., Shin, K., Yoon, Y. -. G. Efficient neural network approximation of robust PCA for automated analysis of calcium imaging data. Medical Image Computing and Computer Assisted Intervention. , 595-604 (2021).
- Shin, C., et al. Three-dimensional fluorescence microscopy through virtual refocusing using a recursive light propagation network. Medical Image Analysis. 82, 102600 (2022).
- Eom, M., et al. Statistically unbiased prediction enables accurate denoising of voltage imaging data. bioRxiv. , (2022).
- Johnston, L., et al. Electrophysiological recording in the brain of intact adult zebrafish. Journal of Visualized Experiments. (81), e51065 (2013).
- Sofroniew, N., et al. napari: a multi-dimensional image viewer for Python. Zenodo. , 3555620 (2022).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Mickoleit, M., et al. High-resolution reconstruction of the beating zebrafish heart. Nature Methods. 11 (9), 919-922 (2014).
- Voleti, V., et al. Real-time volumetric microscopy of in vivo dynamics and large-scale samples with SCAPE 2.0. Nature Methods. 16 (10), 1054-1062 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved