Мультиплексная иммунофлюоресценция в сочетании с анализом пространственных изображений для клинико-биологической оценки микроокружения опухоли
In This Article
Summary
В данной статье описан протокол ручного усиления тирамидного сигнала (TSA) мультиплексной иммунофлуоресценции (mIF) в сочетании с анализом изображений и пространственным анализом. Этот протокол может быть использован с фиксированными формалином парафиновыми срезами (FFPE) для окрашивания от двух до шести антигенов на предметное стекло в зависимости от сканера предметного стекла, доступного в лаборатории.
Abstract
Микроокружение опухоли (TME) состоит из множества различных типов клеток, таких как цитотоксические иммунные клетки и иммуномодулирующие клетки. В зависимости от своего состава и взаимодействия между раковыми клетками и периопухолевыми клетками, TME может влиять на прогрессирование рака. Характеристика опухолей и их сложного микроокружения может улучшить понимание раковых заболеваний и может помочь ученым и клиницистам открыть новые биомаркеры.
Недавно мы разработали несколько мультиплексных панелей иммунофлуоресценции (mIF) на основе амплификации тирамидного сигнала (TSA) для характеристики TME при колоректальном раке, плоскоклеточном раке головы и шеи, меланоме и раке легких. После завершения окрашивания и сканирования соответствующих панелей образцы анализируются с помощью программного обеспечения для анализа изображений. Пространственное положение и окрашивание каждой клетки затем экспортируются из этого программного обеспечения для количественной оценки в R. Мы разработали R-скрипты, которые позволяют нам не только анализировать плотность каждого типа клеток в нескольких опухолевых компартментах (например, в центре опухоли, крае опухоли и строме), но и выполнять анализ на расстоянии между различными типами клеток.
Этот конкретный рабочий процесс добавляет пространственное измерение к классическому анализу плотности, который уже обычно выполняется для нескольких маркеров. Анализ mIF может позволить ученым лучше понять сложное взаимодействие между раковыми клетками и TME и обнаружить новые прогностические биомаркеры ответа на лечение, такие как ингибиторы иммунных контрольных точек и таргетная терапия.
Introduction
С развитием таргетной терапии и ингибиторов иммунных контрольных точек стало крайне важно лучше охарактеризовать взаимодействие между раковыми клетками и их опухолевым микроокружением, и в настоящее время это важная область трансляционных исследований. TME состоит из множества различных типов клеток с балансом иммунных цитотоксических клеток, нацеленных на раковые клетки, и иммуномодулирующих клеток, которые могут способствовать росту опухоли и инвазивности 1,2,3,4. Характеристика этой сложной среды может улучшить понимание раковых заболеваний и может помочь ученым и клиницистам открыть новые прогностические и прогностические биомаркеры, чтобы лучше отбирать пациентов для будущего лечения 5,6. Например, Галон и его команда разработали Immunoscore, который представляет собой воспроизводимый метод оценки, который можно использовать в качестве прогностического биомаркера. Immunoscore рассчитывается с использованием плотности CD3+ и CD8+ Т-клеток в инвазивном крае и в центре опухоли 7,8.
За последние десятилетия были разработаны коммерческие решения для mIF, но они часто являются дорогостоящими и предназначены для специфических панелей антигенов. Чтобы преодолеть потребность в специфических панелях антигенов в академических и трансляционных исследованиях, мы разработали экономически эффективный метод выполнения mIF на срезах опухоли FFPE, позволяющий окрашивать от двух до шести антигенов, добавленных к контрокрашиванию ядер клеток на образцах человека и мыши.
После того, как целые срезы ткани окрашены и отсканированы с помощью флуоресцентного слайд-сканера, образцы могут быть проанализированы с помощью нескольких программ для анализа изображений, поддерживающих большие пирамидальные наборы данных. Наконец, необработанные данные могут быть использованы в среде для статистических вычислений и графики, такой как программное обеспечение R (v.4.0.2), для выполнения плотности и пространственного анализа.
В этой рукописи представлен протокол, оптимизированный для окрашивания пятью маркерами, а также приемы и советы по оптимизации новых панелей. Кроме того, подробно описаны этапы анализа изображений и функции R, используемые для статистического и пространственного анализа.
Protocol
Все образцы, использованные в настоящем протоколе, были получены в результате исследования, одобренного местными комитетами по этике и санкционированного компетентным органом. Все участники исследования дали письменное информированное согласие. Исследование зарегистрировано в ClinicalTrials.gov (NCT03608046).
1. Мультиплексная иммунофлюоресценция
- Секционирование FFPE
- Зафиксируйте ткань в 4% параформальдегиде и вставьте фиксированную ткань в парафин.
- Отрежьте срезы размером 5 мкм и поместите их на клейкие предметные стекла микроскопа.
- Высушите предметные стекла в течение ночи при комнатной температуре (RT).
- Депарафинизация и ингибирование эндогенных пероксидаз
- Депарафиньте ткани, погрузив предметные стекла в толуол (3 раза по 5 мин каждый) и метанол (3 раза по 5 мин каждый) под вытяжной шкаф.
- Ингибируют эндогенные пероксидазы путем погружения предметных стекол в 3% перекись водорода, разбавленную в метаноле, на 20 мин под вытяжным шкафом.
- Промойте предметные стекла в дистиллированной (d) H2O (1x в течение 3 мин).
- Мультиплексное иммунофлюоресцентное окрашивание
- Погрузите предметные стекла в банку для окрашивания объемом 300 мл, содержащую 10 мМ цитратный (рН 6) или ЭДТА (рН 9) буфер с добавлением 0,1% TritonX-100.
ПРИМЕЧАНИЕ: Используемый буфер (рН 6 или рН 9) зависит от окрашенного антигена (см. Таблицу 1). - Поместите банку для окрашивания с закрытой крышкой в микроволновую печь на 3-5 минут при максимальной мощности (например, 900 Вт), пока буфер не закипит.
ПРИМЕЧАНИЕ: Оптимальное время для кипячения зависит от микроволновой печи и объема буфера. Корректировки могут потребоваться, чтобы найти идеальное время. Для некоторых хрупких антигенов или хрупких и менее адгезивных образцов (например, органоидов и сфероидов) кипячение в микроволновой печи может быть слишком резким. В этом случае вместо нее можно использовать скороварку. - Держите буфер при температуре, близкой к кипению, поставив закрытую банку для окрашивания в микроволновую печь на низкой мощности (например, 90 Вт) на 15 минут.
- Выполните последний шаг нагрева, поставив микроволновую печь на максимальную мощность на 90 с.
- Выньте банку из микроволновой печи и дайте буферу остыть в течение 15 минут при RT.
- Промойте предметные стекла 3 раза в течение 5 мин каждый при dH2O и 1x в течение 5 мин в трис-буферизованном физиологическом растворе, содержащем 0,1% Tween 20 (TBS-T).
- Удалите TBS-T, промокнув предметные стекла на бумажном полотенце
- Поместите предметные стекла (плоские) на поддон камеры окрашивания или коробку для предметных стекол микроскопа (см. Таблицу материалов).
- Обведите ткань гидрофобной ручкой.
- Блокируйте неспецифические сайты связывания, покрывая ткань 5% бычьим сывороточным альбумином (BSA), растворенным в TBS-T в течение 30 мин.
- Снимите блокирующий буфер, промокнув слайды на бумажном полотенце.
ПРИМЕЧАНИЕ: Не промывайте слайды после этапа блокировки. - Инкубируют ткань в течение 60 мин с первичным антителом (см. Таблицу 1), разведенным в 1% BSA TBS-T, покрывая ткань примерно 300 мкл раствора.
- Промойте предметные стекла 3 раза по 3 минуты с помощью TBS-T.
- Инкубируют ткань в течение 40 мин с вторичным антителом поли-HRP (см. Таблицу 1), покрывая ткань примерно 300 мкл раствора.
- Промойте предметные стекла 3 раза в течение 3 минут с помощью TBS-T.
- Инкубируют ткань в течение 10 мин с флуорохром-тирамидным реагентом (см. Таблицу 1), разбавленным в 200 раз в боратном буфере (0,1 М борат, рН 7,8, 3 М NaCl), экстемпорально дополненном 0,003% H 2O2 путем покрытия ткани примерно 300 мкл раствора.
- Промойте предметные стекла 3 раза в течение 3 минут с помощью TBS-T.
- Повторяйте шаги 1.3.1-1.3.16 до тех пор, пока не будет выполнено все окрашивание TSA.
- Инкубируйте ткань в течение ночи при 4 ° C с последним первичным антителом (см. Таблицу 1), разведенным в 1% BSA TBS-T.
ПРИМЕЧАНИЕ: Поскольку инкубация проводится в течение ночи, важно накрыть лоток камеры окрашивания или коробку предметного стекла микроскопа и добавить dH2O на бумажное полотенце на дно коробки (под предметными стеклами), чтобы убедиться, что ткани не высохнут во время инкубации. - Промойте салфетку 3 раза в течение 5 минут с помощью TBS-T.
- Инкубируйте ткань в течение 120 мин с вторичным антителом (непосредственно связанным с флуорохромом), разбавленным в 200 раз в 1% BSA TBS-T.
- Промойте салфетку 3 раза в течение 5 минут с помощью TBS-T.
- Окрашивают ядра путем инкубации ткани в течение 5 мин в бисбензимиде (20 мМ), разбавленном в 1,000 раз в 10% BSA TBS-T.
ПРИМЕЧАНИЕ: Бисбензимид можно заменить DAPI, но последний более токсичен и с ним нужно осторожно обращаться под вытяжным шкафом. - Промойте салфетку 3 раза в течение 3 минут каждый при dH2O.
- Установите предметные стекла с помощью флуоресцентной монтажной среды и боросиликатных покровных стекол.
- Погрузите предметные стекла в банку для окрашивания объемом 300 мл, содержащую 10 мМ цитратный (рН 6) или ЭДТА (рН 9) буфер с добавлением 0,1% TritonX-100.
2. Сканирование слайдов
- Оцифруйте слайды, отсканировав их на флуоресцентном сканере слайдов с 20-кратным увеличением (подробная информация о сканере слайдов приведена в таблице материалов).
ПРИМЕЧАНИЕ: Репрезентативное сканирование оптимального мультиплекса показано на рисунке 1.
3. Анализ изображений
- Импортируйте сканы в программное обеспечение для анализа изображений (File > Open Image).
- Перейдите на вкладку «Классификаторы» и выберите плагин DenseNet AI V2 .
- Обучите плагин DenseNet AI V2 распознавать ядра, окружая около 500 ядер на одном изображении.
- Обучите ИИ на нескольких других предметных стеклах из той же партии и разных партиях окрашивания mIF, окружив несколько ядер (50) на нескольких предметных стеклах (около 10).
ПРИМЕЧАНИЕ: Подробные инструкции по использованию плагина AI можно найти в руководстве по программному обеспечению. Использование ИИ для обнаружения ядер не является обязательным. Другие методы обнаружения ядер доступны в зависимости от используемого программного обеспечения для анализа изображений. - Сохраните обученный ИИ (действия классификатора > сохранение).
- Перейдите на вкладку « Аннотации» и создайте аннотацию для каждой интересующей области (ROI), такой как центр опухоли и край опухоли, с помощью инструмента «Перьевая аннотация».
- При необходимости удалите области со складками и размытые области с помощью инструмента аннотации исключений.
ПРИМЕЧАНИЕ: Окрашивание гематоксилин-эозином участка, прилегающего к участку, используемому для mIF, может быть выполнено перед окрашиванием mIF, чтобы убедиться, что опухолевые клетки присутствуют в образце, и помочь анатомопатологам определить ROI. - Перейдите на вкладку «Анализ» и выберите алгоритм HighPlex FL («Действия настроек» > «Загрузить» > HighPlex FL).
- Перейдите на вкладку «Выбор красителя » и выберите интересующий краситель.
- На вкладке « Ядерное обнаружение » перейдите в раздел «Тип ядерной сегментации» и выберите «Пользовательский ИИ».
- В классификаторе ядерной сегментации выберите ИИ, сохраненный на шаге 3.5.
- Во вкладке «Обнаружение мембраны и цитоплазмы» выберите максимальный радиус цитоплазмы (в данном исследовании использовался 1,5) и количество мембранных красителей.
- Для каждого красителя выберите положительный порог ядра, положительный порог цитоплазмы и положительный порог мембраны.
ПРИМЕЧАНИЕ: Порог различен для каждого окрашивания и должен быть скорректирован для каждой партии предметных стекол и каждого окрашенного антигена. Использование инструмента « Настройки просмотра » («Настройки просмотра» > «Просмотр») может помочь выбрать адекватное пороговое значение, используя значение интенсивности в конце пика интенсивности (справа). - Для каждого красителя выберите процент полноты ядра, мембраны и цитоплазмы.
ПРИМЕЧАНИЕ: Этот параметр важен, чтобы избежать ложноположительного обнаружения, когда две клетки с разным окрашиванием находятся близко друг к другу (рис. 2). - Сохраните алгоритм (Действия настроек > Сохранить).
- Проанализируйте рентабельность инвестиций (Analyze > Annotation Layer).
- Перейдите на вкладку « Результаты » и выберите все данные в разделе «Данные объекта » (ctrl + A).
- Экспортируйте данные в .csv формате (щелкните правой кнопкой мыши > Export > Object Data. CSV).
ПРИМЕЧАНИЕ: Эта таблица содержит положение (Xmin, Xmax; Ymin, Ymax) и положительность каждого маркера каждой анализируемой клетки.
4. Биоинформатика с использованием R
ПРИМЕЧАНИЕ: Скрипт R, предоставляющий более подробную информацию о следующих шагах, доступен на GitHub (benidovskaya/Ring: Pipeline for analysis of multiplex immunofluorescence stainings. [github.com])
- Используя экспортированную таблицу, сначала определите различные типы клеток на основе окрашивания колокализации. Например, определяют цитотоксические Т-клетки по двойным положительным клеткам CD3+/CD8+.
- Затем восстановите упрощенное изображение слайда на точечном графике, используя координаты, экспортированные из программного обеспечения для анализа изображений, и ggplot2 (Рисунок 3). Используя эти данные, можно выполнить несколько видов анализа:
- Анализ плотности
ПРИМЕЧАНИЕ: Простейшим анализом является анализ плотности.- Проведите анализ плотности для всех типов клеток, используя весь предметный стекол для биопсии или какую-то конкретную область ткани. Например, вычислите плотность CD3+ и CD8+ Т-клеток в центре опухоли и на краю опухоли (рис. 4A-C).
- Чтобы вычислить эти плотности, используйте программное обеспечение для анализа изображений, чтобы создать определенный кадр данных для каждого образца с фенотипом и координатами каждой клетки. С помощью функции кластеризации (k-ближайший сосед) на R создайте полигональный объект, используя границы исследуемой биопсии, и вычислите плотность интересующих типов клеток внутри него.
ПРИМЕЧАНИЕ: Это позволяет сравнивать плотности различных типов клеток между различными условиями (такими как разные моменты времени, типы лечения, типы тканей и реакция на лечение) и локализациями (центр опухоли, край опухоли, фиброз стромы и область некроза) в зависимости от биологической гипотезы. Из-за высокой близости между раковыми клетками, периопухолевыми клетками и клетками, проникающими в опухоль, программное обеспечение для анализа изображений может обнаруживать двойные положительные клетки как иммунные и раковые клетки одновременно. В этом случае нужно биоинформационно исправить эту проблему, упомянув, что это за двойные положительные клетки. В этом случае клетки CD3 + CD8 + цитокератин+ были помечены как цитотоксические клетки, потому что цитокератин-положительный результат был обусловлен опухолевыми клетками, окружающими инфильтрирующие лимфоциты.
- Тепловые карты
- Используя плотность каждого типа ячеек с разных панелей и применяя нормализацию (например, масштабирование, центрирование), нарисуйте тепловые карты (рис. 5), представляющие обилие ячеек в популяции образцов.
- Используя иерархическую неконтролируемую кластеризацию, основанную на плотности клеток, кластеризуйте пациентов с аналогичными составами TME и соотнесите эти кластеры с клиническими параметрами, такими как ответ на лечение и выживаемость.
ПРИМЕЧАНИЕ: Тепловые карты и кластеризация могут быть легко выполнены с помощью пакета R ComplexHeatmap9.
- Пространственное распределение ячеек
- Вычислить биоинформационно расстояния между клетками (например, иммунными и опухолевыми клетками; Рисунок 6A, B) на основе координат ячеек, полученных при анализе изображений. Используйте медианное и среднее расстояния между интересующими типами клеток, чтобы сравнить близость клеток во всех выборках когорты.
- Пространственно-описательные функции
- Используйте функцию G-кросса ближайшего соседа крестового типа, доступную через пакет10 R spatstat, чтобы определить вероятность того, что интересующая клетка X (например, опухолевая клетка) встретится с ближайшей клеткой Y (например, Т-клеткой) в определенном радиусе вокруг клетки X.
- Рассчитайте площадь под эмпирической кривой, чтобы получить числовое значение, представляющее опухолевую инфильтрацию CD3+ Т-клеток вокруг опухолевых клеток11 (рис. 6C). Используйте другие пространственные описательные функции, такие как F-функция или J-функция12.
- Иммунологический анализ
- Вычислите иммунобалл (I), разработанный командой Galon7,8, используя плотность CD3+ и CD8+ Т-клеток в центре опухоли и инвазивный край опухоли.
ПРИМЕЧАНИЕ: Оценка колеблется от I0 до I4. Низкая плотность CD3+ и CD8+ Т-клеток в центре и на краю опухоли связана с оценкой I0, в то время как высокая плотность CD3+ и CD8+ Т-клеток в обеих областях связана с оценкой I4. Недавно прогностическое воздействие Immunocore было подтверждено в исследовании с образцами 2,681 пациента с раком толстой кишки I-III стадии из 14 центров в 13 странах7. Однако для расчета Immunoscore требуется хирургически резецированный образец, содержащий как центр, так и край опухоли. Для биопсий, которые обычно не имеют запаса, недавно был разработан адаптированный к биопсии иммунобалл13. - Чтобы вычислить адаптированный к биопсии иммунобалл, преобразуйте значение плотности CD3+ и CD8+ Т-клеток в процентиль, а затем используйте средний процентиль CD3+ и CD8+ Т-клеток для оценки в одну из трех категорий (т. е. низкий, средний и высокий)13.
- Вычислите иммунобалл (I), разработанный командой Galon7,8, используя плотность CD3+ и CD8+ Т-клеток в центре опухоли и инвазивный край опухоли.
- Анализ горячих точек
- Используйте анализ горячих точек с помощью функции квадратного счета (spatstat)10 для сравнения плотности различных типов клеток в наиболее инфильтрированной области ткани. Например, можно вычислить оценку «Immunoscore-like», используя значение плотности CD3 и CD8 Т-клеток наиболее инфильтрированных квадратов ткани (рис. 7). Применяют этот метод для анализа любого типа клеток с неоднородным распределением по тканям.
- Анализ плотности
Representative Results
Следуя этому протоколу, следует изучить несколько параметров, чтобы убедиться, что ткань правильно окрашена. Во-первых, окрашивание TSA должно отображать хороший динамический диапазон при использовании низкого времени экспозиции (обычно 2-100 мс) в процессе сканирования. Низкое время экспозиции означает, что амплификация была выполнена правильно во время реакции с HRP. Для антигенов, окрашенных вторичным антителом, непосредственно связанным с флуорохромом, время воздействия может быть намного больше, что может привести к фотообесцвечиванию (снижению интенсивности сигнала из-за длительного времени экспозиции). Во-вторых, важно убедиться, что каждое окрашивание показывает высокое отношение сигнал/шум. Высокий фоновый сигнал с низким сигналом антигена может быть признаком того, что первичное антитело недостаточно специфично, что эндогенные пероксидазы не были инактивированы правильно или что один шаг протокола не был выполнен адекватно. В-третьих, в зависимости от сканера слайдов и наборов фильтров, используемых для сканирования, можно увидеть перекрытия между двумя цветами (например, AF555, AF594 и AF647). Выбор правильных наборов фильтров на сканере и правильное разведение первичных антител имеют решающее значение для предотвращения возможных перекрестных обнаружений. Контроль качества заключается в обнаружении единичных окрашенных ячеек для каждого маркера в отсканированном файле. Наконец, также важно добавить положительный и отрицательный контроль для каждой партии окрашивания. Для иммунных клеток миндалины являются хорошим положительным контролем. Репрезентативный результат оптимального окрашивания показан на рисунке 1.
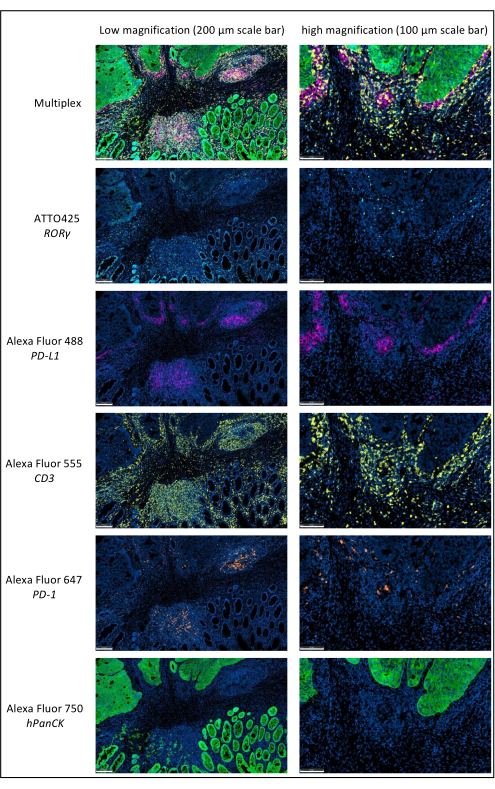
Рисунок 1: Местнораспространенный рак прямой кишки, окрашенный мультиплексной иммунофлуоресценцией. Сокращения: PD-1 = белок запрограммированной клеточной смерти 1; PD-L1 = запрограммированный лиганд смерти 1; ROR-γ = гамма-рецептор сирот, связанный с RAR; CD3 = кластер дифференциации 3; hPanCK = пан-цитокератин человека. Каждое окрашивание антигена сканируется в оттенках серого, а цвета, представленные на рисунке, являются псевдоцветами. Масштабная линейка с малым увеличением: 200 мкм; Масштабная линейка с большим увеличением: 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
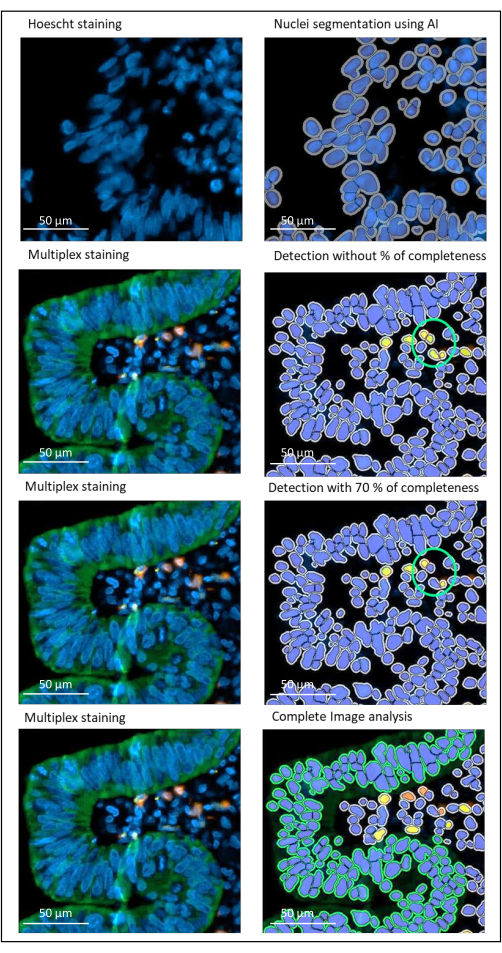
Рисунок 2: Обнаружение ядер и окрашивания местно-распространенного рака прямой кишки с помощью программного обеспечения для анализа изображений. Если параметр полноты не установлен правильно, программа обнаруживает две ячейки CD8+ (зеленый кружок), потому что они расположены близко друг к другу, но окрашивается только одна ячейка. Использование 70% полноты помогает избежать этого ложного срабатывания. Зеленый = hPanCK; желтый = CD3; Оранжевый = CD8. Масштабная линейка: 100 мкм Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
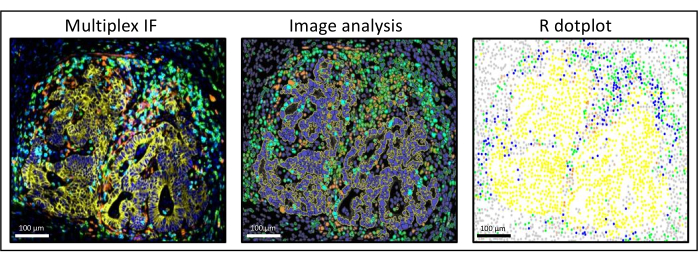
Рисунок 3: Анализ изображений и восстановление метастазов колоректального рака печени на точечной диаграмме. На мультиплексном окрашивании (слева) панцитокератин человека окрашен в желтый цвет, CD3 — в зеленый, CD8 — в светло-голубой, а IDO — в оранжевый. На точечном графике (справа) клетки пан-цитокератина+ человека выделены желтым цветом, клетки CD3+CD8- зеленым, клетки CD3+CD8+ - синим, а клетки IDO+ - оранжевым. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
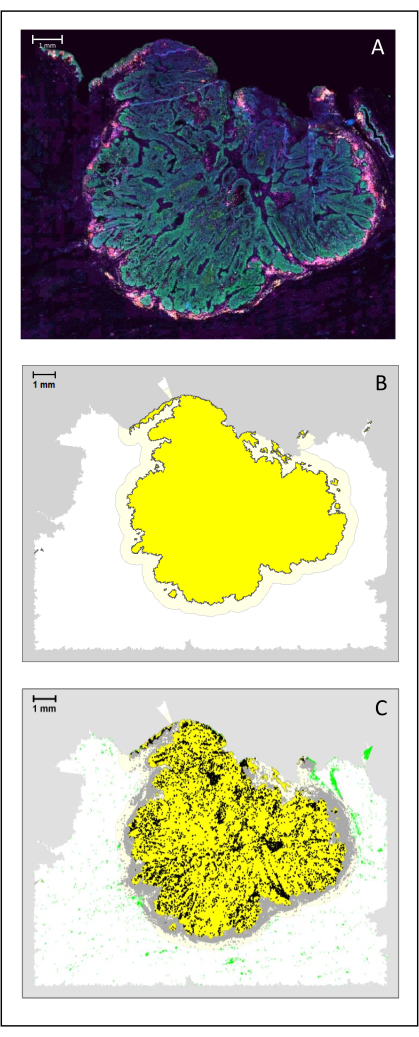
Рисунок 4: Анализ хирургического участка HNSCC. (A) Хирургического участка HNSCC. Раковые клетки видны зеленым цветом. Вокруг опухолевых островков визуализируются периопухолевые клетки (CD3 желтого цвета и CD8 фиолетового цвета). (B) Центр опухоли (желтый цвет с черной каймой) вычисляется биоинформационно с помощью алгоритма k-ближайшего соседа на основе расстояния между опухолевыми островками от одной области. Вокруг этой области вычисляется инвазивный край (светло-желтый с серой каймой) на произвольной основе 500 мкм. (C) Инвазивные Т-клетки выделены черными точками в центре опухоли и серыми точками в инвазивном крае. Другие Т-клетки выделены светло-зелеными точками. Масштабная линейка: 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
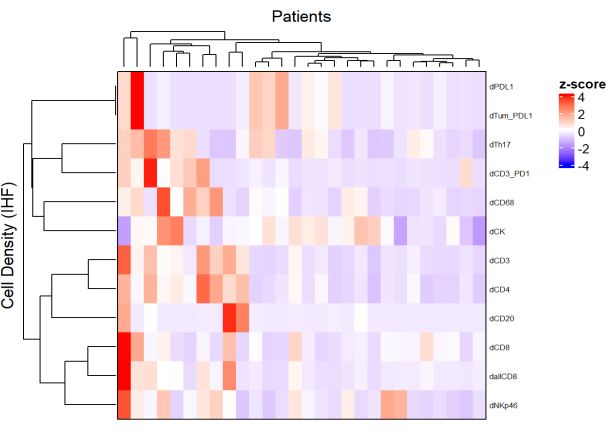
Рисунок 5: Тепловая карта плотности различных типов клеток местно-распространенной биопсии рака прямой кишки. Тепловая карта была построена с использованием неконтролируемой кластеризации плотностей различных типов ячеек из разных мультиплексных панелей с помощью пакета ComplexHeatmap. Для нормализации использовались масштабирование и центрирование. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
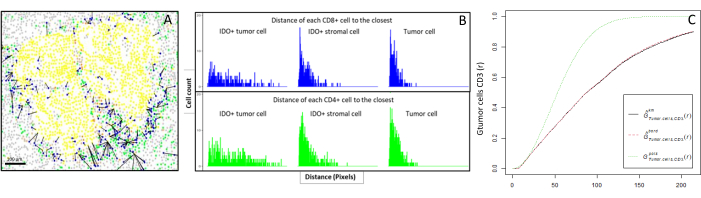
Рисунок 6: Расстояния от клеток CD4+ и CD8+ до каждой IDO+ или опухолевой клетки. Клетки панцитокератина+ человека выделены желтым цветом, клетки CD3 + CD8- зеленым, клетки CD3 + CD8 + - синим, а клетки IDO + - оранжевым. (A) Самое близкое расстояние между опухолевыми клетками и каждой CD8+ Т-клеткой. (B) Штрих-графики расстояний между клетками IDO+ и каждой CD8+ Т-клеткой (синий) или CD4+ Т-клеткой (зеленый). (C) Пример выборки, проанализированной с помощью функции G-креста. Ось Y показывает вероятность того, что опухолевая клетка столкнется с лимфоцитом CD3+ в радиусе от 0 до 200 мкм вокруг опухолевой клетки. Показаны три кривые; теоретическая кривая обозначена пунктирным зеленым цветом (распределение Пуассона), скорректированная эмпирическая кривая с поправкой км - черным, а скорректированная эмпирическая кривая с коррекцией границ - пунктирным красным. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
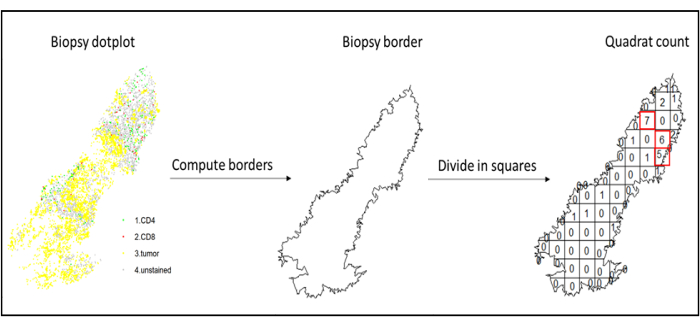
Рисунок 7: Иллюстрация квадратного счета. Вычисление границ и квадратный подсчет были выполнены с помощью пакета spatstats. Наиболее инфильтрированные квадраты (горячие точки) можно использовать для последующей статистики. CD4 окрашен в зеленый цвет, CD8 - в красный, а опухолевые клетки - в желтый. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
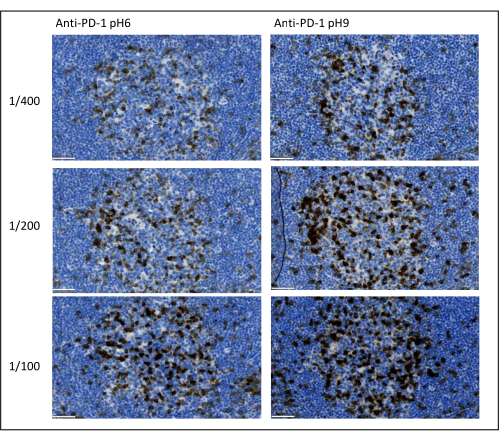
Рисунок 8: Разведение антител и оптимизация извлечения антигена. Хромогенное обнаружение PD-1 с использованием трех различных разведений и двух различных растворов для извлечения антигена первичного антитела (цитрат pH 6 и EDTA pH 9). Масштабная линейка: 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Первичные антитела | Разбавление | Извлечение антигена | Вторичные антитела | Флуорохром | Позиция |
| ПД-1 | 1/100 | ЭДТА (рН 9) | Антикролик | АФ647 | 1 |
| ПД-Л1 | 1/1000 | ЭДТА (рН 9) | Антикролик | АФ488 | 2 |
| РОР-γ | 1/200 | ЭДТА (рН 9) | Анти-мышь | АТТ0-425 | 3 |
| СД3 | 1/100 | Цитрат (рН 6) | Антикролик | АФ555 | 4 |
| hPanCK | 1/50 | Цитрат (рН 6) | Защита от мыши в сочетании с AF750 | 5 | |
Таблица 1: Пример оптимизированной мультиплексной панели. Сокращения: PD-1 = белок запрограммированной клеточной смерти 1; PD-L1 = запрограммированный лиганд смерти 1; ROR-γ = гамма-рецептор сирот, связанный с RAR; CD3 = кластер дифференциации 3; hPanCK = пан-цитокератин человека; AF = AlexaFluor; ЭДТА = этилендиаминтетрауксусная кислота. CD3 используется для обнаружения Т-лимфоцитов; PD-1 используется для обнаружения истощенных лимфоцитов; ROR-γ используется для обнаружения Th-17; и hPanCK используется для обнаружения опухолевых клеток. В столбце позиции указывается порядок, в котором должен быть выполнен последовательный мультиплекс.
Discussion
Наиболее важными параметрами, которые следует учитывать для оптимизации мультиплексного окрашивания, являются разведение, специфичность и извлечение антигена, используемые для каждого первичного антитела. Перед началом мультиплексного протокола необходимо проверить оптимальное разведение каждого первичного антитела и оптимальное извлечение эпитопа (рН 6 или рН 9) с помощью хромогенного окрашивания (DAB). Мы советуем тестировать три разведения для каждого буфера извлечения антигена: разведение, которое обычно указывается брендом, коммерциализирующим антитело, то же разведение, деленное в два раза, и то же разведение, умноженное в два раза (рис. 8). Выбор правильного разведения является очень важным шагом для проверки специфичности антител и оптимизации отношения сигнал/шум (SNR) окрашивания. После выбора правильного разведения в DAB одно и то же разведение следует протестировать для каждого первичного антитела с использованием униплексного TSA. После того, как буфер разведения и извлечения эпитопа выбран для каждого окрашивания антигена, также важно правильно настроить последовательность мультиплекса; В частности, некоторые антигены лучше окрашиваются в первой позиции, а другие - в последней. Мы советуем протестировать мультиплексную маркировку, используя все возможные перестановки порядка, чтобы выбрать, какое окрашивание антигена должно быть первым, вторым и т. Д. Это также очень важный шаг, потому что некоторые хрупкие антигены могут разлагаться после нескольких раундов поиска эпитопов, а некоторые антигены лучше окрашиваются после нескольких раундов поиска эпитопов. Например, SNR всегда выше в последней позиции для CD3 и в первой позиции для окрашивания PD-1. Кроме того, окрашиванию нескольких совместно локализованных антигенов может препятствовать зонтичный эффект (насыщение тирамидных реакционноспособных сайтов). Это можно ослабить, уменьшив концентрацию тирамида. Когда экспрессия одного антигена обусловлена экспрессией другого (CD8 присутствует только на CD3-экспрессирующих Т-клетках), мы рекомендуем окрашивать антиген с самой широкой экспрессией (в данном случае CD3) после другого. Наконец, выбор правильного флуорохрома для каждого окрашивания антигена в соответствии со спецификой сканера также является важным шагом, позволяющим избежать перекрестного обнаружения.
Основными преимуществами этого метода являются усиление и полученное соотношение сигнал/шум. Однако этот метод имеет ограничение, которое заключается в том, что окрашивание происходит последовательно, а флуорохромы ковалентно связаны с тканью. Тем не менее, после выполнения всех раундов усиления тирамидного сигнала также можно добавить последнее окрашивание вторичным антителом, непосредственно связанным с флуорохромом (без TSA). В некоторых панелях мы использовали этот метод для добавления окрашивания в канал 750. Это было необходимо, потому что в то время тирамид-AF750 не был коммерчески доступен. Следует отметить, что время воздействия (во время сканирования) антигена, окрашенного AF750, будет намного больше, чем для других антигенов, окрашенных TSA. В этом случае мы советуем окрашивать высокоэкспрессируемый белок, такой как цитокератин, или увеличивать концентрацию первичного антитела. Таким образом, можно окрашивать максимум пять-шесть антигенов на предметное стекло за одну партию в зависимости от флуоресцентного сканера.
Напротив, несколько коммерчески доступных методов используют серийное окрашивание с несколькими раундами окрашивания, сканирования и удаления или фотообесцвечивания для увеличения количества антигенов, которые могут быть окрашены на одном отдельном участке ткани. Однако эти методы часто отнимают много времени, дороги, не имеют усиления сигнала, требуют сложных вычислительных шагов для правильного объединения последовательных сканирований и, по нашему опыту, могут вызвать необратимое повреждение тканей из-за многочисленных этапов процедуры. Тем не менее, сообщалось, что до 30 антигенов могут быть окрашены на одной ткани с использованием этого метода14.
В заключение, наш метод представляет собой надежный, воспроизводимый, простой в использовании и экономичный метод иммуногистофлуоресценции, который можно использовать в любой лаборатории, имеющей флуоресцентный сканер слайдов. Можно использовать любое коммерциализированное первичное антитело, подходящее для ИГХ, и панели не являются специфическими для каких-либо коммерческих наборов. Анализ изображений может быть выполнен в нескольких различных программах, включая программы с открытым исходным кодом, такие как QuPath и R. Тем не менее, мы считаем, что этот метод может быть даже улучшен в будущем для больших панелей антигенов, что позволит выполнять серийное окрашивание/сканирование одного и того же предметного стекла с разными панелями антигенов и с преимуществом усиления сигнала.
Disclosures
У авторов нет конфликтов интересов, о которых можно было бы заявить.
Acknowledgements
Авторы хотели бы поблагодарить доктора Деруана Ф. за ее помощь и поддержку. Николя Юиг является научным сотрудником, получившим грант Бельгийского национального фонда научных исследований (Télévie/FNRS 7460918F).
Materials
| Name | Company | Catalog Number | Comments |
| anti-CD3 primary antibody | Abcam | ab16669 | rabbit monocolonal |
| anti-CD8 primary antibody | DAKO | M710301 | mouse monoclonal |
| anti-hPanCK primary antibody | DAKO | M3515 | mouse monoclonal |
| anti-PD-1 primary antibody | Cell Signalling | D4W2J | rabbit monocolonal |
| anti-PD-L1 primary antibody | Cell Signalling | 13684 | rabbit monocolonal |
| anti-RORC primary antibody | Sigma | MABF81 | mouse monoclonal |
| ATTO-425 | ATTOtec | ||
| Axioscan Z1 | Zeiss | Light source: Colibri 7 (385, 430, 475, 555, 590, 630, 735 nm) Filtersets: Excitation 379/34 – beam splitter 409 – emission 440/40; Excitation 438/24 – beam splitter 458 – emission 483/32; Excitation 490/20 – beam splitter 505 – emission 525/20; Excitation 546/10 – beam splitter 556 – emission 572/23; Excitation 592/21 – beam splitter 610 – emission 630/30; Excitation 635/18 – beam splitter 652 – emission 680/42; Excitation 735/40 – beam splitter QBS 405 + 493 + 611 + 762 - emission QBP 425/30 + 524/51 + 634/38 + 785/38; Objective: Plan-Apochromat 20x/0.8; Camera : Orca Flash 4.0 V3 | |
| Borosilicate Cover Glass | VWR | 631-0146 | |
| Envision+ anti-mouse | DAKO | K4001 | |
| Envision+ anti-rabbit | DAKO | K4003 | |
| Fluorescence mounting medium | DAKO | S3023 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 750 | ThermoFischer | A-21037 | |
| HALO software | Indicalabs | ||
| Hoescht | Sigma | 14533 | |
| Superfrost plus microscope slides | Fisherscientific/Epredia | 10149870 | |
| Tyramide-AF488 | ThermoFischer | B40953 | |
| Tyramide-AF555 | ThermoFischer | B04955 | |
| Tyramide-AF647 | ThermoFischer | B04958 |
References
- Ge, P., et al. Profiles of immune cell infiltration and immune-related genes in the tumor microenvironment of colorectal cancer. Biomedicine & Pharmacotherapy. 118, 109228 (2019).
- Fridman, W. H. The immune microenvironment as a guide for cancer therapies. Oncoimmunology. 1 (3), 261-262 (2012).
- Fridman, W. H., Pages, F., Sautes-Fridman, C., Galon, J. The immune contexture in human tumours: Impact on clinical outcome. in Nature Reviews. Cancer. 12 (4), 298-306 (2012).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Calu, V., et al. Key biomarkers within the colorectal cancer related inflammatory microenvironment. Scientific Reports. 11 (1), 7940 (2021).
- Havel, J. J., Chowell, D., Chan, T. A. The evolving landscape of biomarkers for checkpoint inhibitor immunotherapy. Nature Reviews. Cancer. 19 (3), 133-150 (2019).
- Pages, F., et al. International validation of the consensus Immunoscore for the classification of colon cancer: a prognostic and accuracy study. Lancet. 391 (10135), 2128-2139 (2018).
- Mlecnik, B., et al. Integrative analyses of colorectal cancer show immunoscore is a stronger predictor of patient survival than microsatellite instability. Immunity. 44 (3), 698-711 (2016).
- Gu, Z., Eils, R., Schlesner, M. Complex heatmaps reveal patterns and correlations in multidimensional genomic data. Bioinformatics. 32 (18), 2847-2849 (2016).
- Baddeley, A., Rubak, E., Turner, R. . Spatial Point Patterns: Methodology and Applications with R. , (2022).
- Barua, S., et al. Spatial interaction of tumor cells and regulatory T cells correlates with survival in non-small cell lung cancer. Lung Cancer. 117, 73-79 (2018).
- Parra, E. R. Methods to determine and analyze the cellular spatial distribution extracted from multiplex immunofluorescence data to understand the tumor microenvironment. Frontiers in Molecular Biosciences. 8, 668340 (2021).
- El Sissy, C., et al. A diagnostic biopsy-adapted immunoscore predicts response to neoadjuvant treatment and selects patients with rectal cancer eligible for a watch-and-wait strategy. Clinical Cancer Research. 26 (19), 5198-5207 (2020).
- Bolognesi, M. M., et al. Multiplex staining by sequential immunostaining and antibody removal on routine tissue sections. The Journal of Histochemistry and Cytochemistry. 65 (8), 431-444 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved