Легкий имплантат привода для хронической записи тетрода у молодых мышей
In This Article
Summary
Здесь мы описываем конструкцию микропривода, процедуру хирургической имплантации и стратегию послеоперационного восстановления, которые позволяют одновременно регистрировать хроническое поле и отдельные единицы из нескольких областей мозга у молодых и подростковых мышей в критическом окне развития с 20-го послеродового дня (p20) до 60-го дня (p60) и далее.
Abstract
Электрофизиология in vivo обеспечивает беспрецедентное понимание динамики цепей субсекундного уровня интактного мозга и представляет собой метод, имеющий особое значение для изучения мышиных моделей нервно-психических расстройств человека. Однако такие методы часто требуют больших черепных имплантатов, которые не могут быть использованы у мышей на ранних этапах развития. Таким образом, практически никаких исследований физиологии in vivo не проводилось на свободно ведущих себя младенцах или молодых мышах, несмотря на то, что лучшее понимание неврологического развития в этом критическом окне, вероятно, даст уникальное представление о возрастных нарушениях развития, таких как аутизм или шизофрения. Здесь описана конструкция микропривода, процедура хирургической имплантации и стратегия послеоперационного восстановления, которые позволяют одновременно регистрировать хроническое поле и отдельные единицы из нескольких областей мозга у мышей по мере их старения с 20-го послеродового дня (p20) до 60-го дня (p60) и далее, временное окно, примерно соответствующее человеческому возрасту от 2 лет до взрослой жизни. Количество регистрирующих электродов и конечных мест записи может быть легко изменено и расширено, что позволяет гибко контролировать экспериментальный мониторинг in vivo областей мозга, связанных с поведением или заболеванием, на протяжении всего развития.
Introduction
Мозг претерпевает масштабные изменения в критические периоды развития в детском и подростковом возрасте 1,2,3. Многие неврологические и психические заболевания, включая аутизм и шизофрению, впервые проявляются поведенчески и биологически в этот период развития мозга у подростков иподростков 4,5,6. Хотя многое известно о клеточных, синаптических и генетических изменениях, которые происходят на ранних этапах развития, сравнительно мало известно о том, как изменяются процессы на уровне цепей или сетей в течение этого временного окна. Важно отметить, что функция мозга на уровне цепи, которая в конечном итоге лежит в основе сложного поведения, памяти и познания, является непредсказуемым, эмерджентным свойством клеточной и синаптической функции 7,8,9,10. Таким образом, чтобы полностью понять функции мозга на сетевом уровне, необходимо непосредственно изучить нейронную активность на уровне интактной нейронной цепи. Кроме того, чтобы определить, как активность мозга изменяется на протяжении всего прогрессирования нервно-психических расстройств, крайне важно изучить сетевую активность в достоверной модели заболевания в течение определенного временного окна, когда проявляются поведенческие фенотипы заболевания, и отслеживать наблюдаемые изменения по мере их сохранения во взрослой жизни.
Одним из наиболее распространенных и мощных научных модельных организмов является мышь с большим количеством уникальных генетических штаммов, которые моделируют нарушения развития нервной системы с возрастным началом поведенческих и/или мнемонических фенотипов 11,12,13,14,15,16,17,18,19,20,21 . Несмотря на то, что сложно соотнести точные моменты развития между мозгом человека и мышей, морфологические и поведенческие сравнения показывают, что мыши p20-p21 представляют человеческий возраст 2-3 года, а мыши p25-p35 представляют человеческий возраст 11-14 лет, при этом мыши, вероятно, достигают эквивалента развития 20-летнего взрослого человека к p603, 22. Таким образом, чтобы лучше понять, как развивается ювенильный мозг, и определить, как нейронные сети мозга становятся дисфункциональными при таких заболеваниях, как аутизм или шизофрения, было бы идеально напрямую контролировать активность мозга in vivo у мышей в возрасте от 20 до 60 дней.
Тем не менее, фундаментальной проблемой в мониторинге активности мозга на ранних этапах развития у мышей является небольшой размер и относительная слабость молодых мышей. Хроническая имплантация электродов, которая необходима для лонгитюдных исследований развития мозга, обычно требует большого, громоздкого корпуса для защиты тонких электродных проводов и интерфейсных плат23,24, а имплантаты должны быть прочно прикреплены к черепу мыши, который тоньше и менее жесткий у молодых мышей из-за уменьшения окостенения. Таким образом, практически все исследования физиологии грызунов in vivo были проведены на взрослых людях из-за их относительного размера, прочности и толщины черепа. На сегодняшний день большинство исследований, изучающих физиологию мозга ювенильных грызунов in vivo, были проведены на крысах дикого типа, что обязательно ограничивает возможность экспериментального мониторинга функции мозга ювенильных особей в свободно ведущей модели расстройства человека 25,26,27,28,29,30.
В этой рукописи описывается новый корпус имплантата, процедура хирургической имплантации и стратегия послеоперационного восстановления для хронического изучения долгосрочной (до 4 и более недель) функции мозга in vivo молодых мышей в течение критического для развития временного окна (от p20 до p60 и далее). Процедура имплантации обеспечивает надежное, постоянное прикрепление электродов к черепам молодых мышей. Кроме того, конструкция микропривода легкая, так как этот микропривод весит ~ 4-6 г в полностью собранном виде, и из-за минимального уравновешивания, необходимого для компенсации веса имплантата, он не влияет на поведенческие характеристики молодых мышей во время типичных поведенческих парадигм.
Protocol
Настоящее исследование было одобрено Комитетом по уходу за животными и их использованию Юго-западного медицинского центра Техасского университета (протокол 2015-100867) и выполнено в соответствии с рекомендациями как учреждения, так и Национального института здравоохранения. Самцы и самки мышей C57/Bl6, использованные в настоящем исследовании, были имплантированы в p20 (вес 8,3-11,1 г на момент имплантации).
1. Проектирование и конструкция микропривода
- Цифровое проектирование и печать микропривода (рис. 1)
- Загрузите шаблоны моделей микродисков (https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive).
- Определите стереотаксические местоположения целевых областей мозга в соответствующем стереотаксическом атласе.
- Используя программное обеспечение для трехмерного автоматизированного проектирования (3D CAD), загрузите шаблон канюли микропривода (рис. 1B).
- При необходимости измените места выхода выходной канюли на модели канюли с микроприводом, чтобы нацелиться на нужные области мозга.
ПРИМЕЧАНИЕ: Каждая экструзия отверстия канюли должна быть не менее 2 мм в длину, чтобы гарантировать, что тетрод выйдет из отверстия канюли, направленного прямо на цель. Шаблон канюли с микроприводом предназначен для двустороннего воздействия на переднюю поясную кору (один тетрод на полушарие), область гиппокампа CA1 (четыре тетрода на полушарие) и область гиппокампа CA3 (два тетрода на полушарие), при этом один эталонный тетрод на полушарие расположен в белом веществе над областью гиппокампа CA1. - При необходимости модифицируйте корпус микропривода (рис. 1A) для размещения крепления платы электронного интерфейса (EIB).
- Распечатайте корпус микронакопителя, канюлю, конус и крышку с высоким разрешением на 3D-принтере (в идеале с разрешением лучше 25 мкм) и подготовьте печатные материалы в соответствии с протоколами производителя. Используйте смолы для принтеров с высокой жесткостью.
- Сборка нестандартных винтов и креплений (рис. 2A, B)
- Используя программное обеспечение 3D CAD, загрузите модели винтовых креплений (рис. 1E).
- Распечатайте винтовые насадки с высоким разрешением на 3D-принтере (в идеале с разрешением не менее 25 мкм) и подготовьте печатные материалы в соответствии с протоколами производителя. Используйте смолы для принтеров с высокой жесткостью.
- Прикрепите винтовые крепления к каждому винту с продвижением тетрода (рис. 1F) (винты, продвигающие тетрод, изготавливаются по индивидуальному заказу в механическом цехе перед изготовлением микропривода).
- Прикрепите к каждому винту по два винтовых крепления, одно над коньком, а другое под гребнем. Убедитесь, что нижняя часть каждого винтового крепления соприкасается с гребнем. Скрепите винтовые насадки гелем цианоакрилатом.
- После крепления убедитесь, что винтовые крепления не перемещаются по продольной оси винта, а свободно вращаются с минимальным сопротивлением.
- Сборка корпуса микропривода (рис. 2C, D)
- Тонкими, острыми ножницами разрежьте большие полиимидные трубки (наружный диаметр: 0,2921 мм, внутренний диаметр: 0,1803 мм) на секции длиной ~6 см.
- Пропустите большие полиимидные секции через выходные отверстия на канюле микропривода так, чтобы каждая трубка выходила за нижнюю часть канюли на несколько миллиметров.
- Используя чистую иглу 30 г, прикрепите полиимид к канюле, нанеся небольшое количество жидкого цианоакрилата. Следите за тем, чтобы цианоакрилат не попал внутрь полиимидной трубки.
ПРИМЕЧАНИЕ: Капание жидкого цианоакрилата в канюлю через верхнюю часть корпуса привода может ускорить этот процесс, но позже потребует повторной очистки направляющих отверстий с помощью сверла с тонким наконечником. - Пропустите большие полиимидные трубки из верхней части канюли микропривода через соответствующие большие полиимидные отверстия в корпусе микропривода.
- Медленно сдвиньте канюлю микропривода и корпус микропривода вместе, пока они не окажутся рядом и выступы крепления канюли/корпуса не сблокируются. Будьте осторожны, чтобы не перегнуть и не повредить полиимидные трубки в процессе.
ПРИМЕЧАНИЕ: Каждая полиимидная трубка должна плавно проходить от нижней части канюли через верхнюю часть корпуса микропривода. Небольшой изгиб является нормальным, но чрезмерный изгиб полиимидной трубки может деформировать тетрод и помешать его прохождению прямо в мозг. - Соедините корпус микропривода и канюлю микропривода вместе с помощью цианоакрилата.
- Используя новое острое лезвие бритвы, отрежьте большие концы полиимидных трубок, которые выдавливаются из нижней части выходных отверстий канюли. Убедитесь, что разрез находится точно у основания канюли, чтобы трубки и дно канюли были на одном уровне друг с другом.
- Острыми ножницами разрежьте большую полиимидную трубку чуть выше края внутреннего обода корпуса привода под углом ~45°.
- Загрузка собранных нестандартных винтов (рис. 2E)
- Вкрутите каждый собранный нестандартный винт во внешние отверстия корпуса микропривода. Убедитесь, что направляющая стойка винта проходит через большое отверстие в винтовых креплениях. Продвигайте каждый винт полностью, пока он не перестанет продвигаться дальше. Рекомендуется предварительно смазывать винты минеральным маслом или консистентной смазкой для осей.
- Используя очень острые ножницы, разрежьте небольшие полиимидные трубки (внешний диаметр: 0,1397 мм, внутренний диаметр: 0,1016) на секции длиной ~ 4 см.
- Пропустите небольшие полиимидные секции через большие полиимидные трубки, уже установленные в микроприводе. Убедитесь, что излишки небольших полиимидных трубок выступают сверху и снизу каждой большой полиимидной трубки.
- Прикрепите маленькие полиимидные трубки к винтовым насадкам с помощью цианоакрилата, стараясь не допускать попадания цианоакрилата ни в большие, ни в маленькие полиимидные трубки.
- Используя новое острое лезвие бритвы, отрежьте маленькие концы полиимидных трубок, которые выдавливаются из нижней части отверстий канюли. Убедитесь, что разрез находится точно у основания канюли и что разрез чистый, и ничто не блокирует отверстие полиимидной трубки.
- Острыми ножницами отрежьте верхнюю часть маленького полиимида на несколько миллиметров выше верхней части винтового крепления под углом ~45°. Убедитесь, что разрез чистый, ничто не блокирует отверстие полиимидной трубки.
- Загрузка тетродов
- Подготовьте тетроды (~6 см в длину), используя ранее описанные способы31.
- Используя щипцы с керамическими или резиновыми наконечниками, осторожно пропустите тетрод через одну из маленьких полиимидных трубок, оставив ~ 2 см выступающим из верхней части маленькой полиимидной трубки.
- Прикрепите тетрод к верхней части небольшой полиимидной трубки с помощью жидкого цианоакрилата, стараясь не соединять маленькие и большие полиимидные трубки вместе в процессе.
- Втяните винт до тех пор, пока он не окажется в верхней части диска.
- Возьмитесь за тетродную проволоку, выступающую из нижней части привода, и осторожно перегибайте ее в том месте, где она выходит из канюли.
- Полностью вставьте винт обратно в диск.
- Используя очень острые ножницы, отрежьте тетродную проволоку чуть выше излома. Под микроскопом убедитесь, что срез чистый и что металл всех четырех тетродов обнажен.
- Втяните винт до тех пор, пока тетрод не закрепится внутри канюли.
- Повторите шаги 1.5.2-1.5.8 для всех винтов.
- Прикрепите EIB к опорной платформе EIB с помощью небольших ювелирных винтов.
- Подключите каждый электрод каждого тетрода к соответствующему порту на EIB.
- Подготовка микронакопителя к операции
- Электрически пластинчатые тетроды для уменьшения электрического импеданса используют ранее описанные способы31.
- После нанесения покрытия убедитесь, что каждый тетрод размещен в канюле таким образом, чтобы кончик тетрода находился на одном уровне с дном каждого отверстия канюли.
- Сдвиньте конус микропривода вокруг готового микропривода. Прикрепите крышку микропривода к конусу микропривода, вставив полюс крепления конуса в порт крышки.
- Сориентируйте конус так, чтобы разъемы EIB свободно проходили через сквозные отверстия соединения EIB, когда крышка закрыта, и приклейте конус на место цианоакрилатом, расположенным вокруг основания конуса, следя за тем, чтобы цианоакрилат не попал ни в одно из выходных отверстий канюли. Снимите крышку.
- Тщательно заполните каждое отверстие канюли стерильным минеральным маслом, чтобы предотвратить попадание биологических жидкостей в полиимидные отверстия после хирургической имплантации.
- Тщательно смажьте основание канюли стерильным вазелином. Это послужит барьером для предотвращения попадания химических агентов (например, стоматологического цемента) в открытый мозг во время операции.
- Взвесьте полностью собранный микропривод, крышку и четыре костяных винта, чтобы получить равновесный противовес.
- При желании, перед операцией, выдавите тетроды на расстоянии, подходящем для достижения целевых областей мозга, как только диск окажется на одном уровне с черепом.
ПРИМЕЧАНИЕ: Перед хирургической имплантацией стерилизуйте имплантат с помощью газовой стерилизации в оксиде этилена (500-1200 мг / л, 2-4 часа). Все костные винты и хирургические инструменты должны быть стерилизованы в автоклаве (121 ° C, 30 минут).
2. Хирургическая имплантация
- Обезболивание мыши и установка ее в стереотаксический аппарат
- Поместите мышь в небольшую коробку с достаточным пространством для перемещения и обезболите мышь 3-4% изофлураном.
ПРИМЕЧАНИЕ: Можно использовать другие анестетики, но следует соблюдать осторожность из-за возраста, размера и веса молодого мыши. - Как только мышь перестает реагировать (нет реакции на защемление хвоста, скорость вентиляции ~ 60 вдохов в минуту), выньте ее из коробки и быстро установите на стереотаксический аппарат.
- Быстро наденьте стереотаксическую маску на морду мыши и поддерживайте анестезию на уровне 1-3% изофлурана. Нанесите любое одобренное ветеринарами обезболивающее, такое как бупренорфин с замедленным высвобождением (0,05-0,5 мг / кг подкожно) или противовоспалительные средства, такие как карпрофен (5-10 мг / кг подкожно), до первоначального хирургического разреза.
- Полностью закрепите голову мыши в стереотаксическом аппарате с помощью амбушюр. Убедитесь, что череп ровный и неподвижный, не оказывая ненужного давления на ушные каналы мыши. Из-за ограниченного окостенения ювенильных костей черепа возможно необратимое повреждение во время фиксации головы.
- Поместите мышь в небольшую коробку с достаточным пространством для перемещения и обезболите мышь 3-4% изофлураном.
- Подготовка мыши к операции и обнажение черепа
- Защитите глаза мыши, нанеся небольшой объем синтетического слезного геля на каждый глаз и покрыв каждый глаз автоклавным пластырем фольги.
ПРИМЕЧАНИЕ: Синтетические слезы сохранят глаза влажными, в то время как фольга предотвратит долгосрочное повреждение любого источника света. Предпочтительны более густые синтетические слезные растворы, поскольку они также могут служить барьером для непреднамеренного введения других потенциально токсичных хирургических растворов (этанола, стоматологического акрила и т. д.) в глаза. - Используя стерильные ватные тампоны, нанесите крем для удаления волос на операционную область, чтобы удалить волосы с кожи головы. Будьте осторожны, чтобы крем не попал в глаза. После удаления волос наденьте стерильную драпировку на кожу головы, чтобы закрепить операционную область.
- Используя стерильные тампоны с ватными наконечниками, очистите кожу головы тремя последовательными промывками раствором повидон-йода (10%), а затем изопропиловым спиртом (100%).
- С помощью стерильного скальпеля или тонких ножниц удалите кожу головы.
- Используя стерильные ватные тампоны и стерильные растворы физиологического раствора (0,9% NaCl) и перекиси водорода, тщательно очистите череп.
- Определите брегму и, используя стереотаксический аппарат, тщательно отметьте перманентным маркером целевые места записи на черепе.
- Защитите глаза мыши, нанеся небольшой объем синтетического слезного геля на каждый глаз и покрыв каждый глаз автоклавным пластырем фольги.
- Открытие отверстия канюли и прикрепление костных якорей
- Удалите череп, накладывая места записи. # Из-за тонкости черепа в этом возрасте разрезают череп лезвием скальпеля; Это устраняет необходимость использования дрели, которая может повредить нижележащую твердую мозговую оболочку. Держите открытую твердую мозговую оболочку влажной с помощью стерильного физиологического раствора (0,9% NaCl) или стерильного минерального масла. Не удаляйте и не прокалывайте твердую мозговую оболочку на этом этапе, так как у молодых мышей она достаточно тонкая, чтобы тетроды могли пройти через нее на будущих этапах.
- Тщательно просверлите пилотные отверстия для четырех костяных шурупов.
- Поместите костные винты в крайние боковые и ростральные или каудальные части черепа, где кость самая толстая, а костные винты находятся достаточно далеко от имплантата микропривода. Для костных винтов используйте стерильные ювелирные винты (например, резьба UNM 120, головка 1.5 мм).
- Плотно намотайте один костный винт тонким проводом с высокой проводимостью, который будет служить заземлением и будет прикреплен к EIB на шаге 2.4.6.
- С помощью лезвия скальпеля или осторожно с помощью сверла забейте череп рядом с местами отверстий для костяных винтов. Скоринг важен для обеспечения достаточно шероховатой поверхности для связывания жидкого цианоакрилата на этапе 2.3.5.
- Используя стерильную отвертку и стерильный винтовой зажим, вставьте каждый стерильный костный винт на место, стараясь не проткнуть нижележащую твердую мозговую оболочку.
- Используя стерильную иглу весом 30 г, поместите жидкий цианоакрилат вокруг каждого костного винта. Это эффективно утолщает череп, к которому прикреплены костные винты. Следите за тем, чтобы цианоакрилат не попадал в открытую твердую мозговую оболочку над местами записи.
- Опускание и крепление микропривода (рис. 2G)
- Установите готовый микропривод на стереотаксический аппарат, который будет осторожно опущен на череп мыши. Убедитесь, что канюля микропривода будет находиться в соответствующих координатах при опускании.
- Опускайте микропривод медленно, двигаясь только в дорсальном/вентральном направлении. Опустите микропривод с тетродами, уже выдвинутыми из отверстий канюли (шаг 1.6.6), чтобы визуализировать их вход в мозг; Любое медиальное/латеральное или ростральное/каудальное движение, когда тетроды касаются мыши, может согнуть тетроды и привести к тому, что они пропустят свой конечный пункт назначения.
- После того, как микропривод полностью опущен, убедитесь, что основание канюли соприкасается с черепом/твердой мозговой оболочкой. Слой вазелина и/или минерального масла будет служить барьером для покрытия открытой твердой мозговой оболочки. При необходимости добавьте стерильный вазелин или стерильный костный воск, чтобы покрыть излишки обнаженной твердой мозговой оболочки.
- Удерживая микропривод на месте с помощью стереотаксического аппарата, покройте череп зубным цементом, чтобы прикрепить основание микропривода к имплантированным костным винтам.
ПРИМЕЧАНИЕ: Стоматологический цемент должен полностью покрывать все костные винты и должен закрывать выступ анкерного зубного цемента на канюле микропривода. - Пока зубной цемент схватывается, тщательно придайте ему форму, чтобы предотвратить острые углы или края, которые могут повредить мышь или повредить микродиск. Убедитесь, что стоматологического цемента достаточно для удержания микропривода, но исключите излишний стоматологический цемент, который добавит ненужный вес.
- Осторожно проденьте заземляющий провод через микропривод и прикрепите его к соответствующему слоту на EIB.
- Как только зубной цемент полностью застынет, осторожно отсоедините микропривод от стереотаксического аппарата. Установите крышку на микропривод.
- Стерильным ватным тампоном и стерильным физиологическим раствором очистите мышь.
- Стерильным ватным тампоном нанесите тонкий слой мази с антибиотиком на любую открытую кожу головы рядом с местом имплантации.
- Снимите фольгу с глаз мыши.
- Извлеките мышь из стереотаксического аппарата, позаботившись о том, чтобы выдержать дополнительный вес микропривода, когда мышь транспортируется в чистую клетку.
3. Послеоперационное восстановление
- Немедленное выздоровление
- Перед операцией подготовьте систему противовеса, подключив трубу из ПВХ диаметром 0,75, как показано на рисунке 2G. Один рычаг системы проходит через отверстия, просверленные в крышке клетки, второй рычаг опирается на верхнюю часть крышки клетки, а третий рычаг выходит над клеткой и за ее пределы. Крайняя верхняя рука закрыта.
- Аккуратно прикрепите микропривод к системе противовесов (рис. 2G-I) и используйте противовес, идентичный весу микропривода и костных винтов. Проведите прочную нить или леску от разъема, прикрепленного к EIB, через три рычага системы противовеса к грузу противовеса, который висит над самым верхним рычагом.
- Убедитесь, что противовес надежно подключен к EIB микропривода и что имеется достаточная линия, чтобы дать мыши полный доступ ко всей клетке.
- Добавьте богатый питательными веществами гель в клетку вместе с увлажненным нормальным кормом для грызунов, чтобы обеспечить регидратацию и восстановление.
- Следите за мышью до тех пор, пока она полностью не оправится от хирургической анестезии.
- Долгосрочное восстановление
- В любое время, когда микропривод не подключен к записывающему оборудованию, убедитесь, что микропривод поддерживается системой противовеса. Со временем уменьшайте противовес, но никогда не снимайте его полностью, чтобы избежать непредвиденной нагрузки на мышь или крутящего момента на костяные винты.
- Чтобы предотвратить повреждение имплантата и системы противовеса, разместите мышь без возможности прямого взаимодействия с другими мышами на время эксперимента.
- Обеспечьте богатый питательными веществами гель в течение как минимум 3 дней после операции, после чего будет достаточно одной твердой пищи.
- Из-за требований к накладным расходам системы противовесов не подавайте еду и воду в воздушную проволочную сетку; Положите еду на пол клетки и подайте воду через стенку клетки. Чтобы предотвратить порчу, полностью заменяйте продукты ежедневно.
- Ежедневно следите за тем, чтобы мышь имела свободный доступ ко всей клетке, а противовес надежно и прочно прикреплен к микродиску.
Representative Results
Описанный выше протокол был использован для одновременной регистрации сигналов локального потенциала поля и отдельных единиц из нескольких областей мозга у мышей, при этом ежедневные записи проводились у одних и тех же мышей от p20 до p60. Здесь представлены репрезентативные электрофизиологические записи двух мышей и гистология после эксперимента, демонстрирующая окончательные места записи.
Хирургическая имплантация микропривода мышам p20
Микропривод (рис. 1) был сконструирован (рис. 2) и хирургически имплантирован в мышь p20, как описано выше. Сразу после операции мышь была прикреплена к системе противовеса (рис. 2G-I) и ей позволили восстановиться. Как только мышь стала полностью мобильной, микропривод был подключен к системе электрофизиологической записи in vivo. Кабели, соединяющие микропривод с записывающей аппаратурой, были подвешены над мышью. Электрофизиологические записи (32 кГц) были получены по всем каналам в течение 1 часа, в то время как мышь вела себя естественно в своей домашней клетке. После записи мышь была отключена от системы записи, снова подключена к системе противовеса и возвращена в виварий со свободным доступом к воде и корму.
Ежедневная запись нейронной активности
Электрофизиологические записи были получены ежедневно в течение нескольких недель, чтобы обеспечить хронический мониторинг одной и той же области мозга в критических окнах развития p20-p60. Необработанные потенциалы локального поля образца (LFP) из хронических записей показаны на рисунке 3A,C. Изолированные единичные блоки были одновременно получены из нескольких тетродов (рис. 3B). Блоки с похожими формами сигналов были идентифицированы в течение нескольких дней (рис. 3B, посередине и справа), но из-за потенциального дрейфа записывающего электрода было невозможно окончательно утверждать, что один и тот же блок был идентифицирован в течение нескольких дней. У отдельной мыши, имплантированной в p20 и регистрируемой ежедневно в течение нескольких недель, нейронная активность была исследована на тетроде, нацеленном на дорсальную область CA1. Пульсация большой амплитуды и хорошо изолированные единичные единицы были идентифицированы в каждый день регистрации (рис. 4). Эти данные указывают на то, что стабильные, высококачественные электрофизиологические записи in vivo могут быть получены от одной и той же мыши на ранних этапах развития.
Гистологическое подтверждение мест регистрации и влияния хронической имплантации на развитие
После последнего дня записи мышь была тщательно анестезирована с помощью изофлурановой анестезии с последующей смертельной инъекцией пентобарбитала натрия, и ток был пропущен через наконечники электродов для создания небольших повреждений в местах записи. Гистологическое разрезание мозга мыши после эксперимента позволило визуализировать конечные места записи (рис. 5A, B). В отдельной когорте три самца и три самки мышей были хирургически имплантированы на p20, как описано выше. Равное количество однопометников оставалось неимплантированным и содержалось в одинаковых условиях содержания. Мыши были принесены в жертву на p62 (через 6 недель после операции для имплантированной когорты). Черепа были тщательно очищены, и были проведены внешние измерения расстояния от брегмы до лямбды (рис. 5C, вверху слева) и внешней максимальной ширины черепа на лямбде (рис. 5C, вверху справа). Разрез был сделан вдоль средней линии черепа, и половина черепа была удалена, чтобы иссечь мозг для измерения массы (рис. 5C, внизу справа). Высота полости черепа при брегме измерялась по неповрежденной половине черепа (рис. 5C, внизу слева). Ни один показатель существенно не различался между имплантированными и неимплантированными когортами (тест Уилкоксона), что указывает на то, что долгосрочная имплантация, начиная с p20, не оказывает серьезного влияния на естественное развитие черепа или объем мозга.

Рисунок 1: Компоненты микропривода. Трехмерная визуализация (A) корпуса микропривода, (B) канюли, (C) конуса, (D) крышки, (E) винтовых креплений и (F) винта, продвигающего тетрод. Указаны критические особенности каждого компонента. Детали измерений могут быть извлечены из файлов моделей, доступных по адресу https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive/. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Конструкция микропривода . (A) Вид сбоку и (B) вид сверху винта, продвигающего тетрод, с соединенными верхним и нижним винтовыми креплениями. (C) Вид сбоку и (D) вид сверху на микропривод с прикрепленным корпусом и канюлей и большой полиимидной трубкой, проходящей через каждое отверстие канюли и обрезанной до дна канюли. (E) Вид сбоку на микропривод с винтами и небольшими полиимидными трубками на месте. Верхушки небольших полиимидных трубок обрезаются непосредственно перед загрузкой тетрода. (F) Завершенный микропривод, прикрепленный к стереотаксическому аппарату. Защитный конус, который обычно окружает микродиск, был удален в целях визуализации. Обратите внимание, что некоторые винтовые крепления были напечатаны черной смолой для этого микронакопителя. g) система поддержки противовесов. (З) Вид сбоку и (I) сверху клетки для мыши с прикрепленной системой поддержки противовеса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
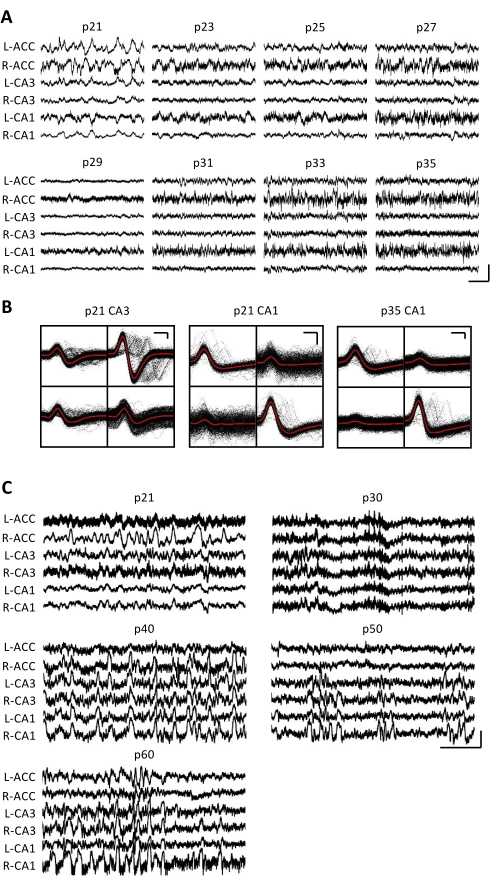
Рисунок 3: Репрезентативные электрофизиологические записи. Мышь p20 была имплантирована с микроприводом, как описано выше. Начиная с p21 и каждый день после этого в течение 2 недель, мышь прикрепляли к записывающему аппарату, и нейронная активность регистрировалась в течение не менее 1 часа. (A) Необработанные записи потенциала локального поля (LFP) с двустороннего (L = слева; R = справа) передняя поясная кора (ACC), область гиппокампа CA3 (CA3) и область гиппокампа CA1 (CA1). Данные собирались каждый день; Для наглядности отображаются только данные за нечетные дни. Все следы были взяты в периоды неподвижности в домашней клетке. Масштабная линейка: 1 мВ, 2 с. (B) Репрезентативные одиночные блоки, выделенные из области гиппокампа CA3 (слева) и CA1 (справа) для записей на панели A. Все необработанные сигналы на каждом электроде показаны черным цветом; Среднее значение выделено красным цветом. Масштабная линейка: 50 мкВ, 0,2 мс. (C) Репрезентативные необработанные следы LFP для каждого 10-го дня до последнего дня записи при p60 для второй мыши, имплантированной в p20. Данные собирались каждый день; Для наглядности отображаются только данные за каждый 10-й день. Все следы были взяты в периоды неподвижности в домашней клетке. Масштабная линейка: 1 мВ, 2 с. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
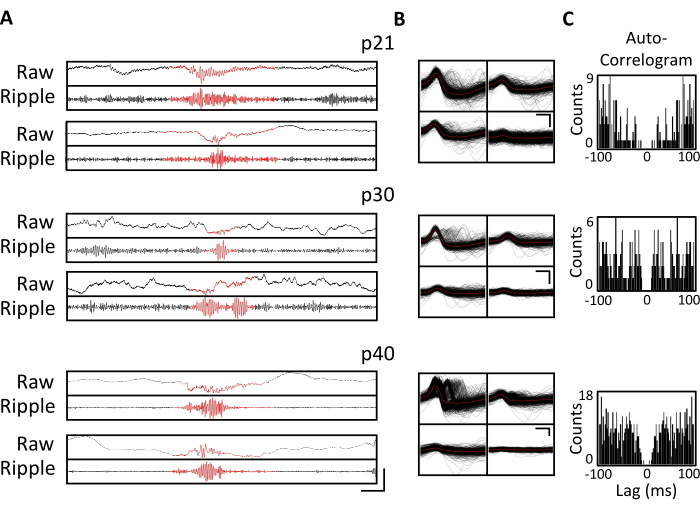
Рисунок 4. Стабильность хронических записей. Мышь p20 была имплантирована с микроприводом, как описано выше. Начиная с p21 и далее в течение 4 недель, мышь прикрепляли к записывающему аппарату, и нейронная активность регистрировалась в течение не менее 1 часа. Показаны данные тетродов, нацеленных на дорсальный гиппокамп CA1. (A) Необработанный (вверху) и отфильтрованный пульсациями (внизу) LFP для идентифицированных событий пульсации на p21, p30 и p40. Для идентификации событий пульсаций необработанный LFP был отфильтрован полосой в диапазоне от 125 Гц до 300 Гц, а события пульсации были идентифицированы как переходное увеличение мощности полосы пульсаций более чем на 3 стандартных отклонения выше среднего. Начало и конец каждой пульсации были определены как точка, когда мощность полосы пульсаций вернулась к среднему значению. Идентифицированная рябь показана красным цветом. Линейка масштабирования: 100 мс, сверху вниз: 1 000 мкВ, 140 мкВ, 1 800 мкВ, 180 мкВ, 9 000 мкВ, 1 200 мкВ, 10 000 мкВ, 1 000 мкВ. (B) Репрезентативная единица каждый день из целевого тетрода CA1 для записей на панели A. Все необработанные сигналы на каждом электроде показаны черным цветом; Среднее значение выделено красным цветом. Масштабная линейка 0,2 мс, сверху вниз: 50 мкВ, 100 мкВ, 100 мкВ. (C) Автокоррелограмма всех шипов для отдельных блоков на панели B. Эти данные демонстрируют стабильное размещение электродов в пирамидном слое гиппокампа в течение нескольких недель. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Репрезентативная гистология и влияние на развитие черепа. Мышь p20 была имплантирована с микроприводом, как описано выше. После последнего дня записи на p60 в местах записи образовались электролитические поражения, и мозг был перфузирован 4% параформальдегидом. Для идентификации мест регистрации были изготовлены срезы размером 50 мкм. (A) Поражения CA1 и CA3 гиппокампа. Наконечник стрелки обозначает место записи CA3; двойной наконечник стрелки обозначает место записи CA1. Масштабная линейка: 0,5 мм. (B) Поражения в двусторонней АСС. Наконечники стрелок обозначают места записи ACC. Масштабная линейка: 0,5 мм. (C) Размеры черепа и измерения массы мозга мышей p62, имплантированных с помощью микропривода на p20 (серый), и неимплантированных однопометников (белый). p-значение критерия ранговой суммы Уилкоксона сообщается для каждого измерения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Discussion
Современные эксперименты, изучающие функцию нейронных цепей in vivo у грызунов, часто используют внеклеточную электрофизиологию с помощью постоянно имплантированных электродов для мониторинга активности отдельных нейронов (т. е. отдельных единиц) или локальных популяций (через локальные полевые потенциалы, LFP), но такие методы редко применяются к молодым мышам из-за технических проблем. В этой рукописи описывается метод получения in vivo электрофизиологических записей у мышей в критических для развития окнах от p20 до p60 и далее. Эта методология включает в себя производственный процесс для печати и изготовления имплантата с микроприводом, процедуру хирургической имплантации и стратегию послеоперационного восстановления, все из которых специально разработаны для использования на молодых мышах. Несколько соображений оказали влияние на разработку этого протокола, в том числе небольшой размер и относительная слабость молодых мышей по сравнению с их взрослыми собратьями, а также уменьшенное окостенение черепа ювенильной мыши, к которому необходимо было прикрепить микропривод.
Двумя основными методами, обычно используемыми для электрофизиологии in vivo , являются массивы электродов (например, тетроды) и кремниевые зонды. Кремниевые зонды имеют малый вес, могут обеспечить большое количество мест записи на единицу веса и ранее использовались у молодых крыс25. Тем не менее, кремниевые зонды относительно дороги за единицу. Напротив, микропривод, описанный в этой рукописи, может быть изготовлен с использованием сырья стоимостью менее 50 долларов США, что делает его экономически эффективным вариантом для записи in vivo . Кроме того, кремниевые зонды часто должны быть имплантированы в фиксированные линии, что запрещает регистрацию пространственно разнообразных областей мозга. В отличие от этого, конструкция микропривода, описанная в этой рукописи, использует независимо регулируемые тетроды для одновременной записи в 16 различных местах практически без ограничений пространственных отношений между этими местами. Эта конструкция микропривода может быть легко изменена, чтобы обеспечить нацеливание на места, отличные от описанных здесь, путем перемещения отверстий канюли в любое желаемое переднее/заднее и медиальное/дистальное расположение. При нацеливании на альтернативные области мозга важно отметить, что, хотя тетроды часто движутся прямо, эти тонкие провода могут слегка отклоняться, когда они выходят из канюли микропривода. Таким образом, чем меньше или вентральнее область мозга, тем сложнее будет успешно нацелиться на область с помощью тетродов.
Имплантат микропривода, описанный в данной рукописи, принципиально аналогичен нескольким предыдущим конструкциям микроприводов на основе тетродов 23,32,33,34,35 в том, что отдельные тетроды прикреплены к винтам, что позволяет точно контролировать глубину записи каждого тетрода. Несмотря на то, что некоторые особенности современной конструкции микропривода уникальны, в том числе простота нацеливания на пространственно распределенные области мозга, основной новизной данной рукописи является описание стратегий хирургической имплантации и послеоперационного восстановления, которые позволяют проводить хронические исследования сетевой активности у все еще развивающихся молодых мышей. Действительно, описанные здесь методы хирургии и восстановления могут быть адаптированы для поддержки других имплантатов у молодых мышей.
Чтобы поддерживать последовательную запись в течение нескольких дней, провода или зонды должны быть жестко прикреплены к черепу. В то время как общая структура черепа мыши претерпевает лишь незначительные изменения после p20, череп значительно утолщается между p20 и p4536. Действительно, череп на p20 недостаточно жесткий, чтобы поддерживать прикрепленный имплантат без повреждения. Чтобы преодолеть это биологическое ограничение, этот протокол искусственно утолщает череп с помощью цианоакрилата во время операции по имплантации. Имплантация мышам моложе p20, вероятно, возможна с использованием этой стратегии, но череп мыши претерпевает значительные изменения в размерах и форме примерно до p2036. Таким образом, имплантация в течение длительных периодов времени у мышей моложе p20 не рекомендуется, поскольку цианоакрилат и фиксированные костные винты в все еще развивающемся черепе могут значительно повлиять на естественный рост черепа и развитие основной ткани мозга. Важно отметить, что в этом исследовании не наблюдалось никакого влияния на общие размеры черепа или размера мозга после хронической имплантации, начиная с p20 (рис. 5C).
Важнейшим шагом в методе, описанном в этой рукописи, является стратегия послеоперационного восстановления; Согласно этой стратегии, вес имплантата должен постоянно уравновешиваться по мере взросления мыши и развития мышечной и опорно-двигательной системы. В начале после имплантации мыши не могут успешно переносить вес имплантата без противовеса, что приводит к недоеданию и обезвоживанию, поскольку мышь не может адекватно добраться до источников пищи и воды в своей клетке. Система противовеса проста и недорога в строительстве, тривиальна в реализации и позволяет мышам любого имплантируемого возраста свободно исследовать всю свою домашнюю клетку, тем самым обеспечивая адекватное питание и гидратацию. По мере старения мышей количество противовеса может быть уменьшено до тех пор, пока оно не будет полностью удалено у взрослых мышей; Тем не менее, рекомендуется продолжать использовать систему противовесов на протяжении всего эксперимента, по крайней мере, с номинальным противовесом, прикрепленным в любое время. В то время как взрослая мышь может быть в состоянии выдержать размер и вес микропривода с течением времени, непрерывное естественное движение во время свободного поведения без улучшающего противовеса создает крутящий момент и силу сдвига на костных винтах, которые закрепляют микродиск на черепе, что делает его все более вероятным, особенно во время более длительных хронических экспериментов.
В настоящем исследовании следует отметить два важных ограничения. Во-первых, чтобы оценить влияние имплантации в p20 на развитие черепа и мозга, несколько когорт мышей были принесены в жертву после длительной имплантации (рис. 5C). Хотя эти анализы не выявили существенного влияния имплантации на размер полости черепа или массу мозга (рис. 5C), в текущем исследовании не изучался размер черепа или масса мозга в несколько временных точек на протяжении раннего периода развития p20-p60. В то время как предыдущая работа показывает, что развитие полости мозга завершается к p2036, возможно, что имплантация в это раннее окно может привести к непредвиденным изменениям, которые корректируются или компенсируются взрослым возрастом, который был оценен здесь. Во-вторых, эксперименты, в результате которых были получены электрофизиологические данные, показанные на рисунках 3 и 4 , не были направлены на максимизацию выхода клеток. Таким образом, хотя представленные здесь данные демонстрируют стабильные, хронические записи и хорошо изолированные единичные единицы, их не следует воспринимать как репрезентативные для максимального потенциального выхода для этого устройства.
Многие неврологические и психические расстройства человека проявляются в периоды раннего развития или в подростковом возрасте, включая аутизм и шизофрению. Тем не менее, мало что известно о дисфункции на уровне цепи, которая может лежать в основе этих заболеваний, несмотря на множество доступных моделей мышей. Идентификация этих первоначальных изменений сети имеет решающее значение для создания стратегий раннего выявления и парадигм лечения. Тем не менее, из-за технических проблем остается неясным, как сетевая функция нарушается при разработке в мышиных моделях нервно-психических заболеваний. Описанная здесь стратегия микродрайва и восстановления предназначена для поддержки исследований развития мультирегиональной мозговой сети в мозге мыши и, таким образом, позволяет исследователям измерять здоровое развитие мозга, а также выявлять изменения в этом развитии в мышиных моделях заболеваний.
Disclosures
Авторам раскрывать нечего.
Acknowledgements
Эта работа была поддержана Национальными институтами здравоохранения R01 NS104829 (B.E.P.), R01 MH117149 (L.J.V.) и F99NS12053 (L.D.Q.), а также премией UT Southwestern GSO Endowment Award (R.J.P. и L.D.Q.). Авторы благодарят Дженни Скарию (Jenny Scaria) (Фармацевтический центр Центра медицинских наук Техасского технологического университета) за техническую помощь и доктора Брендона Уотсона (Мичиганский университет) за методологические предложения.
Materials
| Name | Company | Catalog Number | Comments |
| 10 V video tracking LEDs | Neuralynx | HS-LED-Red/Green-omni-10V | For use with headstage pre-amplifiers that contain LED sockets for movement tracking purposes |
| 16TT EIB Board | Neuralynx | EIB-36-16TT | Electronic interface board- omnetics connector |
| 16TT headstage pre-amplifier | Neuralynx | HS-36-LED | Omnetics 44 socket signal amplifier between EIB board and tether cable for recording applications; includes connectors for headstage LEDs for movement tracking purposes |
| Baby-Mixter hemostat | FST | 13013-14 | Fine curved hemostat |
| Bone anchor screw | Stoelting | 51457 | Used to attach EIB board to main drive body |
| Burpenorphine | ZooPharm | Lot #BERLAB0.5-221207 | Burpenorphine (0.5 mg/mL) 5mL quantity |
| Cable tether | Neuralynx | HS-36 Litz Tether | Lightweight shielded wire tether for omnetics headstages; length options of 1 m/2 m/3 m/5 m |
| Carprofen/Rimadyl | Bio-Serve | MD150-2 | Post-operative anti-inflammatory agent |
| Clear resin v4 | Formlabs | FLGPGR04 | Liquid resin that is photopolymerized by 3D printer during the 3D printing process |
| Custom (shuttle) screw | Advanced Machining and Tooling, Inc. | Custom | Machined and threaded custom screws |
| Dental acrylic liquid component | Teets denture material | Lot# 329801 | liquid component of denture material (see above) |
| Dental acrylic powder component | Teets denture material | Lot# 583987 | "cold cure" denture material, methyl methacrylate; mixed with liquid component for application to secure recording device in place |
| DietGel Boost | ClearH2O | 72-04-5022 | High calorie dietary supplement for young/recovering mice |
| Digital Lynx 16SX | Neuralynx | DigitalLynx 16SX Base | Main recording apparatus with 16 combo board slots for up to 512 recording channels |
| Dissector scissors- heavy blades | FST | 14082-09 | Various |
| Dumont #5 ceramic coated forceps | FST | 11252-50 | Tetrode handling/threading/pinning |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose assembly use |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose surgical use |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Various |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Multipurpose surgical use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Plating/assembly use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Stereotactic accessory for lowering drive onto skull during surgery |
| Euthasol | Virbac | 710101 | Pentobarbital sodium for euthanasia |
| Extra fine Bonn scissors | FST | 14083-38 | Various |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Fine hemostats | FST | 13006-12 | Fine hemostats |
| Fine scissors- CeramaCut | FST | 14958-09 | Tetrode cutting |
| Fine scissors- ToughCut | FST | 14058-09 | Various |
| Form 3+ | Formlabs | PKG-F3-P-WS-SVC-BASIC | 3D printer for fabrication of all printed parts/materials; low-force stereolithography 3D printer (LFS) |
| Gel super glue | Loctite | 1363589 | Various steps |
| Graefe forceps | FST | 11049-10 | Small angled serrated forceps |
| Ground wire | A-M Systems | Lot# 582335 | Stainless steel bare wire, .005" diameter, annealed, 100 feet |
| Hair removal gel | Generic | Commercially available | For pre-op removal of hair from top of mouse head |
| Heat gun | Dewalt | D26960K | Tetrode fusion following spinning |
| High temperature cautery kit | FST | 18010-00 | For use with bone wax if applicable |
| Hot bead sterilizer | FST | 18000-45 | Electrical sterilization apparatus for ad hoc instrument sterilization during surgical procedures |
| Isoflurane | Covetrus | 11695067771 | Standard isoflurane liquid anesthsia for use in isoflurane vaporizer to max 5% |
| Isopropyl alcohol 91% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| Jewelry screw (bone screws for juvenile mice) | Component supply co. | MX-000120-02SFL | S/S machine screw #000-120 x 1/8'' filister head, slotted drive |
| LaGrange scissors | FST | 14173-12 | Various |
| Large polyimide tubing | Nordson medical | Lot # 13564 | Polyimide tubing- inner diameter 0.0071"; outer diameter 0.0115"; length 36" |
| Liquid super glue | Loctite | 1365882 | Various steps |
| Micro drill | Foredom | K.1070 | K.1070 high speed rotary micromotor kit; with control box, 3/32" collet, variable speed foot control, handpiece cradle; stereotactically fittable; 100–115 V use |
| Micro drill burr (0.5 mm+) | FST | 19007-05/07/09 | Craniotomy |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | Various steps |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | For use keeping craniotomy holes open |
| Miniature flathead screwdriver | FST | 30051-10 | Insertion/tightening of bone screws |
| Neosporin Triple Antibiotic Ointment | Johnson & Johnson | 512373700 | Antibiotic ointment |
| Omnetics 44 socket nano connector | Neuralynx | Neuralynx part #A70427-801 | NONSTANDARD ITEM- omnetics 44 socket (female) dual row straight leg nano connector with 2 guide pins (male) for use with custom-made counterbalance apparatus |
| Platinum 10% iridium wire | California fine wire | MO# M374710 | Fine recording wire spun into tetrodes for use during recording by use of the terode assembly station and spinner 2.0 (see below); HML NATRL VG BOND COAT; SIZE .0007 X 200FT |
| Platinum black plating solution | Neuralynx | Platinum black plating solution | Plating |
| Polycarbonate cage bottom | Thomas Scientific/Maryland plastics | 1113M35; mfr. No. E0270 | Standard cage bottom; can be fitted with wire mesh apparatus over top that contains chow+water bottle for unimplanted mice |
| Polycarbonate cage top with N10 micro filter | Ancare | N/A | Standard cage top to be modified with PVC pipe for counterbalance apparatus |
| Povidone iodine 10% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| PVC pipe | Charlotte pipe | N/A | 1/2" x 600 PSI schedule 40 white PVC pipe; for use/assembly into counterbalance apparatus during mouse recovery |
| Scalpel blades- #4 | FST | 10060-00 | Incision use |
| Scalpel handle- #4 gross anatomy | FST | 10060-13 | Incision use |
| Self-holding pin and bone screw forceps | FST | 26100-00 | Holder for bone and ground screws while inserting into skull |
| Small EIB pins | Neuralynx | Small EIB pins | Attachment of tetrode wires to EIB board |
| Small polyimide tubing | Nordson medical | Lot # 19102423 | Polyimide tubing- inner diameter 0.004''; outer diameter 0.0044''; length 36" |
| SolidWorks | Dassault Systemes | SolidWorks | 3D CAD program for micro-drive design |
| Spatula and probe | FST | 1090-13 | Applicator for petroleum jelly/mineral oil + optional use for ad hoc tetrode straightening |
| Spring scissors- 8 mm | FST | 15024-10 | Scissors for cranial tissue incisions |
| Spring scissors- 8 mm | FST | 15024-10 | Initial incisions |
| Standard pattern forceps | FST | 11000-12 | Large serrated forceps |
| Surgical scissors- sharp-blunt | FST | 14001-12 | Various |
| Surgical scissors- ToughCut | FST | 14054-13 | Various |
| Tetrode assembly station | Neuralynx | Tetrode assembly station | Tetrode Assembly |
| Tetrode spinner 2.0 | Neuralynx | Tetrode spinner 2.0 | Tetrode Assembly |
| Two-part epoxy | Gorilla brand | 4200102 | Various steps |
References
- Konrad, K., Firk, C., Uhlhaas, P. J. Brain development during adolescence. Deutsches Arzteblatt International. 110 (25), 425-431 (2013).
- Silbereis, J. C., Pochareddy, S., Zhu, Y., Li, M., Sestan, N. The cellular and molecular landscapes of the developing human central nervous system. Neuron. 89 (2), 248-268 (2016).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Progress in Neurobiology. 106-107, 1-16 (2013).
- Volk, L., Chiu, S. -. L., Sharma, K., Huganir, R. L. Glutamate synapses in human cognitive disorders. Annual Review of Neuroscience. 38, 127-149 (2015).
- Lord, C., et al. Autism spectrum disorder. Nature Reviews Disease Primers. 6, 5 (2020).
- McCutcheon, R. A., Reis Marques, T., Howes, O. D. Schizophrenia - An overview. JAMA Psychiatry. 77 (2), 201-210 (2020).
- Hopfield, J. J. Neural networks and physical systems with emergent collective computational abilities. Proceedings of the National Academy of Sciences of the United States of America. 79 (8), 2554-2558 (1982).
- Heeger, D. J. Theory of cortical function. Proceedings of the National Academy of Sciences of the United States of America. 114 (8), 1773-1782 (2017).
- Pouget, A., Dayan, P., Zemel, R. Information processing with population codes. Nature Reviews Neuroscience. 1, 125-132 (2000).
- Averbeck, B. B., Latham, P. E., Pouget, A. Neural correlations, population coding and computation. Nature Reviews Neuroscience. 7 (5), 358-366 (2006).
- Bey, A. L., Jiang, Y. -. H. Overview of mouse models of autism spectrum disorders. Current Protocols in Pharmacology. 66, 1-26 (2014).
- Kazdoba, T. M., et al. Translational mouse models of autism: Advancing toward pharmacological therapeutics. Current Topics in Behavioral Neurosciences. 28, 1-52 (2016).
- Mendoza, M. L., Quigley, L. D., Dunham, T., Volk, L. J. KIBRA regulates activity-induced AMPA receptor expression and synaptic plasticity in an age-dependent manner. iScience. 25 (12), 105623 (2022).
- Bernardet, M., Crusio, W. E. Fmr1 KO mice as a possible model of autistic features. The Scientific World Journal. 6, 1164-1176 (2006).
- Weaving, L. S., Ellaway, C. J., Gécz, J., Christodoulou, J. Rett syndrome: Clinical review and genetic update. Journal of Medical Genetics. 42 (1), 1-7 (2005).
- Krawczyk, M., et al. Hippocampal hyperexcitability in fetal alcohol spectrum disorder: Pathological sharp waves and excitatory/inhibitory synaptic imbalance. Experimental Neurology. 280, 70-79 (2016).
- Jaramillo, T. C., et al. Altered striatal synaptic function and abnormal behaviour in Shank3 exon4-9 deletion mouse model of autism. Autism Research. 9 (3), 350-375 (2016).
- Suh, J., Foster, D. J., Davoudi, H., Wilson, M. A., Tonegawa, S. Impaired hippocampal ripple-associated replay in a mouse model of schizophrenia. Neuron. 80 (2), 484-493 (2013).
- Altimus, C., Harrold, J., Jaaro-Peled, H., Sawa, A., Foster, D. J. Disordered ripples are a common feature of genetically distinct mouse models relevant to schizophrenia. Molecular Neuropsychiatry. 1 (1), 52-59 (2015).
- Marcotte, E. R., Pearson, D. M., Srivastava, L. K. Animal models of schizophrenia: A critical review. Journal of Psychiatry and Neuroscience. 26 (5), 395-410 (2001).
- Makuch, L., et al. Regulation of AMPA receptor function by the human memory-associated gene KIBRA. Neuron. 71 (6), 1022-1029 (2011).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sciences. 152, 244-248 (2016).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. Journal of Visualized Experiments. (26), e1094 (2009).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Farooq, U., Dragoi, G. Emergence of preconfigured and plastic time-compressed sequences in early postnatal development. Science. 363 (6423), 168-173 (2019).
- Langston, R. F., et al. Development of the spatial representation system in the rat. Science. 328 (5985), 1576-1580 (2010).
- Wills, T. J., Cacucci, F., Burgess, N., O'Keefe, J. Development of the hippocampal cognitive map in preweanling rats. Science. 328 (5985), 1573-1576 (2010).
- Bjerknes, T. L., Moser, E. I., Moser, M. B. Representation of geometric borders in the developing rat. Neuron. 82 (1), 71-78 (2014).
- Bjerknes, T. L., Dagslott, N. C., Moser, E. I., Moser, M. -. B. Path integration in place cells of developing rats. Proceedings of the National Academy of Sciences. 115 (7), E1637-E1646 (2018).
- Jansen, N. A., et al. Impaired θ-γ coupling indicates inhibitory dysfunction and seizure risk in a Dravet syndrome mouse model. Journal of Neuroscience. 41 (3), 524-537 (2021).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: Tetrode assembly. Journal of Visualized Experiments. (26), e1098 (2009).
- Voigts, J., Siegle, J., Pritchett, D. L., Moore, C. I. The flexDrive: An ultra-light implant for optical control and highly parallel chronic recording of neuronal ensembles in freely moving mice. Frontiers in Systems Neuroscience. 7, 8 (2013).
- Voigts, J., Newman, J. P., Wilson, M. A., Harnett, M. T. An easy-to-assemble, robust, and lightweight drive implant for chronic tetrode recordings in freely moving animals. Journal of Neural Engineering. 17 (2), 026044 (2020).
- Guardamagna, M., et al. The Hybrid Drive: A chronic implant device combining tetrode arrays with silicon probes for layer-resolved ensemble electrophysiology in freely moving mice. Journal of Neural Engineering. 19 (3), (2022).
- Yamamoto, J., Wilson, M. A. Large-scale chronically implantable precision motorized microdrive array for freely behaving animals. Journal of Neurophysiology. 100 (4), 2430-2440 (2008).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, 417 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved