Um fluxo de trabalho para determinar quantitativamente variações específicas da lesão de degeneração macular relacionada à idade na autofluorescência do fundo de olho
In This Article
Summary
Esta pesquisa descreve um fluxo de trabalho para determinar e comparar os níveis de autofluorescência de regiões individuais de interesse (por exemplo, drusas e depósitos drusenoides sub-retinianos na degeneração macular relacionada à idade [DMRI]) enquanto contabiliza os níveis variáveis de autofluorescência em todo o fundo.
Abstract
A imagem de autofluorescência do fundo de olho (FAF) permite o mapeamento não invasivo dos fluoróforos intrínsecos do fundo ocular, particularmente do epitélio pigmentado da retina (EPR), agora quantificável com o advento da autofluorescência quantitativa baseada em oftalmoscopia confocal a laser (QAF). Demonstrou-se que a QAF está geralmente diminuída no polo posterior na degeneração macular relacionada à idade (DMRI). A relação entre QAF e várias lesões de DMRI (drusen, depósitos drusenoides sub-retinianos) ainda não está clara.
Este artigo descreve um fluxo de trabalho para determinar QAF específico de lesão na DMRI. Uma abordagem de imagem in vivo multimodal é usada, incluindo, mas não limitado a, tomografia de coerência óptica de domínio espectral (SD-OCT), varredura de volume macular e QAF. Usando plug-ins FIJI personalizados, a imagem QAF correspondente é alinhada com a imagem infravermelha próxima da varredura SD-OCT (pontos de referência característicos; ou seja, bifurcações de vasos). A fóveola e a borda da cabeça do nervo óptico são marcadas nas imagens de OCT (e transferidas para a imagem QAF registrada) para o posicionamento preciso das grades de análise.
As lesões específicas da DMRI podem então ser marcadas em BScans individuais da OCT ou na própria imagem QAF. Mapas QAF normativos são criados para levar em conta a média e o desvio padrão variáveis dos valores de QAF ao longo do fundo de olho (imagens QAF de um grupo representativo de AMD foram calculadas em média para construir mapas normativos padrão de QAF AMD retiniana). Os plug-ins registram as coordenadas X e Y, z-score (medida numérica que descreve o valor do QAF em relação à média dos mapas AF em termos de desvio padrão da média), valor de intensidade média, desvio padrão e número de pixels marcados. Os instrumentos também determinam escores z a partir da zona de borda das lesões marcadas. Esse fluxo de trabalho e as ferramentas de análise melhorarão a compreensão da fisiopatologia e da interpretação clínica da imagem de FA na DMRI.
Introduction
A imagem de autofluorescência do fundo de olho (FAF) fornece um mapeamento não invasivo dos fluoróforos naturais e patológicos do fundo ocular1. A autofluorescência (FA) azul (excitação de 488 nm) mais comum excita lipofuscina e grânulos de melanolipofuscina do epitélio pigmentar da retina (EPR)2,3,4. A distribuição e o aumento/diminuição dos grânulos desempenham um papel central no envelhecimento normal e em várias doenças retinianas, incluindo a degeneração macular relacionada à idade (DMRI)5.
Um desenvolvimento adicional da FAF, a autofluorescência quantitativa de fundo de olho (QAF), agora permite a determinação precisa das intensidades de FA retiniana resolvidas topograficamente 4,6. Ao incorporar uma referência na via óptica do dispositivo de imagem FAF, as intensidades de FA podem ser comparadas entre dispositivos, pontos de tempo e indivíduos. Essa técnica resultou em uma mudança de paradigma em relação a um suposto fator patogênico na DMRI, que por muito tempo foi especulado como sendo devido ao acúmulo excessivo de lipofuscina nas células doEPR7. A quantificação histológica e clínica da FA, entretanto, revelou uma diminuição da FA na DMRI (devido à redistribuição e perda de lipofuscina autofluorescente e grânulos de melanolipofuscina), em vez do aumento proposto na FA 8,9,10.
O monitoramento da FA tem implicações clínicas. Von der Emde e col. e outros mostraram que a FA não apenas diminui, mas também diminui ainda mais no curso da DMRI em olhos de DMRI intermediários de alto risco 8,9. Além disso, estudos histológicos sugerem que a maioria das células de EPR afetadas pela DMRI apresenta um comportamento característico com agregação e extrusão de grânulos antes da perda de células de EPR por subducção, descamação, migração ou atrofia13,14,15,16. Isso indica ainda que a perda de FA pode ser um gatilho ou um sinal substituto de progressão iminente da doença.
Os estudos QAF até o momento avaliaram a FA globalmente apenas no polo posterior usando sistemas de coordenadas polares pré-fabricadas (por exemplo, QAF8/Delori Grid)17. O uso de grades pré-fabricadas para medir FA resulta em múltiplos valores de FA em áreas predeterminadas por olho de um indivíduo. Investigar os valores de FA dessa forma pode perder alterações locais em áreas com FA patologicamente alterada, por exemplo, na DMRI no topo ou perto de depósitos drusenoides (SDDs) drusenoides sub-retinianos. Drusen, e em um grau mais alto SDDs, estão associados a um alto risco de desenvolver DMRI tardia e perda de visão. Drusen, em particular, têm um ciclo típico de aumento de tamanho ao longo de muitos anos e podem se deteriorar rapidamente antes da atrofia. É concebível que, por exemplo, a FA global diminua na DMRI, mas aumente ou seja ainda mais reduzida dentro e ao redor dessas lesões focais específicas relacionadas à doença.
Diferentes padrões locais de FA também podem ter relevância prognóstica para a progressão da doença. Por exemplo, os níveis de autofluorescência podem ser usados para avaliar se as drusas estão aumentando de tamanho ou se já estão em regressão à atrofia. Já foi demonstrado que padrões perilesionais alterados de FA na atrofia geográfica afetam amplamente a progressão da atrofia ao longo dotempo18. Além disso, padrões locais de autofluorescência poderiam revelar mais detalhes sobre a saúde do EPR. Muitas vezes, a tomografia de coerência óptica (OCT) mostra hiper-refletância para o coriocapilar, embora a camada de EPR pareça intacta. Uma abordagem multimodal combinando valores locais de QAF e OCT pode ajudar a diferenciar lesões com alto risco de ruptura do EPR e atrofia iminente.
Uma razão pela qual análises espacialmente resolvidas em estudos não têm sido realizadas é porque o software do fabricante mais comumente usado não fornece uma ferramenta para esses tipos de análise. As propriedades da FA de diferentes lesões dependentes do estágio da doença da DMRI poderiam explicar melhor a patogênese da DMRI. Portanto, uma ferramenta para medir FA regional específica da lesão seria desejável. Para comparar com precisão as lesões localizadas ao longo da retina, o fluxo de trabalho necessita de uma maneira de explicar os diferentes graus de FA no fundo de olhohumano19. Mais centralmente, a FA é caracteristicamente menor devido aos efeitos de sombreamento do pigmento macular e à diferença na contagem de grânulos20,21.
A FA atinge seu pico em ~9° (distância da fóvea em todas as direções) e diminui em maior extensão perifericamente4. Portanto, se comparássemos os valores absolutos dos níveis de FA a partir de drusas moles (localizadas na fóvea e parafovea em áreas de baixa FA) e SDDs (localizadas paracentralmente em áreas de FA altas), os resultados não seriam comparáveis22. Inspirada no trabalho de Pfau e col. e no conceito de perda de sensibilidade (correção da sensibilidade medida na DMRI para o monte da visão [diminuição da sensibilidade retiniana com a distância à fóvea] de controles saudáveis) para a perimetria controlada por fundo, a FA é comparada com valores padronizados de FA em toda amácula23,24. Os resultados são apresentados como z-scores (medida numérica da relação de um valor de região de interesse com a média).
O objetivo deste estudo é avaliar o uso de uma nova ferramenta para medir os níveis locais de QAF em diferentes tipos de lesões em pacientes com DMRI. Esta ferramenta foi projetada para medir os níveis de autofluorescência de lesões identificadas em exames de OCT. Isso permite a avaliação dos níveis de autofluorescência local em lesões, como drusas moles ou SDDs, e permite rastrear as alterações da FA das lesões ao longo do tempo. A utilidade potencial dessa ferramenta é possibilitar um novo biomarcador estrutural que estime a saúde do EPR e possa ter valor prognóstico para as lesões investigadas.
Protocol
O estudo foi conduzido de acordo com a Declaração de Helsinque e aprovado pelo Comitê de Ética da Universidade de Bonn (protocolo código 305/21). Consentimento informado por escrito foi obtido de todos os sujeitos envolvidos no estudo. Exigimos que todos os participantes do vídeo assinassem formulários de liberação nos concedendo permissão para usar sua imagem e informações pessoais na criação de um vídeo on-line.
1. Aquisição de imagens de autofluorescência quantitativa (QAF)
- Para uma aquisição precisa da imagem com o dispositivo QAF, certifique-se de que o participante esteja sentado confortavelmente à frente do dispositivo. Peça ao participante que pressione o queixo e a testa contra o queixo e o encosto de cabeça. Ajuste a altura do queixo até que o ângulo da pálpebra lateral esteja na mesma altura da marcação vermelha.
- Certifique-se de que a imagem está focada no modus infravermelho próximo, girando a roda no dispositivo de gravação até que os pequenos vasos estejam em foco. Aumente o zoom no olho movendo a câmera para frente até que os cantos da imagem estejam uniformemente iluminados. Como regra geral, ajuste o foco para o equivalente esférico. Reduza o foco antes da imagem QAF por uma ou duas dioptrias, pois o QAF azul usa um comprimento de onda mais curto, e mude o modus do dispositivo QAF do infravermelho próximo para o modo QAF.
- Reajuste e aumente a iluminação e ajuste o foco da imagem até que os pequenos vasos mais próximos da fóvea estejam em foco e a imagem seja iluminada sem pontos vermelhos (indicando sobreiluminação). Branquear o fotopigmento aguardando pelo menos 30 s no modo QAF antes da aquisição da imagem para permitir a excitação contínua da luz azul para branquear o pigmento fotorreceptor no campo de visão das configurações da câmera.
- Para capturar imagens, pressione a aquisição de imagens no touch pad do dispositivo de imagem; certifique-se de capturar mais de uma imagem QAF em caso de piscar ou movimentos bruscos dos olhos durante a aquisição.
NOTA: O fluxo de trabalho também requer imagens de tomografia de coerência óptica de domínio espectral (SD-OCT). A aquisição de imagens de OCT é explicada em outro artigo, pois é amplamente utilizada na prática clínica25.
2. Exportação de imagens
- Para esse pipeline de análise, verifique se as imagens QAF e OCT estão no formato de arquivo XML (Extensible Markup Language). No visualizador HEYEX clique com o botão direito do mouse em uma imagem QAF/OCT desejada e selecione Exportar | como XML no menu suspenso.
3. Plug-ins de código aberto para análise QAF - instalando o pipeline
NOTA: O software QAF apresentado é um plug-in de código aberto chamado "Spectralis pipeline" criado para o software de código aberto ImageJ (expansão FIJI)26.
- Para acessar o plug-in, abra o FIJI, selecione Ajuda e Atualizar no menu suspenso e clique em Gerenciar Sites de Atualização para adicionar o Site de Atualização de Computação Criativa "https://sites.imagej.net/CreativeComputation/" aos sites de atualização preexistentes.
- Baixe os plug-ins e reinicie o FIJI. Agora, o Spectralis Pipeline está instalado. Os diferentes plug-ins Spectralis estão localizados no menu suspenso Plugins | Spectralis ou Plugins | SpectralisBatch.
4. Configuração - armazenamento de dados
Observação : para permitir um fluxo de trabalho contínuo, é recomendável configurar a estrutura de pastas da seguinte maneira. Primeiro, crie uma pasta para cada tema de estudo. Oculus dexter (OD) e oculus sinister (OS) referem-se ao olho direito e esquerdo, respectivamente, e essas abreviações são usadas em todo esse fluxo de trabalho.
- Para cada olho examinado de cada sujeito de estudo, configure uma pasta para uma OCT, denominada OD_OCT e OS_OCT, respectivamente. Permita que o pipeline do Spectralis armazene automaticamente sua saída do plug-in "Mark_BScans_OCT" como valores separados por tabulação nessas pastas.
- Para as imagens QAF, crie duas pastas chamadas OD_QAF e OS_QAF.
- Crie pastas adicionais se outras modalidades de imagem multimodais forem usadas. Certifique-se de que a estrutura de pastas resultante seja semelhante à estrutura listada abaixo:
CASE_ID
OD_OCT
OD_QAF
OD_other_imaging_modality
OS_OCT
OS_QAF
OS_other_imaging_modality
5. Conversão do arquivo XML QAF em uma imagem QAF (plug-in usado: QAF_xml_reader)
- Os arquivos de exportação XML do Spectralis QAF são armazenados no formato vermelho-verde-azul (RGB), limitado a uma escala de 0 a 255 (representando valores de AF medidos) e incluindo regiões de calibração "padrão" e "preto". O plug-in "QAF_xml_reader" produz uma imagem QAF. Para isso, abra o menu suspenso de plug-ins , selecione Spectralis | QAF_XML_Reader e descarte a tela de abertura.
- Uma nova janela é exibida mostrando o prompt Escolha um diretório contendo um Spectralis XML QAF Export:. Selecione o diretório e clique em Selecionar.
- Insira o fator de calibração de referência (RCF) do dispositivo QAF (incluído nas informações da imagem do QAF) e a idade do paciente no momento em que a imagem foi tirada.
- A próxima janela é chamada de Parâmetros QAF. Se o paciente for pseudofácico na aquisição da imagem, selecione a idade de 20 anos (isso tem o efeito de não aplicar correção de idade). Depois de clicar em OK, quando um pop-up rotulado Mapear para 8 bits for exibido, insira o valor QAF mínimo (qafMin) e o valor QAF máximo (qafMax) para uma imagem QAF codificada por cores. Caso qafMin e qafMax sejam desconhecidos, use as configurações padrão, clique em OK e observe a imagem original rotulada como Dados QAF brutos que aparece, bem como a imagem QAF de 32 bits e QAF codificada por cores de 8 bits.
NOTA: A imagem QAF codificada por cores é usada exclusivamente para fins ilustrativos; a imagem QAF de 32 bits com valores reais de QAF é utilizada para análise posterior.
6. Registrando imagens QAF com a imagem da OCT (plug-in usado: Register_OCT_2)
NOTA: Esta etapa é necessária para alinhar com precisão a imagem da OCT com a imagem QAF, de modo que as lesões nas imagens QAF e OCT BScans estejam alinhadas.
- Acesse o plug-in através do menu suspenso Plugins | Spectralis, ou crie uma tecla de atalho para acessar os diferentes plug-ins usados. Para conseguir isso, selecione Register_OCT_2 em Plugins | Atalhos | Adicione atalho e escolha a tecla de atalho desejada.
- Depois de abrir o plug-in, clique em OK na primeira janela exibida. Em seguida, uma janela contendo o prompt: Escolha um diretório contendo a exportação XML da OCT do Spectralis: aparecerá na janela principal do ImageJ. Selecione a pasta que contém o Spectralis OCT XML Export e clique em Abrir.
Observação : a OCT agora será carregada, o que, dependendo da capacidade de processamento do computador que está sendo usado, pode levar até 2 minutos. - Em seguida, aguarde uma janela contendo o prompt Salvar imagens registradas para: para pop-up. Selecione o diretório onde o EnFaceStack (arquivo de imagem alinhado) será armazenado e clique em Abrir.
- Aguarde uma janela pop-up contendo o prompt Escolha uma imagem para adicionar ao EnFaceStack: para aparecer, selecione a imagem QAF de 32 bits para alinhar a imagem com o SD-OCT e clique em Abrir. Se todas as imagens necessárias neste EnFaceStack estiverem incluídas, selecione Cancelar.
- Quando a próxima janela pedir ao usuário para selecionar um rótulo para o EnFaceStack, selecione o rótulo QAF pré-fabricado; alternativamente, digite o nome desejado da modalidade na caixa Outro. Selecione OK para registrar a imagem.
Observação : não inclua espaços ou outra pontuação no campo Outro . - Observe as três janelas que aparecem. O primeiro é rotulado Localizer e exibe o SD-OCT como uma imagem do olho esquerdo (SO). A segunda janela é denominada QAF ou uma das outras modalidades selecionadas anteriormente como o olho esquerdo (OS) ou direito (OD) original. A última janela é chamada de Pontos de Referência, que pede para selecionar de um a três pontos de referência em cada imagem.
- Alinhe as duas imagens selecionando de um a três pontos de referência por bifurcações imagem-vaso ou outras características localizadas em ambas as modalidades. Aumente o zoom (use o caractere de teclado " +" para ampliar e " -" para reduzir) antes de selecionar o ponto de referência. Certifique-se de que os pontos de referência selecionados estejam espalhados vertical e horizontalmente na imagem. Depois que todos os pontos de referência forem anotados, selecione OK na guia Pontos de referência e Cancelar no próximo prompt.
- Quando uma janela solicitando Deseja ver os resultados for exibida, selecione Sim para verificar se a imagem foi alinhada corretamente. Faça isso ampliando um pequeno vaso e colocando o cursor ao lado dele, depois role para cima ou para baixo para verificar o quanto o vaso se move em relação ao cursor. Se o alinhamento não for preciso, exclua o arquivo ".tiff" no diretório OD_QAF e reinicie o processo a partir do início da etapa 2.
NOTA: Como as marcações em Mark_BScans_OCT devem ser precisas, o alinhamento entre a imagem SD-OCT e QAF também deve ser muito preciso. O alinhamento perfeito de pixels pode ser alcançado na maioria das imagens, embora em alguns casos o alinhamento seja limitado a uma precisão de três ou quatro pixels.
7. Criação de uma imagem QAF média para comparação (plug-in usado: StandardRetina/BatchStandardRetina)
NOTA: Os valores de QAF são fortemente dependentes da localização da retina (por exemplo, sombra central causada pelo pigmento macular). Portanto, os valores de QAF de drusen devem ser comparados com os valores de QAF padrão da mesma região. Como pré-requisito para análise, o StandardRetina cria um mapa enface de imagens QAF médias (por exemplo, de uma coorte de controle pareada por idosos). O mapa de enface resultante mostra um mapa pixel a pixel de um valor QAF médio para a retina central.
- Existem duas maneiras de criar retinas padrão dentro do pipeline Spectralis: a primeira, AddToStandardRetina_OCT, permite um novo caso de cada vez para o mapa enface, enquanto a segunda, BatchStandardRetina, adiciona vários casos ao mesmo tempo.
- Para adicionar uma imagem de cada vez, selecione Plugins | Spectralis - Brasil | AddToStandardRetina_OCT e dispensar a tela de abertura. Quando aparecer uma janela exibindo o texto Escolha um diretório que contenha uma exportação XML da OCT do Spectralis, selecione a pasta e clique em Selecionar para abrir o BScan.
- Quando uma nova janela aparecer exibindo o prompt Escolha um diretório contendo imagens registradas do EnFace:, selecione a pasta apropriada e clique em Selecionar.
- Observe as três janelas que aparecem, uma rotulada EnFaceStack que exibe as imagens empilhadas da pasta selecionada na segunda etapa, a segunda rotulada Bscan Stack exibindo o OCT BScan e uma terceira janela aparecendo no meio rotulada Choose Modality. Selecione uma modalidade no EnFaceStack.
- Selecione uma modalidade e observe a nova janela que aparece com o prompt Escolha um diretório que contenha o StandardRetina. Se um diretório contendo um StandardRetina ainda não existir, selecione uma pasta vazia para criar um novo StandardRetina.
- Examine o novo StandardRetina, role para cima e para baixo e mova o cursor para exibir a média e o desvio padrão para esse local específico. Clique no botão Aceitar? Para adicionar a foto mais recente ao StandardRetina ou descartá-la.
- Para adicionar várias imagens ao mesmo tempo, use Batch_QAF_StandardRetina.
- Primeiro, prepare um arquivo "manifest.txt" na mesma pasta que as IDs de maiúsculas e minúsculas e certifique-se de que ele lista o caminho relativo do local do arquivo .txt para a OCT e o EnFaceStack. Separe os dois por um espaço de tabulação e verifique se não há espaço em branco adicional na frente e atrás dos nomes. O arquivo deve ser semelhante a esta instalação:
pathToOCT_1>pathToEnFaceStack_1>001/OD-OCT>001/OD-QAF
pathToOCT_2>pathToEnFaceStack_2>002/OD-OCT>002/OD-QAF - Crie o arquivo no software de planilha e salve-o como um arquivo txt. Certifique-se de que todos os caminhos contenham a fatia (letras de caractere) QAF para que o arquivo de manifesto funcione corretamente. Os plug-ins estão localizados no menu suspenso Plugins | SpectralisBatch-Lote | QAF_StandardRetina.
- Dispense a tela de abertura e aguarde até que uma nova janela seja aberta exibindo o prompt Selecione a Retina Padrão inicial. Selecione uma pasta com um StandardRetina preexistente ou selecione uma pasta vazia para criar um novo StandardRetina.
- Procure um prompt rotulado Select Modality para aparecer; o padrão é QAF. Certifique-se de que o nome do arquivo da respectiva modalidade corresponda exatamente ao nome do arquivo de uma fatia em cada EnFaceStack nomeado no arquivo de manifesto. Em seguida, quando uma janela for aberta solicitando que o usuário escolha um arquivo de manifesto (descrito anteriormente), clique em Cancelar se nenhum outro arquivo de manifesto for adicionado a este StandardRetina ou selecione outro arquivo de manifesto. Examine o novo StandardRetina em uma nova janela rotulada Aceitar?, e decida se deseja adicionar o lote mais recente ao StandardRetina ou descartar o lote mais recente.
NOTA: O processo de combinar todos os QAFs para um StandardRetina pode demorar um pouco.
- Primeiro, prepare um arquivo "manifest.txt" na mesma pasta que as IDs de maiúsculas e minúsculas e certifique-se de que ele lista o caminho relativo do local do arquivo .txt para a OCT e o EnFaceStack. Separe os dois por um espaço de tabulação e verifique se não há espaço em branco adicional na frente e atrás dos nomes. O arquivo deve ser semelhante a esta instalação:
8. Anotação de regiões de interesse para análise (plug-in utilizado: Mark_BScans_OCT)
- Para marcar lesões (como drusen), abra Plugins | Spectralis - Brasil | Mark_BScans_OCT e descartar o prompt de abertura. Procure uma nova janela rotulada Escolha um diretório que contenha uma exportação XML da OCT do Spectralis para aparecer. Escolha a pasta que tem a OCT desejada e clique em OK.
- Depois que o FIJI tiver carregado a OCT, observe a nova janela com o rótulo Escolha um diretório contendo imagens en face registradas para aparecer. Selecione o diretório que contém o EnFaceStack e clique em Selecionar.
- Três novas janelas agora aparecem, uma rotulada EnFaceStack, uma rotulada BscanStack e uma chamada User Parameters.
- A janela Parâmetros do usuário solicita que o usuário insira os seguintes parâmetros: ID do caso, que aparecerá no nome do arquivo csv de saída, largura de banda em mm, largura da linha enface, largura da linha BScan e opacidade da máscara de região.
- O parâmetro largura de banda em mm determina a largura de cada isocasco em milímetros ( mm ). Use a largura da linha Enface para alterar a largura da linha das lesões marcadas na janela denominada EnFaceStack.
- A largura da linha BScan determina a largura da linha na janela Bscan Stack. Observe que definir esse parâmetro como 1 é a melhor configuração de largura de linha para a maioria dos casos.
- Escolha entre uma Máscara Facial ou um Mapa de Distância exibido em uma janela separada para decidir se as faixas internas devem ser coloridas. Depois, clique em concluído na janela Marcar no BScan no plug-in.
- Em seguida, quando solicitado a selecionar um StandardRetina preexistente, selecione a pasta que contém o StandardRetina e clique em Selecionar. Observe que se um StandardRetina for selecionado, o Mark_BScans_OCT de saída selecionará o z-score do modo (de um valor QAF medido em comparação com o StandardRetina). Se o valor QAF bruto for preferido, clique em Cancelar e aguarde uma nova janela chamada Mensagem que avisa que os resultados serão valores brutos, não pontuações z.
- A janela Parâmetros do usuário solicita que o usuário insira os seguintes parâmetros: ID do caso, que aparecerá no nome do arquivo csv de saída, largura de banda em mm, largura da linha enface, largura da linha BScan e opacidade da máscara de região.
- Procure uma nova janela para pop-up solicitando Escolha um diretório que contenha o estado salvo com os dados salvos. Se existir um arquivo salvo, clique no diretório que contém as fatias | Selecione. Caso o progresso não seja salvo, selecione cancelar. Procure uma nova janela chamada Marcar no BScan e, em um menu suspenso, selecione salvar, ignorar, concluído e marcar.
- Assinalar: Comece a anotar as regiões de interesse no BScan, com comandos semelhantes aos do plug-in "Register_OCT_2" explicado acima. Para marcar uma região, selecione iniciar clicando com o botão direito do mouse e arrastando o cursor do mouse até o final da lesão, verifique se a marca está selecionada na janela Marcar no B-Sscan e clique em OK. A região de interesse está agora marcada neste BScan.
- Ignorar: Selecione Ignorar na janela Marcar no BScan e clique em OK para ignorar a marcação.
- Salvar: Selecione salvar na janela Marcar no BScan e clique em OK para fazer com que uma nova janela apareça, contendo o prompt selecione um diretório para salvar o estado. Selecione uma pasta já existente ou crie uma nova. Abra arquivos já existentes iniciando "Mark_BScans_OCT" e selecione o diretório que contém o estado de salvamento quando a janela Escolher um diretório contendo o estado salvo for exibida.
Observação : vários estados de salvamento não podem ser armazenados em um diretório; salvar estados de uma localidade para outra não pode ser alternado facilmente (por exemplo, ALEMÃO para EUA). - Terminado: Selecione concluído na janela Marcar no BScan e clique em OK para fazer com que uma nova janela com o rótulo escolha modalidade apareça.
- Quando aparecer um prompt rotulado trazer a modalidade correta em cima da pilha de enface, traga a modalidade chamada QAF em cima, que foi alinhada usando "Register_OCT_2". Faça isso rolando pelo EnFaceStack, selecionando a janela En face Stack ou clicando na seta para a esquerda ou para a direita. Observe que o nome da modalidade é exibido no canto superior esquerdo.
- Para melhor inspecionar e marcar as lesões, amplie a janela do Bscan. Clique na janela B-Scan , aponte o mouse na direção para ampliar e pressione a tecla + ; Para reduzir o zoom, pressione a tecla -.
- Percorra a pilha BScan rolando para cima ou para baixo no mouse, arrastando a barra na parte inferior para a esquerda ou direita para passar pela varredura, ou selecionando o quadro B-Scan e clicando nas teclas de seta para a esquerda e para a direita no teclado. Observe que uma visão geral da área atual na pilha BScan é fornecida pela linha vermelha na janela EnFaceStack e no canto superior esquerdo da janela BScan onde o número BScan (por exemplo, 31/120) é exibido.
- Clique em OK para criar um novo arquivo .tsv na pasta "OD_OCT" ou "OS_OCT" correspondente. Observe que o nome do arquivo .tsv será composto por "Mark_Bscans_OCT" mais o ID do caso que foi inserido, a lateralidade e a modalidade que foi escolhida na última etapa do Mark_Bscans_OCT. Além disso, os "isocascos" codificados por cores do drusen agora serão exibidos no EnFaceStack.
Representative Results
Exibindo a saída
Para analisar adequadamente e tirar conclusões dos resultados, é importante entender o arquivo de saída de Mark_Bscans_OCT. As três primeiras colunas são rotuladas após o ID do caso, a lateralidade do arquivo e a modalidade de imagem escolhida. A quarta coluna é referida por modo e é rotulada como z-score. Note que, no momento em que escrevo este texto, Mark BScans só pode calcular todas as lesões de uma só vez; As linhas referem-se a cascos iso, cujas distâncias da borda externa da lesão são especificadas nas colunas inferior e superior da planilha. As isocascos medem a FA em escores z (no caso de QAF) em uma circunferência especificada ao redor da lesão. Observe que o valor mínimo de um pixel em um casco isológico pode ser encontrado nas colunas rotuladas min, as colunas rotuladas mediana, max, média e stdev, respectivamente contêm a mediana, o máximo, a média e o desvio padrão da média dos valores de pixel em umisocasco. A coluna n contém o número total de pixels em um isocasco. A Figura 1 mostra uma única drusa mole marcada de um paciente masculino de 84 anos com degeneração macular relacionada à idade intermediária (DMRIi).
A Figura 2 mostra o olho esquerdo de um paciente representativo com DDS marcado com a ferramenta QAF-Workflow (Figura 3). Os DDS nesse paciente foram associados à redução da FA (escore-z = -0,4 ± 0,2). Da mesma forma, os isocascos ao redor do SDD demonstraram AF reduzida (por exemplo, isocasco mais próximo = -0,3 ± 0,3) em comparação com o StandardRetina. Uma explicação plausível para esse fenômeno pode ser o efeito de sombreamento (redução da translucidez) das lesões de SDD sobre o PSE. O uso de SDDs foi exemplar. A ferramenta permite a avaliação dos níveis locais de FA também em outras lesões, como drusas. Além disso, a ferramenta permite rastrear as alterações da FA das lesões ao longo do tempo.
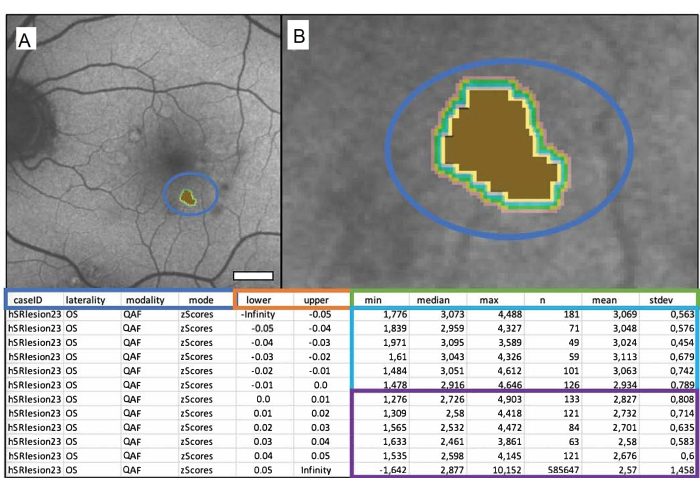
Figura 1: Um único drusen mole marcado de um paciente masculino de 84 anos com degeneração macular relacionada à idade intermediária (iAMD). ( A) A imagem QAF de um olho esquerdo com o druso marcado. (B) Close-up do druso: centro marrom representando o druso marcado e faixas coloridas representando os isocascos circundantes. A tabela abaixo mostra o arquivo de saída. Os valores de QAF drusen são comparados com os valores correspondentes de QAF da excentricidade correspondente do StandardRetina. Isso resulta em escores z que representam desvio da média das áreas não afetadas. A caixa azul mostra da esquerda para a direita: o ID do caso, a lateralidade do olho, a modalidade usada e a saída desejada (neste caso, escores z). As colunas dentro da caixa laranja mostram os limites da área medida em milímetros (inferior = limite inferior, superior = limite superior). A caixa verde rotula as colunas que mostram as medidas QAF. Da esquerda para a direita, eles contêm o mínimo, mediana, máximo, número de pixels, média e desvio padrão da média. Cada linha representa um isocasco, linhas dentro da caixa azul representam valores dentro da lesão, e linhas dentro da caixa roxa mostram os isocascos ao redor de cada lesão (de cima para baixo com o aumento da distância até a lesão). Barra de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.
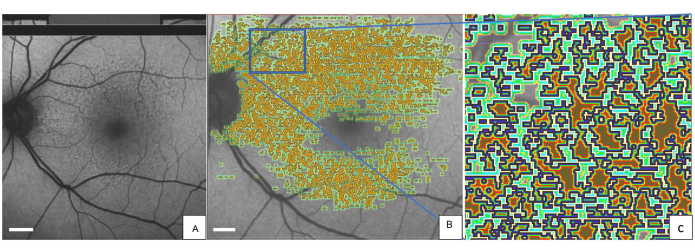
Figura 2: DDS marcados em uma imagem QAF de uma paciente de 80 anos com DMRI precoce. A mesma imagem QAF é mostrada com anotações impressas de SDDs. (B) Ao redor de cada lesão marcada, os isocascos são representados com codificação de cores (verde claro, verde escuro e vermelho). (C) Uma versão ampliada do retângulo azul. A borda externa de cada SDD é marcada em azul. Abreviações: QAF = autofluorescência quantitativa; DMRI = degeneração macular relacionada à idade; SDD = depósito drusenóide sub-retiniano. Barra de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.
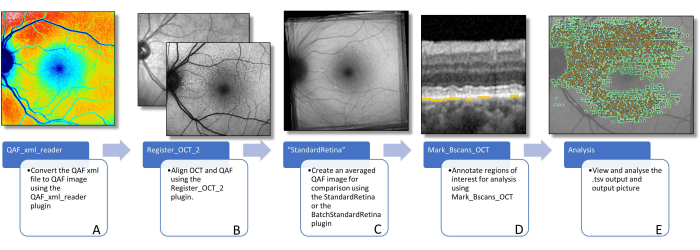
Figura 3: Fluxo de trabalho para determinação da FA das lesões. Esta figura visualiza os plug-ins de software necessários para determinar a FA específica da lesão. (A) A imagem mostra uma imagem QAF codificada por cores que pode ser usada para visualizar a distribuição dos valores de QAF, mas não deve ser usada para análise posterior. (B) Uma imagem QAF em primeiro plano, com a imagem infravermelha da varredura SD-OCT em segundo plano é mostrada. Supõe-se que isso visualize o alinhamento usando bifurcações de vasos. Isso pode ser feito usando o plug-in Register_OCT_2. (C) Um StandardRetina que é usado para medir os valores de escore z das lesões. StandardRetinas pode ser criado usando StandardRetina/BatchStandardRetina. (D) Uma BScan com setas azuis apontando para SDDs, que são destacadas por linhas amarelas (nota: as lesões são sempre marcadas abaixo da PSE independente da localização na direção z) é representada. (E) Todas as lesões marcadas são vistas impressas em uma imagem QAF (ver Figura 1). As duas últimas etapas são feitas usando o plug-in Mark_BScans_OCT. Abreviações: AF = autofluorescência; QAF = autofluorescência quantitativa; SDD = depósito drusenóide sub-retiniano; IR = infravermelho; PSE = epitélio pigmentado da retina; SD-OCT = tomografia de coerência óptica de domínio espectral. Clique aqui para ver uma versão maior desta figura.
Discussion
Este fluxo de trabalho fornece um guia passo a passo para usar ferramentas de plug-in FIJI de código aberto para determinar e comparar FA de lesões específicas da DMRI. Os plug-ins fornecem modelos fáceis de usar, que não requerem nenhum conhecimento de codificação e podem ser aplicados por médicos sem suporte técnico27. Até onde sabemos, essas ferramentas são únicas para a quantificação da FA específica da lesão.
Os valores de QAF variam naturalmente ao longo da retina, com valores sendo maiores na periferia e menores na mácula devido à distribuição desigual de lipofuscina e melanolipofuscina dentro da retina, baixa FA dos vasos e distribuição desigual de pigmentos maculares. Devido à alta variação dos níveis naturais de QAF na retina, analisar diretamente os valores absolutos de QAF das lesões não é uma abordagem promissora. Por exemplo, uma lesão hipoautofluorescente na periferia ainda pode ter valores absolutos de QAF mais elevados do que os níveis fisiológicos de fluorescência da mácula. O uso de um StandardRetina e o uso de escores z para medir os níveis de fluorescência de drusen corrigem para esta variância natural dos valores de QAF.
Um escore z é uma medida numérica da relação de um valor de região de interesse com a média no StandardRetina. Ele é calculado subtraindo-se a média de um indivíduo da média do Retina Padrão no mesmo local e, em seguida, dividindo-se o resultado pelo desvio padrão. Essa padronização permite a comparação de diferentes imagens do QAF, pois o escore z indica quantos desvios-padrão um valor difere da média. Um escore z positivo indica que o valor está acima da média, enquanto um escore z negativo indica que está abaixo da média.
É importante notar que pode haver armadilhas potenciais que devem ser consideradas. Embora esse método seja responsável pela quantidade variável de níveis de FA ao longo do fundo, ainda pode não ser a maneira mais precisa de medir e comparar a FA de uma PSE. Os indivíduos apresentam diferentes níveis e topografia do pigmento lúteo macular, e as lesões podem afetar também a translucência da retina sobrejacente28,29. Portanto, é plausível que a FA reduzida medida em áreas de SDDs (ver resultados representativos) seja uma consequência de efeitos de sombreamento em vez de fluoróforos diminuídos no PSE30,31,32.
Atualmente, estamos trabalhando em um fluxo de trabalho para contabilizar a refletividade da retina, espessura e pigmento macular quantificado (usando AF verde e azul) com modelos mistos lineares. Além disso, até o momento, o QAF usa um fator de correção dependente da idade para explicar a opacificação lenticular que desconsidera as diferenças interindividuais na opacificação lenticular de participantes de idade semelhante33. Portanto, estamos atualmente trabalhando em um fluxo de trabalho para um fator de correção personalizado de autofluorescência lenticular e opacificação. Para extrair de forma confiável informações de FA de pequenas lesões, é necessária a confiabilidade teste-reteste adequada das imagens QAF. Para diferenciar ainda mais as imagens QAF onde a análise mais detalhada é viável, estamos investigando "índices de confiabilidade da imagem QAF" que podem predizer a confiabilidade teste-reteste das imagens QAF. No estágio atual, a abordagem prudente é adquirir imagens duplicadas e investigar a confiabilidade do reteste da FA lesional-específica.
O método apresentado de análise adicional dos isocascos das lesões foi tecnicamente difícil de implementar, pois os isocascos das lesões vizinhas se fundem. Áreas de isocascos fundidos podem ser caracterizadas distintamente dependendo de qual lesão é considerada. Nossa solução foi considerar todas as lesões de um tipo como uma lesão e analisar sua periferia como um isocasco articular. Este método, no entanto, reduz drasticamente a capacidade de medir os isocascos de drusas individuais e pode ser considerado uma armadilha adicional desta técnica. Métodos tecnicamente mais sofisticados para explicar a fusão de isocascos ou o relato suspenso de FA em áreas de isocascos fundidos poderiam facilitar a análise de FA na circunferência das lesões no futuro.
Utilizamos a DMRI como doença modelo para este estudo. O fluxo de trabalho pode ser adaptado para estudar lesões em outras doenças também. Até o momento, o QAF tem sido usado em muitas doenças coriorretinianas, incluindo doença de Stargardt recessiva, doenças associadas à Bestrophin-1, várias formas de retinose pigmentar, retinopatia externa oculta zonal aguda, pseudoxantoma elástico e outras 17,33,34,35,36,37. Como esse fluxo de trabalho usa software de código aberto, encorajamos outros a duplicar esse trabalho na determinação da FA específica da lesão e expandir nosso conhecimento sobre distúrbios da retina. Em resumo, apresentamos um fluxo de trabalho para determinar e comparar os níveis de FA de diferentes lesões retinianas ao longo da mácula. Esse fluxo de trabalho abre caminho para uma análise mais aprofundada da FA e pode facilitar o desenvolvimento de novos biomarcadores na AMD e além.
Disclosures
Leon von der Emde relata ter recebido pagamentos da Heidelberg Engineering. Merten Mallwitz não relata divulgações financeiras. Kenneth R. Sloan também não relata divulgações financeiras. Frank G. Holz relata consultoria/pagamentos pessoais para Acucela, Alcon (C), Gyroscope Allergan Apellis, Bayer Bioeq/Formycon, CenterVue, Roche/Genentech, Geuder, Ivericbio, NightStarX, Novartis, Optos, Oxurion, Pixium Vision, Stealth BioTherapeutics, Zeiss e GRADE Reading Center. Thomas Ach reporta consultoria/pagamentos pessoais para Bayer, Apellis, Roche e Novartis.
Acknowledgements
Este trabalho foi financiado pela bolsa da Sociedade Alemã de Oftalmologia (DOG) para estudantes de doutorado (MW) e pelo NIH/NEI 1R01EY027948 (TA).
Materials
| Name | Company | Catalog Number | Comments |
| BatchStandardRetina plugin | n.a. | n.a. | n.a. |
| FIJI (Image J) | n.a. | n.a. | n.a. |
| Mark_Bscans_OCT plugin | n.a. | n.a. | n.a. |
| Microspft office | Microsoft | n.a. | n.a. |
| QAF_xml_reader plugin | n.a. | n.a. | n.a. |
| Register_OCT_2 plugin | n.a. | n.a. | n.a. |
| Spectralis | Heidelberg Engineering | n.a. | QAF extension |
| StandardRetina plugin | n.a. | n.a. | n.a. |
References
- Schmitz-Valckenberg, S., et al. Fundus autofluorescence imaging. Progress in Retinal and Eye Research. 81, 100893 (2021).
- Bermond, K., et al. Autofluorescent granules of the human retinal pigment epithelium: phenotypes, intracellular distribution, and age-related topography. Investigative Ophthalmology and Visual Science. 61 (5), 35 (2020).
- Bermond, K., et al. Autofluorescent organelles within the retinal pigment epithelium in human donor eyes with and without age-related macular degeneration. Investigative Ophthalmology and Visual Science. 63 (1), 23 (2022).
- Delori, F., et al. Quantitative measurements of autofluorescence with the scanning laser ophthalmoscope. Investigative Ophthalmology and Visual Science. 52 (13), 9379-9390 (2011).
- Fleckenstein, M., et al. Age-related macular degeneration. Nature Reviews Disease Primers. 7 (1), 31 (2021).
- Greenberg, J. P., et al. Quantitative fundus autofluorescence in healthy eyes. Investigative Ophthalmology and Visual Science. 54 (8), 5684-5693 (2013).
- Sparrow, J. R., Boulton, M. RPE lipofuscin and its role in retinal pathobiology. Experimental Eye Research. 80 (5), 595-606 (2005).
- vonder Emde, L., et al. Natural history of quantitative autofluorescence in intermediate age-related macular degeneration. Retina. 41 (4), 694-700 (2021).
- Reiter, G. S., et al. Longitudinal changes in quantitative autofluorescence during progression from intermediate to late age-related macular degeneration. Retina. 41 (6), 1236-1241 (2021).
- Gliem, M., et al. Quantitative fundus autofluorescence in early and intermediate age-related macular degeneration. JAMA Ophthalmology. 134 (7), 817-824 (2016).
- Hussain, R. M., Gregori, N. Z., Ciulla, T. A., Lam, B. L. Pharmacotherapy of retinal disease with visual cycle modulators. Expert Opinion on Pharmacotherapy. 19 (5), 471-481 (2018).
- Ammar, M. J., Hsu, J., Chiang, A., Ho, A. C., Regillo, C. D. Age-related macular degeneration therapy: a review. Current Opinion in Ophthalmology. 31 (3), 215-221 (2020).
- Ach, T., et al. Lipofuscin redistribution and loss accompanied by cytoskeletal stress in retinal pigment epithelium of eyes with age-related macular degeneration. Investigative Ophthalmology and Visual Science. 56 (5), 3242-3252 (2015).
- Zanzottera, E. C., Messinger, J. D., Ach, T., Smith, R. T., Curcio, C. A. Subducted and melanotic cells in advanced age-related macular degeneration are derived from retinal pigment epithelium. Investigative Ophthalmology and Visual Science. 56 (5), 3269-3278 (2015).
- Cao, D., et al. Hyperreflective foci, optical coherence tomography progression indicators in age-related macular degeneration, include transdifferentiated retinal pigment epithelium. Investigative Ophthalmology and Visual Science. 62 (10), 34 (2021).
- Zanzottera, E. C., et al. The Project MACULA retinal pigment epithelium grading system for histology and optical coherence tomography in age-related macular degeneration. Investigative Ophthalmology and Visual Science. 56 (5), 3253-3268 (2015).
- Sparrow, J. R., Duncker, T., Schuerch, K., Paavo, M., de Carvalho, d. R. L. Lessons learned from quantitative fundus autofluorescence. Progress in Retinal and Eye Research. 74, 100774 (2020).
- Schmitz-Valckenberg, S., et al. Correlation between the area of increased autofluorescence surrounding geographic atrophy and disease progression in patients with AMD. Investigative Ophthalmology and Visual Science. 47 (6), 2648-2654 (2006).
- Ach, T., Bermond, K. Autofluorescence of the human retinal pigment epithelium in normal aging and in age-related macular degeneration: histology and clinical correlation. Klinische Monatsblatter Fur Augenheilkunde. 236 (5), 672-681 (2017).
- Pollreisz, A., et al. Visualizing melanosomes, lipofuscin, and melanolipofuscin in human retinal pigment epithelium using serial block face scanning electron microscopy. Experimental Eye Research. 166, 131-139 (2018).
- Bernstein, P. S., et al. meso-zeaxanthin: The basic and clinical science underlying carotenoid-based nutritional interventions against ocular disease. Progress in Retinal and Eye Research. 50, 34-66 (2016).
- Göbel, A. P., Fleckenstein, M., Heeren, T. F. C., Holz, F. G., Schmitz-Valckenberg, S. In-vivo mapping of drusen by fundus autofluorescence and spectral-domain optical coherence tomography imaging. Graefe's Archive for Clinical and Experimental Ophthalmology. 254 (1), 59-67 (2016).
- Pfau, M., et al. Mesopic and dark-adapted two-color fundus-controlled perimetry in geographic atrophy secondary to age-related macular degeneration. Retina. 40 (1), 169-180 (2020).
- vonder Emde, L., et al. Mesopic and dark-adapted two-color fundus-controlled perimetry in choroidal neovascularization secondary to age-related macular degeneration. Translational Vision Science and Technology. 8 (1), 7 (2018).
- Aumann, S., Donner, S., Fischer, J., Müller, F. Optical coherence tomography (OCT): principle and technical realization. High Resolution Imaging in Microscopy and Ophthalmology: New Frontiers in Biomedical Optics. , 59-85 (2019).
- Schindelin, J., et al. FIJI: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Kleefeldt, N., et al. Quantitative fundus autofluorescence: advanced analysis tools. Translational Vision Science and Technology. 9 (8), 2 (2020).
- Hong, I. H., Jung, W. H., Lee, J. H., Chang, I. B. Macular pigment optical density in the Korean population: a cross sectional study. Journal of Korean Medical Science. 35 (5), e30 (2020).
- Putnam, C. M. Clinical imaging of macular pigment optical density and spatial distribution. Clinical and Experimental Optometry. 100 (4), 333-340 (2017).
- Zweifel, S. A., Spaide, R. F., Curcio, C. A., Malek, G., Imamura, Y. Reticular pseudodrusen are subretinal drusenoid deposits. Ophthalmology. 117 (2), 303-312 (2010).
- Curcio, C. A., et al. Subretinal drusenoid deposits in non-neovascular age-related macular degeneration: morphology, prevalence, topography, and biogenesis model. Retina. 33 (2), 265-276 (2013).
- Spaide, R. F. Outer retinal atrophy after regression of subretinal drusenoid deposits as a newly recognized form of late age-related macular degeneration. Retina. 33 (9), 1800-1808 (2013).
- Reiter, G. S. Influence of lens opacities and cataract severity on quantitative fundus autofluorescence as a secondary outcome of a randomized clinical trial. Scientific Reports. 11 (1), 12685 (2021).
- Gliem, M., et al. Quantitative fundus autofluorescence in pseudoxanthoma elasticum. Investigative Ophthalmology and Visual Science. 58 (14), 6159-6165 (2017).
- Burke, T. R., et al. Quantitative fundus autofluorescence in recessive Stargardt disease. Investigative Ophthalmology and Visual Science. 55 (5), 2841-2852 (2014).
- Armenti, S. T., Greenberg, J. P., Smith, R. T. Quantitative fundus autofluorescence for the evaluation of retinal diseases. Journal of Visualized Experiments. (109), 53577 (2016).
- Pröbster, C., et al. Quantitative fundus autofluorescence in the developing and maturing healthy eye. Translational Vision Science and Technology. 10 (2), 15 (2021).
- Duncker, T., et al. Quantitative fundus autofluorescence and optical coherence tomography in PRPH2/RDS- and ABCA4-associated disease exhibiting phenotypic overlap. Investigative Ophthalmology and Visual Science. 56 (5), 3159-3170 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved