בידוד דו-שלבי ללא תגים של מיטוכונדריה לשיפור גילוי וכימות חלבונים
In This Article
Summary
אנו מציגים פרוטוקול דו-שלבי לבידוד מיטוכונדריה באיכות גבוהה התואם לגילוי וכימות חלבונים בקנה מידה של פרוטאום. הפרוטוקול שלנו אינו דורש הנדסה גנטית ולכן מתאים לחקר מיטוכונדריה מכל תא ורקמות ראשוניים.
Abstract
רוב התהליכים הפיזיולוגיים והמחלות, החל מחילוף חומרים מרכזי ועד תגובה חיסונית לניוון עצבי, כרוכים במיטוכונדריה. הפרוטאום המיטוכונדריאלי מורכב מיותר מ-1,000 חלבונים, והשפע של כל אחד מהם יכול להשתנות באופן דינמי בתגובה לגירויים חיצוניים או במהלך התקדמות המחלה. במאמר זה אנו מתארים פרוטוקול לבידוד מיטוכונדריה באיכות גבוהה מתאים ראשוניים ומרקמות. ההליך הדו-שלבי כולל (1) הומוגניזציה מכנית וצנטריפוגה דיפרנציאלית לבידוד מיטוכונדריה גולמית, ו-(2) לכידה חיסונית ללא תגים של מיטוכונדריה כדי לבודד אברונים טהורים ולחסל מזהמים. חלבונים מיטוכונדריאליים מכל שלב טיהור מנותחים על ידי ספקטרומטריית מסות כמותית, ומחושבת תפוקת העשרה, המאפשרת גילוי של חלבונים מיטוכונדריאליים חדשים על ידי פרוטאומיקה חיסורית. הפרוטוקול שלנו מספק גישה רגישה ומקיפה לחקר תכולת המיטוכונדריה בשורות תאים, תאים ראשוניים ורקמות.
Introduction
מיטוכונדריה הם אברונים מורכבים ודינמיים המסוגלים לחוש ולהסתגל לצרכים המטבוליים של התא. מיטוכונדריה, המרכיב המרכזי במורכבות חילוף החומרים בתאים, פועלים כמרכזים מטבוליים שבהם מתכנסים תגובות מטבוליזם של פחמימות, חלבונים, שומנים, חומצות גרעין וקו-פקטורים1. הם משמשים גם כאברוני איתות למסלולים של התגובה החיסונית המולדת ובתגובה לשינויים ביונים ובמיני חמצן תגובתי 2,3. עד כה, כ-1,100 חלבונים מופו למיטוכונדריה 4,5,6, אך אנו יכולים להניח שנותרו עוד חלבונים רבים להתגלות, במיוחד אלה המתבטאים רק בסוגי תאים מסוימים או באופן ארעי בתנאי סביבה ספציפיים. פיתוח גישות חדשות לכימות שינויים בהרכב המיטוכונדריה במצבי עניין מטבוליים יגביר את הידע שלנו על אברונים אלה וידגיש דרכים טיפוליות חדשות להפרעות המאופיינות בתפקוד לקוי של המיטוכונדריה7.
נכון לעכשיו, קיימים פרוטוקולים שונים לבידוד מיטוכונדריה, עם תפוקות שונות ורמות טוהר שונות8. גישות מבוססות צנטריפוגה הן הפופולריות ביותר, בשל פשטותן ועלותן הנמוכה. למרות שהיא מתאימה לרוב היישומים, לצנטריפוגה דיפרנציאלית יש את החיסרון של השגת טוהר מיטוכונדריאלי נמוך יותר ודורשת כמויות גדולות של חומר מוצא כאשר משתמשים ביישומים מורכבים יותר מבוססי שיפוע צפיפות. בשנים האחרונות התפתחו שיטות חדשות לבידוד מיטוכונדריה, כגון לכידה חיסונית מבוססת תגיות ("MITO-IP")9 ומיון אברונים המופעלים על ידי פלואורסצנטיות10. למרות ששני ההליכים יכולים לייצר דגימות עם טוהר גבוה, הראשון דורש הנדסה גנטית כדי לתייג מיטוכונדריה לטיהור אהדה, מה שהופך את הפרוטוקולים לבלתי תואמים לחומר ראשוני מאורגניזמים שלא עברו שינוי או מתורמים אנושיים. בינתיים, האחרון תלוי בגישה לציטומטריית זרימה ומכשירי מיון. שילוב שיטות בידוד שונות מציע הבטחה ליצירת פרוטוקולים חזקים יותר וטוהר מוגבר.
כאן, אנו מציגים פרוטוקול חדש לבידוד מיטוכונדריה המבוסס על שילוב של שתי שיטות קיימות: (1) צנטריפוגה דיפרנציאלית לבידוד מקטע מיטוכונדריאלי גולמי, ו-(2) לכידה חיסונית ללא תגים של מיטוכונדריה עם חרוזים על-פאראמגנטיים הקשורים באופן קוולנטי לנוגדנים כנגד טרנסלוקז של קרום מיטוכונדריאלי חיצוני 22 (Tomm22)11, חלבון מיטוכונדריאלי חיצוני שנמצא בכל מקום (איור 1)). ההליך שאנו מתארים תואם לספקטרומטריית מסת חלבונים כמותית, ומכיוון שהוא נטול תגים ואינו דורש מניפולציה גנטית, ניתן ליישם אותו במגוון רחב של מודלים מחקריים, החל מקווי תאים, דרך נוזלי גוף ועד רקמות שלמות של בעלי חיים. יתר על כן, השימוש בשני שלבים בפרוטוקול מאפשר שימוש בפרוטאומיקה חיסורית 6,12 לגילוי חלבונים מיטוכונדריאליים חדשים ולחקר ביטוים.
Protocol
יש ללבוש כפפות בכל עת ולבצע צעדי תרבית תאים מתחת למכסה מנוע זרימה למינרית. התאים נשמרים באינקובטור של 37 מעלות צלזיוס עם 5% CO2. המחקר המוצג בפרוטוקול זה אושר ובוצע בהתאם להנחיות אוניברסיטת לוזאן ושוויץ לשימוש בבעלי חיים.
1. תרבית של קו תאי מקרופאג RAW264.7
- לגדל את המקרופאג' RAW264.7 של עכברים במדיום הנשר המעובד של דולבקו (DMEM) עם גלוקוז וגלוטמין גבוהים בתוספת סרום בקר עוברי 5% מומת חום (HI-FBS) ו-100 IU/מ"ל פניצילין ו-100 מיקרוגרם/מ"ל סטרפטומיצין (P/S).
הערה: כדי לבודד מיטוכונדריה, צלחת אחת בקוטר 15 ס"מ (בערך 70 x 107 תאים גולמיים 264.7) מספיקה. - שמור על תאי RAW264.7 בלוחיות תרבית רקמה. צפיפות זריעה ראשונית של 1 x 105 תאים / מ"ל מובילה לצלחת מפגש תוך 3 ימים. השתמש 25 מ"ל של תרחיף התא במדיה עבור צלחת 15 ס"מ. לתאי RAW264.7 יש קצב חלוקת תאים גבוה ויש לפצל אותם בתדירות גבוהה יותר מרוב קווי התאים.
- ניתוק תאי RAW264.7
- שאפו את המדיה ושטפו את התאים פעם אחת במי מלח חוצצי פוספט (PBS).
- לקבלת צלחת בקוטר 15 ס"מ, הוסיפו 8 מ"ל של חיץ דיסוציאציה גולמי חם (270 מ"מ אשלגן כלורי, 30 מ"מ נתרן ציטראט דיהידרט ב-H2O, סטרילי מסונן) ודגרו על התאים ב-37°C למשך 5 דקות.
- הוסף נפח שווה ערך של מדיה ללוחות (דילול 1:1 של חיץ הדיסוציאציה), ופיפטה כדי לנתק ולהפוך את התאים להומוגניים.
- מעבירים את מתלה התא לצינור חרוטי וצנטריפוגות את הצינור ב 300 x גרם למשך 3 דקות בטמפרטורת החדר.
- שאפו את הסופרנאטנט והשעו מחדש את הגלולה בנפח מתאים של מדיה (המתואר בשלב 1.1) לספירת תאים.
הערה: ניתן להשתמש בשיטות אחרות לניתוק תאי RAW264.7, כגון טריפסין או מגרד תאים. עם זאת, שיטות אלה קשות יותר על התאים ועלולות להוביל לקיטוב שלהם למקרופאגים דמויי M1 בימים שלאחר הניתוק.
2. בידוד ותרבית של מקרופאגים שמקורם במח עצם (BMDM)
הערה: הפרוטוקול המתואר כאן מיועד לעכבר יחיד וניתן להגדיל אותו עבור עכברים מרובים. פרוטוקולים מפורטים לבידוד ותרבות BMDM תוארו במקומות אחרים13,14.
- הקריבו עכבר C57BL/6 בן 8-12 שבועות עם מינון גבוה של CO2.
הערה: ניתן להשתמש בעכברים זכרים או נקבות. - רססו את העכבר באתנול 75% כדי לעקר אותו.
- נתחו ואספו את הירכיים, עצם הירך והטיביאס מהעכבר15.
- כדי לאסוף את מח העצם מן עצם הירך ואת tibias, להסיר את קצה מפרק הברך של שתי העצמות15. לשחזר מח עצם מן הירכיים על ידי הסרת acetabulum.
- מעבירים את העצמות לצינור חרוטי של 50 מ"ל עם 4 מ"ל של מדיה BMDM שנשמרת על קרח (DMEM עם גלוקוז גבוה וגלוטמין בתוספת 5% HI-FBS, P/S ו-10 mM HEPES).
הערה: חשוב לשמור את העצמות במדיה כדי למנוע התייבשות של מח העצם במהלך דיסקציה. - הוסף 4 מ"ל של PBS ו 4 מ"ל של מדיה BMDM חם בשתי בארות שונות של צלחת 6 בארות.
- מעבירים את העצמות ואת המדיה מצינור החרוטי 50 מ"ל לבאר ריקה של צלחת 6 בארות.
- באמצעות זוג מלקחיים, להעביר את העצמות PBS היטב כדי לשטוף אותם.
- מעבירים את העצמות לבאר המכילה מדיה BMDM חמה.
- צור חור בקוטר 1-2 מ"מ בתחתית שני צינורות 0.5 מ"ל עם המלקחיים והניחו אותם בצינור 1.5 מ"ל.
הערה: אין צורך להוסיף מדיה לצינור עבור שלב מהיר זה. - בכל צינור של 0.5 מ"ל, הניחו את עצם הירך, השוקה והירך באופן כזה שמח העצם של העצמות החשופות פונה לכיוון תחתית הצינורות.
- צנטריפוגה את הצינורות ב 13,000 x גרם במשך דקה אחת בטמפרטורת החדר כדי לאסוף את מח העצם ושאריות מדיה דרך החור של צינור 0.5 מ"ל לתוך צינור 1.5 מ"ל. השליכו את צינורות 0.5 מ"ל עם העצמות.
- להשעות מחדש את כדורי מח העצם במדיה BMDM ולהעביר צינור חרוטי 15 מ"ל.
- הוסף מדיית BMDM עד 10 מ"ל.
- מניחים מסננת תאים בגודל 40 מיקרומטר על צינור חרוטי בנפח 50 מ"ל ומסננים דרכו את תרחיף מח העצם.
- צנטריפוגה את המתלה המסונן ב 300 x גרם במשך 5 דקות בטמפרטורת החדר כדי לשחזר את התאים שלמים ולהסיר פסולת קטנה מן השעיית התא.
- הכינו 70 מ"ל של מדיית BMDM בתוספת 50 ננוגרם/מ"ל של גורם מגרה מושבת מקרופאגים (M-CSF).
- השהה מחדש את הגלולה ב -10 מ"ל של מדיית BMDM בתוספת M-CSF.
- הוסיפו 9 מ"ל של מדיית BMDM בתוספת M-CSF לכל אחת משבע צלחות פטרי בקוטר 10 ס"מ.
- צלחת 1 מ"ל של תאים (סביב 1 x 107 תאים) בכל אחד משבעת צלחות פטרי 10 ס"מ.
- הומוגניזציה של תרחיף התא בכל צלחת על ידי זילוף בזהירות למעלה ולמטה על הצלחת ולהעביר את הלוחות לאינקובטור.
- לאחר 3 ימים, יש להוסיף 5 מ"ל של מדיית BMDM חמה בתוספת 50 ננוגרם/מ"ל m-csf לכל צלחת.
- לאחר 3 ימים (יום 6, לאחר בידוד מח עצם), יש לוודא הידבקות והתמיינות של BMDM במיקרוסקופיה.
הערה: בשלב זה, ניתן להמשיך ישירות לבידוד מיטוכונדריה (שלב 3). לחילופין, ניתן להפעיל מחדש את ה-BMDM, מה שמאפשר לטפל בהם עם ציטוקינים ומולקולות קטנות. - ניתוק BMDMs
- שאפו את המדיה מכל צלחת והוסיפו 7 מ"ל של PBS קר בתוספת 5 mM ethylenediaminetetraacetic acid (EDTA).
- לדגור על התאים ב 4 ° C במשך 7-8 דקות.
- נתק את BMDMs על ידי זינוק זהיר למעלה ולמטה באמצעות פיפטה של 10 מ"ל.
- אחסן יחד את ה- BMDMs התלויים מחדש מכל שבעת הלוחות לצינור חרוטי יחיד של 50 מ"ל וצנטריפוגה במהירות של 300 x גרם למשך 3 דקות בטמפרטורת החדר.
- שאפו את הסופרנאטנט והשעו מחדש את התאים ב-40 מ"ל של מדיית BMDM חמה לספירת תאים.
הערה: בין 7-9 x 107 BMDM מתקבלים לכל עכבר. מומלץ לפחות 6 x 107 BMDM לבידוד מיטוכונדריה עבור פרוטאומיקה. - אם תרצה, צלחת ולטפל BMDMs בהתאם למטרת הניסוי. אם לא, המשך ישירות לשלב 3.3.
3. הכנת מקטע מיטוכונדריאלי גולמי על ידי צנטריפוגה דיפרנציאלית
הערה: בצע את כל שלבי הצנטריפוגה ב- 4 °C. דרושות שתי צנטריפוגות האחת עם רוטור מתנדנד ומתאמים לצינורות חרוטיים בעלי כוח צנטריפוגלי יחסי של לפחות 300 x גרם, והשנייה עם כוח צנטריפוגלי יחסי של לפחות 21,000 x g המתאים לצינורות 1.5 מ"ל. בעת שימוש בתאים דבקים, השתמש במגרד תאים.
- עבור תאים דבקים, לשאוף את המדיה ולהוסיף 10 מ"ל של PBS לכל צלחת 15 ס"מ.
הערה: גירוד תאים ב- PBS מאפשר לשטוף אותם בו זמנית. אם התאים כבר נמצאים בהשעיה, המשך ישירות לשלב 3.3. - נתקו את התאים באמצעות מגרד תאים ואגרו אותם בצינור חרוטי יחיד של 50 מ"ל. הומוגניזציה של תרחיף התא על ידי pipeting למעלה ולמטה.
הערה: ניתן לנתק תאים באמצעות מגרד תאים, מכיוון שזה מהיר יותר והם יעברו ליזה זמן קצר לאחר מכן. - עבור כל תנאי ניסוי, להעביר 5% מנפח תרחיף התא לצינור 1.5 מ"ל ולצנוח אותו ב 300 x גרם במשך 5 דקות בטמפרטורת החדר.
הערה: בעת שימוש בתאי תרחיף, הקפד לשטוף את התאים פעם אחת עם PBS לפני, כדי להסיר מזהמים אפשריים מהמדיה כגון FBS. - השליכו את הסופרנאטנט והשאירו את הגלולה על קרח.
הערה: זה ייצג את החלק "התא הכולל" עבור פרוטאומיקה. - צנטריפוגה את שאר הדגימות משלב 3.1 או 3.2 ב 300 x גרם במשך 5 דקות בטמפרטורת החדר.
- בצע את כל השלבים הבאים על קרח ובאמצעות מאגרים קרים כקרח.
- שאפו את הסופרנאטנט והשהו מחדש את גלולת התא ב-5 מ"ל של חיץ מיטוכונדריה קר כקרח (MB) (210 מילימטר מניטול, 70 מ"מ סוכרוז, 10 מ"מ HEPES/NaOH [pH 7.4] ו-1 מ"מ EDTA).
- לשחזר את התאים על ידי צנטריפוגה ב 300 x גרם במשך 5 דקות ב 4 °C.
- להשעות את גלולת התא ב 0.5 מ"ל של MB קר ולהעביר אותו צינור 1.5 מ"ל.
הערה: הליך זה מניב ריכוז תאים משוער של 1.5 x 10 8 תאי BMDM/מ"ל או 3 x 108 תאי RAW264.7/מ"ל. - באמצעות מזרק בנפח 1 מ"ל המצויד במחט של 25 גרם, ערכו הומוגניות לתרחיף התא על-ידי 30 מעברים דרך המחט (איור 1A).
- הוסף 1 מ"ל של MB קר לצינור וערבב על ידי היפוך. צנטריפוגה את תרחיף התא ההומוגני ב 2,000 x גרם למשך 5 דקות ב 4 ° C.
- מעבירים 1 מ"ל של הסופרנאטנט לצינור טרי של 1.5 מ"ל על קרח מבלי להפריע לכדורית התא. השהה מחדש את גלולת התא והומוגניזציה שלה שוב, כמו בשלב 3.7.
- אגרו את גלולת התא ההומוגנית ואת הסופרנאטנט משני השלבים הקודמים בצינור יחיד של 1.5 מ"ל וצנטריפוגה אותו ב 2,000 x גרם למשך 5 דקות ב 4 ° C.
הערה: בשלב זה, הגלולה מכילה בעיקר גרעינים ותאים לא שבורים והיא מושלכת. הסופרנאטנט מכיל פסולת תאית, ציטוזול ואברונים, כולל מיטוכונדריה (איור 1B). - מחלקים את הסופרנאטנט בין ארבעה צינורות של 1.5 מ"ל.
הערה: חלוקת הסופרנאטנט בין צינורות מרובים בשלב זה משפרת את הסרת המזהמים בשלבים הבאים. - הוסף MB כדי ליצור נפח סופי של 1 מ"ל בכל אחד מארבעת הצינורות. מערבבים על ידי היפוך וצנטריפוגה את הצינורות ב 13,000 x גרם במשך 10 דקות ב 4 ° C.
הערה: לאחר שלב זה, גלולה עם שתי שכבות גלויה. הגלולה התחתונה, המוצקה והחומה, מכילה מיטוכונדריה ונשמרת לטיהור נוסף (איור 1C). הגלולה העליונה, הרופפת, הלבנה מכילה מבנים תאיים אחרים וניתן להשליכה. - בצע שלב זה בזהירות. מוציאים את הסופרנאטנט עם כמה שיותר מהגלולה העליונה הלבנה. על ידי פיפטינג עדין על זה, ניתן להשעות מחדש את הגלולה הלבנה ולאחר מכן להשליך אותו, משאיר את הגלולה המיטוכונדריאלית החומה שלמה.
- שמור את אחד מארבעת הצינורות עם הגלולה המיטוכונדריאלית על קרח. זה מייצג את החלק "מיטוכונדריה גולמית" עבור פרוטאומיקה.
- אגרו יחד את שלושת הכדוריות האחרות בצינור של 1.5 מ"ל בנפח סופי של 1 מ"ל של MB.
4. טיהור מבוסס נוגדנים על-פאראמגנטיים של מיטוכונדריה
הערה: בצע את כל השלבים הבאים בחדר קר בטמפרטורה של 4°C.
- העבר 1 מ"ל של התכשיר המיטוכונדריאלי הגולמי משלב 3.18 לצינור חרוטי של 15 מ"ל והוסף 7 מ"ל של MB בתוספת 150 mM NaCl (MB + NaCl).
הערה: הוספת NaCl משפרת את קשירת הנוגדנים ומפחיתה קשירה לא ספציפית של המזהמים לחרוזים ולמיטוכונדריה. - הוסיפו 50 מיקרוליטר של חרוזי Tomm22 לתרחיף המיטוכונדריה הגולמי בנפח 8 מ"ל (איור 1D) ודגרו על הצינור במשך 15 דקות בטמפרטורה של 4°C על גלגל מסתובב במהירות נמוכה.
הערה: חרוזי Tomm22 קשורים באופן קוולנטי לנוגדנים חד-שבטיים Tomm22 המוגדלים בעכבר, יחד עם חרוזים על-פאראמגנטיים. - בינתיים, הניחו עמוד על המגנט.
- אזן את העמודה עם 8 מ"ל של MB + NaCl ומחק את הזרימה.
- לאחר הדגירה של 15 דקות ב -4 מעלות צלזיוס של הדגימה עם חרוזי Tomm22, העבירו את הדגימה לעמודה. מחק את הזרימה.
הערה: מיטוכונדריה יישארו מחוברים לחרוזים המגנטיים בעמוד (איור 1E). - שטף את העמודה שלוש פעמים עם 8 מ"ל של MB + NaCl.
- הסר את העמוד מהמגנט ומקם אותו בצינור חרוטי של 15 מ"ל.
- הצהירו את המיטוכונדריה על ידי הוספת 1.5 מ"ל של MB + NaCl לעמודה, והפעילו בוכנה באופן מיידי כדי להאיר את המיטוכונדריה המטוהרים לתוך הצינור.
- מעבירים את המיטוכונדריה המדוללת לצינור בנפח 1.5 מ"ל וצנטריפוגות אותו בטמפרטורה של 21,000 x גרם למשך 10 דקות ב-4°C.
הערה: תיווצר גלולה חומה. זה מכיל את המיטוכונדריה המבודדת וחלק מהחרוזים המצומדים לנוגדנים (איור 1F). - מוציאים בזהירות את הסופרנאטנט מהכדור. הגלולה מייצגת את החלק "המיטוכונדריה הטהורה" עבור פרוטאומיקה. גלולה זו יחד עם הכדוריות משלבים 3.4 ו-3.17 ניתנות לאחסון בטמפרטורה של -20°C ומוכנות ליישומים במורד הזרם.
Representative Results
שלוש דגימות עם דרגות הולכות וגדלות של טוהר מיטוכונדריה נוצרות בפרוטוקול הנוכחי: סך כל התאים, מיטוכונדריה גולמית ("מיטו-גולמי") ומיטוכונדריה טהורה ("מיטו-טהור") (איור 1). תיקפנו את טיהור המיטוכונדריה מקו תאי המקרופאג RAW264.7 על-ידי העמסת כמויות חלבון שוות מכל חלק על ג'ל ואימונובלוטינג, ומצאנו כי סינתאז הציטראט המיטוכונדריאלי (Cs) הועשר בכל שלב טיהור; בינתיים, חלבונים מהציטוזול (GAPDH), מממברנת הפלזמה (Na/K ATPase), הגרעין (Lamin B), הליזוזומים (Lamp1) והרשתית האנדופלסמית (ER) (Pdi) נעלמו בהדרגה (איור 2A). תוצאות דומות התקבלו באמצעות BMDM. לאימות נוסף של הטוהר והשלמות של המיטוכונדריה המבודדת, בוצע מיקרוסקופ אלקטרונים על החלק המיטוכונדריאלי הטהור. צפינו במיטוכונדריה עם צורה אליפסה קלאסית וקריסטות שלמות מוקפות בחלקיקים צפופים אלקטרונים המתאימים לחרוזים מצופים נוגדנים (איור 2B). לכן, ניתן להסיק כי הפרוטוקול שלנו מעשיר מיטוכונדריה, מדלדל רכיבים תאיים אחרים ושומר על שלמות המבנה של המיטוכונדריה.
לאחר מכן, בוצע ניתוח פרוטאום של כל שבר באמצעות כרומטוגרפיה נוזלית המצומדת לספקטרומטריית מסות (LC/MS). סה"כ זוהו 6,248 חלבונים בתמצית מכלל התאים, 907 מהם סומנו בעבר כמיטוכונדריה במלאי מיטוקרטה3.05. לאחר סינון חלבונים בעלי סף של לפחות שני פפטידים ייחודיים, חישבנו ציון העשרה לכל חלבון בכל דגימה בהתבסס על עוצמתו בהשוואה לכלל התאים. לאחר מכן הקצינו את החלבונים לשבעה תאים תת-תאיים עיקריים: מיטוכונדריה, מיון, ליזוזומים, מנגנון גולג'י, שלד, גרעין וציטוזול, תוך שימוש באונטולוגיה גנטית (GO)16,17 ובמיטוקרטה3.05 כסימוכין. חשוב לציין שנצפתה העשרה ממוצעת של יותר מפי 10 ויותר מפי 20 עבור חלבונים מיטוכונדריאליים גולמיים וטהורים, בהתאמה (איור 2C). לעומת זאת, רכיבים של ששת תאי התא האחרים שנותחו התרוקנו במהלך הליך הטיהור. יש לציין במיוחד כי בחלק המיטוכונדריה הגולמי נצפתה העשרה חולפת עבור ER וחלבונים ליזוזומליים, שני סוגים של חלבונים מזהמים המופיעים לעתים קרובות בעקבות פרוטוקולי צנטריפוגה דיפרנציאליים18. ייתכן שהדבר נבע מאינטראקציות אברון-אברון ומקדמי שיקוע דומים, במיוחד עבור ליזוזומים, הנמצאים בשפע רב במקרופאגים19. בעוד ששניהם התרוקנו ברובם לאחר לכידת מערכת החיסון, זיהינו אות קטן לחלבונים מאתרי המגע בין המיטוכונדריה למיטוכונדריה בחלק המיטו-טהור.
לאחר מכן השווינו ישירות את שפע החלבונים מכלל התאים ומדגימות מיטו-טהורות, וצפינו בשתי אוכלוסיות נפרדות, המתאימות לחלבונים מיטוכונדריאליים ולא מיטוכונדריאליים (איור 2D). בעוד שהרוב המכריע של חלבוני מיטוקרטה התקבצו יחד, מצאנו כמה (<5%) שהתקבצו עם חלבונים שאינם מיטוקרטה. חלבונים אלה עשויים לייצג (1) חלבונים ציטוסוליים המקיימים אינטראקציה עם מיטוכונדריה (קטגוריה חדשה המתוארת בגרסה 3.0 של מיטוקרטה), (2) חלבונים בעלי מיקום כפול, או (3) חלבונים בעלי הערות שגויות. לעומת זאת, מצאנו כמה מקרים של חלבונים שאינם מיטוקרטה מתקבצים עם חלבונים מיטוכונדריאליים. בעוד חלבונים כאלה עשויים לייצג מזהמים של הליך הבידוד, הם עשויים גם לייצג חלבונים שלא סווגו בעבר כנמצאים במיטוכונדריה.
כדי לחקור סוג חדש זה של חלבונים מיטוכונדריאליים פוטנציאליים, נעשה שימוש בפרוטאומיקה מופחתת, גישה שהוכיחה את עצמה כשימושית לגילוי פרוטאומים אברונים, כולל מיטוכונדריה 6,12. פרוטאומיקה חיסורית מניחה שהמיטוכונדריה צריכים להיות מועשרים במהלך שלבי הטיהור, והמזהמים צריכים להתרוקן6. לדוגמה, בעוד שמזהמים עשויים להצטבר במהלך צנטריפוגה דיפרנציאלית (למשל, בשל תכונות שיקוע דומות) או במהלך לכידה חיסונית (למשל, עקב קשירת נוגדנים לא ספציפיים), רק חלבונים מיטוכונדריאליים בתום לב צריכים להצטבר באופן משמעותי בשניהם. כך ניתן לסנן חלבונים שנמצאו בחלק המיטוכונדריה הטהור אך הראו דפוסי העשרה לא עקביים. בדוגמה הנוכחית עם תאי RAW264.7, על ידי קביעת סף לפפטידים ייחודיים של ≥1 עבור דגימות מיטו-גולמי ומיטו-טהור, ושימוש בספי העשרה מחמירים, הצלחנו לחדד את רשימת הפרוטאומים המיטוכונדריאליים שנמצאו מ-1,127 חלבונים שנמצאו בתחילה בחלק המיטוכונדריאלי הגולמי לאחר צנטריפוגה דיפרנציאלית, עד ל-481 חלבונים לאחר סבב הטיהור השני באמצעות Tomm22. המספר המופחת של חלבוני מיטוקרטה במקטע המיטו-טהור משקף את החומרה הגבוהה המיושמת לבחירה. באופן מעניין, 70 מהחלבונים שנמצאים בחלק המיטו-טהור לא היו נוכחים במלאי של MitoCarta3.0 (איור 3A, B). חלבונים אחרונים אלה עשויים לייצג חלבונים מועמדים מיטוכונדריאליים פוטנציאליים חדשים, אשר עשויים לבוא לידי ביטוי רק בקו תאי המקרופאגים RAW264.7 ובתאים קשורים, ואשר ראויים לחקירה נוספת.
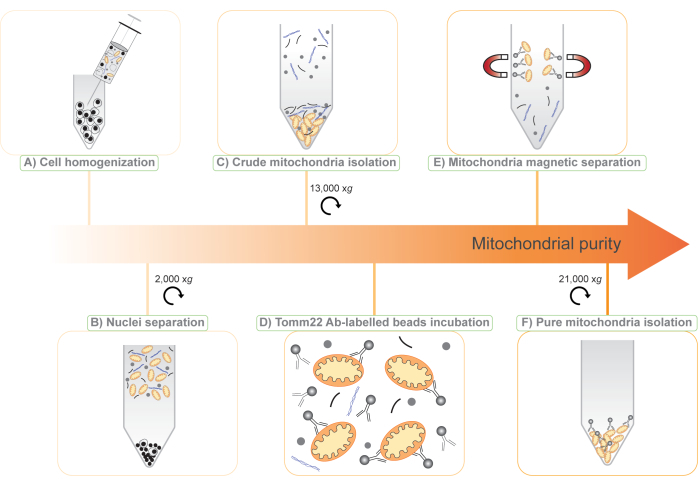
איור 1: איור של פרוטוקול בידוד מיטוכונדריה דו-שלבי ללא תגים. (A) תרחיף התא מופרע דרך מחט של 25 גרם. (B) גרעינים ותאים שלמים מופרדים באמצעות צנטריפוגה בגודל 2,000 x גרם והסופרנאטנט נשמר. (C) מיטוכונדריה גולמית מבודדת על ידי צנטריפוגה דיפרנציאלית של הסופרנאטנט ב-13,000 x גרם (מיטו-גולמי). (D) מיטוכונדריה גולמיים מודגרים לאחר מכן עם נוגדנים Tomm22 (Ab) הקשורים באופן קוולנטי לחרוזים על-פאראמגנטיים. (E) קומפלקסי הנוגדנים-חרוזים של המיטוכונדריה-Tomm22 מופרדים ממזהמים באמצעות עמודים מגנטיים ומופלטים. (F) מיטוכונדריה טהורים נאספים ומרוכזים על ידי צנטריפוגה (מיטו-טהורה). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
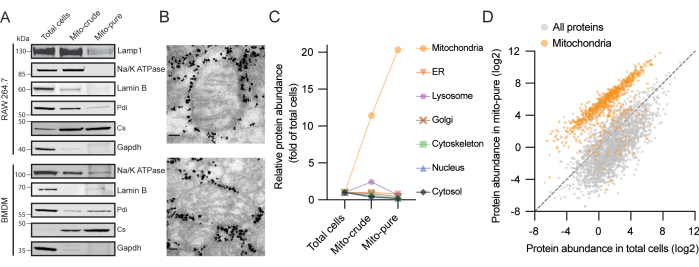
איור 2. תוצאות מייצגות של בידוד מיטוכונדריה משני מקורות מקרופאגים. (A) ניתוח אימונובלוט חלבוני של תאי RAW264.7 (למעלה) ו-BMDM (למטה) באמצעות נוגדנים לסינתאז ציטראט מיטוכונדריאלי (Cs - מיטוכונדריה), גליצראלדהיד 3-פוספט דהידרוגנאז (Gapdh - ציטוזול), משאבת נתרן-אשלגן (Na/K ATPase - קרום פלזמה), Lamin B (Lamin B - גרעין), חלבון קרום ליזוזומלי 1 (Lamp1 - ליזוזום) וחלבון דיסולפיד-איזומראז (Pdi - ER). (B) מיקרוסקופ אלקטרונים של מיטוכונדריה מטוהרים מתאי RAW264.7. חלקיקים בצפיפות גבוהה סביב המיטוכונדריה מתאימים לחרוזי Tomm22 שממשיכים עם דגימות מיטו-טהורות לאחר יציאה מהעמודות. פסי קנה מידה: 80 ננומטר. (C) ציוני העשרה בכל התאים, מיטו-גולמי ומיטו-טהור משבעה תאים בתאי RAW264.7. MitoCarta3.0 ו-GO שימשו לביאור חלבונים והציונים הממוצעים מיוצגים. קיצור: ER = רשתית אנדופלסמית. (D) ערכי שפע חלבונים (riBAQ) עבור חלבונים בסך הכל תאים ודגימות מיטו-טהורות מתאי RAW264.7. חלבוני MitoCarta3.0 מוצגים בכתום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
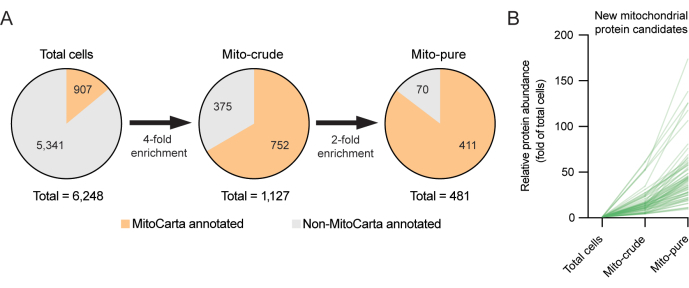
איור 3. גילוי חלבונים מיטוכונדריאליים חדשים באמצעות פרוטאומיקה חיסורית. (A) אסטרטגיית פרוטאומיקה חיסורית לגילוי חלבונים מיטוכונדריאליים חדשים. ערכי סף גבוהים של בחירה (4x ו- 2x) מוחלים כדי למזער את הבחירה בתוצאות חיוביות שגויות. (B) תפוקת העשרה (קפל מסך התאים) של חלבונים מועמדים מיטוכונדריאליים חדשים שלא צוינו קודם לכן במלאי MitoCarta3.0. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
שילבנו צנטריפוגה דיפרנציאלית ולכידת חיסון כדי להשיג טוהר משופר לבידוד מיטוכונדריה. ההליך שלנו מאפשר גישה לחומר ראשוני לזיהוי ואפיון חלבונים מיטוכונדריאליים חדשים. הפרוטוקול פשוט וחזק, וניתן ליישם אותו על קווי תאים, תאים ראשוניים ורקמות ללא צורך בשינוי גנטי. תיקפנו את הפרוטוקול שלנו על ידי ניתוחי אימונובלוטיקה ופרוטאומיקה על דגימות שנלקחו בשלבים שונים לאורך תהליך הטיהור.
בהשוואה לשיטות בידוד בודדות, השילוב של שלבי העשרה בעלי אופי שונה - כאן, צנטריפוגה ותיוג חיסוני - מייצר פרוטוקול חזק יותר לבידוד מיטוכונדריה. הסיבה לכך היא שבעוד חלבונים מיטוכונדריאליים יועשרו בשני הטיהורים, לא סביר שגם מזהמים יועשרו לאחר שני שלבי ההעשרה. למרות טוהר מיטוכונדריאלי גבוה יכול להיות מושג גם על ידי צפיפות הדרגתית ultracentrifugation, גישה זו דורשת כמות גדולה של חומר מוצא וגישה אולטרה צנטריפוגה. לבסוף, בניגוד לשיטות עדכניות המבוססות על בידוד מיטוכונדריאלי מבוסס תגים20, הגישה שלנו אינה דורשת שינוי גנטי של הדגימה, מה שהופך אותה מתאימה לחומר ראשוני מכל מקור שהוא.
כמה שיקולים טכניים וביולוגיים צריכים להילקח בחשבון בתכנון הניסוי בעת יישום הפרוטוקול שלנו. (1) כמות חומר המוצא היא קריטית על מנת לקבל חומר מספיק. באופן בלתי נמנע, מספר קטן של מיטוכונדריה יאבד במהלך הומוגניזציה (שלב 3.10), מכיוון שלא כל התאים עוברים ליזה, או במהלך שטיפת שלושת הטורים (שלב 4.6). בעוד שהפרוטוקול שלנו מתמקד בטוהר על פני יבול, יעילות בידוד המיטוכונדריה, ומכאן התפוקה שלהם, לא נמדדה או עברה אופטימיזציה. שימוש ביותר חרוזי Tomm22 ויותר עמודות צפוי להגדיל את תפוקת התאוששות המיטוכונדריה. יחד עם זאת, אופטימיזציה יסודית של שלב ההומוגניזציה יכולה גם להוביל לשיפור התשואה במיטוכונדריה. פרוטוקול זה ומספרי התאים הראשוניים שאנו מדווחים עליהם כאן עבור תאי RAW264.7 ו- BMDM מתאימים לפרוטאומיקה וניתן להתאים אותם ליישומים אחרים. במקרה של BMDM ראשוניים, מצאנו כי עכבר אחד היה מספיק עבור שכפול אחד. במידת הצורך, ניתן להרחיב את ההליך כדי לבודד BMDMs מבעלי חיים מרובים, אשר לאחר מכן ניתן לאגד כדי לקבל מספיק חומר. ניתן למטב את מספר התא בהתאם לסוג התא, גודלו ותכולת המיטוכונדריה שלו. (2) Tomm22 מבוטא על מיטוכונדריה מכל סוגי התאים והרקמות21אך רמת הביטוי שלו עשויה להשתנות., לכן, כאשר מתכננים ניסוי להשוואת תנאים שונים, חשוב לוודא שרמות הביטוי של Tomm22 דומות. יתר על כן, בשל הביטוי הנפוץ של Tomm22, לא ניתן לחקור חלבונים מיטוכונדריאליים ספציפיים מסוג תא בתוך רקמות מורכבות. (3) הזמן הדרוש ליצירת מיטוכונדריה טהורה (בסביבות 2.5 שעות) אינו עולה בקנה אחד עם מחקר של אירועים חולפים, כגון שינויים בפרופילים מטבוליים. במקרה זה, אנו ממליצים על לכידה חיסונית ישירה מבוססת תגים9מה שמאפשר גם לחקור מיטוכונדריה ספציפית לסוג התא., in vivo20. (4) למרות שמחקרים על מיטוכונדריה מבודדים שהתקבלו באמצעות חרוזים המסומנים בנוגדנים Tomm22 בלבד הראו פעילות בבדיקות תפקודיות11נותר לקבוע אם מיטוכונדריה הנוצרים באמצעות הפרוטוקול שלנו תואמים לבדיקות מבוססות פעילות במורד הזרם., צביעת מיטוכונדריה או טטרמתילרודאמין מתיל אסטר פרכלורט (TMRM), או מדידות רספירומטריה, הן גישות פוטנציאליות לכימות הפונקציונליות של מיטוכונדריה מבודדת22. (5) לאחר הוצאת הדגימה "מיטו-טהורה" מהעמודה, חלק מחרוזי Tomm22 יהיו נוכחים במקטע המיטוכונדריה הטהור (איור 2B). אמנם לא ראינו הפרעה לעיכול טריפסין ולספקטרומטריית מסת חלבונים, אך יש לקחת בחשבון את נוכחותם של חרוזים אלה ואת האימונוגלובולינים ביישומים אחרים במורד הזרם. נוגדן Tomm22 הוא נוגדן חד שבטי המיוצר בעכברים23ולכן חשוב לזכור כי, בעת שימוש נוגדנים משניים נגד עכברים immunoblotting, זה ייצור להקות לא ספציפיות בגודל של שרשראות אימונוגלובולינים., (6) הומוגניזציה מלאה של תרחיף התא היא המפתח לבידוד מוצלח של מיטוכונדריה. כאן, אנו משתמשים מזרק עם מחט 25 G כדי lyse הן RAW264.7 תאים BMDM. עם זאת, בהתאם לסוג התא וגודלו, שיטות הומוגניזציה מכניות אחרות, כגון שימוש בהומוגנייזר Dounce, או גישות מבוקרות יותר כמו התקני הומוגנייזר תא, עשויות להיות מתאימות יותר. ניתן לשקול גם שיטות הומוגניזציה לא מכניות, כגון סוניקציה עדינה. גישות הומוגניזציה של רקמות נדונות עוד יותר במחקרים אחרים24,25. (7) למרות שתיקוף על ידי אימונובלוטינג היא השיטה הפשוטה והזולה ביותר, התוצאות שלה לא תמיד עשויות להיות מתואמות עם שינויים ברמת האברון כולו. לכן אנו ממליצים להשתמש בפרוטאומיקה כדי לאמת באופן מלא את ההעשרה או הדלדול של מיטוכונדריה ואברונים אחרים, בהתאמה.
פרוטוקול טיהור המיטוכונדריה הדו-שלבי המתואר כאן אפשר לנו לייצר דגימות רציפות עם טוהר מיטוכונדריאלי הולך וגדל, וזה אפשר לנו לגלות מועמדים חדשים לחלבון מיטוכונדריאלי באמצעות פרוטאומיקה12 חיסורית. לצורך הניתוח שלנו, אנו משתמשים בערכי סף מחמירים כדי לבחור חלבונים מיטוכונדריאליים מועשרים באופן משמעותי, ואף על פי שזה עלול להיכשל בזיהוי כמה חלבונים מיטוכונדריאליים ידועים (איור 3A), שיעור החיוביים הכוזבים לגילוי חלבונים מיטוכונדריאליים חדשים יורד. עם זאת, חשוב להדגיש כי כל חלבון מועמד המתגלה על ידי הפרוטוקול שלנו חייב להיות מאומת באמצעות גישות אורתוגונליות. אנו ממליצים על תיוג GFP מסוף קרבוקסי או על שימוש בנוגדנים כנגד החלבון האנדוגני כדי לאמת את הקשר עם מיטוכונדריה באופן מיקרוסקופי או על ידי בדיקות הגנה מפני פרוטאזות.
היישום הישיר של השיטה שלנו במקרה של תאים ורקמות שלא שונו מציע כלי רב עוצמה לחקור כיצד מיטוכונדריה משתנים ומסתגלים לסביבתם בתנאים בריאים ומחלות. יישום הפרוטוקול שלנו על קווי תאים, מודלים של מחלות בעלי חיים, נוזלים אנושיים ואפילו ביופסיות מניתוח עשוי להיות שימושי במיוחד כדי לשפר את ההבנה שלנו של מיטוכונדריה וההפרעות הקשורות אליהם.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים ל-Manfredo Quadroni, למתקן לניתוח חלבונים ולמתקן למיקרוסקופיית אלקטרונים באוניברסיטת לוזאן על עזרתם. אנו מודים גם ל- H.G. Sprenger, K. Maundrell ולחברי מעבדת Jourdain על הייעוץ והמשוב על כתב היד. עבודה זו נתמכה על ידי קרן Pierre-Mercier pour la Science והקרן הלאומית למדע של שווייץ (מענק פרויקט 310030_200796).
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD Plastipal | 309628 | |
| 25 G Needle | BD Microlance | 300400 | |
| 40 µm cell strainer | Corning | 352340 | |
| Anti-TOM22 Microbeads, mouse | Miltenyi Biotec | 130-127-693 | |
| Cell scraper | FisherScientific | 11577692 | |
| DMEM, high glucose, GlutaMAX | ThermoFisher | 31966 | |
| Ethylenediaminetetraacetic acid | FisherScientific | BP-120-1 | |
| Fetal bovine serum | Gibco | 10270 | |
| HEPES | BioConcept | 5-31F00-H | |
| LS columns and plungers | Miltenyi Biotec | 130-042-401 | |
| Macrophage colony-stimulating factor | Immunotools | 12343115 | |
| Mannitol | Sigma | M4125 | |
| Sodium chloride | Sigma | 71380 | |
| Sucrose | Sigma | S1888 | |
| Penicillin/Streptomycin | BioConcept | 4-01F00-H | |
| Petri dishes | Corning | BH93B-102 | |
| Phosphate-buffered saline 10X | Eurobio Scientific | CS3PBS01-01 | |
| QuadroMACS Separator | Miltenyi Biotec | 130-090-976 | |
| Vi-CELL BLU Cell Viability Analyzer | Beckman Coulter | C19196 |
References
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- West, A. P., Shadel, G. S., Ghosh, S. Mitochondria in innate immune responses. Nature Reviews Immunology. 11 (6), 389-402 (2011).
- Chakrabarty, R. P., Chandel, N. S. Mitochondria as signaling organelles control mammalian stem cell fate. Cell Stem Cell. 28 (3), 394-408 (2021).
- Morgenstern, M., et al. Quantitative high-confidence human mitochondrial proteome and its dynamics in cellular context. Cell Metabolism. 33 (12), 2464-2483 (2021).
- Rath, S., et al. MitoCarta3.0: an updated mitochondrial proteome now with sub-organelle localization and pathway annotations. Nucleic Acids Research. 49, D1541-D1547 (2021).
- Pagliarini, D. J., et al. A mitochondrial protein compendium elucidates complex I disease biology. Cell. 134 (1), 112-123 (2008).
- Diaz-Vegas, A., et al. Is mitochondrial dysfunction a common root of noncommunicable chronic diseases. Endocrine Reviews. 41 (3), 005 (2020).
- Bury, A. G., Vincent, A. E., Turnbull, D. M., Actis, P., Hudson, G. Mitochondrial isolation: when size matters. Wellcome Open Research. 5, 226 (2020).
- Chen, W. W., Freinkman, E., Sabatini, D. M. Rapid immunopurification of mitochondria for metabolite profiling and absolute quantification of matrix metabolites. Nature Protocols. 12 (10), 2215-2231 (2017).
- Daniele, J. R., Heydari, K., Arriaga, E. A., Dillin, A. Identification and characterization of mitochondrial subtypes in Caenorhabditis elegans via analysis of individual mitochondria by flow cytometry. Analytical Chemistry. 88 (12), 6309-6316 (2016).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PLoS One. 8 (12), e82392 (2013).
- Yates, J. R., Gilchrist, A., Howell, K. E., Bergeron, J. J. M. Proteomics of organelles and large cellular structures. Nature Reviews Molecular Cell Biology. 6 (9), 702-714 (2005).
- Trouplin, V., et al. marrow-derived macrophage production. Journal of Visualized Experiments. (81), e50966 (2013).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. Journal of Visualized Experiments. (76), e50323 (2013).
- Toda, G., Yamauchi, T., Kadowaki, T., Ueki, K. Preparation and culture of bone marrow-derived macrophages from mice for functional analysis. STAR Protocols. 2 (1), 100246 (2020).
- Gene Ontology Consortium. The Gene Ontology resource: enriching a GOld mine. Nucleic Acids Research. 49, D325-D334 (2021).
- Ashburner, M., et al. Gene ontology: tool for the unification of biology. The Gene Ontology Consortium. Nature Genetics. 25 (1), 25-29 (2000).
- Hartwig, S., et al. A critical comparison between two classical and a kit-based method for mitochondria isolation. Proteomics. 9 (11), 3209-3214 (2009).
- Delamarre, L., Pack, M., Chang, H., Mellman, I., Trombetta, E. S. Differential lysosomal proteolysis in antigen-presenting cells determines antigen fate. Science. 307 (5715), 1630-1634 (2005).
- Bayraktar, E. C., et al. MITO-Tag mice enable rapid isolation and multimodal profiling of mitochondria from specific cell types in vivo. Proceedings of the National Academy of Sciences. 116 (1), 303-312 (2019).
- Nusinow, D. P., et al. Quantitative proteomics of the cancer cell line encyclopedia. Cell. 180 (2), 387-402 (2020).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Hornig-Do, H. T., et al. Isolation of functional pure mitochondria by superparamagnetic microbeads. Analytical Biochemistry. 389 (1), 1-5 (2009).
- Liao, P. C., Bergamini, C., Fato, R., Pon, L. A., Pallotti, F. Isolation of mitochondria from cells and tissues. Methods in Cell Biology. 155, 3-31 (2020).
- Lanza, I. R., Nair, K. S. Functional assessment of isolated mitochondria in vitro. Methods in Enzymology. 457, 349-372 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved