הרכבה והפעלה של במת קירור כדי לשתק C. elegans על צלחות התרבות שלהם
In This Article
Summary
מאמר זה מתאר פרוטוקולים לבנייה והפעלה של שלב קירור כדי לשתק C. elegans על לוחות הגידול המקוריים שלהם בהמוניהם.
Abstract
גישות מיקרוסקופיות in vivo ברזולוציה גבוהה יכולות לחשוף מידע עדין ופרטים קטנים בתוך חיית המודל Caenorhabditis elegans (C. elegans), אך דורשות השתקה חזקה של בעלי חיים כדי למנוע טשטוש תנועה בתמונות. למרבה הצער, רוב טכניקות האימוביליזציה הנוכחיות דורשות מאמץ ידני משמעותי, מה שהופך הדמיה ברזולוציה גבוהה לתפוקה נמוכה. אימוביליזציה של C. elegans מפושטת מאוד על ידי שימוש בגישת קירור שיכולה בקלות לשתק אוכלוסיות שלמות ישירות על לוחות הגידול שלהם. שלב הקירור יכול לבסס ולשמור על טווח רחב של טמפרטורות עם פיזור אחיד על צלחת הגידול. במאמר זה מתועד כל תהליך בניית שלב הקירור. המטרה היא שחוקר טיפוסי יוכל לבנות שלב קירור תפעולי במעבדה שלו בהתאם לפרוטוקול זה ללא קושי. מוצג ניצול שלב הקירור בעקבות שלושה פרוטוקולים, ולכל פרוטוקול יתרונות לניסויים שונים. כמו כן מוצגת דוגמה לפרופיל קירור של השלב כשהוא מתקרב לטמפרטורה הסופית שלו וכמה עצות מועילות בשימוש באימוביליזציה של קירור.
Introduction
מיקרוסקופ אופטי ברזולוציה גבוהה מספק כלי חיוני לחקר מבנים ביולוגיים in vivo ברמה התת-תאית. מחקרים ביולוגיים רבים דורשים דימות ברזולוציה תת-מיקרונית כדי לפתור פרטים אנטומיים עדינים, כולל מורפולוגיה של נוירונים1,2, מבנה הממברנה3,4 ולוקליזציה של חלבונים 5,6. תמונה ברזולוציה גבוהה דורשת זמן חשיפה של מספר אלפיות שנייה עד שניות, בהתאם לאופן ההדמיה ולבדיקה 7,8. כדי להשיג תוצאות אופטימליות, חיוני לתכנן בזהירות ולבצע ניסויים מבוססי מיקרוסקופיה. חיוני למאמץ זה הוא שיטת הכנה יעילה לבעלי חיים המאפשרת הדמיה ברזולוציה גבוהה.
הנמטודה C. elegans היא אורגניזם מודל נפוץ לחקר תהליכים ביולוגיים רבים9. בעל חיים קטן זה מעובד בדרך כלל על לוחות אגר בינוניים לגידול נמטודות (NGM), והם מתרבים במהירות על ידי הפריה עצמית, מה שהופך אותם מתאימים היטב למחקרים בקנה מידה גדול. השקיפות שלהם ומגוון רחב של טכניקות תיוג מאפשרים הדמיה פשוטה של האנטומיה הפנימית שלהם10,11. המבנים העדינים ב-C. elegans אידיאליים לחקר תהליכים ביולוגיים ברמה התת-תאית, כגון התחדשות נוירונים 12, ניוון נוירונים13 וחלוקת תאים14. מחקרים כאלה מחייבים הדמיה ברזולוציה תת-מיקרונית והשתקה חזקה מספיק של בעלי חיים כדי למנוע טשטוש תמונה. אימוביליזציה חזקה חיונית במיוחד עבור טכניקות המערבות תמונות מרובות במרחב או בזמן, כגון ערימות תמונות תלת-ממדיות (כלומר, ערימות z) והדמיית קיטועי זמן. כל תזוזה של בעלי חיים בין החשיפות יכולה לטשטש את התוצאה. עבור C. elegans, אימוביליזציה חזקה כוללת בדרך כלל מניפולציה ידנית של בעלי חיים בודדים והרכבתם על שקופיות עם חומר הרדמה15,16. הליכים עתירי זמן ועבודה אלה מקשים מאוד על ניסויים בקנה מידה גדול. אסטרטגיית אימוביליזציה שבה בעלי חיים משותקים באופן ישיר והפיך על לוחות הגידול המקוריים שלהם יכולה לאפשר הדמיה ברזולוציה גבוהה בתפוקה גבוהה.
קירור אימוביליזציה של C. elegans הוכח במספר מחקרים, אך אינו בשימוש נרחב. זה בדרך כלל בשילוב עם מכשיר microfluidic כדי לרסן עוד יותר בעלי חיים17,18,19. עם זאת, התקנים מיקרופלואידים הם מורכבים, דורשים הכשרה מבצעית משמעותית, ולא ניתן לשלב אותם בקלות עם זרימות עבודה טיפוסיות של גידול מוצק של ניסויי C. elegans. לפיכך, מיקרופלואידיקה אינה בשימוש נרחב עבור אימוביליזציה של C. elegans. מוצג כאן, יחד עם פרסום20 האחרון של מעבדת צ'ונג, הצגת גישה חדשה של אימוביליזציה של קירור באמצעות שלב קירור תרמואלקטרי (איור 1) כדי לטפל בחסרונות האלה. בשלב הקירור, ניתן לקרר צלחת גידול פוליסטירן טיפוסית בקוטר 60 מ"מ לכל טמפרטורת יעד (T set) בין -8°C לטמפרטורת החדר. גישה זו של שלב הקירור יכולה בקלות ובאופן הפיך לשתק אוכלוסיית בעלי חיים שלמה במאמץ משתמש מינימלי, ולבטל 98% מזמן העיבוד של בעלי החיים20.
להלן מתוארים ההליכים לבניית שלב קירור מאפס. למעט עיבוד שבבי של חלקים והדפסה תלת מימדית, ההליך כולו צפוי להימשך 4 שעות ללא צורך בכלים מיוחדים או מומחיות. לאחר מכן, מתוארות שלוש אסטרטגיות קירור שונות עם קצבי קירור משתנים ומאמצי המשתמש לשתק C. elegans במיקרוסקופ זקוף טיפוסי. האסטרטגיה המועדפת עשויה להיות תלויה ביישום המשתמש. הפרוטוקולים עבור שלוש אסטרטגיות אימוביליזציה אלה מתוארים בפירוט.
Protocol
1. ייצור והכנת כל רכיב בשלב הקירור
הערה: שלב הקירור מורכב ממספר רכיבים (ראה טבלת חומרים). רוב הרכיבים הם מהמדף. חלון הספיר דורש הזמנה מותאמת אישית, בעוד שניתן לייצר את לוח הנחושת, תושבת האחיזה ולוחית הבידוד באתר באמצעות טחנת בקרה נומרית ממוחשבת או מדפסת תלת ממד. לאחר הייצור הראשוני, תהליך ההרכבה המאוחר יותר לוקח בערך 2-3 שעות.
- השתמשו בטחנת בקרה נומרית ממוחשבת כדי לעבד את לוח הנחושת מיריעת מתכת טהורה בגודל 170 מ"מ x 120 מ"מ x 3 מ"מ, 99.9% נחושת טהורה (איור 2A). השרטוט הדו-ממדי לייצור זה מופיע בקובץ המשלים 1. השתמשו בנייר זכוכית דק כדי להסיר קצוות חדים ושאריות מלוכלכות.
- כדי לייצר את תושבת האחיזה ואת לוחית הבידוד, השתמשו במדפסת תלת-ממד ובחוט להט של חומצה פולילקטית (PLA) בקוטר 1.75 מ"מ (איור 2B,C). לקבלת איכות טובה יותר, מדפסת התלת-ממד צריכה לספק גובה שכבה עדין מ-0.2 מ"מ.3D הדגמים מסופקים בקובץ משלים 2 ובקובץ משלים 3.
2. בניית מכלול קירור מים
- הכינו את צינור הסיליקון העשוי פלטינה, מיכל המשאבה, בלוק הקירור מנחושת והרדיאטור (איור 3A) לבניית מכלול קירור המים. הכינו סכין גילוח, מספריים ומפתח משושה מוכנים לשימוש. היו מודעים למפגעים חשמליים עקב שימוש במים במהלך ההרכבה.
- חתכו את צינור הסיליקון לשלושה חלקים באורכים מומלצים של 40 ס"מ, 50 ס"מ ו-80 ס"מ. התאם את האורך בעת הצורך.
- חברו את חלקי צינור הסיליקון משלב 2.2 ליציאות הרדיאטור, מיכל המשאבה ובלוק הקירור מנחושת, כפי שמוצג באיור 3B. ודא שכל החיבורים אטומים למים. מכלול קירור המים בנוי כעת.
- הכינו את מכלול קירור המים, ספק כוח 12 וולט, שלושה חוטי מגשר אדומים ושחורים, קרש לחם ו-500 מ"ל מים מטוהרים.
- ודא ששולחן העבודה נקי מנוזלים לבטיחות חשמלית.
- חברו את מיכלי המשאבה ואת חוטי הרדיאטור לספק הכוח של 12 וולט דרך לוח הלחם (איור 3C). קרש הלחם משמש לנוחות.
הערה: לחיבור קבוע ובטוח יותר, החוקרים יכולים להחליף את לוח הלחם בחוטי הלחמה. - פתח את מכסה מיכל המשאבה באמצעות מברג שטוח. השתמשו במשפך כדי להוסיף מים עד שמיכל המשאבה מלא בכ-80% (איור 3D). אין לסגור את מיכל המשאבה לאחר מילוי זה.
- הפעל את מכלול קירור המים על-ידי חיבור ספק הכוח של 12 וולט או הפעלתו (אם קיים מתג). לאחר ההפעלה, המים יזרמו בתוך המכלול והמאווררים ברדיאטור אמורים לנשוף.
- בשל זרימת המים ממיכל המשאבה, מפלס הנוזלים במיכל יירד. הוסיפו עוד מים למכל המשאבה עד שהוא מתייצב על כמעט 2/3 מלא (איור 3E).
- נערו את הרדיאטור כדי להיפטר מבועות אוויר ולאחר מכן סגרו את מיכל הקירור.
- כבה את ספק הכוח לפני המעבר לשלב הבא.
3. בדיקת משטחים קרים וחמים של פלטייה
הערה: Peltier, מרכיב מרכזי בשלב הקירור, הוא משאבת חום פעילה במצב מוצק המעבירה חום מצד אחד לשני21. משטח אחד של פלטייה מתחמם, והמשטח השני נעשה קר בעת אספקת חשמל. כברירת מחדל, יצרני פלטייה מסמנים את המשטח הקר לפני המכירה, אך עדיין כדאי לבדוק אותו ידנית לפני ההרכבה.
- הכינו את ספק הכוח המתכוונן ואת הפלטייה, כפי שמוצג באיור 4A.
- ודא שספק הכוח כבוי כדי למנוע סכנות חשמליות אפשריות.
- חברו את החוט האדום של הפלטייה לפלט החיובי ואת החוט השחור לפלט השלילי של ספק הכוח המתכוונן בעזרת תפסי תנין, המסופקים עם ספק הכוח (איור 4B).
- הפעל את ספק הכוח המתכוונן והגדר אותו לסביבות 2 V על-ידי אפנון ידיות המתח והזרם בשורה העליונה של ספק הכוח. השתמש מיד באצבע חשופה כדי להרגיש את שני המשטחים של Peltier. משטח אחד מתקרר תוך מספר שניות.
- לאחר זיהוי איזה משטח קר, מיד לכבות את אספקת החשמל לנתק את Peltier.
- השתמש בטוש כדי לציין את המשטח הקר להרכבה עתידית.
4. בניית המכלול לקירור הפלטייה באמצעות מכלול קירור מים
- כפי שניתן לראות באיור 4A, הכינו את מכלול קירור המים הכבוי, את פלטייה (משטח קר מסומן) ואת המשחה התרמית (לשיפור ההולכה התרמית).
- נקו את כל המשטחים של בלוק קירור הנחושת עם 70% אתנול (או תמיסה נקייה אחרת) במכלול קירור המים.
- מרחו כ-0.4 גרם משחה תרמית על משטח אחד של גוש הנחושת לקירור מים וודאו שכיוון משטח זה ימנע מהצינורות לחצות או להתכופף כאשר הם פונים כלפי מטה. השתמשו בכפפה כדי להגן על העור ונסו לפזר את המשחה התרמית באופן דק ואחיד (איור 4C).
- באופן דומה, נקו את המשטח החם של הפלטייה ולאחר מכן מרחו את המשחה התרמית על פני השטח (איור 4D).
- חבר את המשטח החם של פלטייה למשטח בלוק הקירור מנחושת באמצעות משחה תרמית. הפעל לחץ כדי להבטיח שהוא מאובטח. עקבו אחר כיוון החוטים על הפלטיר והצינורות של גוש הקירור מנחושת, כפי שמוצג באיור 4E. נקו את עודפי הדבק התרמי.
- השאר הן את ספק הכוח של 12 וולט והן את ספק הכוח התקין כבויים. חבר את הפלטייה לספק הכוח המתכוונן, כמו בסעיף 3.
- בדוק מחדש הן את חיבורי החשמל והן את חיבורי המכלול לקירור מים, ולאחר מכן הפעל את ספק הכוח של 12 וולט ואת ספק הכוח הניתן לכוונון ברצף.
- בהדרגה להפוך את ספק הכוח tunable ל 12 V. עם פלטייה המוצע, הנוכחי צריך להיות סביב 7.3 A.
- המתן 2 דקות; הטמפרטורה של משטח קר פלטייה צריך להיות קר יותר מ -35 °C (75 °F). מדדו את הטמפרטורה הזו בעזרת מדחום אינפרא-אדום (איור 4F). אין לגעת במשטח הקר כדי למנוע פגיעה בידיים.
- בדוק את כל החיבורים והרכיבים אם הטמפרטורה אינה יכולה להגיע מתחת ל -30 ° C. בועות אוויר בתוך מכלול קירור המים הן סיבה אפשרית לביצועי קירור לא אופטימליים.
- כדי להבטיח בטיחות בשלבים מאוחרים יותר, כבה את ספק הכוח התקין, המתן דקה אחת ולאחר מכן כבה את ספק הכוח של 12 וולט.
5. בניית פלטת נחושת ומכלול חלונות ספיר
- הכינו את לוח הנחושת, חלון ספיר בקוטר 80 מ"מ, משחה תרמית, סרט ברוחב 4 אינץ' ולהב חד לחיתוך (איור 5A).
- נקו בזהירות את צלחת הנחושת ואת חלון הספיר עם 70% אתנול והשתמשו בנייר זכוכית דק כדי להחליק משטחים גסים.
- מרחו את המשחה התרמית על שלושה משטחים פנימיים, כפי שמוצג באיור 5B. ודא שהדבק התרמי מכסה את כל שלושת שטחי הפנים אך אינו עבה מדי, בסביבות 0.5 מ"מ.
- הנח את לוח הנחושת על הספסל מוגן בנייר מדפסת. הנייר מקל על הניקוי המאוחר.
- הכניסו את חלון הספיר לתוך חור לוחית הנחושת (איור 5C). ודא שהספיר אינו מסתובב במהלך ההחדרה כדי למנוע מהמשחה התרמית לעבור לאזורים אחרים. יש להסיר את עודפי הדבק התרמי.
- הדביקו את סרט הדבקה ברוחב 4 אינץ' למשטח העליון של מכלול חלון לוחית-ספיר מנחושת (המשטח שיש לו את אזור השקע הריבועי, כפי שמוצג באיור 5D). הימנעו מבועות אוויר בין סרט הדבקה למשטחי נחושת במהלך ההדבקה על ידי הנחיית ההדבקה באיטיות מצד אחד לשני.
- גזרו את האזורים הכחולים המקווקווים שצוינו בקלטת באמצעות להב חד, בהתאם לאיור 5E. החיתוך חושף את שני חורי החוטים, את השקע הריבועי ואת השטח בקוטר 70 מ"מ של חלון הספיר.
- הדביקו את המשטח התחתון של מכלול חלון לוח הנחושת-ספיר ולאחר מכן חזרו על הליך החיתוך (אזור ספיר בלבד) על משטח זה, כפי שמוצג באיור 5F.
הערה: כעת, חלון הספיר מקובע ללוח הנחושת, ומשטחי הנחושת מוגנים מפני חלודה.
6. שלב קירור הרכבה סופית
- ודא שכל תת-ההרכבה והרכיבים החיוניים מוכנים.
- מרחו כ-0.4 גרם של משחה תרמית על השקע המרובע של לוח הנחושת (איור 6A).
- החל על 0.4 גרם של הדבק תרמי על פני השטח הקר של Peltier. שימו לב שהפלטייה כבר מחובר לגוש קירור הנחושת (איור 6B).
- חבר את משטח הקור של פלטייה לשקע לוח הנחושת בלחץ כלפי מטה. נקו את כל עודפי המשחה התרמית (איור 6C).
- הרכיבו את התושבת המודפסת בתלת-ממד על החלק העליון של בלוק הקירור מנחושת, ולאחר מכן השתמשו במפתח משושה כדי להדק שני ברגים באורך 8-32 אינץ' כדי לקבע את התושבת ללוח הנחושת (איור 6D). השתמש בהידוק מומנט נמוך כדי שהתושבת המודפסת לא תישבר או תתעוות כדי להבטיח הולכה תרמית נאותה מהפלטייה לנחושת.
- הניחו את לוח הנחושת בבסיס הבידוד המודפס בתלת-ממד לצורך בידוד תרמי מבסיס הספסל או המיקרוסקופ במהלך הפעולה (איור 6D).
- שלב הקירור מורכב ומוכן לשימוש (איור 6E).
- עבור מיקרוסקופיה, הניחו את שלב הקירור שהושלם על משטח מיקרוסקופ זקוף (איור 7A).
- הרכבת שלב הקירור הושלמה. פרטים נוספים ניתן למצוא בפרסום הנלווה של מעבדת צ'ונג, המאפיין באופן מלא את האסטרטגיות המפורטות ואת תנועת בעלי החיים20.
הערה: בסעיפים הבאים נדונים פרוטוקולי קירור איטיים, מהירים ופתאומיים. N2 hermaphrodites בגיל L4 או מבוגר צעיר שימשו כדי לייצר את הנתונים הבאים. אסטרטגיית הקירור האיטי שימושית לשיתוק 20 מעלות צלזיוס בעלי חיים מעובדים N2 ב -6 מעלות צלזיוס; 15 ° C - מעובד N2 בעלי חיים הם משותקים חזק ביותר ב 1 °C (75 °F)20. השוואה קצרה בין שלושת פרוטוקולי הקירור הללו מוצגת בטבלה 1.
7. פרוטוקול אימוביליזציה של קירור איטי
- מעבירים את צלחת הטיפוח עם מכסה למקרר בטמפרטורה של 4°C.
- לאחר העברת צלחת הטיפוח למקרר, הפעל את ספק הכוח של שלב הקירור 12 V והגדר את מתח ספק הכוח המתכוונן ל- 5.5 V.
- לאחר שצלחת הטיפוח עם המכסה נשארה במקרר בטמפרטורה של 4°C למשך שעה אחת, העבירו את הצלחת מיד לשלב הקירור והסירו את המכסה (איור 7A). צלחות טיפוח כאלה הן בדרך כלל סביב 6 מעלות צלזיוס. השלב המקורר מראש יציב וקר מספיק כדי לשמור על משטח האגר ב -6 מעלות צלזיוס.
- אם טמפרטורת פני השטח של האגר משתנה, כפי שנמדד או על ידי ציון תנועת בעלי חיים, כוונן מעט את המתח עד שהוא מתייצב ב -6 מעלות צלזיוס.
- בעלי חיים משותקים כראוי בזמן ההעברה.
8. פרוטוקול אימוביליזציה של קירור מהיר
הערה: אסטרטגיית הקירור המהיר היא שיטת האימוביליזציה הבסיסית ביותר (ראה סרט 1); עם זאת, צלחות אגר תופסות את הבמה זמן ממושך תוך כדי הגעהלסט T. כמו כן, כאשר יש צורך באימוביליזציה חזקהוקבוצת T היא 6 מעלות צלזיוס, זמן הסרק מוארך לסביבות 1 שעה20.
- הפעל את ספק הכוח של שלב הקירור 12 V והגדר את מתח ספק הכוח הניתן לכוונון לסביבות 12 V. המתן 10 דקות.
- מביאים צלחת טיפוח מהאינקובטור שלה ישירות לשלב הקירור ומסירים את המכסה.
- ברגע שטמפרטורת פני השטח של האגר יורדת ל (Tset + ΔT) °C, התאם את ספק הכוח המתכוונן לסט V והמתן עד שהאגר יגיעלסט T. סט V הוא המתח המתאים לייצוב האגר בסטT. ΔT הוא משתנה המונע קירור יתר. ראו טבלה 2 לשילוב שלערכת T, ערכת ΔTוקבוצת V.
הערה: הנתונים המוצגים בטבלה 2 מתייחסים באופן ספציפי למעבדת צ'ונג, ולכן יש לציין כי הפרמטרים הניסיוניים עשויים להשתנות בהתאם לתנאי הסביבה והשימוש הייחודיים של כל ניסוי בנפרד. - בעלי חיים משותקים כאשר האגר מגיעלסט T. אימוביליזציה משתפרת עם הזמן עד ~ 50 דקות לאחר תחילת הקירור.
9. פרוטוקול אימוביליזציה של קירור פתאומי
הערה: אסטרטגיית הקירור הפתאומי צורכת את זמן המשתמש הרב ביותר, אך משתקת בעלי חיים במהירות הרבה ביותר מטמפרטורת הגידול שלהם.
- הפעל את ספק הכוח של שלב הקירור 12 V והפנה את מתח ספק הכוח הניתן לכ- 12 V. שמור למשך 10 דקות.
- הביאו צלחת אגר פנויה לשלב הקירור. השתמש בשלב 8.3 בפרוטוקול אימוביליזציה של קירור מהיר כדי לייצב את טמפרטורת משטח האגרבערכת T.
- העבירו את בעלי החיים מצלחת הגידול המקורית שלהם לצלחת המקוררת היושבת על במת הקירור.
- בהתבסס על גודל בעלי החיים הקטנים, החיות צפויות להתקררלסט T תוך שניות ולהיות משותקות. אימוביליזציה משתפרת עם הזמן עד ~ 50 דקות לאחר תחילת הקירור.
10. החייאת בעלי חיים לאחר קירור אימוביליזציה
- החזירו את צלחת התרבית המקוררת לאינקובטור המקורי או לטמפרטורת החדר.
- המתן 20 דקות עד שעה עד שכל התולעים בצלחת יחזרו להתנהגות הזחילה וההזנה הרגילה שלהן.
Representative Results
מדידת טמפרטורת קירור
עבור ניסויי אימוביליזציה ראשוניים בקירור, חשוב לעקוב אחר טמפרטורת פני השטח של האגר כדי להבטיח שניתן יהיה לשתק את בעלי החיים כראוי. ניסויים עתידיים המשוכפלים מהראשון יכולים להשתמש באותם פרמטרים, בדרך כלל ללא מעקב טמפרטורה תכוף. למדידת טמפרטורה, קצה התרמוזוג של המדחום מעוקר באמצעות תמיסת אתנול 70%, וממתין עד שהאתנול יתאדה במלואו לפני השימוש. לאחר מכן, חוד התרמוזוג מוכנס 1 מ"מ לתוך אגר NGM כדי להבטיח קריאת טמפרטורה מדויקת. קצה המדחום מוחזק באמצעות מחזיק מהדק או מחזיקים אחרים (איור 7B).
מדידת טמפרטורה באמצעות מצלמת אינפרא אדום
שלב הקירור נועד להבטיח שפיזור הטמפרטורה באזור הקוטר המרכזי של הצלחת בקוטר 40 מ"מ יהיה אחיד. מצלמת אינפרא אדום צופה פני עתיד (FLIR) משמשת לצילום התפלגות הטמפרטורה על משטח האגר. הפרש הטמפרטורה המרבי הוא בסביבות 1°C כאשרקבוצת T היא 1, 3 או 6 °C (איור 8A).
הערכת קצב הקירור באמצעות אסטרטגיית הקירור המהיר
אסטרטגיית הקירור המהיר משמשת לאפיון קצב הקירור של שלב ב- 12 V. צלחת של 20 מעלות צלזיוס ממוקמת על שלב הקירור ומדחום תרמוזוגי משמש למעקב אחר טמפרטורת פני השטח. השלב מקרר את הלוחות של 20°C ל-6°C ב-6 דקות, ל-1°C ב-10 דקות, ובסופו של דבר מתייצב מתחת ל-7°C בסביבות 40 דקות (איור 8B).
שימוש בשלב הקירור על משטח מיקרוסקופ זקוף
מיקרוסקופ זקוף כולל בדרך כלל מטרה להדמיה, שלב להחזקת דגימה ולהארה. שלב קירור זה מיועד לשימוש על במת מיקרוסקופ זקוף טיפוסי עם הכנסה והסרה קלות (איור 8C). כאשר יש צורך באימוביליזציה של קירור לצורך הדמיה או הקרנה, שלב הקירור פשוט ממוקם על במת המיקרוסקופ כדי לסיים את הפרק ולהיפך.
אימוביליזציה של תולעים על צלחת הקירור מוצג בסרט 1.
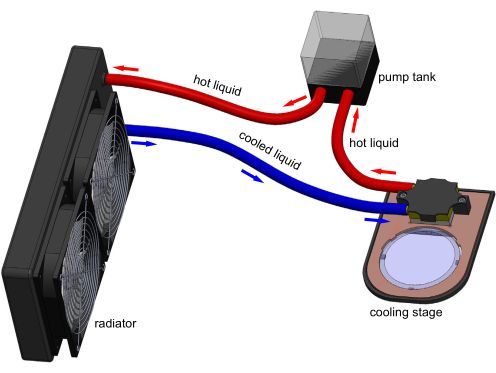
איור 1: מודל תלת-ממדי של מנגנון שלב הקירור. חיבורים אלקטרוניים אינם מוצגים לבהירות. מיכל שואב מים דרך בלוק הקירור כדי להסיר חום המועבר על ידי פלטייה המוטבע בבמה. צלחת גידול פוליסטירן טיפוסית בקוטר 60 מ"מ יכולה לשבת על חלון הספיר השקוף ולהיות מקוררת על ידי שלב. מודל שנוצר ב- Solidworks. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
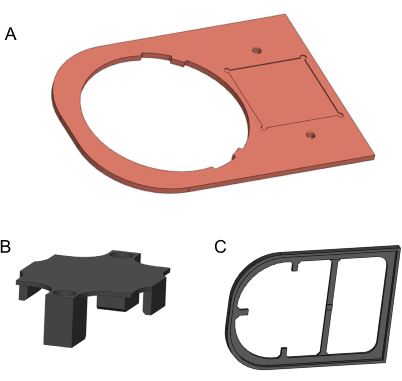
איור 2: מודלים תלת-ממדיים של רכיבים שיש לייצר. (A) לוח נחושת. (B) סוגר החזקה מודפס בתלת-ממד. (C) לוח בידוד מודפס בתלת-ממד. מודלים שנוצרו ב- Solidworks. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: מכלול קירור מים . (A) רכיבים בודדים. צינורות חתוכים לאורכים מוגדרים. (B) רכיבי קירור מים מחוברים. (C) חוטים המחברים את מיכל המשאבה ואת הרדיאטור לספק הכוח של 12 וולט. באופן כללי, חוטים אדומים מתחברים לסוף החיובי, וחוטים שחורים לסוף השלילי. (ד) מים מטוהרים שנשפכו לתוך המשאבה. (E) המיכל התמלא ביותר משני שלישים ליעילות אופטימלית של המשאבה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: חיבור מכלול פלטייה לקירור מים . (A) רכיבים להפעלת הפלטייה. (B) ניצול ספק הכוח התקין כדי לקבוע את הצדדים החמים והקרים של הפלטייה. לבטיחות, לא יותר מ 2 V משמש. (C) אפילו יישום של משחה תרמית על פני השטח של גוש נחושת. (D) אפילו מריחת משחה תרמית על המשטח החם של פלטייה. (E) הצד החם של הפלטיר שנלחץ על גוש הנחושת עם משחה תרמית. (F) מדחום אינפרא אדום המשמש למדידת טמפרטורת פני השטח הקרים של פלטייה. באופן אידיאלי, הטמפרטורה הקרה יכולה להגיע קרוב ל -35 °C (75 °F). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
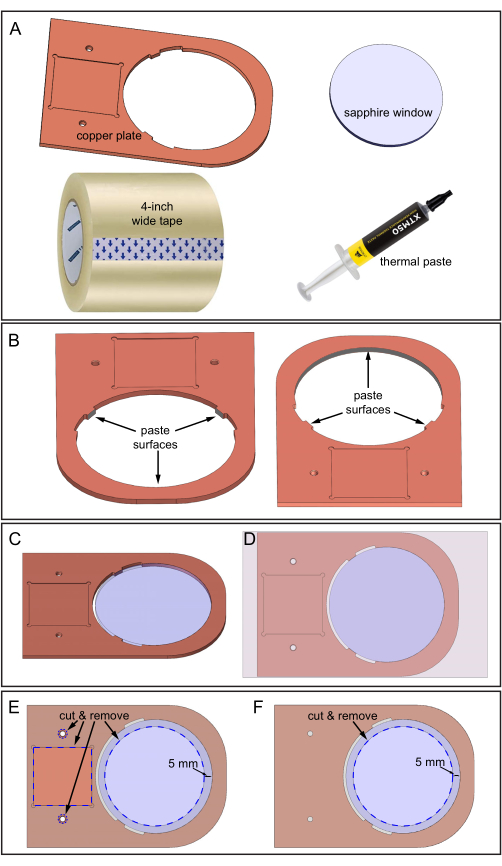
איור 5: הרכבת לוח הנחושת וחלון הספיר . (A) רכיבים נדרשים. (B) משחה תרמית המיושמת על שלושה משטחים פנימיים של לוח הנחושת שבהם חלון הספיר ייגע. שתי תצוגות כלפי מטה של לוח הנחושת המראות את מיקומם של שלושת המשטחים. (C) חלון ספיר בחור לוחית הנחושת. (D) סרט הדבקה שהודבק על המשטח העליון של המכלול. (E) צד עליון: קווים מקווקווים כחולים מציינים את המיקומים לגזירה ולהסרה של סרט הדבקה: שקע מרובע, שני חורים ואזור ספיר בקוטר 70 מ"מ. (F) צד תחתון: הסרט נחתך ומוסר כפי שמוצג. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 6: הרכבה סופית של שלב הקירור . (A) משחה תרמית המיושמת על שקע לוח הנחושת. (B) משחה תרמית המיושמת על הצד הקר של הפלטייה. (C) משטח קר של פלטייה המחובר לשקע. (D) בלוק קירור נחושת המקובע ללוח הנחושת באמצעות ברגים. שלב קירור בבסיס הבידוד. (ה) שלב הקירור הושלם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
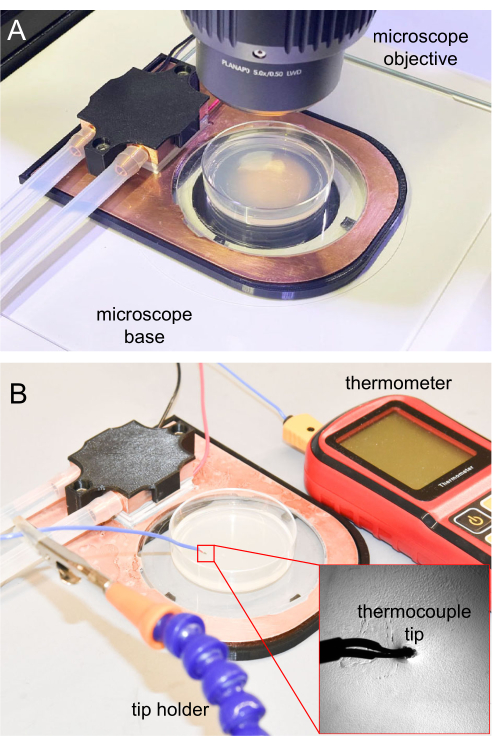
איור 7: שלב קירור במיקרוסקופ ומדידת זוג תרמי. (A) שלב קירור הממוקם על בסיס המיקרוסקופ לצורך הדמיה. חלון הספיר שקוף, ומאפשר הארה. (B) מדחום תרמי המשמש למדידת טמפרטורת פני השטח של אגר NGM. החוד הוכנס כ-1 מ"מ לתוך אגר ה-NGM. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
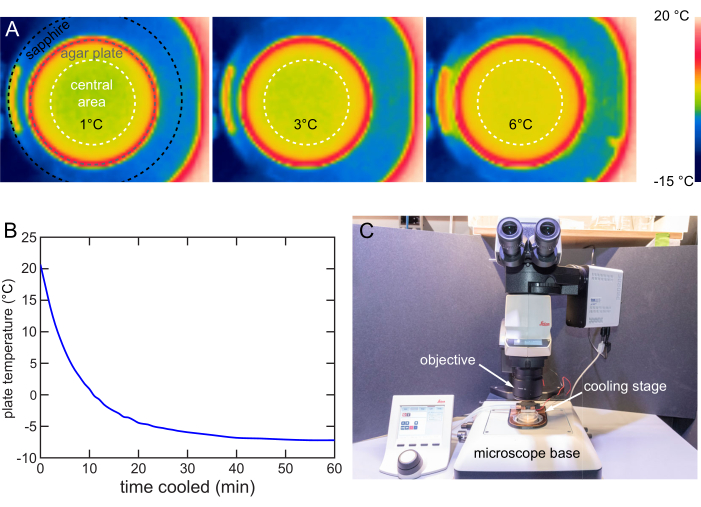
איור 8: אפיון שלב הקירור והשימוש בו . (A) תמונות תרמיות המציגות את משטח האגר מקורר לטמפרטורה של 1, 3 ו-6°C. התפלגות טמפרטורה אחידה באזור המרכזי של 40 מ"מ (עיגול מקווקו לבן). (B) טמפרטורה של משטח אגר NGM לאורך זמן על במת הקירור ב 12 V. משטח אגר NGM יכול להיות מקורר מתחת -7 ° C. הטמפרטורה נמדדה בשיטה באיור 7B. (C) שלב קירור בשימוש במיקרוסקופ זקוף טיפוסי. ניתן להתקין או להסיר את שלב הקירור בקלות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| קירור איטי | קירור מהיר | קירור פתאומי | |
| עיסוק בימתי | מינימום | ארוך | בינוני |
| זמן עד שבעלי החיים משותקים | ארוך | בינוני | קצר מאוד |
| כוח אימוביליזציה | חזק | בינוני | בינוני |
| מאמץ המשתמש | מינימום | קצת יותר ממינימום | המרבי |
טבלה 1: השוואת אסטרטגיות קירור.
| סט T (°C) | ΔT (°C) | סט V (V) |
| 1 | 2 | 8 |
| 2 | 3 | 7.4 |
| 3 | 4.5 | 7 |
| 4 | 5.5 | 6.5 |
| 5 | 6 | 5.9 |
| 6 | 6 | 5.5 |
טבלה 2: פרמטרים להשגת הטמפרטורה הרצויה באסטרטגיית הקירור המהיר.
קובץ משלים 1: לוח נחושת במטריקה. שרטוט A2D לעיבוד לוח הנחושת. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 2: סוגר החזקה. שרטוט תלת ממדי של סוגר אחיזה שניתן לפתוח או לשנות על ידי Solidworks ולייצא לתוכנת הדפסה תלת מימדית. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 3: לוחית בידוד. שרטוט תלת ממדי של לוח בידוד שניתן לפתוח או לשנות על ידי Solidworks ולייצא לתוכנת הדפסה תלת מימדית. אנא לחץ כאן כדי להוריד קובץ זה.
סרט 1: סרטון קירור. תולעי אימוביליזציה על צלחת אגר NGM ב 2 ° C. הצלחת התקררה מטמפרטורת החדר ל -2 מעלות צלזיוס, ונשארה ב -2 מעלות צלזיוס במשך מספר דקות. לאחר מכן, שלב הקירור כבה והצלחות החלו להתחמם לטמפרטורת החדר באופן טבעי. הסרטון מואץ פי 10 כדי להתאים לסרטון של שעה אחת תוך 6 דקות. אנא לחץ כאן להורדת סרט זה.
טבלה משלימה 1: הערכת מחיר לחץ כאן להורדת קובץ זה.
Discussion
שלב הייצור, ההרכבה והשימוש בקירור מוצג בכתב יד זה. רוב הרכיבים הם פריטי מדף שניתן לרכוש באינטרנט. רכיבים מסוימים, כמו לוח הנחושת וחלון הספיר, זקוקים להזמנה מותאמת אישית וייצורם עשוי להימשך עד חודש. רכיבים אחרים הניתנים להדפסה תלת-ממדית מיוצרים בקלות ברוב מוסדות המחקר (טבלה משלימה 1). תהליך ההרכבה דורש כלים ספורים בלבד ויכול להיעשות במהירות על ידי מי שאינו מומחה תוך מספר שעות. לכן, רוב המעבדות הביולוגיות צריכות להיות מסוגלות ליישם בקלות את המכשיר הזה.
לשלב הקירור ולגישת אימוביליזציה של קירור יש מספר שיפורים משמעותיים לעומת שיטות האימוביליזציה הקיימות, שפורטו בקפידה בפרסום המקורי20. בקצרה, שלב הקירור מאפשר אימוביליזציה חזקה של אוכלוסיות גדולות של C. elegans בכל הגילאים, כולל עוברים ודאוורים, על לוחות התרבית הטיפוסיים שלהם תחת תהליכי עבודה סטנדרטיים של מיקרוסקופיה. זה מבטל את הצורך בהגדרות חומרה מורכבות, כמו מיקרופלואידיקה, תוך מתן אפקט אימוביליזציה חזק יותר. בנוסף, הוא ממזער את החשיפה הכימית הרעילה האפשרית לבעלי חיים ולחוקרים מכיוון שלא נעשה שימוש בכימיקלים, תוך מתן אפקט אימוביליזציה דומה. יכולות טכניות אלה מאפשרות יישום רחב של מכשיר זה וגישה לניסויים רבים הדורשים מיקרוסקופ in vivo ברזולוציה גבוהה על מספר רב של בעלי חיים.
ישנם כמה שלבים קריטיים במהלך בניית המכשיר, כולל כל יישום הדבק התרמי והסרט הרחב לקיבוע חלון הספיר לצלחת הקופר. המשחה התרמית מבטיחה מוליכות תרמית חזקה על ידי החלפת רווחים בחומר בעל התנגדות תרמית נמוכה. כדי להשיג את ביצועי הקירור הרצויים, יש להכניס את הדבק כראוי בין כל המשטחים הסמוכים/באים במגע, כולל משטח הקור של פלטייה ללוח הנחושת, המשטח החם של פלטייה לבלוק הקירור מנחושת ולוח הנחושת לחלון הספיר. הסרט הרחב המודבק על הבמה מבודד את לוח הנחושת כדי למנוע חימום מהאוויר ועיבוי, מה שמוביל לחלודה. זה גם מחזק את הקשר בין חלון הספיר ללוח הנחושת. לכן, הן החלת הדבק תרמי ואת סרט רחב דורשים טיפול נוסף.
בניסוי אימוביליזציה של קירור בפועל, הפרמטרים המופיעים בכתב יד זה, כגון מתחים וזמנים, תלויים בתכונות הספציפיות של לוחות הגידול והשלב, כגון כמות האגר בצלחות, יעילות הבמה, טמפרטורת הסביבה והלחות. בשינויים עתידיים, ניתן יהיה להתקין בקר משוב, כמו נגזרת אינטגרלית פרופורציונלית (PID), כדי להתאים באופן פעיל את כניסת המתח לשלב הקירור כדי להשיג את הטמפרטורה הרצויה ולייצב אותה.
ישנן מספר מגבלות של אימוביליזציה זו של שלב הקירור, שפורטו בקפידה בפרסום המקורי20. בקצרה, בעלי חיים שגדלו בטמפרטורות שונות משותקים בדרגות שונות, מה שעשוי להזדקק לכוונון עדין נוסף. כמו כן, שלב קירור נוכחי זה אינו מיועד למיקרוסקופ הפוך. יתר על כן, הדמיה או סינון על צלחת טיפוח ישירות עלול להכניס זיהום לצלחת.
אנו מתכננים גרסאות חדשות של שלב הקירור המתאימות לפלטפורמות הדמיה שונות, כולל מיקרוסקופים זקופים מורכבים ומיקרוסקופים הפוכים. עיצובים חדשים אלה יאפשרו קירור ישיר של בעלי חיים על לוחות תרבית במהלך הדמיה על פלטפורמות אלה. ההדמיה בשלבי קירור אלה תשתמש במטרות טבילה באוויר למרחקי עבודה ארוכים, בדומה לתצורה הזקופה. כיום, מטרות טבילה באוויר יכולות להיות בעלות מפתח צמצם מספרי של עד 0.9, המספק רזולוציה של כ-300 ננומטר להדמיית חלבון פלואורסצנטי ירוק. לפיכך, שילוב של שלב קירור חדש עם מיקרוסקופ יכול לאפשר הדמיה פלואורסצנטית ברזולוציה תת-מיקרונית באופן שגרתי.
אנו מספקים גם כמה טיפים מועילים לשימוש בשלב הקירור בהתאם לניסיון שלנו. לדוגמה, אנשים צריכים לבדוק אם יש בועות אוויר בתוך מכלול קירור המים. בועות אוויר פוגעות בקירור למשטח החם של פלטייה ובכך פוגעות ביעילות הקירור של שלב הקירור. אם קיימות בועות אוויר, יש להפעיל את ספק הכוח 12 V כדי לגרום למים לזרום ויש לנער את כל מרכיבי זרימת המים. ניתן לשטוף בועות אוויר מאזורים לכודים ולאוורר אותן על ידי מיכל המשאבה. על החוקרים לוודא כי צינורות זרימת המים אינם מכופפים או נחצים בעת הרכבת מכלול קירור המים. כיפוף או חציית צינור עלולים למנוע זרימה מספקת של מים ולהפחית את יעילות הקירור. חיבורי הצינור צריכים להיות מתאימים והדוקים. במידת הצורך, ניתן להשתמש במקום צינור רך בקוטר שונה כדי להבטיח אטימות. אין להחיל הדבק, גם אם החיבור אינו הדוק מספיק, שכן הדבק עלול להכניס סתימות במהלך שימוש עתידי. לחות החדר משפיעה על ביצועי הקירור ומציגה עיבוי וקרח בשלב הקירור. לפני הנחת צלחת טיפוח על שלב הקירור, מומלץ להשתמש ברישו נייר כדי להסיר עיבוי או להשתמש בצלעות קירור כדי להסיר במהירות קרח שנוצר על חלון הספיר. מיכל המשאבה ומאווררי הרדיאטור יכולים לגרום לתנודות קטנות במיקרוסקופ אם הם עובדים על אותו שולחן. רטט במיקרוסקופ מטשטש את התמונה הנרכשת ולכן יש להימנע ממנו. כרית יכולה לשמש לבידוד מכני של המיכל והרדיאטור, או שהם יכולים להיות ממוקמים על שולחן סמוך נפרד. שלב הקירור יכול להפוך לשלב חימום על ידי היפוך החיבור החשמלי לפלטייר.
Disclosures
המחברים מצהירים כי אין אינטרסים כלכליים מתחרים או ניגודי עניינים אחרים.
Acknowledgements
אנו מודים לנח יוסף (המחלקה לביו-הנדסה צפון-מזרחית) על עיבוד לוחות נחושת.
Materials
| Name | Company | Catalog Number | Comments |
| 12-V power supply | ANYTITI | ledpower00 | output DC 12V +/-0.5V, 5A power 60W |
| 8-32 screw | arbitrary | for bracket fixation | |
| bracket | N/A | N/A | 3D printed using 1.75mm PLA filament. See supplementary for 3D model. |
| breadboard | DEYUE | 7545924028 | 400 pin solderless board kit for DIY electric connection |
| copper cooling block | Kalolary | Kalolary-Heatsink001 | 40*40mm internal fin thickness 0.5mm |
| copper plate | arbitrary | N/A | Machined from a 170x120x3 mm 99.9% pure copper sheet. See supplementary for 2D drawing for manufacturing. |
| digital thermocouple thermometer | Proster | 4333090752 | dual channel thermometer with two K-type thermocouple probes measuring range -50-300°C accuracy ±1.5% resolution 0.1°C /°F < 1000° |
| isolation base | N/A | N/A | 3D printed using 1.75mm PLA filament. See supplementary for 3D model. |
| jumper wires | arbitrary | for electronic connection | |
| multistage peltier | DigiKey | TEC1-12706 | thermoelectric cooling device size 40*40*7.05 mm Umax 16.1 V Imax 8.5 A ΔTmax @ Th 85°C @ 27°C Qmax @ Th 51.6W @ 27°C resistance 1.65 Ω |
| Nalgene 50 Platinum-Cured Silicone Tubing | ThermoScientific | 14-176-332E | ultrasoft tube durometer hardness Shore A, 50 inner diameter 1/4 in outer diameter 9.5 mm |
| packaging tape | arbitrary | 4 inch wide to cover the copper plate | |
| pump tank | Yosoo | SC-300T | input power DC 12V flow rate 300L/h max |
| radiator | DIYhzWater | 10463 | 12 pipe aluminum heat exchanger cooling water drain row with two 120mm fans |
| sapphire window | Altos Photonics, Inc. | N/A | Contact Altos for custom order size Ø 80mm, 3mm thick surface quality 60-40s/d uncoated |
| thermal paste | Corsair | XTM50 | reduce thermal impedance between surfaces thermal conductivity 5.0W/mK |
| tunable power supply | Kungber | DY-SPS3010B | voltage range 0 – 30V current range 0 – 10A linear Power Supply with 4-Digits coarse and fine adjustments with alligator leads |
References
- Wearne, S. L., et al. New techniques for imaging, digitization and analysis of three-dimensional neural morphology on multiple scales. Neuroscience. 136 (3), 661-680 (2005).
- Zhou, Z., Sorensen, S., Zeng, H., Hawrylycz, M., Peng, H. Adaptive image enhancement for tracing 3D morphologies of neurons and brain vasculatures. Neuroinformatics. 13 (2), 153-166 (2015).
- Parthasarathy, R., Groves, J. T. Optical techniques for imaging membrane topography. Cell Biochemistry and Biophysics. 41 (3), 391-414 (2004).
- Chan, C. Y., Faragalla, Y., Wu, L. -. G. Illuminating membrane structural dynamics of fusion and endocytosis with advanced light imaging techniques. Biochemical Society Transactions. 50 (4), 1157-1167 (2022).
- Chen, Y., Periasamy, A. Characterization of two-photon excitation fluorescence lifetime imaging microscopy for protein localization. Microscopy Research and Technique. 63 (1), 72-80 (2004).
- Chen, Y., Mills, J. D., Periasamy, A. Protein localization in living cells and tissues using FRET and FLIM. Differentiation. 71 (9-10), 528-541 (2003).
- Frigault, M. M., Lacoste, J., Swift, J. L., Brown, C. M. Live-cell microscopy-tips and tools. Journal of Cell Science. 122 (6), 753-767 (2009).
- Schneckenburger, H., et al. Light exposure and cell viability in fluorescence microscopy. Journal of Microscopy. 245 (3), 311-318 (2012).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Hobert, O., Loria, P. Uses of GFP in Caenorhabditis elegans. Green Fluorescent Protein: Properties, Applications, and Protocols. 47, 203-226 (2005).
- Emmons, S. W., Yemini, E., Zimmer, M. Methods for analyzing neuronal structure and activity in Caenorhabditis elegans. Genetics. 218 (4), (2021).
- Chung, S. H., et al. Novel DLK-independent neuronal regeneration in Caenorhabditis elegans shares links with activity-dependent ectopic outgrowth. Proceedings of the National Academy of Sciences. 113 (20), E2852-E2860 (2016).
- Caldwell, K. A., Willicott, C. W., Caldwell, G. A. Modeling neurodegeneration in Caenorhabditis elegans. Disease Models & Mechanisms. 13 (10), (2020).
- Pintard, L., Bowerman, B. Mitotic cell division in Caenorhabditis elegans. Genetics. 211 (1), 35-73 (2019).
- Bargmann, C. I., Avery, L. Laser killing of cells in Caenorhabditis elegans. Methods in Cell Biology. 48, 225-250 (1995).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods in Cell Biology. 107, 177-206 (2012).
- Chung, K. H., Crane, M. M., Lu, H. Automated on-chip rapid microscopy, phenotyping and sorting of C. elegans. Nature Methods. 5 (7), 637-643 (2008).
- Rohde, C. B., Yanik, M. F. Subcellular in vivo time-lapse imaging and optical manipulation of Caenorhabditis elegans in standard multiwell plates. Nature Communications. 2, 271 (2011).
- Guo, S. X., et al. Femtosecond laser nanoaxotomy lab-on-a-chip for in vivo nerve regeneration studies. Nature Methods. 5 (6), 531-533 (2008).
- Wang, Y. L., Grooms, N. W. F., Jaklitsch, E. L., Schulting, L. G., Chung, S. H. High-throughput submicron-resolution microscopy of Caenorhabditis elegans populations under strong immobilization by cooling cultivation plates. iScience. 26 (2), 105999 (2023).
- Zhao, D., Tan, G. A review of thermoelectric cooling: Materials, modeling and applications. Applied Thermal Engineering. 66 (1-2), 15-24 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved