Montagem e Operação de um Estágio de Resfriamento para Imobilização de C. elegans em Suas Placas de Cultura
In This Article
Summary
Este trabalho descreve protocolos para a construção e operação de uma etapa de resfriamento para imobilizar C. elegans em suas placas de cultivo originais em massa.
Abstract
Abordagens de microscopia in vivo de alta resolução podem revelar informações sutis e detalhes finos dentro do animal modelo Caenorhabditis elegans (C. elegans), mas requerem forte imobilização animal para evitar borrões de movimento nas imagens. Infelizmente, a maioria das técnicas atuais de imobilização requer esforço manual substancial, tornando as imagens de alta resolução de baixo rendimento. A imobilização de C. elegans é muito simplificada usando uma abordagem de resfriamento que pode facilmente imobilizar populações inteiras diretamente em suas placas de cultivo. O estágio de resfriamento pode estabelecer e manter uma ampla faixa de temperaturas com uma distribuição uniforme na placa de cultivo. Neste artigo, todo o processo de construção da etapa de resfriamento está documentado. O objetivo é que um pesquisador típico possa construir uma etapa de resfriamento operacional em seu laboratório seguindo este protocolo sem dificuldade. A utilização da etapa de resfriamento seguindo três protocolos é mostrada, e cada protocolo apresenta vantagens para diferentes experimentos. Também é mostrado um exemplo de perfil de resfriamento do estágio à medida que se aproxima de sua temperatura final e algumas dicas úteis no uso da imobilização de resfriamento.
Introduction
A microscopia óptica de alta resolução fornece uma ferramenta indispensável para o estudo de estruturas biológicas in vivo em nível subcelular. Muitos estudos biológicos requerem imagens com resolução submicrônica para resolver detalhes anatômicos sutis, incluindo morfologia do neurônio1,2, estrutura da membrana3,4 e localização de proteínas 5,6. Uma imagem de alta resolução requer um tempo de exposição de vários milissegundos a segundos, dependendo da modalidade de imagem e da sonda 7,8. Para alcançar os melhores resultados, é essencial planejar e conduzir cuidadosamente experimentos baseados em microscopia. Crucial para esse esforço é um método eficiente de preparo de animais que facilite imagens de alta resolução.
O nematoide C. elegans é um organismo modelo amplamente utilizado para o estudo de diversos processos biológicos9. Este pequeno animal é tipicamente cultivado em placas de ágar meio de crescimento de nematoides (NGM) e eles se reproduzem rapidamente por autofecundação, tornando-os adequados para estudos em larga escala. Sua transparência e uma ampla gama de técnicas de marcação permitem a visualização direta de sua anatomia interna10,11. As estruturas finas em C. elegans são ideais para estudar processos biológicos em nível subcelular, como regeneração de neurônios 12, degeneração de neurônios13 e divisão celular14. Tais estudos necessitam de imagens com resolução submicrônica e imobilização animal forte o suficiente para evitar o desfoque da imagem. A imobilização forte é especialmente crucial para técnicas que envolvem múltiplas imagens no espaço ou no tempo, como pilhas de imagens 3D (ou seja, pilhas z) e imagens de lapso de tempo. Qualquer movimento de animal entre as exposições pode obscurecer o resultado. Para C. elegans, a imobilização forte tipicamente envolve manipulação manual de animais individuais e montagem em lâminas com anestésico15,16. Esses procedimentos demorados e trabalhosos tornam os experimentos em grande escala muito difíceis. Uma estratégia de imobilização em que os animais são direta e reversivelmente imobilizados em suas placas de cultivo originais poderia permitir imagens de alta produtividade e alta resolução.
A imobilização por resfriamento de C. elegans tem sido demonstrada em alguns estudos, mas não é amplamente utilizada. Geralmente é combinada com um dispositivo microfluídico para conter ainda mais os animais17,18,19. No entanto, os dispositivos microfluídicos são complexos, requerem treinamento operacional significativo e não podem ser facilmente integrados aos fluxos de trabalho típicos de cultivo sólido dos experimentos de C. elegans. Assim, a microfluídica não é amplamente utilizada para a imobilização de C. elegans. Apresentamos aqui, em conjunto com a recente publicação20 do Laboratório Chung, a introdução de uma nova abordagem de imobilização de resfriamento usando um estágio de resfriamento termoelétrico (Figura 1) para resolver essas deficiências. Com o estágio de resfriamento, uma placa de cultivo de poliestireno típica de 60 mm pode ser resfriada até qualquer temperatura alvo (conjunto T) entre -8 °C e temperatura ambiente. Essa abordagem do estágio de resfriamento pode imobilizar pronta e reversivelmente toda uma população animal com o mínimo esforço do usuário, eliminando 98% do tempo de processamento animal20.
Abaixo, são descritos os procedimentos para a construção de um estágio de resfriamento do zero. Com exceção da usinagem de peças e impressão 3D, todo o procedimento deve levar 4 h sem a necessidade de ferramentas especiais ou experiência. Em seguida, três diferentes estratégias de resfriamento com taxas de resfriamento variáveis e esforços do usuário para imobilizar C. elegans em um microscópio vertical típico são descritas mais adiante. A estratégia preferida pode depender do aplicativo do usuário. Os protocolos para essas três estratégias de imobilização por resfriamento são descritos em detalhes.
Protocol
1. Fabricação e preparação de cada componente da etapa de resfriamento
NOTA: O estágio de resfriamento é composto por vários componentes (consulte a Tabela de Materiais). A maioria dos componentes está pronta para uso. A janela de safira requer um pedido personalizado, enquanto a placa de cobre, o suporte de fixação e a placa de isolamento podem ser fabricados no local com um moinho de controle numérico computadorizado ou impressora 3D. Após a fabricação inicial, o processo de montagem posterior leva em torno de 2-3 h.
- Use um moinho de controle numérico computadorizado para usinar a placa de cobre de uma chapa metálica de cobre 99,9% pura de 170 mm x 120 mm x 3 mm (Figura 2A). O desenho 2D para esta fabricação é fornecido no Arquivo Suplementar 1. Use lixa de areia fina para remover bordas afiadas e resíduos sujos.
- Para fabricar o suporte de fixação e a placa de isolamento, use uma impressora 3D e filamento de ácido polilático (PLA) de 1,75 mm de diâmetro (Figura 2B,C). Para melhor qualidade, a impressora 3D deve fornecer uma altura de camada mais fina do que 0,2 mm.3D modelos são fornecidos no Arquivo Suplementar 2 e no Arquivo Suplementar 3.
2. Construção do conjunto de resfriamento a água
- Prepare o tubo de silicone curado com platina, o tanque da bomba, o bloco de resfriamento de cobre e o radiador (Figura 3A) para construir o conjunto de resfriamento a água. Prepare uma lâmina de barbear, tesoura e chave hexadecimal prontas para uso. Esteja atento aos riscos elétricos decorrentes do uso de água durante toda a montagem.
- Corte o tubo de silicone em três seções com comprimentos sugeridos de 40 cm, 50 cm e 80 cm. Ajuste o comprimento quando necessário.
- Conecte as seções do tubo de silicone da etapa 2.2 às portas do radiador, do tanque da bomba e do bloco de resfriamento de cobre, conforme mostrado na Figura 3B. Certifique-se de que todas as conexões sejam estanques. O conjunto de resfriamento a água agora está construído.
- Prepare o conjunto de resfriamento a água, uma fonte de alimentação de 12 V, três fios de jumper vermelhos e três pretos, uma protoboard e 500 mL de água purificada.
- Certifique-se de que a bancada de trabalho esteja livre de líquido para segurança elétrica.
- Conecte os tanques da bomba e os fios do radiador à fonte de alimentação de 12 V através da protoboard (Figura 3C). A protoboard é usada para conveniência.
OBS: Para uma conexão mais permanente e segura, os pesquisadores podem substituir a protoboard por fios de solda. - Abra a tampa do tanque da bomba usando uma chave de fenda de cabeça plana. Use um funil para adicionar água até que o tanque da bomba esteja cerca de 80% cheio (Figura 3D). Não tampar o tanque da bomba após este enchimento.
- Ligue o conjunto de resfriamento a água conectando a fonte de alimentação de 12 V ou ligando-a (se houver um interruptor). Depois de ligado, a água fluirá para dentro do conjunto e os ventiladores no radiador devem soprar.
- Devido ao fluxo de água do tanque da bomba, o nível de líquido no tanque cairá. Adicione mais água ao tanque da bomba até que ele se estabilize em quase 2/3 cheio (Figura 3E).
- Agite o radiador para se livrar das bolhas de ar e, em seguida, tampe o tanque de resfriamento.
- Desligue a fonte de alimentação antes de ir para a próxima etapa.
3. Teste de superfícies frias e quentes Peltier
NOTA: O Peltier, um componente-chave do estágio de resfriamento, é uma bomba de calor ativa de estado sólido que transfere calor de um lado para o outro21. Uma superfície do Peltier torna-se quente, e a outra superfície torna-se fria ao fornecer energia elétrica. Por padrão, os fabricantes da Peltier marcam a superfície fria antes de vender, mas ainda é útil testá-la manualmente antes de montar.
- Prepare a fonte de alimentação ajustável e o Peltier, conforme mostrado na Figura 4A.
- Verifique se a fonte de alimentação ajustável está desligada para evitar possíveis riscos elétricos.
- Conecte o fio vermelho do Peltier à saída positiva e o fio preto à saída negativa da fonte de alimentação ajustável com grampos de jacaré, que são fornecidos com a fonte de alimentação (Figura 4B).
- Ligue a fonte de alimentação ajustável e defina-a para cerca de 2 V modulando os botões de tensão e corrente na linha superior da fonte de alimentação. Use imediatamente um dedo nu para sentir as duas superfícies do Peltier. Uma superfície torna-se fria em poucos segundos.
- Depois de identificar qual superfície está fria, desligue imediatamente a fonte de alimentação e desconecte o Peltier.
- Use um marcador para indicar a superfície fria para montagem futura.
4. Construção do conjunto para resfriar o Peltier usando o conjunto de resfriamento a água
- Como mostrado na Figura 4A, prepare o conjunto de resfriamento a água desligado, o Peltier (superfície fria marcada) e a pasta térmica (para melhor condução térmica).
- Limpe todas as superfícies do bloco de resfriamento de cobre com etanol 70% (ou outra solução mais limpa) no conjunto de resfriamento a água.
- Aplique cerca de 0,4 g de pasta térmica em uma superfície do bloco de resfriamento de água de cobre e certifique-se de que essa orientação da superfície evitará que os tubos cruzem ou se dobrem quando estiverem virados para baixo. Use uma luva para proteger a pele e tente distribuir a pasta térmica de forma fina e uniforme (Figura 4C).
- Da mesma forma, limpe a superfície quente do Peltier e, em seguida, aplique a pasta térmica na superfície (Figura 4D).
- Conecte a superfície quente Peltier à superfície do bloco de resfriamento de cobre com pasta térmica. Aplique pressão para garantir que está seguro. Siga a orientação dos fios no Peltier e dos tubos do bloco de resfriamento de cobre, como mostra a Figura 4E. Limpe o excesso de pasta térmica.
- Mantenha a fonte de alimentação de 12 V e a fonte de alimentação ajustável desligadas. Conecte o Peltier à fonte de alimentação ajustável, como na seção 3.
- Verifique novamente as conexões do conjunto elétrico e de resfriamento a água e, em seguida, ligue a fonte de alimentação de 12 V e a fonte de alimentação ajustável sequencialmente.
- Ligue gradualmente a fonte de alimentação ajustável para 12 V. Com o Peltier sugerido, a corrente deve ficar em torno de 7,3 A.
- Aguarde 2 min; a temperatura da superfície fria de Peltier deve tornar-se mais fria do que -35 °C. Meça essa temperatura com um termômetro infravermelho (Figura 4F). Não toque na superfície fria para evitar lesões nas mãos.
- Verifique todas as conexões e componentes se a temperatura não puder chegar abaixo de -30 °C. Bolhas de ar dentro do conjunto de resfriamento a água são uma possível razão para o desempenho de resfriamento abaixo do ideal.
- Para garantir a segurança em etapas posteriores, desligue a fonte de alimentação ajustável, aguarde 1 min e desligue a fonte de alimentação de 12 V.
5. Construção de placa de cobre e montagem de janela de safira
- Prepare a placa de cobre, a janela de safira de 80 mm de diâmetro, a pasta térmica, uma fita de 4 polegadas de largura e uma lâmina afiada para o corte (Figura 5A).
- Limpe cuidadosamente a placa de cobre e a janela de safira com etanol 70% e use lixa de areia fina para suavizar superfícies ásperas.
- Aplique a pasta térmica em três superfícies internas, como mostra a Figura 5B. Certifique-se de que a pasta térmica cubra as três áreas de superfície, mas não seja muito espessa, cerca de 0,5 mm.
- Coloque a placa de cobre na bancada protegida com papel de impressora. O papel facilita a limpeza posterior.
- Insira a janela de safira no orifício da placa de cobre (Figura 5C). Certifique-se de que a safira não gire durante a inserção para evitar que a pasta térmica se mova para outras áreas. Retire o excesso de pasta térmica.
- Adera a fita de 4 polegadas de largura à superfície superior do conjunto da janela de placa de cobre-safira (a superfície que tem a área de depressão quadrada, como mostrado na Figura 5D). Evite bolhas de ar entre a fita e as superfícies de cobre durante a colagem, guiando a adesão lentamente de um lado para o outro.
- Recorte as áreas tracejadas azuis especificadas da fita usando uma lâmina afiada, seguindo a Figura 5E. O corte expõe os dois orifícios de rosca, a depressão quadrada e a área de 70 mm de diâmetro da janela de safira.
- Tape a superfície inferior do conjunto da janela de chapa de cobre-safira e, em seguida, repita o procedimento de corte (somente área de safira) nessa superfície, como mostrado na Figura 5F.
NOTA: Agora, a janela de safira é fixada à placa de cobre, e as superfícies de cobre são protegidas da ferrugem.
6. Montagem final da etapa de resfriamento
- Certifique-se de que todos os subconjuntos e componentes essenciais estejam prontos.
- Aplicar cerca de 0,4 g de pasta térmica na depressão quadrada da placa de cobre (Figura 6A).
- Aplicar cerca de 0,4 g de pasta térmica na superfície fria do Peltier. Observe que o Peltier já está acoplado ao bloco de resfriamento de cobre (Figura 6B).
- Conecte a superfície fria Peltier à depressão da placa de cobre com pressão descendente. Limpe todo o excesso de pasta térmica (Figura 6C).
- Monte o suporte impresso em 3D na parte superior do bloco de resfriamento de cobre e, em seguida, use uma chave hexadecimal para apertar dois parafusos de 8-32 polegadas de 0,5 polegadas de comprimento para fixar o suporte à placa de cobre (Figura 6D). Use aperto de baixo torque para que o suporte impresso não quebre ou se deforme para garantir a condução térmica adequada do Peltier para o cobre.
- Coloque a placa de cobre na base de isolamento impressa em 3D para isolamento térmico da base da bancada ou do microscópio durante a operação (Figura 6D).
- O estágio de resfriamento está montado e pronto para uso (Figura 6E).
- Para microscopia, colocar o estágio de resfriamento completo em uma plataforma de microscópio vertical (Figura 7A).
- A montagem da etapa de resfriamento está concluída. Mais detalhes estão disponíveis na publicação companheira do Laboratório Chung, que caracteriza completamente as estratégias detalhadas e a movimentação dos animais20.
Observação : nas seções a seguir, protocolos de resfriamento lento, rápido e abrupto são discutidos. Hermafroditas N2 em L4 ou idade adulta jovem foram usados para produzir os seguintes dados. A estratégia de resfriamento lento é útil para imobilizar animais N2 cultivados a 20 °C a 6 °C; Os animais N2 cultivados a 15 °C são mais fortemente imobilizados a 1 °C20. Uma breve comparação entre esses três protocolos de resfriamento é mostrada na Tabela 1.
7. Protocolo de imobilização de resfriamento lento
- Mova a placa de cultivo com tampa para um frigorífico a 4 °C.
- Depois de mover a placa de cultivo para a geladeira, ligue a fonte de alimentação de 12 V do estágio de resfriamento e ajuste a tensão da fonte de alimentação ajustável para 5,5 V.
- Após a placa de cultivo tampada ter permanecido no refrigerador a 4 °C por 1 h, transfira a placa imediatamente para o estágio de resfriamento e retire a tampa (Figura 7A). Tais placas de cultivo são geralmente em torno de 6 °C. O estágio pré-resfriado é estável e frio o suficiente para manter a superfície do ágar a 6 °C.
- Se a temperatura da superfície do ágar mudar, conforme medido ou observando o movimento do animal, ajuste ligeiramente a tensão até que ela se estabilize em 6 °C.
- Os animais são devidamente imobilizados no momento da transferência.
8. Protocolo de imobilização de resfriamento rápido
NOTA: A estratégia de resfriamento rápido é o método de imobilização mais básico (ver Filme 1); no entanto, placas de ágar ociosamente ocupam o palco por um longo tempo enquanto atingem oconjunto T. Além disso, quando uma forte imobilização é necessária e oconjunto T é de 6 °C, o tempo ocioso é estendido para cerca de 1 h20.
- Ligue a fonte de alimentação de 12 V do estágio de resfriamento e ajuste a tensão da fonte de alimentação ajustável para cerca de 12 V. Aguarde 10 minutos.
- Leve uma placa de cultivo de sua incubadora diretamente para o estágio de resfriamento e remova a tampa.
- Uma vez que a temperatura da superfície do ágar diminua para (T set + ΔT) °C, ajuste a fonte de alimentação ajustável para V set e aguarde até que o ágar atinja Tset. O conjunto V é a tensão apropriada para estabilizar o ágar noconjunto T. O ΔT é uma variável que evita o superresfriamento. Veja a Tabela 2 para a combinaçãode conjunto T, ΔT econjunto V.
NOTA: Os dados apresentados na Tabela 2 referem-se especificamente ao Laboratório de Chung, e, portanto, deve-se notar que os parâmetros experimentais podem variar com base nas condições ambientais e de uso únicas de cada experimento individual. - Os animais são imobilizados quando o ágar atinge oconjunto T. A imobilização melhora com o tempo até ~50 min após o início do resfriamento.
9. Protocolo de imobilização por resfriamento abrupto
NOTA: A estratégia de resfriamento abrupto consome mais tempo do usuário, mas imobiliza os animais mais rapidamente de sua temperatura de cultivo.
- Ligue a fonte de alimentação de 12 V do estágio de resfriamento e gire a tensão da fonte de alimentação ajustável para cerca de 12 V. Mantenha por 10 minutos.
- Leve uma placa de ágar desocupada para o estágio de resfriamento. Use o passo 8.3 no protocolo de imobilização de resfriamento rápido para estabilizar a temperatura da superfície do ágar noconjunto T.
- Mova os animais de sua placa de cultivo original para a placa resfriada sentada no estágio de resfriamento.
- Com base no pequeno tamanho do animal, espera-se que os animais resfriem até Tem segundos e sejam imobilizados. A imobilização melhora com o tempo até ~50 min após o início do resfriamento.
10. Recuperação dos animais após imobilização por resfriamento
- Mova a placa de cultura resfriada de volta para a incubadora original ou para a temperatura ambiente.
- Aguarde de 20 min a 1 h até que todos os vermes no prato revivam ao seu comportamento normal de rastejar e se alimentar.
Representative Results
Medição de temperatura de resfriamento
Para os experimentos iniciais de imobilização de resfriamento, é importante rastrear a temperatura da superfície do ágar para garantir que os animais possam ser imobilizados adequadamente. Experimentos futuros que são replicados a partir do inicial podem utilizar os mesmos parâmetros, geralmente sem rastreamento frequente de temperatura. Para medição de temperatura, a ponta termopar do termômetro é esterilizada com solução de etanol 70%, aguardando até que o etanol evapore completamente antes de usar. Em seguida, a ponta do termopar é inserida 1 mm no ágar NGM para garantir uma leitura precisa da temperatura. A ponta do termômetro é mantida usando um suporte de braçadeira ou outros suportes (Figura 7B).
Medição de temperatura com câmera infravermelha
O estágio de resfriamento é projetado para garantir que a distribuição de temperatura na área central de 40 mm de diâmetro da placa seja uniforme. Uma câmera infravermelha prospectiva (FLIR) é usada para obter imagens da distribuição de temperatura na superfície do ágar. A diferença de temperatura máxima é de cerca de 1 °C quando oconjunto T é de 1, 3 ou 6 °C (Figura 8A).
Avaliando a taxa de resfriamento com a estratégia de resfriamento rápido
A estratégia de resfriamento rápido é utilizada para caracterizar a taxa de resfriamento de um estágio a 12 V. Uma placa de 20 °C é colocada no estágio de resfriamento e um termômetro de termopar é usado para rastrear a temperatura da superfície. O estágio resfria as placas de 20 °C a 6 °C em 6 min, a 1 °C em 10 min e, eventualmente, estabiliza abaixo de -7 °C em cerca de 40 min (Figura 8B).
Usando o estágio de resfriamento em uma plataforma de microscópio vertical
Um microscópio vertical normalmente compreende uma objetiva para aquisição de imagens, um estágio para retenção de amostras e iluminação. Este estágio de resfriamento é projetado para uso em um estágio típico de microscópio vertical com fácil inserção e remoção (Figura 8C). Quando a imobilização de resfriamento é necessária para geração de imagens ou triagem, o estágio de resfriamento é simplesmente colocado no estágio do microscópio para terminar a instalação e vice-versa.
A imobilização de vermes na placa de resfriamento é mostrada no Filme 1.
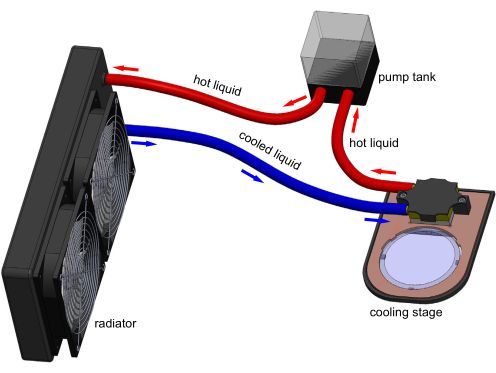
Figura 1: Modelo 3D do aparelho de estágio de resfriamento. As conexões eletrônicas não são mostradas para maior clareza. Um tanque bombeia água através do bloco de resfriamento para remover o calor transferido pelo Peltier embutido no estágio. Uma placa típica de cultivo de poliestireno de 60 mm pode ficar na janela de safira transparente e ser resfriada por estágio. Modelo gerado no Solidworks. Clique aqui para ver uma versão maior desta figura.
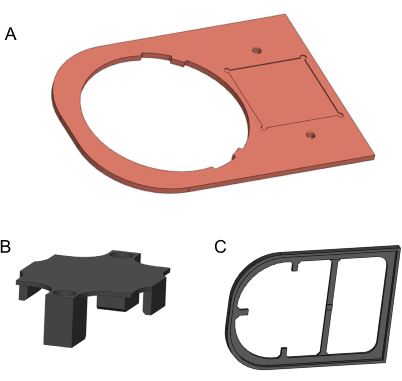
Figura 2: Modelos 3D dos componentes a serem fabricados. (A) Placa de cobre. (B) Suporte de fixação impresso em 3D. (C) Placa de isolamento impressa em 3D. Modelos gerados no Solidworks. Clique aqui para ver uma versão maior desta figura.

Figura 3: Conjunto de resfriamento a água . (A) Componentes individuais. Tubos cortados em comprimentos especificados. (B) Componentes de resfriamento a água conectados. (C) Fios que ligam o reservatório da bomba e o radiador à fonte de alimentação de 12 V. Em geral, os fios vermelhos se conectam à extremidade positiva e os pretos à extremidade negativa. (D) Água purificada despejada na bomba. (E) O tanque encheu até mais de dois terços para uma eficiência ideal da bomba. Clique aqui para ver uma versão maior desta figura.

Figura 4: Conexão do conjunto Peltier e de resfriamento a água . (A) Componentes para operar o Peltier. (B) Utilizar a fonte de alimentação ajustável para determinar os lados quente e frio do Peltier. Por segurança, não mais do que 2 V é usado. (C) Aplicação uniforme de pasta térmica na superfície do bloco de cobre. (D) Aplicação uniforme de pasta térmica na superfície quente de Peltier. (E) Lado quente do Peltier pressionado sobre o bloco de cobre com pasta térmica. (F) Termômetro infravermelho usado para medir a temperatura da superfície fria de Peltier. O ideal é que a temperatura fria chegue perto de -35 °C. Clique aqui para ver uma versão maior desta figura.
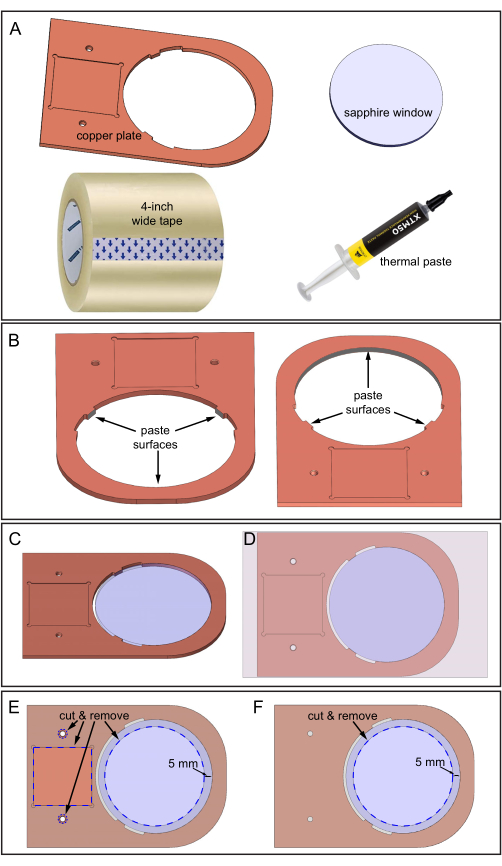
Figura 5: Montagem da placa de cobre e da janela de safira . (A) Componentes necessários. (B) Pasta térmica aplicada em três superfícies internas da placa de cobre onde a janela de safira entrará em contato. Duas vistas para baixo da placa de cobre mostrando a localização das três superfícies. (C) Janela de safira no orifício da placa de cobre. (D) Fita aplicada na superfície superior do conjunto. (E) Parte superior: linhas tracejadas azuis indicam os locais para cortar e remover a fita: depressão quadrada, dois furos e uma área de safira de 70 mm de diâmetro. (F) Parte inferior: A fita é cortada e removida conforme mostrado. Clique aqui para ver uma versão maior desta figura.

Figura 6: Montagem final do estágio de resfriamento . (A) Pasta térmica aplicada à depressão da placa de cobre. (B) Pasta térmica aplicada no lado frio do Peltier. (C) Superfície fria do Peltier conectada à depressão. (D) Bloco de resfriamento de cobre fixado à placa de cobre com parafusos. Estágio de resfriamento na base de isolamento. (E) Concluída a etapa de resfriamento. Clique aqui para ver uma versão maior desta figura.
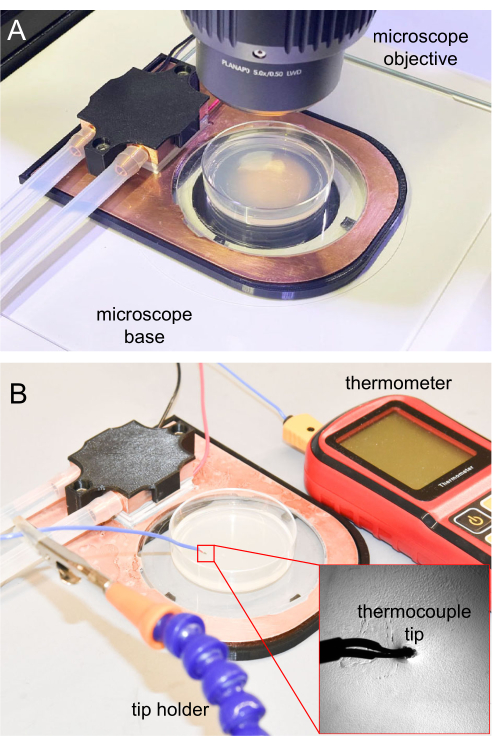
Figura 7: Estágio de resfriamento no microscópio e medição do termopar. (A) Estágio de resfriamento colocado na base do microscópio para obtenção de imagens. A janela de safira é transparente, permitindo a transiluminação. (B) Termômetro termopar utilizado para medir a temperatura da superfície do ágar NGM. A ponta inserida em torno de 1 mm no ágar NGM. Clique aqui para ver uma versão maior desta figura.
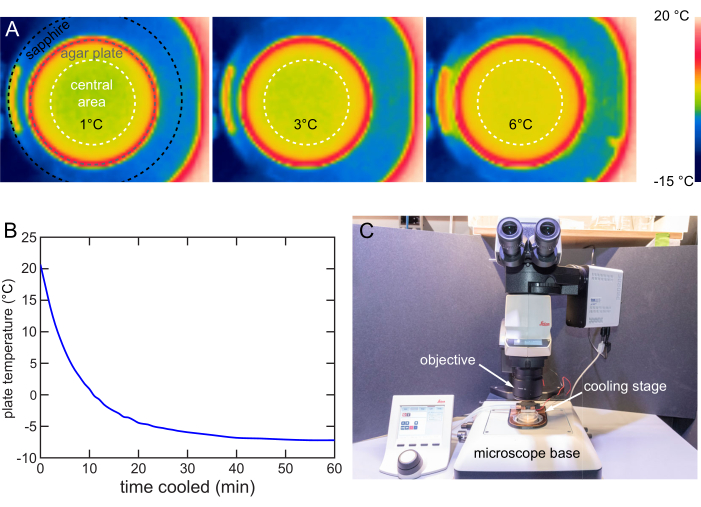
Figura 8: Caracterização e utilização do estágio de resfriamento . (A) Imagens térmicas mostrando a superfície do ágar resfriada a 1, 3 e 6 °C. Distribuição uniforme da temperatura dentro da área central de 40 mm (círculo tracejado branco). (B) Temperatura da superfície do ágar NGM ao longo do tempo no estádio de resfriamento a 12 V. A superfície do ágar NGM pode ser resfriada abaixo de -7 °C. Temperatura medida pelo método da figura 7B. (C) Estágio de resfriamento em uso em um microscópio vertical típico. O estágio de resfriamento pode ser facilmente instalado ou removido. Clique aqui para ver uma versão maior desta figura.
| resfriamento lento | Resfriamento rápido | resfriamento abrupto | |
| ocupação de palco | mínimo | Longas | Média |
| tempo até a imobilização dos animais | Longas | Média | muito curto |
| força de imobilização | forte | Média | Média |
| esforço do usuário | mínimo | um pouco mais do que o mínimo | máximo |
Tabela 1: Comparação das estratégias de resfriamento.
| Conjunto T (°C) | ΔT (°C) | Vconjunto (V) |
| 1 | 2 | 8 |
| 2 | 3 | 7.4 |
| 3 | 4.5 | 7 |
| 4 | 5.5 | 6.5 |
| 5 | 6 | 5.9 |
| 6 | 6 | 5.5 |
Tabela 2: Parâmetros para atingir a temperatura desejada na estratégia de resfriamento rápido.
Arquivo Suplementar 1: Placa de cobre em métrica. Desenho A2D para usinagem da chapa de cobre. Clique aqui para baixar este arquivo.
Arquivo Suplementar 2: Suporte de contenção. Um desenho 3D de um suporte de fixação que pode ser aberto ou modificado pelo Solidworks e exportado para o software de impressão 3D. Clique aqui para baixar este arquivo.
Arquivo Suplementar 3: Placa de isolamento. Um desenho 3D de uma placa de isolamento que pode ser aberta ou modificada pelo Solidworks e exportada para o software de impressão 3D. Clique aqui para baixar este arquivo.
Filme 1: Resfriamento de vídeo. Vermes de imobilização na placa de ágar NGM a 2 °C. A placa foi resfriada da temperatura ambiente para 2 °C e permaneceu a 2 °C por vários minutos. Em seguida, a etapa de resfriamento foi desligada e as placas começaram a aquecer à temperatura ambiente naturalmente. O vídeo é acelerado em 10x para caber um vídeo de 1 h em 6 min. Por favor, clique aqui para baixar este filme.
Quadro Suplementar 1: Estimativa de preços Clique aqui para baixar este arquivo.
Discussion
A fabricação, montagem e uso do estágio de resfriamento é mostrado neste manuscrito. A maioria dos componentes são itens de prateleira que podem ser comprados on-line. Alguns componentes, como a placa de cobre e a janela de safira, precisam de um pedido personalizado e podem levar até 1 mês para serem fabricados. Outros componentes que podem ser impressos em 3D são facilmente fabricados na maioria das instituições de pesquisa (Tabela Suplementar 1). O processo de montagem precisa de apenas algumas ferramentas e pode ser feito rapidamente por um não especialista em poucas horas. Assim, a maioria dos laboratórios biológicos deve ser capaz de implementar facilmente este dispositivo.
O estágio de resfriamento e a abordagem de imobilização por resfriamento possuem várias melhorias significativas em relação aos métodos de imobilização existentes, cuidadosamente detalhados na publicação original20. Em resumo, o estágio de resfriamento permite a forte imobilização de grandes populações de C. elegans de todas as idades, incluindo embriões e dauers, em suas placas de cultura típicas sob fluxos de trabalho de microscopia padrão. Ele elimina a necessidade de configurações de hardware complexas, como microfluídica, proporcionando um efeito de imobilização mais forte. Além disso, minimiza a possível exposição química tóxica a animais e pesquisadores, uma vez que não são usados produtos químicos, proporcionando um efeito de imobilização semelhante. Essas capacidades técnicas permitem a ampla aplicação deste dispositivo e a abordagem a muitos experimentos que requerem microscopia in vivo de alta resolução em um grande número de animais.
Existem algumas etapas críticas durante a construção do dispositivo, incluindo toda a aplicação de pasta térmica e a fita larga para fixar a janela de safira na placa de cobre. A pasta térmica garante uma forte condutividade térmica, substituindo as lacunas por um material de baixa resistência térmica. Para alcançar o desempenho de resfriamento desejado, a pasta precisa ser introduzida corretamente entre todas as superfícies de apoio/contato, incluindo a superfície fria Peltier para a placa de cobre, a superfície quente Peltier para o bloco de resfriamento de cobre e a placa de cobre para a janela de safira. A fita larga aplicada ao estágio isola a placa de cobre para evitar o aquecimento do ar e a condensação, o que leva à ferrugem. Também reforça a conexão entre a janela de safira e a placa de cobre. Assim, tanto a aplicação da pasta térmica quanto da fita larga exigem cuidados extras.
Em um experimento real de imobilização de resfriamento, os parâmetros fornecidos neste manuscrito, como tensões e tempos, dependem das propriedades específicas das placas e do estágio de cultivo, como a quantidade de ágar nas placas, a eficiência do estágio e a temperatura e umidade ambiente. Em modificações futuras, um controlador de realimentação poderia ser instalado, como um proporcional-integral-derivado (PID), para ajustar ativamente a entrada de tensão para o estágio de resfriamento para atingir a temperatura desejada e estabilizá-lo.
Existem várias limitações da imobilização dessa etapa de resfriamento, cuidadosamente detalhadas na publicação original20. Em resumo, animais criados em diferentes temperaturas são imobilizados em diferentes graus, o que pode precisar de ajustes finos extras. Além disso, este estágio de resfriamento atual não é projetado para um microscópio invertido. Além disso, imagens ou triagem em uma placa de cultivo diretamente podem introduzir contaminação na placa.
Estamos projetando novas versões do estágio de resfriamento adequadas para diferentes plataformas de imagem, incluindo microscópios verticais compostos e microscópios invertidos. Esses novos projetos permitirão a imobilização direta do resfriamento animal em placas de cultura durante a obtenção de imagens nessas plataformas. As imagens nesses estágios de resfriamento usarão objetivas de imersão de ar de longa distância de trabalho, semelhantes à configuração vertical. Atualmente, as objetivas de imersão no ar podem ter uma abertura numérica de até 0,9, o que fornece cerca de 300 nm de resolução para imagens de proteínas de fluorescência verde. Assim, a combinação de um novo estágio de resfriamento com um microscópio poderia permitir imagens de fluorescência com resolução submicrônica rotineiramente.
Também fornecemos algumas dicas úteis para usar o estágio de resfriamento de acordo com nossa experiência. Por exemplo, os indivíduos devem verificar se há bolhas de ar dentro do conjunto de resfriamento de água. As bolhas de ar degradam o resfriamento para a superfície quente Peltier e, assim, degradam a eficácia de resfriamento do estágio de resfriamento. Se houver bolhas de ar, a fonte de alimentação de 12 V deve ser ligada para fazer a água fluir e todos os componentes do fluxo de água devem ser agitados. As bolhas de ar podem ser liberadas de áreas presas e ventiladas pelo tanque da bomba. Os pesquisadores devem garantir que a tubulação de fluxo de água não seja dobrada ou cruzada ao montar o conjunto de resfriamento de água. A flexão ou cruzamento do tubo pode impedir o fluxo adequado de água e reduzir a eficácia do resfriamento. As conexões de tubo devem ser adequadamente ajustadas e apertadas. Se necessário, um tubo macio com um diâmetro diferente pode ser usado em vez disso para garantir a estanqueidade. A pasta não deve ser aplicada, mesmo que a conexão não seja apertada o suficiente, pois a pasta pode introduzir entupimentos durante o uso futuro. A umidade ambiente afeta o desempenho do resfriamento e introduz condensação e gelo no estágio de resfriamento. Antes de colocar uma placa de cultivo no estágio de resfriamento, recomenda-se usar um lenço de papel para remover a condensação ou usar um dissipador de calor para remover rapidamente o gelo que se formou na janela de safira. O tanque da bomba e os ventiladores do radiador podem causar pequenas vibrações no microscópio se trabalharem na mesma mesa. A vibração do microscópio borra a imagem adquirida e, portanto, deve ser evitada. Uma almofada pode ser usada para isolar mecanicamente o tanque e o radiador, ou eles podem ser colocados em uma mesa separada próxima. O estágio de resfriamento pode se tornar um estágio de aquecimento invertendo a conexão elétrica com o Peltier.
Disclosures
Os autores declaram não haver interesses financeiros concorrentes ou outros conflitos de interesses.
Acknowledgements
Agradecemos a Noah Joseph (Departamento de Bioengenharia do Nordeste) pela usinagem de chapas de cobre.
Materials
| Name | Company | Catalog Number | Comments |
| 12-V power supply | ANYTITI | ledpower00 | output DC 12V +/-0.5V, 5A power 60W |
| 8-32 screw | arbitrary | for bracket fixation | |
| bracket | N/A | N/A | 3D printed using 1.75mm PLA filament. See supplementary for 3D model. |
| breadboard | DEYUE | 7545924028 | 400 pin solderless board kit for DIY electric connection |
| copper cooling block | Kalolary | Kalolary-Heatsink001 | 40*40mm internal fin thickness 0.5mm |
| copper plate | arbitrary | N/A | Machined from a 170x120x3 mm 99.9% pure copper sheet. See supplementary for 2D drawing for manufacturing. |
| digital thermocouple thermometer | Proster | 4333090752 | dual channel thermometer with two K-type thermocouple probes measuring range -50-300°C accuracy ±1.5% resolution 0.1°C /°F < 1000° |
| isolation base | N/A | N/A | 3D printed using 1.75mm PLA filament. See supplementary for 3D model. |
| jumper wires | arbitrary | for electronic connection | |
| multistage peltier | DigiKey | TEC1-12706 | thermoelectric cooling device size 40*40*7.05 mm Umax 16.1 V Imax 8.5 A ΔTmax @ Th 85°C @ 27°C Qmax @ Th 51.6W @ 27°C resistance 1.65 Ω |
| Nalgene 50 Platinum-Cured Silicone Tubing | ThermoScientific | 14-176-332E | ultrasoft tube durometer hardness Shore A, 50 inner diameter 1/4 in outer diameter 9.5 mm |
| packaging tape | arbitrary | 4 inch wide to cover the copper plate | |
| pump tank | Yosoo | SC-300T | input power DC 12V flow rate 300L/h max |
| radiator | DIYhzWater | 10463 | 12 pipe aluminum heat exchanger cooling water drain row with two 120mm fans |
| sapphire window | Altos Photonics, Inc. | N/A | Contact Altos for custom order size Ø 80mm, 3mm thick surface quality 60-40s/d uncoated |
| thermal paste | Corsair | XTM50 | reduce thermal impedance between surfaces thermal conductivity 5.0W/mK |
| tunable power supply | Kungber | DY-SPS3010B | voltage range 0 – 30V current range 0 – 10A linear Power Supply with 4-Digits coarse and fine adjustments with alligator leads |
References
- Wearne, S. L., et al. New techniques for imaging, digitization and analysis of three-dimensional neural morphology on multiple scales. Neuroscience. 136 (3), 661-680 (2005).
- Zhou, Z., Sorensen, S., Zeng, H., Hawrylycz, M., Peng, H. Adaptive image enhancement for tracing 3D morphologies of neurons and brain vasculatures. Neuroinformatics. 13 (2), 153-166 (2015).
- Parthasarathy, R., Groves, J. T. Optical techniques for imaging membrane topography. Cell Biochemistry and Biophysics. 41 (3), 391-414 (2004).
- Chan, C. Y., Faragalla, Y., Wu, L. -. G. Illuminating membrane structural dynamics of fusion and endocytosis with advanced light imaging techniques. Biochemical Society Transactions. 50 (4), 1157-1167 (2022).
- Chen, Y., Periasamy, A. Characterization of two-photon excitation fluorescence lifetime imaging microscopy for protein localization. Microscopy Research and Technique. 63 (1), 72-80 (2004).
- Chen, Y., Mills, J. D., Periasamy, A. Protein localization in living cells and tissues using FRET and FLIM. Differentiation. 71 (9-10), 528-541 (2003).
- Frigault, M. M., Lacoste, J., Swift, J. L., Brown, C. M. Live-cell microscopy-tips and tools. Journal of Cell Science. 122 (6), 753-767 (2009).
- Schneckenburger, H., et al. Light exposure and cell viability in fluorescence microscopy. Journal of Microscopy. 245 (3), 311-318 (2012).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Hobert, O., Loria, P. Uses of GFP in Caenorhabditis elegans. Green Fluorescent Protein: Properties, Applications, and Protocols. 47, 203-226 (2005).
- Emmons, S. W., Yemini, E., Zimmer, M. Methods for analyzing neuronal structure and activity in Caenorhabditis elegans. Genetics. 218 (4), (2021).
- Chung, S. H., et al. Novel DLK-independent neuronal regeneration in Caenorhabditis elegans shares links with activity-dependent ectopic outgrowth. Proceedings of the National Academy of Sciences. 113 (20), E2852-E2860 (2016).
- Caldwell, K. A., Willicott, C. W., Caldwell, G. A. Modeling neurodegeneration in Caenorhabditis elegans. Disease Models & Mechanisms. 13 (10), (2020).
- Pintard, L., Bowerman, B. Mitotic cell division in Caenorhabditis elegans. Genetics. 211 (1), 35-73 (2019).
- Bargmann, C. I., Avery, L. Laser killing of cells in Caenorhabditis elegans. Methods in Cell Biology. 48, 225-250 (1995).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods in Cell Biology. 107, 177-206 (2012).
- Chung, K. H., Crane, M. M., Lu, H. Automated on-chip rapid microscopy, phenotyping and sorting of C. elegans. Nature Methods. 5 (7), 637-643 (2008).
- Rohde, C. B., Yanik, M. F. Subcellular in vivo time-lapse imaging and optical manipulation of Caenorhabditis elegans in standard multiwell plates. Nature Communications. 2, 271 (2011).
- Guo, S. X., et al. Femtosecond laser nanoaxotomy lab-on-a-chip for in vivo nerve regeneration studies. Nature Methods. 5 (6), 531-533 (2008).
- Wang, Y. L., Grooms, N. W. F., Jaklitsch, E. L., Schulting, L. G., Chung, S. H. High-throughput submicron-resolution microscopy of Caenorhabditis elegans populations under strong immobilization by cooling cultivation plates. iScience. 26 (2), 105999 (2023).
- Zhao, D., Tan, G. A review of thermoelectric cooling: Materials, modeling and applications. Applied Thermal Engineering. 66 (1-2), 15-24 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved