Un saggio biologico di idratazione del polline in vivo ad alta risoluzione, a granulo, singolo grano per Arabidopsis thaliana
In This Article
Summary
Un metodo migliorato per misurare i profili di idratazione del polline in Arabidopsis thaliana è descritto qui. Il nuovo metodo offre una risoluzione più elevata, non è invasivo ed è altamente riproducibile. Il protocollo rappresenta un nuovo strumento per una più fine dissezione dei processi che regolano le prime fasi dell'impollinazione.
Abstract
La riproduzione sessuale nelle piante da fiore richiede un'interazione iniziale tra il granello di polline e la superficie stigmatica, dove si stabilisce un dialogo molecolare tra i partner interagenti. Studi su una serie di specie hanno rivelato che una serie di checkpoint molecolari regolano l'interazione polline-stigma per garantire che solo il polline compatibile, generalmente intraspecifico, abbia successo nell'effettuare la fecondazione. Nelle specie che possiedono uno "stigma secco", come la pianta modello Arabidopsis thaliana, il primo checkpoint di compatibilità prezigotica post-impollinazione è l'istituzione dell'idratazione del polline.
Questa fase di impollinazione è strettamente regolata, per cui i segnali del granello di polline suscitano il rilascio di acqua dallo stigma, consentendo così l'idratazione del polline. La capacità di misurare e tracciare con precisione l'idratazione del polline nel tempo è fondamentale per la progettazione di esperimenti diretti a comprendere la regolazione di questa fase critica della riproduzione. I protocolli pubblicati utilizzano frequentemente fiori che sono stati asportati dalla pianta madre, mantenuti su supporti liquidi o solidi e impollinati alla rinfusa.
Questo articolo descrive un saggio biologico di impollinazione non invasivo in vivo che consente il monitoraggio dell'idratazione minuto per minuto dei singoli grani di polline di A. thaliana ad alta risoluzione. Il test è altamente riproducibile, in grado di rilevare variazioni molto sottili dei profili di idratazione del polline, ed è quindi adatto per l'analisi di mutanti che influenzano le vie che regolano l'impollinazione. Sebbene il protocollo sia più lungo di quelli descritti per l'impollinazione di massa, la precisione e la riproducibilità che fornisce, insieme alla sua natura in vivo , lo rendono ideale per la dissezione dettagliata dei fenotipi di impollinazione.
Introduction
Il successo della riproduzione sessuale nelle angiosperme si basa tipicamente sul trasferimento di granuli di polline intraspecifici dall'antera allo stigma, sia all'interno che tra gli individui (cioè l'impollinazione). Questo trasferimento di granuli di polline a un fiore ricettivo è solitamente mediato da impollinatori o fattori abiotici; Come tale, questo spesso provoca anche la deposizione di polline eterospecifico in condizioni naturali. Con poche eccezioni, la progressione dell'impollinazione da parte del polline eterospecifico è evolutivamente svantaggiosa, riducendo l'idoneità riproduttiva attraverso la perdita di opportunità di accoppiamento, con la maggior parte della progenie ibrida risultante che non riesce a svilupparsi in modo appropriato o è sterile1. Pertanto, si sono evoluti meccanismi per bloccare l'impollinazione da polline eterospecifico "incompatibile"2. Il rapido riconoscimento del polline compatibile è quindi probabilmente il processo più importante nelle prime fasi della riproduzione sessuale in molte piante da fiore.
Nella famiglia delle Brassicaceae, dove gli stimmi sono di tipo "secco", una serie di checkpoint molecolari agiscono in più fasi del processo riproduttivo regolando l'impollinazione, in modo tale che solo il polline compatibile abbia successo. L'idratazione del polline è uno dei punti di controllo più importanti (Figura 1), poiché il polline che non riesce a idratarsi non può progredire per produrre un tubo pollinico e successivamente consegnare lo sperma al gametofito femminile. Spesso, i cereali incompatibili non riescono a superare questo primo punto di controllo dell'impollinazione e quindi non ottengono l'accesso all'acqua stigmatica3. Tra i membri della famiglia delle Brassicaceae, il riconoscimento del polline avviene rapidamente, con compatibilità stabilita entro pochi minuti dall'attaccamento del granello di polline al pistillo 4,5. Negli ultimi anni sono stati fatti molti progressi e ora stiamo iniziando a capire i meccanismi molecolari che regolano i punti chiave di controllo dell'impollinazione.
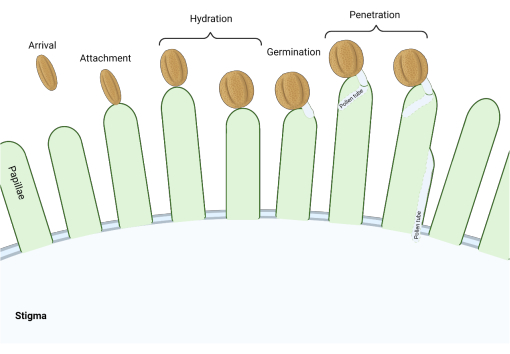
Figura 1: Panoramica degli eventi chiave durante l'impollinazione compatibile. Queste fasi, come l'idratazione del polline e la germinazione del tubo pollinico, sono anche "punti di controllo" di impollinazione che devono essere navigati con successo per effettuare un'impollinazione compatibile. Il diagramma rappresenta uno stigma di tipo "secco", tipico delle specie della famiglia delle Brassicaceae 2,20. Fare clic qui per visualizzare una versione ingrandita di questa figura.
La ricerca pionieristica sul sistema di auto-incompatibilità (SI) di Brassica, in cui il polline "self" viene riconosciuto e rifiutato, ha stabilito il paradigma per il riconoscimento dello stigma del polline nelle Brassicaceae 6,7,8,9,10. L'SI in Brassica e nei suoi parenti è mediato da proteine di "riconoscimento" che risiedono sulla superficie del polline e sulla membrana plasmatica stigmatica che, dopo interazione, portano al rigetto del polline. Il rigetto del polline SI opera per interruzione del sistema basale di compatibilità polline-stigma che, quando completamente attivato dalla percezione del polline compatibile, porta alla secrezione mirata da parte dello stigma, guidando così l'idratazione del polline (per le revisioni del meccanismo di compatibilità del polline, vedi11,12). Nell'esempio di SI, il ligando trasmesso dal polline è una piccola proteina ricca di cisteina, ricca di cisteina S-locus (SCR / SP11) e il recettore stigmatico è la chinasi del recettore S-locus (SRK).
Recentemente, in Arabidopsis thaliana, un altro gruppo di piccole proteine polline ricche di cisteina, la proteina del rivestimento pollinico di classe B (AtPCP-Bs), è stata trovata per essere importanti regolatori dell'accettazione del polline attraverso l'attivazione dell'idratazione del polline13. Recentemente sono stati descritti anche recettori stigmatici dell'AtPCP-B e aspetti del percorso regolatorio a valle14,15. È interessante notare che gli studi mutazionali sui geni che codificano potenziali mediatori di segnalazione del polline e stigmatici dell'idratazione del polline (compresi i PCP-B) non sono riusciti a generare piante che hanno un blocco completo al checkpoint di idratazione del polline. Ciò suggerisce fortemente che molteplici altri fattori, ancora non scoperti, svolgono un ruolo nella regolazione dell'idratazione del polline. Basandoci sul metodo descritto per la prima volta da Wang et al.13, qui descriviamo un saggio biologico in vivo ad alta risoluzione migliorato adatto per l'identificazione di sottili difetti di idratazione del polline nelle linee candidate mutanti di A. thaliana.
Protocol
1. Crescita delle piante e preparazione dei fiori
- Stratificare i semi di A. thaliana in agarosio allo 0,1% o acqua sterile per 3 giorni a 4 °C, o come semi secchi per 16-24 h a -20 °C (uNASC, comunicazione personale).
- Trasferire i semi stratificati in vasi di compost e metterli in una camera di crescita controllata dal punto di vista ambientale. Propagare le piante con un fotoperiodo chiaro:scuro di 16:8 h, fornito da tubi fluorescenti (130 μmol m-2 s-1). Mantenere la temperatura a 21 ± 2 °C con circa il 40% di umidità relativa.
- Assicurarsi che le piante donatrici e riceventi di polline, insieme a qualsiasi altra linea di piante di "controllo" appropriate, siano seminate insieme per garantire una fioritura sincrona. Propagare le piante per circa 6 settimane fino a quando le infiorescenze sono ben stabilite.
- Selezionare i boccioli di fiori dello stadio 12 sulla pianta ricevente del polline 1 giorno prima di eseguire il saggio biologico per l'evirazione 16,17-questi sono boccioli di fiori non aperti che completeranno l'apertura del fiore e la deiscenza dell'antera il giorno successivo 18.
NOTA: Evitare i primi tre fiori prodotti sull'infiorescenza principale, poiché in genere mostrano un comportamento riproduttivo insolito. Se disponibile e appropriato per lo studio, utilizzare una linea di piante sterili maschili, come la linea pA9-barnase di A. thaliana (adesione Col-0), dove le antere non riescono a maturare19. - Per evirare i fiori del destinatario del polline, posizionare la pianta, nella sua pentola, su un lato. Fissare il gambo della pianta, nella regione vicino ai fiori che saranno evirati, su un vetrino che è in posizione sotto un microscopio da dissezione stereo.
- Usando un paio di pinze a punta fine, stuzzicare con cura il bocciolo del fiore e rimuovere tutti i petali e le antere dei fiori. Assicurarsi che il pistillo non sia danneggiato e che lo stigma sia privo di polline contaminante.
NOTA: Le linee di piante sterili maschili non richiedono evirazione. - Riportare le piante nella camera di crescita e assicurarsi che i fiori evirati non entrino in contatto con altre piante o oggetti estranei.
2. Saggio di idratazione del polline-acquisizione di dati grezzi
- La mattina seguente, rimuovere le piante dalla camera di crescita. Posare la pianta ricevente di polline su un lato e posizionare il fiore sul palco di un microscopio invertito (Figura 2) in modo che lo stigma possa essere chiaramente ripreso.
- Fissare la posizione del fiore da fotografare immobilizzando lo stelo su un vetrino usando strisce di nastro adesivo. Mantenere la temperatura tra 18 °C e 25 °C e l'umidità relativa al di sotto del 60%.
NOTA: Per la linea di piante sterili maschili pA9-barnase, è ottimale eseguire il test al mattino quando i fiori si aprono e i petali non ostacolano il campo visivo. - Quindi, rimuovere un fiore sano e appena aperto dalla pianta donatrice di polline. Mettere sotto un microscopio da dissezione e raccogliere alcuni granelli di polline sulla punta di una pinza pulita a punta fine toccando delicatamente le antere (Figura 3A). Una ciglia attaccata a un'asta corta è anche uno strumento efficace per raccogliere e trasferire il polline (Figura 3C).
- Rimuovere il polline in eccesso dalle pinze toccandole leggermente contro i petali dei fiori da dove sono stati raccolti i granuli di polline, fino a formare un monostrato di grani di polline sulla punta della pinza.
NOTA: Un monostrato di granuli di polline sulla punta di una pinza a punta fine faciliterà significativamente il trasferimento di singoli grani nelle fasi successive. È anche possibile ottenere un singolo granello di polline sulla pinza con questa tecnica (Video supplementare S1). - Tornare alla pianta ricevente di polline e, utilizzando una lente obiettiva a bassa potenza (ad esempio, lente obiettivo 10x; Figura 3B), focalizzare il microscopio invertito sullo stigma da impollinare.
- Tenendo la pinza lungo l'apertura tra le braccia della pinza (Figura 4), avvicinarsi con attenzione a una cellula della papilla stigmatica non impollinata ("vergine").
NOTA: Abbiamo scoperto che questo metodo di tenere la pinza aiuta la destrezza e riduce l'impatto delle mani tremanti. Un micromanipolatore può essere utilizzato per gli utenti meno esperti o che hanno difficoltà ad applicare con precisione un singolo granello di polline a mano. - Selezionare un granello di polline opportunamente posizionato sulla pinza per il trasferimento allo stigma. Continuare ad avvicinarsi alla cellula della papilla stigmatica non impollinata fino a quando il granello di polline selezionato non entra in contatto leggero con la sua superficie. Ritirare lentamente la pinza e confermare l'attaccamento del polline (Figura 5).
NOTA: il video supplementare S1 e il video supplementare S2 dimostrano questo passaggio con grani di polline singoli e multipli presenti sulle pinze. - Assicurarsi che il granello di polline sia orientato in modo tale che il suo asse equatoriale sia chiaramente visibile e ben messo a fuoco. Passare immediatamente a un obiettivo di potenza superiore (ad esempio, 20x) e acquisire un'immagine del granello di polline. Questa prima immagine è T = 0. Continuare a catturare ulteriori immagini a intervalli di 1 minuto per un totale di 10 minuti.
- Regolare la messa a fuoco secondo necessità per accogliere piccoli movimenti nel granello di polline o nello stigma. Registrare la temperatura ambiente e l'umidità relativa della stanza ogni 2 minuti per consentire confronti futuri tra repliche sperimentali.
- Una volta acquisite tutte le immagini, salvarle in un formato senza perdita di dati, ad esempio il formato proprietario del produttore o come TIFF.
NOTA: Ci saranno 11 immagini per ogni granello di polline campionato (Figura supplementare S1). Le impostazioni di acquisizione timelapse automatizzate/manuali nella maggior parte dei software proprietari di acquisizione immagini sono funzioni utili per facilitare l'organizzazione di ogni serie temporale. - Ripetere i passaggi da 2,4 a 2,9 per ulteriori grani di polline. Acquisire dati per un numero quasi equivalente di impollinazioni di controllo (wild type [WT]) e sperimentali.

Figura 2: Configurazione dell'apparecchiatura utilizzata per il biotest di idratazione del polline. In questo esempio, una linea di piante sterili maschili pA9-barnase era il destinatario del polline. La pianta, all'interno del suo vaso, è stata posta su un fianco, e lo stelo fissato a un vetrino posizionato sul palco del microscopio. Per ridurre le sollecitazioni meccaniche e favorire il posizionamento della pianta, è stata utilizzata una piattaforma regolabile per sostenere il vaso. Fare clic qui per visualizzare una versione ingrandita di questa figura.
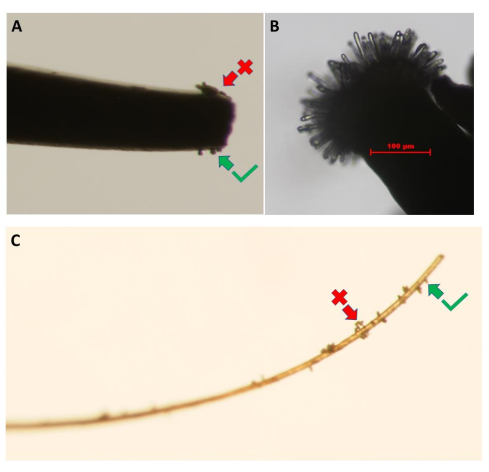
Figura 3: Raccolta dei granuli di polline dal fiore donatore di polline. Le immagini mostrano l'uso di (A) pinze a punta fine e (C) un pezzo di ciglia. I ciuffi di polline (freccia rossa) devono essere rimossi toccandoli leggermente contro i petali dei fiori donatori fino ad ottenere un monostrato di granelli di polline (freccia verde). (B) Immagine ad alta risoluzione di uno stigma della linea sterile maschile non impollinata di A. thaliana (Col-0) pA9-barnase che ha raggiunto lo stadio di sviluppo appropriato per il biotest di idratazione del polline. Barra della scala = 100 μm (B). Fare clic qui per visualizzare una versione ingrandita di questa figura.
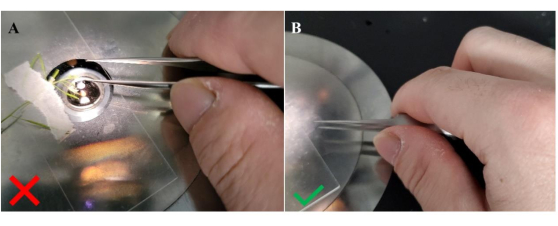
Figura 4: Metodo per trattenere la pinza durante il trasferimento del polline allo stigma ricevente. (A) Orientamento errato per tenere la pinza; (B) orientamento corretto per tenere la pinza. Tenere la pinza lateralmente in questa configurazione, come indicato dalla posizione del pollice tra le braccia della pinza, fornisce una maggiore stabilità per facilitare il trasferimento dei grani di polline alle papille stigmatiche non impollinate. Fare clic qui per visualizzare una versione ingrandita di questa figura.
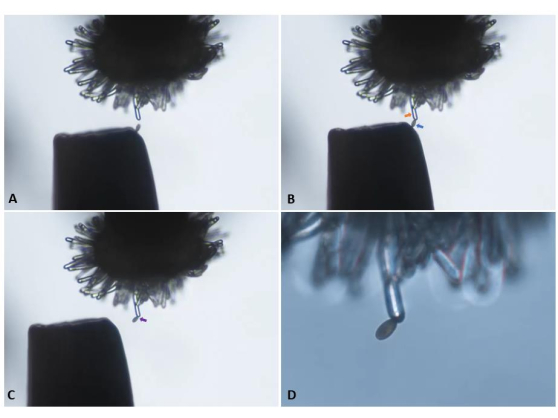
Figura 5: Trasferimento di un singolo granello di polline dalla punta di un paio di pinze a una papilla stigmatica non impollinata ("vergine") di una pianta sterile maschio pA9-barnase. (A) Approccio attento verso la cellula della papilla. (B) Attacco di un granello di polline opportunamente posizionato (freccia blu) alla cellula della papilla (freccia arancione). (C) Ritiro della pinza e conferma visiva dell'attacco del polline (freccia viola). I pannelli A-C sono stati ripresi con un obiettivo 10x (distanza di lavoro 10,5 mm; apertura numerica 0,25) e sono istantanee derivate dal video clip presentato in Supplementary Video S1. (D) Passaggio a un obiettivo 20x (distanza di lavoro 2,1 mm; apertura numerica 0,5) per l'avvio dell'acquisizione di immagini in una serie temporale. Fare clic qui per visualizzare una versione ingrandita di questa figura.
3. Misurazioni-saggio di idratazione del polline
- Definire il tasso di idratazione del polline come la variazione di lunghezza del semiasse minore (Figura 6) del granello di polline (cioè il raggio equatoriale) nel tempo e presentarlo come variazione percentuale (equazione [1]):
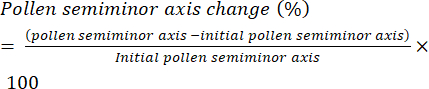 (1)
(1) - Utilizzando il software di analisi delle immagini, registrare i valori dei semiassi minori per ciascun granello di polline nella serie sperimentale.
NOTA: il nome di questa opzione di misurazione dipende dal software, ad esempio "Ellisse ruotata" o "Ellisse a 5 punti". - Ripetere i passaggi 3.1-3.2 per tutti gli altri grani di polline da misurare. Per coerenza, applicare lo stesso grado di zoom digitale e lo stesso approccio alla definizione del "confine del polline" per tutte le misurazioni nei set di dati.
- Una volta completate tutte le misurazioni per una serie temporale, esportare i valori degli assi semi-minori non elaborati di ogni pila di immagini in un foglio di calcolo e presentare i dati in colonne per pila di immagini. Garantire l'inclusione dei dati di almeno 15 granuli di polline idratati nell'analisi per ogni linea di piante (Tabella supplementare S1).
- Non è insolito che un piccolo numero di granuli di polline non riesca a idratarsi o idratarsi significativamente più lentamente del previsto. Questi grani "dud" possono essere il risultato di uno scarso contatto tra il grano e la cellula della papilla o legati alla vitalità del polline. Cercarli ed escluderli dal set di dati a meno che non siano richiesti nella loro progettazione sperimentale.
- Calcolare i valori medi per ogni punto temporale per linea di impianto. Utilizzare test t spaiati e ANOVA unidirezionale per l'analisi statistica dei dati di idratazione da WT e linee mutanti in ogni punto temporale. Utilizzare un t-test multiplo per il confronto simultaneo delle medie tra WT e linee mutanti su più punti temporali.
NOTA: I grafici XY sono anche molto utili per visualizzare la tendenza generale dell'idratazione del polline tra le linee di piante confrontate.
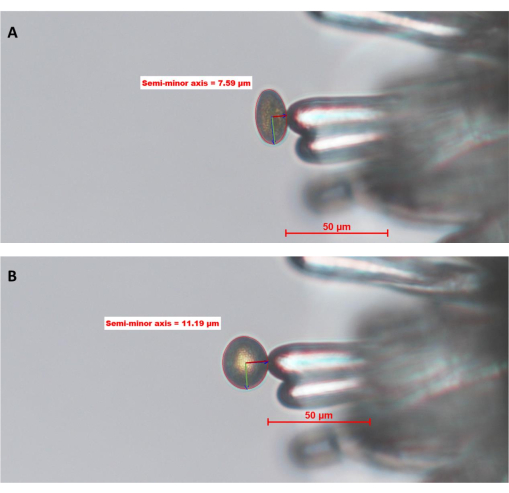
Figura 6: Idratazione del granello di polline WT su una papilla stigmatica di A. thaliana (Col-0; linea sterile maschile pA9-barnase). (A) Punto temporale zero, 0 (0 MAP) e (B) 10 MAP. Il cerchio rosso attorno al granello di polline è il "confine del polline" definito e disegnato dall'operatore utilizzando il software di analisi delle immagini. Le linee verde e rosso scuro all'interno del polline rappresentano rispettivamente gli assi semi-maggiore e semi-minore. La lunghezza del semiasse minore viene utilizzata per calcolare il grado di idratazione del polline. Una serie temporale completa di questo set di dati è disponibile nella figura supplementare S1. L'immagine è stata scattata con un obiettivo 20x (distanza di lavoro 2,1 mm; apertura numerica 0,5). Barre della scala = 50 μm. Abbreviazione: MAP = min-post-impollinazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Representative Results
Questa sezione presenta due serie di esempi di dati sull'idratazione del polline, raccolti come descritto sopra, per A. thaliana. La prima serie di dati consiste in tre repliche di una serie temporale di idratazione del polline per le piante WT, ciascuna delle quali è stata raccolta in un giorno diverso. Ogni replica contiene non meno di 18 singoli valori di granulo di polline, per un totale di 55 grani di polline in tutte e tre le repliche. I valori minimi e massimi per le medie tra le repliche, per tutti i punti temporali, erano entro il 3% (Figura 7 e Tabella supplementare S1). Questi dati rappresentativi per l'impollinazione WT dimostrano chiaramente l'alto grado di coerenza che può essere ottenuto utilizzando la metodologia qui descritta per numeri di campioni relativamente bassi e in giorni diversi.
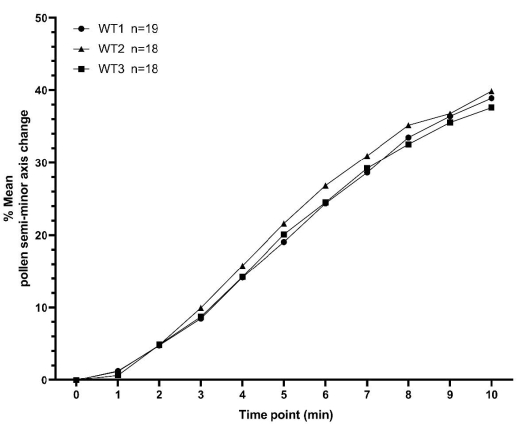
Figura 7: Grafico XY che mostra la consistenza dei profili di idratazione del polline selvatico di A. thaliana su un periodo di tempo di 10 minuti. Il genitore del polline era l'adesione Col-0 di A. thaliana e il genitore del pistillo era la linea sterile pA9-barnase maschile di A. thaliana (Col-0). I dati rappresentano tre set di dati indipendenti raccolti in giorni diversi e dimostrano un alto grado di coerenza. Un diagramma a scatola e baffi e un'analisi statistica dei mezzi per questi set di dati sono presentati nella figura supplementare S2. Il numero di pollini misurati ('n') per ciascun set di dati indipendente viene visualizzato accanto alla sintassi (WT1/WT2/WT3) sulla figura. Abbreviazione: WT = wild type. Fare clic qui per visualizzare una versione ingrandita di questa figura.
La seconda serie di dati è stata ottenuta per una linea vegetale che ospita un'inserzione di T-DNA in un gene codificante proteine del rivestimento pollinico che genera una mutazione "knockdown", qui indicata come "mutante KD". Il polline mutante è stato depositato su stimmi sterili maschili pA9-barnase per il profilo di idratazione, come descritto nel protocollo. Come si può vedere dai dati risultanti (Figura 8), il polline mutante e WT aveva profili di idratazione indistinguibili nei primi 5 minuti. Tuttavia, 5-10 minuti dopo l'impollinazione (MAP), la variazione media dell'asse semi-minore per il polline mutante ha iniziato a scendere rispetto a quella del polline WT, con la differenza che è diventata statisticamente significativa a 10 MAP. Questo risultato non solo dimostra che questa proteina del rivestimento pollinico ha un ruolo nel mediare l'idratazione del polline, ma illustra anche bene l'utilità di questo biotest ad alta risoluzione a granulo singolo per monitorare l'idratazione del polline. In questo particolare esempio, la sua sensibilità è stata in grado di rilevare l'effetto sottile di un "knockdown" di un gene codificante le proteine del rivestimento pollinico.
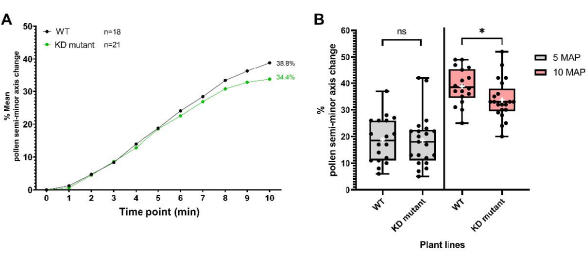
Figura 8: Profili di idratazione del polline per WT e una linea mutante di proteine del rivestimento pollinico "knockdown" (mutante KD). (A) Profili di idratazione su un periodo di tempo di 10 minuti per WT e polline mutante. I genitori del polline erano l'adesione Col-0 di A. thaliana e la proteina del rivestimento pollinico KD mutante (anche nello sfondo Col-0). In entrambi i casi, il genitore del pistillo era la linea sterile pA9-barnase maschio di A. thaliana (Col-0). (B) Grafici a scatola e baffi che mostrano l'entità dell'idratazione del polline (in termini di variazione percentuale del semiasse minore) a 5 MAP e 10 MAP per i set di dati WT e polline mutante. I baffi rappresentano i valori minimi e massimi del campione. Le caselle rappresentano il quartile inferiore, la mediana e il quartile superiore del set di dati. Le croci bianche rappresentano la media del set di dati. L'analisi del t-test spaiata mostra che la percentuale media di idratazione del polline è significativamente diversa tra le due linee di piante a 10 MAP. Un asterisco indica p < 0,05 (test t spaiato). Abbreviazioni: WT = wild type; KD = abbattimento; MAP = min-post-impollinazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Figura supplementare S1: Una serie temporale di un granello di polline WT idratato su una cellula di papilla stigmatica di una pianta sterile maschio pA9-barnase nel corso di 10 minuti. Le immagini sono state scattate a intervalli di 1 minuto. Le immagini a 0 MAP e 10 MAP sono state utilizzate nella Figura 6 (allegate separatamente). Barra di scala = 50 μm. Abbreviazioni: WT = wild type; MAP = min-post-impollinazione. Clicca qui per scaricare questo file.
Figura supplementare S2: Grafico a scatola e baffi che mostra l'entità dell'idratazione del polline (in termini di variazione percentuale del semiasse minore) su un periodo di tempo di 10 minuti per i tre set di dati di polline WT descritti nella Figura 7. Il genitore del pistillo era la linea sterile pA9-barnase maschio A. thaliana (Col-0). I baffi rappresentano i valori minimi e massimi del campione. Le caselle rappresentano il quartile inferiore (cerniera inferiore), la mediana (cerniera centrale) e il quartile superiore (cerniera superiore) del set di dati. Vengono visualizzati i singoli punti dati. ANOVA unidirezionale mostra che la percentuale media di valori di idratazione del polline tra i tre set di dati non era statisticamente significativamente diversa l'una dall'altra durante il periodo di tempo di 10 minuti. La soglia significativa è p < 0,05 (ANOVA unidirezionale). Abbreviazione: WT = wild type. Clicca qui per scaricare questo file.
Tabella supplementare S1: Dati grezzi sull'idratazione del polline utilizzati per costruire la Figura 7 (A. thaliana WT Col-0 pollen on pA9-barnase male sterile stigma). Clicca qui per scaricare questo file.
Video supplementare S1: Un video che dimostra il trasferimento di un singolo granello di polline WT (adesione Col-0) sulla punta di un paio di pinze a una papilla stigmatica "vergine" (linea sterile maschile pA9-barnase). Per facilitare l'accessibilità del video, la qualità dell'immagine è stata intenzionalmente abbassata. Clicca qui per scaricare questo file.
Video supplementare S2: Un video che dimostra il trasferimento di un singolo polline WT (adesione Col-0) da un monostrato di granuli di polline sulla punta di un paio di pinze a una papilla stigmatica "vergine" (linea sterile maschile pA9-barnase). Per facilitare l'accessibilità del video, la qualità dell'immagine è stata intenzionalmente abbassata. Clicca qui per scaricare questo file.
Discussion
Per le piante da fiore, le primissime fasi della riproduzione sessuale sono probabilmente le più importanti. A livello dell'interazione polline-stigma, vengono prese decisioni molecolari che determinano la "compatibilità" dei partner interagenti. Tali decisioni, se prese correttamente, evitano lo spreco di risorse che potrebbe influire sull'idoneità riproduttiva21. Pertanto, consentire solo al polline compatibile di effettuare la fecondazione è una componente importante del mantenimento di genotipi ben adattati, e quindi del successo evolutivo delle specie. La ricerca condotta con la pianta modello A. thaliana è stata estremamente preziosa per approfondire la nostra comprensione di questo processo. Numerosi studi negli ultimi decenni hanno rivelato la presenza di fattori nel rivestimento pollinico che agiscono al primo "checkpoint" di compatibilità, dove il polline ottiene l'accesso all'acqua stigmatica per consentire l'idratazione del polline13. Nonostante queste prime intuizioni sui meccanismi che regolano la compatibilità tra polline e stigma, ci sono ancora molte lacune nella nostra comprensione di questo processo. Ad oggi, nessun mutante di ligandi trasmessi dal polline o recettori stigmatici noti per influenzare l'idratazione del polline può bloccare completamente l'impollinazione compatibile, suggerendo la presenza di altri determinanti di idratazione del polline non scoperti. Essendo in grado di osservare prontamente il fenotipo di interesse, il saggio biologico di idratazione del polline qui descritto è una delle tecniche più semplici per studiare potenziali mutanti che regolano l'impollinazione.
Le metodologie esistenti per misurare l'idratazione del polline utilizzano comunemente impollinazioni di massa e riportano meno punti temporali 14,22,23, e quindi possono perdere importanti fenotipi sottili del profilo di idratazione. Ad esempio, lo studio di Wang et al.13, insieme al lavoro su altri mutanti della proteina del rivestimento pollinico nel nostro laboratorio (osservazioni non pubblicate), hanno rivelato differenze intriganti nei profili di idratazione tra i mutanti. Tali sottili differenze possono contenere importanti indizi sui meccanismi regolatori alla base dell'impollinazione compatibile.
Il metodo qui descritto si concentra sull'acquisizione di un numero relativamente piccolo di misurazioni tra linee di piante mutanti e WT, con particolare attenzione alla precisione metodologica per ridurre la variazione all'interno dei set di dati. Sebbene questo metodo sia altamente riproducibile (come mostrato nella Figura 7), supponendo che la temperatura e l'umidità siano adeguatamente controllate, è importante raccogliere dati di idratazione per un numero quasi uguale di WT e polline mutante nello stesso giorno per ridurre ulteriormente il potenziale di variazione. I dati possono quindi essere raggruppati in giorni diversi, se necessario. Inoltre, la selezione degli impianti di controllo WT appropriati è fondamentale per una corretta interpretazione dei risultati di idratazione. Per il destinatario del polline, la stessa linea vegetale dovrebbe essere utilizzata per ricevere sia il controllo WT che i grani di polline mutanti.
Ad esempio, utilizziamo la linea di piante sterili maschili pA9-barnase, che è anche presente nel protocollo video, come destinatario del polline sia per WT (controllo) che per il polline mutante (sperimentale) quando studiamo le linee mutanti del polline del T-DNA (come il mutante "KD" descritto nella Figura 8). La mescolanza dei dati provenienti da una tale linea sterile maschile, che non deve essere evirata, con quelli raccolti da una linea di controllo evirata manualmente dovrebbe essere evitata poiché questi stigmi probabilmente si comporteranno in modo diverso. Allo stesso modo, le linee mutanti evirate dovrebbero essere utilizzate in combinazione con una linea WT (controllo) evirata quando possibile. La stessa cautela dovrebbe essere applicata anche quando si considera il background genetico delle piante in studio. Mentre le collezioni più popolari di mutanti del T-DNA sono state generate nello sfondo Col-0, altre, come la collezione FLAG dell'Institut national de la Recherche Agronomique (INRA), sono disponibili nel background genetico Wassilewskija (WS)24,25. In tali casi, è consigliabile utilizzare come controlli le linee di impianti WT del rispettivo ecotipo.
Sebbene qui ci siamo concentrati sull'idratazione del polline nei primi 10 minuti dell'interazione polline-stigma, questo metodo può anche essere adattato per comprendere profili di idratazione che coprono un periodo di tempo più lungo. Una caratteristica chiave del protocollo è che i fiori rimangono attaccati alla corrente della pianta madre I protocolli pubblicati richiedono tipicamente l'escissione del pistillo e il posizionamento nei mezzi per sostenere il tessuto per la durata dell'esperimento14,18,26. Sebbene non vi siano prove dirette che suggeriscano che un tale approccio semi in vivo influisca sull'idratazione del polline o addirittura alteri la regolazione in vivo di questo processo, è concepibile che l'escissione dei fiori dalla pianta madre possa influire sull'impollinazione. Pertanto, questo protocollo raggiunge un vero ambiente in vivo per lo studio dell'interazione polline-stigma, in cui viene preservata l'integrità strutturale della pianta.
Il trasferimento di singoli granuli di polline a papille stigmatiche "vergini" è probabilmente una delle operazioni più impegnative descritte in questo protocollo. Non è raro trasferire grappoli di granuli di polline per errore. Tuttavia, la possibilità che ciò si verifichi può essere notevolmente ridotta assicurando che solo un monostrato di polline sia presente sul forcipe (Figura 3A) (o anche solo un singolo granello di polline; Figura 5), e/o utilizzando granelli di polline già orientati, in modo tale che "sporgano" dagli altri sulla punta della pinza. Abbiamo scoperto che un operatore esperto può completare con successo il trasferimento di un singolo polline a una cellula di papilla stigmatica in circa 3 minuti e registrare i dati per un massimo di cinque grani di polline in un periodo di 1 ora. Pertanto, in un periodo di 2-4 giorni, è possibile accumulare dati sufficienti per un'analisi statistica significativa delle linee di piante in studio.
L'errore umano è potenzialmente la più grande fonte di variazione nell'analisi dei set di dati derivati da studi che utilizzano questo protocollo. Ad esempio, la definizione del "confine del polline" durante l'analisi delle immagini dipende dal giudizio del singolo ricercatore. Pertanto, esiste la possibilità che le misurazioni effettuate da diversi ricercatori, anche sullo stesso set di dati, possano generare variazioni. Ove possibile, un singolo ricercatore dovrebbe effettuare le misurazioni per ridurre al minimo gli errori di campionamento. Inoltre, l'accoppiamento dell'analisi di WT e set di dati mutanti da parte dello stesso operatore nega la definizione potenzialmente soggettiva del "confine del polline" e della variazione interoperatore.
In conclusione, viene descritto un metodo sofisticato ma accurato per misurare i profili di idratazione del polline nell'organismo modello A. thaliana. Abbiamo dimostrato che, utilizzando questo protocollo, è possibile acquisire facilmente dati di idratazione del polline altamente coerenti per A. thaliana. Tre lotti indipendenti di dati per l'impollinazione WT acquisiti in giorni diversi hanno mostrato piccole deviazioni costanti del <3% in tutti i punti temporali (Figura 7 e Tabella supplementare S1). Sebbene il biotest qui presentato sia leggermente più complesso rispetto alla maggior parte dei protocolli esistenti, la risoluzione dei dati generati è superiore e adatta per l'identificazione e la caratterizzazione di nuovi mutanti che influenzano i percorsi che regolano l'impollinazione compatibile.
Disclosures
Gli autori non hanno conflitti di interesse da dichiarare.
Acknowledgements
Questa ricerca è stata supportata dalle borse di studio post-laurea dell'Università di Bath (Università di Bath, Bath, Regno Unito, BA2 7AY) a Y.-L.L. e L.W. Figure 1 è stato creato con BioRender.com (https://biorender.com/).
Materials
| Name | Company | Catalog Number | Comments |
| A9-barnase line | University of Bath | Courtsey of Prof. Rod Scott | Male sterile Arabidopsis thaliana wildtype equivalent line of the ecotype Columbia-0 |
| Dumont Tweezer, Dumont #5 Inox 11cm | Fisher | Dumont 500342 | Tweezer uses for transfer of pollen grain |
| GraphPad Prsim (version 8.0.2) | Dotmatics | Prism | Comprehensive data analysis, graphing and statistics software |
| JMP (version 17) | JMP Statistical Discovery LLC | JMP 17 | Statistical analysis software |
| Levington F2S seed & modular compost (with sand) | Levington | LEV75F2SMS | General-purpose compost for plant growth |
| Micromanipulator | Singer instrument Co. LTD. | Singer Micromanipulator | Micromanipulator to aid transfer of pollen grain |
| Nikon Digit sight DS-U1 | Nikon | DS-U1 | Microscope camera (coupletd to SMZ1500) |
| Nikon Eclipse TE2000-S Inverted Microscope | Nikon | TE2000-S | Inverted microscope |
| Nikon SMZ1500 Stereomicroscope | Nikon | SMZ1500 | Stereomicroscope |
| Nikon DS-Fi3 microscope camera | Nikon | DS-Fi3 | Microscope camera (coupletd to TE2000-S) |
| Nikon NIS-Elements Basic Research | Nikon | NIS-Elements BR | Image accquisition and analysis software (for DS-Fi3) |
| Nikon NIS-Elements F | Nikon | NIS-Elements F | Image accquisition and analysis software (for DS-U1) |
| WT Col-0 plant line | NASC | N700000 | Wildtype Arabidopsis thaliana, ecotype Columbia-0 |
References
- Rieseberg, L. H., Willis, J. H. Plant speciation. Science. 317 (5840), 910-914 (2007).
- Hiscock, S. J., Allen, A. M. Diverse cell signalling pathways regulate pollen-stigma interactions: the search for consensus. New Phytologist. 179 (2), 286-317 (2008).
- Kandasamy, M. K., Nasrallah, J. B., Nasrallah, M. E. Pollen pistil interactions and developmental regulation of pollen-tube growth in Arabidopsis. Development. 120 (12), 3405-3418 (1994).
- Bosch, M., Wang, L. Pollen-stigma interactions in Brassicaceae: complex communication events regulating pollen hydration. Journal of Experimental Botany. 71 (9), 2465-2468 (2020).
- Rozier, F., et al. Live-cell imaging of early events following pollen perception in self-incompatible Arabidopsis thaliana. Journal of Experimental Botany. 71 (9), 2513-2526 (2020).
- Dickinson, H. Dry stigmas, water and self-incompatibility in Brassica. Sexual Plant Reproduction. 8, 1-10 (1995).
- Takasaki, T., et al. The S receptor kinase determines self-incompatibility in Brassica stigma. Nature. 403 (6772), 913-916 (2000).
- Schopfer, C. R., Nasrallah, M. E., Nasrallah, J. B. The male determinant of self-incompatibility in Brassica. Science. 286 (5445), 1697-1700 (1999).
- Takayama, S., et al. Direct ligand-receptor complex interaction controls Brassica self-incompatibility. Nature. 413 (6855), 534-538 (2001).
- Shiba, H., et al. A pollen coat protein, SP11/SCR, determines the pollen S-specificity in the self-incompatibility of Brassica species. Plant Physiology. 125 (4), 2095-2103 (2001).
- Broz, A. K., Bedinger, P. A. Pollen-pistil interactions as reproductive barriers. Annual Review of Plant Biology. 72 (1), 615-639 (2021).
- Cheung, A. Y., Duan, Q., Li, C., James Liu, M. -. C., Wu, H. -. M. Pollen-pistil interactions: It takes two to tangle but a molecular cast of many to deliver. Current Opinion in Plant Biology. 69, 102279 (2022).
- Wang, L. D., et al. PCP-B class pollen coat proteins are key regulators of the hydration checkpoint in Arabidopsis thaliana pollen-stigma interactions. New Phytologist. 213 (2), 764-777 (2017).
- Liu, C., et al. Pollen PCP-B peptides unlock a stigma peptide-receptor kinase gating mechanism for pollination. Science. 372 (6538), 171-175 (2021).
- Bordeleau, S. J., Sanchez, L. E. C., Goring, D. R. Finding new Arabidopsis receptor kinases that regulate compatible pollen-pistil interactions. Frontiers in Plant Science. 13, 1022684 (2022).
- Suwabe, K., et al. Double-locking mechanism of self-compatibility in Arabidopsis thaliana: the synergistic effect of transcriptional depression and disruption of coding region in the male specificity gene. Frontiers in Plant Science. 11, 576140 (2020).
- Smyth, D. R., Bowman, J. L., Meyerowitz, E. M. Early flower development in Arabidopsis. Plant Cell. 2 (8), 755-767 (1990).
- Lee, H. K., Macgregor, S., Goring, D. R. A toolkit for teasing apart the early stages of pollen-stigma interactions in Arabidopsis thaliana. Pollen and Pollen Tube Biology. 2160, 13-28 (2020).
- Dilkes, B. P., et al. The maternally expressed WRKY transcription factor TTG2 controls lethality in interploidy crosses of Arabidopsis. PLoS Biology. 6 (12), 2707-2720 (2008).
- Riglet, L., et al. KATANIN-dependent mechanical properties of the stigmatic cell wall mediate the pollen tube path in Arabidopsis. eLife. 9, e57282 (2020).
- Zhou, L. Z., Dresselhaus, T. Friend or foe: Signaling mechanisms during double fertilization in flowering seed plants. Plant Development and Evolution. 131, 453-496 (2019).
- Gao, X. -. Q., et al. The Arabidopsis KINβγ subunit of the SnRK1 complex regulates pollen hydration on the stigma by mediating the level of reactive oxygen species in pollen. PLoS Genetics. 12 (7), e1006228 (2016).
- Lee, H. K., Goring, D. R. Two subgroups of receptor-like kinases promote early compatible pollen responses in the Arabidopsis thaliana pistil. Journal of Experimental Botany. 72 (4), 1198-1211 (2021).
- O'Malley, R. C., Barragan, C. C., Ecker, J. R. A user's guide to the Arabidopsis T-DNA insertion mutant collections. Pollen and Pollen Tube Biology. 1284, 323-342 (2015).
- Samson, F., et al. FLAGdb++: a database for the functional analysis of the Arabidopsis genome. Nucleic Acids Research. 32, D347-D350 (2004).
- Doucet, J., et al. Investigations into a putative role for the novel BRASSIKIN pseudokinases in compatible pollen-stigma interactions in Arabidopsis thaliana. BMC Plant Biology. 19 (1), 549 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved