Анализ трансгенерационного эпигенетического наследования C. elegans с использованием флуоресцентного репортера и хроматиновой иммунопреципитации (ChIP)
* These authors contributed equally
In This Article
Summary
В этом протоколе описывается РНК-интерференция и анализ ChIP для изучения эпигенетического наследования РНК-индуцированного сайленсинга и связанных с ним модификаций хроматина у C. elegans.
Abstract
Трансгенерационное эпигенетическое наследование (TEI) позволяет передавать информацию через зародышевую линию без изменения последовательности генома с помощью таких факторов, как некодирующие РНК и модификации хроматина. Явление РНК-интерференционного наследования (РНК-интерференции) у нематоды Caenorhabditis elegans является эффективной моделью для исследования TEI, которая использует преимущества короткого жизненного цикла, самораспространения и прозрачности этого модельного организма. При наследовании РНК-интерференции воздействие на животных РНК-интерференции приводит к подавлению экспрессии генов и изменению сигнатур хроматина в целевом локусе, которые сохраняются в течение нескольких поколений при отсутствии первоначального триггера. Этот протокол описывает анализ наследования РНК-интерференции у C. elegans с использованием репортера с экспрессируемым зародышевой линией ядерным зеленым флуоресцентным белком (GFP). Сайленсинг репортеров инициируется кормлением животных бактериями, экспрессирующими двухцепочечную РНК, нацеленную на GFP. В каждом поколении животные пассажируют для поддержания синхронного развития, а сайленсинг репортерных генов определяется с помощью микроскопии. В отдельных поколениях популяции собирают и обрабатывают для иммунопреципитации хроматина (ChIP)-количественной полимеразной цепной реакции (кПЦР) для измерения обогащения модификацией гистонов в репортерном локусе GFP. Этот протокол изучения наследования РНК-интерференции может быть легко модифицирован и объединен с другими анализами для дальнейшего изучения факторов TEI в малых путях РНК и хроматина.
Introduction
Эпигенетическое наследование позволяет передавать генную регуляторную информацию из поколения в поколение и, следовательно, может позволить окружающей среде или опыту родителей влиять на их потомство. У C. elegans подавление гена зародышевой линии, инициированное экзогенной двухцепочечной РНК (дцРНК), может наследоваться в течение нескольких поколений у потомства, не подвергавшегося воздействию исходного триггера 1,2,3,4. Этот процесс, называемый РНК-интерференционным (РНК-интерференционным) наследованием, является одним из нескольких связанных эпигенетических феноменов сайленсинга у C. elegans, включая мультипоколенческое сайленсинг, инициированное пиРНК2,5, парамутацию/РНК-э (РНК-индуцированное эпигенетическое молчание)6,7,8 и многокопийное подавление массива9, которые имеют перекрывающиеся, но различные требования к механизмам регуляции малых РНК и хроматина . В экзогенной РНК-интерференции C. elegans дцРНК перерабатывается в малые интерферирующие РНК (миРНК), которые действуют в комплексе с первичными белками Argonaute для распознавания своей целевой мРНК. Это нацеливание приводит к амплификации вторичных миРНК, которые связываются со вторичными аргонавтами, чтобы заставить замолчать мРНК-мишень как через цитоплазматический, так и через ядерный пути подавления. Для мишеней РНК-интерференции, экспрессируемой зародышевой линией, ядерный вторичный Argonaute HRDE-1 и дополнительные ядерные факторы РНК-интерференции нацелены на зарождающиеся транскрипты, что приводит к репрессивной репрессии транскрипции и рекрутированию гистон-метилтрансфераз для депонирования репрессивных хроматиновых меток, включая H3K9me310. Гистон H3K9me3 способствует установлению наследственного сайленсинга трансгенов зеленого флуоресцентного белка (GFP), экспрессируемых зародышевой линией, путем наследования РНК-интерференции11,12.
Целью данного протокола является использование трансгена, экспрессирующего белок слияния GFP-гистонов в зародышевой линии, в качестве репортера для наследования РНК-интерференции и анализ изменений в модификациях гистонов в локусе репортерного трансгена с помощью иммунопреципитации хроматина и количественной полимеразной цепной реакции (ChIP-qPCR). В этом протоколе описывается стандартизированный подход к подаче РНК-интерференции на основе пластин для инициирования подавления репортеров. В нем также приводится подробный график передачи животных от поколения к поколению путем изоляции эмбрионов в утробе матери от взрослых особей путем обработки щелочным гипохлоритом («отбеливанием»). Также описаны методы и репрезентативные данные для мониторинга частоты подавления GFP в подпопуляции методами флуоресцентной микроскопии и для гистонов H3K9me3 ChIP-qPCR. Анализы наследования на основе РНК-интерференции на основе репортеров представляют собой хорошо управляемую систему для функционального анализа роли генетических факторов и факторов окружающей среды в эпигенетической регуляции 13,14, а генетические скрининги с использованием таких репортеров выявили как гены, необходимые для 2,3,15, так и гены, которые отрицательно регулируют 16,17 продолжительность трансгенерационного эпигенетического наследования.
Protocol
ПРИМЕЧАНИЕ: График анализа представлен на рисунке 1.
1. Приготовление планшетов из питательной среды для РНК-интерференционной нематоды (РНК-интерференционная среда для выращивания нематод)
- E. coli HT115(DE3), содержащий векторы GFP или контрольной РНК-интерференции, из глицериновых запасов на агаровые пластины Лурии-Бертани (LB) с добавлением ампициллина в дозе 100 мкг/мл. Инкубируйте бактерии в течение ночи при температуре 37 °C.
- На следующий день готовят планшеты RNAi-NGM (1,7% [масс./об.] агар, 0.3% [масс./об.] NaCl, 0.25% [масс./об.] пептон, 1 мМ CaCl2, 5 мкг/мл холестерина, 25 мМ калийфосфатного буфера [рН 6,0], 1 мМ MgSO4, 25 мкг/мл карбенициллина и 5 мМ изопропилового β-d-1-тиогалактопиранозида [IPTG]) в соответствии со стандартным протоколом18.
- Для каждого штамма в анализе подготовьте как минимум шесть планшетов РНК-интерференции с РНК-интерференцией GFP (по две пластины для каждого из трех биологических репликатов) и две пластины РНК-интерференции с контрольной РНК-интерференцией (один биологический репликат).
- Неплотно накройте тарелки фольгой, чтобы защитить от света, и оставьте на ночь при комнатной температуре для высыхания.
- В тот же день, что и заливка планшета РНК-интерференцией, приготовьте 4 мл жидких культур РНК-интерференции.
- В стерильных условиях аликвотные 4 мл бульона LB с добавлением 10 мкг/мл тетрациклина и 100 мкг/мл ампициллина в культуральные пробирки. Соберите отдельные колонии из агаровых пластин LB в каждую пробирку и инкубируйте в течение ночи при встряхивании в течение примерно 16 ч при 37 °C.
- Поместите РНК-интерференционные бактерии на пластины РНК-интерференции.
- После ночного роста измерьте оптическую плотность (OD600) культур, используя разбавление бактерий бульоном LB в соотношении 1:5.
- Разбавляют РНК-интерференционные бактерии до относительного OD 600 из 2 с помощью бульона LB, добавленного 10 мкг/мл тетрациклина и100 мкг/мл ампициллина.
- В стерильных условиях добавьте 150 мкл контрольных или GFP РНК-интерференционных бактерий на каждую пластину RNAi-NGM.
- Перед использованием накройте пластины фольгой и дайте бактериям расти не менее 24 часов при комнатной температуре.
ПРИМЕЧАНИЕ: Неиспользованные планшеты RNAi-NGM можно хранить в перевернутом виде до 1 недели при температуре 4 °C в закрытом контейнере в темноте.
2. Начало анализа наследования РНК-интерференции: обесцвечивание и покрытие эмбрионов поколения P0
ПРИМЕЧАНИЕ: Перед началом анализа наследования РНК-интерференции черви, содержащие репортер GFP mjIs134 [mex-5p::gfp-h2b::tbb-2 3'UTR]7 , должны содержаться без голодания при температуре 21 °C в течение, по крайней мере, двух поколений.
- За 4 дня (96 ч) до начала анализа наследования РНК-интерференции (рис. 1) на каждую 35-миллиметровую стандартную пластину NGM, засеянную бактериями OP50-1, высаживают три или четыре взрослых особи гравида на каждую 35-миллиметровую пластину NGM.
ПРИМЕЧАНИЕ: Достаточно трех пластин NGM на штамм. Для штаммов с пониженной фертильностью может потребоваться более четырех животных на тарелку. - Через 4 дня убедитесь, что взрослая популяция начала откладывать эмбрионы на пластину. Смыть червей с планшетов в пробирки по 1,5 мл, используя 800 мкл буфера M9 с добавлением Triton X-100 (TX-100) (22 мМ KH 2 PO 4, 42 мМ Na2HPO 4, 86 мМ NaCl,1 мМ MgSO 4, 0,01% (v/v) TX-100). Повторите стирку и смешайте в той же пробирке.
- Изолируют эмбрионы от популяции путем отбеливания следующим образом.
- Приготовьте отбеливающий раствор с отбеливателем (6% гипохлорит натрия) и 10 N NaOH в объемном соотношении 1,5:1. Подготовьте достаточное количество, чтобы можно было использовать 250 мкл для каждого образца.
- Центрифугируют пробирки объемом 1,5 мл с червями при концентрации 1 000 x g в течение 1,5-2 мин.
- Отсасывайте надосадочную жидкость, оставляя 100 мкл, не нарушая «гранулы» червя. В качестве альтернативы пробирки можно оставить примерно на 2 минуты, чтобы черви успокоились перед аспирацией.
- Добавьте 650 мкл ddH2O в каждую пробирку, чтобы получить окончательный объем 750 мкл.
ПРИМЕЧАНИЕ: Следующие шаги чувствительны ко времени. - Добавьте 250 мкл отбеливающего раствора в каждую пробирку и запустите таймер.
- Каждые 1-2 минуты тщательно прокручивайте трубки. Через 5 мин проверьте глистов под стереоскопом, чтобы проследить за деградацией взрослых особей.
- Продолжайте вихрь до тех пор, пока черви полностью не растворятся и не останутся только эмбрионы. Немедленно центрифугируйте пробирки при концентрации 1 000 x g в течение 1,5 мин.
ПРИМЕЧАНИЕ: Обесцвечивание, как правило, завершается в течение 6-7 минут, но должно контролироваться под стереоскопом при увеличении, достаточном для наблюдения за выпущенными эмбрионами (40x). Не оставляйте червей в отбеливателе на длительное время, так как это может поставить под угрозу эмбрионы. - После центрифугирования аспирируйте надосадочную жидкость и оставьте примерно 50-100 мкл. Добавьте 1 мл буфера M9 с TX-100 для промывки и перемешивания путем вихряния. Снова центрифугируйте при 1 000 x g в течение 1,5-2 мин и промойте еще не менее двух раз.
- Отсасывайте надосадочную жидкость из окончательной промывки и оставьте примерно 100 мкл в пробирке. Перемешиваем вихревым способом. Пипетку по 2 мкл из каждой пробирки дважды на предметное стекло с этикеткой. Подсчитайте эмбрионы с помощью счетчика, чтобы оценить концентрацию эмбрионов на микролитр.
ПРИМЕЧАНИЕ: Слайды с несколькими морозными лунками могут быть использованы здесь для подсчета репликаций нескольких штаммов. Подсчитывающие предметные стекла можно мыть и использовать повторно.
- Чтобы начать полусинхронизированный рост популяции, смешайте и пипетируйте объем, содержащий 250 эмбрионов, на каждую пластину RNAi-NGM. Используйте две пластины для каждой репликации. Дайте жидкости впитаться.
- Поколение P0, обработанное РНК-интерференцией, инкубируют при 21 °C в течение 4 дней (96 ч) (от эмбрионов до взрослого возраста). Сроки могут варьироваться в зависимости от генотипа.
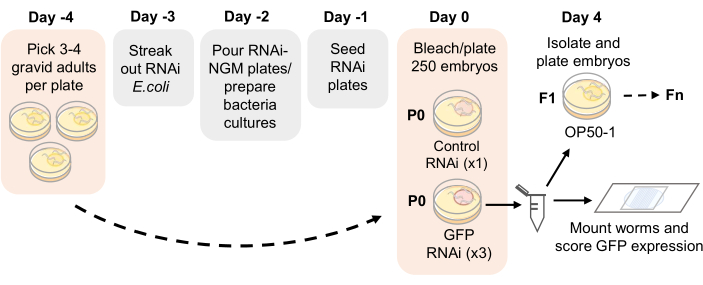
Рисунок 1: Схема анализа наследования РНК-интерференции. Предлагаемый график подготовки планшетов RNAi-NGM и настройки анализа наследования РНК-интерференции. Взрослые особи высевают на 4-й день на тарелки NGM, засеянные OP50-1. Через 4 дня взрослое потомство отбеливают, а эмбрионы помещают на планшеты RNAi-NGM. Поколение P0 подвергается воздействию РНК-интерференции в течение 4 дней при 21 °C. Как только черви достигают зрелого возраста, репликанты пассируются путем обесцвечивания и оцениваются на экспрессию GFP зародышевой линии в каждом поколении. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Пассаж и оценка экспрессии GFP в каждом поколении зародышевой линии
ПРИМЕЧАНИЕ: Чтобы облегчить подсечку, используйте виниловую пластинку для создания агарозных подушечек с линейными гребнями, чтобы выровнять червей. Этот метод был заимствован у Риверы Гомеса и Шварцштейна19.
- Приготовьте 1%-ную агарозу, растворив агарозу в ddH2Oв небольшой колбе путем нагревания в микроволновой печи. Добавьте перемешиватель и накройте фольгой. При переплавке нагрейте агарозу на конфорке при температуре 200 °C при перемешивании. После расплавления уменьшите огонь до 80 °C.
- Смойте червей с планшетов NGM с помощью 800 мкл буфера M9 с TX-100 в пробирку объемом 1,5 мл. Вымойте тарелки дважды, чтобы удалить все взрослые особи. Проверьте пластины под стереоскопом, чтобы убедиться, что животные были собраны эффективно.
- Центрифугируйте пробирки при концентрации 1 000 x g в течение 1,5-2 мин или дайте червям отстояться в течение 2 минут. Отсасывайте надосадочную жидкость и оставляйте 100 мкл, не нарушая «гранулы» червя.
- Подготовьте агарозные подушечки для крепления червей следующим образом.
- Поместите каплю расплавленной 1%-ной агарозы на виниловую пластинку (описанную выше19) с помощью стеклянной пипетки Пастера (с отломанным узким концом).
- Сориентируйте предметное стекло так, чтобы линии на пластинке были горизонтальными или вертикальными, и быстро поместите предметное стекло на каплю агарозы. Подождите примерно 30 секунд, прежде чем снимать предметное стекло с пластинки.
ПРИМЕЧАНИЕ: При оценке нескольких генотипов может быть полезно сделать большую агарозную подушечку на одном предметном стекле и разрезать ее пополам с помощью лезвия.
- Установите червей на агарозные подушечки.
- Под стереоскопом добавьте примерно 5 мкл 5 мМ левамизола в агарозную подушечку. Разбавление левамизола следует делать свежим каждую неделю.
- Осторожно перемешайте пробирки с червями и перенесите 5-10 мкл червей на агарозную подушечку. Оцените количество червей на глаз по мере их добавления, чтобы на одну реплику приходилось примерно 40 червей.
- Выровняйте червей в ряды, используя насадку для ресниц для облегчения подрезки. Добавьте стеклянный покровный листок.
ПРИМЕЧАНИЕ: Горки с животными, установленными таким образом, могут прослужить несколько часов, прежде чем высохнут.
- Изолируйте эмбрионы от остальных животных, используя протокол отбеливания (см. шаг 2.3), прежде чем ставить баллы на предметных стеклах. Планшет 250 эмбрионов на 35-миллиметровые планшеты NGM, засеянные OP50-120. Как только жидкость впитается, переверните пластины и верните их в инкубатор с температурой 21 °C.
- Используйте флоресцентный стереоскоп с набором фильтров GFP. Подсчитайте и запишите количество GFP-положительных и GFP-отрицательных червей на предметных стеклах для каждой репликации с помощью счетчика подсчета.
ПРИМЕЧАНИЕ: GFP-положительные черви будут иметь ядерную экспрессию GFP в своей зародышевой линии и эмбрионы в утробе матери. Зародышевые линии GFP-отрицательных червей не флуоресцируют, однако, когда GFP начинает снова включаться в более поздних поколениях, флуоресценция может быть тусклой. Может быть полезно установить дополнительные нетрансгенные штаммы червей, чтобы учесть любую наблюдаемую автофлуоресценцию. - Проходите популяцию путем отбеливания, как описано выше, примерно каждые 4 дня (96 ч) при 21 °C. Кроме того, для удобства пассирование может осуществляться по чередующемуся 3-дневному и 4-дневному графику. Добавьте ~50 эмбрионов для более коротких поколений, если они чередуются, так как после 72 ч может быть более низкий выход эмбрионов.
ПРИМЕЧАНИЕ: Следите за тем, чтобы время пассажа поколения P0 оставалось неизменным на уровне 4 дней после нанесения эмбрионов на пластину.
4. Сбор животных для ЦИП
ПРИМЕЧАНИЕ: Количество животных и сроки их содержания зависят от штамма, стадии развития, эпитопа и количества мишеней для иммунопреципитации (ВП). В приведенном ниже примере соберите животных по трем IP: H3K9me3, гистон H3 и контрольный IgG. Протокол ChIP был адаптирован из Askjaer et al.21.
- Перед сбором образцов ChIP расширьте предыдущее поколение анализа наследования РНК-интерференции еще тремя планшетами NGM (по крайней мере, до четырех планшетов на репликацию). Выращивать в течение 4 дней при температуре 21 °C.
- Отбеливайте взрослых особей, чтобы изолировать эмбрионы (см. шаг 2.3).
- Для каждого штамма поместите примерно 3500 эмбрионов на 14 планшетов (по 250 на планшет) и выращивайте в течение 3 дней при температуре 21 °C до стадии молодого взрослого человека.
- Промывают животных в пробирки объемом 1,5 мл с фосфатно-солевым буфером (PBS), содержащим 0,01% (v/v) TX-100 (PBS/TX). Центрифуга при 1 000 x g в течение 2 мин. Аспирируйте и объединяйте животных из одного штамма в одну пробирку и промойте еще три раза не менее 1 мл PBS/TX.
- Отсасывайте до 1000 мкл, инвертируйте для смешивания и подсчитайте количество животных в 3 мкл три раза (см. шаг 2.3.9).
- Рассчитайте концентрацию животных и перенесите объем, соответствующий 3 000 животных, в новую пробирку для сшивания формальдегида.
- Убедитесь, что общий объем не менее чем в 10 раз превышает объем червячных гранул.
5. Сшивание формальдегида
ВНИМАНИЕ: Работайте с формальдегидом в вытяжном шкафу, чтобы предотвратить воздействие пара.
- Добавьте формальдегид (конечная концентрация 1,8%) в пробирку с червями. Вращайте при комнатной температуре в течение 6 минут.
- Сразу замораживаем в жидком азоте. На этом этапе эксперимент можно приостановить, а образцы хранить при температуре -80 °C.
- Сшитый образец разморозить на водяной бане комнатной температуры в течение 3 мин и вращать в течение 16 мин при комнатной температуре.
- Добавьте 1,25 М глицина до конечной концентрации 125 мМ и вращайте в течение 5 минут.
ПРИМЕЧАНИЕ: До магнитного элюирования шариков держите образцы на льду или при температуре 4 °C и используйте ледяные буферы. - Центрифугируют образец при 1 000 x g в течение 3 мин. Каждый раз промывайте водой по 1 мл PBS/TX. Дважды промыть 1 мл буфера ресуспензии (150 мМ NaCl, 50 мМ Hepes-Koh [рН 7,5], 1 мМ этилендиаминтетрауксусной кислоты [ЭДТА], 0,01% TX-100, ингибитор протеазы [одна таблетка на 5 мл]).
- После последней промывки оставьте достаточно буфера, чтобы общий объем был как минимум в три раза больше объема гранул и минимум ~ 100 мкл.
6. Ультразвуковая обработка
ПРИМЕЧАНИЕ: Параметры ультразвуковой обработки зависят от типа и модели ультразвукового аппарата и животного этапа. Такие параметры, как объем и концентрация образца, интервалы включения/выключения, количество циклов и настройка мощности, должны быть оптимизированы опытным путем. Например, в течение определенного времени ультразвука можно контролировать лизис червей с помощью анализа белка и определять, когда концентрация достигает плато. Кроме того, контролируйте, когда средний размер сдвига геномной ДНК составляет примерно 200-1000.н., путем электрофореза ДНК, очищенной после реверсирования сшивания, на 1,5% геле агарозы/трис-ацетата-ЭДТА (ТАЕ).
- Измерьте объем образцов из предыдущего шага. Смешать и аликвотировать 90-120 мкл в полистирольную ультразвуковую трубку.
- Добавьте равный объем буфера для ресуспендирования, содержащего 2 моющих средства (150 мМ NaCl, 50 мМ Hepes-KOH [рН 7,5], 1 мМ ЭДТА, 0,2% дезоксихолата натрия, 0,7% саркозила).
- Ультразвуковая обработка в водяной бане при мощности 50% в течение 7 мин (20 с вкл./40 с выкл.) при 4 °C. Аккуратно перемешайте пипеткой. Повторяйте ультразвуковую обработку еще 7 минут.
- Перелейте ультразвуковой лизат в пробирку объемом 1,5 мл. Добавьте 0,5 объемов буфера для ресуспензии без детергентов (150 мМ NaCl, 50 мМ Hepes-Koh [рН 7,5], 1 мМ ЭДТА) (например, добавьте 100 мкл буфера на 200 мкл образца).
- Центрифуга при 13 000 x g в течение 15 мин при 4 °C. Оставьте лизат в надосадочной жидкости и переложите в новую пробирку.
- При необходимости можно провести анализ белка для определения концентраций каждого лизата. Этот шаг может быть полезен для больших количеств образцов или межпробных сравнений. Тем не менее, стандартизация количества животных, как описано выше, хорошо работает для описанных здесь количеств образцов, поскольку существует лучшая корреляция с выходом хроматина/ДНК, определенным с помощью кПЦР.
7. Иммунопреципитация
ПРИМЕЧАНИЕ: Масштабируйте количество антител и магнитных шариков в соответствии с объемом и концентрацией лизата.
- Разделите лизатную надосадочную жидкость на четыре части: три равных объема для каждого IP и 10% от объема одного IP в качестве входного (например, 100 мкл IP #1, 100 мкл IP #2, 100 мкл IP #3, 10 мкл входа). Перенесите лизат IP в ПЦР-пробирку объемом 200 мкл и храните входной лизат при -20 °C в пробирке объемом 1,5 мл.
- Добавьте 0,5 мкг антител к H3K9me3, антигистоновых антител H3 или IgG к соответствующему образцу IP. Инкубировать при температуре 4 °C в течение ночи с ротацией.
- На следующий день аликвоту 9 мкл магнитных шариков с белковым покрытием G на одну пробирку объемом 1,5 мл. Дважды промыть шарики 1 мл FA-150 (150 мМ NaCl, 50 мМ Hepes-Koh [рН 7,5], 1 мМ ЭДТА, 1% ТХ-100, 0,1% дезоксихолат натрия).
- Ресуспендируйте магнитные шарики в буфере FA-150 до исходного объема, взятого из заготовки на шаге 7.3 выше. Добавьте 7,5 мкл к каждому IP. Инкубируют при 4 °C в течение 2 ч с ротацией.
8. Промывки и элюирование
ПРИМЕЧАНИЕ: Чтобы магнитные шарики не высохли, быстро добавляйте каждый буфер для промывки или элюирования после аспирации предыдущей стирки.
- Используйте 0,2-1 мл следующих буферных растворов каждый раз, чтобы промыть бусины. Соберите шарики на магнитной подставке, чтобы аспирировать смывки. Выдерживайте каждую стирку при температуре 4 °C в течение 5 минут с вращением. Следуйте приведенному ниже порядку.
- Вымойте два раза FA-150.
- Промыть один раз FA-1M (FA-150 с 1 М NaCl).
- Промыть один раз FA-0,5M (FA-150 с 0,5 M NaCl). Пересадите в новую ПЦР-пробирку.
- Промыть один раз TE-LiCl (250 мМ LiCl, 10 мМ Tris-Cl [pH 8,0], 1 мМ ЭДТА, 1% IGEPAL CA-630, 1% дезоксихолат натрия).
- Дважды промыть TE+ (50 мМ NaCl, 10 мМ Tris-Cl [pH 8,0], 1 мМ ЭДТА, 0,005% IGEPAL CA-630).
ПРИМЕЧАНИЕ: Продолжайте обработку образца при комнатной температуре, если не указано иное.
- Аспирируйте последний буфер для промывки. Ресуспендировать магнитные шарики с 50 мкл элюирующего буфера ChIP (200 мМ NaCl, 10 мМ Tris-Cl [pH 8,0], 1 мМ ЭДТА, 1% додецилсульфат натрия [SDS]) и перенести в пробирку объемом 1,5 мл.
- Элюют при 65 °C в течение 15 мин в термомиксере со смешиванием при 1 000 об/мин в течение 5 с каждую минуту.
- Соберите бусины на магнитной подставке и перенесите надосадочную жидкость в новую пробирку.
- Повторите элюирование с еще 50 мкл элюирующего буфера ChIP. Объедините надосадочную жидкость в общей сложности на 100 мкл. Приступайте к обратному сшиванию и элюированию ДНК, как описано ниже.
9. Обратное сшивание и элюирование ДНК
- Разморозьте входной образец лизата. Долейте до 100 мкл элюирующим буфером ChIP.
- Добавьте 16,5 мкг РНКазы А к каждому IP-образцу и входному образцу. Инкубируют при температуре 37 °C в течение 1 ч.
- Добавьте 40 мкг протеиназы К и инкубируйте при 55 °C в течение 2 ч. Затем инкубируйте при температуре 65 °C в течение ночи.
- Охладите образцы до комнатной температуры и очистите ДНК с помощью набора для спин-колонки.
10. Настройка и запуск реакции кПЦР
ПРИМЕЧАНИЕ: Параметры праймера, настройки реакции и амплификатора должны быть изменены в соответствии с рекомендациями производителя для используемой реакционной смеси для количественной ПЦР.
- Подготовьте наборы праймеров, нацеленные на репортерную РНК-интерференцию GFP и контрольные области H3K9me3 с положительным и отрицательным обогащением. Температура плавления грунтовки составляет 60 °C. Последовательность праймеров приведена в Таблице материалов .
- Для входной ДНК сделайте четыре четырехкратных последовательных разведения (например, 1:5, 1:20, 1:80, 1:320).
ПРИМЕЧАНИЕ: ДНК IP может быть использована непосредственно или разбавлена (например, 1:2 или 1:3), чтобы обеспечить большее количество реакций. Пригодность разведения должна быть определена опытным путем, так как это может повлиять на производительность кПЦР. - Организуйте все реакции, соответствующие одному набору праймеров, на одной ПЦР-планшете. Настройте технические дублирующие реакции для каждого входного разведения ДНК и каждого образца ДНК IP. Каждая реакция объемом 10 мкл содержит 1,5 мкл входной или IP-ДНК (или элюирующий буфер в качестве контроля), мастер-смесь для кПЦР (1x конечная концентрация), прямой праймер и обратный праймер (конечная концентрация 400 нМ для каждого праймера).
- На амплификаторе реального времени выполните следующую программу: начальная денатурация: 95 °C в течение 4 мин; амплификация и флуоресцентное детектирование: 40 циклов при 95 °C в течение 10 с и 60 °C в течение 30 с при считывании пластины; окончательное растяжение: 60 °C в течение 5 мин; кривая плавления: от 60 °C до 90 °C с шагом 0,5 °C, 5 с на шаг.
11. Определение эффективности усиления и проверка специфичности продукта
- Для каждого набора входных разведений ДНК постройте график четырех точек данных с [log10(1/dilution)] на оси x и [Input Cq] на оси y. Определите наклон линии наилучшего соответствия.
- Рассчитайте эффективность усиления. Идеальные наборы праймеров должны стабильно демонстрировать эффективность 95%-100%.
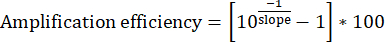
- Убедитесь, что все реакции имеют один резкий пик кривой плавления и что реакции с одним и тем же набором праймеров имеют одинаковую температуру плавления. Множественные пики или разные температуры плавления могут указывать на неспецифическое усиление.
- При необходимости можно провести реакции на стандартном 2% геле агарозы/ТАЭ при комнатной температуре, чтобы проверить размер полосы продукта.
12. Расчет процента ввода
- Рассчитайте Коэффициент разбавления на входе. Поскольку 10% объема IP-лизата было сохранено в качестве входа, коэффициент разбавления для разведения входной ДНК в соотношении 1:5 составляет 50.
- Определите коэффициент разбавления IP. Если ДНК ИС не разбавляют перед кПЦР, то коэффициент разбавления равен 1.
- Вычислите разницу Cq между IP и входом с поправкой на коэффициенты разбавления.
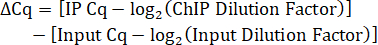
- Рассчитайте процент входных данных.
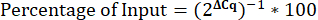
Representative Results
Животные, несущие экспрессируемый зародышевой линией GFP-гистон H2B [mex-5p::gfp-h2b::tbb-2 3'UTR]7 reporter (рис. 2A), подвергались воздействию GFP РНК-интерференции или контрольной РНК-интерференции при кормлении и пассажировались, как описано в протоколе и на рисунке 1. Ядерный сигнал GFP в зародышевой линии оценивали вручную с помощью флуоресцентного рассеивающего микроскопа для выборки популяции в каждом поколении. Сайленсинг трансгена был полностью пенетрантным у животных P0 и F1, обработанных GFP РНК-интерференцией (рис. 2B). В поколении F2 доля популяции, демонстрирующей наследование подавления GFP, составляла примерно 50%. К поколению F5 у большинства популяции не было выявлено наследования молчания, а к поколению F10 наследование не было обнаружено, так как у всех животных экспрессировался GFP.
Для определения изменения обогащения гистонов H3K9me3, соответствующего РНК-индуцированному сайленсингу, ChIP-qPCR проводили на животных поколения F1 после обработки GFP RNAi или контрольной РНК-интерференции. Как и ожидалось, популяция, обработанная РНК-интерференцией GFP, показала более высокие уровни гистонов H3K9me3 в мишени GFP и в области ниже по течению 1,3 кб по сравнению с контрольными животными, получавшими РНК-интерференцию (рис. 2C). Специфичность гистона H3K9me3 ChIP подтверждается обогащением в положительном локусе контроля (clec-18), который, как известно, обогащен этой меткой, но не в соседнем локусе отрицательного контроля (hrp-2). Обогащение гистонами H3 и околофонное обогащение в контрольных иммунопреципитациях IgG, как и ожидалось, также были обнаружены во всех локусах кПЦР. При нормализации обогащения ChIP в репортере к положительному локусу контроля clec-18 показано более высокое обогащение гистонов H3K9me3 на GFP РНК-интерференции, в то время как обогащение гистонов H3 одинаково между контролем и GFP РНК-интерференцией (рис. 2D). Поскольку ожидается, что GFP РНК-интерференция не повлияет на гистон H3K9me3 или общую занятость гистонов H3 в локусе clec-18 , эта нормализация смягчает технические вариации, такие как различия в эффективности ChIP между образцами РНК-интерференции GFP и контрольной РНК-интерференции. Изменение уровня гистонов H3K9me3 и гистонов H3 между РНК-интерференционными методами показывает обогащение гистонов H3K9me3, специфичных для репортеров GFP, независимо от занятости гистонов, при подавлении GFP РНК-интерференции (рис. 2E).
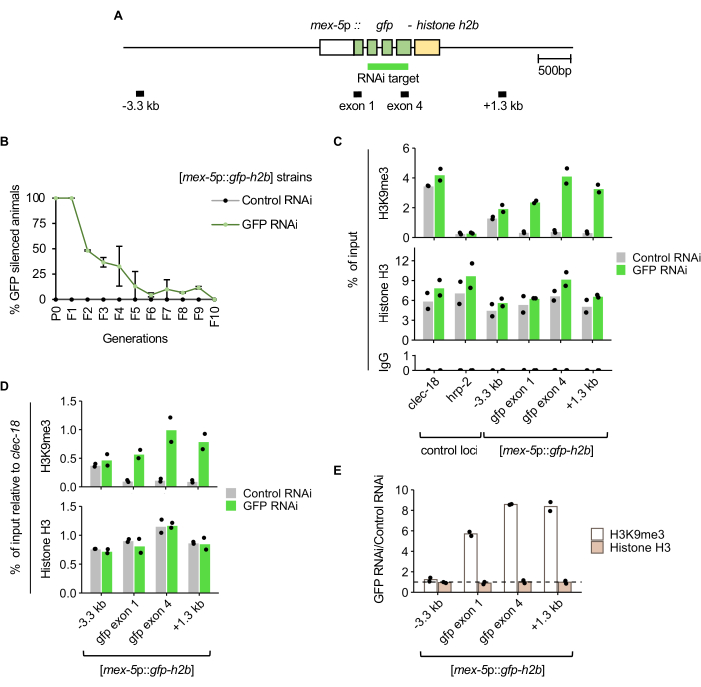
Рисунок 2: Сайленсинг, индуцированный РНК-интерференцией GFP, соответствует повышенному обогащению H3K9me3 в мишени РНК-интерференции. (A) Диаграмма репортера GFP РНК-интерференции mjIs134[mex-5p::gfp-h2b::tbb-2 3'UTR] с мечеными областями ампликона кПЦР. (B) Экспрессия GFP оценивалась в разных поколениях после обработки РНК-интерференцией при 21 °C. Столбцы погрешности представляют собой стандартное отклонение от двух биологических репликаций. (C) ChIP-qPCR H3K9me3, гистона H3 и контроля IgG у молодых людей F1 из двух биологических репликаций. clec-18 и HRP-2 являются положительным и отрицательным контрольными локусами обогащения H3K9me3 соответственно. (D) Обогащение H3K9me3 и гистонов H3 в репортере GFP РНК-интерференции нормализовано к положительному локусу контроля clec-18. (E) Изменение обогащения H3K9me3 и гистонов H3 между животными, получавшими GFP РНК-интерференцию, и контрольной РНК-интерференцией с нормализацией до clec-18. Пунктирная линия представляет собой изменение сгиба, равное 1. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Discussion
В этом протоколе дцРНК вводится путем кормления, что стало стандартным методом у C. elegans18. Для анализа наследования РНК-интерференции подход кормления обеспечивает простой метод получения большой популяции P0 2,11,12,22,23,24,25. Однако время и продолжительность воздействия РНК-интерференции влияют на эффективность подавления трансгенов26, а концентрация РНК-интерференционных бактерий влияет на персистенцию наследуемого подавления РНК-интерференции1. Таким образом, стандартизированные РНК-интерференционные бактерии и рост червей важны для получения постоянного уровня подавления GFP и продолжительности наследования. Здесь эмбрионы наносятся на пластины РНК-интерференции, чтобы животные P0 подвергались воздействию РНК-интерференционных бактерий с момента вылупления. Альтернативные подходы заключались в нанесении на планшеты РНК-интерференции синхронизированных L1 24,27 илиL4 25 стадий. Кроме того, поскольку голодание и другие стрессы влияют на сохранение наследственности РНК-интерференции13, необходимо контролировать планшеты, чтобы предотвратить переполнение и истощение запасов пищи. В качестве альтернативы инициированию РНК-интерференции путем питания, некоторые из пионерских исследований наследования РНК-интерференции C. elegans индуцировали РНК-интерференцию через инъекцию гонад, что обеспечивает больший контроль концентрации дцРНК 1,28.
В этом протоколе каждое поколение проходит как популяция с щелочной обработкой гипохлоритом, как описано ранее 16,22,23,24. Обработка гипохлоритом гарантирует, что поколение F1 не будет загрязнено бактериями РНК-интерференции из родительской среды22 и предотвращает потенциальное нежелательное образование узких мест в популяции. Тем не менее, массовый пассаж также может быть ограничением, поскольку отдельные животные могут иметь различные модели наследования 1,29. Альтернативным методом установления каждого поколения является отбор отдельных животных 1,2,9,11,25. Такой подход позволяет отслеживать фенотипы внутри линий и включать генетические скрещивания. Анализ родословной также может быть полезен для фенотипов с низкой пенетрантностью12.
Флуоресцентная экспрессия белка является мощным и удобным считыванием РНК-индуцированного сайленсинга 2,3,4,12,14,15,16,25,30. Как описано в этом протоколе, экспрессия GFP может быть вручную оценена как ON или OFF 11,12,15,16,25. Ручная оценка может быть дополнительно усовершенствована путем присвоения качественных уровней интенсивности 3,4,14. В качестве альтернативы автоматизированная оценка интенсивности микроскопических изображений 11,12,14,25,27 или измерение флуоресценции живых животных с помощью проточной цитометрии 2 могут обеспечить количественное и высокопроизводительное считывание. Однако, поскольку репортерная экспрессия ограничена зародышевой линией, предостережение автоматизированных подходов заключается в том, что они также должны различать животных с подавленной экспрессией GFP и животных без зародышевой линии, особенно если исследование включает мутантов с аномальным развитием зародышевой линии. В качестве альтернативы флуоресценции GFP можно использовать обратную транскрипцию (ОТ)-кПЦР для количественного определения уровней пре-мРНК и мРНК-мишеней 2,16,23,24. Этот подход обеспечивает более прямое считывание сайленсинга, который нацелен на РНК, и особенно полезен для других РНК-мишеней, где сайленсинг не приводит к видимому фенотипу. Ограничением использования искусственных репортеров GFP является то, что экзогенные и эндогенные последовательности дифференцированно регулируются в трансгенерационной РНК-интерференции11. Поэтому исследования с эндогенными мишенями, такими как чувствительный к температуре эмбриональный летальный аллель oma-1(zu405)1,11,16,25, следует рассматривать как дополнительный подход к флуоресцентным трансгенным репортерам.
Анализ ChIP в контексте анализа наследования РНК-интерференции требует сравнения между лечением и репликатами. Во-первых, чтобы учесть различия в исходном материале между образцами, сигнал ChIP нормализуется во входной сигнал в том же локусе, что и «процент входа». Параллельная обработка гистонов H3 ChIP поможет определить, соответствуют ли какие-либо изменения модификации гистонов изменениям плотности нуклеосом. Кроме того, поскольку ChIP является многоступенчатым процессом, эффективность может варьироваться в зависимости от образца. Выбор соответствующих положительных и отрицательных управляющих локусов полезен для оценки и сравнения отношения сигнал/шум между образцами и экспериментами. Кроме того, для облегчения сравнения между образцами пороговые значения цикла кПЦР ДНК ChIP в мишени РНК-интерференции часто нормализуют до контрольного локуса 3,11,15,23,30,31. Для оценки эффектов лечения РНК-интерференцией также сравнивается соотношение сигнала ChIP в лечебных РНК-интерференции с контрольными состояниями или условиями отсутствия РНК-интерференции. Ограничением современного подхода является то, что ХИП проводится с цельными животными, в то время как реакция на лечение РНК-интерференцией может быть уникальной для зародышевой линии. Одним из способов преодоления этого предостережения является выполнение ChIP с использованием изолированных ядер зародышевой линии. Дополнительные технические соображения по оптимизации ChIP также широко обсуждались в других статьях32,33.
В целом, этот протокол наследования РНК-интерференции и ChIP обеспечивает подробную и простую в адаптации основу, которая может быть интегрирована с другими методами для дальнейшего изучения трансгенерационной эпигенетической регуляции. Например, на основе ДНК ChIP (ChIP-seq) могут быть созданы библиотеки высокопроизводительного секвенирования для более детального представления ландшафта хроматина как в непосредственной близости от мишени РНК-интерференции, так и в масштабе всего генома.
Disclosures
Все авторы подтверждают, что у них нет каких-либо конфликтов, которые они могли бы раскрыть.
Acknowledgements
Мы хотели бы выразить признательность лабораториям из сообщества C. elegans , которые разработали и поделились инструментами, и чья работа цитируется в этой рукописи. Некоторые штаммы были предоставлены CGC, который финансируется Управлением программ исследовательской инфраструктуры NIH (P40 OD010440). Эта работа была поддержана грантом проекта Канадского института исследований в области здравоохранения (CIHR) для A.L.S. (PJT-175245). C.L. поддерживается стипендией для аспирантов Совета по естественным наукам и инженерным исследованиям Канады (NSERC) (PGS-D).
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Bioshop | AGA002 | |
| Ampicillin | Bioshop | AMP201 | Make a 100 mg/mL solution in ultrapure water. Filter-sterilize and store at -20 °C. |
| Anti-H3K9me3 Rabbit Polyclonal Antibody | Abcam | ab8898 | Concentration is batch-dependent (0.9 - 1 mg/mL). |
| Anti-Histone H3 Rabbit Polyclonal Antibody | Abcam | ab1791 | Concentration is batch-dependent (0.7 - 1 mg/mL). |
| Bleach (6% Sodium hypochlorite) | Lavo | 02358107 | |
| C. elegans strain with GFP RNAi Reporter | NA | SX1263 | Sapetschnig et al. 2015 (ref. 7). A gift from E. Miska lab, University of Cambridge. |
| Carbenicillin | BioShop | CAR544 | Make a 25 mg/mL solution in ultrapure water. Filter-sterilize and store at -20 °C. |
| Dynabeads Protein G Magnetic Beads | Invitrogen | 10003D | |
| E. coli strain HT115(DE3) | Caenorhabditis Genetics Center (CGC) | HT115(DE3) | |
| E. coli strain OP50-1 | Caenorhabditis Genetics Center (CGC) | OP50-1 | |
| EDTA (0.5 M, pH 8.0) | Invitrogen | 15575020 | |
| Fluorescence Stereoscope | Zeiss | Axio Zoom.V16 | |
| Formaldehyde (37%) | Sigma | F8775 | |
| Glycine | Sigma | 50046 | Make a 1.25 M solution and store at 4 °C. |
| HEPES-KOH (1 M, pH 7.5) | Teknova | H1035 | |
| Hydrophobic Printed Slides, 10 wells | VWR | 100488-904 | |
| IGEPAL CA-630 (Octylphenol ethoxylate) | BioShop | NON999 | Make a 10% (v/v) solution in ultrapure water and store at room temperature. |
| IPTG (Isopropyl-β-D-thiogalactoside) | BioShop | IPT001 | Make a 0.2 g/mL solution in ultrapure water. Filter-sterilize and store at -20 °C. |
| iTaq Universal SYBR Green Supermix | Bio-Rad | 1725122 | |
| LB Agar Plates supplemented with 100 µg/mL Ampicillin | NA | NA | Standard lab recipe. |
| Levamisole (Tetramisole hydrochloride) | Sigma | L9756 | Make a 200 mM solution in ultrapure water. Store at -20 °C. |
| LiCl (8 M) | Sigma | L7026 | |
| M9 Buffer | NA | NA | 22 mM KH2PO4, 42 mM Na2HPO4, 86 mM NaCl, 1 mM MgSO4. |
| Magnetic Separator (1.5 mL tubes) | Applied Biosystems | A13346 | |
| Magnetic Separator (0.2 mL tubes) | Permagen | MSR812 | |
| Microscope Cover Glass | Fisher Scientific | 12541B | |
| Microscope Slide | Technologist Choice | LAB-037 | |
| NaCl (5 M) | Promega | V4221 | For ChIP buffers. |
| NaOH | Sigma | S5881 | Make a 10 M solution and store at room temperature. |
| NGM Plates | NA | NA | 1.7% (w/v) agar, 0.3% (w/v) NaCl, 0.25% (w/v) peptone, 1 mM CaCl2, 5 μg/mL cholesterol, 25 mM Potassium phosphate pH 6.0, 1 mM MgSO4, 50 µg/mL streptomycin. |
| Normal Rabbit IgG (1 mg/mL) | Cell Signaling Technology | 2729 | |
| Petri Dishes (35 mm x 10 mm) | Sarstedt | 82.1135.500 | |
| Phosphate Buffered Saline (10X) | Fisher BioReagents | BP3991 | |
| Plasmid - Control RNAi | Addgene | L4440 (Plasmid #1654) | |
| Plasmid - GFP-targetting RNAi | Addgene | L4417 (Plasmid #1649) | Note, alternative L4440-derived plasmids targeting GFP can be used. |
| Primer pair [-3.3 kb upstream of gfp] | Integrated DNA Technologies | NA | F: AAACCAAAGGACGAGAGATTCA, R: GGCTCGATCAAGTAAAATTTCG |
| Primer pair [+1.3 kb downstream of gfp] | Integrated DNA Technologies | NA | F: TCGACCAGTTCTAAAGTCACCG, R: ACGTGCGGGATCATTTCTTACT |
| Primer pair [clec-18] | Integrated DNA Technologies | NA | F: TGCTCCATGACCTCAACAACA, R: AGTACAGTTCACCGATCCAGA |
| Primer pair [gfp exon 1] | Integrated DNA Technologies | NA | F: CTGGAGTTGTCCCAATTCTTGT, R: GGGTAAGTTTTCCGTATGTTGC |
| Primer pair [gfp exon 4] | Integrated DNA Technologies | NA | F: GATGGCCCTGTCCTTTTACCA, R: ATGCCATGTGTAATCCCAGCA |
| Primer pair [hrp-2] | Integrated DNA Technologies | NA | F: CGTCAACAGGGAGCAGCTG, R: CCTCCGAACTTTCTCTGTCCA |
| Protease Inhibitor Cocktail Tablet | Roche | 11836170001 | |
| Proteinase K | Bioline | BIO-37084 | |
| QIAquick PCR Purification Kit | Qiagen | 28104 | |
| Real-Time PCR Detection System | Bio-Rad | CFX96 | |
| RNAi-NGM plates | NA | NA | 1.7% (w/v) agar, 0.3% (w/v) NaCl, 0.25% (w/v) peptone, 1 mM CaCl2, 5 µg/mL cholesterol, 25 mM Potassium phosphate buffer pH 6.0, 1 mM MgSO4, 25 µg/mL carbenicillin and 5 mM IPTG. |
| RNase A | Sigma | R4642 | |
| Sarkosyl (N-Lauroylsarcosine sodium salt) | Sigma | L5777 | Make a 10% (w/v) solution and store at room temperature protected from light for a maximum of 1 month. |
| SDS | Sigma | 74255 | Make a 10% (w/v) solution and store at room temperature. |
| Sodium deoxycholate | Sigma | 30970 | Make a 5% (w/v) solution and store at room temperature protected from light for a maximum of 1 month. |
| Sonication Tube | Evergreen | 214-3721-010 | |
| Sonication Tube Cap | Evergreen | 300-2911-020 | |
| Sonicator | Qsonica | Q800R3-110 | |
| Streptomycin sulfate | Bioshop | STP101 | Make a 50 mg/mL solution in ultrapure water. Filter-sterilize and store at -20 °C. |
| TAE buffer (1X) | NA | NA | 40 mM Tris, 20 mM acetate, 1 mM EDTA |
| Tally counter clicker | Uline | H-7350 | |
| Tetracycline | Bioshop | TET701 | Make a 5 mg/mL solution in ethanol and store at -20 °C. |
| Thermomixer | Eppendorf | 05-400-205 | |
| Tris-HCl (1 M, pH 8.0) | Invitrogen | 15568025 | |
| Triton X-100 | Sigma | T8787 | Make a 10% (v/v) solution in ultrapure water and store at room temperature. |
References
- Alcazar, R. M., Lin, R., Fire, A. Z. Transmission dynamics of heritable silencing induced by double-stranded RNA in Caenorhabditis elegans. Genetics. 180 (3), 1275-1288 (2008).
- Ashe, A., et al. piRNAs can trigger a multigenerational epigenetic memory in the germline of C. elegans. Cell. 150 (1), 88-99 (2012).
- Buckley, B. A., et al. A nuclear Argonaute promotes multigenerational epigenetic inheritance and germline immortality. Nature. 489 (7416), 447-451 (2012).
- Vastenhouw, N. L., et al. Long-term gene silencing by RNAi. Nature. 442 (7105), 882 (2006).
- Lee, H. -. C., et al. C. elegans piRNAs mediate the genome-wide surveillance of germline transcripts. Cell. 150 (1), 78-87 (2012).
- Luteijn, M. J., et al. Extremely stable Piwi-induced gene silencing in Caenorhabditis elegans. The EMBO Journal. 31 (16), 3422-3430 (2012).
- Sapetschnig, A., Sarkies, P., Lehrbach, N. J., Miska, E. A. Tertiary siRNAs mediate paramutation in C. elegans. PLoS Genetics. 11 (3), e1005078 (2015).
- Shirayama, M., et al. piRNAs initiate an epigenetic memory of nonself RNA in the C. elegans germline. Cell. 150 (1), 65-77 (2012).
- Minkina, O., Hunter, C. P. Stable heritable germline silencing directs somatic silencing at an endogenous locus. Molecular Cell. 65 (4), 659-670 (2017).
- Seroussi, U., et al. Mechanisms of epigenetic regulation by C. elegans nuclear RNA interference pathways. Seminars in Cell & Developmental Biology. 127, 142-154 (2022).
- Lev, I., Gingold, H., Rechavi, O. H3K9me3 is required for inheritance of small RNAs that target a unique subset of newly evolved genes. eLife. 8, e40448 (2019).
- Woodhouse, R. M., et al. Chromatin modifiers SET-25 and SET-32 are required for establishment but not long-term maintenance of transgenerational epigenetic inheritance. Cell Reports. 25 (8), 2259-2272 (2018).
- Houri-Zeevi, L., Teichman, G., Gingold, H., Rechavi, O. Stress resets ancestral heritable small RNA responses. eLife. 10, e65797 (2021).
- Houri-Ze'evi, L., et al. A tunable mechanism determines the duration of the transgenerational small RNA inheritance in C. elegans. Cell. 165 (1), 88-99 (2016).
- Spracklin, G., et al. The RNAi inheritance machinery of Caenorhabditis elegans. Genetics. 206 (3), 1403-1416 (2017).
- Perales, R., et al. Transgenerational epigenetic inheritance is negatively regulated by the HERI-1 chromodomain protein. Genetics. 210 (4), 1287-1299 (2018).
- Shukla, A., Perales, R., Kennedy, S. piRNAs coordinate poly(UG) tailing to prevent aberrant and perpetual gene silencing. Current Biology. 31 (20), 4473-4485 (2021).
- Ahringer, J. Reverse GeneticsWormBook: the Online Review of C. elegans Biology. WormBook. , (2006).
- Rivera Gomez, K., Schvarzstein, M. Immobilization of nematodes for live imaging using an agarose pad produced with a Vinyl Record. microPublication Biology. 2018, (2018).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. Elegans Biology. , 1-11 (2006).
- Askjaer, P., Ercan, S., Meister, P. Modern techniques for the analysis of chromatin and nuclear organization in C. elegans. WormBook: the Online Review of C. elegans Biology. , 1-35 (2014).
- Gu, S. G., et al. Amplification of siRNA in Caenorhabditis elegans generates a transgenerational sequence-targeted histone H3 lysine 9 methylation footprint. Nature Genetics. 44 (2), 157-164 (2012).
- Kalinava, N., Ni, J. Z., Peterman, K., Chen, E., Gu, S. G. Decoupling the downstream effects of germline nuclear RNAi reveals that H3K9me3 is dispensable for heritable RNAi and the maintenance of endogenous siRNA-mediated transcriptional silencing in Caenorhabditis elegans. Epigenetics & Chromatin. 10, 6 (2017).
- Kalinava, N., et al. elegans heterochromatin factor SET-32 plays an essential role in transgenerational establishment of nuclear RNAi-mediated epigenetic silencing. Cell Reports. 25 (8), 2273-2284 (2018).
- Lev, I., et al. MET-2-dependent H3K9 methylation suppresses transgenerational small RNA inheritance. Current Biology. 27 (8), 1138-1147 (2017).
- Kamath, R. S., Martinez-Campos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome Biology. 2 (1), (2001).
- Xu, F., et al. A cytoplasmic Argonaute protein promotes the inheritance of RNAi. Cell Reports. 23 (8), 2482-2494 (2018).
- Grishok, A., Tabara, H., Mello, C. C. Genetic requirements for inheritance of RNAi in C. elegans. Science. 287 (5462), 2494-2497 (2000).
- Houri-Zeevi, L., Korem Kohanim, Y., Antonova, O., Rechavi, O. Three rules explain transgenerational small RNA inheritance in C. elegans. Cell. 182 (5), 1186-1197 (2020).
- Burton, N. O., Burkhart, K. B., Kennedy, S. Nuclear RNAi maintains heritable gene silencing in Caenorhabditis elegans. Proceedings of the National Academy of Sciences. 108 (49), 19683-19688 (2011).
- Mao, H., et al. The Nrde pathway mediates small-RNA-directed histone H3 lysine 27 trimethylation in Caenorhabditis elegans. Current Biology. 25 (18), 2398-2403 (2015).
- Landt, S. G., et al. ChIP-seq guidelines and practices of the ENCODE and modENCODE consortia. Genome Research. 22 (9), 1813-1831 (2012).
- Mukhopadhyay, A., Deplancke, B., Walhout, A. J. M., Tissenbaum, H. A. Chromatin immunoprecipitation (ChIP) coupled to detection by quantitative real-time PCR to study transcription factor binding to DNA in Caenorhabditis elegans. Nature Protocols. 3 (4), 698-709 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved