מודל חזירי של זיהום ביופילם ופצעים בלתי נראים
In This Article
Summary
פצעים כרוניים עמידים לאנטיביוטיקה מהווים איום משמעותי על מערכת הבריאות. זיהומי ביופילם הם עקשניים ועוינים ועלולים לגרום לסגירת פצעים תפקודית לקויה. אנו מדווחים על מודל חזירים רלוונטי מבחינה קלינית של פצעים כרוניים בעובי מלא הנגועים בביופילם. מודל זה הוא רב עוצמה למחקרים מכניסטיים, כמו גם לבדיקת התערבויות.
Abstract
זיהום ביופילם הוא תורם מרכזי לכרוניזציה של פצעים. ביסוס זיהום ביופילם ניסיוני רלוונטי מבחינה קלינית דורש מעורבות של מערכת החיסון המארחת. שינויים איטרטיביים במארח ובפתוגן במהלך היווצרות ביופילם רלוונטי קליני כזה יכולים להתרחש רק in vivo. מודל פצע החזירים מוכר ביתרונותיו כמודל פרה-קליני רב עוצמה. ישנן מספר גישות מדווחות לחקר ביופילמים של פצעים. מערכות In vitro ו-ex vivo לוקות בחסר מבחינת התגובה החיסונית של המאכסן. מחקרי in vivo קצרי טווח כרוכים בתגובות חריפות, ולכן אינם מאפשרים הבשלת ביופילם, כפי שידוע שקורה מבחינה קלינית. מחקר הביופילם ארוך הטווח הראשון על פצעי חזירים דווח בשנת 2014. המחקר הכיר בכך שפצעים נגועים בביופילם עשויים להיסגר כפי שנקבע על ידי פלנימטריה, אך תפקוד מחסום העור של האתר הפגוע עלול להיכשל בשיקום. מאוחר יותר, תצפית זו קיבלה תוקף קליני. כך נולד הרעיון של סגירת פצע תפקודי. פצעים סגורים אך תפקוד לקוי של מחסום העור עשויים להיתפס כפצעים בלתי נראים. בעבודה זו, אנו מבקשים לדווח על הפרטים המתודולוגיים הדרושים כדי לשחזר את מודל החזירים ארוך הטווח של פגיעה חמורה בכוויות נגועות בביופילם, שהוא רלוונטי מבחינה קלינית ובעל ערך תרגומי. פרוטוקול זה מספק הנחיות מפורטות ליצירת זיהום ביופילם פצע למשך 8 שבועות באמצעות P. aeruginosa (PA01). שמונה פצעי כוויות בעובי מלא נוצרו באופן סימטרי על גבי חזירים לבנים מבויתים, שחוסנו ב-PA01 ביום השלישי שלאחר הכוויה; לאחר מכן, הערכות לא פולשניות של ריפוי הפצע נערכו בנקודות זמן שונות באמצעות הדמיית כתמי לייזר (LSI), אולטרסאונד ברזולוציה גבוהה (HUSD) ואיבוד מים טרנסאפידרמלי (TEWL). פצעי הכוויות המחוסנים כוסו בחבישה בת ארבע שכבות. ביופילמים, כפי שנקבע ואושר מבנית על ידי SEM ביום 7 לאחר החיסון, פגע בסגירת הפצע התפקודי . תוצאה שלילית כזו כפופה להיפוך בתגובה להתערבויות מתאימות.
Introduction
זיהום ביופילם מסבך כוויות ופצעים כרוניים וגורם לכרוניות 1,2,3,4,5. במיקרוביולוגיה, מנגנוני ביופילם נחקרים בעיקר, עם דגש על מיקרובים 1,6. הלקחים שהופקו ממחקרים אלה הם בעלי חשיבות עליונה מנקודת מבט של מדע הביולוגיה, אך לא בהכרח יכולים להיות ישימים לביופילמים פתוגנייםרלוונטיים מבחינה קלינית 6,7,8. אגרגטים מבניים רלוונטיים מבחינה קלינית של ביופילם צריכים לכלול גורמים מיקרוביאליים כמו גם גורמים מארחים 8,9,10. מיקרו-סביבה כזו מאפשרת הכללה של אינטראקציות איטרטיביות בין מיקרוב לפונדקאי, שהן קריטיות לפיתוח ביופילם 7,8 רלוונטי מבחינה קלינית. בתהליך כזה, ההשתתפות של תאי מערכת החיסון וגורמים הנישאים בדם היא קריטית11,12. האינטראקציות בין המיקרובים המארחים העומדות בבסיס ביופילמים פתוגניים קליניים, כפי שניתן לראות בפצעים כרוניים, מתרחשות לאורך תקופת זמן ארוכה. לפיכך, כל גישה ניסיונית שמטרתה לפתח מודל רלוונטי מבחינה תרגומית של זיהום ביופילם חייבת לקחת בחשבון גורמים אלה. לכן, ביקשנו לפתח מודל קליני של זיהום ביופילם כרוני של חזירים.
בעוד שמחקרים בבני אדם מייצגים בבירור את הגישה הטובה ביותר לחקר תוצאות הריפוי, לעתים קרובות הם אינם מתאימים ביותר לטיפול במנגנונים הבסיסיים ובפרדיגמות מכניסטיות חדשות. חששות אתיים מגבילים את השימוש בעיצובי מחקר המחייבים איסוף של ביופסיות מרובות מפצע כרוני בנקודות זמן שונות. לכן, חיוני שיהיה מודל מבוסס היטב וניתן לשחזור של בעלי חיים שיאפשר מחקרים פולשניים לבחינה יסודית של גורל ביופילם 7,13. הבחירה של מודל בעלי חיים תלויה במספר גורמים, כולל רלוונטיות מדעית / תרגומית ולוגיסטיקה. המערכת החזירית מוכרת באופן נרחב כמודל הניסויי בעל הערך הרב ביותר מבחינה תרגומית לחקר פצעי עור אנושיים7. לפיכך, עבודה זו מדווחת על מודל חזירים מבוסס של פגיעה בכוויות בעובי מלא נגוע בביופילם. עבודה זו מבוססת על מספר פרסומים מקוריים שדווחו בספרות 2,7,13,14,15,16,17. במחקר זה, נבחר מבודד קליני של Pseudomonas aeruginosa עמיד לתרופות מרובות (PA01) כדי להדביק את הפצע. P. aeruginosa הוא גורם שכיח לזיהומים בפצעים 2,18,19,20. זהו חיידק גראם-שלילי שיכול להיות קשה לטיפול בשל עמידותו לאנטיביוטיקה מסוימת11,19,21. אף אחד ממודלי הביופילם של החזירים שדווחו עד כה לא כלל 8 שבועות של מחקרים ארוכי טווח 22,23,24,25,26. פצעים כרוניים הם אלה שנשארים פתוחים במשך 4 שבועות או יותר 14,27,28. אין מודלים אחרים של ביופילם של פצעים כרוניים שדווחו בספרות. עבודה זו עוסקת ברעיון של סגירת פצע תפקודי 2,7,13,15,17,29.
Protocol
כל המחקרים בבעלי חיים בוצעו בהתאם לפרוטוקולים שאושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) #21147. המחקר נערך במרכז משאבי חיות מעבדה (LARC), אוניברסיטת אינדיאנה. השתמשנו בנקבת חזיר לבן ביתי (70-80 ליברות) בפרוטוקול זה.
1. התאקלמות בעלי חיים
- עם הגעת החזירים למתקן, לשכן את בעלי החיים בנפרד באותו חדר לפחות 3 ימים לצורך התאקלמות ואינטראקציה חברתית.
- להאכיל את החזירים תזונה מאוזנת היטב. החליטו על הכמות המוזנת על בסיס משקל, ועקבו אחר המלצות היצרן.
- ודא כי בעל החיים הוא בצום במשך 6-12 שעות לפני ההליך כדי למנוע בחילות, הקאות, ואת השאיפה של נוזלי הבטן בזמן הרדמה.
2. מערך חדר ניתוח
- הכינו את מכונת ההרדמה, וודאו שהיא מוכנה עם מעגל הנשימה מחדש.
- סדרו את החדר לניתוח, כמתואר להלן (איור 1A).
- כסו את טבלת הפרוצדורות בשפשוף סטרילי, והניחו שמיכת מים במחזור מתחתיה כדי לסייע בוויסות חום.
- ערוך שולחן עם ציוד אינדוקציה וחומרי הכנה לניתוח. ערוך שולחן עם התקני המבער ותיבות הבקרה. הגדר את ציוד ההדמיה וודא שהוא מופעל.
3. הרגעת החזיר
- הרגיעו את החזיר בזריקה תוך שרירית של TKX (טלזול 4.4 מ"ג/ק"ג; קטמין 2.2 מ"ג/ק"ג; קסילזין 2.2 מ"ג/ק"ג) במינון של 1 מ"ל/50 ליברות. החזיקו את החזיר בחדר ההליכים על איזופלורן 1%-3% המועבר באמצעות מסכה.
- לנהל את משככי הכאבים (לפני הניתוח) לחזירים על פי פרוטוקול IACUC; להלן כמה דוגמאות: buprenorphine 0.3 מ"ג / מ"ל, 0.01-0.05 מ"ג / ק"ג IM; קרפרופן 50 מ"ג/מ"ל, 4 מ"ג/ק"ג IM או SQ; פנטניל טרנסדרמלי 100 מק"ג / שעה מונח על הפינה של האוזן; gabapentin 300 מ"ג כמוסות, 3-10 מ"ג / ק"ג PO.
הערה: עבור כל הליכי הכוויה והביופסיה, מנה אחת של gabapentin תינתן יום לפני הניתוח ומנה אחת של קרפרופן תינתן ביום ההליך. עבור הליך הצריבה הראשי, מדבקת פנטניל יוצב, ומנה מלאה אחת של buprenorphine תינתן במהלך הכנה כירורגית.
4. אינדוקציה של הרדמה
- לעקר את האוזן עם לסירוגין 2% chlorhexidine לשפשף אלכוהול לפחות שלוש פעמים. הכנס A 22-18 G 1 בצנתר תוך ורידי לווריד האוזן השולי ואשר את זרימת הדם. שטפו את הצנתר במי מלח, וקבעו את הצנתר בעזרת סרט ניתוח (איור 1B).
- הכניסו את החזיר לאינטובציה עם צינור אנדוטרכאלי בגודל מתאים (7-9 מ"מ) לאחר שהושגה הרפיית שרירים על ידי שאיפת הרדמה דרך המסכה. בדוק את הרפיית השרירים על ידי אובדן טונוס הלסת ורפלקס palpebral להיות נצפה.
- פתחו את הצינור ובדקו את דליפת השרוול באמצעות מזרק אוויר. הכנס את הצינור בעזרת laryngoscope30.
- יש לנפח את השרוול ולאבטח את הצינור לאחר אישור המיקום הנכון. חבר את החזיר למעגל הנשימה.
הערה: הצינור קשור למקומו מעל החוטם, וגזה גליל משמש כדי לאבטח אותו. פיסול החזה מתבצע באמצעות סטטוסקופ כדי לאשר את המיקום הנכון של הצינור.
הערה: במהלך ההרדמה, האוויר מסופק כל 5-10 דקות על ידי סגירת שסתום הקפיץ ולחץ על שקית הנשימה מחדש עד שמנומטר הלחץ מגיע ל -20 מ"מ / כספית כדי למנוע אטלקטזיס מיקום.
- עקוב אחר בעל החיים ועומק ההרדמה.
- חבר את החזיר לצג מרובה פרמטרים. הצג יקרא ברציפות את ריווי החמצן (SpO 2), קצב הדופק, פחמן דו חמצני בסוף הגאות (EtCO2), קצב הנשימה והטמפרטורה. רשום את החיוניות כל 10 דקות לאורך כל ההליך.
- להעריך את עומק ההרדמה על ידי בדיקת רפלקסי הכאב עם צביטה בבוהן רגל אחורית לפני תחילת הפציעה.
הערה: בעת הצורך, התאימו את מכשיר ההרדמה למתן הרדמה נוספת, או המתינו מספר דקות. בדוק את רפלקסי הכאב ואת הרפלקסים המישושיים באופן קבוע לאורך כל הניתוח.
5. הכנת בעלי חיים לפציעה מכוויה
- נתקו את החזיר ממכונת ההרדמה והעבירו אותו לשולחן הפרוצדורות. הניחו את החזיר בתנוחת שכיבה של עצם החזה, והקפידו לאבטח את כל הקווים והצינורות המחוברים (איור 1C).
- חבר מחדש את החזיר למכונת ההרדמה, ושמור על O2 ב 0.8-1.5 ליטר / דקה ואת isoflurane ב 1%-3% עד סוף ההליך.
- יש לתת עירוי נוזלים (LRS) לחזיר בקצב טפטוף של 8-10 מ"ל/ק"ג/שעה. עקוב אחר ההרדמה כמו בשלב 4.3.
6. הכנה אנטיספטית וסימון של אתר הכוויה בעור
- הכינו את אזור הפצע על-ידי גילוח ומריחת קרם להסרת שיער, כמתואר להלן (איור 2).
- מגלחים את דורסום החזיר בשטח ברוחב של כ-25 ס"מ מעמוד השדרה ועד לבית השחי משני הצדדים באמצעות קוצץ חשמלי.
- יש למרוח את קרם הסרת השיער על האזור הקצוץ, ולאפשר לשבת במשך 3-7 דקות. הסירו את הקרם יחד עם השיער בעזרת מגבות נקיות סופגות.
- הכנת אתר הכוויה
- יש לשפשף את האזור הפצוע עם פילינג 2% כלורהקסידין ו-70% אלכוהול איזופרופיל לסירוגין לפחות שלוש פעמים במשך כ-5 דקות. ודא שהשפשוף נמרח בתבנית עין שור (מתחיל במרכז ונע החוצה בספירלה) על ידי אנשי צוות הלובשים כפפות סטריליות.
- סמנו את אתרי הפצע באמצעות תבנית כוויה סטרילית וסמן עור כירורגי (איור 2B). סמן שישה עד שמונה פצעים (2 אינץ 'x 2 אינץ ') באופן סימטרי על הגב.
- כסו את האזורים סביב האתרים המסומנים עם וילון סטרילי כדי להפחית את הזיהום (איור 2C).
7. הליך פציעה מכוויה
- השתמש בהתקן כוויה, כגון מבער מותאם אישית מייצור ביתי המורכב מבלוק נירוסטה בגודל 2 אינץ' x 2 אינץ' (משקל: 352 גרם) המחובר לחרט מתכת, מיקרוסטט אלקטרוני ומשקל אלקטרוני (משקל כולל: 1,714 גרם; איור 3).
- כוונו את המבער לטמפרטורה הרצויה. התאימו את טמפרטורת היעד לפצעים בעובי מלא ב-150°C (איור 3A). לשם כך, התאם את נקודת ההגדרה (SP) ביחידת הבקרה ל- 150 °C. קבעו את נקודת הסט הנמוכה ל-145°C ואת נקודת הקביעה הגבוהה ל-155°C (איור 1D).
- צרו פצע כוויה בעובי מלא של 2 אינץ' x 2 אינץ' באמצעות בלוקים מחוממים מפלדת אל-חלד המחוברים למכשיר הכוויה והנחתם על העור למשך 60 שניות (איור 3B, C). במהלך יישום הכוויה, השתמש בסולם האלקטרוני כדי להבטיח לחץ אחיד מופעל על ידי המבער.
8. הערכה והדמיה של פצעי כוויות
- צילום דיגיטלי
- צלם את הפצעים באמצעות מצלמת DSLR ומיקוד אלקטרו-פוקוס אחורי קצר (EFS), עדשה על-קולית בעלת זווית רחבה בגודל 17-55 מ"מ ופנס.
- צלם תמונה דיגיטלית של כל החזיר בחזרה, כולל שלט עם זיהוי החזיר, נקודת זמן ותאריך. לאחר מכן, צלם תמונות עבור כל פצע בנפרד המציגות שלט עם מזהה חזיר, מזהה פצע ונקודת זמן, וסרגל.
- חשב את שטח הפצע כאחוז מגודל הפצע המקורי בכל נקודת זמן של איסוף עד ליום 56.
הערה: בעבודה זו, אזור הפצע חושב בכל נקודת זמן (d0, d7, d14, d28 ו-d56) כאחוז משטח הפצע המקורי ב-d0.
- דימות כתמי לייזר (LSI)
- להדמיית כתמי לייזר, השתמש במכונת הדמיה של זילוח דם המבוססת על טכנולוגיית ניתוח ניגוד כתמי לייזר (LASCA) כדי להעריך את הזלוף המיקרו-וסקולרי של הפצע בזמן אמת.
- צלם את התמונות של כל הפצעים בהקלטה אחת. התאימו את הערך הנמדד של מרחק העבודה ממצלמת הלייזר לפצע כך שיהיה עקבי להדמיה של כל פצע (איור 4A).
- הקלט את הזילוח על ידי סדרה של תמונות שצולמו בטווח של 10-15 שניות. לאחר צילום פצע, ההקלטה מושהית באופן אוטומטי, וההקלטה מתחדשת ברגע שהמצלמה מותאמת לפצע הבא. בכל פעם שההקלטה נעצרת, מתווסף סמן לזיהוי הפצע.
- איבוד מים טרנסאפידרמלי (TEWL)
- מדדו את ה-TEWL עבור כל פצע באמצעות יחידה סטנדרטית, בדיקה של TEWL ותוכנה (איור 4B). עבור כל פצע, הניחו כיסוי בדיקה נקי מעל קצה הבדיקה, אשר יהיה במגע עם רקמת הפצע.
- הנח את הבדיקה בעדינות ובאופן שווה על העור, והתחל את הקריאה על-ידי לחיצה על לחצן התחל ביחידה.
- מדדו כל פצע חמש פעמים, תחילה במרכז ולאחר מכן בכל פינה. לאחר מכן, יצא את כל הקריאות לגיליון אלקטרוני (איור 4B).
- אולטרסאונד הרמוני (HUSD)
- בצע מיפוי HUSD על ידי סריקת הפצע עם בדיקת אולטרסאונד (US) מקו האמצע (עמוד השדרה) החל מעור רגיל לכיוון הצד הצדדי של החזיר שבו יש שוב עור רגיל. עקבו אחר תבנית סריקה זו עבור כל פצע הן במצב B והן במצב אלסטוגרפיה של רקמות באמצעות מכשיר האולטרסאונד (איור 4C).
- לסריקה במצב B, יש למרוח ג'ל אולטרסאונד סטרילי על אזור הפצע, ולמרוח מעט על הבדיקה ML-615 ברזולוציה גבוהה. הוסף הערות לכל הקלטה עם תווית זיהוי הפצע. התחל את ההקלטה, והזז את הבדיקה באיטיות מקו האמצע במורד הפצע עד שמגיעים לעור הרגיל בצד השני.
הערה: לאחר סיום הסריקה, ההקלטה נשמרת ומיוצאת מהמכשיר לניתוח. - עבור אלסטוגרפיה, העבר את מכשיר האולטרסאונד למצב אלסטו על ידי לחיצה על לחצן Elasto . סרוק שוב את הפצע באותו אופן כמו בסריקה במצב B, וודא שהלחץ האחיד של הבדיקה נשמר כדי לאפשר למחוון צבע האלסטוגרפיה (הפסים הירוקים) להישאר גלוי לאורך כל ההקלטה.
הערה: ניתן לקבוע לחץ מתאים על-ידי סרגל קנה המידה בהקלטה, שמופיע ירוק כאשר נוצר המגע הנכון (איור 4D). - שנה את הביאור לאחר שכל פצע מצולם הן במצב B והן במצב אלסטו (שתי הקלטות לכל פצע). שנה את ההערה בתוכנה כדי לכלול את המידע עבור הפצע הבא, וחזור על התהליך עבור הפצעים הבאים.
- לסריקה במצב B, יש למרוח ג'ל אולטרסאונד סטרילי על אזור הפצע, ולמרוח מעט על הבדיקה ML-615 ברזולוציה גבוהה. הוסף הערות לכל הקלטה עם תווית זיהוי הפצע. התחל את ההקלטה, והזז את הבדיקה באיטיות מקו האמצע במורד הפצע עד שמגיעים לעור הרגיל בצד השני.
- בצע מיפוי HUSD על ידי סריקת הפצע עם בדיקת אולטרסאונד (US) מקו האמצע (עמוד השדרה) החל מעור רגיל לכיוון הצד הצדדי של החזיר שבו יש שוב עור רגיל. עקבו אחר תבנית סריקה זו עבור כל פצע הן במצב B והן במצב אלסטוגרפיה של רקמות באמצעות מכשיר האולטרסאונד (איור 4C).
9. חבישה והלבשה
- כסו את פצעי הכוויות בנפרד בחבישות סרט שקוף או בחבישת הבדיקה (איור 5A, B). הניחו חבישת סרט שקופה גדולה יותר על כל אזור הפצע (איור 5C).
- החל שכבה שנייה של גזה גליל באופן רופף סביב כל תא המטען של החזיר כדי לספוג כל exudate נוזל שמגיע מן הפצעים. גלגלו את החזיר קדימה ואחורה מצדו עד מעט על גבו כדי לעטוף את חומר התחבושת סביב החזיר.
- כסו את הגזה באופן רופף בשכבה של תחבושת אלסטית גמישה (איור 5D). ודא כי התחבושת אינה הדוקה מדי, כמו החלת אותו חזק מדי יכול להגביל את הנשימה ולהפעיל לחץ על הבטן, אשר יכול לגרום לצניחה רקטלית או סיבוכים שונים.
הערה: התחבושת האלסטית נמתחת וניתן בקלות להדק אותה יתר על המידה במהלך המריחה. משיכת אותו מהגליל ולאפשר לו להניח על קצה העטיפה הקודמת יכולה לסייע במניעת הידוק יתר. - כסו את התחבושת האלסטית בשכבה סופית של 4 בסרט אלסטי (איור 4E). שוב, ודאו שהמריחה אינה הדוקה מדי, אך ודאו שהחבישה מאובטחת בקצה העליון והתחתון כדי למנוע ממנה להחליק מטה בזמן שהחזיר נע לאחר ההליך.
10. התאוששות בעלי חיים וטיפול לאחר הניתוח
- שחזור
- יש להפסיק את השימוש בגז ההרדמה עם סיום הפציעה, הליך ההדמיה והחבישה. הניחו לחזיר להישאר על חמצן למשך 5 דקות לפחות.
- העבירו את החזיר, לאחר חזרתו למתחם הראשי, משולחן ההובלה/הרמה למשטח התאוששות מקצף בכלוב. הרימו את מתקן המים האוטומטי, והסירו את מזין ה-J כדי למנוע פגיעה בחזיר במהלך ההתאוששות.
- כסו את החזיר בשמיכות (כולל שמיכת אוויר חם) אם קיימת היפותרמיה. נטר ותעד את המדדים החיוניים כולל הטמפרטורה, הדופק, קצב הנשימה ו- SpO2 כל 10-15 דקות.
- עקוב ברציפות אחר החזיר עד שהוא מסוגל לשמור על שכיבת עצם החזה באופן עצמאי. לאחר שהחזיר התאושש לחלוטין, הורידו את מי הפטמות, ואז ניתן גם להאכיל את החזיר.
- הערכת כאב
- בצע הערכת כאב לאחר הניתוח באמצעות טופס ניקוד כאב גלזגו שונה. ודא שהערכות הכאב הושלמו על ידי צוות המעבדה או LARC לפחות כל 12 שעות במשך 3-4 הימים הראשונים לאחר הניתוח. תדירות ניקוד הכאב נקבעת על ידי הווטרינר המטפל. אם בעל החיים מקבל ציון מעל 5, לנהל שיכוך כאבים הצלה (buprenorphine או hydromorphone).
- לספק שיכוך כאבים על ידי מתן מינון של buprenorphine 0.01-0.05 מ"ג / ק"ג IM טרום הליך, עם מנה שנייה ניתנה 8-12 שעות מאוחר יותר.
- הניחו מדבקת פנטניל (100 מק"ג/שעה) על הפינה של האוזן לפני פציעת הכוויה.
- יש להזריק קרפרופן 4 מ"ג/ק"ג IM או SQ לפני ההליך, ולאחר מכן פעם ביום IM, SQ או PO במשך יומיים או לפי הוראות וטרינר LARC.
- תן gabapentin 3-10 מ"ג / ק"ג דרך הפה, עם מינון ניתן יום לפני ההליך, בבוקר של ההליך, בערב שלאחר ההליך, ולאחר מכן כל 12 שעות במשך 3-5 ימים.
- דיאטה
- ודא שהחזירים התאוששו, ולאחר מכן אפשר גישה חופשית למים ולמזון בהתאם למנת המשקל שלהם פעמיים ביום.
- לספק העשרת מזון (פירות וירקות טריים, פירות קפואים, מרשמלו, יוגורט, פודינג, וכו '), ולהשתמש בהם כדי לפתות אכילה אם ירידה בתיאבון הוא ציין.
- שינוי הלבשה
- החליפו את התחבושות לפחות פעם בשבוע או לעתים קרובות יותר אם התחבושות מתלכלכות או כדי להתאים לאסטרטגיות טיפול.
- החליפו את התחבושות לאחר ההדמיה בעודכם תחת הרדמה, או הרדימו את החזיר עם TKX בלבד להחלפת חבישה.
- כדי להחליף את התחבושת, התחילו בהסרה זהירה של התחבושת המלוכלכת באמצעות מספריים של תחבושת ליסטר או צווחות טראומה, שימו לב לא לאפשר לחלק החיצוני של החבישה לבוא במגע עם הפצעים.
- נקו את האזור סביב הפצעים במידת הצורך באמצעות 0.9% NaCl על גזה נקייה, וייבשו את האזור בעדינות. בצע את שלבי ההליך לחבישה המתוארים בסעיף 9.
הערה: אם מוחלים תחבושות ניסיוניות, ניתן למרוח אותן לפני כיסוי הפצעים בחבישת הסרט השקוף.
- תדירות הדמיה
- קבל הדמיה (תמונות דיגיטליות, LSI, TEWL ו- HUSD) בנקודות זמן שונות במהלך המחקר. אספו נתוני הדמיה ביום ה-3 (פציעת כוויה), ביום 0 (חיסון) וביום 7, ביום ה-14, ביום ה-28, ביום ה-35 וביום ה-56 שלאחר החיסון.
11. הכנת ביופילם וחיסון
- הכנת Inoculum
- הכינו צלחת התחלה ממלאי גליצרול מקפיא של Pseudomonas aeruginosa (PA01) לתרבית טהורה של החיידק. לגדל תרבית P. aeruginosa ב Luria-Bertani אגר דל מלח (LBA), ולדגור ב 37 ° C במשך הלילה.
- יש לחסן 5 מ"ל של מרק לוריא-ברטאני דל מלח (LBB) במושבת P. aeruginosa אחת למחרת, ולדגור לילה ב-37°C עם רעידות ב-200 סל"ד.
- כדי להשיג תאי שלב לוג, חסן 200 μL של תרבית לילה לתוך 5 מ"ל של LBB, ודגר בשייקר ב 200 סל"ד ב 37 ° C במשך 2.5 שעות.
- מדוד את הצפיפות האופטית ב- 600 ננומטר (OD600) באמצעות ספקטרופוטומטר. הכינו דילולים סדרתיים עד 1 x 10−9 באמצעות 100 μL מהתרבית ב-900 μL של LBB סטרילי.
הערה: התחלנו עם דגימות לא מדוללות וסיימנו עם 1 x 10 7 CFU/mL.השגנו מושבות ניתנות לספירה, בדילול 1 x 107, ולכן שקלנו דילול זה כדילול הסיום. - יש לפזר 100 μL מכל דילול על LBA, ולדגור למשך הלילה ב-37°C. בהתאם לפרוטוקולים מיקרוביולוגיים סטנדרטיים, השתמש בדילולים המראים מושבות ניתנות לספירה, (30-300) עבור ספירת המושבות, וקבל את יחידות יצירת המושבה (CFU).
- חיסון הפצע
- יש לחסן 200 μL מתרבית הלילה לתוך 5 מ"ל של ציר LB, ולדגור בשייקר ב 37 ° C במשך 2.5 שעות.
- מדוד את הצפיפות האופטית של תרבית היום ב- 600 ננומטר (OD600). לחיסון PA01, יש להשתמש ב-3 x 10 8 CFU/mL (250 μL של 1 x 108 CFU/mL PA01 מחוסן לכל פצע). יש להעביר את החיסון למתקן בעלי החיים במיכל מסוכן ביולוגית.
- פזרו את החיסון על פני השטח של הפצעים החשופים ביום השלישי שלאחר הכוויה באמצעות פיפטה, ופזרו באופן שווה באמצעות מפזר חד פעמי (איור 6). יש להשאיר את הפצעים פתוחים למשך כ-15 דקות לפני החבישה.
הערה: כל ההליכים הכירורגיים, החיסון, ביופסיות הרקמות, ההדמיה והחבישה נעשים בהרדמה כללית כמו בסעיפים 3 ו-4.
- אישור הקמת זיהום
הערה: כדי לוודא שהפצעים הזדהמו בהצלחה בעקבות החיסון, נעשה שימוש במספר גישות, ודגימות פצע מושוות לדגימות שנאספו מעור רגיל; להלן מספר דוגמאות.- לניתוח מבוסס פתולוגיה של דגימות שנאספו בנקודות זמן שונות, השתמש בספירה של יחידות יוצרות מושבה כדי להעריך זיהום (CFU; איור 7E, F).
- לאסוף 6 מ"מ של רקמות הפצע על ידי ביופסיית אגרוף. יש לתייג ולשקול צינורות ריקים בנפח 5 מ"ל בעלי תחתית עגולה. מעבירים את הדגימות לצינורות, ושוקלים את הצינורות עם הדגימות.
- חותכים את הרקמה בעזרת אזמל על משטח סטרילי. בצע את כל השלבים במכסה מנוע BSL2.
הערה: כדי לוודא שהרקמות הומוגניות בקלות, הגודל צריך להיות קטן מאוד (אך לא פחות מ -0.5 מ"מ) - שים את הדגימה בצינור, ולהוסיף 1mL של PBS. מערבבים וטוחנים את הרקמה באמצעות בדיקת שחיקת רקמות קשות.
- מדולל באופן סדרתי (לא מדולל ל-1 x 10-5) את ההומוגנאט, ולוחית 50 μL מכל דילול במדיה סלקטיבית (Pseudomonas Isolation Agar, PIA) ולא סלקטיבית (LBA).
- לדגור את כל דילולים בתנאים אירוביים ב 37 ° C במשך 18-24 שעות. דמיינו את הלוחות עם תנאי תאורה מתאימים.
- בחרו צלחות עם 30-300 מושבות, אם אף אחת מהפלטות לא הגיעה לריכוז הזה, השתמשו בצלחת הלא מדוללת. השתמש ב- ImageJ כדי לספור את מספרי המושבה, ולחשב את CFU לכל צלחת על ידי הכפלת הערך הממוצע בגורם הדילול הסופי.
- רכשו את התמונות מדגימות שנאספו מהיום השביעי שלאחר החיסון ומנקודות זמן אחרות באמצעות מיקרוסקופ אלקטרונים סורק (SEM) כדי לאשר את נוכחותם של הביופילמים החיידקיים (איור 7G).
הערה: יום 7 לאחר החיסון נבחר מכיוון שהוא יום הקמת זיהום ביופילם ותחילת ריכוך אשחר כוויות, המאפשר חדירה של גלי ארה"ב ובכך הדמיה של הרקמות העמוקות יותר. באיור 4, בדקו את תמונת פצע הכוויה בארה"ב ביום 3, אשר מראה את האשכר העבה דמוי העור שמונע מגלי ארה"ב לעבור דרך הרקמות העמוקות יותר. - הכתימו את חלקי ביופסיות הפצע בנוגדנים ספציפיים נגד P. aeruginosa כדי לאשר את נוכחות החיידקים הספציפיים, כפי שמוצג בפרסום קודם13 (איור 7H).
- בצע ריצוף של הדור הבא (NGS), כפי שפורסם ב- Sinha et al.31. כמת את החיידק 16srRNA מהפצעים הנגועים ואת דגימות העור הרגילות הלא נגועות שנאספו בנקודות זמן שונות החל מהיום השביעי לאחר החיסון ועד סוף המחקר.
- לניתוח מבוסס פתולוגיה של דגימות שנאספו בנקודות זמן שונות, השתמש בספירה של יחידות יוצרות מושבה כדי להעריך זיהום (CFU; איור 7E, F).
12. איסוף ביופסיה
- אספו את ביופסיות הרקמה לניתוח לאחר הדמיה ביום 7, יום 14, יום 28 ויום 56 לאחר החיסון. אספו ביופסיות מכל פצע פעם אחת בלבד כדי למזער את ההפרעה לתהליך הריפוי.
הערה: כל ההליכים הכירורגיים, החיסון, ביופסיות הרקמות, ההדמיה והחבישה נעשים בהרדמה כללית כמו בסעיפים 3 ו-4.- לחדור לאזור סביב הפצע עם 0.5% bupivacaine. חותכים רצועה ברוחב 3-4 מ"מ מקצה אחד של הפצע לקצה השני, תוך שמירה על שוליים קטנים של עור רגיל משני הצדדים, באמצעות אזמל חד פעמי עם להב בגודל 10. מניחים את הרצועה לתוך צינור חרוטי מסומן מלא פורמלין חוצץ 4% לקיבוע.
הערה: עבור הליכי הדמיה וביופסיה מוקדמים, מינון מלא של buprenorphine יינתן במהלך הכנה כירורגית. עבור הליכי ביופסיה מאוחרים, חצי מנה של buprenorphine תינתן במהלך הכנה כירורגית. לאחר כל הליכי הכוויה והביופסיה, gabapentin יינתן BID עד 7 ימים כפי שהומלץ על ידי הווטרינר המטפל. קרפרופן יינתן במשך ימים לאחר הניתוח או על פי המלצת הווטרינר המטפל. - חותכים ביופסיית ניקוב 6 מ"מ מהפצע (ממיטת הפצע או מקצה הפצע). יש לאסוף מקצה הפצע, כולל חלק מהעור הרגיל וממיטת הפצע, לסוגים שונים של ניתוח.
- מוציאים את הדגימה בעזרת מלקחיים מעוקרים ומספריים מנתחים. הניחו את דגימת הביופסיה בצינור או בקלטת המתאימים לעיבוד וניתוח.
- עבור CFU, SEM, RNA ו- FPPE, שמור את הדגימות בצינורות עם חיץ מתאים. לדוגמה, ניתן להכניס דגימות ל-OCT בקלטות עבור מיקרוסקופ לכידת לייזר (LCM) ואימונוהיסטוכימיה (IHC).
- להשיג hemostasis לאחר הדגימות נאספים על ידי לחיצה עדינה על הפצע עם גזה סטרילית. כסו את הפצע בחבישה לא דבקה, ותחבושת כמו בסעיף 9.
- לחדור לאזור סביב הפצע עם 0.5% bupivacaine. חותכים רצועה ברוחב 3-4 מ"מ מקצה אחד של הפצע לקצה השני, תוך שמירה על שוליים קטנים של עור רגיל משני הצדדים, באמצעות אזמל חד פעמי עם להב בגודל 10. מניחים את הרצועה לתוך צינור חרוטי מסומן מלא פורמלין חוצץ 4% לקיבוע.
13. המתת חסד ואיסוף רקמות
- להרגיע את החזיר ביום המתת חסד עם TKX, להרדים עם isoflurane. יש להכניס קטטר תוך ורידי לווריד האוזן השולי בהתאם לשלבים המפורטים בסעיף 3. יש לבצע אינטובציה לחזיר בהתאם לשלבים בסעיף 4.
- הסירו את התחבושת לאחר שהחזיר מורדם, ונקו את האזור סביב הפצעים.
- צילום דיגיטלי מלא, LSI, TEWL והדמיית HUSD. יש לאסוף את הדגימות מהפצעים ומהעור הרגיל בהתאם לשלבים המפורטים בסעיף 12.
- לאחר איסוף כל הדגימות הנדרשות, יש להרדים את החזיר באופן הומני בעודו תחת הרדמה באמצעות הזרקה תוך ורידית של תמיסת המתת חסד מסחרית (נתרן פנטוברביטל). השתמש בסטטוסקופ כדי לאשר את הפסקת פעימות הלב והנשימה הספונטנית.
- בצע שיטה משנית של המתת חסד, כנדרש על ידי SOM IACUC, באמצעות אזמל כדי לגרום pneumothorax. מעבירים את פגר החזיר לחבית, ומעבירים למקפיא לאיסוף לשריפה.
Representative Results
מכשיר כוויה סטנדרטי שימש ליצירת פצעי כוויות בעובי מלא בטמפרטורה של 150 מעלות צלזיוס למשך דקה אחת, מה שהביא לכוויה עמוקה הומוגנית עם שוליים אחידים של אריתמה ודלקת (איור 3 ואיור 7). כל חזיר קיבל שמונה פצעי כוויות בעובי מלא על גבו, כפי שמתואר באיור 3C.
הערכה לא פולשנית בזמן אמת של פצעי הכוויות באמצעות אולטרסאונד ברזולוציה גבוהה במצב B כדי לאשר את עומק הפצע ואת התקדמות ריפוי הפצע לאורך זמן הראתה הרס של כל שכבות העור עד לשומן התת עורי (איור 4). הדמיית כתמי לייזר (LSI) שימשה לאפיון נוסף של זילוח הפצע (איור 4A).
פצעי הכוויה הראו קרום פיוגני עבה על פני השטח של הפצע ביום 7 לאחר החיסון, ובכך אישרו את הזיהום ואת התבססות הביופילם של פצע הכוויה (איור 7A). פלנימטריה דיגיטלית הראתה אזור פצע מוגבר ביום השלישי לאחר החיסון עם PAO1 עקב התגובה הדלקתית באזור הפצע ובשוליים (איור 7A,B). אף על פי שאזור הפצע החל להתכווץ ביום ה-14 שלאחר החיסון, ביום ה-56 נצפתה החלמה חלקית לכ-25% מגודל הפצע המקורי, מה שמצביע על כרוניות הפצעים (איור 7B). כרוניות הפצע וריפוי פצעים לקוי אושרו עוד יותר על ידי TEWL, אשר הראה אובדן מים טרנסאפידרמלי גבוה. תוצאות TEWL שיקפו את אובדן תפקוד מחסום העור בהשוואה לעור רגיל שנמדד בכל נקודות הזמן, ובכך הצביעו על פגיעה תפקודית בריפוי פצע הכוויה (איור 7B). זה אושר גם על ידי דיכוי חלבוני הצמתים ההדוקים ZO-1 ו-213 והפגיעה בשיקום תפקוד מחסום העור, כפי שמשתקף בערכי TEWL הגבוהים שנצפו ביום 35 (אמצע) וביום 56 (מאוחר) למרות סגירת פצע הראייה (איור 7I).
עומק הכוויה קיבל תוקף נוסף על-ידי צביעת H&E, שהראתה עיוות ונמק של כל שכבות העור ההיסטולוגיות, כפי שניתן לראות באיור 7C. הביופילם המבוסס של PA01 קיבל תוקף נוסף ביום השביעי שלאחר החיסון על-ידי CFU (איור 7E,F), דימות SEM (איור 7G) וצביעה אימונופלואורסצנטית (איור 7H).

איור 1: הכנה להליך . (A) הכנת שולחן ניתוחים. (B) קנולציה של ורידים באוזן לעירוי נוזלים ומתן תרופות. (C) כיסוי שמיכה תרמי להגנה על החזיר מפני היפותרמיה במהלך ההליך. (D) הגדרת מבער וטיימר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
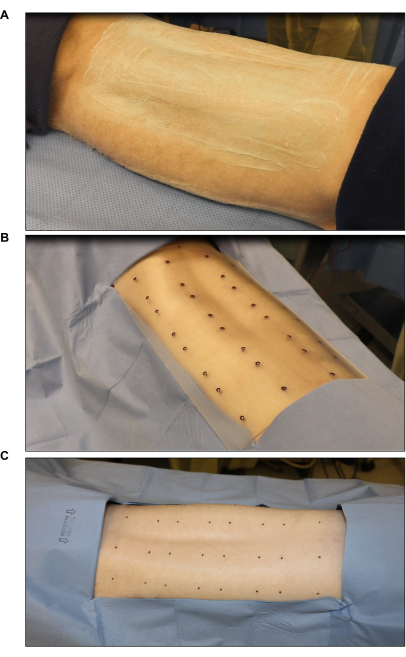
איור 2: עיקור וסימון של אתר ניתוחי . (A) גזירת שיער ועיקור. (B) סימון מקום הכוויה באמצעות תבנית סטנדרטית סטרילית בעלת שמונה פצעים (כל פצע בגודל 2 אינץ' x 2 אינץ'). (C) סימון סופי באמצעות סמן עור סטרילי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
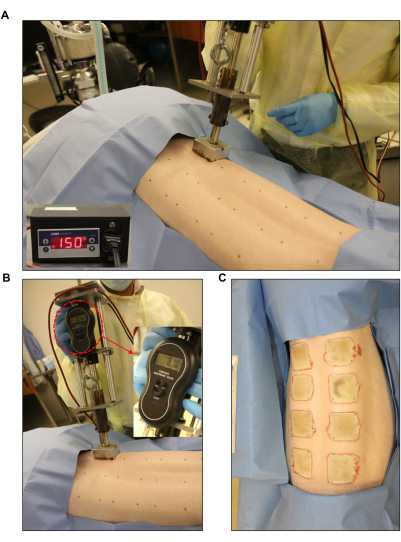
איור 3: השראת פצע כוויה. (A,B) מבער סטנדרטי עם מד לחץ ויחידת בקר אוטומטית (2 אינץ' x 2 אינץ') שהוחלו על אתר הפצע המסומן מראש. (C) כל הגב מראה את שמונת פצעי הכוויות בעובי מלא. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
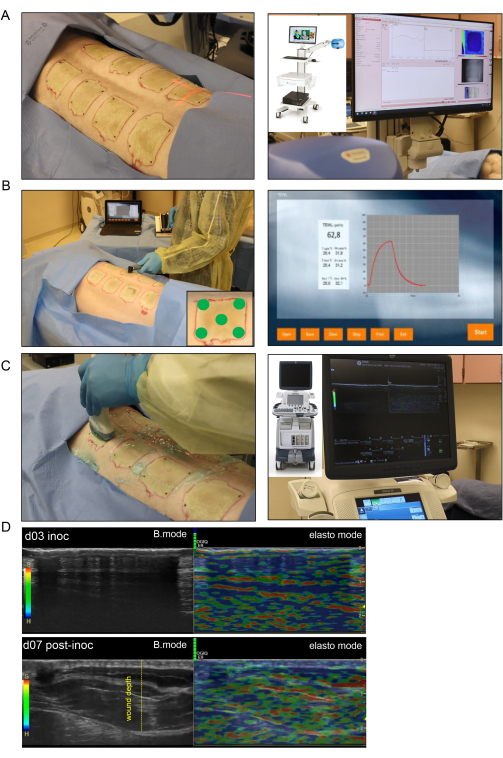
איור 4: הדמיה והערכה לא פולשנית של פצעי כוויות. (A) הדמיית כתמי לייזר (LSI) עם כיוון נכון של מחוון קרן הלייזר למרכז הפצע מוצגת בתמונה בצד שמאל; התמונה בצד ימין מציגה את מכשיר LSI ואת מפת זילוח כלי הדם של העור בזמן אמת. (B) יישום בדיקת איבוד מים טרנסאפידרמלי (TEWL) על אתר הפצע בחמישה מקומות שונים (ארבע פינות פצע והמרכז מודגם בתמונה בפינה הימנית התחתונה) מוצג בתמונה בצד שמאל; התמונה בצד ימין היא מסך מייצג שצולם בזמן אמת של מדידת TEWL. (C) סריקת אולטרסאונד הרמונית של פצע הכוויה באמצעות בדיקת אולטרסאונד ברזולוציה גבוהה של 16 MHz מוצגת בצד שמאל; התמונה בצד ימין מציגה את מכשיר האולטרסאונד ואת הקלטת המסך בזמן אמת. (D) תמונות מבניות (תמונות במצב B, אולטרסאונד בגווני אפור) וביומכניות (אלסטוגרפיה, אולטרסאונד צבעוני) של אתר פצע הכוויה ביום החיסון וביום השביעי שלאחר החיסון. עומק הפצע מסומן על ידי הקו המקווקו הצהוב. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
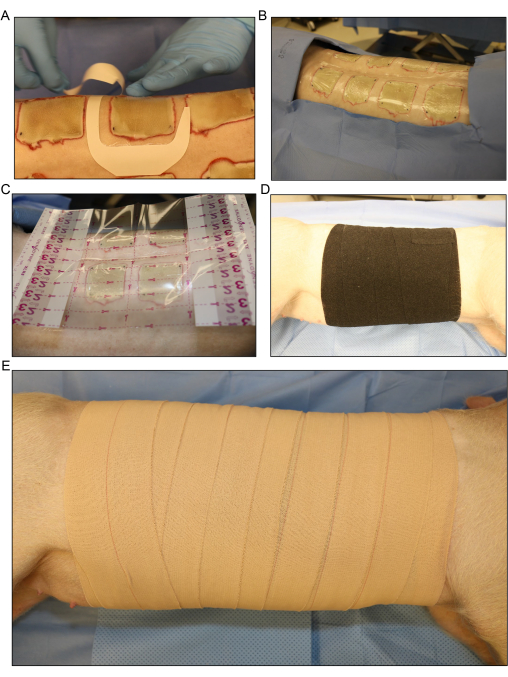
איור 5: חבישת פצעים וחבישה. (A) יישום של חבישת הסרט השקוף לכל פצע בנפרד. (B) כל פצעי הכוויות המחוסנים בגב מכוסים בשכבת החבישה הראשונה. (C) חבישת סרט שקופה גדולה יותר מונחת על כל אזור הפצע. (D) מריחת שכבת הגזה השנייה ושכבה רופפת של תחבושת אלסטית נמתחת סביב כל תא המטען של החזיר כדי לספוג כל הפרשה נוזלית שמגיעה מהפצעים. (ה) כיסוי כל אזור הפצע בשכבה סופית של 4 בחבישת דבק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
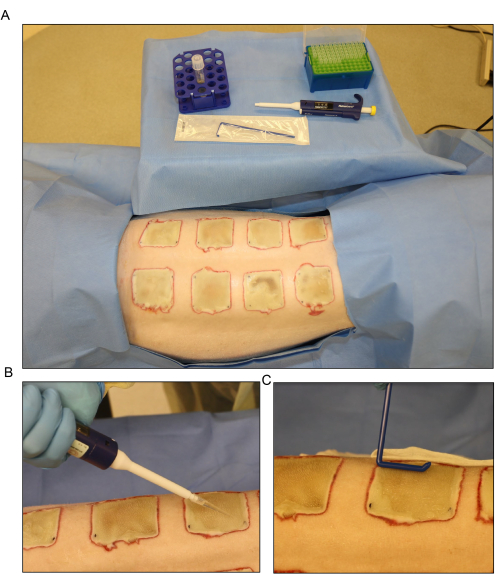
איור 6: חיסון חיידקי . (A) הכנה לחיסון Pseudomonas aeruginosa (PA01) ביום השלישי לאחר הכוויה. (B) מריחה מקומית של החיסון עם פיפטה בנפח 500 μL לכל פצע. (C) החיסון מפוזר על פני משטח הפצע באופן שווה באמצעות מפזר חד פעמי סטרילי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
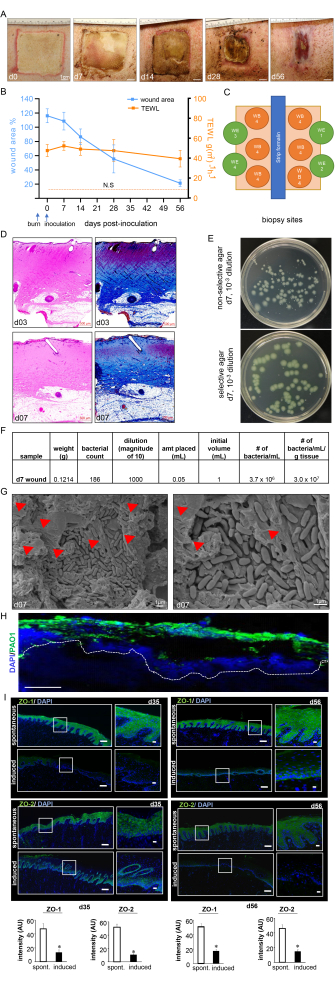
איור 7: התקדמות ריפוי פצעים ואישור ביופילם. (A) תמונות מייצגות של סגירת הפצע על ציר הזמן של המחקר. סרגל קנה מידה = 1 ס"מ. (B) כימות אזור הפצע ומדידות TEWL על ציר הזמן של המחקר (n = 6). הנתונים מיוצגים כממוצע ± SD. N.S. מתייחס לערך TEWL של עור רגיל. (C) תרשים סכמטי המציג אתרי ביופסיה שונים של פצע. ד. מכתים H&E עם מכתמי הטריכרום המתאימים של Masson המראים עיוות ונמק של כל שכבות העור ביום 3 לאחר הכוויה וביום 7 לאחר החיסון. סרגל קנה מידה = 500 מיקרומטר. (E) תמונות דיגיטליות מייצגות של אגר לא סלקטיבי (אגר לוריא-ברטאני) ואגר סלקטיבי (אגר בידוד Pseudomonas) עם מושבות חיידקים שגדלו מרקמת מיטה חזירית. המדיום הסלקטיבי מאפשר ספירה מדויקת של מושבות PA01 בלבד. (F) מוצג חישוב יחידת יצירת מושבות מדגם (CFU) מספירות המושבה שנלקחו מביופסיות פצע מעובדות ביום 7 לאחר החיסון. (G) תמונות מייצגות של מיקרוסקופ אלקטרונים סורק (SEM) של פצעי הכוויות המחוסנים ביום השביעי שלאחר החיסון המראות את הביופילם PA01 שנקבע, עם תמונה מוגדלת בצד ימין. סרגל קנה מידה = 1 מיקרומטר. ראשי החץ האדומים מצביעים על חומרים פולימריים חוץ-תאיים (EPS). (H) P. aeruginosa על פצעי הכוויות הודגמו באמצעות נוגדן אנטי-Pseudomonas (ירוק); תמונות האימונופלואורסנציה של יום 7 לאחר החיסון ביופסיות פצע מראות התיישבות כבדה של רקמות הפצע על ידי P. aeruginosa. סרגל קנה מידה = 100 מיקרומטר. (I) פסיפס מייצג (סרגל קנה מידה = 200 מיקרומטר) ותמונות מוגדלות תואמות (סרגל קנה מידה = 50 מיקרומטר) של מקטעים מוכתמים ZO-1 ו- ZO-2 ביום 35 וביום 56 לאחר החיסון, המדגימות ביטוי מופחת של החלבונים לאחר הזיהום המושרה. החלקים הקפואים המשובצים ב-OCT (10 מיקרומטר) הוכתמו באמצעות אנטי-ZO-1 (ירוק) או אנטי-ZO-2 (ירוק). הקטעים הוכתמו באמצעות DAPI. גרפי העמודות מציגים את כימות עוצמת האות ZO-1 ו- ZO-2. הנתונים מוצגים כממוצע ± SD (n = 3); * P < 0.05 בהשוואה לספונטניים. מאן-ויטני או קרוסקל-וואליס ניתוח חד-כיווני של מבחני שונות בוצעו כדי לבחון את המובהקות. איור 7H,I שונה מרוי ואחרים 13. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
דו"ח זה מספק פרוטוקול מפורט להקמת מודל חזירי של זיהום ביופילם פצע כרוני למחקרים ניסיוניים. מספר מודלים של ביופילם חזירים דווחו בעבר 22,23,24,25,26, אך אף אחד מהם אינו מודל חזירי הכולל מחקרים ארוכי טווח של 8 שבועות. פצעים כרוניים הם אלה שנשארים פתוחים במשך 4 שבועות או יותר 14,27,28. אין מודלים אחרים של ביופילם של פצעים כרוניים שדווחו בספרות. עבודה זו עוסקת ברעיון של סגירת פצע תפקודי 2,7,13,15,17,29. מחקר שנערך בשנת 2014 היה הראשון לדווח כי פצעים נגועים בביופילם עלולים להיסגר ללא שיקום תפקוד מחסום7. מדידת תפקוד מחסום העור בפצע הריפוי באמצעות איבוד מים טרנסאפידרמלי (TEWL) מדווחת בעבודה זו.
מבחינה אנטומית ופיזיולוגית, העור החזירי, בהשוואה לעורם של בעלי חיים קטנים אחרים, מתאים יותר לעור האדם32,33,34. גם לעור חזיר וגם לעור האדם יש אפידרמיס עבה 33, ויחס עובי העור-אפידרמיס נע בין 10:1 ל-13:1 בחזיר, הדומה לבני אדם34,35. מבחינה היסטולוגית וביומכנית, העור של בני אדם וחזירים מראה דמיון ברכסי רטה, שומן תת-עורי, קולגן עורי, פיזור שיער, מבנים אדנקסליים, גודל כלי הדם ופיזורם36,37,38. מבחינה פונקציונלית, הן חזירים והן בני אדם חולקים דמיון בהרכב מרכיבי השומנים, החלבון והקרטין של שכבת האפידרמיס, כמו גם דפוסים אימונוהיסטולוגיים דומים37,38. מערכת החיסון החזירית, בהשוואה לזו של בעלי חיים קטנים אחרים, חולקת קווי דמיון גבוהים יותר עם מערכת החיסון האנושית, כלומר חזירים הם מודל מתאים למחקרים על אינטראקציות הפונדקאי שהן חלק בלתי נפרד מהמורכבות של הביופילם הפתולוגי בזיהומים בפצעים39. ההערכה הביקורתית של היתרונות והחסרונות המוצעים על ידי מודלים שונים של בעלי חיים הובילה לקונצנזוס כי חזירים מייצגים מודל יעיל לחקר ריפוי פצעים34,38. בנוסף, חזירי בית מפתחים באופן ספונטני זיהומים חיידקיים כרוניים, כפי שנצפה בבני אדם10. מכשיר הכוויה המשמש ליצירת הפצעים הוא מכשיר כוויה מתקדם ואוטומטי המספק אנרגיית חום המבוססת על טמפרטורה הקוראת מאתר העור הממוקד22,40. גישה כזו משפרת את הקשיחות והשחזור של פציעת הכוויה. השימוש במבודדים קליניים אנושיים של חיידקים כדי להדביק את פצעי החזיר מוסיף ערך מוסף כמודל פרה-קליני.
פציעות כוויות הן מורכבות וגורמות למספר הפרעות מערכתיות20,41. לכן, חשוב להחיות את החזיר עם נוזלים נאותים ולמנוע היפותרמיה במהלך הרדמה והתאוששות. מספר גורמים יכולים להפריע לריפוי הפצע, כולל תזונה לאחר כוויה, נוזלים וכאב42. לכן יש חשיבות למעקב צמוד אחר הערכות התזונה והכאב. כאב לאחר כוויה יכול להיות חמור ולהשפיע על התנהגות בעל החיים ותזונתו. יש לשקול באופן פעיל התערבויות לטיפול בבעיות התנהגותיות. ניקוד וניהול כאב קבוע ומתמשך הוא הכרחי. גיליון הערכת כאב יסודי עם תוכנית מפורטת מאוד לניהול כאב כלול בפרוטוקול זה. כדי למנוע זיהום צולב בין הפצעים, תשומת לב מיוחדת צריכה להיעשות כדי להחיל את השכבה הראשונה של החבישה על כל פצע בנפרד. יש לנקוט טיפול קריטי בטיפול בכל החומרים המסוכנים ביולוגית ובעת ביצוע חיטוי יסודי של הציוד, הכלים וחדר הניתוח כולו. מריחת שכבות מרובות של החבישה מונעת מהחזיר לחשוף את הפצעים במהלך מאמציו לשפשף או לגרד את הגירוד בחזרה.
החזיר במודל הנוכחי לא נפגע מהפרעות מטבוליות בסיסיות (למשל, סוכרת), ולכן ההשפעה הנחקרת הייתה אך ורק ההשפעה של זיהום ביופילם חיידקי על ריפוי פצעים. עם זאת, המודל משאיל את עצמו להשראת סוכרת (באמצעות סטרפטוזוטוצין למשל) וניתן להשתמש בו כדי לחקור זיהום ביופילם ביחס להפרעה מטבולית בסיסית. המגבלה השנייה של המודל היא הגדרת זיהום מבוקרת באמצעות חיידק P. aeruginosa. צפוי כי מיקרו-פלורת העור הרגילה של החזיר עשויה גם לגדול בפצע ויכולה להשפיע על הריפוי. ניתוח נוסף באמצעות NGS או טכניקות מתקדמות אחרות כדי להגדיר את התוכן המיקרוביאלי של הפצע הוא הכרחי. המודל הנוכחי יכול להיות מיושם גם על זיהומים מעורבים עם מינים מיקרוביאליים שונים (למשל, פטרייתי, ויראלי וכו '). זהו מרכיב חשוב, שכן פצעים רלוונטיים מבחינה קלינית צפויים להיות מאוכלסים על ידי חיידקים מעורבים, אשר עשויים להשפיע על ריפוי פצעים באופן דיפרנציאלי.
ישנם יתרונות פוטנציאליים רבים במודל זה, כולל הדמיון למורכבות ולטווח ארוך של פצעים כרוניים אנושיים, תהליך הכוויה האוטומטי והניתן לשחזור, והשימוש בזני חיידקים מבודדים קלינית. השימוש במספר שיטות הדמיה לא פולשניות מייצג גישה רבת עוצמה לאיסוף נתונים פיזיולוגיים שימושיים המאפיינים את הפצע. לבסוף, הערכת ריפוי הפצע התפקודי באמצעות שיקום תפקוד מחסום העור המבוסס על TEWL היא קריטית. לסיכום, בעבודה זו מוצג פרוטוקול חזק, פשוט, מפורט וקל לשימוש לפיתוח פציעת כוויות חמורה נגועה בביופילם באמצעות מערכת מודל חזירי.
Disclosures
המחברים מצהירים כי אין אינטרסים מתחרים.
Acknowledgements
ברצוננו להודות למרכז משאבי חיות המעבדה (LARC), אוניברסיטת אינדיאנה, על תמיכתם והטיפול הווטרינרי בבעלי החיים במהלך המחקר. עבודה זו נתמכה חלקית על ידי מענקי המכונים הלאומיים לבריאות NR015676, NR013898 ו-DK125835 ומענק משרד ההגנה W81XWH-11-2-0142. בנוסף, עבודה זו נהנתה מהפרסים הבאים של המכונים הלאומיים לבריאות: GM077185, GM069589, DK076566, AI097511 ו-NS42617.
Materials
| Name | Company | Catalog Number | Comments |
| Sedation | |||
| Ketamine | Zoetis | 10004027 | 100mg/ml |
| Telazol | Zoetis | 106-111 | 100mg/ml |
| Xylazine | Pivetal | 04606-6750-02 | 100mg/ml Anased |
| 3ml syringe w/ 20g needle | Covidien-Monoject | 8881513033 | |
| Winged infusion set 21g | Jorgensen Labs | J0454B | |
| Anesthetic | |||
| Isoflurane | Pivetal | 21295097 | |
| Surgery | |||
| Hair clippers | Wahl | 8787-450A | |
| Nair | Church and Dwight Co. Inc | 70506572 | |
| Chlorhexidine Solution | First Priority Inc. | 179925722 | |
| 70% Isopropyl Alcohol | Uline | S-17474 | |
| 0.9% Saline Solution | ICU Medical | RL-7282 | |
| Non-woven gauze | Pivetal | 21295051 | |
| Paper tape | McKesson | 455531 | |
| 2" Elastic tape | Pivetal | 21300869 | |
| 18-22g Intravenous Angiocath | SurVet | (01)14806017512306 | |
| Spay hook | Jorgensen Labs | J0112A | |
| Sterile lube | McKesson | 16-8942 | |
| Laryngoscope | Jorgensen Labs | J0449S | |
| Roll gauze | Pivetal | 21295032 | |
| Endotracheal tube (7-9mm) | Covidien | 86112 | Shiley Hi-Lo Oral Nasal Tracheal Tube Cuffed |
| 15gtt/ml IV administration set | ICU Medical | 12672-28 | |
| LRS 1000ml bag | ICU Medical | 07953-09 | |
| Three Quarter Drape Sheet | McKesson | 16-i80-12110G | |
| Analgesia | |||
| Buprenorphine | RX Generics | 42023-0179-05 | 0.3mg/ml |
| Fentanyl Transdermal | |||
| Carprofen | 21294548 | Pivetal | 50mg/ml Levafen |
| Bandaging | |||
| Transparent film dressing 26x30 | Genadyne Biotechnologies | A4-S00F5 | |
| Film dressing 4 x 4-3/4 Frame Style | McKesson | 886408 | |
| Vetrap | 3M | 1410BK BULK | |
| Elastic tape 4" | Pivetal | 21300931 | |
| Kerlix Roll Gauze | Cardinal Health | 3324 | |
| Imaging | |||
| Canon EOS 80D | Canon | 1263C004 | |
| Speedlight 600EX II-RT | Canon | 1177C002 | |
| EFS 17-55mm Ultrasonic | Canon | 1242B002 | |
| GE Logiq E9 | GE | 5197104-2 | |
| ML6-15 Probe | GE | 5199103 | |
| PeriCamPSI | Perimed | 90-00070 | |
| DermaLab | Cortex Technologies Inc | 4608D78 | |
| Biopsy/Tissue Collection | |||
| 6mm punch biopsy | Integra Lifesciences | 33-36 | |
| bupivicaine 0.5% | Auromedics Pharma | 55150017030 | |
| Size 10 Disposable Scalpel | McKesson | 16-63810 | |
| Dissection scissors | Pivetal | 21294806 | |
| Rat tooth thumb tissue forceps | Aesculap | BD512R | |
| Non-adherent Dressing | Covidien | 2132 | Telfa |
| 50ml Conical tube | Falcon | 352070 | |
| Eppendorf/microcentrifuge tube | Fisherbrand | 02-681-320 | |
| OCT Cassette | |||
| Non Woven Gauze 4x4 | Pivetal | 21295051 | |
| Inoculum | |||
| Low salt LB agar | Invitrogen | 22700-025 | |
| Low salt LB broth | Fisher scientific | BP1427-500 | |
| Petri plate | Falcon | REF-351029 | |
| Polyprophyline round bottom tubes (14 ml) | Falcon | REF-352059 | |
| Pseudomonas Agar Base (Dehydrated) | Thermo Scientific | OXCM0559B | |
| LB Agar, powder (Lennox L agar) | Thermo Fisher Scientific (Life Technologies) | 22700025 | |
| Gibco™ DPBS, calcium, magnesium | Gibco | 14040133 | |
| Euthanasia | |||
| 18-22g Intravenous Angiocath | SurVet | (01)14806017512306 | |
| Fatal Plus | Vortech Pharmaceuticals | 9373 |
References
- Goodwine, J., et al. Pyruvate-depleting conditions induce biofilm dispersion and enhance the efficacy of antibiotics in killing biofilms in vitro and in vivo. Scientific Reports. 9 (1), 3763 (2019).
- Sen, C. K., Roy, S., Mathew-Steiner, S. S., Gordillo, G. M. Biofilm management in wound care. Plastic and Reconstructive Surgery. 148 (2), 275-288 (2021).
- Church, D., Elsayed, S., Reid, O., Winston, B., Lindsay, R. Burn wound infections. Clinical Microbiology Reviews. 19 (2), 403-434 (2006).
- Nguyen, T. T., Gilpin, D. A., Meyer, N. A., Herndon, D. N. Current treatment of severely burned patients. Annals of Surgery. 223 (1), 14-25 (1996).
- Eriksson, E., et al. Chronic wounds: Treatment consensus. Wound Repair and Regeneration. 30 (2), 156-171 (2022).
- Lebeaux, D., Chauhan, A., Rendueles, O., Beloin, C. From in vitro to in vivo models of bacterial biofilm-related infections. Pathogens. 2 (2), 288-356 (2013).
- Ganesh, K., et al. Chronic wound biofilm model. Advances in Wound Care. 4 (7), 382-388 (2015).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Stewart, P. S. Biophysics of biofilm infection. Pathogens and Disease. 70 (3), 212-218 (2014).
- Jensen, L. K., Johansen, A. S. B., Jensen, H. E. Porcine models of biofilm infections with focus on pathomorphology. Frontiers in Microbiology. 8, 1961 (2017).
- Mah, T. F., O'Toole, G. A. Mechanisms of biofilm resistance to antimicrobial agents. Trends in Microbiology. 9 (1), 34-39 (2001).
- Gonzalez, J. F., Hahn, M. M., Gunn, J. S. Chronic biofilm-based infections: Skewing of the immune response. Pathogens and Disease. 76 (3), 023 (2018).
- Roy, S., et al. Mixed-species biofilm compromises wound healing by disrupting epidermal barrier function. Journal of Pathology. 233 (4), 331-343 (2014).
- Sen, C. K. Human wound and its burden: Updated 2020. Compendium of Estimates. Advances in Wound Care. 10 (5), 281-292 (2021).
- Barki, K. G., et al. Electric field based dressing disrupts mixed-species bacterial biofilm infection and restores functional wound healing. Annals of Surgery. 269 (4), 756-766 (2019).
- Dusane, D. H., et al. Electroceutical treatment of Pseudomonas aeruginosa biofilms. Scientific Reports. 9 (1), 2008 (2019).
- Roy, S., et al. Staphylococcus aureus biofilm infection compromises wound healing by causing deficiencies in granulation tissue collagen. Annals of Surgery. 271 (6), 1174-1185 (2020).
- Ghanbari, A., et al. Inoculation density and nutrient level determine the formation of mushroom-shaped structures in Pseudomonas aeruginosa biofilms. Scientific Reports. 6, 32097 (2016).
- Yin, R., Cheng, J., Wang, J., Li, P., Lin, J. Treatment of Pseudomonas aeruginosa infectious biofilms: Challenges and strategies. Frontiers in Microbiology. 13, 955286 (2022).
- Norbury, W., Herndon, D. N., Tanksley, J., Jeschke, M. G., Finnerty, C. Infection in burns. Surgical Infections. 17 (2), 250-255 (2016).
- Nitz, F., et al. Molecular detection of drug-resistance genes of bla(OXA-23)-bla(OXA-51) and mcr-1 in clinical isolates of Pseudomonas aeruginosa. Microorganisms. 9 (4), 786 (2021).
- Davis, S. C., et al. Microscopic and physiologic evidence for biofilm-associated wound colonization in vivo. Wound Repair and Regeneration. 16 (1), 23-29 (2008).
- Breuing, K., Kaplan, S., Liu, P., Onderdonk, A. B., Eriksson, E. Wound fluid bacterial levels exceed tissue bacterial counts in controlled porcine partial-thickness burn infections. Plastic and Reconstructive Surgery. 111 (2), 781-788 (2003).
- Nusbaum, A. G., et al. Effective method to remove wound bacteria: Comparison of various debridement modalities in an in vivo porcine model. Journal of Surgical Research. 176 (2), 701-707 (2012).
- Hirsch, T., et al. Enhanced susceptibility to infections in a diabetic wound healing model. BMC Surgery. 8, 5 (2008).
- Roche, E. D., et al. Increasing the presence of biofilm and healing delay in a porcine model of MRSA-infected wounds. Wound Repair and Regeneration. 20 (4), 537-543 (2012).
- Hartoch, R. S., McManus, J. G., Knapp, S., Buettner, M. F. Emergency management of chronic wounds. Emergency Medical Clinics of North America. 25 (1), 203-221 (2007).
- Mustoe, T. Understanding chronic wounds: a unifying hypothesis on their pathogenesis and implications for therapy. American Journal of Surgery. 187 (5), 65-70 (2004).
- Bhattacharya, M., et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing. Proceedings of the National Academy of Sciences of the United States of America. 115 (28), 7416-7421 (2018).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Sinha, M., et al. Pseudomonas aeruginosa theft biofilm require host lipids of cutaneous wound. Annals of Surgery. 277 (3), e634-e647 (2023).
- Fan, G. Y., et al. Severe burn injury in a swine model for clinical dressing assessment. Journal of Visualized Experiments. (141), e57942 (2018).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration. 9 (2), 66-76 (2001).
- Meyer, W., Schwarz, R., Neurand, K. The skin of domestic mammals as a model for the human skin, with special reference to the domestic pig. Current Problems in Dermatology. 7, 39-52 (1978).
- Vardaxis, N. J., Brans, T. A., Boon, M. E., Kreis, R. W., Marres, L. M. Confocal laser scanning microscopy of porcine skin: implications for human wound healing studies. Journal of Anatomy. 190, 601-611 (1997).
- Heinrich, W., Lange, P. M., Stirtz, T., Iancu, C., Heidemann, E. Isolation and characterization of the large cyanogen bromide peptides from the alpha1- and alpha2-chains of pig skin collagen. FEBS Letters. 16 (1), 63-67 (1971).
- Marcarian, H. Q., Calhoun, M. L. Microscopic anatomy of the integument of adult swine. American Journal of Veterinary Research. 27 (118), 765-772 (1966).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration. 9 (2), 66-76 (2001).
- Dawson, H. D., et al. Structural and functional annotation of the porcine immunome. BMC Genomics. 14, 332 (2013).
- Kim, J. Y., Dunham, D. M., Supp, D. M., Sen, C. K., Powell, H. M. Novel burn device for rapid, reproducible burn wound generation. Burns. 42 (2), 384-391 (2016).
- Nielson, C. B., Duethman, N. C., Howard, J. M., Moncure, M., Wood, J. G. Burns: Pathophysiology of systemic complications and current management. Journal of Burn Care and Research. 38 (1), e469-e481 (2017).
- Rowan, M. P., et al. Burn wound healing and treatment: Review and advancements. Critical Care. 19 (1), 243 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved