Свиная модель биопленочной инфекции и невидимых ран
In This Article
Summary
Хронические раны, устойчивые к антибиотикам, представляют серьезную угрозу для системы здравоохранения. Инфекции биопленки являются упорными и враждебными и могут привести к недостаточному функциональному закрытию раны. Мы представляем клинически значимую модель хронических ран, инфицированных биопленкой, по всей толщине. Эта модель эффективна как для механистических исследований, так и для тестирования вмешательств.
Abstract
Инфицирование биопленкой является основным фактором, способствующим хронизации раны. Установление клинически значимой экспериментальной раневой биопленочной инфекции требует участия иммунной системы хозяина. Итеративные изменения в организме хозяина и возбудителя при образовании такой клинически значимой биопленки могут происходить только in vivo. Модель свиной раны получила признание за свои преимущества в качестве мощной доклинической модели. Существует несколько подходов к изучению раневых биопленок. Системы in vitro и ex vivo имеют дефицит с точки зрения иммунного ответа хозяина. Краткосрочные исследования in vivo включают острые реакции и, таким образом, не допускают созревания биопленки, как это обычно происходит клинически. Первое долгосрочное исследование биопленки ран свиней было проведено в 2014 году. В исследовании было признано, что раны, инфицированные биопленкой, могут закрываться, как определено с помощью планиметрии, но барьерная функция кожи пораженного участка может не восстановиться. Позже это наблюдение было подтверждено клинически. Так родилась концепция функционального закрытия раны. Закрытые раны, но с недостаточной барьерной функцией кожи, могут рассматриваться как невидимые раны. В данной работе мы стремимся сообщить методологические детали, необходимые для воспроизведения долгосрочной модели тяжелой ожоговой травмы, инфицированной биопленкой, на свиньях, которая является клинически значимой и имеет трансляционную ценность. Этот протокол содержит подробные рекомендации по установлению 8-недельной инфекции раневой биопленки с использованием P. aeruginosa (PA01). Восемь ожоговых ран полной толщины были созданы симметрично на тыльной стороне домашних белых свиней, которые были инокулированы (PA01) на 3-е сутки после ожога; Впоследствии была проведена неинвазивная оценка заживления раны в разные моменты времени с использованием лазерной спекл-визуализации (LSI), ультразвука высокого разрешения (HUSD) и трансэпидермальной потери воды (TEWL). Привитые ожоговые раны накладывали четырехслойную повязку. Биопленки, как было установлено и подтверждено структурно с помощью SEM на 7-й день после инокуляции, нарушали функциональное закрытие раны. Такой неблагоприятный исход может быть отменен в ответ на соответствующие вмешательства.
Introduction
Инфицирование биопленкой осложняет ожоговые и хронические раны и вызывает хронизацию 1,2,3,4,5. В микробиологии в первую очередь изучаются механизмы формирования биопленки, с акцентом на микробы 1,6. Уроки, извлеченные из этих исследований, имеют первостепенное значение с точки зрения биологической науки, но не обязательно могут быть применимы к клинически значимым патогенным биопленкам 6,7,8. Клинически значимые структурные агрегаты биопленки должны включать как микробные, так и принимающие факторы 8,9,10. Такое микроокружение позволяет включать итеративные взаимодействия между хозяином и микробом, которые имеют решающее значение для разработки клинически значимой биопленки 7,8. В таком процессе участие иммунных клеток и факторов, передающихся через кровь, имеет решающее значение11,12. Взаимодействие между хозяином и микробом, лежащее в основе клинических патогенных биопленок, наблюдаемое при хронических ранах, происходит в течение длительного периода времени. Таким образом, любой экспериментальный подход, направленный на разработку трансляционно релевантной модели биопленочной инфекции, должен учитывать эти факторы. Таким образом, мы стремились разработать клинически воспроизводимую модель хронической биопленочной инфекции свиней.
В то время как исследования на людях, несомненно, представляют собой лучший подход к изучению результатов исцеления, часто они не лучшим образом подходят для рассмотрения лежащих в их основе механизмов и новых механистических парадигм. Этические соображения ограничивают использование дизайна исследований, требующих забора нескольких биопсий из хронической раны в разные моменты времени. Поэтому крайне важно иметь хорошо зарекомендовавшую себя и воспроизводимую животную модель, позволяющую проводить инвазивные исследования для тщательного изучения судьбы биопленки 7,13. Выбор модели животного зависит от нескольких факторов, включая научную/трансляционную значимость и логистику. Система свиней широко признана наиболее ценной с точки зрения трансляций экспериментальной моделью для изучения ран кожи человека7. Таким образом, в данной работе сообщается об установленной модели ожоговой травмы, зараженной биопленкой, на свиньях. Данная работа основана на нескольких оригинальных публикациях, опубликованных в литературе 2,7,13,14,15,16,17. В этом исследовании для инфицирования раны был выбран клинический изолят синегнойной палочки с множественной лекарственной устойчивостью (PA01). P. aeruginosa является частой причиной раневых инфекций 2,18,19,20. Это грамотрицательная бактерия, которую трудно лечить из-за ее устойчивости к некоторым антибиотикам11,19,21. Ни одна из моделей биопленки свиней, о которых сообщалось до сих пор, не включала 8-недельные долгосрочные исследования 22,23,24,25,26. Хронические раны – это те, которые остаются открытыми в течение 4 недель и более 14,27,28. В литературе отсутствуют другие модели биопленок хронических ран. В данной работе рассматривается понятие функционального закрытия раны 2,7,13,15,17,29.
Protocol
Все исследования на животных были проведены в соответствии с протоколами, утвержденными Комитетом по уходу и использованию животных (IACUC) #21147. Исследование проводилось в Ресурсном центре лабораторных животных (LARC) Университета Индианы. В этом протоколе мы использовали самку домашней белой свиньи (70-80 фунтов).
1. Акклиматизация животных
- По прибытии свиней на объект разместите животных индивидуально в одном помещении не менее 3 дней для акклиматизации и социального взаимодействия.
- Кормите свиней хорошо сбалансированным рационом. Определитесь с количеством корма, исходя из веса, и следуйте рекомендациям производителя.
- Убедитесь, что животное голодает в течение 6-12 часов перед процедурой, чтобы предотвратить тошноту, рвоту и аспирацию желудочных соков во время анестезии.
2. Обустройство операционного зала
- Подготовьте наркозный аппарат и убедитесь, что он готов с контуром редыхания.
- Обустройте кабинет для операции, как описано ниже (рисунок 1А).
- Накройте процедурный стол стерильной простыней и положите под него одеяло с циркуляцией воды, чтобы способствовать терморегуляции.
- Поставьте стол с принадлежностями для индукции и материалами для подготовки к операции. Установите стол с горелочными устройствами и блоками управления. Настройте оборудование для визуализации и убедитесь, что оно включено.
3. Седация свиньи
- Усыпляют свинью внутримышечной инъекцией ТКХ (телазол 4,4 мг/кг; кетамин 2,2 мг/кг; ксилазин 2,2 мг/кг) в дозе 1 мл/50 фунтов. Держите свинью в процедурном кабинете на 1%-3% изофлуране, вводимом через маску.
- Вводить свиньям (предоперационные) анальгетики в соответствии с протоколом IACUC; некоторые примеры: бупренорфин 0,3 мг/мл, 0,01-0,05 мг/кг в/м; карпрофен 50 мг/мл, 4 мг/кг в/м или SQ; фентанил трансдермальный 100 мкг/ч, наносимый на ушную раковину; габапентин 300 мг капсулы, 3-10 мг/кг перорально.
ПРИМЕЧАНИЕ: Для всех ожоговых процедур и биопсии 1 доза габапентина будет введена за день до операции, а 1 доза карпрофена будет введена в день процедуры. Для основной процедуры прижигания будет наложен фентаниловый пластырь, а во время подготовки к операции будет введена 1 полная доза бупренорфина.
4. Индукция анестезии
- Стерилизовать ухо чередованием 2% скраба с хлоргексидином и спиртом не менее трех раз. Введите A 22-18 G 1 во внутривенный катетер в краевую ушную вену и подтвердите кровоток. Промойте катетер физиологическим раствором и зафиксируйте катетер хирургической лентой (Рисунок 1B).
- Интубируйте свинью эндотрахеальной трубкой соответствующего размера (7-9 мм) после того, как будет достигнуто расслабление мышц путем вдыхания анестезии через маску. Проверьте расслабление мышц по потере тонуса челюсти и наблюдению пальпебрального рефлекса.
- Откройте трубку и проверьте герметичность манжеты с помощью шприца с воздухом. Введите трубку с помощью ларингоскопа30.
- Надуйте манжету и закрепите трубку, как только будет подтверждено правильное размещение. Подключите скребка к контуру редыхания.
ПРИМЕЧАНИЕ: Трубка привязывается к рылу, а для ее закрепления используется рулонная марля. Аускультация грудной клетки проводится стетоскопом для подтверждения правильности установки трубки.
ПРИМЕЧАНИЕ: Во время анестезии воздух подается каждые 5-10 минут, закрывая выдвижной клапан и нажимая на дыхательный мешок до тех пор, пока манометр давления не достигнет 20 мм/рт. ст., чтобы предотвратить позиционный ателектаз.
- Следите за животным и глубиной анестезии.
- Подключите скребок к многопараметрическому монитору. Монитор будет непрерывно считывать сатурацию кислорода (SpO2), частоту пульса, конечную дыбовую кислоту (EtCO2), частоту дыхания и температуру. Записывайте жизненно важные показатели каждые 10 минут на протяжении всей процедуры.
- Оцените глубину анестезии, проверив болевые рефлексы с помощью зажима пальца задней ноги перед началом ранения.
ПРИМЕЧАНИЕ: При необходимости отрегулируйте испаритель анестетика для введения дополнительной анестезии или подождите несколько минут. Регулярно проверяйте болевые рефлексы и пальпебральные рефлексы на протяжении всей операции.
5. Подготовка животных к ожоговым ранениям
- Отсоедините поросенка от наркозного аппарата и переместите его на процедурный стол. Поместите свинью в положение лежа на грудине и убедитесь, что все соединенные линии и трубки закреплены (рис. 1C).
- Снова подключите свинью к наркозному аппарату и поддерживайте уровеньO2 на уровне 0,8-1,5 л/мин и изофлурана на уровне 1%-3% до конца процедуры.
- Вводите свиньям внутривенные жидкости (LRS) со скоростью капельницы 8-10 мл/кг/ч. Контролируйте анестезию, как описано в шаге 4.3.
6. Антисептическая подготовка и разметка места ожога кожи
- Подготовьте область раны, побрившись и нанеся крем для удаления волос, как описано ниже (рисунок 2).
- Побрейте спинку свиньи на участке шириной примерно 25 см от позвоночного столба до подмышечных впадин с обеих сторон с помощью электрических машинок для стрижки.
- Нанесите крем для удаления волос на подстриженную область и оставьте на 3-7 минут. Снимите крем вместе с волосами, используя чистые впитывающие полотенца.
- Подготовка места ожога
- Протрите ранимую область чередованием 2% хлоргексидина и 70% изопропилового спирта не менее трех раз в течение примерно 5 минут. Убедитесь, что скраб наносится в виде яблочка (начиная с центра и двигаясь наружу по спирали) персоналом в стерильных перчатках.
- Отметьте места ран с помощью стерильного шаблона ожога и хирургического маркера кожи (рис. 2B). Отметьте от шести до восьми ран (2 дюйма х 2 дюйма) симметрично на спинке.
- Накройте участки вокруг отмеченных участков стерильной простыней, чтобы уменьшить загрязнение (Рисунок 2C).
7. Процедура нанесения ожоговых ран
- Используйте устройство для сжигания, например, изготовленную на заказ горелку собственного производства, состоящую из блока из нержавеющей стали размером 2 x 2 дюйма (вес: 352 г), соединенного с металлическим стилусом, электронным микростатом и электронными весами (общий вес: 1 714 г; Рисунок 3).
- Установите конфорку на желаемую температуру. Отрегулируйте целевую температуру для ран полной толщины на уровне 150 °C (Рисунок 3A). Для этого отрегулируйте заданное значение (SP) на блоке управления до 150 °C. Установите нижнюю заставку на 145 °C, а максимальную заставку на 155 °C (рис. 1D).
- Создайте ожоговую рану на всю толщину размером 2 x 2 дюйма, используя нагретые блоки из нержавеющей стали, подключенные к ожоговому устройству, и поместив их на кожу на 60 секунд (рис. 3B, C). Во время нанесения ожога используйте электронные весы, чтобы обеспечить равномерное давление горелки.
8. Оценка и визуализация ожоговых ран
- Цифровая фотография
- Визуализируйте раны с помощью цифровой зеркальной камеры и короткофокусного короткофокусного широкоугольного объектива (EFS) 17-55 мм и фонарика.
- Сделайте цифровую фотографию всей свиньи, включая табличку с идентификацией свиньи, временем и датой. Затем сделайте снимки для каждой раны отдельно, поставив табличку с идентификатором свиньи, идентификатором раны и временной точкой, а также линейку.
- Рассчитайте площадь раны в процентах от первоначального размера раны в каждый момент времени забора до 56-го дня.
ПРИМЕЧАНИЕ: В этой работе площадь раны была рассчитана в каждый момент времени (d0, d7, d14, d28 и d56) в процентах от исходной площади раны на d0.
- Лазерная спекл-визуализация (LSI)
- Для лазерной спекл-визуализации используйте сканер крови на основе технологии лазерного спекл-контрастного анализа (LASCA) для оценки микрососудистой перфузии раны в режиме реального времени.
- Сделайте снимки всех ран в одной записи. Отрегулируйте измеренное значение рабочего расстояния от лазерной камеры до раны таким образом, чтобы оно соответствовало визуализации каждой раны (Рисунок 4A).
- Запишите перфузию серией изображений, сделанных в течение 10-15 секунд. После получения изображения ранения запись автоматически приостанавливается и возобновляется, как только камера настраивается для последующего ранения. Каждый раз, когда запись приостанавливается, добавляется маркер для идентификации раны.
- Трансэпидермальная потеря воды (TEWL)
- Измерьте TEWL для каждой раны с помощью стандартного устройства, датчика TEWL и программного обеспечения (Рисунок 4B). Для каждой раны наденьте чистую крышку зонда на наконечник зонда, который будет соприкасаться с раневой тканью.
- Аккуратно и равномерно поместите зонд на кожу и начните считывание, нажав кнопку «Пуск » на устройстве.
- Измерьте каждую рану пять раз, сначала по центру, а затем по каждому углу. Затем экспортируйте все показания в электронную таблицу (рис. 4B).
- Гармонический ультразвук (HUSD)
- Выполните HUSD-картирование, просканировав рану ультразвуковым датчиком (УЗИ) от средней линии (позвоночного столба), начиная от нормальной кожи к боковой стороне свиньи, где снова есть нормальная кожа. Следуйте этой схеме сканирования для каждой раны как в режиме В, так и в режиме эластографии тканей с помощью ультразвукового аппарата (рис. 4C).
- Для сканирования в B-режиме нанесите стерильный ультразвуковой гель на область раны и нанесите немного на зонд высокого разрешения ML-615. Снабдите каждую запись идентификационной этикеткой раны. Начните запись и медленно перемещайте зонд от средней линии вниз по ране, пока не дойдете до нормальной кожи с другой стороны.
ПРИМЕЧАНИЕ: После завершения сканирования запись сохраняется и экспортируется с аппарата для анализа. - Для эластографии переключите ультразвуковой аппарат в режим elasto, нажав кнопку Elasto . Просканируйте рану еще раз так же, как и при сканировании в режиме B, убедившись, что поддерживается равномерное давление зонда, чтобы цветной индикатор эластографии (зеленые полосы) оставался видимым на протяжении всей записи.
ПРИМЕЧАНИЕ: Соответствующее давление можно определить с помощью шкалы на записи, которая отображается зеленым цветом при правильном контакте (Рисунок 4D). - Изменяйте аннотацию после того, как каждая рана будет изображена как в режиме B, так и в режиме elasto (две записи на рану). Измените комментарий в программном обеспечении, включив в него информацию о следующей ране, и повторите процесс для последующих ран.
- Для сканирования в B-режиме нанесите стерильный ультразвуковой гель на область раны и нанесите немного на зонд высокого разрешения ML-615. Снабдите каждую запись идентификационной этикеткой раны. Начните запись и медленно перемещайте зонд от средней линии вниз по ране, пока не дойдете до нормальной кожи с другой стороны.
- Выполните HUSD-картирование, просканировав рану ультразвуковым датчиком (УЗИ) от средней линии (позвоночного столба), начиная от нормальной кожи к боковой стороне свиньи, где снова есть нормальная кожа. Следуйте этой схеме сканирования для каждой раны как в режиме В, так и в режиме эластографии тканей с помощью ультразвукового аппарата (рис. 4C).
9. Бинтование и перевязка
- Наложите на ожоговые раны по отдельности прозрачные пленочные повязки или пробную повязку (рис. 5А, Б). Наложите большую прозрачную пленочную повязку на всю область раны (Рисунок 5C).
- Наложите второй слой рулонной марли вокруг всего туловища свиньи, чтобы впитать жидкий экссудат, который выходит из ран. Переверните свинью взад и вперед с бока, чтобы слегка перевернуться на спину, чтобы обернуть перевязочный материал вокруг свиньи.
- Неплотно накройте марлю слоем гибкого эластичного бинта (рисунок 5D). Следите за тем, чтобы повязка не была слишком тугой, так как ее слишком тугое наложение может ограничить дыхание и оказать давление на живот, что может привести к выпадению прямой кишки или различным осложнениям.
ПРИМЕЧАНИЕ: Эластичный бинт эластичный и может быть легко перетянут во время наложения. Сняв его с рулона и позволив ему лечь за край предыдущего обмотки, можно предотвратить чрезмерную затяжку. - Покройте эластичный бинт завершающим слоем из 4 эластичных лент (рисунок 4Е). Опять же, убедитесь, что повязка не слишком тугая, но убедитесь, что повязка закреплена за верхний и нижний края, чтобы она не соскальзывала вниз при движении свиньи после процедуры.
10. Восстановление животных и послеоперационный уход
- Выздоровление
- Прекратите прием анестезирующего газа после завершения процедуры раны, визуализации и перевязки. Дайте свинье оставаться на кислороде не менее 5 минут.
- После возвращения в основной вольер переместите свинью со стола для транспортировки/подъема на коврик для регенерации пены в клетке. Поднимите автоматическую поилку и снимите кормушку, чтобы предотвратить травмирование свиньи во время восстановления.
- Накройте свинью одеялами (в том числе одеялом с теплым воздухом), если присутствует переохлаждение. Контролируйте и записывайте жизненно важные показатели, включая температуру, пульс, частоту дыхания и SpO2 каждые 10-15 минут.
- Постоянно наблюдайте за свиньей до тех пор, пока она не сможет самостоятельно поддерживать положение грудины. Как только свинья полностью выздоровеет, опустите ниппельную поилку, и тогда свинью также можно кормить.
- Оценка боли
- Проведите оценку послеоперационной боли с помощью модифицированной формы оценки боли по шкале Глазго. Убедитесь, что оценка боли выполняется сотрудниками лаборатории или LARC не реже чем каждые 12 часов в течение первых 3-4 дней после операции. Частоту оценки боли определяет лечащий ветеринарный врач. Если животное набрало более 5 баллов, введите экстренную анальгезию (бупренорфин или гидроморфон).
- Обеспечьте анальгезию, введя дозу бупренорфина 0,01-0,05 мг/кг в/м до процедуры, а вторую дозу вводят через 8-12 ч.
- Наложите фентаниловый пластырь (100 мкг/ч) на ушную раковину уха до ожоговой раны.
- Вводят карпрофен в дозе 4 мг/кг в/м или SQ перед процедурой, а затем один раз в день внутримышечно, SQ или перорально в течение 2 дней или в соответствии с указаниями ветеринара LARC.
- Назначают габапентин перорально в дозе 3-10 мг/кг за день до процедуры, утром в день процедуры, вечером после процедуры, а затем каждые 12 ч в течение 3-5 дней.
- Диета
- Убедитесь, что свиньи выздоровели, а затем обеспечьте свободный доступ к воде и еде в соответствии с их рационом в зависимости от веса два раза в день.
- Обеспечьте обогащение пищи (свежие фрукты и овощи, замороженные фрукты, зефир, йогурт, пудинг и т. д.) и используйте их, чтобы побудить вас съесть, если наблюдается снижение аппетита.
- Смена повязки
- Меняйте повязки не реже одного раза в неделю или чаще, если повязки загрязняются или в соответствии со стратегией лечения.
- Меняйте повязки после визуализации, все еще находясь под наркозом, или давайте свинье только TKX для смены повязки.
- Чтобы заменить повязку, начните с осторожного удаления загрязненной повязки с помощью ножниц для бинтов Lister или травматических ножниц, следя за тем, чтобы внешняя сторона повязки не соприкасалась с ранами.
- При необходимости очистите область вокруг раны, используя 0,9% NaCl на чистой марле, и осторожно высушите эту область. Выполните процедуру перевязки, описанную в разделе 9.
ПРИМЕЧАНИЕ: Если накладываются экспериментальные повязки, их можно наложить до того, как раны будут покрыты прозрачной пленочной повязкой.
- Частота визуализации
- Получение изображений (цифровые фотографии, LSI, TEWL и HUSD) в различные моменты времени на протяжении всего исследования. Соберите данные визуализации на 3-й день (ожоговая рана), 0-й день (инокуляция) и 7-й, 14-й, 28-й, 35-й и 56-й день после инокуляции.
11. Подготовка и посев биопленки
- Подготовка посевного материала
- Приготовьте стартовую тарелку из глицеринового запаса Pseudomonas aeruginosa (PA01) для чистой культуры бактерии. Выращивают культуру P. aeruginosa в агаре Лурия-Бертани с низким содержанием соли (LBA) и инкубируют при температуре 37 °C в течение ночи.
- На следующий день инокулируют 5 мл бульона Лурия-Бертани с низким содержанием соли (LBB) одной колонией P. aeruginosa и инкубируют в течение ночи при 37 °C при встряхивании при 200 об/мин.
- Для получения логарифмических фазовых клеток посев 200 мкл ночной культуры в 5 мл LBB и инкубируют в шейкере при 200 об/мин при 37 °C в течение 2,5 ч.
- Измерьте оптическую плотность на длине волны 600 нм (OD600) с помощью спектрофотометра. Готовят серийные разведения до 1 х 10−9 с использованием 100 мкл из культуры в 900 мкл стерильной ЛББ.
ПРИМЕЧАНИЕ: Мы начали с неразбавленных образцов и закончили 1 x 10 7 КОЕ/мл.Мы получили счетные колонии в разведении 1 x 107, поэтому мы рассматривали это разведение как конечное разведение. - Распределите по 100 мкл каждого раствора на LBA и инкубируйте в течение ночи при 37 °C. В соответствии со стандартными микробиологическими протоколами для подсчета колоний используют разведения, показывающие счетные колонии (30-300), и получают колониеобразующие единицы (КОЕ).
- Прививка раны
- Высейте 200 мкл из ночной культуры в 5 мл бульона LB и инкубируйте в шейкере при 37 °C в течение 2,5 ч.
- Измерьте оптическую плотность дневной культуры на длине волны 600 нм (OD600). Для инокуляции PA01 используйте 3 x 10 8 КОЕ/мл (250 мкл из 1 x 108 КОЕ/мл PA01 высевается на рану). Транспортируйте посевной материал в животноводческий комплекс в контейнере для биологически опасных веществ.
- Распределите посевной материал по поверхности открытых ран на 3-й день после ожога с помощью пипетки и равномерно распределите с помощью одноразового распределителя (Рисунок 6). Перед наложением повязки держите раны открытыми примерно 15 минут.
ПРИМЕЧАНИЕ: Все хирургические процедуры, инокуляция, биопсия тканей, визуализация и перевязка выполняются под общим наркозом, как описано в разделах 3 и 4.
- Подтверждение установления инфекции
ПРИМЕЧАНИЕ: Чтобы подтвердить, что раны успешно инфицировались после инокуляции, используется несколько подходов, и образцы раны сравниваются с образцами, взятыми с нормальной кожи; Ниже приведено несколько примеров.- Для патологоанатомического анализа образцов, собранных в разные моменты времени, используйте количество колониеобразующих единиц для оценки инфекции (КОЕ; Рисунок 7E, F).
- Забор 6 мм тканей раны методом пункционной биопсии. Наклейте этикетки и взвесьте пустые пробирки объемом 5 мл с круглым дном. Переложите образцы в пробирки и взвесьте пробирки с образцами.
- Нарежьте ткань кубиками скальпелем на стерильной поверхности. Выполните все действия в вытяжке BSL2.
ПРИМЕЧАНИЕ: Чтобы ткани легко гомогенизировались, размер должен быть очень маленьким (но не менее 0,5 мм) - Поместите образец в пробирку и добавьте 1 мл PBS. Смешайте и измельчите ткань с помощью зонда для шлифовки твердых тканей.
- Последовательно разбавляют (в неразбавленном виде до 1 х 10−5) гомогенат и выделывают по 50 мкл каждого разведения в селективных (синегнойный изоляционный агар, PIA) и неселективных (LBA) средах.
- Инкубируют все разведения в аэробных условиях при 37 °C в течение 18-24 ч. Изобразите пластины с правильным освещением.
- Выберите планшеты с 30-300 колониями, если ни одна из них не достигла этой концентрации, используйте неразбавленную чашку. Используйте ImageJ для подсчета количества колоний и рассчитайте количество КОЕ на пластину, умножив среднее значение на конечный коэффициент разбавления.
- Получите изображения образцов, собранных на 7-й день после инокуляции и в другие моменты времени с помощью сканирующей электронной микроскопии (СЭМ), чтобы подтвердить наличие бактериальных биопленок (рис. 7G).
ПРИМЕЧАНИЕ: Пост-инокуляция на 7-й день была выбрана потому, что это день установления инфекции биопленки и начала размягчения ожогового струпа, что позволяет проникать ультразвуковым волнам и, таким образом, визуализировать более глубокие ткани. На рисунке 4 посмотрите на изображение ожоговой раны на 3-й день, на котором виден толстый кожистый струп, препятствующий прохождению ультразвуковых волн к более глубоким тканям. - Окрасьте срезы раневой биопсии специфическими антителами против P. aeruginosa , чтобы подтвердить присутствие специфических бактерий, как показано в предыдущей публикации13 (рисунок 7H).
- Выполните секвенирование нового поколения (NGS), как описано в Sinha et al.31. Количественное определение бактерий 16srRNA из инфицированных ран и нормальных неинфицированных образцов кожи, собранных в разные моменты времени, начиная с 7-го дня после инокуляции и до конца исследования.
- Для патологоанатомического анализа образцов, собранных в разные моменты времени, используйте количество колониеобразующих единиц для оценки инфекции (КОЕ; Рисунок 7E, F).
12. Забор биопсии
- Соберите биопсию тканей для анализа после визуализации на 7-й, 14-й, 28-й и 56-й день после инокуляции. Берите биопсию из каждой раны только один раз, чтобы свести к минимуму вмешательство в процесс заживления.
ПРИМЕЧАНИЕ: Все хирургические процедуры, инокуляция, биопсия тканей, визуализация и перевязка выполняются под общим наркозом, как описано в разделах 3 и 4.- Инфильтрируйте область вокруг раны 0,5% бупивакаином. Отрежьте полоску шириной 3-4 мм от одного края раны до другого, сохраняя небольшие края нормальной кожи с обеих сторон, используя одноразовый скальпель с лезвием 10-го размера. Поместите полоску в коническую трубку с этикеткой, заполненную 4% буферным формалином для фиксации.
ПРИМЕЧАНИЕ: Для ранних процедур визуализации и биопсии во время подготовки к операции будет введена полная доза бупренорфина. При проведении биопсии на поздних сроках во время подготовки к операции будет введена половинная доза бупренорфина. После всех процедур ожога и биопсии габапентин будет назначаться BID на срок до 7 дней в соответствии с рекомендациями лечащего ветеринара. Карпрофен будет назначаться в течение нескольких дней после операции или по рекомендации лечащего ветеринара. - Вырезать пуансонную биопсию диаметром 6 мм из раны (либо из раневого ложа, либо из края раны). Собирают с края раны, включая часть нормальной кожи и раневого ложа, для разных видов анализа.
- Извлеките образец с помощью стерилизованных щипцов и ножниц для препарирования. Поместите образец биопсии в соответствующую пробирку или кассету для обработки и анализа.
- Для КОЕ, СЭМ, РНК и FPPE образцы следует хранить в пробирках с соответствующим буфером. Например, образцы могут быть помещены в ОКТ в кассетах для лазерной микроскопии (LCM) и иммуногистохимии (IHC).
- Достижения гемостаза после сбора образцов достигаются путем осторожного надавливания на рану стерильной марлей. Накройте рану неслипшейся повязкой и забинтуйте, как в разделе 9.
- Инфильтрируйте область вокруг раны 0,5% бупивакаином. Отрежьте полоску шириной 3-4 мм от одного края раны до другого, сохраняя небольшие края нормальной кожи с обеих сторон, используя одноразовый скальпель с лезвием 10-го размера. Поместите полоску в коническую трубку с этикеткой, заполненную 4% буферным формалином для фиксации.
13. Эвтаназия и забор тканей
- Успокойте свинью в день эвтаназии с помощью TKX и обезболивайте изофлураном. Установите внутривенный катетер в краевую ушную вену, выполнив действия, описанные в разделе 3. Интубируйте свинью, выполнив действия, описанные в разделе 4.
- Снимите повязку после того, как свинья будет обезболина, и очистите область вокруг ран.
- Полная цифровая фотография, LSI, TEWL и HUSD. Соберите образцы из ран и нормальной кожи, выполнив действия, описанные в разделе 12.
- После того, как все необходимые образцы будут собраны, гуманно усыпите свинью, пока она еще находится под наркозом, путем внутривенной инъекции коммерчески доступного раствора для эвтаназии (пентобарбитал натрия). Используйте стетоскоп для аускультации, чтобы подтвердить прекращение сердцебиения и спонтанного дыхания.
- Выполните вторичный метод эвтаназии, как того требует SOM IACUC, используя скальпель для индуцирования пневмоторакса. Переложите тушу свиньи в бочку и отвезите в морозильную камеру, чтобы забрать для сжигания.
Representative Results
Стандартизированное ожоговое устройство использовалось для создания ожоговых ран на всю толщину при 150 °C в течение 1 мин, что приводило к однородному глубокому ожогу с равномерным краем эритемы и воспаления (рис. 3 и рис. 7). Каждая свинья получила по восемь ожоговых ран на спине, как показано на рисунке 3C.
Неинвазивная оценка ожоговых ран в режиме реального времени с помощью ультразвука высокого разрешения в В-режиме для подтверждения глубины раны и прогрессирования заживления раны с течением времени показала разрушение всех слоев кожи вплоть до подкожно-жировой клетчатки (рис. 4). Лазерная спекл-визуализация (ЛСС) использовалась для дальнейшей характеристики перфузии раны (рис. 4А).
К 7-му дню после инокуляции ожоговые раны показали толстую гнойную оболочку на поверхности раны, что подтвердило инфекцию и образование биопленки ожоговой раны (рис. 7А). Цифровая планиметрия показала увеличение площади раны на 3-е сутки после инокуляции PAO1 из-за воспалительной реакции в месте раны и по краям (рис. 7A,B). Несмотря на то, что площадь раны начала уменьшаться к 14-му дню после инокуляции, на 56-й день наблюдалось неполное заживление примерно до 25% от первоначального размера раны, что указывает на хронический характер ран (рис. 7B). Хронизация раны и нарушение заживления ран были дополнительно подтверждены TEWL, которая показала высокую трансэпидермальную потерю воды. Результаты TEWL отражали потерю барьерной функции кожи по сравнению с нормальной кожей во все измеренные временные точки, что указывает на функциональное нарушение заживления ожоговой раны (рис. 7B). Это также было подтверждено подавлением плотных соединительных белков ZO-1 и 213 и нарушением восстановления барьерной функции кожи, что отразилось в высоких значениях TEWL, наблюдаемых на 35-й день (середина) и 56-й день (поздний), несмотря на визуальное закрытие раны (рис. 7I).
Глубина ожога была дополнительно подтверждена окрашиванием H&E, которое показало деформацию и некроз всех гистологических слоев кожи, как показано на рисунке 7C. Установленная биопленка PA01 была дополнительно валидирована на 7-й день после инокуляции с помощью КОЕ (рис. 7E,F), СЭМ-визуализации (рис. 7G) и иммунофлуоресцентного окрашивания (рис. 7H).

Рисунок 1: Подготовка к процедуре . (A) Подготовка операционного стола. (B) Канюляция ушной вены для внутривенного введения жидкостей и лекарственных препаратов. (C) Термоодеяло для защиты свиньи от переохлаждения во время процедуры. (D) Настройка горелки и таймера. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
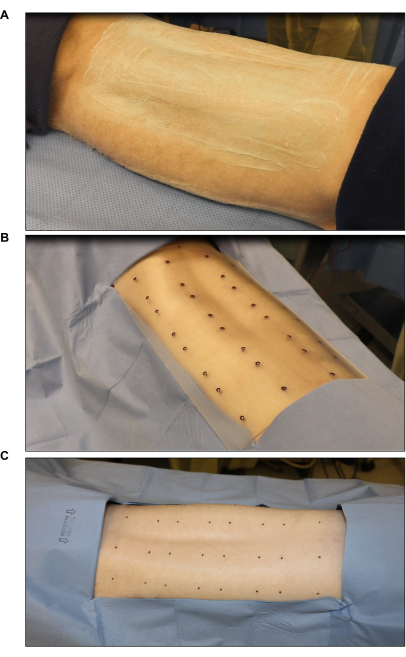
Рисунок 2: Стерилизация и маркировка операционного поля . (А) Стрижка и стерилизация волос. (B) Маркировка места ожога с использованием стерильного стандартного шаблона с восемью ранами (каждая рана имеет размер 2 x 2 дюйма). (C) Окончательная маркировка стерильным маркером для кожи. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
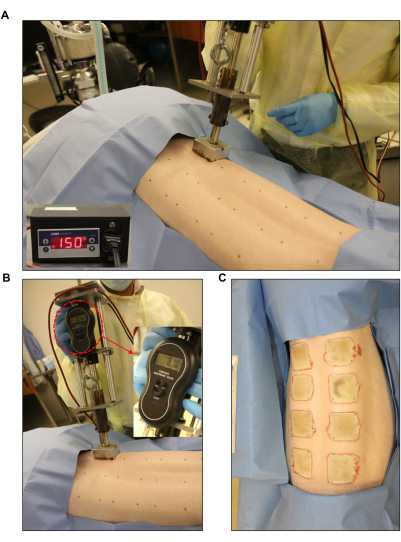
Рисунок 3: Индукция ожоговой раны. (A,B) Стандартизированная горелка с манометром и автоматическим блоком управления (2 дюйма x 2 дюйма), применяемая к предварительно размеченному месту раны. (C) На всей спине видны восемь ожоговых ран во всю толщину. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
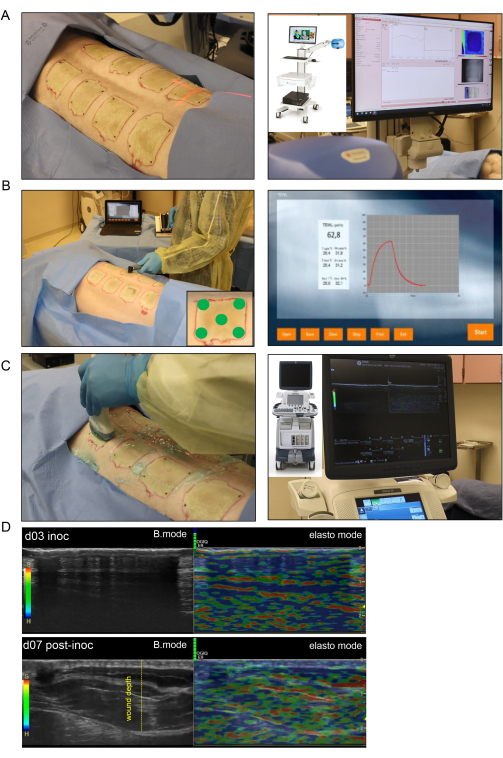
Рисунок 4: Неинвазивная визуализация и оценка ожоговых ран. (A) Лазерная спекл-визуализация (LSI) с правильной ориентацией индикатора лазерного луча к центру раны показана на изображении слева; на рисунке справа показан аппарат LSI и карта перфузии кожных сосудов в режиме реального времени. (B) Применение трансэпидермального датчика водопотери (TEWL) к месту раны в пяти различных точках (четыре угла раны и центр, показанный на изображении в правом нижнем углу) показано на изображении слева; Изображение справа представляет собой репрезентативный экран, снятый в режиме реального времени с измерением TEWL. (C) Гармоническое ультразвуковое сканирование ожоговой раны с помощью ультразвукового датчика высокого разрешения 16 МГц показано с левой стороны; На изображении справа показан ультразвуковой аппарат и запись экрана в режиме реального времени. (D) Структурные (B-режимные изображения, УЗИ в оттенках серого) и биомеханические (эластография, цветное ультразвуковое исследование) изображения места ожоговой раны в день прививки и на 7-й день после инокуляции. Глубина раны обозначается желтой пунктирной линией. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
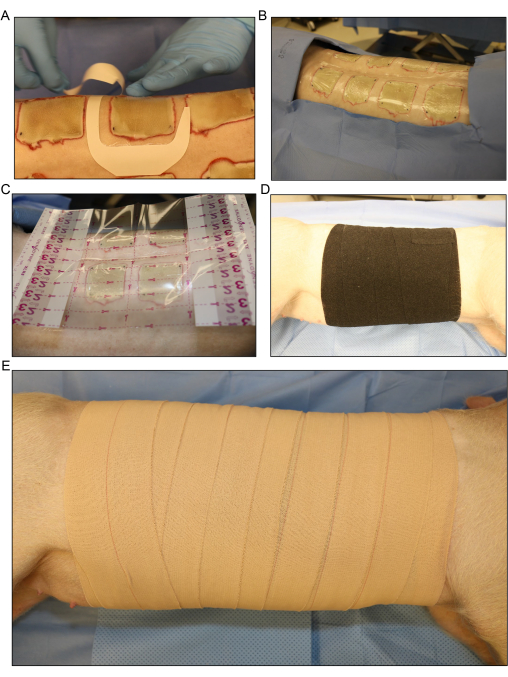
Рисунок 5: Перевязка и перевязка раны . (А) Наложение прозрачной пленочной повязки на каждую рану отдельно. (Б) Все дорсальные привитые ожоговые раны покрываются первым слоем повязки. (C) На всю область раны накладывается повязка из прозрачной пленки большего размера. (D) Наложение второго слоя марли и рыхлого слоя эластичного эластичного бинта вокруг всего туловища свиньи, чтобы впитать любой жидкий экссудат, который выходит из ран. (E) Покрытие всей области раны последним слоем из 4 пластырей в лейкопластыре. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
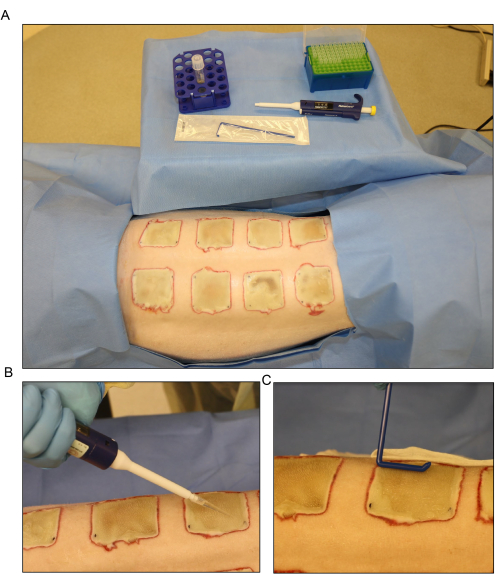
Рисунок 6: Бактериальный посев. (A) Подготовка к инокуляции синегнойной палочки (PA01) на 3-й день после ожога. (B) Местное применение посева с помощью пипетки с использованием объема 500 мкл для каждой раны. (C) Посевной материал равномерно распределяется по раневой поверхности с помощью стерильного одноразового разбрасывателя. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
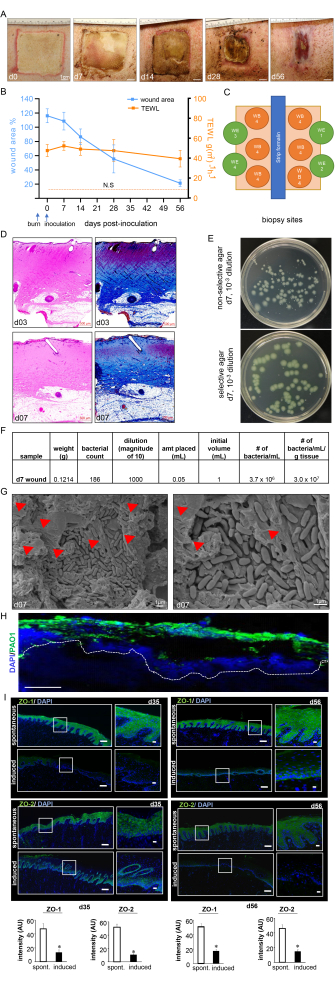
Рисунок 7: Ход заживления раны и подтверждение биопленки . (A) Репрезентативные изображения закрытия раны в течение всего периода исследования. Масштабная линейка = 1 см. (B) Количественное определение площади раны и измерений TEWL на временной шкале исследования (n = 6). Данные представлены в виде среднего ± SD. N.S. относится к значению TEWL нормальной кожи. (C) Принципиальная схема, показывающая различные участки биопсии раны. Г. Окрашивание H&E с соответствующим трихромным окрашиванием Массона, демонстрирующим искажение и некроз всех слоев кожи на 3-й день после ожога и 7-й день после инокуляции. Масштабная линейка = 500 мкм. (E) Репрезентативные цифровые изображения неселективного агара (агар Лурии-Бертани) и селективного агара (синегнойный изоляционный агар) с колониями бактерий, выращенных из тканей раневого ложа свиньи. Селективная среда позволяет проводить точный подсчет только колоний PA01. (F) Показан расчет колониеобразующей единицы (КОЕ) на основе подсчета колоний, взятого из обработанных биопсий раны после инокуляции на 7-й день. (G) Репрезентативные изображения привитых ожоговых ран методом сканирующей электронной микроскопии (СЭМ) на 7-й день после инокуляции, на которых видна созданная биопленка PA01 с увеличенным изображением с правой стороны. Масштабная линейка = 1 мкм. Красные стрелки указывают на внеклеточные полимерные вещества (ЭПС). (H) P. aeruginosa на ожоговых ранах визуализировали с помощью антисинегнойных (зеленых) антител; Иммунофлуоресцентные изображения биопсии раны после инокуляции на 7-й день показывают сильную колонизацию тканей раны P. aeruginosa. Масштабная линейка = 100 мкм. (I) Репрезентативная мозаика (масштабная линейка = 200 мкм) и соответствующие увеличенные (масштабная линейка = 50 мкм) изображения окрашенных ZO-1 и ZO-2 срезов на 35-й и 56-й день после инокуляции, демонстрирующие снижение экспрессии белков после индуцированной инфекции. Замороженные срезы (10 мкм), внедренные в ОКТ, окрашивали с использованием анти-ZO-1 (зеленый) или анти-ZO-2 (зеленый). Секции были окрашены с помощью DAPI. Гистограммы показывают количественную оценку интенсивности сигналов ZO-1 и ZO-2. Данные представлены в виде среднего ± SD (n = 3); * p < 0,05 по сравнению со спонтанными. Для проверки значимости был проведен однофакторный дисперсионный анализ тестов Манна-Уитни или Краскела-Уоллиса. Рисунок 7H, I был изменен по сравнению с Roy et al.13. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Discussion
В настоящем отчете представлен подробный протокол создания свинообразной модели хронической раневой биопленочной инфекции для экспериментальных исследований. Ранее сообщалось о нескольких моделях биопленки свиней 22,23,24,25,26, но ни одна из них не является моделью свиней, включающей 8-недельные долгосрочные исследования. Хронические раны – это те, которые остаются открытыми в течение 4 недель и более 14,27,28. В литературе отсутствуют другие модели биопленок хронических ран. В данной работе рассматривается понятие функционального закрытия раны 2,7,13,15,17,29. Исследование, проведенное в 2014 году, было первым, в котором сообщалось, что раны, инфицированные биопленкой, могут закрываться без восстановления барьернойфункции. В данной работе сообщается об измерении барьерной функции кожи в заживающей ране с помощью трансэпидермальной потери воды (TEWL).
Анатомически и физиологически кожа свиньи, по сравнению с кожей других мелких животных, ближе к коже человека32,33,34. Как кожа свиньи, так и человека имеет толстый эпидермис 33, а соотношение толщины дермы и эпидермиса колеблется от 10:1 до13:1 у свиньи, что сопоставимо с человеком34,35. Гистологически и биомеханически кожа человека и свиньи обнаруживает сходство в гребнях, подкожном жире, дермальном коллагене, распределении волос, структурах придатков, а также размере и распределении кровеносных сосудов36,37,38. Функционально как свиньи, так и люди имеют сходство в составе липидного, белкового и кератинового компонентов эпидермального слоя, а также сопоставимые иммуногистологические картины37,38. Иммунная система свиней, по сравнению с иммунной системой других мелких животных, имеет большее сходство с иммунной системой человека, что означает, что свиньи являются подходящей моделью для исследований взаимодействий с хозяином, которые являются неотъемлемой частью сложности патологической биопленки при раневыхинфекциях. Критическая оценка плюсов и минусов, предложенных различными животными моделями, привела к консенсусу о том, что свиньи представляют собой эффективную модель для изучения заживления ран34,38. Кроме того, у домашних свиней спонтанно развиваются хронические бактериальные инфекции, что наблюдается у людей10. Ожоговое устройство, используемое для создания ран, представляет собой усовершенствованное и автоматизированное ожоговое устройство, которое подает тепловую энергию на основе температуры, считываемой с целевого участка кожи22,40. Такой подход повышает тяжесть и воспроизводимость ожоговой травмы. Использование клинических изолятов бактерий для инфицирования ран свиньи повышает ценность в качестве доклинической модели.
Ожоговые травмы носят сложный характер и вызывают несколько системных нарушений20,41. Таким образом, важно реанимировать свинью достаточным количеством жидкости и не допускать переохлаждения во время анестезии и восстановления. Несколько факторов могут препятствовать заживлению раны, в том числе питание после ожога, жидкость и боль42. Поэтому очень важен тщательный контроль за питанием и оценкой боли. Боль после ожога может быть сильной и влиять на поведение и рацион животного. Необходимо активно рассматривать меры по решению поведенческих проблем. Регулярная и непрерывная оценка боли и ее лечение являются обязательными. В этот протокол включен подробный лист оценки боли с очень подробным планом обезболивания. Чтобы избежать перекрестного загрязнения между ранами, особое внимание следует уделять нанесению первого слоя повязки на каждую рану отдельно. Следует проявлять особую осторожность при обращении со всеми биологически опасными материалами и при проведении тщательной дезинфекции оборудования, инструментов и всего операционного. Наложение нескольких слоев повязки предотвращает обнажение ран свиньей во время попытки растереть или почесать зудящую спину.
Свинья в текущей модели не была скомпрометирована основными метаболическими нарушениями (например, диабетом), и, следовательно, изучаемый эффект был исключительно влиянием бактериальной инфекции биопленки на заживление ран. Тем не менее, модель подходит для индукции диабета (например, с использованием стрептозотоцина) и может быть использована для изучения инфекции биопленки в связи с основным метаболическим расстройством. Другим ограничением модели является контролируемая инфекция с использованием бактерии P. aeruginosa. Ожидается, что нормальная микрофлора кожи свиньи также может расти в ране и влиять на заживление. Необходим дальнейший анализ с использованием NGS или других передовых методов для определения микробного содержимого раны. Нынешняя модель также может быть применена к смешанным инфекциям, вызванным различными видами микробов (например, грибковыми, вирусными и т.д.). Это важный элемент, так как клинически значимые раны, скорее всего, будут заселены смешанными микробами, которые могут по-разному влиять на заживление ран.
У этой модели есть много потенциальных преимуществ, в том числе сходство со сложностью и долгосрочными последствиями хронических ран человека, автоматизированный и воспроизводимый процесс ожога, а также использование клинически изолированных видов бактерий. Использование нескольких неинвазивных методов визуализации представляет собой мощный подход к сбору полезных физиологических данных, характеризующих рану. Наконец, оценка функционального заживления ран путем восстановления барьерной функции кожи на основе TEWL имеет решающее значение. В заключение, в данной работе показан надежный, простой, подробный и удобный в использовании протокол для разработки тяжелой ожоговой травмы, инфицированной биопленкой, с использованием модельной системы свиньи.
Disclosures
Авторы заявляют об отсутствии конкурирующих интересов.
Acknowledgements
Мы хотели бы поблагодарить Ресурсный центр лабораторных животных (LARC) Университета Индианы за поддержку и ветеринарную помощь животным во время исследования. Эта работа была частично поддержана грантами Национальных институтов здравоохранения NR015676, NR013898 и DK125835, а также грантом Министерства обороны W81XWH-11-2-0142. Кроме того, эта работа была отмечена следующими наградами Национальных институтов здравоохранения: GM077185, GM069589, DK076566, AI097511 и NS42617.
Materials
| Name | Company | Catalog Number | Comments |
| Sedation | |||
| Ketamine | Zoetis | 10004027 | 100mg/ml |
| Telazol | Zoetis | 106-111 | 100mg/ml |
| Xylazine | Pivetal | 04606-6750-02 | 100mg/ml Anased |
| 3ml syringe w/ 20g needle | Covidien-Monoject | 8881513033 | |
| Winged infusion set 21g | Jorgensen Labs | J0454B | |
| Anesthetic | |||
| Isoflurane | Pivetal | 21295097 | |
| Surgery | |||
| Hair clippers | Wahl | 8787-450A | |
| Nair | Church and Dwight Co. Inc | 70506572 | |
| Chlorhexidine Solution | First Priority Inc. | 179925722 | |
| 70% Isopropyl Alcohol | Uline | S-17474 | |
| 0.9% Saline Solution | ICU Medical | RL-7282 | |
| Non-woven gauze | Pivetal | 21295051 | |
| Paper tape | McKesson | 455531 | |
| 2" Elastic tape | Pivetal | 21300869 | |
| 18-22g Intravenous Angiocath | SurVet | (01)14806017512306 | |
| Spay hook | Jorgensen Labs | J0112A | |
| Sterile lube | McKesson | 16-8942 | |
| Laryngoscope | Jorgensen Labs | J0449S | |
| Roll gauze | Pivetal | 21295032 | |
| Endotracheal tube (7-9mm) | Covidien | 86112 | Shiley Hi-Lo Oral Nasal Tracheal Tube Cuffed |
| 15gtt/ml IV administration set | ICU Medical | 12672-28 | |
| LRS 1000ml bag | ICU Medical | 07953-09 | |
| Three Quarter Drape Sheet | McKesson | 16-i80-12110G | |
| Analgesia | |||
| Buprenorphine | RX Generics | 42023-0179-05 | 0.3mg/ml |
| Fentanyl Transdermal | |||
| Carprofen | 21294548 | Pivetal | 50mg/ml Levafen |
| Bandaging | |||
| Transparent film dressing 26x30 | Genadyne Biotechnologies | A4-S00F5 | |
| Film dressing 4 x 4-3/4 Frame Style | McKesson | 886408 | |
| Vetrap | 3M | 1410BK BULK | |
| Elastic tape 4" | Pivetal | 21300931 | |
| Kerlix Roll Gauze | Cardinal Health | 3324 | |
| Imaging | |||
| Canon EOS 80D | Canon | 1263C004 | |
| Speedlight 600EX II-RT | Canon | 1177C002 | |
| EFS 17-55mm Ultrasonic | Canon | 1242B002 | |
| GE Logiq E9 | GE | 5197104-2 | |
| ML6-15 Probe | GE | 5199103 | |
| PeriCamPSI | Perimed | 90-00070 | |
| DermaLab | Cortex Technologies Inc | 4608D78 | |
| Biopsy/Tissue Collection | |||
| 6mm punch biopsy | Integra Lifesciences | 33-36 | |
| bupivicaine 0.5% | Auromedics Pharma | 55150017030 | |
| Size 10 Disposable Scalpel | McKesson | 16-63810 | |
| Dissection scissors | Pivetal | 21294806 | |
| Rat tooth thumb tissue forceps | Aesculap | BD512R | |
| Non-adherent Dressing | Covidien | 2132 | Telfa |
| 50ml Conical tube | Falcon | 352070 | |
| Eppendorf/microcentrifuge tube | Fisherbrand | 02-681-320 | |
| OCT Cassette | |||
| Non Woven Gauze 4x4 | Pivetal | 21295051 | |
| Inoculum | |||
| Low salt LB agar | Invitrogen | 22700-025 | |
| Low salt LB broth | Fisher scientific | BP1427-500 | |
| Petri plate | Falcon | REF-351029 | |
| Polyprophyline round bottom tubes (14 ml) | Falcon | REF-352059 | |
| Pseudomonas Agar Base (Dehydrated) | Thermo Scientific | OXCM0559B | |
| LB Agar, powder (Lennox L agar) | Thermo Fisher Scientific (Life Technologies) | 22700025 | |
| Gibco™ DPBS, calcium, magnesium | Gibco | 14040133 | |
| Euthanasia | |||
| 18-22g Intravenous Angiocath | SurVet | (01)14806017512306 | |
| Fatal Plus | Vortech Pharmaceuticals | 9373 |
References
- Goodwine, J., et al. Pyruvate-depleting conditions induce biofilm dispersion and enhance the efficacy of antibiotics in killing biofilms in vitro and in vivo. Scientific Reports. 9 (1), 3763 (2019).
- Sen, C. K., Roy, S., Mathew-Steiner, S. S., Gordillo, G. M. Biofilm management in wound care. Plastic and Reconstructive Surgery. 148 (2), 275-288 (2021).
- Church, D., Elsayed, S., Reid, O., Winston, B., Lindsay, R. Burn wound infections. Clinical Microbiology Reviews. 19 (2), 403-434 (2006).
- Nguyen, T. T., Gilpin, D. A., Meyer, N. A., Herndon, D. N. Current treatment of severely burned patients. Annals of Surgery. 223 (1), 14-25 (1996).
- Eriksson, E., et al. Chronic wounds: Treatment consensus. Wound Repair and Regeneration. 30 (2), 156-171 (2022).
- Lebeaux, D., Chauhan, A., Rendueles, O., Beloin, C. From in vitro to in vivo models of bacterial biofilm-related infections. Pathogens. 2 (2), 288-356 (2013).
- Ganesh, K., et al. Chronic wound biofilm model. Advances in Wound Care. 4 (7), 382-388 (2015).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Stewart, P. S. Biophysics of biofilm infection. Pathogens and Disease. 70 (3), 212-218 (2014).
- Jensen, L. K., Johansen, A. S. B., Jensen, H. E. Porcine models of biofilm infections with focus on pathomorphology. Frontiers in Microbiology. 8, 1961 (2017).
- Mah, T. F., O'Toole, G. A. Mechanisms of biofilm resistance to antimicrobial agents. Trends in Microbiology. 9 (1), 34-39 (2001).
- Gonzalez, J. F., Hahn, M. M., Gunn, J. S. Chronic biofilm-based infections: Skewing of the immune response. Pathogens and Disease. 76 (3), 023 (2018).
- Roy, S., et al. Mixed-species biofilm compromises wound healing by disrupting epidermal barrier function. Journal of Pathology. 233 (4), 331-343 (2014).
- Sen, C. K. Human wound and its burden: Updated 2020. Compendium of Estimates. Advances in Wound Care. 10 (5), 281-292 (2021).
- Barki, K. G., et al. Electric field based dressing disrupts mixed-species bacterial biofilm infection and restores functional wound healing. Annals of Surgery. 269 (4), 756-766 (2019).
- Dusane, D. H., et al. Electroceutical treatment of Pseudomonas aeruginosa biofilms. Scientific Reports. 9 (1), 2008 (2019).
- Roy, S., et al. Staphylococcus aureus biofilm infection compromises wound healing by causing deficiencies in granulation tissue collagen. Annals of Surgery. 271 (6), 1174-1185 (2020).
- Ghanbari, A., et al. Inoculation density and nutrient level determine the formation of mushroom-shaped structures in Pseudomonas aeruginosa biofilms. Scientific Reports. 6, 32097 (2016).
- Yin, R., Cheng, J., Wang, J., Li, P., Lin, J. Treatment of Pseudomonas aeruginosa infectious biofilms: Challenges and strategies. Frontiers in Microbiology. 13, 955286 (2022).
- Norbury, W., Herndon, D. N., Tanksley, J., Jeschke, M. G., Finnerty, C. Infection in burns. Surgical Infections. 17 (2), 250-255 (2016).
- Nitz, F., et al. Molecular detection of drug-resistance genes of bla(OXA-23)-bla(OXA-51) and mcr-1 in clinical isolates of Pseudomonas aeruginosa. Microorganisms. 9 (4), 786 (2021).
- Davis, S. C., et al. Microscopic and physiologic evidence for biofilm-associated wound colonization in vivo. Wound Repair and Regeneration. 16 (1), 23-29 (2008).
- Breuing, K., Kaplan, S., Liu, P., Onderdonk, A. B., Eriksson, E. Wound fluid bacterial levels exceed tissue bacterial counts in controlled porcine partial-thickness burn infections. Plastic and Reconstructive Surgery. 111 (2), 781-788 (2003).
- Nusbaum, A. G., et al. Effective method to remove wound bacteria: Comparison of various debridement modalities in an in vivo porcine model. Journal of Surgical Research. 176 (2), 701-707 (2012).
- Hirsch, T., et al. Enhanced susceptibility to infections in a diabetic wound healing model. BMC Surgery. 8, 5 (2008).
- Roche, E. D., et al. Increasing the presence of biofilm and healing delay in a porcine model of MRSA-infected wounds. Wound Repair and Regeneration. 20 (4), 537-543 (2012).
- Hartoch, R. S., McManus, J. G., Knapp, S., Buettner, M. F. Emergency management of chronic wounds. Emergency Medical Clinics of North America. 25 (1), 203-221 (2007).
- Mustoe, T. Understanding chronic wounds: a unifying hypothesis on their pathogenesis and implications for therapy. American Journal of Surgery. 187 (5), 65-70 (2004).
- Bhattacharya, M., et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing. Proceedings of the National Academy of Sciences of the United States of America. 115 (28), 7416-7421 (2018).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Sinha, M., et al. Pseudomonas aeruginosa theft biofilm require host lipids of cutaneous wound. Annals of Surgery. 277 (3), e634-e647 (2023).
- Fan, G. Y., et al. Severe burn injury in a swine model for clinical dressing assessment. Journal of Visualized Experiments. (141), e57942 (2018).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration. 9 (2), 66-76 (2001).
- Meyer, W., Schwarz, R., Neurand, K. The skin of domestic mammals as a model for the human skin, with special reference to the domestic pig. Current Problems in Dermatology. 7, 39-52 (1978).
- Vardaxis, N. J., Brans, T. A., Boon, M. E., Kreis, R. W., Marres, L. M. Confocal laser scanning microscopy of porcine skin: implications for human wound healing studies. Journal of Anatomy. 190, 601-611 (1997).
- Heinrich, W., Lange, P. M., Stirtz, T., Iancu, C., Heidemann, E. Isolation and characterization of the large cyanogen bromide peptides from the alpha1- and alpha2-chains of pig skin collagen. FEBS Letters. 16 (1), 63-67 (1971).
- Marcarian, H. Q., Calhoun, M. L. Microscopic anatomy of the integument of adult swine. American Journal of Veterinary Research. 27 (118), 765-772 (1966).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration. 9 (2), 66-76 (2001).
- Dawson, H. D., et al. Structural and functional annotation of the porcine immunome. BMC Genomics. 14, 332 (2013).
- Kim, J. Y., Dunham, D. M., Supp, D. M., Sen, C. K., Powell, H. M. Novel burn device for rapid, reproducible burn wound generation. Burns. 42 (2), 384-391 (2016).
- Nielson, C. B., Duethman, N. C., Howard, J. M., Moncure, M., Wood, J. G. Burns: Pathophysiology of systemic complications and current management. Journal of Burn Care and Research. 38 (1), e469-e481 (2017).
- Rowan, M. P., et al. Burn wound healing and treatment: Review and advancements. Critical Care. 19 (1), 243 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved