Анализ плотности митохондрий и продольного распределения в костных мышечных волокнах крыс методом конфокальной микроскопии
In This Article
Summary
Здесь мы представляем протокол для анализа изменений плотности митохондрий и продольного распределения с помощью визуализации живых скелетных мышц с использованием конфокальной микроскопии для сканирования митохондриальной сети.
Abstract
Митохондрия представляет собой органеллу, которая может быть удлинена, фрагментирована и обновлена в соответствии с метаболическими потребностями клеток. Ремоделирование митохондриальной сети позволяет здоровым митохондриям удовлетворять клеточные потребности; Однако потеря этой способности связана с развитием или прогрессированием различных патологий. В скелетных мышцах изменения плотности и распределения митохондрий наблюдаются при физиологических и патологических состояниях, таких как физические упражнения, старение и ожирение. Таким образом, изучение митохондриальной сети может обеспечить лучшее понимание механизмов, связанных с этими состояниями.
Здесь описан протокол визуализации митохондрий живых скелетных мышечных волокон крыс. Волокна рассекают вручную в расслабляющем растворе и инкубируют с флуоресцентным индикатором визуализации живых клеток митохондрий (этиловый эфир тетраметилродамина, TMRE). Митохондриальный сигнал регистрируется с помощью конфокальной микроскопии с использованием режима сканирования XYZ для получения конфокальных изображений межмиофибриллярной митохондриальной (ИМФ) сети. После этого конфокальные изображения обрабатываются методом порогирования и бинаризации. Бинаризованное конфокальное изображение учитывает положительные пиксели митохондрий, которые затем подсчитываются для получения плотности митохондрий. Митохондриальная сеть в скелетных мышцах характеризуется высокой плотностью популяции ИМФ, которая имеет периодическое продольное распределение, сходное с таковым у Т-канальцев (ТТ). Быстрое преобразование Фурье (БПФ) — стандартная методика анализа, выполняемая для оценки распределения ТТ, позволяющая найти частоту распределения и уровень их организации. В данном протоколе описана реализация алгоритма БПФ для анализа продольного митохондриального распределения в скелетной мускулатуре.
Introduction
Митохондрии образуют высокодинамичные сети, которые в основном регулируются балансом между его элонгацией (слиянием) и фрагментацией (делением)1,2, которые модулируются экспрессией и активностью белков, таких как митофузин 1 и 2 (Mfn1 и Mfn2) и атрофия оптического белка 1 (Opa1), которые регулируют слияние внешней митохондриальной мембраны и внутренней мембраны, соответственно 1,2. Динамин-связанный белок (Drp1) преимущественно регулирует деление митохондрий при фосфорилировании в Ser6163.
В скелетных мышцах установлено, что митохондриальная сеть организована в структурно четко определенные субпопуляции на основе их близости к различным областям клеток (миофибриллам, сарколеммам и ядрам)4,5. Те митохондрии, которые расположены непосредственно под сарколеммой, называются субсарколеммальными митохондриями (SSM), те, которые расположены между сократительными нитями, называются интермиофибриллярными митохондриями (IMF), а митохондриальная субпопуляция вокруг ядер называется перинуклеарной митохондриальной сетью (PMN). Более того, было высказано предположение, что эти митохондриальные субпопуляции имеют регионоспецифичные функции и являются метаболически специализированными 4,5.
Поддержание клеточного энергетического гомеостаза, обеспечивающего метаболическую и сократительную функцию, в значительной степени зависит от взаимодействия и коммуникации на определенных участках через митохондриальную сеть (например, взаимодействие IMF и SSM)4,6. Помимо сетевых взаимодействий митохондрий, митохондрии также могут взаимодействовать с другими органеллами, образуя структурно-функциональные комплексы. В связи с этим показано, что ИМФ может располагаться по соседству с саркоплазматическим ретикулумом (СР) и в непосредственной близости от единиц высвобожденияСа2+ (CRU), образованных поперечными канальцами (ТТ)7. Этот факт актуален в связи с ролью митохондриального поглощенияCa2+ в регуляции синтеза и апоптоза АТФ. В последнее время также была высказана гипотеза о потенциальной роли в регуляции цитозольных транзиентовCa2+ 8.
ТТ представляют собой инвагинации сарколеммы, имеющие периодическое распределение по продольной оси кардиомиоцитов и скелетных мышечных волокон9,10, аналогичное распределению ИМФ5. Изменения в распределении ТТ имеют важные физиологические последствия, учитывая их роль в сократительной функции. Однако эти изменения в основном оценивались в кардиомиоцитах. Использование анализа с быстрым преобразованием Фурье (БПФ) позволяет преобразовывать периодические сигналы из дистанционной области в частотную, в результате чего получается спектр БПФ, указывающий частоту и регулярность сигнала11,12,13. Хотя имеются данные о том, что организация митохондриальной сети в скелетных мышечных волокнах имеет важное значение для адаптации к различным метаболическим условиям, так как при регенерации после мышечной травмы14,15 большинство анализов выполняется качественно.
Кроме того, учитывая, что митохондриальная дисфункция связана с рядом заболеваний, связанных со скелетными мышцами (например, неиспользуемая атрофия)2 и немышечных заболеваний, особенно метаболических заболеваний, и связанной с этим потерей мышечной массы (т.е. атрофией)16, количественная оценка митохондриальной сети и ее распределения в скелетных мышцах приобретает актуальность. В последнее время выявлена существенная разница в продольном распределении митохондрий икроножных мышечных волокон между группой страдающих ожирением (Ob; Zucker fa/fa rats) и постная группа (Lean; Цукер +/+ крысы) был идентифицирован с помощью БПФ17. Это исследование продемонстрировало полезность БПФ при анализе митохондриального распределения. Таким образом, в данном протоколе представлена методология исследования митохондрий в волокнах живых скелетных мышц по изображениям, полученным методом флуоресцентной конфокальной микроскопии. Митохондриальная плотность количественно оценивается с помощью фоновых пороговых значений, а также описан анализ продольного распределения митохондрий с помощью БПФ-анализа. Схема рабочего процесса представлена на рисунке 1.
Protocol
Все процедуры экспериментов на животных были оценены и одобрены Комитетом по использованию и уходу за животными (CICUAL) Tecnologico de Monterrey (протокол 2019-007). Для этого исследования были использованы крысы-самцы Цукера (+/+ и fa/fa) в возрасте от 12 до 13 недель. Животные содержались в стандартных условиях содержания (цикл 12 ч/12 ч свет/темнота, влажность 40-60%) и имели доступ к пище (стандартный крысиный корм) и воде ad libitum.
1. Состав раствора
- Приготовьте свежий раствор «Релакс», смешав компоненты, указанные в таблице 1. Отрегулируйте pH до 7,3 с помощью гидроксида натрия (NaOH).
- Рассчитайте концентрацию свободного кальция в растворе Relax с помощью программы моделирования для определения концентрации свободного металла.
- Приготовьте 5 мМ тетраметилродаминового метилового эфира (TMRE) в диметилсульфоксиде (ДМСО) и последующее разбавление 0,1 мМ в ДМСО.
2. Рассечение пучков икроножных мышечных волокон
- Поместите животное внутрь индукционной камеры и закройте крышку. Включите источник кислорода, установите расход газа на 0,5 л/мин и установите испаритель на 4% севофлурана, чтобы вызвать анестезию.
- Как только крыса уснет, поместите ее за пределы камеры в положение лежа на спине, сохраняя при этом анестезию. Зажмите носок или хвост, чтобы убедиться в отсутствии рефлексов.
- Ножницами разрежьте кожу и мышцы живота. Затем разрежьте грудную клетку, чтобы получить доступ к сердцу.
- Чтобы выполнить кардиэктомию, захватите сердце от самых верхних вен и артерий щипцами и перережьте кровеносные сосуды ножницами. Удалите сердце.
- Сразу после эвтаназии продезинфицируйте заднюю конечность этанолом и побрейте ее с помощью бритвенного станка.
- Возьмитесь за заднюю лапу и сделайте надрез ножницами через кожу на уровне ахиллова сухожилия.
- Разрежьте ножницами заднюю конечность на уровне проксимального отдела большеберцовой кости. Переложите его в чашку Петри диаметром 60 мм, содержащую 3 мл ледяного раствора Relax в дорсальном положении. Залейте его достаточным количеством раствора, чтобы мышцы не пересыхали.
- Определите ахиллово сухожилие, осторожно приподнимите его щипцами и рассеките мышцы от кости ножницами по радужной оболочке. Используйте стереомикроскоп, начиная с этого этапа вскрытия.
- Определите и отделите всю икроножную мышцу, основную массу в задней части задней конечности.
- Рассеките и удалите соединительную и жировую ткань, окружающую мышцу, с помощью щипцов с тонким кончиком. Перенесите боковую головку мышцы в новую чашку Петри с ледяным раствором Relax (см. рисунок 2A).
- Аккуратно зажмите мышцу щипцами с одного конца и аккуратно разделите ее на пучки микроножницами. Всегда манипулируйте пучками, осторожно удерживая их за один конец щипцами.
ПРИМЕЧАНИЕ: Пучки имеют длину около 10 мм и ширину 2 мм. - Переложите пучки волокон в новую чашку Петри с 2 мл ледяного раствора Relax. Выбирайте только те, которые имеют гладкий вид, завершены от одного конца до другого и не укорочены (рисунок 2B).
3. Получение изображений митохондрий в скелетных мышцах с помощью конфокальной микроскопии
- Инкубируют волокна в 2,5 × 10-4 мМ TMRE в растворе Relax в течение 20 мин при комнатной температуре.
ПРИМЕЧАНИЕ: При рекомендуемых рабочих концентрациях TMRE ожидается, что он будет находиться в незакалочном режиме. С этого момента беречь от воздействия света. - Во время инкубации:
- Откройте стандартное программное обеспечение конфокального микроскопа, выберите структуру конфигурации, а в диалоговом окне конфигурации оборудования выберите лазер и установите флажок для опции HeNe 543.
- В платформе сбора данных выберите диалоговое окно сбора данных, а в режиме сбора данных выберите панель XYZ.
- В диалоговом окне XY выберите формат 512 x 512, частоту 400 Гц и установите флажок на панели точечных отверстий. В отображаемом диалоговом окне точечного отверстия выберите AU для единицы измерения и добавьте значение 3 Airy для точечного отверстия.
ПРИМЕЧАНИЕ: Рассмотрите возможность уменьшения размера точечного отверстия, ближайшего к оптимальному критерию 1 Эйри, если сохраняется адекватный флуоресцентный сигнал. - В диалоговом окне " Настройки траектории луча" выберите объектив погружения в воду с 20-кратным увеличением и числовой апертурой (NA) 0,7 (20x/0,7 IMM), а также выберите окно длины волны излучения 576-700 нм. Выберите DD488/543 и 15% мощности лазера для лазера 543.
ПРИМЕЧАНИЕ: Настоятельно рекомендуется использовать объектив с погружением в воду для сканирования изображений в реальном времени (при наличии). Так как достигается одинаковый показатель преломления иммерсионной среды и инкубационной среды.
- После 20 мин инкубации дважды смените инкубационную среду. Убедитесь, что конфокальные изображения получены в течение 20-30 минут после инкубации.
- Подготовьте записывающую камеру с помощью покровного стекла толщиной 0,15 мм из боросиликатного стекла.
ПРИМЕЧАНИЕ: Выберите толщину защитного стекла в соответствии с имеющейся регистрирующей камерой, учитывая, что толщина обычно колеблется от 0,15 до 0,22 мм для оптимальной производительности. - Добавьте 200 мкл раствора Relax в записывающую камеру и перенесите пучки волокон.
- В конфокальном микроскопе используйте режим светлого поля для идентификации жизнеспособных волокон для флуоресцентной регистрации митохондрий. Жизнеспособные волокна полные, не сужаются, имеют неповрежденный бороздчатый рисунок.
- Отделите пучки волокон друг от друга и совместите их щипцами. Выберите те, которые находятся ближе всего к обложке.
- Отсканируйте флуоресценцию с помощью кнопки в реальном времени , чтобы отрегулировать усиление и смещение в консоли панели управления с учетом следующего:
- Выберите низкие значения интенсивности флуоресценции для фона около 0 произвольных единиц (а.е.).
- Выберите уровень усиления от 100 до 200 а.е. чтобы избежать перенасыщения системы записи. Следовательно, не регистрируйте самые высокие уровни флуоресценции.
- Выберите размер пикселя 150-190 нм, чтобы получить полную ширину волокна, отрегулировав коэффициент масштабирования в диалоговом окне XY .
ПРИМЕЧАНИЕ: Рассмотрите возможность использования размера пикселя, близкого к критерию Найквиста (90 нм), что позволяет сканировать всю ширину волокна.
- В диалоговом окне Стек Z отрегулируйте расстояние по оси Z для получения сигнала флуоресценции, начиная с глубины волокна 15 мкм (кнопка «Начало») до 22 мкм (кнопка «Конец»). Выберите 3 мкм в качестве размера шага Z.
- Нажмите кнопку Пуск, чтобы получить конфокальные изображения. Получите Z-стек, состоящий из трех конфокальных изображений, полученных на глубине 15, 18 и 21 мкм.
4. Анализ плотности митохондрий
- В платформе с открытым исходным кодом для анализа биологических изображений18 откройте файл Z-stack и поверните изображения, чтобы разместить волокно горизонтально, как показано на рисунке 3B.
- Случайным образом выберите прямоугольную область интереса (ROI), которая включает в себя область, занимаемую митохондриями (ROImito). Выберите размеры ROImito в диапазоне от 65 до 90 мкм для X. Для Y размер будет зависеть от ширины волокна, избегая его периферии.
- Продублируйте Z-стек с выбранным ROI mito и сохраните его как новый Z-стек (Mito-stack) в формате TIFF. Сохраните позицию ROI mito, выбранную в исходном стеке, с помощью инструмента ROI Manager.
- Вычислите порог для вычитания фона следующим образом:
- Используйте сочетание клавиш command+ shift+t, чтобы открыть диалоговое окно Пороговое значение .
- Выберите пороговый алгоритм Otsu |Ч/Б | Вариант с темным фоном . Обратите внимание, что изображение теперь бинаризовано.
- В диалоговом окне «Порог » обратите внимание на гистограмму распределения интенсивности флуоресценции и отображаемое пороговое значение.
ПРИМЕЧАНИЕ: Митохондрии-положительные пиксели имеют значения интенсивности флуоресценции выше порогового значения и отображаются в двоичном изображении как белые пиксели. - Примените пороговое значение к стеку двоичных изображений, нажав кнопку Применить. В открывшемся диалоговом окне «Преобразовать стек в двоичный» выберите параметры «Вычислить пороговое значение для каждого изображения», «Черный фон», «Создать новый стек» и нажмите кнопку «ОК».
- Обратите внимание, что генерируется стек с тремя двоичными изображениями (BinDMito-stack). Сохраните его в формате TIFF.
- Рассчитаем плотность митохондрий в BinDMito-стеке следующим образом:
- Выберите меню Анализ. Далее нажмите кнопку Гистограмма. В отображаемом диалоговом окне гистограммы нажмите кнопку Да , чтобы включить все изображения стека для анализа.
- В диалоговом окне " Гистограмма стека " нажмите кнопку "Список ", чтобы получить данные гистограммы. Перенесите данные гистограммы в электронную таблицу.
- В электронной таблице определите Mito-пиксели со значением 255 . Вычислите плотность митохондрий, используя уравнение (1):
Плотность митохондрий =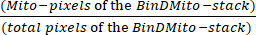 × 100 (1)
× 100 (1)
Общее количество пикселей определяется как N в диалоговом окне Гистограмма или вычисляется путем суммирования в электронной таблице количества пикселей гистограммы. - Чтобы вычислить площадь, занимаемую митохондриями (мкм2), умножьте Mito-пиксели BinDMito-стека на размер пикселя.
5. Анализ распределения митохондрий методом быстрого преобразования Фурье
- В платформе с открытым исходным кодом для анализа биологических изображений откройте стек BinDMito и нарисуйте прямоугольный ROI шириной 256 пикселей и высотой 5 мкм. Расположите ROI в центральном положении, а другой — в боковом, как показано на рисунке 4A, B.
- Используйте инструмент ROI Manager , чтобы настроить ROI для анализа БПФ и сохранить его.
ПРИМЕЧАНИЕ: В соответствии с потребностями анализа, другие ROI могут быть выбраны в различных позициях, и их размеры могут быть изменены. Тем не менее, для выполнения БПФ ширина должна быть равна 2n пикселям (например, 128, 256, 512 пикселей). - Получите профиль графика ROI с помощью команды быстрого доступа + k и перенесите данные в электронную таблицу.
- В электронной таблице заполните столбцы B и C данными, полученными из профиля графика. Столбец B содержит расстояние в мкм, а столбец C — соответствующее серое значение интенсивности флуоресценции (A.U.).
- Столбец D соответствует частоте БПФ (событие/мкм), которая будет заполнена следующим образом:
- Вычислите частоту дискретизации (Fs): Fs = 1/Δ d, где Δd — шаг расстояния (второе значение B).
- Вычислите Δ Fs: Δ Fs= Fs/N, где N — количество точек данных B (256).
- Вычислите стоповое значение частоты БПФ (S): S = (N/2) ×ΔFs.
- Заполните столбец D следующим образом:
- Первое значение столбца D равно 0.
- Выделите вторую ячейку в столбце D, перейдите в главное меню, выберите «Заливка» и нажмите «Ряд». Выберите столбцы. Для значения шага используйте вычисленное значение Δ Fs. В качестве стоп-значения используйте вычисленное значение S.
- Затем заполните столбец E комплексными значениями БПФ следующим образом:
- Вставьте 0 в первую ячейку столбца C, т.к. расстояние 0 должно совпадать с сигналом 0 для вычисления БПФ.
- Затем перейдите в меню « Данные », нажмите «Анализ данных» и выберите «Анализ Фурье».
- В новом окне выберите диапазон точек данных флуоресцентного сигнала, описанный в столбце C , для входного диапазона.
ПРИМЕЧАНИЕ: Количество точек данных должно быть 2n (например, 256 или 128 точек данных флуоресцентного сигнала). - Выберите соответствующий диапазон E для выходного диапазона.
- Нажмите кнопку Ok и позвольте комплексным значениям БПФ заполняться автоматически.
- Заполните столбец F величиной БПФ следующим образом:
- Используйте функцию IMABS , чтобы вернуть абсолютное значение в F из комплексного числа в E и умножить на 2/N для нормализации (уравнение (2)):
Величина БПФ = (IM.ABS (E1... En) × (2/N) (2)
- Используйте функцию IMABS , чтобы вернуть абсолютное значение в F из комплексного числа в E и умножить на 2/N для нормализации (уравнение (2)):
- Постройте график спектра БПФ, используя величину БПФ в F как функцию частоты БПФ в D, до S. Найдите точку максимального пика и соответствующую ей частоту БПФ.
- Преобразуйте частоту БПФ максимального пика в расстояние с помощью уравнения (3). Это вычисленное расстояние представляет собой продольное расстояние митохондриального распределения.
Расстояние (мкм) = 1/частота БПФ (3)
ПРИМЕЧАНИЕ: Из-за симметрии БПФ не стройте график частоты БПФ выше значения S , которое соответствует половине точек данных, избегая дублирования спектра БПФ.
6. Дополнительные шаги предварительной обработки для уменьшения шума изображения перед анализом изображения
- Примените медианный фильтр или 2D-деконволюцию следующим образом:
- Для медианного фильтра:
- Выберите Процесс | Фильтры и нажмите на опцию Медиана.
- В открывшемся диалоговом окне " Медиана " выберите 2,0 для параметра "Радиус " и нажмите кнопку "ОК". Выберите Да , чтобы применить процесс ко всем изображениям в стеке Mito.
- Обратите внимание на уменьшение шума на изображениях.
- Для 2D-деконволюции:
- Сгенерируйте теоретическую функцию разброса точек (PSF).
- Скачайте плагин PSF_Generator.jar и поместите файл в папку «Плагины».
- В диалоговом окне « Генератор PSF » выберите опцию « Оптическая 3D-модель Борна и Вольфа», введите значение иммерсии «Показатель преломления », равное 1,33 , используемое при конфокальном сканировании, и выберите « Наилучший » для параметра «Расчет точности ».
- Захват длины волны излучения 576 нм, NA используемой линзы объектива 0,7 и шаг Z 3 000 нм.
- Захват размера пикселя XY конфокального изображения, подлежащего деконволюции, а также размера XYZ , указывающего количество пикселей X и Y и количество шагов Z (3 для этого протокола).
- В меню «Дисплей» генератора PSF выберите параметр «Линейный», выберите разрешение 8 бит, а затем выберите параметр «Оттенки серого» для таблицы подстановки (LUT).
- Запустите генератор PSF и сохраните теоретический PSF , созданный в формате TIFF.
- Составьте сумму срезов PSF, созданных для открытия инструмента Z Project с опцией Stacks , которая находится в меню Image .
- В открывшемся диалоговом окне ZProjection выберите Суммарные срезы для параметра Тип проекции и нажмите кнопку ОК. Сохраните новый PSF в формате TIFF.
ПРИМЕЧАНИЕ: Вместо теоретического PSF можно использовать PSF, полученный экспериментально с помощью конфокальных сканирующих флуоресцентных микрогранул известного диаметра. - Скачайте плагин "DeconvolutionLab_2.jar"19 и поместите его в папку плагина.
- Перейдите в меню Плагины. Затем нажмите DeconvolutionLab2.
- Отделите конфокальные изображения от Mito-стека с помощью инструмента Images to stack из опции Stacks , расположенной в меню Image , и сохраните его в формате TIFF.
- В диалоговом окне DeconvolutionLab2 выберите одно из изображений, полученных из Mito-стека. Выделите созданный теоретический PSF и выберите алгоритм Ричардсона-Люси с 15 итерациями.
- Запустите DeconvolutionLab2, проверьте улучшение сигнала и шумоподавление на изображении и сохраните его в формате TIFF.
- Для медианного фильтра:
- Перейдите к шагу 4.4 для анализа изображений.
- Для определения пороговых значений деконволютированных изображений преобразуйте их в 8-битную маску в процессе определения порогового значения. Создайте подборку с двоичными и деконволютированными изображениями, выбрав « Изображения для стека » в инструменте « Подборки » меню «Изображение ».
- Для анализа БПФ деконволютированных изображений профиль графика содержит расстояние в пиксельных единицах. Преобразуйте пиксельные единицы в мкм следующим образом:
- В электронной таблице после выполнения шага 5.4 перенесите данные из B в A. Затем заполните B расстоянием в мкм , умножив каждый номер пикселя из A на размер пикселя.
Representative Results
В соответствии с настоящим протоколом может быть проведен анализ плотности и распределения митохондрий в живой скелетной мускулатуре. Протокол разделен на три основных этапа: рассечение пучка скелетных мышц, сканирование с помощью конфокальной микроскопии и анализ изображений. Обзор рабочего процесса представлен на рисунке 1. На рисунке 2А показана целая икроножная мышца крысы в чашке Петри, отмечающая боковую головку, из которой получены волокна, а на рисунке 2В показаны пучки волокон в растворе Relax. С помощью конфокальной микроскопии митохондрии могут быть зарегистрированы по глубине живого скелетного мышечного волокна с помощью флуоресцентного индикатора TMRE. TMRE представляет собой липофильный катионный флуорофор, который избирательно накапливается в митохондриях в соответствии с мембранным потенциалом митохондрий20.
Оптимальное конфокальное изображение IMF может быть получено путем выбора Z-расстояния выше 15 мкм глубины в волокне (рис. 3A). На рисунке 3B представлены репрезентативные конфокальные изображения митохондрий, нагруженных TMRE, полученные вдоль Z-расстояния икроножных мышечных волокон (от 15 до 21 мкм). Конфокальные изображения были обработаны с помощью порогового значения, чтобы преобразовать их в бинарные изображения для обеспечения митохондриального анализа. На рисунке 3B (левая панель) показано волокно от тренированной худощавой крысы. Он представляет собой ожидаемую конфокальную запись митохондрий скелетных мышечных волокон, поскольку он имеет последовательный рисунок вдоль волокна. В противоположность этому, мы выбрали волокно от крысы Ob (рис. 3B, правая панель), которое демонстрирует существенные изменения в содержании и распределении митохондрий. На рисунке 3С показана количественная оценка площади волокон, занимаемой митохондриями, выраженная в виде плотности митохондрий, полученная из каждого биаризованного изображения (показано на панели B). Как и ожидалось, волокно Ob имело меньшую плотность митохондрий. Она была определена последовательно вдоль анализируемого Z-расстояния, что также наблюдается на рисунке 3D , когда плотность митохондрий вычисляется для каждого стека, соответствующего трем конфокальным изображениям, полученным на 15, 18 и 21 мкм.
Подобно анализу плотности митохондрий, конфокальное сканирование флуоресцентного индикатора для визуализации живых клеток, такого как TMRE, позволяет изучать продольную организацию митохондрий в живых скелетных мышцах. IMF представляет периодическую организацию в I-диапазоне, близком к TT7, которая может быть проанализирована с помощью БПФ для количественной оценки частоты митохондриального сигнала и уровня организации17. На рисунке 4 показаны различия в организации ИМФ, обнаруженные в икроножной мышце, полученные от тощих и обных крыс, и то, как БПФ позволяет обнаружить изменения в распределении митохондриального сигнала. На рисунках 4A, B показаны продольные ROI, выбранные в центральном и боковом положении волокна для анализа БПФ. Перед выполнением БПФ вычисляется пороговое значение для вычитания фона. Затем изображение бинаризируется; Эти процедуры устраняют вариации уровней интенсивности флуоресценции митохондриального сигнала. Двоичное изображение обеспечивает профиль распределения флуоресценции, необходимый для выполнения БПФ.
На рисунках 4C, D показаны выбранные ROI на панелях A и B с их профилями графиков (верхние панели). Из профилей графиков можно наблюдать различия в распределении флуоресценции между волокнами, полученными от тощих и обных крыс, а также различия между ROI в пределах одного волокна. Для каждого профиля графика представлен соответствующий спектр БПФ (нижние панели). Пик максимального спектра БПФ указывает на частоту БПФ (ось X) распределения митохондриального сигнала вдоль продольной оси. Он может быть преобразован в значение расстояния, близкое к 2 мкм в боковом и центральном ROI от Lean крысы. Примечательно, что величина пика БПФ является показателем регулярности митохондриального сигнала, и изменения этой амплитуды свидетельствуют об изменениях в митохондриальном распределении.
На рисунке 4E, F показаны различия в спектре БПФ между волокнами, полученными из Lean, и волокнами, полученными из Ob, где были проанализированы латеральный и центральный ROI, соответственно. В латеральных ROI (рис. 4E) частота митохондриального продольного распределения была одинаковой в тощих волокнах и волокнах, полученных от Ob; тем не менее, амплитуда максимального пика БПФ в волокнах, полученных от Ob, была выше, что согласуется с более высокой регулярностью сигнала, наблюдаемой на изображении на рисунке 4B. Тем не менее, центральный ROI (рис. 4F) Ob наблюдается в качестве примера критического снижения пика БПФ по сравнению с Lean при наличии значительного изменения митохондриального распределения.
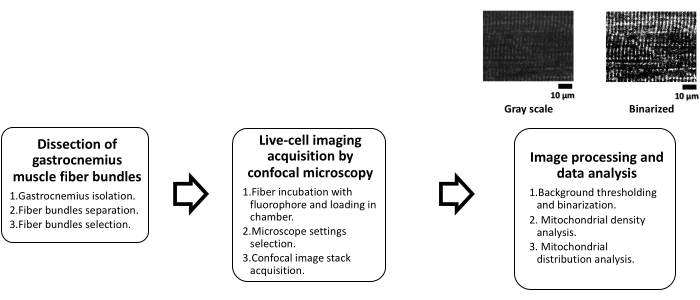
Рисунок 1: Схема митохондриального анализа в скелетных мышцах методом конфокальной микроскопии. Эта схема обобщает основные этапы протокола в три отдельных этапа. Первая фаза, рассечение пучков икроножных мышечных волокон, подразделяется на три последующих этапа: изоляция икроножной мышцы, за которой следует механическое рассечение мышцы на пучки для окончательного визуального отбора жизнеспособных. Вторая фаза состоит из получения изображений живых клеток с помощью конфокальной микроскопии, которая заключается в инкубации с флуорофором (TMRE) в течение 20 минут при комнатной температуре для помещения волокон в камеру. После этого в микроскопе выполняются соответствующие настройки для получения конфокальных изображений. На третьем этапе проводится конфокальная обработка изображений и анализ данных. Начиная с обработки изображений, где требуется пороговое значение для генерации двоичных изображений, на основе которых выполняются расчеты плотности митохондрий и распределение митохондрий с помощью БПФ. Сокращения: TMRE = этиловый эфир тетраметилродамина; БПФ = быстрое преобразование Фурье. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
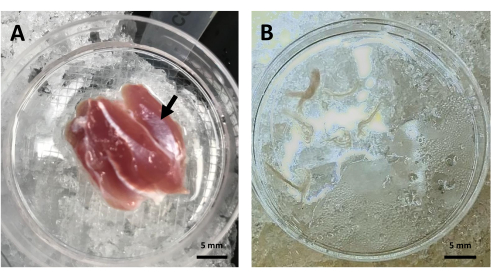
Рисунок 2: Рассечение пучка скелетных мышц. (А ) Рассеченная латеральная икроножная мышца крысы (черная стрелка) в чашке Петри с раствором Relax. (B) Репрезентативное изображение пучков икроножных мышечных волокон в растворе Relax перед нагрузкой TMRE. Аббревиатура: TMRE = этиловый эфир тетраметилродамина. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
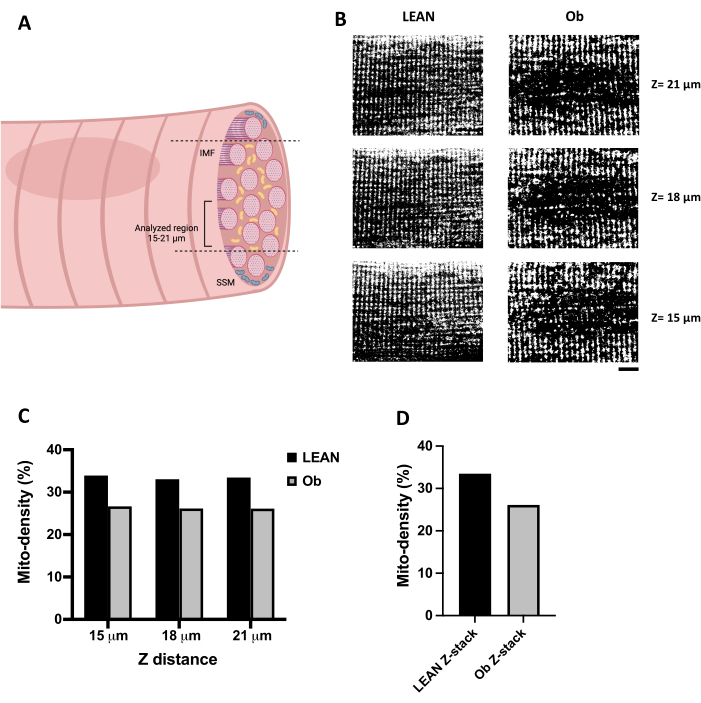
Рисунок 3: Анализ плотности митохондрий. (A) Иллюстрация, представляющая Z-расстояние, рекомендуемое для конфокального сканирования митохондрий IMF в скелетных мышечных волокнах. (B) Серия конфокальных изображений митохондрий, нагруженных TMRE в скелетных мышечных волокнах, полученных от тренируемой крысы Zucker +/+ (Lean) и от тучной крысы Zucker fa/fa (Ob), записанных на расстоянии Z (от 15 до 21 мкм глубины). Изображения были обработаны с помощью пороговых значений и преобразованы в двоичные изображения. (C) Вычисленная митоплотность конфокальных срезов, полученных на различных расстояниях Z, наблюдаемых на панели B. (D) Митоплотность, полученная из стека, состоящего из изображений, наблюдаемых на панели B. Изображения на панели B имеют размер 65 x 50 мкм. Масштабная линейка = 10 мкм. Сокращения: Мито-плотность = Митохондриальная плотность; IMF = интермиофибриллярные митохондрии; Об = ожирение; SSM = субсарколеммальные митохондрии. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
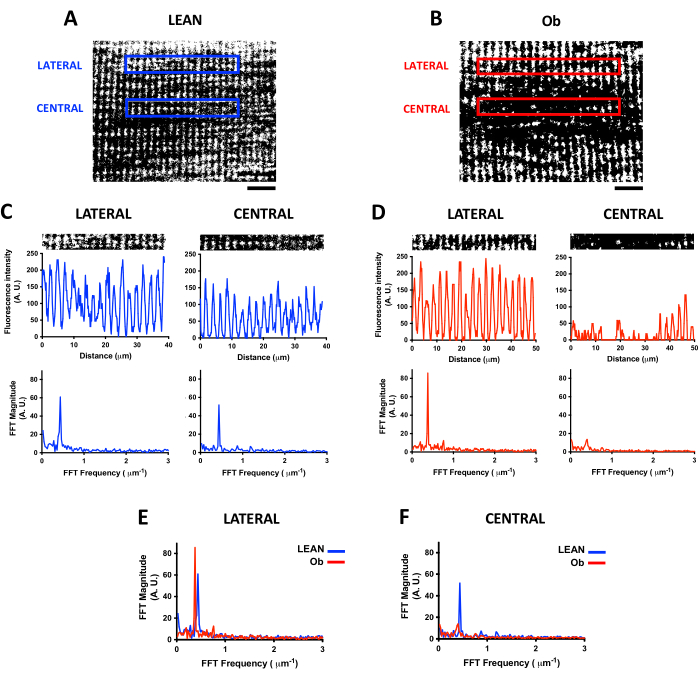
Рисунок 4: Анализ распределения митохондрий методом БПФ. Репрезентативные конфокальные изображения митохондрий, нагруженные флуоресцентным индикатором TMRE, получены на глубине 21 мкм скелетных мышечных волокон, полученных от тренированной крысы Zucker +/+ (Lean, панель A) и от крысы Zucker fa/fa с ожирением (Ob, панель B). Изображения были обработаны с помощью пороговых значений и преобразованы в двоичные изображения. Боковые и центральные ROI из панелей A (панель C) и B (панель D) с соответствующими профилями интенсивности флуоресценции (верхний график) и спектра БПФ (нижний график). БПФ был рассчитан на основе ROI с шириной 256 пикселей, что соответствует размеру ROI 39 x 5 мкм на панели A и размеру ROI 50 x 5 мкм на панели B. На панели E показаны различия в спектре БПФ, обнаруженные между митохондриями, полученными от тощих и обных крыс в латеральном ROI, в то время как на панели F показаны различия в спектре БПФ центрального ROI. Масштабная линейка = 10 мкм. Сокращения: A.U. = условные единицы; БПФ = быстрое преобразование Фурье; ROI = интересующие регионы; Об = Ожирение. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
| Реагент | Конечная концентрация в 100 мл | Запас |
| К-аспартат | 100 мМ | |
| KCl | 20 мМ | |
| ГЕПС | 20 мМ | |
| L-глутаминовая кислота | 3 мМ | |
| Яблочная кислота | 3 мМ | |
| ЭГТА | 0,1 мМ | 10 мМ |
| MgCl2 | 1 мМ свободного Mg2+ | |
| CaCl2 | 0,00002 мМ свободного Ca2+ | |
| Фосфокреатин ди-На | 5 мМ | 500 мМ |
| Креатинфосфокиназа | 5 ЕД/мл | 200 ЕД/мл |
| MgATP | 5 мМ | |
| рН 7,3 (с NaOH) |
Таблица 1: Реагенты и концентрация раствора релакса.
Дополнительный рисунок S1: Влияние методов предварительной обработки изображений. (A) Репрезентативные конфокальные изображения митохондрий, нагруженные флуоресцентным индикатором TMRE, полученные на глубине 18 мкм в скелетных мышечных волокнах, полученные от тренированной крысы Zucker +/+ (Lean, верхняя панель) и от крысы Zucker fa/fa с ожирением (нижняя панель), вместе с соответствующими изображениями, полученными после предварительной обработки с использованием порогового значения Otsu, медианного фильтра и порогового значения Otsu, а также 2D деконволюция и пороговое значение Оцу. (Б) График профиля митоплотности, полученного по конфокальным изображениям (панель А) после предварительной обработки различными методами. Изображения на панели A имеют размер 65 x 50 мкм. Масштабная линейка = 10 мкм. Сокращения: 2D-Decon = 2D деконволюция; Митоплотность = Плотность митохондрий. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Discussion
Митохондрии являются органеллами с высокой способностью к ремоделированию. Их содержание, плотность и распределение могут быть быстро изменены за счет активации механизмов слияния и деления митохондрий, известных как митохондриальная динамика1, и баланса между механизмами митохондриального обмена: митохондриальным биогенезом и специализированным путем деградации митохондрий, митофагией21,22. Содержание и морфология митохондрий могут варьироваться в зависимости от типа и стадии развития клеток и могут быть реструктурированы под воздействием различных физиологических и патологических стимулов 17,22,23,24. Поэтому изучение морфологии митохондрий актуально уже болееполувека25. Примечательно, что анализ митохондрий с помощью электронной микроскопии был стандартным методом, применяемым во многих исследованиях26.
Флуоресцентные исследования с помощью конфокальной микроскопии приобрели актуальность в последние несколько лет из-за их способности визуализировать митохондрии живых клеток на разной глубине волокон, что может помочь лучше понять роль митохондрий в скелетных мышцах в различных адаптивных и дезадаптивныхусловиях. В данном исследовании описана методика анализа плотности и распределения митохондрий в волокнах живой скелетной мускулатуры методом конфокальной микроскопии. Одна из основных проблем при работе с живыми скелетными мышечными волокнами состоит в том, чтобы избежать сокращения от процессов изоляции до митохондриальной конфокальной записи. Для достижения этой цели используется раствор17 с высоким содержанием Mg и АТФ Relax, который сохраняет волокна расслабленными в течение не менее 2 ч, что дает достаточно времени для проведения процесса изоляции волокон, флуорофорной нагрузки и получения митохондриального сигнала с помощью конфокальной микроскопии. Критическим моментом протокола является получение волокон механическим способом, так как это требует высокой точности и свежей ткани; Тем не менее, можно получить жизнеспособные пучки волокон из мышц крыс с помощью этого ранее использовавшегося и описанного метода28. Получение интактных волокон позволяет сохранить сарколемму и внутриклеточную среду, поддерживая метаболические и функциональные перекрестные помехи между клеточными структурами28,29.
В отличие от работы с тканями или фиксированными клетками, получение флуоресцентных изображений живых клеток с помощью конфокальной микроскопии позволяет в режиме реального времени отслеживать влияние различных условий эксперимента. Настоящий протокол может быть использован для изучения изменений в плотности и распределении митохондрий в режиме реального времени, а также для изучения различий между экспериментальными группами, например, в представленных здесь примерах между волокнами, полученными из Lean и Ob (рис. 3 и рис. 4). Всегда следует учитывать, что визуализация живых клеток подразумевает стандартизацию оптимальных условий работы при незначительных повреждениях клеток. Время работы, качество используемых растворов, параметры сбора данных и экспонирование лазеров должны точно контролироваться. Следовательно, основные соображения упомянуты ниже.
Митохондрии мышечных волокон не могут быть полностью зарегистрированы в продольном направлении с помощью конфокальной микроскопии из-за размера волокна и повреждения волокна, которое может быть вызвано длительным лазерным воздействием. Тем не менее, репрезентативная проба волокна регистрируется с помощью этой методики. Несмотря на то, что с помощью конфокальной микроскопии можно зарегистрировать всю толщину скелетного мышечного волокна крысы, это подразумевает более длительное время регистрации и воздействие лазерного луча. В случае с контрольными крысами проблем с этими записями не возникало. Тем не менее, волокна при патологических состояниях могут быть более восприимчивы к повреждениям, что наблюдается в волокнах крыс Ob. Следовательно, получение стопки репрезентативных конфокальных изображений, полученных на разных Z-расстояниях, является предпочтительным. Когда регистрируется только участок толщины волокна, рекомендуется брать стопку на одинаковой глубине на всех тестируемых волокнах, поскольку распределение и плотность митохондрий могут варьироваться в зависимости от их положения в волокне. Для получения репрезентативных конфокальных изображений IMF рекомендуется регистрировать сигнал на глубине более 15 мкм, избегая популяций SSM, расположенных близко к периферии.
При конфокальной съемке необходимо учитывать некоторые важные моменты. Во-первых, выбор иммерсионного объектива с учетом увеличения, высокой NA и иммерсионной среды. Поскольку клетки содержатся в гидрофильной инкубационной среде, показатель преломления инкубационной и иммерсионной среды должен быть одинаковым для получения хорошего сигнала и сканирования глубоко в ткани. Обычно достигается с помощью водного иммерсионного объектива. Конфокальные изображения на рисунках 3 и 4 были получены с помощью 20-кратного иммерсионного объектива 0,7 NA. Эта цель позволяет регистрировать волокно на всей его глубине, но было решено сканировать на 15, 18 и 21 мкм, так как репрезентативные конфокальные изображения IMF могут быть получены с сигналом высокой интенсивности флуоресценции и незначительными повреждениями волокна. Другие увеличения, такие как 40-кратное и масло в качестве иммерсионной среды, могут быть рассмотрены, но должны быть оценены.
Во-вторых, размер пикселя для получения изображения вычисляется в соответствии с теоремой Найквиста, что позволяет выбрать подходящий размер пикселя, который позволяет избежать избыточной дискретизации (более высокая лазерная экспозиция) и недостаточной дискретизации (приводит к меньшему разрешению)30. Расчет зависит от характеристик выбранного объектива и длины волны (~90 нм). Его можно регулировать с помощью зума; Таким образом, всего одна настройка масштабирования обеспечивает оптимальный размер пикселя30. Тем не менее, на практике масштаб также зависит от площади анализируемого образца. Таким образом, нахождение баланса позволяет работать с размером пикселя, наиболее близким к критерию Найквиста, а также подходящим к анализируемой области. Рисунки 3 и 4 получены с размером пикселя 150 и 190 нм, что позволило провести анализ полной ширины волокна, составляющей ~50-80 мкм.
В-третьих, следует использовать точечное отверстие соответствующего диаметра, предотвращающего попадание расфокусированного света на детектор. Как правило, 1 Эйри считается оптимальным размером пинхола, так как он позволяет регистрировать ~80% фотонов, исходящих из плоскости фокуса30. Тем не менее, некоторые окрашенные биологические образцы, которые показывают низкий уровень флуоресценции, требуют точечного увеличения30. Конфокальные изображения на рисунках 3 и 4 были получены с размером пиньхола 3 по Эйри из-за слабого сигнала, захваченного с помощью нижнего отверстия Эйри. Важно учитывать, что увеличение интенсивности сигнала в результате увеличения размера отверстия приводит к снижению разрешения из-за увеличения захваченного света вне фокуса. По этой причине мы рекомендуем использовать размер отверстия, максимально близкий к 1 воздушному.
При адекватном получении конфокальные изображения могут быть обработаны для получения количественной информации о плотности и распределении митохондрий. В любом случае, перед анализом необходимо выполнить критический этап обработки изображения порогового значения, чтобы улучшить количественную оценку сигнала. На этом важном этапе определяется значение интенсивности флуоресценции, которое отделяет положительные пиксели митохондрий от пикселей фона. Порог может быть определен гауссовской аппроксимацией пика, представляющего митохондрии, когда гистограмма изображения показывает два пика, один из которых соответствует фону, а другой — митохондриям. Однако бимодальное распределение не всегда достигается в каждом из изображений, поэтому приходится применять другие методы порогового распределения.
В этом протоколе описывается реализация порогового значения Оцу, которое представляет собой непараметрический и неконтролируемый метод, предназначенный для нахождения порогового значения, когда два пика не разделены или присутствуют другие пики31. Otsu может быть легко применен с помощью платформы с открытым исходным кодом для анализа биологических изображений; Однако можно протестировать и другие методы порогового значения. Один и тот же метод порогового значения должен быть применен ко всем конфокальным изображениям и должен быть рассчитан независимо для каждого конфокального изображения. Применение порога ко всему стеку приводит к неверным результатам. После того, как бинарные изображения получены после процесса порогового значения, анализ плотности митохондрий и БПФ может быть легко проведен, следуя инструкциям, описанным в этом протоколе. Тем не менее, следует соблюдать осторожность при выполнении обоих анализов, чтобы избежать включения ядер и капилляров, так как это может привести к ошибкам количественной оценки. Что касается плотности, то достаточно вычесть пиксели, или площадь, занимаемую ядрами или капиллярами, из пикселей или общей площади, подлежащей анализу. Кроме того, при выполнении анализа БПФ необходимо убедиться в том, что митохондриальный сигнал является прямым. И наоборот, когда сигнал митохондрий наклонен, он может создавать профили, которые не представляют митохондриальное продольное распределение, что приводит к неверным данным спектра БПФ. Кроме того, для уменьшения шума на изображениях может быть применен этап предварительной обработки. Этот протокол описывает два необязательных этапа предварительной обработки с использованием медианного фильтра и 2D-деконволюции. Влияние этих методов предварительной обработки на изображение и содержание плотности митохондрий представлено на дополнительном рисунке S1. Важно учитывать, что, хотя эти предварительные процессы могут улучшить качество изображения, они также могут привести к потере определенных деталей изображения. Поэтому их следует использовать с осторожностью и последовательно применять ко всем анализируемым изображениям.
Несмотря на свои преимущества, конфокальная микроскопия ограничена латеральным разрешением (XY) 180-250 нм при реализации оптимальных условий для получения данных32. Диаметр митохондрий ~200-700 нм, что близко к дифракционному пределу конфокальной микроскопии; таким образом, субмитохондриальные структуры не могут быть адекватно обнаружены33 и не могут быть оценены с помощью анализа плотности и БПФ, показанного в этом протоколе. Другие методы микроскопии со сверхвысоким разрешением, такие как стохастическая оптическая реконструкционная микроскопия (STORM), вынужденная эмиссионная наноскопия (STED) или микроскопия структурированного освещения (SIM), могут быть изучены для разрешения субмитохондриальных структур32. В этом протоколе конфокальные изображения митохондрий получают с помощью флуорофора TMRE, который зависит от мембранного потенциала митохондрий. Таким образом, интенсивность флуоресценции митохондрий может варьироваться в зависимости от их мембранного потенциала. Для решения этой проблемы перед анализом данных выполняется процесс порогового значения. Все пиксели, превышающие определенный порог, считаются положительными для митохондриального сигнала, независимо от их значения флуоресценции. Тем не менее, следует отметить, что митохондрии с очень низким мембранным потенциалом не могут быть разрешены с помощью этого метода. Таким образом, рекомендуются дополнительные исследования количественного определения содержания митохондриального белка. Преимущество использования TMRE заключается в том, что конфокальные изображения также могут быть использованы для анализа потенциала митохондриальной мембраны, но необходимо проводить адекватный контроль с помощью разобщающих агентов, таких как карбонилцианид--трифторметоксифенилгидразон (FCCP). Кроме того, инструкции по анализу плотности и распределения митохондрий могут быть выполнены с помощью зеленых флуоресцентных индикаторов для митохондрий, которые нагружают митохондрии независимо от их мембранного потенциала, но стратегия инкубации и настройки конфокального захвата должны быть стандартизированы.
Учитывая, что структура митохондрий связана с основными митохондриальными и клеточными функциями, протокол, описанный здесь, может предоставить ценную информацию об их ремоделировании во время болезни или при конкретном стрессовом ударе. Это может способствовать лучшему пониманию ключевых функций скелетных мышц, управляемых митохондриями, таких как производство энергии, или в которых митохондрии играют важную роль во взаимодействии с другими органеллами, например, в связи между сокращением и метаболизмом. Следование инструкциям протокола позволяет оценить плотность и распределение митохондрий в живой скелетной мускулатуре. Этапы протокола разделены на три основных этапа, ориентированных на рассечение пучка скелетных мышц, сканирование конфокальной микроскопии и анализ изображений, где содержатся подробные инструкции и важные соображения. Примечательно, что протокол может быть дополнительно оптимизирован для изучения дополнительных этапов Z для полной митохондриальной реконструкции в волокне в соответствии с потребностями пользователя. Например, конфокальное изображение и этапы анализа могут быть протестированы для изучения клеточных структур с аналогичным распределением, таких как TT в живых и фиксированных образцах.
Disclosures
Авторы заявляют об отсутствии конфликта интересов.
Acknowledgements
Эта работа была поддержана Медицинской школой и Институтом исследований ожирения Tecnologico de Monterrey. Рисунок 3A был создан с помощью программного обеспечения Scientific Image and Illustration.
Materials
| Name | Company | Catalog Number | Comments |
| Adenosine 5’-triphosphate disodium salt hydrate | Sigma-Aldrich | A6419 | |
| Borosilicate glass coverslip | Warner Instruments | 64-0709 | |
| Calcium chloride | Sigma-Aldrich | C5670 | |
| Confocal microscope | Leica | TCS SP5 | |
| Confocal microscope software Leica Application Suite | Leica | 2.7.3.9723 | |
| Creatine Phosphokinase | Sigma-Aldrich | C3755 | |
| DeconvolutionLab2 (DeconvolutionLab_2.jar) | Biomedical Imaging Group, EPFL | http://bigwww.epfl.ch/deconvolution/deconvolutionlab2/ | |
| Dimethyl Sulfoxide | Sigma-Aldrich | D2650 | |
| DL-Aspartic acid potassium sat hemihydrate | Sigma-Aldrich | 11240 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N´N´-tetraacetic acid | Sigma-Aldrich | E4378 | |
| Forceps | Miltex | MH-18 | |
| HC PL APO 20x/ 0.7 IMM objective | Leica | 506517 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Iris scissors | Miltex | 5-304 | |
| L-(-)-Malic acid | Sigma-Aldrich | M7397 | |
| L-glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626 | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | M2393 | |
| Maxchelator | UC Davis Health | https://somapp.ucdmc.ucdavis.edu/pharmacology/bers/maxchelator/downloads.htm | |
| Micro scissors | Miltex | 18-1633 | |
| Open-source platform for biological-image analysis Fiji | Public, maintained by Eliceiri/LOCI group, Jug group, and Tomancak lab.Fiji | https://fiji.sc/ | |
| Phosphocreatine disodium salt hydrate | Sigma-Aldrich | P7936 | |
| Potassium chloride | Sigma-Aldrich | P9333 | |
| PSF Generator (PSF_Generator.jar) | Biomedical Imaging Group, EPFL | http://bigwww.epfl.ch/algorithms/psfgenerator/ | |
| Recording chamber | Warner Instruments | RC-27N | |
| Sodium hydroxide | Sigma-Aldrich | S5881 | |
| Spreadsheet Microsoft Excel | Microsoft | ||
| Stereo microscope | Zeiss | Stemi 508 | |
| Tetramethylrhodamine, ethyl ester | Invitrogen | T669 |
References
- Lackner, L. L. Shaping the dynamic mitochondrial network. BMC Biology. 12, 35 (2014).
- De Mario, A., Gherardi, G., Rizzuto, R., Mammucari, C. Skeletal muscle mitochondria in health and disease. Cell Calcium. 94, 102357 (2021).
- Chang, C. R., Blackstone, C. Dynamic regulation of mitochondrial fission through modification of the dynamin-related protein Drp1. Annals of the New York Academy of Sciences. 1201, 34-39 (2010).
- Willingham, T. B., Ajayi, P. T., Glancy, B. Subcellular specialization of mitochondrial form and function in skeletal muscle cells. Frontiers in Cell and Developmental Biology. 9, 757305 (2021).
- Kuznetsov, A. V., et al. Mitochondrial subpopulations and heterogeneity revealed by confocal imaging: possible physiological role. Biochimica et Biophysica Acta. 1757 (5-6), 686-691 (2006).
- Díaz-Vegas, A. R., et al. Mitochondrial calcium increase induced by RyR1 and IP3R channel activation after membrane depolarization regulates skeletal muscle metabolism. Frontiers in Physiology. 9, 791 (2018).
- Boncompagni, S., et al. Mitochondria are linked to calcium stores in striated muscle by developmentally regulated tethering structures. Molecular Biology of the Cell. 20 (3), 1058-1067 (2009).
- Reggiani, C., Marcucci, L. A controversial issue: Can mitochondria modulate cytosolic calcium and contraction of skeletal muscle fibers. The Journal of General Physiology. 154 (9), e202213167 (2022).
- Heinzel, F. R., et al. Remodeling of T-tubules and reduced synchrony of Ca2+ release in myocytes from chronically ischemic myocardium. Circulation Research. 102 (3), 338-346 (2008).
- Al-Qusairi, L., Laporte, J. T-tubule biogenesis and triad formation in skeletal muscle and implication in human diseases. Skeletal Muscle. 1 (1), 26 (2011).
- Pérez-Treviño, P., Pérez-Treviño, J., Borja-Villa, C., García, N., Altamirano, J. Changes in T-tubules and sarcoplasmic reticulum in ventricular myocytes in early cardiac hypertrophy in a pressure overload rat model. Cellular Physiology and Biochemistry. 37 (4), 1329-1344 (2015).
- Celestino-Montes, A., Pérez-Treviño, P., Sandoval-Herrera, M. D., Gómez-Víquez, N. L., Altamirano, J. Relative role of T-tubules disruption and decreased SERCA2 on contractile dynamics of isolated rat ventricular myocytes. Life Sciences. 264, 118700 (2021).
- Song, L. S., et al. Orphaned ryanodine receptors in the failing heart. Proceedings of the National Academy of Sciences of the United States of America. 103 (11), 4305-4310 (2006).
- Houzelle, A., et al. Human skeletal muscle mitochondrial dynamics in relation to oxidative capacity and insulin sensitivity. Diabetologia. 64 (2), 424-436 (2021).
- Call, J. A., et al. Ulk1-mediated autophagy plays an essential role in mitochondrial remodeling and functional regeneration of skeletal muscle. American Journal of Physiology. Cell Physiology. 312 (6), C724-C732 (2017).
- Fealy, C. E., Grevendonk, L., Hoeks, J., Hesselink, M. K. C. Skeletal muscle mitochondrial network dynamics in metabolic disorders and aging. Trends in Molecular Medicine. 27 (11), 1033-1044 (2021).
- Rivera-Alvarez, I., et al. A single session of physical activity restores the mitochondrial organization disrupted by obesity in skeletal muscle fibers. Life Sciences. 256, 117965 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2022).
- Sage, D., et al. DeconvolutionLab2: An open-source software for deconvolution microscopy. Methods. 115, 28-41 (2017).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes, and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- Ma, K., et al. Mitophagy, mitochondrial homeostasis, and cell fate. Frontiers in Cell and Developmental Biology. 8, 467 (2020).
- Meinild, L. A. -. K., et al. Exercise training increases skeletal muscle mitochondrial volume density by enlargement of existing mitochondria and not de novo biogenesis. Acta Physiologica. 222 (1), (2018).
- Memme, J. M., Erlich, A. T., Phukan, G., Hood, D. A. Exercise and mitochondrial health. Journal of Physiology. 599 (3), 803-817 (2021).
- Gan, Z., Fu, T., Kelly, D. P., Vega, R. B. Skeletal muscle mitochondrial remodeling in exercise and diseases. Cell Research. 28 (10), 969-980 (2018).
- Schiaffino, S., Hanzlíková, V., Pierobon, S. Relations between structure and function in rat skeletal muscle fibers. Journal of Cell Biology. 47 (1), 107-119 (1970).
- Vincent, A. E., et al. The spectrum of mitochondrial ultrastructural defects in mitochondria myopathy. Scientific Reports. 6, 30610 (2016).
- Mishra, P., Varuzhanyan, G., Pham, A. H., Chan, D. C. Mitochondrial dynamics is a distinguishing feature of skeletal muscle fiber types and regulates organellar compartmentalization. Cell Metabolism. 22 (6), 1033-1044 (2015).
- Cheng, A. J., Westerblad, H. Mechanical isolation, and measurement of force and myoplasmic free [Ca2+] in fully intact single skeletal muscle fibers. Nature Protocols. 12 (9), 1763-1776 (2017).
- Kuznetsov, A. V., Javadov, S., Margreiter, R., Hagenbuchner, J., Ausserlechner, M. J. Analysis of mitochondrial function, structure, and intracellular organization in situ in cardiomyocytes and skeletal Muscles. International Journal of Molecular Sciences. 23 (4), 2252 (2022).
- Pawley, J. B. Fundamental limits in confocal microscopy. In: Pawley, J. (eds) Handbook of Biological Confocal Microscopy. , (2006).
- Otsu, N. A. Threshold selection method from gray-level histogram. IEEE Transactions on System Man Cybernetics. 9, 62-66 (1979).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190 (2), 165-175 (2010).
- Jakobs, S., Stephan, T., Ilgen, P., Brüser, C. Light microscopy of mitochondria at the nanoscale. Annual Review of Biophysics. 49, 289-308 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved