Rilevazione quantitativa dei legami incrociati DNA-proteina e delle loro modificazioni post-traduzionali
In This Article
Summary
Il presente protocollo evidenzia un metodo modificato per rilevare e quantificare i legami incrociati DNA-proteina (DPC) e le loro modificazioni post-traduzionali (PTM), tra cui l'ubiquitilazione, la SUMOilazione e l'ADP-ribosilazione indotte da inibitori della topoisomerasi e dalla formaldeide, consentendo così lo studio della formazione e della riparazione delle DPC e dei loro PTM.
Abstract
I legami incrociati DNA-proteina (DPC) sono lesioni del DNA frequenti, ubiquitarie e deleterie, che derivano da danni endogeni al DNA, malfunzionamento di enzimi (topoisomerasi, metiltransferasi, ecc.) o agenti esogeni come chemioterapici e agenti reticolanti. Una volta indotte le DPC, diversi tipi di modificazioni post-traduzionali (PTM) vengono prontamente coniugate ad esse come meccanismi di risposta precoce. È stato dimostrato che le DPC possono essere modificate dall'ubiquitina, dal piccolo modificatore simile all'ubiquitina (SUMO) e dal poli-ADP-ribosio, che innescano i substrati per segnalare i rispettivi enzimi di riparazione designati e, in alcuni casi, coordinano la riparazione in modo sequenziale. Poiché i PTM traspaiono rapidamente e sono altamente reversibili, è stato difficile isolare e rilevare i DPC coniugati con PTM che di solito rimangono a bassi livelli. Qui viene presentato un test immunologico per purificare e rilevare quantitativamente le DPC ubiquitilate, SUMOilate e ADP-ribosilate (DPC topoisomerasi indotte da farmaci e DPC non specifiche indotte da aldeidi) in vivo. Questo test deriva dal test RADAR (rapid approach to DNA adduct recovery) che viene utilizzato per l'isolamento di DNA genomico contenente DPC mediante precipitazione di etanolo. Dopo la normalizzazione e la digestione delle nucleasi, i PTM delle DPC, tra cui l'ubiquitilazione, la SUMOilazione e l'ADP-ribosilazione, vengono rilevati mediante immunoblotting utilizzando i loro anticorpi corrispondenti. Questo robusto test può essere utilizzato per identificare e caratterizzare nuovi meccanismi molecolari che riparano le DPC enzimatiche e non enzimatiche e ha il potenziale per scoprire inibitori di piccole molecole che mirano a fattori specifici che regolano le PTM per riparare le DPC.
Introduction
Il danno al DNA genomico si verifica a causa del decadimento spontaneo, del danno interno e di fattori ambientali1. Le lesioni del DNA risultanti comprendono basi danneggiate, disallineamenti, rotture a singolo e doppio filamento, legami incrociati tra e intrafilamenti e legami incrociati DNA-proteina (DPC). Una DPC si forma quando una proteina legata alla cromatina è intrappolata sul DNA attraverso un legame covalente. Le DPC sono indotte da lesioni endogene del DNA e metaboliti reattivi, nonché da agenti esogeni come chemioterapici e agenti reticolanti bifunzionali. In determinate circostanze, la disfunzione enzimatica può anche portare alla formazione di DPC2. La grande differenza negli induttori del DPC si traduce in una differenza nell'identità della proteina legata al covalente, nella regione cromosomica in cui si forma il DPC, nel tipo di struttura del DNA reticolato con la proteina e nella proprietà chimica del legame covalente tra la proteina e il DNA 2,3,4.
In base alla loro natura chimica, le DPC sono generalmente classificate in due gruppi: DPC enzimatiche e DPC non enzimatiche. Alcuni enzimi come le topoisomerasi, le glicosilasi e le metil/aciltransferasi agiscono formando intermedi covalenti enzima-DNA reversibili durante le loro normali reazioni catalitiche. Si tratta di intermedi enzima-DNA a vita breve e possono essere convertiti in DPC enzimatici a lunga vita dopo il loro intrappolamento da parte di agenti endogeni o esogeni, in particolare da parte di chemioterapici3. Le DPC della topoisomerasi sono tra le DPC enzimatiche più frequenti nelle cellule eucariotiche, che possono essere generate da inibitori della topoisomerasi clinicamente utili (topotecan e irinotecan per la topoisomerasi I [TOP1] ed etoposide e doxorubicina per la topoisomerasi II [TOP2]) e sono i principali meccanismi terapeutici di questi inibitori 5,6. Le DNA metiltransferasi (DNMT) 1, 3A e 3B sono il bersaglio della 5-aza-2'-deossicitidina (nota anche come decitabina) e formano DPC in seguito all'esposizione al farmaco7. Gli agenti reattivi, così come la luce ultravioletta e le radiazioni ionizzanti, inducono DPC non enzimatiche attraverso la reticolazione non specifica delle proteine al DNA. Le aldeidi reattive come l'acetaldeide e la formaldeide (FA) sono spesso generate come sottoprodotti dei metabolismi cellulari, tra cui la FA viene prodotta a concentrazioni micromolari durante il metabolismo del metanolo, la perossidazione lipidica e la demetilazione degli istoni. Inoltre, la FA è una sostanza chimica ad alto volume prodotta in tutto il mondo, a cui molte persone sono esposte sia dal punto di vista ambientale che professionale 8,9.
Sia le DPC enzimatiche che quelle non enzimatiche sono altamente tossiche per le cellule poiché i loro componenti proteici ingombranti ostacolano efficacemente quasi tutti i processi basati sulla cromatina, tra cui la replicazione e la trascrizione, portando all'arresto del ciclo cellulare e all'apoptosi se non riparati. Negli ultimi due decenni, la riparazione delle DPC è stata studiata con vigore e diverse proteine/vie sono state identificate come fattori chiave che riparano direttamente le DPC o modulano i loro processi di riparazione. Ad esempio, è stato ben stabilito che la proteolisi della massa proteica di un DPC è un passaggio fondamentale della riparazione del DPC e che la proteolisi può essere catalizzata dalle proteasi SPRTN 10,11,12,13,14, FAM111A15, GCNA 16,17 o dal complesso proteasoma26S 18,19,20,21,22 ,23,24,25,26,27 in modo dipendente dal tipo di cellula o dal contesto cellulare. L'identificazione e la caratterizzazione di queste proteasi si sono basate in gran parte sul complesso in vivo dell'enzima (ICE)28,29 e sul rapido approccio al recupero degli addotti del DNA (RADAR)30,31, entrambi i quali isolano le molecole di DNA e le loro proteine legate al covalente dalle proteine cellulari libere per consentire la rilevazione di DPC mediante slot-blot utilizzando anticorpi mirati alle proteine reticolate. Inoltre, il test di immunocolorazione del DNA con agarosio intrappolato (TARDIS) è stato utilizzato come mezzo per rilevare e quantificare le DPC a livello di singola cellula32. Attualmente, i ricercatori scelgono il test RADAR rispetto al test ICE per misurare i DPC, poiché il test ICE si basa sulla purificazione degli acidi nucleici utilizzando l'ultracentrifugazione a gradiente di cloruro di cesio, che richiede estremamente tempo, mentre il test RADAR precipita gli acidi nucleici utilizzando l'etanolo in un periodo molto più breve.
Negli ultimi anni, sono emerse prove crescenti che molteplici modificazioni post-traduzionali (PTM) sono coinvolte nella segnalazione e nel reclutamento delle proteasi 3,33,34,35 mirate a DPC. Ad esempio, è stato scoperto che sia TOP1- che TOP2-DPC sono coniugati da un piccolo modificatore simile all'ubiquitina (SUMO)-2/3 e poi SUMO-1 dalla ligasi SUMO E3 PIAS4, indipendentemente dalla replicazione e dalla trascrizione del DNA. Le modificazioni sequenziali di SUMO sembrano essere un bersaglio dell'ubiquitina, che si deposita nei TOP-DPC SUMOilati e forma catene polimeriche attraverso il suo residuo di lisina 48 da parte di un'ubiquitina ligasi mirata a SUMO chiamata RNF4. Successivamente, il polimero di ubiquitina suscita un segnale e recluta il proteasoma 26S nelle TOP-DPC23,36. La stessa via SUMO-ubiquitina ha recentemente dimostrato di agire sui DNMT1-DPC e sui complessi PARP-DNA per la loro riparazione37,38. Inoltre, è stato riportato che l'ubiquitilazione indipendente da SUMO da parte dell'ubiquitina E3 ligasi TRAIP innesca le DPC per la degradazione proteasomica in modo accoppiato alla replicazione39. Analogamente alla degradazione proteasomica delle TOP-DPC, la proteolisi delle DPC enzimatiche e non enzimatiche da parte della metalloproteasi accoppiata alla replicazione SPRTN richiede anche l'ubiquitilazione dei substrati delle DPC come meccanismo per coinvolgere SPRTN40,41. La delineazione del ruolo della SUMOilazione e dell'ubiquitilazione richiede l'individuazione di DPC marcati con questi PTM. Poiché il test ICE originale e il test RADAR si basano su apparecchiature slot-blot/dot-blot per misurare campioni di DNA non digeriti, nessuno di questi due saggi è in grado di risolvere e visualizzare specie DPC coniugate con PTM con pesi molecolari diversi. Per ovviare a questo problema, abbiamo digerito i campioni di DNA dopo la loro purificazione mediante precipitazione con etanolo e normalizzazione del campione con nucleasi micrococcica, un'endo-esonucleasi di DNA e RNA per rilasciare le proteine reticolate, che ci ha permesso di risolvere le proteine e i loro PTM covalenti con elettroforesi su gel di poliacrilammide di sodio dodecil-solfato (SDS-PAGE). L'elettroforesi ci ha permesso di rilevare e quantificare le DPC coniugate con PTM utilizzando anticorpi specifici che hanno come bersaglio le PTM. Inizialmente abbiamo chiamato questo metodo migliorato il saggio DUST, per evidenziare la sua robustezza nella rilevazione di TOP-DPC ubiquitilati e SUMOilati23. Successivamente, abbiamo ampliato l'uso del test per valutare quantitativamente l'ADP-ribosilazione delle TOP1-DPC in vivo, utilizzando anticorpi contro polimeri di poli-ADP-ribosio20.
Di seguito è presentato un protocollo dettagliato per il test che rileva e misura le DPC ubiquitilate, SUMOilate e ADP-ribosilate, che è stato ottimizzato per le TOP-DPC modificate indotte dai loro inibitori e le DPC non specifiche/non enzimatiche indotte da FA. Questo test isola le DPC coniugate con PTM lisando le cellule con un agente caotropico, precipitando il DNA con etanolo e rilasciando le proteine altrimenti reticolate e i loro modificatori con la nucleasi micrococcica. Le proteine altrimenti legate al DNA e i loro PTM vengono quantificati mediante immunoblotting utilizzando anticorpi specifici. Questo saggio apre una nuova strada per chiarire i meccanismi molecolari attraverso i quali la cellula ripara le DPC enzimatiche e non enzimatiche. In particolare, consente studi dettagliati dell'induzione e della cinetica dei PTM importanti per la regolazione della degradazione e della riparazione dei TOP-DPC, e quindi consente la scoperta di nuovi fattori come le ligasi E3 che dettano i PTM, così come gli inibitori che prendono di mira questi fattori. Poiché alcuni dei PTM responsabili della riparazione di TOP-DPC sono probabilmente coinvolti nella riparazione di DPC indotti da altri chemioterapici, come i farmaci a base di platino22, questo test ha anche il potenziale per l'applicazione alla scoperta di nuovi farmaci e all'ottimizzazione razionale di terapie combinatorie con inibitori della topoisomerasi o antineoplastici a base di platino nelle cellule dei pazienti per guidare i regimi di trattamento.
Protocol
1. Coltura cellulare e trattamento farmacologico nella linea cellulare del rene embrionale umano 293 (HEK293)
- Preparare il terreno di coltura, il terreno di coltura modificato di Dulbecco (DMEM), integrato con il 10% di siero fetale bovino, l'1% di L-glutammina 2 mM e 100 unità/mL di penicillina-streptomicina.
- Seminare 1 x 106 cellule in una piastra da 60 mm o una piastra da 6 pozzetti per condizione di trattamento più controllo.
- Il giorno successivo, trattare le cellule con induttori DPC a scelta.
- Per indurre le TOP1-DPC e la loro ubiquitilazione e SUMOilazione, aggiungere l'inibitore TOP1 camptotecina a 20 μM alle cellule e raccogliere le cellule a 20, 60 e 180 min.
- Per indurre TOP2α e β-DPC e la loro ubiquitilazione e SUMOilazione, esporre le cellule per aggiungere l'inibitore TOP2 etoposide a 200 μM alle cellule e raccogliere le cellule a 20, 60 e 180 min.
- Per indurre le DPC non enzimatiche e la loro ubiquitilazione e SUMOilazione, aggiungere FA a 1 mM e raccogliere le cellule 2 ore dopo l'esposizione.
- Per indurre la PARilazione delle TOP1-DPC, pretrattare le cellule per 1 ora per bloccare la dePARilazione con l'inibitore della poli(ADP-ribosio) glicoidrolasi (PARG) PDD00017273 a 10 μM, seguita da un co-trattamento con 20 μM di camptotecina per 20, 60 e 180 minuti.
2. Isolamento e normalizzazione di DNA contenente proteine reticolate
- Aspirare rapidamente il terreno con una pipetta di aspirazione dopo il trattamento e sciacquare le cellule con soluzione salina tamponata con fosfato 1x ghiacciata (PBS). Lisare immediatamente le cellule in 600 μL di reagente DNAzol contenente 1 inibitore del cocktail di proteasi, 1 mM di ditiotreitolo (DTT) e 20 mM di N-etilmaleimmide (inibitore degli enzimi deSUMOilanti e deubiquitilanti).
- Agitare lentamente la piastra su una piattaforma vibrante per 10 minuti a 4 °C.
- Aggiungere 1/2 volume di etanolo freddo al 100% (0,3 ml) direttamente sulla piastra e ripetere il passaggio 2.2 fino a quando l'aggregato di acido nucleico opaco non diventa visibile. Trasferire il lisato cellulare in una provetta per microcentrifuga da 1,5 mL e sottoporre la provetta a centrifugazione alla massima velocità (20.000 x g) per 15 minuti a 4 °C per far precipitare l'acido nucleico e le sue proteine reticolate.
- Aspirare il surnatante utilizzando una pipetta di aspirazione e lavare il pellet di acido nucleico in 1 mL di etanolo al 75%, seguito da 2 minuti di centrifugazione 20.000 x g a 4 °C.
- Aspirare il surnatante, centrifugarlo alla stessa velocità e rimuovere il liquido rimanente utilizzando una pipetta P20. Asciugare il pellet all'aria per 5 min.
- Sciogliere rapidamente il pellet di acido nucleico in 0,1 mL di ddH2O. Risospendere il pellet mediante pipettaggio ripetuto, quindi incubare a bagnomaria a 37 °C fino a quando il pellet non si gonfia fino a diventare almeno tre volte più grande (circa 30 min).
- Sonicare i campioni con una sonda del processore a ultrasuoni con un'ampiezza del 30% per 10 secondi per dissolvere completamente il pellet.
- Fase facoltativa: trattare i campioni con una miscela di RNasi A/T1 (10 μg di RNasi A e 25 U di RNasi T1) e incubare a 37 °C per 15 minuti. Aggiungere 1/10 di volume di acetato di sodio 3 M e due volumi di etanolo ghiacciato al 100% nella provetta, seguito da centrifugazione a 20.000 x g per 10 minuti per recuperare il DNA. Rimuovere il surnatante e sciogliere il DNA precipitato in 0,1 mL di ddH2O.
- Passaggio facoltativo: centrifugare il campione per 5 minuti a 20.000 x g e trasferire il surnatante in una nuova provetta.
- Quantificare la concentrazione di DNA utilizzando uno spettrometro ultravioletto-visibile (UV-Vis). La resa tipica del DNA è di circa 600-800 ng/μL. Il rapporto A260/A280 deve essere ridotto da 2,0-2,1 a 1,8-1,9 dopo la rimozione dell'RNA.
- Regolare la concentrazione del DNA a 400-500 ng/μL in 0,12 mL di ddH 2 O. Trasferire 20 μL del campione in una nuova provetta per microcentrifuga come controllo del carico di DNA non digerito (fare riferimento al passaggio2.4).
- Per digerire il DNA disciolto nei restanti 100 μL di ddH 2 O, aggiungere al campione 2.000 unità gel di nucleasi micrococcica insieme a 1/10 di volume (~11 μL) di tampone di reazione della nucleasi micrococcica di calcio 10x. Incubare a 37 °C per 30 min.
3. Western blotting di campioni di DNA digerito
- Aggiungere 4 tamponi per campioni Laemmli, quindi far bollire il campione per 5 minuti.
- Caricare 5-6 μg di campione digerito (~15 μL) su gel di poliacrilammide al 4%-20%, seguito da SDS-PAGE42 per risolvere DPC non modificati e coniugati con PTM.
- Per rilevare le specie DPC non enzimatiche indotte da FA, incubare il gel con la colorazione blu Coomassie per una notte a temperatura ambiente. Lavare il gel con ddH 2 O per2ore e acquisire un'immagine utilizzando un sistema di imaging.
- Trasferire il gel e incubare le membrane per una notte a 4 °C con opportune diluizioni dell'anticorpo primario in tampone bloccante.
- Per rilevare l'ubiquitilazione, effettuare una diluizione 1:100 dell'anticorpo anti-ubiquitina.
- Per rilevare la modifica di SUMO-1 o SUMO-2/3, effettuare una diluizione 1:250 dell'anticorpo anti-SUMO-1 o anti-SUMO-2/3.
- Per rilevare l'ADP-ribosilazione, effettuare una diluizione 1:500 dell'anticorpo anti-PAR.
- Per rilevare le DPC totali TOP1-, TOP2α- o TOP2β-DPC, effettuare una diluizione 1:500 degli anticorpi anti-TOP1, anti-TOP2α o anti-TOP2β.
NOTA: Fare riferimento alla Tabella dei materiali per i dettagli sulla diluizione degli anticorpi.
- Incubare una membrana lavata con 1x PBS-T (0,1% tween 20) con un anticorpo secondario diluito 5.000 volte in tampone bloccante per 60 minuti a temperatura ambiente.
- Sviluppare la membrana con il reagente a chemiluminescenza potenziata (ECL) e acquisire un'immagine utilizzando il sistema di imaging.
4. Slot-blotting di campioni di DNA non digeriti
- Diluire il campione di DNA non digerito da 20 μL in 180 μL di tampone fosfato di sodio (25 mM, pH 6,6).
- Tagliare la membrana di nitrocellulosa (0,45 μm) ed equilibrare per 5 minuti nel tampone fosfato di sodio.
- Assemblare l'apparecchio slot-blot secondo le istruzioni del produttore e collegarlo a un sistema di aspirazione.
- Lavare i pozzetti con tampone fosfato di sodio applicando il vuoto. Assicurarsi che non vi siano perdite dai pozzetti.
- Arrestare il vuoto e caricare 200 μL di DNA per campione (1 μg). Riempire i pozzetti vuoti con 200 μL di tampone fosfato di sodio.
- Applicare il vuoto.
- Quando tutti i pozzetti sono completamente vuoti, arrestare il vuoto, caricare 200 μL di tampone fosfato di sodio in ciascun pozzetto e ripetere il passaggio 4.6.
- Recuperare la membrana e bloccare con tampone bloccante al 5% per 0,5 ore a temperatura ambiente.
- Sonda con anticorpo anti-DNA a doppio filamento (dsDNA) a diluizione 1:5.000 durante la notte a 4 °C.
- Lavare 3 volte con 1x PBS-T e incubare con anticorpo secondario anti-topo legato alla perossidasi di rafano (HRP) diluito 1:5.000.
- Sviluppare la membrana con il reagente a chemiluminescenza potenziata (ECL) e acquisire un'immagine utilizzando il sistema di imaging.
5. Analisi densitometrica
- Utilizzando ImageJ, calcolare il rapporto tra l'intensità di ciascuna banda/striscio rispetto all'intensità della fessura di DNA non digerito e normalizzare il rapporto con quello delle cellule senza/prima del trattamento farmacologico.
Representative Results
I risultati rappresentativi presentati nella Figura 1 mostrano la formazione e la cinetica delle TOP1-DPC indotte da farmaci e la loro SUMOilazione e ubiquitilazione. TOP1 ha scisso un filamento del duplex di DNA e ha formato un intermedio covalente enzima-DNA, chiamato complesso di scissione TOP1 (TOP1cc). Il trattamento della camptotecina (CPT), un inibitore di TOP1, legato e stabilizzato a TOP1cc, che porta alla formazione di TOP1-DPC a lunga vita. È stato osservato che i TOP1-DPC sono stati indotti e hanno raggiunto il picco 20 minuti dopo l'esposizione al CPT. Allo stesso tempo, i TOP1-DPC sono stati modificati da SUMO-2/3, che ha raggiunto il picco anche 20 minuti dopo il trattamento con CPT. Poiché SUMO-2 e SUMO-3 condividono il 95% dell'identità di sequenza, l'anticorpo non distingue l'uno dall'altro. A 60 minuti, i TOP1-DPC e la loro modificazione SUMO-2/3 sono diminuiti, accompagnati dal culmine della loro modificazione SUMO-1 e dell'ubiquitilazione. Dopo il trattamento farmacologico di 60 minuti, i livelli di modifica e ubiquitilazione di TOP1-DPC SUMO-1 hanno iniziato a diminuire. Nei mammiferi, gli isoenzimi TOP2 α e β agiscono introducendo una rottura del doppio filamento del DNA, nonché attraverso la formazione di un complesso covalente enzima-DNA transitorio e reversibile (TOP2cc). Gli inibitori di TOP2, come l'etoposide (ETOP), convertono TOP2cc in TOP2-DPC e ne inducono la SUMOilazione e l'ubiquitilazione. Analogamente alla cinetica dei TOP1-DPC e dei loro PTM, i TOP2α- e β-DPC e la loro modifica SUMO-2/3 hanno raggiunto un picco a 20 min, poi hanno iniziato a diminuire; nel frattempo, le loro modifiche SUMO-1 e ubiquitina hanno raggiunto il picco a 60 minuti (Figura 2). È stato dimostrato che la clearance delle TOP-DPC deriva dalla degradazione proteasomica e la clearance della SUMOilazione e dell'ubiquitilazione delle TOP-DPC è probabilmente dovuta al riciclaggio mediante deSUMOilazione e deubiquitilazione, rispettivamente, da parte dei loro enzimi di inversione. Gli esperimenti nella Figura 3 hanno esaminato le DPC non enzimatiche indotte da FA e i loro PTM. È stato osservato che i DPC e i loro SUMO-2/3, SUMO-1 e ubiquitilazione si sono formati e accumulati in modo dose-dipendente da FA. Infine, la PARilazione delle TOP1-DPC è stata rilevata quantitativamente con un anticorpo anti-PAR utilizzando lo stesso metodo (Figura 4). La PARilazione TOP1-DPC non era rilevabile a meno che non fosse stato aggiunto un inibitore di PARG alla cellula, suggerendo che la PARilazione traspira prontamente ed è altamente dinamica. Coerentemente con la scoperta precedente, l'inibizione della dePARilazione da parte di PARGi sembrava accumulare TOP1-DPC, probabilmente bloccando la degradazione proteolitica.
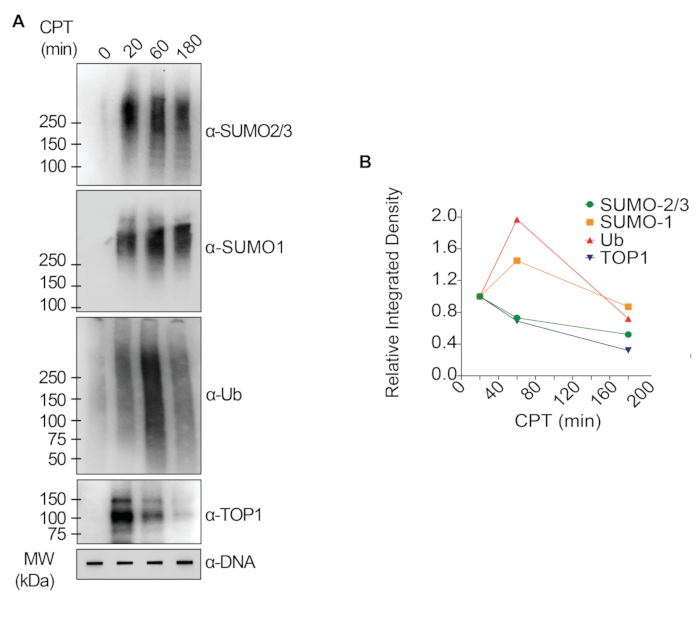
Figura 1: Analisi quantitative della formazione e della cinetica delle TOP1-DPC e della loro SUMOilazione e ubiquitilazione dopo il trattamento con CPT in cellule HEK293. (A) Le cellule HEK293 sono state trattate con 20 μM CPT per i periodi di tempo indicati. I lisati cellulari sono stati raccolti e sottoposti al test RADAR modificato e al western blotting con gli anticorpi indicati. I campioni di DNA non digeriti sono stati sottoposti a slot-blotting utilizzando l'anticorpo anti-dsDNA come controllo di carico. (B) Le intensità di banda sono state quantificate con il software ImageJ e tracciate con il software Prism. Fare clic qui per visualizzare una versione più grande di questa figura.
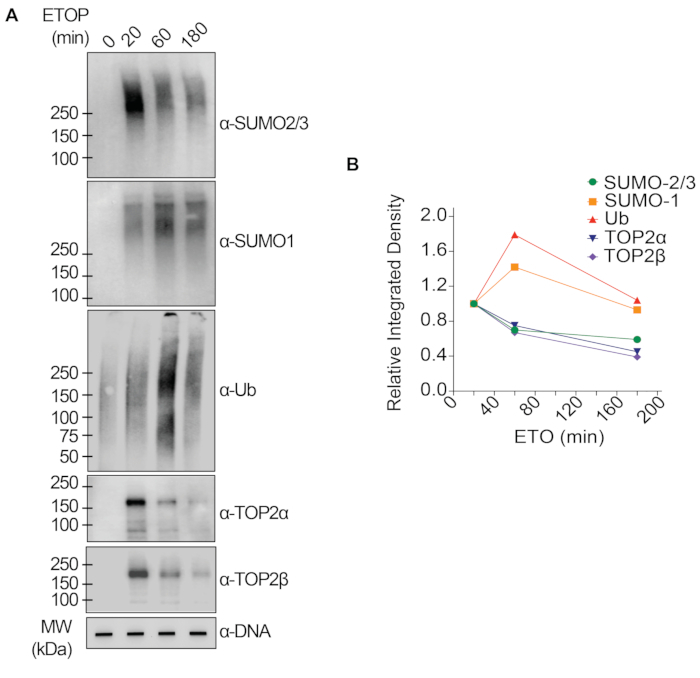
Figura 2: Analisi quantitative della formazione e della cinetica delle TOP2-DPC e della loro SUMOilazione e ubiquitilazione dopo il trattamento con ETOP in cellule HEK293. (A) Le cellule HEK293 sono state trattate con 200 μM di ETOP per i periodi di tempo indicati. I lisati cellulari sono stati raccolti e sottoposti al test RADAR modificato e al western blotting con gli anticorpi indicati. I campioni di DNA non digeriti sono stati sottoposti a slot-blotting utilizzando l'anticorpo anti-dsDNA come controllo di carico. (B) Le intensità di banda sono state quantificate con il software ImageJ e tracciate con il software Prism. Fare clic qui per visualizzare una versione più grande di questa figura.
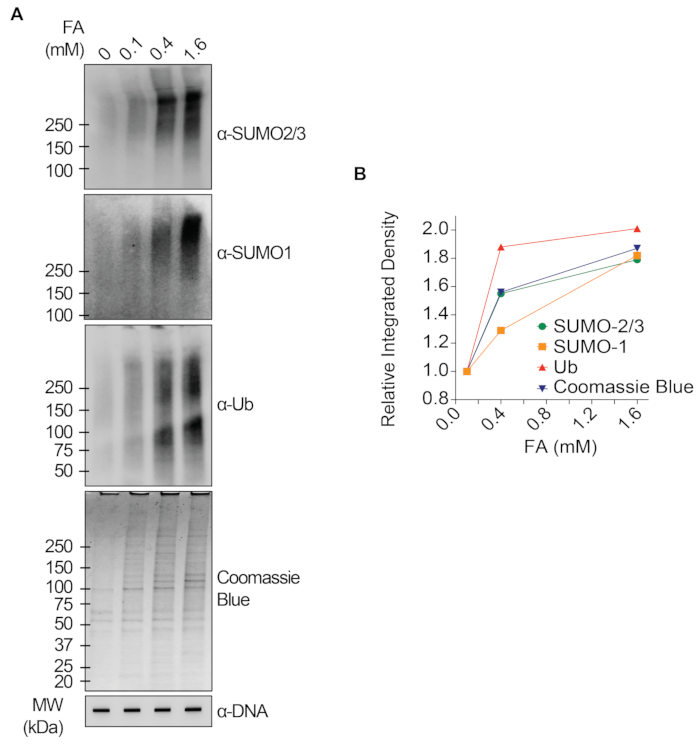
Figura 3: Analisi quantitative delle DPC non enzimatiche e della loro SUMOilazione e ubiquitilazione dopo il trattamento con FA in cellule HEK293. (A) Le cellule HEK293 sono state trattate con FA delle concentrazioni indicate per 2 ore. I lisati cellulari sono stati raccolti e sottoposti al test RADAR modificato e al western blotting con gli anticorpi indicati. I campioni di DNA non digeriti sono stati sottoposti a slot-blotting utilizzando l'anticorpo anti-dsDNA come controllo di carico. (B) Le intensità di banda sono state quantificate con il software ImageJ e tracciate con il software Prism. Fare clic qui per visualizzare una versione più grande di questa figura.
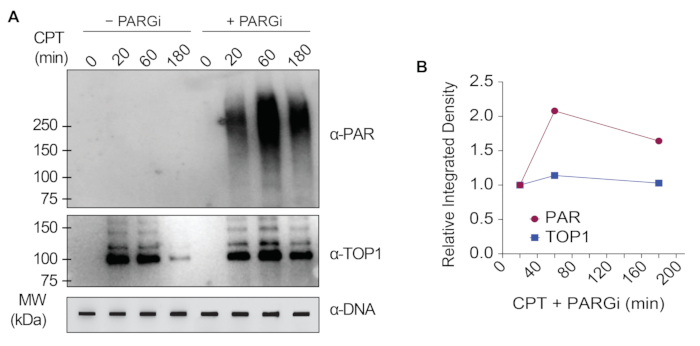
Figura 4: Analisi quantitative delle TOP1-DPC e della loro PARilazione dopo il trattamento con CPT in cellule HEK293. (A) Le cellule HEK293 sono state pretrattate con 10 μM di PARGi per 1 ora e poi co-trattate con CPT per i periodi di tempo indicati. I lisati cellulari sono stati raccolti e sottoposti al test RADAR modificato e al western blotting con gli anticorpi indicati. I campioni di DNA non digeriti sono stati sottoposti a slot-blotting utilizzando l'anticorpo anti-dsDNA come controllo di carico. (B) Le intensità di banda sono state quantificate con il software ImageJ e tracciate con il software Prism. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussion
Il metodo descritto consente la misura dei legami crociati enzimatici e non enzimatici DNA-proteina in cellule di mammifero ed è l'unico approccio adatto per studiarne l'ubiquitilazione, la SUMOilazione e l'ADP-ribosilazione. Lo slot-blotting dopo il test ICE o RADAR consente la rapida rilevazione di specifiche DPC enzimatiche come le TOP-DPC utilizzando i loro anticorpi. Tuttavia, un avvertimento a questo metodo è la sua incapacità di separare proteine di diversi pesi molecolari, rendendo impossibile determinare le dimensioni delle DPC coniugate con PTM. Il metodo descritto risolve il problema rilasciando proteine reticolate con nucleasi micrococcica, che degrada il DNA in oligonucleotidi con 3'-fosfati terminali, consentendo così la completa separazione delle proteine (coniugate con oligonucleotidi) mediante SDS-PAGE. I DPC modificati con monomeri e polimeri di ubiquitina, SUMO o ADP-ribosio di diverse dimensioni possono quindi essere visualizzati e quantificati da anticorpi mirati a questi PTM, consentendo un'indagine dettagliata della loro formazione e cinetica. Per garantire la riproducibilità e calcolare la significatività statistica, sono necessarie repliche biologiche degli esperimenti.
Uno dei problemi più comuni di questo test è la bassa resa del DNA dopo la precipitazione dell'etanolo. Da un lato, la resa del DNA può essere aumentata con più materiale di partenza (cellule). D'altra parte, l'incubazione di lisati cellulari con etanolo in una piastra piana anziché in una provetta Eppendorf può migliorare notevolmente l'aggregazione delle molecole di DNA e quindi facilitarne la precipitazione. Segnali aspecifici osservati in campioni senza trattamenti farmacologici possono indicare una contaminazione proteica non covalente. In questo caso, si può prendere in considerazione il lavaggio dei pellet di DNA con un tampone ad alto contenuto di sale per rimuovere i contaminanti prima della sonicazione. Si raccomanda inoltre di centrifugare i campioni di DNA dopo la sonicazione e la digestione delle nucleasi micrococciche e di scartare quelli insolubili. In caso di segnale scarso o assente, si possono tentare diverse potenziali soluzioni. In primo luogo, è possibile aumentare la quantità di carico di DNA per SDS-PAGE e immunoblotting. Per rendere rilevabili le specie di DPC SUMOilate e ubiquitilate, si raccomanda di caricare almeno 4 μg di DNA sul gel. In secondo luogo, è possibile aumentare le concentrazioni del farmaco per indurre livelli più elevati di DPC e PTM associati. In terzo luogo, si suggerisce di incubare i blot con anticorpi primari per un altro giorno se le bande/strisci sembrano essere deboli. Un'incubazione di 2 giorni può potenziare significativamente il segnale e quindi ridurre la variabilità biologica da esperimenti indipendenti23. Lo stripping della membrana per la ri-colorazione comporta inevitabilmente la perdita di una certa quantità di specie DPC coniugate con PTM che sono già in bassa abbondanza. Pertanto, si consiglia vivamente di eseguire gel separati per il rilevamento dell'ubiquitina e del SUMO piuttosto che sondare nuovamente un blot. Inoltre, i pellet di DNA devono essere lavati con etanolo al 75% per rimuovere il restante sale di guanidina contenente DNAzol prima della dissoluzione in H2O o altri solventi, che altrimenti provoca la cristallizzazione del campione dopo l'aggiunta del tampone di carico Laemmli.
Il flusso di lavoro del metodo descritto è molto più efficiente in termini di tempo rispetto all'ingombrante test ICE, in quanto si basa sulla rapida precipitazione dell'etanolo invece che sull'ultracentrifugazione del cloruro di cesio, che richiede molto tempo, per isolare il DNA genomico. A un prezzo, la purificazione a base di etanolo comporta una bassa quantità di contaminanti proteici che normalmente sono trascurabili per l'immunorilevazione. Tuttavia, quando si tratta di studi analitici, come l'analisi proteomica basata sulla spettrometria di massa o il sequenziamento di nuova generazione che richiedono accuratezza e precisione, la centrifugazione a gradiente di densità di cesio-cloruro è ancora un approccio più affidabile per isolare il DNA puro e ad alta abbondanza. Questo metodo può anche essere potenzialmente applicato alla profilazione di siti di modificazione su proteine reticolate e alla determinazione di tipi di linkage di poli-ubiquitilazione e poli-SUMOilazione utilizzando metodi appropriati basati sulla spettrometria di massa.
Da notare che questo test consente l'identificazione e la caratterizzazione dei fattori che regolano i PTM per la riparazione delle DPC. Ad esempio, i metodi di screening imparziali ad alto rendimento (interferenza dell'RNA e CRISPR) sono strumenti potenti per scoprire le ubiquitina E3 ligasi, le SUMO E3 ligasi e i loro cofattori associati che mitigano la citotossicità degli induttori DPC. Il metodo descritto consente la convalida molecolare di queste proteine determinando se aiutano le cellule a sopravvivere agli induttori delle DPC riparando le DPC. Con questo protocollo possono essere convalidati anche nuovi inibitori di piccole molecole che prendono di mira queste proteine identificati, ad esempio, mediante screening virtuale. Dato che gli inibitori della topoisomerasi sono tra i chemioterapici più prescritti, questo robusto test può essere sviluppato come strumento per lo sviluppo di farmaci che agiscono in sinergia con gli inibitori clinici della topoisomerasi.
Disclosures
L'autore dichiara di non avere interessi contrastanti.
Acknowledgements
Questo lavoro è stato in parte sostenuto dal National Cancer Institute Center for Cancer ResearchExcellence in Postdoctoral Research Transition Award.
Materials
| Name | Company | Catalog Number | Comments |
| 10x Phosphate buffered saline (PBS) | Thermo Fisher | 70011069 | |
| 4–20% precast polyacrylamide gel | Bio-Rad | 4561096 | |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| AcquaStain (coomassie blue) | Bulldog Bio | AS001000 | |
| anti-dsDNA (mouse monoclonal) | Abcam | 27156 | 1: 5,000 dilution is recommended |
| anti-PAR (mouse monoclonal) | R&D systems | 4335-MC-100 | 1: 500 dilution is recommended |
| anti-SUMO-1(rabbit monoclonal) | Cell Signaling Technology | 4940 | 1: 250 dilution is recommended |
| anti-SUMO-2/3 (rabbit monoclonal) | Cell Signaling Technology | 4971 | 1: 250 dilution is recommended |
| anti-TOP1 (mouse monoclonal) | BD Biosciences | 556597 | 1: 500 dilution is recommended |
| anti-TOP2α (mouse monoclonal) | Santa Cruz Biotechnology | SC-365799 | 1: 250 dilution is recommended |
| anti-TOP2β (mouse monoclonal) | Santa Cruz Biotechnology | SC-25330 | 1: 250 dilution is recommended |
| anti-ubiquitin (mouse monoclonal) | Santa Cruz Biotechnology | SC-8017 | 1: 100 dilution is recommended |
| Calcium chloride | Sigma-Aldrich | 499609 | Used for micrococcal nuclease digestion |
| Camptothecin | Sigma-Aldrich | PHL89593 | |
| ChemiDo MP imaging system | Bio-Rad | 12003154 | |
| Disodium phosphate | Sigma-Aldrich | 5438380100 | Used to make sodium phosphate buffer |
| DNAzol | Thermo Fisher | 10503027 | |
| DTT (dithiothreitol) | Thermo Fisher | R0861 | |
| Dulbecco's modified eagle's medium | Sigma-Aldrich | 11965084 | |
| Ethyl alcohol, 200 proof | Sigma-Aldrich | E7023 | |
| Etoposide | Sigma-Aldrich | 1268808 | |
| Formaldehyde | Sigma-Aldrich | 47608 | |
| Graphpad Prism Software | GraphStats | Prism 9.0.0 | |
| HRP-linked Mouse IgG | Cytiva | NA931 | 1: 5,000 dilution is recommended |
| HRP-linked Rabbit IgG | Cytiva | NA934 | 1: 5,000 dilution is recommended |
| ImageJ Software | NIH, USA | ImageJ 1.53e | |
| L-Glutamine | Fisher Scientific | 25030081 | |
| Maximum sensitivity ECL substrate | Thermo Fisher | 34095 | |
| Micrococcal nuclease | New England BioLabs | M0247S | |
| Monosodium phosphate | Sigma-Aldrich | S3139 | Used to make sodium phosphate buffer |
| NanoDrop 2000 spectrophotometer | Thermo Scientific | ND-2000 | |
| N-ethylmaleimide | Thermo Fisher | 23030 | DeSUMOylation/deubiquitylation inhibitor |
| Nitrocellulose membrane, 0.45 µm | Bio-Rad | 1620115 | |
| Non-fat dry milk | Bio-Rad | 1706404XTU | |
| PDD00017273 | Selleckchem | S8862 | Poly(ADP-ribose) glycohydrolase inhibitor |
| Penicillin-Streptomycin | Thermo Fisher | 15140122 | |
| Protease inhibitor cocktail | Thermo Fisher | 78430 | |
| Q700 sonicator | Qsonica | Q700-110 | |
| Ready-to-assemble PVDF transfer kit | Bio-Rad | 1704274 | |
| Slot-blot apparatus | Bio-Rad | 1706542 | |
| Slot-blot filter paper | Bio-Rad | 1620161 | |
| Trans-Blot turbo transfer system | Bio-Rad | 1704150 | |
| Tris/Glycine/SDS electrophoresis buffer | Bio-Rad | 1610732 | |
| Tween-20 | Sigma-Aldrich | P3179 | |
| Vertical electrophoresis cell | Bio-Rad | 1658004 |
References
- Jackson, S. P., Bartek, J. The DNA-damage response in human biology and disease. Nature. 461 (7267), 1071-1078 (2009).
- Klages-Mundt, N. L., Li, L. Formation and repair of DNA-protein crosslink damage. Science China. Life Sciences. 60 (10), 1065-1076 (2017).
- Weickert, P., Stingele, J. DNA-protein crosslinks and their resolution. Annual Review of Biochemistry. 91, 157-181 (2022).
- Tretyakova, N. Y., Groehler, A., Ji, S. DNA-Protein cross-links: formation, structural identities, and biological outcomes. Accounts of Chemical Research. 48 (6), 1631-1644 (2015).
- Pommier, Y., Nussenzweig, A., Takeda, S., Austin, C. Human topoisomerases and their roles in genome stability and organization. Nature Reviews Molecular Cell Biology. 23 (6), 407-427 (2022).
- Pommier, Y., Sun, Y., Huang, S. N., Nitiss, J. L. Roles of eukaryotic topoisomerases in transcription, replication and genomic stability. Nature Reviews Molecular Cell Biology. 17 (11), 703-721 (2016).
- Ruggiano, A., Ramadan, K. DNA-protein crosslink proteases in genome stability. Communications Biology. 4 (1), 11 (2021).
- Hoffman, E. A., Frey, B. L., Smith, L. M., Auble, D. T. Formaldehyde crosslinking: a tool for the study of chromatin complexes. The Journal of Biological Chemistry. 290 (44), 26404-26411 (2015).
- Moretton, A., Loizou, J. I. Interplay between cellular metabolism and the DNA damage response in cancer. Cancers. 12 (8), 2051 (2020).
- Stingele, J., Schwarz, M. S., Bloemeke, N., Wolf, P. G., Jentsch, S. A DNA-dependent protease involved in DNA-protein crosslink repair. Cell. 158 (2), 327-338 (2014).
- Maskey, R. S., et al. Spartan deficiency causes accumulation of topoisomerase 1 cleavage complexes and tumorigenesis. Nucleic Acids Research. 45 (8), 4564-4576 (2017).
- Stingele, J., et al. Mechanism and regulation of DNA-protein crosslink repair by the DNA-dependent metalloprotease SPRTN. Molecular Cell. 64 (4), 688-703 (2016).
- Vaz, B., et al. Metalloprotease SPRTN/DVC1 orchestrates replication-coupled DNA-protein crosslink repair. Molecular Cell. 64 (4), 704-719 (2016).
- Lopez-Mosqueda, J., et al. SPRTN is a mammalian DNA-binding metalloprotease that resolves DNA-protein crosslinks. eLife. 5, e21491 (2016).
- Kojima, Y., et al. FAM111A protects replication forks from protein obstacles via its trypsin-like domain. Nature Communications. 11 (1), 1318 (2020).
- Dokshin, G. A., et al. GCNA interacts with spartan and topoisomerase II to regulate genome stability. Developmental Cell. 52 (1), 53-68 (2020).
- Borgermann, N., et al. SUMOylation promotes protective responses to DNA-protein crosslinks. The EMBO Journal. 38 (8), e101496 (2019).
- Sun, Y., Zhang, Y., Schultz, C. W., Pommier, Y., Thomas, A. CDK7 inhibition synergizes with topoisomerase I inhibition in small cell lung cancer cells by inducing ubiquitin-mediated proteolysis of RNA polymerase II. Molecular Cancer Therapeutics. 21 (9), 1430-1438 (2022).
- Sun, Y., et al. Requirements for MRN endonuclease processing of topoisomerase II-mediated DNA damage in mammalian cells. Frontiers in Molecular Biosciences. 9, 1007064 (2022).
- Sun, Y., et al. PARylation prevents the proteasomal degradation of topoisomerase I DNA-protein crosslinks and induces their deubiquitylation. Nature Communications. 12 (1), 5010 (2021).
- Sun, Y., et al. Excision repair of topoisomerase DNA-protein crosslinks (TOP-DPC). DNA Repair. 89, 102837 (2020).
- Sun, Y., Saha, L. K., Saha, S., Jo, U., Pommier, Y. Debulking of topoisomerase DNA-protein crosslinks (TOP-DPC) by the proteasome, non-proteasomal and non-proteolytic pathways. DNA Repair. 94, 102926 (2020).
- Sun, Y., et al. A conserved SUMO pathway repairs topoisomerase DNA-protein cross-links by engaging ubiquitin-mediated proteasomal degradation. Science Advances. 6 (46), (2020).
- Saha, S., et al. DNA and RNA cleavage complexes and repair pathway for TOP3B RNA- and DNA-protein crosslinks. Cell Reports. 33 (13), 108569 (2020).
- Swan, R. L., Cowell, I. G., Austin, C. A. Mechanisms to repair stalled topoisomerase II-DNA covalent complexes. Molecular Pharmacology. 101 (1), 24-32 (2022).
- Swan, R. L., Poh, L. L. K., Cowell, I. G., Austin, C. A. Small molecule inhibitors confirm ubiquitin-dependent removal of TOP2-DNA covalent complexes. Molecular Pharmacology. 98 (3), 222-233 (2020).
- Sciascia, N., et al. Suppressing proteasome mediated processing of topoisomerase II DNA-protein complexes preserves genome integrity. eLife. 9, e53447 (2020).
- Anand, J., Sun, Y., Zhao, Y., Nitiss, K. C., Nitiss, J. L. Detection of topoisomerase covalent complexes in eukaryotic cells. Methods in Molecular Biology. 1703, 283-299 (2018).
- Subramanian, D., Furbee, C. S., Muller, M. T. ICE bioassay. Isolating in vivo complexes of enzyme to DNA. Methods in Molecular Biology. 95, 137-147 (2001).
- Nitiss, J. L., Kiianitsa, K., Sun, Y., Nitiss, K. C., Maizels, N. Topoisomerase assays. Current Protocols. 1 (10), e250 (2021).
- Kiianitsa, K., Maizels, N. A rapid and sensitive assay for DNA-protein covalent complexes in living cells. Nucleic Acids Research. 41 (9), e104 (2013).
- Cowell, I. G., Tilby, M. J., Austin, C. A. An overview of the visualisation and quantitation of low and high MW DNA adducts using the trapped in agarose DNA immunostaining (TARDIS) assay. Mutagenesis. 26 (2), 253-260 (2011).
- Leng, X., Duxin, J. P. Targeting DNA-protein crosslinks via post-translational modifications. Frontiers in Molecular Biosciences. 9, 944775 (2022).
- Kuhbacher, U., Duxin, J. P. How to fix DNA-protein crosslinks. DNA Repair. 94, 102924 (2020).
- Stingele, J., Bellelli, R., Boulton, S. J. Mechanisms of DNA-protein crosslink repair. Nature Reviews Molecular Cell Biology. 18 (9), 563-573 (2017).
- Sun, Y., Nitiss, J. L., Pommier, Y. SUMO: A Swiss army knife for eukaryotic topoisomerases. Frontiers in Molecular Biosciences. 9, 871161 (2022).
- Krastev, D. B., et al. The ubiquitin-dependent ATPase p97 removes cytotoxic trapped PARP1 from chromatin. Nature Cell Biology. 24 (1), 62-73 (2022).
- Liu, J. C. Y., et al. Mechanism and function of DNA replication-independent DNA-protein crosslink repair via the SUMO-RNF4 pathway. The EMBO Journal. 40 (18), e107413 (2021).
- Larsen, N. B., et al. Replication-coupled DNA-protein crosslink repair by SPRTN and the proteasome in Xenopus egg extracts. Molecular Cell. 73 (3), 574-588 (2019).
- Zhao, S., et al. A ubiquitin switch controls autocatalytic inactivation of the DNA-protein crosslink repair protease SPRTN. Nucleic Acids Research. 49 (2), 902-915 (2021).
- Ruggiano, A., et al. The protease SPRTN and SUMOylation coordinate DNA-protein crosslink repair to prevent genome instability. Cell Reports. 37 (10), 110080 (2021).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. North American Journal of Medical Sciences. 4 (9), 429-434 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved