Real-Time Measurements of Calcium and Contractility Parameters in Human Induced Pluripotent Stem Cell-Derived Cardiomyocytes
In This Article
Summary
Here, an established method is described to perform contractility and calcium measurements in human induced pluripotent stem cell-derived cardiomyocytes using an optics-based platform. This platform enables researchers to study the effect of mutations and the response to various stimuli in a rapid and reproducible manner.
Abstract
Human induced pluripotent stem cell-derived cardiomyocytes (hiPSC-CMs) represent a powerful tool for studying mutation-mediated changes in cardiomyocyte function and defining the effects of stressors and drug interventions. In this study, it is demonstrated that this optics-based system is a powerful tool to assess the functional parameters of hiPSC-CMs in 2D. By using this platform, it is possible to perform paired measurements in a well-preserved temperature environment on different plate layouts. Moreover, this system provides researchers with instant data analysis.
This paper describes a method for measuring the contractility of unmodified hiPSC-CMs. Contraction kinetics are measured at 37 °C based on pixel correlation changes relative to a reference frame taken at relaxation at a 250 Hz sampling frequency. Additionally, simultaneous measurements of intracellular calcium transients can be acquired by loading the cell with a calcium-sensitive fluorophore, such as Fura-2. Using a hyperswitch, ratiometric calcium measurements can be performed on a 50 µm diameter illumination spot, corresponding to the area of the contractility measurements.
Introduction
Heart failure is the leading cause of death worldwide. In 2019, cardiovascular disease caused 18.6 million deaths globally, which reflects a 17.1% increase over the past decade1. Despite the efforts of researchers to identify drug targets to prevent and cure heart failure, patient outcomes are still poor2. The difference in the pathophysiology of animal models with respect to humans could be one of the underlying factors in the limited success for the optimization of heart failure therapy3. Additional human-like models are warranted to model disease and test the toxicity and effectiveness of novel drug compounds.
Human induced pluripotent stem cell-derived cardiomyocytes (hiPSC-CMs) represent a powerful tool to define cellular pathomechanisms induced by stressors, ischemia, altered metabolism, or pathogenic gene variants, and the effectiveness and toxicity of drug interventions4. To define effects on the functional properties of hiPSC-CMs, a high-speed system that measures the systolic and diastolic properties of cellular contractions in an unbiased and reproducible manner is warranted. This overall goal of the current study is to demonstrate that an optics-based system is a powerful tool to perform real-time analyses of the functional parameters of hiPSC-CMs.
Currently, there are multiple platforms to evaluate the contractility of hiPSC-CMs. However, current systems either offer a slow readout, or the required number of cells might be a challenge. Label-free video measurement systems5,6 rely on post-hoc analysis of videos, which requires a lot of storage and lacks direct feedback during video acquisition. In addition, sufficient temporal and spatial resolution is hard to achieve, and may result in undersampling. Other methods to determine cardiomyocyte properties, such as clustered regularly interspaced short palindromic repeats (CRISPR)/Cas9-edited hiPSC-CMs7 with fluorescent reporters might interfere with the gene stability of the cells and require specialized laboratory expertise.
To overcome the limitations mentioned above, a unique optics-based measurement system was developed and introduced in this study. This platform enables contractility measurements on unmodified hiPSC-CMs by simply replating them on any required plate format, without any limitation in plate size. Moreover, real-time measurements allow direct observation and analyses of the functional parameters of hiPSC-CMs, and thereby provide an experimental setting to instantly adjust and optimize protocols. Moreover, the location of each measurement is stored, which enables paired measurements on the same sample, thereby increasing the power of the experiments.
To demonstrate the optics-based system, contractility measurements were performed on a control hiPSC-CM line. This control hiPSC line was generated from the dermal fibroblast of a healthy male donor with a normal karyotype8. Contraction kinetics were measured at 37 °C, based on pixel correlation changes relative to a reference frame taken during relaxation at a 250 Hz sampling frequency. As the exact start of contraction cannot always be unambiguously determined, the time point at which 20% of the peak height was reached (time to peak 20%) was taken as the starting point for measurements of time to peak. By doing so, less variability was found for this parameter within one sample. Similarly, as the exact moment at which the signal returns to baseline is difficult to assess, the time it took to reach 80% of the return to baseline from peak (time to baseline 80% ) was used to describe the relaxation time.
Overall contractility measurements included resting beating frequencies, the time from 20% peak to peak contraction (TP.Con), and the time from peak contraction to 80% of baseline (TB.Con80) (Figure 1B). To test the effect of a stressor, cells were incubated with isoprenaline (ISO). In addition, coincidentally with contractility measurements, Ca2+ transients were measured by loading the cells with Fura-2-acetoxymethyl ester (Fura-2 AM) at a sampling frequency of 250 Hz. Ratiometric Ca2+ measurements9 using a hyperswitch were done on a 50 µm diameter illumination area, corresponding to the area of the contractility measurements. Ca2+ measurement data are depicted as time from 20% peak to peak in the Ca2+ transient (TP.Ca) and the time from peak to 80% of the baseline (TB.Ca80) (Figure 1C). A fast, automatic data analysis tool was used to yield average contractile and calcium kinetic parameters for each area.
Protocol
1. Preparation of cell culture media and reagents
- Prepare hiPSC-CM media by adding 1 mL of B27 supplement (50x) to 49 mL of RPMI1640.
- Prepare the replating medium by first adding 5 mL of knockout serum replacement to 45 mL of hiPSC-CM media. Then, add 22.5 µL of Y-27632 ROCK inhibitor (1:2,000 dilution; stock concentration: 10 mM) and mix thoroughly.
- Prepare basement membrane-coated plates as described below:
- Thaw a vial of basement membrane overnight in the fridge or on an ice box.
- Dilute the basement membrane with an appropriate amount of Dulbecco's modified Eagle's medium/Ham's F12 (DMEM/F12). As each batch of basement membrane has a different concentration, calculate the amount of DMEM/F12 needed to reach a 1 mg/1 mL dilution. Make 0.5 or 1 mL aliquots for storage at -20 °C.
NOTE: Step 1.3.2 needs to be done on ice inside a flow hood. - Thaw the 0.5 mL aliquot of basement membrane and dilute it with 6 mL of DMEM/F12. Mix thoroughly.
- Coat the plate by pipetting 250 µL of diluted basement membrane/well in a 24-well plate. Calculate based on the surface area of each well for different plate formats, for example, 1 mL/well in a 6-well plate.
- Incubate the plate for 1 h in a 37 °C incubator.
- Prepare Fura-2 AM aliquots by dissolving Fura-2 AM in dimethyl sulfoxide (DMSO), according to the manufacturer's manual to prepare 1 mM aliquots. Store the aliquots at -20 °C.
2. Culturing hiPSC-CMs
- Thaw a vial of hiPSC-CMs in a 37 °C water bath. Transfer the thawed content of the vial to a 15 mL tube. Add 10 mL of the replating medium in a dropwise manner to the cells.
- Centrifuge the cells for 5 min at 100 × g.
- Remove the supernatant and add 1 mL of replating medium. Gently pipet up and down to resuspend the pellet and remove any cell clumps.
- Use a hemocytometer or an automated cell counter to count the number of cells.
- Remove the basement membrane from the incubated plate and replace it with the replating medium.
- Plate the cells with an appropriate cell density on a 6/12/24/48/96-well plate coated with basement membrane (e.g., 250,000 cells/well in a 24-well plate).
NOTE: For Ca2+ transient experiments, plate the cells on glass-bottom plates. - Replace the medium with hiPSC-CM culture medium the next day and subsequently refresh the medium every other day using 0.5 mL/well in a 24-well plate.
- Perform the contractility measurements once the hiPSC-CMs have recovered from thawing and replating (3-5 days after replating in this protocol).
NOTE: In case of uneven cell replating, it is possible that a group of cells is not in contact with the rest of the replated cells and might show some irregular or non-synchronized beating pattern. To avoid asynchrony, it is advised to have an even distribution of cells and a synchronized well-connected monolayer of hiPSC-CMs in each well.
3. Contractility measurements
- Switch on the optics-based measurement system, microscope light emitting diode (LED) light source, and computer (see Table of Materials).
- Open the program and open a new file. Under File in the top left of the screen, click New.
- Click on Collect, choose Experiments, and then select “iPSC + Calcium”.
- Turn on the climate control device. Set the temperature to 37 °C and the CO2 level to 5%.
- Replace the hiPSC-CM culture medium with Tyrode solution (0.5 mL/well in a 24-well plate). Replace the plate lid with the climate control lid.
NOTE: If calcium transient measurements need to be performed, load the cells with Fura-2 AM, as described in section 4. - Place the plate inside the optics-based measurement system once the climate control device shows that the temperature is 37 °C.
NOTE: Contraction is measured using brightfield conditions. - Click on Open cell finder under the toolbar and wait for a new screen to pop up. In the top right of the screen, select the plate format and the well.
- Select one well, choose an area within the well to observe synchronized contraction and relaxation, Press the start, click on Add measurement. Select the duration of measurements in the settings (10 s per area). Discard asynchronized contraction measurements immediately and select a new area.
NOTE: The real-time contractility transients can be seen on the monitor. For synchronized contractions, a smooth continuous transient is observed, while for asynchronized contractions, small extra peaks are observed. - Measure multiple areas within the well depending on the size of the well. For example, to follow this study, measure 10 areas per well in a 24-well plate. In case only baseline measurements are needed and there is no plan to test any compound, continue from step 3.13.
- After the areas within a well are measured, press complete and open the optics-based measurement instrument to add the stressor/compound to the well (e.g., 500 nM ISO, dissolved in Tyrode).
- Choose the incubation time depending on the compound of interest (2 min with ISO in this protocol).
- Click on automatic measurement to allow the optics-based measurement instrument to perform measurements in the same areas where the baseline measurements were performed, resulting in paired measurements within the well.
- Press complete once all the measurements in the well have been performed.
- Choose the next well from the top right of the screen.
- Continue measurements for all the required wells.
- Click stop once all the required wells have been measured and save the file.
NOTE: The climate control is used to maintain stable CO2. This allows for measuring the effect of compounds/stressors on hiPSC-CMs in a high-speed manner.
4. Calcium transient measurements
- Prepare 37 °C Tyrode solution.
- Dissolve the Fura-2 AM aliquots in Tyrode solution so that a final concentration of 1 µM Fura-2 AM will be added to the cells.
NOTE: While using Fura-2 AM, make sure the lights in the flow hood are off to minimize light exposure. - Aspirate the medium and replace it with Tyrode solution containing Fura-2 AM.
- Incubate for 15 min at 37 °C in an incubator or in the optics-based measurement system.
- Remove the Tyrode solution containing Fura-2 AM, and subsequently wash 2x with fresh Tyrode solution. Finally, incubate the cells in Tyrode solution for another 5 min at 37 °C to allow de-esterification of Fura-2 AM.
- Place the plate inside the optics-based measurement system and start the measurements, as described in section 3.
NOTE: In step 4.6. by starting the measurements simultaneously with the contraction measurements, a ratiometric calcium transient is recorded: excitation at 340 nm and 385 nm in a 100 µm spot; emission collected at 510 ± 40 nm. In addition to the contractility traces, real-time ratiometric calcium transients will appear on the screen.
5. Data analysis
- To analyze the data, click CytoSolver on the desktop.
- Click on import and select the file(s) to be analyzed.
- After the program has performed the analysis, observe the accepted (blue) and rejected (red) transients appearing on the screen (Figure 1A).
NOTE: Here, the following default rejection criteria, defined by signal to noise ratio (SNR) and goodness of fit (R2), were used: R2 > 0.9 and SNR > 4 for contraction transients, and R2 > 0.5 and SNR > 3 for calcium transients. These rejection criteria can be adjusted by the user depending on the quality of the measurements, quality of the cells, and the primary outcome for the researcher. For example, if the interest of the researcher is mainly relaxation kinetics, the criteria could be lowered for the time to peak variables. If very strong calcium transients are obtained, the SNR may have to be increased to exclude data that is noisier. - Click on export and tick for the average transient data. Inspect the analyzed data presented in a spreadsheet.
- Turn off the computer and all the other instruments.
Results
Following this protocol, measurements of contractility, Ca2+ transients, and response to a compound in hiPSC-CMs were performed. By using this optics-based measurement system, hiPSC-CMs could simply be replated on the required plates, and the contractility measurements could be performed. Contractility is measured in a 100 µm x 100 µm region of interest (ROI) at 250 frames per second by calculating the pixel correlation relative to a reference frame. The reference frame is automatically detected by the system at end-diastole. Simultaneously with the contraction measurements, a ratiometric calcium transient is recorded.
In this study, three different rounds of differentiation were used as three biological replicates. For each batch of differentiation, three wells were measured as technical replicates. This study was performed using 24-well plates, and 10 areas within each well were measured. After the measurements, the CytoSolver program was used to immediately analyze the data. The following parameters were reported: the resting beating frequency, TP.Con, and TB.Con80 of the control hiPSC-CMs (Figure 2A-C). To visualize the variability of data for each mentioned parameter, the measurements within each well and the average values of three wells for each round of differentiation are presented as superplots10. To better evaluate the variability of data for each round of differentiation and among the three rounds, the coefficient of variance (Figure 2D) for each parameter was calculated. As shown in Figure 2D, the values of technical replicates corresponding to one biological replicate fall within a very close range to each other (i.e., low coefficient of variance), which illustrates the robustness of this method.
This application is very well suited to test drug effects. Here, the effect of 500 nM ISO, a non-selective β-adrenergic receptor agonist, on the contractility of control hiPSC-CMs was tested. This compound is known to increase heart rate and exert a positive lusitropic effect. As depicted in Figure 3A, ISO significantly increased the beating frequency in all wells. ISO also increased kinetics, evident in a decrease in TP.Con and TB.Con80 (Figure 3B,C). Overall, upon incubation with ISO, the beating frequency was significantly increased in all wells, along with a reduction in the contraction and relaxation time, which indicated that the expected response to this compound was registered by this platform.
Parallel to contractility measurements, calcium measurements were also performed. In the same fashion as contractility data (Figure 2), hiPSC-CMs' calcium measurement data are depicted in Figure 4. The TB.Ca80 is considerably slower than in isolated rat or mouse cardiomyocytes, which is partly explained by species and heart rate differences11, as well as by the immature calcium handling in hiPSC-CMs due to lower calcium dynamics within the sarcoplasmic reticulum and lower expression of calcium handling proteins compared to primary cells12. Similar to contractility data, the coefficient of variance for calcium measurements was calculated, and shows low variability within the technical and biological replicates (Figure 4C).
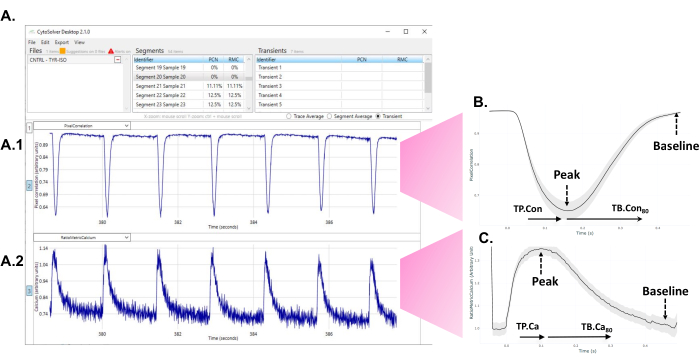
Figure 1: Immediate use of the CytoSolver transient analysis tool after the experiment to analyze the data. (A) An example of the accepted transients (all in blue) of one area measured within a well. Panel A1 depicts the contractile transients. Panel A2 represents the calcium transients. (B) Average contractility transient obtained from measurements in three wells of one round of differentiation. From each single or average transient, data from different time points of time to peak (TP.Con) and time to baseline (TB.Con) of the contractility transient could be extracted. As the exact start of contraction cannot always be unambiguously determined, time to peak 20% is taken as the starting point for measurements of time to peak. Similarly, the exact moment at which the signal returns to baseline is difficult to assess. Therefore, time to baseline 80% is used to describe the relaxation time. Here, TP.Con (time to peak - time to peak 20%) and TB.Con80 (time to baseline 80% - time to peak) are used. (C) Average calcium transient data obtained from measurements in three wells of one round of differentiation. From each single or average calcium transient, data from different time points of time to peak (TP.Ca) and time to baseline (TB.Ca) of calcium transients could be extracted. For time to peak measurements, the starting point is time to peak 20%, and for time to baseline, the end point is time to baseline 80%. In this study, TP.Ca(time to peak - time to peak 20%) and TB.Ca80 (time to baseline 80% - time to peak) are used. Please click here to view a larger version of this figure.
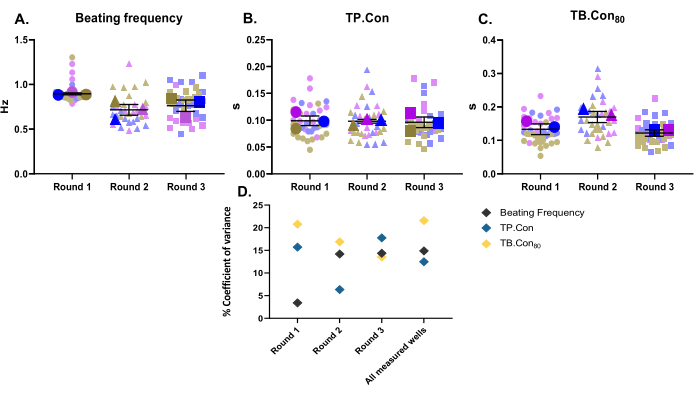
Figure 2: Baseline contractility measurements performed on three different rounds of differentiation. Three biological replicates and three wells for each round of differentiation (i.e., three technical replicates). Three main symbols for each round of differentiation represent the average value of the measured areas (the background symbols in faded colors) within each well. Data are shown as mean ± SEM. Data regarding resting beating frequency is represented in Hertz, and for TP.Con and TB.Con80, the data are in seconds. (A) Resting beating frequency. (B) Time to peak (TP.Con). (C) Time to baseline 80% (TB.Con80). (D) To evaluate the variation between the data obtained in each round and between all three rounds of differentiation, the coefficient of variance percentage was calculated using the average values of each well. Please click here to view a larger version of this figure.
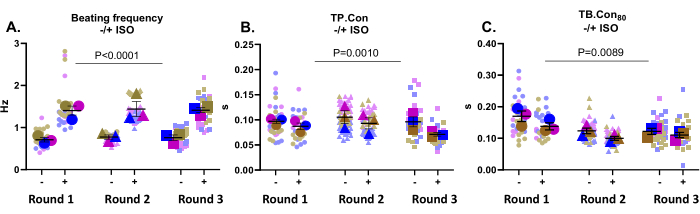
Figure 3: Contractility measurements at baseline (-) and after incubation with ISO (+) on three wells from three rounds of differentiation. (A) The resting beating frequency (-) and the beating frequency after incubation with 500 nM ISO (+). (B) Time to peak (TP.Con) measurements at baseline and after incubation with ISO. (C) Time to baseline 80% (TB.Con80) measurements at baseline and after incubation with ISO. To evaluate the effect of ISO on the contractility parameters, a two-way Anova with Bonferroni correction was performed. Data are shown as mean ± SEM. Data regarding resting beating frequency are represented in Hertz, and for TP.Con and TB.Con80, the data are represented in seconds. Please click here to view a larger version of this figure.
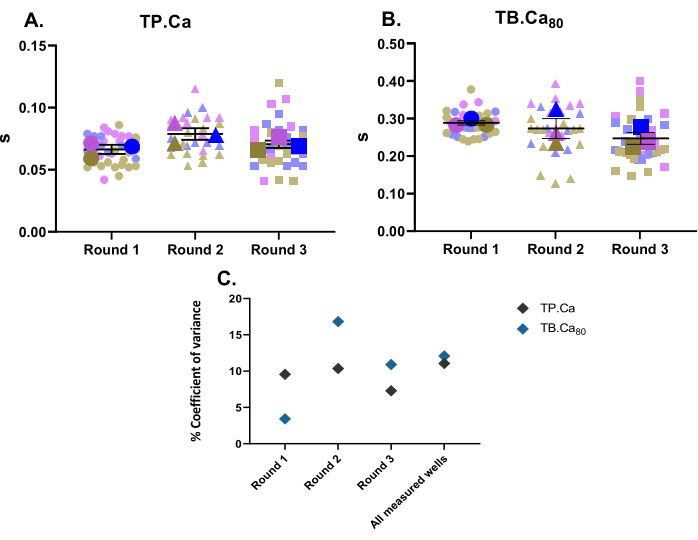
Figure 4: Baseline calcium transient measurements performed on three wells from three rounds of differentiation. (A) Time to peak (TP.Ca) and (B) time to baseline 80% (TB.Ca80) of calcium transients. Data are shown as mean ± SEM. TP.Ca and TB.Ca80 data are represented in seconds. (C) To evaluate the variation between the data obtained in each round and between all three rounds of differentiation, the coefficient of variance percentage was calculated using the average value of each well. Please click here to view a larger version of this figure.
Discussion
In this study, a method is described to perform contractility and calcium transient measurements on hiPSC-CMs and study the effect of stressors/drugs on these cells. Contractility measurements, ratiometric calcium measurements, and the response to ISO were performed on three different rounds of differentiation as biological replicates. For each biological replicate, measurements were performed on three wells as the technical replicates. The reason to perform the measurements in this way was to ensure that the biological variability and the technical variability of the sample and the platform could be evaluated. Aside from considering the appropriate number of biological and technical replicates, the hiPSC-CM culturing condition could play an important role for achieving constant and robust results. It is important to be consistent with criteria, such as the age of hiPSC-CMs, composition of medium, replating conditions, and compound incubation time during measurements. In this study, it took on average 568 ± 24 s to measure 11 areas twice for 10 s in one well. This includes an ISO incubation time of 79 ± 11 s. This comes down to roughly 10 min per well, which should enable researchers to measure a full 24-well plate in ~4 h. The climate control is used to maintain stable CO2. This allows for measuring the effect of compounds/stressors on hiPSC-CMs in a high-speed manner.
To measure the contractile function of iPSC-CMs, there are several existing systems relying on optogenetics13 or label-free video-based microscopy5,6. Optogenetics systems are quite complex and require special techniques to obtain either electrophysical and/or contractility data. Other systems rely on post-hoc analysis of videos, which requires a lot of storage and lacks direct feedback during video acquisition. In addition, sufficient temporal and spatial resolution is hard to achieve, which may result in undersampling. Likewise, CRISPR/CAS-9-edited hiPSC-CMs with fluorescent reporters7 may introduce unwanted effects on cardiomyocyte behaviour. The use of fluorescent dyes for contraction-relaxation measurements is an elegant approach as well, but limits performing experiments on the same sample over a longer period14.
This optics-based measurement platform, however, could be used for measuring contraction-relaxation times without using any fluorescent dye or invasive methods. However, as pixel correlation does not provide spatial information, this method cannot be used to measure the strength of contraction, but rather can only reliably detect changes in the speed of contraction and relaxation. The introduced measurement system is temperature-controlled and can acquire calcium and contractility data in real time at a resolution of >200 frames per second. Additionally, the location of each measurement is stored, which enables paired measurements, thereby increasing the power of the experiments. Moreover, this platform provides researchers with the ability to store data and analyze them instantly after the experiment. Overall, this optics-based measurement system shows to be a promising method to study cellular pathomechanisms, can evaluate the effect of compounds on the functionality of hiPSC-CMs, and can be helpful with the preclinical process in drug screening.
Disclosures
EM is an employee of CytoCypher BV. MH is the CEO of CytoCypher BV. The remaining authors declare that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest.
Acknowledgements
This research has been funded in part by Eurostars grant Estars2 113937 CARDIOMYO (EM & DK), and NWO-VICI grant 91818602 (JV).
Materials
| Name | Company | Catalog Number | Comments |
| µ-Plate 24 Well Black ID 14 mm | ibidi | 82421 | |
| B-27 Supplement (50x) | Thermo Fisher | 17504044 | |
| CytoSolver transient analysis tool | CytoCypher | A fast automatic data analysis tool | |
| DMEM/F-12 | Thermo Fisher | 11320033 | |
| Fura-2, AM | Thermo Fisher | F1221 | |
| Isoprenaline hydrochloride | Merck | 15627 | |
| KnockOut™ Serum Replacement | Thermo Fisher | 10828010 | |
| Matrigel | Merck | CLS3542C | Basement membrane |
| MultiCell CytoCypher with Nikon 20x Super Fluor objective and 730 nm LED light source and Ionwizard software | CytoCypher | Optics-based measurement system | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI 1640 | Thermo Fisher | 11875119 | |
| Tyrode | Self-made solution with final concentration of the following components: NaCl 134 mM, KCl 5 mM, Hepes 12 mM, MgSO4 1.2 mM, NaH2PO4 H2O 1.2 mM, Glucose 11 mM, Sodium Pyrovate 5 mM, 1 mM CaCl2 |
References
- Tsao, C. W., et al. Heart disease and stroke statistics-2022 update: a report from the American Heart Association. Circulation. 145 (8), e153 (2022).
- Ghionzoli, N., et al. Current and emerging drug targets in heart failure treatment. Heart Failure Reviews. 27 (4), 1119-1136 (2022).
- Criscione, J., et al. Heart-on-a-chip platforms and biosensor integration for disease modeling and phenotypic drug screening. Biosensors and Bioelectronics. 220, 114840 (2023).
- vander Velden, J., et al. Animal models and animal-free innovations for cardiovascular research: current status and routes to be explored. Consensus document of the ESC Working Group on Myocardial Function and the ESC Working Group on Cellular Biology of the Heart. Cardiovascular Research. 118 (15), 3016-3051 (2022).
- Maddah, M., et al. A non-invasive platform for functional characterization of stem-cell-derived cardiomyocytes with applications in cardiotoxicity testing. Stem Cell Reports. 4 (4), 621-631 (2015).
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), e5-e16 (2018).
- Sharma, A., et al. CRISPR/Cas9-mediated fluorescent tagging of endogenous proteins in human pluripotent stem cells. Current Protocols in Human Genetics. 96 (1), 1-20 (2018).
- Wang, L., et al. Hypertrophic cardiomyopathy-linked mutation in troponin T causes myofibrillar disarray and pro-arrhythmic action potential changes in human iPSC cardiomyocytes. Journal of Molecular and Cellular Cardiology. 114, 320-327 (2018).
- Luo, X., et al. IP3R-mediated compensatory mechanism for calcium handling in human induced pluripotent stem cell-derived cardiomyocytes with cardiac ryanodine receptor deficiency. Frontiers in Cell and Developmental Biology. 8, 772 (2020).
- Lord, S. J., Velle, K. B., Mullins, R. D., Fritz-Laylin, L. K. SuperPlots: communicating reproducibility and variability in cell biology. The Journal of Cellular Biology. 219 (6), e202001064 (2020).
- Milani-Nejad, N., Janssen, P. M. L. Small and large animal models in cardiac contraction research: advantages and disadvantages. Pharmacology and Therapeutics. 141 (3), 235-249 (2014).
- Karbassi, E., et al. Cardiomyocyte maturation: advances in knowledge and implications for regenerative medicine. Nature Reviews Cardiology. 17 (6), 341-359 (2020).
- Klimas, A., Ortiz, G., Boggess, S. C., Miller, E. W., Entcheva, E. Multimodal on-axis platform for all-optical electrophysiology with near-infrared probes in human stem-cell-derived cardiomyocytes. Progress in Biophysics and Molecular Biology. 154, 62-70 (2020).
- van Meer, B. J., et al. Simultaneous measurement of excitation-contraction coupling parameters identifies mechanisms underlying contractile responses of hiPSC-derived cardiomyocytes. Nature Communications. 10 (1), 4325 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved