Echtzeitmessungen von Kalzium- und Kontraktilitätsparametern in humanen induzierten pluripotenten Stammzell-abgeleiteten Kardiomyozyten
In diesem Artikel
Zusammenfassung
Hier wird eine etablierte Methode beschrieben, um Kontraktilitäts- und Kalziummessungen in humanen induzierten pluripotenten Stammzell-abgeleiteten Kardiomyozyten unter Verwendung einer optischen Plattform durchzuführen. Diese Plattform ermöglicht es den Forschern, die Auswirkungen von Mutationen und die Reaktion auf verschiedene Reize schnell und reproduzierbar zu untersuchen.
Zusammenfassung
Humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten (hiPSC-CMs) stellen ein leistungsfähiges Werkzeug dar, um mutationsvermittelte Veränderungen in der Kardiomyozytenfunktion zu untersuchen und die Auswirkungen von Stressoren und medikamentösen Interventionen zu definieren. In dieser Studie wird gezeigt, dass dieses optikbasierte System ein leistungsfähiges Werkzeug ist, um die Funktionsparameter von hiPSC-CMs in 2D zu bewerten. Durch die Verwendung dieser Plattform ist es möglich, paarweise Messungen in einer gut erhaltenen Temperaturumgebung auf verschiedenen Plattenlayouts durchzuführen. Darüber hinaus bietet dieses System den Forschern eine sofortige Datenanalyse.
In dieser Arbeit wird eine Methode zur Messung der Kontraktilität von unmodifizierten hiPSC-CMs beschrieben. Die Kontraktionskinetik wird bei 37 °C gemessen, basierend auf Pixelkorrelationsänderungen relativ zu einem Referenzbild, das bei Relaxation bei einer Abtastfrequenz von 250 Hz aufgenommen wurde. Darüber hinaus können simultane Messungen intrazellulärer Kalziumtransienten durchgeführt werden, indem die Zelle mit einem kalziumsensitiven Fluorophor, wie z. B. Fura-2, beladen wird. Mit Hilfe eines Hyperschalters können ratiometrische Kalziummessungen an einem Beleuchtungsfleck mit einem Durchmesser von 50 μm durchgeführt werden, der dem Bereich der Kontraktilitätsmessungen entspricht.
Einleitung
Herzinsuffizienz ist weltweit die häufigste Todesursache. Im Jahr 2019 verursachten Herz-Kreislauf-Erkrankungen weltweit 18,6 Millionen Todesfälle, was einem Anstieg von 17,1 % in den letzten zehn Jahren entspricht1. Trotz der Bemühungen von Forschern, Wirkstoffziele zur Vorbeugung und Heilung von Herzinsuffizienz zu identifizieren, sind die Ergebnisse für die Patienten immer noch schlecht2. Der Unterschied in der Pathophysiologie von Tiermodellen im Vergleich zum Menschen könnte einer der zugrundeliegenden Faktoren für den begrenzten Erfolg bei der Optimierung der Herzinsuffizienztherapie sein3. Zusätzliche menschenähnliche Modelle sind erforderlich, um Krankheiten zu modellieren und die Toxizität und Wirksamkeit neuartiger Wirkstoffe zu testen.
Humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten (hiPSC-CMs) stellen ein leistungsfähiges Werkzeug dar, um zelluläre Pathomechanismen, die durch Stressoren, Ischämie, veränderten Stoffwechsel oder pathogene Genvarianten induziert werden, sowie die Wirksamkeit und Toxizität von medikamentösen Interventionen zu definieren4. Um die Auswirkungen auf die funktionellen Eigenschaften von hiPSC-CMs zu definieren, ist ein Hochgeschwindigkeitssystem erforderlich, das die systolischen und diastolischen Eigenschaften zellulärer Kontraktionen unvoreingenommen und reproduzierbar misst. Das übergeordnete Ziel der aktuellen Studie ist es, zu zeigen, dass ein optikbasiertes System ein leistungsfähiges Werkzeug ist, um Echtzeitanalysen der Funktionsparameter von hiPSC-CMs durchzuführen.
Derzeit gibt es mehrere Plattformen, um die Kontraktilität von hiPSC-CMs zu evaluieren. Aktuelle Systeme bieten jedoch entweder eine langsame Ablesung, oder die erforderliche Anzahl von Zellen könnte eine Herausforderung darstellen. Markierungsfreie Videomesssysteme5,6 beruhen auf der Post-hoc-Analyse von Videos, die viel Speicherplatz benötigt und keine direkte Rückmeldung während der Videoaufnahme bietet. Darüber hinaus ist eine ausreichende zeitliche und räumliche Auflösung schwer zu erreichen und kann zu einer Unterabtastung führen. Andere Methoden zur Bestimmung der Eigenschaften von Kardiomyozyten, wie z. B. CRISPR/Cas9-editierte hiPSC-CMs7 mit fluoreszierenden Reportern, können die Genstabilität der Zellen beeinträchtigen und spezielle Laborkenntnisse erfordern.
Um die oben genannten Einschränkungen zu überwinden, wurde ein einzigartiges optisches Messsystem entwickelt und in dieser Studie eingeführt. Diese Plattform ermöglicht Kontraktilitätsmessungen an unmodifizierten hiPSC-CMs, indem sie einfach auf jedem erforderlichen Plattenformat neu beschichtet werden, ohne dass die Plattengröße begrenzt ist. Darüber hinaus ermöglichen Echtzeitmessungen die direkte Beobachtung und Analyse der Funktionsparameter von hiPSC-CMs und bieten damit eine experimentelle Umgebung zur sofortigen Anpassung und Optimierung von Protokollen. Darüber hinaus wird der Ort jeder Messung gespeichert, was paarweise Messungen an derselben Probe ermöglicht und dadurch die Aussagekraft der Experimente erhöht.
Zur Demonstration des optikbasierten Systems wurden Kontraktilitätsmessungen an einer Kontroll-hiPSC-CM-Linie durchgeführt. Diese Kontroll-hiPSC-Linie wurde aus dem dermalen Fibroblasten eines gesunden männlichen Spenders mit einem normalen Karyotyp8 generiert. Die Kontraktionskinetik wurde bei 37 °C gemessen, basierend auf Änderungen der Pixelkorrelation relativ zu einem Referenzbild, das während der Relaxation bei einer Abtastfrequenz von 250 Hz aufgenommen wurde. Da der genaue Beginn der Kontraktion nicht immer eindeutig bestimmt werden kann, wurde der Zeitpunkt, zu dem 20 % der Peakhöhe erreicht wurden (Time to Peak 20 %), als Ausgangspunkt für Messungen der Zeit bis zum Peak genommen. Auf diese Weise wurde eine geringere Variabilität für diesen Parameter innerhalb einer Stichprobe gefunden. Da der genaue Moment, in dem das Signal zum Ausgangswert zurückkehrt, schwer zu beurteilen ist, wurde die Zeit, die benötigt wurde, um 80 % der Rückkehr zum Ausgangswert vom Höchststand (Zeit bis zum Ausgangswert 80 %) zu erreichen, zur Beschreibung der Relaxationszeit verwendet.
Die Gesamtmessungen der Kontraktilität umfassten die Ruheschlagfrequenzen, die Zeit von 20 % Peak- bis Peak-Kontraktion (TP. Con) und die Zeit von der Spitzenkontraktion bis zu 80 % des Ausgangswerts (TB. Con80) (Abbildung 1B). Um die Wirkung eines Stressors zu testen, wurden die Zellen mit Isoprenalin (ISO) inkubiert. Zusätzlich wurden zeitgleich mit den Kontraktilitätsmessungen Ca2+-Transienten gemessen, indem die Zellen mit Fura-2-Acetoxymethylester (Fura-2 AM) bei einer Abtastfrequenz von 250 Hz beladen wurden. Ratiometrische Ca2+-Messungen 9 mit einem Hyperschalter wurden auf einer Beleuchtungsfläche mit einem Durchmesser von 50 μm durchgeführt, die der Fläche der Kontraktilitätsmessungen entspricht. Ca2+-Messdaten werden als Zeit von 20 % Spitze zu Spitze in derCa2+-Transienten (TP.Ca) und als Zeit von Spitze bis 80 % der Basislinie (TB.Ca80) dargestellt (Abbildung 1C). Ein schnelles, automatisches Datenanalysewerkzeug wurde verwendet, um die durchschnittlichen kontraktilen und kinetischen Parameter für jeden Bereich zu ermitteln.
Protokoll
1. Vorbereitung von Zellkulturmedien und Reagenzien
- Bereiten Sie hiPSC-CM-Medien vor, indem Sie 1 ml B27-Präparat (50x) zu 49 ml RPMI1640 hinzufügen.
- Bereiten Sie das Replattiermedium vor, indem Sie zuerst 5 ml Knockout-Serumersatz zu 45 ml hiPSC-CM-Medien hinzufügen. Dann 22,5 μl Y-27632 ROCK-Inhibitor (1:2.000-Verdünnung; Stammkonzentration: 10 mM) zugeben und gründlich mischen.
- Bereiten Sie die mit Kellermembranen beschichteten Platten wie folgt vor:
- Eine Durchstechflasche mit Kellermembran über Nacht im Kühlschrank oder auf einer Eisbox auftauen.
- Verdünnen Sie die Basalmembran mit einer geeigneten Menge des modifizierten Dulbecco-Mediums Eagle's Medium/Ham's F12 (DMEM/F12). Da jede Charge der Basalmembran eine andere Konzentration aufweist, berechnen Sie die Menge an DMEM/F12, die erforderlich ist, um eine Verdünnung von 1 mg/1 ml zu erreichen. Stellen Sie 0,5 oder 1 ml Aliquots für die Lagerung bei -20 °C her.
HINWEIS: Schritt 1.3.2 muss auf Eis in einer Durchflusshaube durchgeführt werden. - Die 0,5 ml aliquoten Basalmembranen werden aufgetaut und mit 6 ml DMEM/F12 verdünnt. Gründlich mischen.
- Beschichten Sie die Platte, indem Sie 250 μl verdünnte Basalmembran/Vertiefung in eine 24-Well-Platte pipettieren. Berechnen Sie basierend auf der Oberfläche jedes Wells für verschiedene Plattenformate, z. B. 1 ml/Well in einer 6-Well-Platte.
- Inkubieren Sie die Platte 1 h in einem 37 °C warmen Inkubator.
- Bereiten Sie Fura-2 AM-Aliquots vor, indem Sie Fura-2 AM in Dimethylsulfoxid (DMSO) gemäß dem Herstellerhandbuch auflösen, um 1 mM-Aliquots herzustellen. Lagern Sie die Aliquots bei -20 °C.
2. Kultivierung von hiPSC-CMs
- Eine Durchstechflasche mit hiPSC-CMs in einem 37 °C warmen Wasserbad auftauen. Den aufgetauten Inhalt der Durchstechflasche in ein 15-ml-Röhrchen überführen. Geben Sie 10 ml des Umschichtungsmediums tropfenweise zu den Zellen.
- Die Zellen werden 5 min bei 100 × g zentrifugiert.
- Entfernen Sie den Überstand und fügen Sie 1 ml Nachbeschichtungsmedium hinzu. Pipetieren Sie vorsichtig auf und ab, um das Pellet zu resuspendieren und Zellklumpen zu entfernen.
- Verwenden Sie ein Hämozytometer oder einen automatischen Zellzähler, um die Anzahl der Zellen zu zählen.
- Entfernen Sie die Basalmembran von der inkubierten Platte und ersetzen Sie sie durch das Nachbeschichtungsmedium.
- Platten Sie die Zellen mit einer geeigneten Zelldichte auf einer 6/12/24/48/96-Well-Platte, die mit einer Basalmembran beschichtet ist (z. B. 250.000 Zellen/Well in einer 24-Well-Platte).
HINWEIS: Für Ca2+ transiente Experimente werden die Zellen auf Glasbodenplatten plattiert. - Ersetzen Sie das Medium am nächsten Tag durch hiPSC-CM-Nährmedium und frischen Sie das Medium anschließend jeden zweiten Tag mit 0,5 ml/Well in einer 24-Well-Platte auf.
- Führen Sie die Kontraktilitätsmessungen durch, sobald sich die hiPSC-CMs vom Auftauen und Neuplattieren erholt haben (3-5 Tage nach dem Auftauen in diesem Protokoll).
HINWEIS: Im Falle einer ungleichmäßigen Zellumschichtung ist es möglich, dass eine Gruppe von Zellen nicht in Kontakt mit dem Rest der umplattierten Zellen steht und ein unregelmäßiges oder nicht synchronisiertes Schwebungsmuster aufweist. Um Asynchronität zu vermeiden, wird empfohlen, eine gleichmäßige Verteilung der Zellen und eine synchronisierte, gut verbundene Monoschicht von hiPSC-CMs in jedem Well zu haben.
3. Messungen der Kontraktilität
- Schalten Sie das optische Messsystem, die Lichtquelle der Mikroskop-Leuchtdiode (LED) und den Computer ein (siehe Materialtabelle).
- Öffnen Sie das Programm und öffnen Sie eine neue Datei. Klicken Sie oben links auf dem Bildschirm unter Datei auf Neu.
- Klicken Sie auf "Sammeln", wählen Sie "Experimente" und dann "iPSC + Kalzium".
- Schalten Sie die Klimaanlage ein. Stellen Sie die Temperatur auf 37 °C und den CO2 - Gehalt auf 5 % ein.
- Ersetzen Sie das hiPSC-CM-Nährmedium durch Tyrode-Lösung (0,5 ml/Well in einer 24-Well-Platte). Ersetzen Sie den Plattendeckel durch den Klimadeckel.
HINWEIS: Wenn transiente Kalziummessungen durchgeführt werden müssen, laden Sie die Zellen mit Fura-2 AM, wie in Abschnitt 4 beschrieben. - Legen Sie die Platte in das optische Messsystem, sobald das Klimagerät eine Temperatur von 37 °C anzeigt.
HINWEIS: Die Kontraktion wird unter Verwendung von Hellfeldbedingungen gemessen. - Klicken Sie unter der Symbolleiste auf Zellenfinder öffnen und warten Sie, bis ein neuer Bildschirm angezeigt wird. Wählen Sie oben rechts auf dem Bildschirm das Plattenformat und die Vertiefung aus.
- Wählen Sie eine Vertiefung aus, wählen Sie einen Bereich innerhalb der Vertiefung, um die synchronisierte Kontraktion und Entspannung zu beobachten, drücken Sie die Starttaste und klicken Sie auf Messung hinzufügen. Wählen Sie in den Einstellungen die Dauer der Messungen (10 s pro Bereich). Asynchrone Kontraktionsmessungen sofort verwerfen und einen neuen Bereich auswählen.
HINWEIS: Die Transienten der Kontraktilität in Echtzeit sind auf dem Monitor zu sehen. Bei synchronisierten Kontraktionen wird ein glatter, kontinuierlicher Transient beobachtet, während bei asynchronen Kontraktionen kleine zusätzliche Peaks beobachtet werden. - Messen Sie mehrere Bereiche innerhalb des Brunnens, abhängig von der Größe des Brunnens. Um dieser Studie zu folgen, messen Sie beispielsweise 10 Bereiche pro Well in einer 24-Well-Platte. Falls nur Basismessungen erforderlich sind und keine Prüfung einer Verbindung geplant ist, fahren Sie mit Schritt 3.13 fort.
- Nachdem die Bereiche innerhalb einer Vertiefung gemessen wurden, drücken Sie auf " Vollständig" und öffnen Sie das optische Messgerät, um den Stressor/die Verbindung in die Vertiefung zu geben (z. B. 500 nM ISO, gelöst in Tyrode).
- Wählen Sie die Inkubationszeit in Abhängigkeit von der interessierenden Verbindung (2 Minuten mit ISO in diesem Protokoll).
- Klicken Sie auf automatische Messung , damit das optische Messgerät Messungen in denselben Bereichen durchführen kann, in denen die Basismessungen durchgeführt wurden, was zu paarigen Messungen innerhalb des Wells führt.
- Drücken Sie auf "Abschließen ", sobald alle Messungen in der Vertiefung durchgeführt wurden.
- Wählen Sie das nächste Feld oben rechts auf dem Bildschirm aus.
- Setzen Sie die Messungen für alle erforderlichen Vertiefungen fort.
- Klicken Sie auf Stopp , sobald alle erforderlichen Vertiefungen gemessen wurden, und speichern Sie die Datei.
HINWEIS: Die Klimaanlage wird verwendet, um einen stabilen CO2 -Gehalt aufrechtzuerhalten. Dies ermöglicht es, die Wirkung von Verbindungen/Stressoren auf hiPSC-CMs mit hoher Geschwindigkeit zu messen.
4. Transiente Kalziummessungen
- Bereiten Sie die 37 °C heiße Tyrode-Lösung vor.
- Lösen Sie die Fura-2 AM-Aliquots in Tyrode-Lösung auf, so dass den Zellen eine Endkonzentration von 1 μM Fura-2 AM zugesetzt wird.
HINWEIS: Stellen Sie bei der Verwendung von Fura-2 AM sicher, dass die Lichter in der Durchflusshaube ausgeschaltet sind, um die Lichtexposition zu minimieren. - Saugen Sie das Medium an und ersetzen Sie es durch eine Tyrode-Lösung, die Fura-2 AM enthält.
- 15 min bei 37 °C in einem Inkubator oder im optischen Messsystem inkubieren.
- Entfernen Sie die Tyrode-Lösung, die Fura-2 AM enthält, und waschen Sie sie anschließend 2x mit frischer Tyrode-Lösung. Zum Schluss werden die Zellen für weitere 5 Minuten bei 37 °C in Tyrode-Lösung inkubiert, um die Entesterung von Fura-2 AM zu ermöglichen.
- Legen Sie die Platte in das optische Messsystem und starten Sie die Messungen, wie in Abschnitt 3 beschrieben.
HINWEIS: In Schritt 4.6. Durch den gleichzeitigen Start der Messungen mit den Kontraktionsmessungen wird ein ratiometrischer Kalziumtransient aufgezeichnet: Anregung bei 340 nm und 385 nm in einem 100 μm Spot; Emission bei 510 ± 40 nm. Zusätzlich zu den Kontraktilitätsspuren werden ratiometrische Kalziumtransienten in Echtzeit auf dem Bildschirm angezeigt.
5. Datenanalyse
- Um die Daten zu analysieren, klicken Sie auf dem Desktop auf CytoSolver .
- Klicken Sie auf Importieren und wählen Sie die zu analysierende(n) Datei(en) aus.
- Nachdem das Programm die Analyse durchgeführt hat, beobachten Sie die akzeptierten (blau) und abgelehnten (rot) Transienten, die auf dem Bildschirm angezeigt werden (Abbildung 1A).
ANMERKUNG: Hier wurden die folgenden Standardunterdrückungskriterien verwendet, die durch das Signal-Rausch-Verhältnis (SNR) und die Güte der Anpassung (R2) definiert sind:R2 > 0,9 und SNR > 4 für Kontraktionstransienten undR2 > 0,5 und SNR > 3 für Kalziumtransienten. Diese Ablehnungskriterien können vom Benutzer in Abhängigkeit von der Qualität der Messungen, der Qualität der Zellen und dem primären Ergebnis für den Forscher angepasst werden. Wenn das Interesse des Forschers beispielsweise hauptsächlich auf der Relaxationskinetik liegt, könnten die Kriterien für die Zeit bis zum Höhepunkt der Variablen gesenkt werden. Wenn sehr starke Kalziumtransienten erhalten werden, muss das Signal-Rausch-Verhältnis (SNR) möglicherweise erhöht werden, um verrauschtere Daten auszuschließen. - Klicken Sie auf Exportieren und setzen Sie ein Häkchen bei den durchschnittlichen transienten Daten. Untersuchen Sie die analysierten Daten, die in einer Tabelle dargestellt werden.
- Schalten Sie den Computer und alle anderen Instrumente aus.
Ergebnisse
Nach diesem Protokoll wurden Messungen der Kontraktilität, der Ca2+ Transienten und der Reaktion auf eine Verbindung in hiPSC-CMs durchgeführt. Durch den Einsatz dieses optischen Messsystems konnten hiPSC-CMs einfach auf die benötigten Platten aufgebracht und die Kontraktilitätsmessungen durchgeführt werden. Die Kontraktilität wird in einer 100 μm x 100 μm großen Region of Interest (ROI) bei 250 Bildern pro Sekunde gemessen, indem die Pixelkorrelation relativ zu einem Referenzbild berechnet wird. Das Bezugssystem wird am Ende der Diastole automatisch vom System erkannt. Gleichzeitig mit den Kontraktionsmessungen wird ein ratiometrischer Calciumtransient aufgezeichnet.
In dieser Studie wurden drei verschiedene Differenzierungsrunden als drei biologische Replikate verwendet. Für jede Charge der Differenzierung wurden drei Bohrungen als technische Replikate gemessen. Diese Studie wurde mit 24-Well-Platten durchgeführt, wobei 10 Bereiche innerhalb jeder Bohrung gemessen wurden. Nach den Messungen wurde das Programm CytoSolver verwendet, um die Daten sofort zu analysieren. Folgende Parameter wurden berichtet: die Ruheschlagfrequenz, TP. Contra und TB. Con80 der Steuerung hiPSC-CMs (Abbildung 2A-C). Um die Variabilität der Daten für jeden genannten Parameter zu visualisieren, werden die Messungen innerhalb jeder Vertiefung und die Durchschnittswerte von drei Vertiefungen für jede Differenzierungsrunde als Superplots10 dargestellt. Um die Variabilität der Daten für jede Differenzierungsrunde und zwischen den drei Runden besser bewerten zu können, wurde der Varianzkoeffizient (Abbildung 2D) für jeden Parameter berechnet. Wie in Abbildung 2D dargestellt, liegen die Werte der technischen Replikate, die einem biologischen Replikat entsprechen, in einem sehr engen Bereich (d. h. niedriger Varianzkoeffizient), was die Robustheit dieser Methode verdeutlicht.
Diese Anwendung eignet sich sehr gut, um Arzneimittelwirkungen zu testen. Hier wurde die Wirkung von 500 nM ISO, einem nicht-selektiven β-adrenergen Rezeptoragonisten, auf die Kontraktilität von Kontroll-hiPSC-CMs getestet. Es ist bekannt, dass diese Verbindung die Herzfrequenz erhöht und eine positive lusitrope Wirkung ausübt. Wie in Abbildung 3A dargestellt, erhöhte ISO die Schlagfrequenz in allen Vertiefungen signifikant. ISO erhöhte auch die Kinetik, was sich in einer Abnahme der TP zeigte. Nachteil und Tuberkulose. Con80 (Abbildung 3B,C). Insgesamt war die Schlagfrequenz nach der Inkubation mit ISO in allen Wells signifikant erhöht, zusammen mit einer Verkürzung der Kontraktions- und Relaxationszeit, was darauf hindeutet, dass die erwartete Reaktion auf diese Verbindung von dieser Plattform registriert wurde.
Parallel zu den Kontraktilitätsmessungen wurden auch Kalziummessungen durchgeführt. Analog zu den Kontraktilitätsdaten (Abbildung 2) sind die Kalziummessdaten der hiPSC-CMs in Abbildung 4 dargestellt. Die TB.Ca80 ist deutlich langsamer als bei isolierten Kardiomyozyten von Ratten oder Mäusen, was zum Teil durch Spezies- und Herzratenunterschiedeerklärt wird 11 sowie durch die unreife Kalziumbehandlung in hiPSC-CMs aufgrund einer geringeren Kalziumdynamik im sarkoplasmatischen Retikulum und einer geringeren Expression von Kalzium-Transportproteinen im Vergleich zu Primärzellen12. Ähnlich wie bei den Kontraktilitätsdaten wurde der Varianzkoeffizient für Kalziummessungen berechnet, der eine geringe Variabilität innerhalb der technischen und biologischen Replikate aufweist (Abbildung 4C).
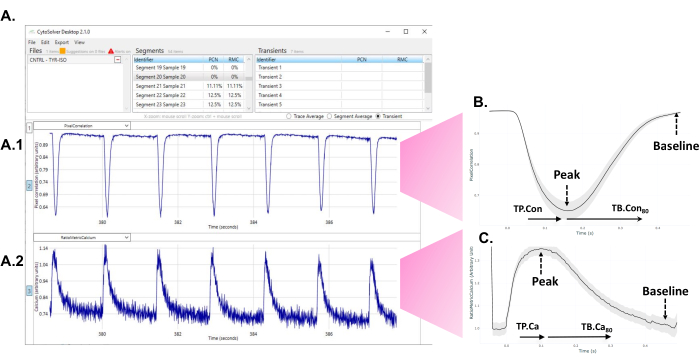
Abbildung 1: Sofortiger Einsatz des transienten Analysewerkzeugs CytoSolver nach dem Experiment zur Analyse der Daten. (A) Ein Beispiel für die akzeptierten Transienten (alle in blau) eines Bereichs, der innerhalb einer Vertiefung gemessen wurde. Tafel A1 zeigt die kontraktilen Transienten. Tafel A2 stellt die Kalziumtransienten dar. (B) Durchschnittliche transiente Kontraktilität, die aus Messungen in drei Wells einer Differenzierungsrunde ermittelt wurde. Von jedem einzelnen oder durchschnittlichen Transienten werden Daten von verschiedenen Zeitpunkten bis zum Peak (TP. Nachteil) und die Zeit bis zum Ausgangswert (TB. Con) der Kontraktilität transient extrahiert werden konnte. Da der genaue Beginn der Kontraktion nicht immer eindeutig bestimmt werden kann, wird die Zeit bis zum Höhepunkt von 20 % als Ausgangspunkt für Messungen der Zeit bis zum Höhepunkt genommen. Ebenso ist der genaue Zeitpunkt, zu dem das Signal zum Ausgangswert zurückkehrt, schwer zu beurteilen. Daher wird die Zeit bis zum Ausgangswert 80 % verwendet, um die Entspannungszeit zu beschreiben. Hier hat TP. Nachteil (Zeit bis zur Spitze - Zeit bis zur Spitze 20%) und TB. Con80 (Zeit bis zum Ausgangswert 80 % - Zeit bis zum Peak) verwendet werden. (C) Durchschnittliche transiente Kalziumdaten, die aus Messungen in drei Vertiefungen einer Differenzierungsrunde gewonnen wurden. Aus jedem einzelnen oder durchschnittlichen Calcium-Transienten konnten Daten von verschiedenen Zeitpunkten bis zum Peak (TP.Ca) und der Zeit bis zur Baseline (TB.Ca) von Calcium-Transienten extrahiert werden. Bei Messungen von der Zeit bis zur Spitze ist der Startpunkt die Zeit bis zum Höchststand von 20 %, und für die Zeit bis zum Ausgangswert ist der Endpunkt die Zeit bis zum Ausgangswert von 80 %. In dieser Studie werden TP.Ca (Zeit bis zum Höhepunkt - Zeit bis zum Höhepunkt 20 %) und TB.Ca 80 (Zeit bis zum Ausgangswert 80 % - Zeit bis zum Höhepunkt) verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
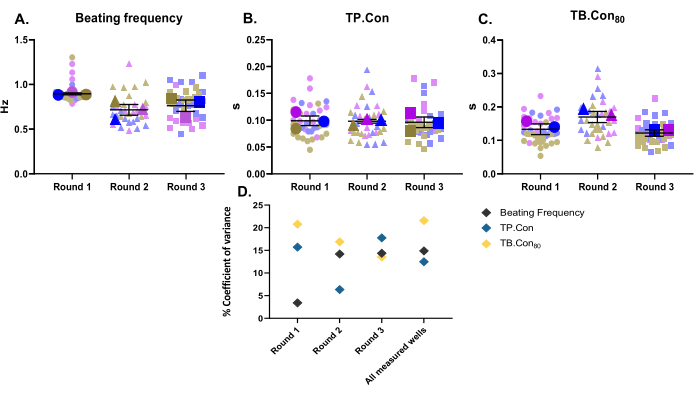
Abbildung 2: Baseline-Kontraktilitätsmessungen, die an drei verschiedenen Differenzierungsrunden durchgeführt wurden. Drei biologische Replikate und drei Wells für jede Differenzierungsrunde (d.h. drei technische Replikate). Drei Hauptsymbole für jede Differenzierungsrunde stellen den Durchschnittswert der gemessenen Bereiche (die Hintergrundsymbole in verblassten Farben) innerhalb jeder Vertiefung dar. Die Daten werden als Mittelwert ± REM angezeigt. Die Daten zur Ruheschlagfrequenz werden in Hertz und für TP angegeben. Nachteil und Tuberkulose. Con80, die Daten sind in Sekunden. (A) Schlagfrequenz im Ruhezustand. (B) Zeit bis zum Höhepunkt (TP. Contra). (C) Zeit bis zum Ausgangswert 80 % (TB. Con80). (D) Um die Variation zwischen den in jeder Runde erhaltenen Daten und zwischen allen drei Differenzierungsrunden zu bewerten, wurde der Prozentsatz des Varianzkoeffizienten anhand der Durchschnittswerte jeder Bohrung berechnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
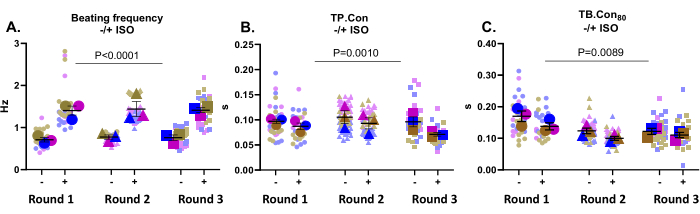
Abbildung 3: Kontraktilitätsmessungen zu Studienbeginn (-) und nach Inkubation mit ISO (+) an drei Wells aus drei Differenzierungsrunden. (A) Die Ruheschlagfrequenz (-) und die Schlagfrequenz nach der Inkubation mit 500 nM ISO (+). (B) Zeit bis zum Höhepunkt (TP. Con) Messungen zu Studienbeginn und nach Inkubation mit ISO. (C) Zeit bis zum Ausgangswert 80 % (TB. Con80) Messungen zu Studienbeginn und nach Inkubation mit ISO. Um den Einfluss von ISO auf die Kontraktilitätsparameter zu evaluieren, wurde eine Zwei-Wege-Anova mit Bonferroni-Korrektur durchgeführt. Die Daten werden als Mittelwert ± REM dargestellt. Die Daten zur Ruheschlagfrequenz werden in Hertz und für TP angegeben. Nachteil und Tuberkulose. Con80 werden die Daten in Sekunden dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
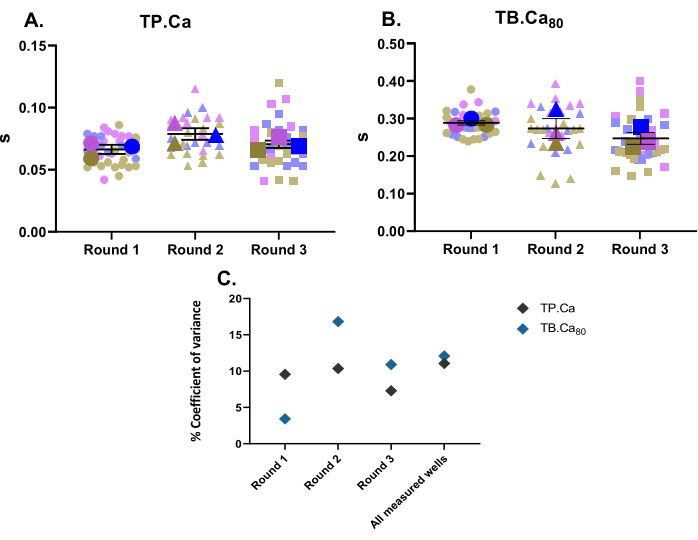
Abbildung 4: Baseline-Calcium-Transienten-Messungen, die an drei Wells aus drei Differenzierungsrunden durchgeführt wurden . (A) Zeit bis zum Peak (TP.Ca) und (B) Zeit bis zum Ausgangswert 80% (TB.Ca80) der Calcium-Transienten. Die Daten werden als Mittelwert ± SEM angezeigt. TP.Ca undTB.Ca 80 Daten werden in Sekunden dargestellt. (C) Um die Variation zwischen den in jeder Runde erhaltenen Daten und zwischen allen drei Differenzierungsrunden zu bewerten, wurde der Prozentsatz des Varianzkoeffizienten anhand des Durchschnittswerts jeder Vertiefung berechnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In dieser Studie wird eine Methode beschrieben, mit der Kontraktilitäts- und Kalziumtransientenmessungen an hiPSC-CMs durchgeführt und die Wirkung von Stressoren/Medikamenten auf diese Zellen untersucht werden kann. Kontraktilitätsmessungen, ratiometrische Kalziummessungen und die Reaktion auf ISO wurden in drei verschiedenen Differenzierungsrunden als biologische Replikate durchgeführt. Für jedes biologische Replikat wurden Messungen an drei Wells als technische Replikate durchgeführt. Der Grund, die Messungen auf diese Weise durchzuführen, bestand darin, sicherzustellen, dass die biologische Variabilität und die technische Variabilität der Probe und der Plattform bewertet werden können. Neben der Berücksichtigung der angemessenen Anzahl biologischer und technischer Replikate könnte die hiPSC-CM-Kultivierungsbedingung eine wichtige Rolle spielen, um konstante und robuste Ergebnisse zu erzielen. Es ist wichtig, bei den Messungen Kriterien wie dem Alter der hiPSC-CMs, der Zusammensetzung des Mediums, den Umplattungsbedingungen und der Inkubationszeit der Verbindung konsistent zu sein. In dieser Studie dauerte es durchschnittlich 568 ± 24 s, um 11 Bereiche zweimal für 10 s in einer Vertiefung zu messen. Dazu gehört eine ISO-Inkubationszeit von 79 ± 11 s. Dies entspricht etwa 10 Minuten pro Well, was es den Forschern ermöglichen sollte, eine vollständige 24-Well-Platte in ~4 h zu messen. Die Klimatisierung dient dazu, den CO2 -Stand stabil zu halten. Dies ermöglicht es, die Wirkung von Verbindungen/Stressoren auf hiPSC-CMs mit hoher Geschwindigkeit zu messen.
Um die kontraktile Funktion von iPSC-CMs zu messen, gibt es mehrere bestehende Systeme, die auf der Optogenetik13 oder der markierungsfreien videobasierten Mikroskopie 5,6 basieren. Optogenetische Systeme sind recht komplex und erfordern spezielle Techniken, um entweder elektrophysikalische und/oder Kontraktilitätsdaten zu erhalten. Andere Systeme setzen auf die Post-hoc-Analyse von Videos, die viel Speicherplatz benötigt und bei der Videoaufnahme kein direktes Feedback gibt. Darüber hinaus ist eine ausreichende zeitliche und räumliche Auflösung schwer zu erreichen, was zu einer Unterabtastung führen kann. Ebenso können CRISPR/CAS-9-editierte hiPSC-CMs mit fluoreszierenden Reportern7 unerwünschte Wirkungen auf das Verhalten von Kardiomyozyten haben. Die Verwendung von Fluoreszenzfarbstoffen für Kontraktions-Relaxations-Messungen ist ebenfalls ein eleganter Ansatz, schränkt jedoch die Durchführung von Experimenten an derselben Probe über einen längeren Zeitraum ein14.
Diese auf Optik basierende Messplattform könnte jedoch zur Messung von Kontraktions- und Relaxationszeiten verwendet werden, ohne Fluoreszenzfarbstoffe oder invasive Methoden zu verwenden. Da die Pixelkorrelation jedoch keine räumlichen Informationen liefert, kann diese Methode nicht zur Messung der Kontraktionsstärke verwendet werden, sondern nur Änderungen der Kontraktions- und Relaxationsgeschwindigkeit zuverlässig erkennen. Das vorgestellte Messsystem ist temperaturgeregelt und kann Kalzium- und Kontraktilitätsdaten in Echtzeit mit einer Auflösung von >200 Bildern pro Sekunde erfassen. Zusätzlich wird der Ort jeder Messung gespeichert, was paarweise Messungen ermöglicht und dadurch die Aussagekraft der Experimente erhöht. Darüber hinaus bietet diese Plattform den Forschern die Möglichkeit, Daten zu speichern und sofort nach dem Experiment zu analysieren. Insgesamt erweist sich dieses optische Messsystem als vielversprechende Methode zur Untersuchung zellulärer Pathomechanismen, kann die Wirkung von Substanzen auf die Funktionalität von hiPSC-CMs bewerten und kann für den präklinischen Prozess im Wirkstoffscreening hilfreich sein.
Offenlegungen
EM ist ein Mitarbeiter von CytoCypher BV. MH ist der CEO von CytoCypher BV. Die übrigen Autoren erklären, dass die Forschung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Diese Forschung wurde zum Teil durch das Eurostars-Stipendium Estars2 113937 CARDIOMYO (EM & DK) und das NWO-VICI-Stipendium 91818602 (JV) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| µ-Plate 24 Well Black ID 14 mm | ibidi | 82421 | |
| B-27 Supplement (50x) | Thermo Fisher | 17504044 | |
| CytoSolver transient analysis tool | CytoCypher | A fast automatic data analysis tool | |
| DMEM/F-12 | Thermo Fisher | 11320033 | |
| Fura-2, AM | Thermo Fisher | F1221 | |
| Isoprenaline hydrochloride | Merck | 15627 | |
| KnockOut™ Serum Replacement | Thermo Fisher | 10828010 | |
| Matrigel | Merck | CLS3542C | Basement membrane |
| MultiCell CytoCypher with Nikon 20x Super Fluor objective and 730 nm LED light source and Ionwizard software | CytoCypher | Optics-based measurement system | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI 1640 | Thermo Fisher | 11875119 | |
| Tyrode | Self-made solution with final concentration of the following components: NaCl 134 mM, KCl 5 mM, Hepes 12 mM, MgSO4 1.2 mM, NaH2PO4 H2O 1.2 mM, Glucose 11 mM, Sodium Pyrovate 5 mM, 1 mM CaCl2 |
Referenzen
- Tsao, C. W., et al. Heart disease and stroke statistics-2022 update: a report from the American Heart Association. Circulation. 145 (8), e153 (2022).
- Ghionzoli, N., et al. Current and emerging drug targets in heart failure treatment. Heart Failure Reviews. 27 (4), 1119-1136 (2022).
- Criscione, J., et al. Heart-on-a-chip platforms and biosensor integration for disease modeling and phenotypic drug screening. Biosensors and Bioelectronics. 220, 114840 (2023).
- vander Velden, J., et al. Animal models and animal-free innovations for cardiovascular research: current status and routes to be explored. Consensus document of the ESC Working Group on Myocardial Function and the ESC Working Group on Cellular Biology of the Heart. Cardiovascular Research. 118 (15), 3016-3051 (2022).
- Maddah, M., et al. A non-invasive platform for functional characterization of stem-cell-derived cardiomyocytes with applications in cardiotoxicity testing. Stem Cell Reports. 4 (4), 621-631 (2015).
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), e5-e16 (2018).
- Sharma, A., et al. CRISPR/Cas9-mediated fluorescent tagging of endogenous proteins in human pluripotent stem cells. Current Protocols in Human Genetics. 96 (1), 1-20 (2018).
- Wang, L., et al. Hypertrophic cardiomyopathy-linked mutation in troponin T causes myofibrillar disarray and pro-arrhythmic action potential changes in human iPSC cardiomyocytes. Journal of Molecular and Cellular Cardiology. 114, 320-327 (2018).
- Luo, X., et al. IP3R-mediated compensatory mechanism for calcium handling in human induced pluripotent stem cell-derived cardiomyocytes with cardiac ryanodine receptor deficiency. Frontiers in Cell and Developmental Biology. 8, 772 (2020).
- Lord, S. J., Velle, K. B., Mullins, R. D., Fritz-Laylin, L. K. SuperPlots: communicating reproducibility and variability in cell biology. The Journal of Cellular Biology. 219 (6), e202001064 (2020).
- Milani-Nejad, N., Janssen, P. M. L. Small and large animal models in cardiac contraction research: advantages and disadvantages. Pharmacology and Therapeutics. 141 (3), 235-249 (2014).
- Karbassi, E., et al. Cardiomyocyte maturation: advances in knowledge and implications for regenerative medicine. Nature Reviews Cardiology. 17 (6), 341-359 (2020).
- Klimas, A., Ortiz, G., Boggess, S. C., Miller, E. W., Entcheva, E. Multimodal on-axis platform for all-optical electrophysiology with near-infrared probes in human stem-cell-derived cardiomyocytes. Progress in Biophysics and Molecular Biology. 154, 62-70 (2020).
- van Meer, B. J., et al. Simultaneous measurement of excitation-contraction coupling parameters identifies mechanisms underlying contractile responses of hiPSC-derived cardiomyocytes. Nature Communications. 10 (1), 4325 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten