ヒト人工多能性幹細胞由来心筋細胞におけるカルシウムおよび収縮性パラメータのリアルタイム測定
要約
ここでは、光学系プラットフォームを用いてヒト人工多能性幹細胞由来心筋細胞において収縮性およびカルシウム測定を行う確立された方法について説明する。このプラットフォームにより、研究者は突然変異の影響とさまざまな刺激に対する応答を迅速かつ再現性のある方法で研究できます。
要約
ヒト人工多能性幹細胞由来心筋細胞(hiPSC-CM)は、突然変異を介した心筋細胞機能の変化を研究し、ストレッサーや薬物介入の影響を定義するための強力なツールです。本研究では、この光学系がhiPSC-CMの機能パラメータを2次元で評価するための強力なツールであることを実証した。このプラットフォームを使用することにより、異なるプレートレイアウトで保存状態の良い温度環境でペア測定を実行することができます。さらに、このシステムは研究者に即時のデータ分析を提供します。
本稿では、未修飾のhiPSC-CMの収縮性を測定する方法について述べる。収縮速度論は、250Hzのサンプリング周波数で緩和時に取得した参照フレームに対するピクセル相関の変化に基づいて、37°Cで測定されます。さらに、細胞内カルシウム過渡現象の同時測定は、Fura-2などのカルシウム感受性蛍光色素を細胞にロードすることによって取得できます。ハイパースイッチを使用して、収縮性測定の面積に対応する直径50μmの照明スポットでレシオメトリックカルシウム測定を実行できます。
概要
心不全は世界中の主要な死因です。2019年、心血管疾患は世界で1,860万人の死亡を引き起こし、これは過去10年間で17.1%の増加を反映しています1。心不全を予防および治癒するための薬物標的を特定するための研究者の努力にもかかわらず、患者の転帰は依然として貧弱です2。ヒトに対する動物モデルの病態生理の違いは、心不全治療の最適化のための限られた成功の根本的な要因の1つである可能性があります3。疾患をモデル化し、新規薬物化合物の毒性と有効性をテストするために、追加の人間のようなモデルが保証されています。
ヒト人工多能性幹細胞由来心筋細胞(hiPSC-CM)は、ストレッサー、虚血、代謝の変化、または病原性遺伝子変異によって誘発される細胞病態メカニズム、および薬物介入の有効性と毒性を定義するための強力なツールです4。hiPSC-CMの機能特性に対する効果を明らかにするには、細胞収縮の収縮期および拡張期特性を偏りのない再現性のある方法で測定する高速システムが必要です。今回の研究の全体的な目標は、光学系システムがhiPSC-CMの機能パラメータをリアルタイムで解析するための強力なツールであることを実証することです。
現在、hiPSC-CMの収縮性を評価するためのプラットフォームは複数あります。ただし、現在のシステムでは読み出しが遅いか、必要なセル数が課題になる可能性があります。ラベルフリービデオ測定システム5,6は、ビデオの事後分析に依存しているため、多くのストレージが必要であり、ビデオ取得中の直接フィードバックが不足しています。また、十分な時間分解能や空間分解能は達成が難しく、アンダーサンプリングにつながる可能性があります。蛍光レポーターを用いたクラスター化された規則的に間隔を空けた短い回文反復(CRISPR)/Cas9編集hiPSC-CMs7など、心筋細胞の特性を決定する他の方法は、細胞の遺伝子安定性を妨げる可能性があり、専門的な実験室の専門知識を必要とします。
上記の限界を克服するために、独自の光学ベースの測定システムを開発し、この研究で導入しました。このプラットフォームは、プレートサイズに制限なく、必要なプレートフォーマットに再メッキするだけで、未修飾のhiPSC-CMの収縮性測定を可能にします。さらに、リアルタイム測定により、hiPSC-CMの機能パラメータを直接観察および分析できるため、プロトコルを即座に調整および最適化するための実験設定が提供されます。さらに、各測定の場所が保存されるため、同じサンプルでペアの測定が可能になり、実験の検出力が向上します。
光学ベースのシステムを実証するために、対照hiPSC-CMラインで収縮性測定を実施しました。このコントロールhiPSC株は、正常な核型8を有する健康な男性ドナーの皮膚線維芽細胞から生成した。収縮速度論は、250Hzのサンプリング周波数での緩和中に取得された参照フレームに対するピクセル相関の変化に基づいて、37°Cで測定されました。収縮の正確な開始は必ずしも明確に決定できるとは限らないため、ピーク高さの20%に達した時点(ピークまでの時間20%)をピークまでの時間の測定の開始点としました。そうすることで、1つのサンプル内でこのパラメータの変動性が少なくなりました。同様に、信号がベースラインに戻る正確な瞬間を評価することは困難であるため、ピークからベースラインへの復帰の80%に達するのにかかった時間(ベースライン80%までの時間)を緩和時間を記述するために使用した。
全体的な収縮性測定には、静止拍動周波数、20%ピークからピーク収縮までの時間(TP。Con)、およびピーク収縮からベースラインの80%までの時間(TB。Con80)(図1B)。ストレッサーの効果を試験するために、細胞をイソプレナリン(ISO)と共にインキュベートした。加えて、収縮性測定と同時に、250Hzのサンプリング周波数で細胞にフラ−2−アセトキシメチルエステル(Fura−2AM)を負荷することによってCa2+過渡現象を測定した。 ハイパースイッチを用いたレシオメトリックCa2+測定9は、収縮性測定の面積に対応する直径50μmの照明領域上で行った。Ca2+測定データは、Ca2+過渡現象における20%ピークからピークまでの時間(TP.Ca)およびピークからベースラインの80%までの時間(TB.Ca80)として描かれる(図1C)。高速の自動データ分析ツールを使用して、各領域の平均収縮性およびカルシウム動態パラメータを生成しました。
プロトコル
1. 細胞培養培地および試薬の調製
- 49 mLのRPMI1640に1 mLのB27サプリメント(50倍)を加えてhiPSC-CM培地を調製します。
- まず、45 mLのhiPSC-CM培地に5 mLのノックアウト血清置換液を加えて再めっき培地を調製します。次に、Y-27632 ROCK阻害剤22.5 μL(1:2,000希釈、ストック濃度:10 mM)を添加し、十分に混合します。
- 以下に説明するように、基底膜コーティングプレートを準備します。
- 基底膜のバイアルを冷蔵庫またはアイスボックスで一晩解凍します。
- 基底膜を適量のダルベッコ改変イーグル培地/ハムF12(DMEM / F12)で希釈します。基底膜の各バッチの濃度は異なるため、1 mg/1 mL希釈に達するために必要なDMEM/F12の量を計算します。-20°Cで保存するために0.5または1 mLのアリコートを作ります。
注意: ステップ1.3.2は、フローフード内の氷上で実行する必要があります。 - 基底膜の0.5 mLアリコートを解凍し、6 mLのDMEM/F12で希釈します。よく混ぜます。
- 250 μLの希釈基底膜/ウェルを24ウェルプレートにピペッティングしてプレートをコーティングします。プレートフォーマットが異なる場合の各ウェルの表面積に基づいて計算します(例:6ウェルプレートでは1 mL/ウェル)。
- プレートを37°Cのインキュベーター内で1時間インキュベートします。
- Fura-2 AMをジメチルスルホキシド(DMSO)に溶解してFura-2 AMアリコートを調製し、製造元のマニュアルに従って1 mMアリコートを調製します。アリコートを-20°Cで保存します。
2. ヒトPSC-CMの培養
- hiPSC-CMのバイアルを37°Cの水浴中で解凍します。バイアルの解凍内容物を15mLチューブに移します。10 mLの再メッキ培地を細胞に滴下します。
- 細胞を100 × gで5分間遠心分離します。
- 上清を除去し、1mLの再メッキ培地を加える。ゆっくりと上下にピペットでペレットを再懸濁し、細胞の塊を取り除きます。
- 血球計算盤または自動セルカウンターを使用して、細胞の数をカウントします。
- インキュベートしたプレートから基底膜を取り出し、再メッキ培地と交換します。
- 基底膜でコーティングされた6/12/24/48/96ウェルプレート上に適切な細胞密度で細胞をプレートします(例:24ウェルプレートで250,000細胞/ウェル)。
注:Ca2+ 過渡実験の場合は、ガラス底プレートにセルをプレートします。 - 翌日に培地をhiPSC-CM培地に交換し、その後、24ウェルプレートで0.5 mL/ウェルを使用して1日おきに培地を更新します。
- hiPSC-CMが解凍および再メッキから回復したら、収縮性測定を実行します(このプロトコルでは再メッキ後3〜5日)。
注:不均一な細胞再播種の場合、細胞のグループが残りの再播種細胞と接触していない可能性があり、不規則または非同期の拍動パターンを示す可能性があります。非同期性を避けるために、細胞を均等に分布させ、各ウェルにhiPSC-CMの単分子膜を同期させることをお勧めします。
3.収縮性測定
- 光学ベースの測定システム、顕微鏡発光ダイオード(LED)光源、およびコンピューターの電源を入れます( 材料表を参照)。
- プログラムを開き、新しいファイルを開きます。画面の左上にある [ ファイル ] で、[ 新規] をクリックします。
- [収集]をクリックし、[実験]を選択して、[iPSC+カルシウム]を選択します。
- 空調装置の電源を入れます。温度を37°Cに、CO2 レベルを5%に設定します。
- hiPSC-CM培地をタイロード溶液(24ウェルプレートに0.5 mL/ウェル)に置き換えます。プレートの蓋を気候制御の蓋と交換します。
注意: カルシウム過渡測定を実行する必要がある場合は、セクション2で説明されているように、セルにFura-4AMをロードします。 - 温度が 37°Cであることが気候制御装置によって示されたら、プレートを光学ベースの測定システム内に置きます。
注:収縮は明視野条件を使用して測定されます。 - ツールバーの下にある[ セルファインダーを開く ]をクリックして、新しい画面がポップアップするのを待ちます。画面の右上で、 プレート形式 と ウェルを選択します。
- ウェルを1つ選択し、ウェル内の領域を選択して、同期した収縮と弛緩を観察し、スタートを押して、測定の追加をクリックします。設定で測定時間を選択します(面積あたり10秒)。非同期収縮測定値をすぐに破棄し、新しい領域を選択します。
メモ: リアルタイムの収縮性トランジェントはモニターで確認できます。同期収縮の場合、滑らかな連続過渡現象が観察されますが、非同期収縮の場合、小さな余分なピークが観察されます。 - ウェルのサイズに応じて、ウェル内の複数の領域を測定します。たとえば、この研究に従うには、24ウェルプレートでウェルあたり10個の領域を測定します。ベースライン測定のみが必要で、化合物をテストする予定がない場合は、ステップ3.13から続行します。
- ウェル内の領域が測定されたら、 完全 を押して光学ベースの測定器を開き、ストレッサー/化合物をウェルに追加します(例: 500 nM ISO、 タイロードに溶解)。
- 目的の化合物に応じてインキュベーション時間を選択します(このプロトコルではISOで2分)。
- 自動測定をクリックすると、光学ベースの測定器がベースライン測定が行われたのと同じ領域で 測定 を実行でき、ウェル内でペアの測定が可能になります。
- ウェル内のすべての測定が完了したら、 完了 を押します。
- 画面の右上から次のウェルを選択します。
- 必要なすべてのウェルの測定を続行します。
- 必要なウェルがすべて測定 されたら停止 をクリックし、ファイルを保存します。
注意: 気候制御は、安定したCO2を維持するために使用されます。これにより、化合物/ストレッサーがhiPSC-CMに及ぼす影響を高速に測定することができます。
4. カルシウム過渡測定
- 37°Cのタイロード溶液を調製します。
- Fura-2 AMアリコートをタイロード溶液に溶解して、最終濃度1 μMのFura-2 AMが細胞に添加されるようにします。
注意: Fura-2 AMを使用しているときは、光の露出を最小限に抑えるために、フローフードのライトがオフになっていることを確認してください。 - 培地を吸引し、Fura-2 AMを含むタイロード溶液と交換します。
- インキュベーターまたは光学ベースの測定システムで37°Cで15分間インキュベートします。
- Fura-2 AMを含むタイロード溶液を除去し、続いて新しいタイロード溶液で2倍洗浄します。最後に、細胞をタイロード溶液中で37°Cでさらに5分間インキュベートし、Fura-2 AMの脱エステル化を可能にします。
- プレートを光学ベースの測定システム内に置き、セクション3の説明に従って測定を開始します。
メモ: 手順 4.6.収縮測定と同時に測定を開始することにより、レシオメトリックカルシウム過渡が記録されます:100μmスポットでの340nmおよび385nmでの励起。510 ± 40 nmで収集された発光。収縮性のトレースに加えて、リアルタイムのレシオメトリックカルシウム過渡現象が画面に表示されます。
5.データ分析
- データを解析するには、デスクトップの 「サイトソルバー 」をクリックします。
- インポートをクリックし、分析するファイルを選択します。
- プログラムが解析を実行した後、画面に表示される許容トランジェント(青)と不合格(赤)のトランジェントを観察します(図1A)。
注:ここでは、信号対雑音比(SNR)と適合度(R2)によって定義される次のデフォルトの除去基準を使用しました:収縮トランジェントにはR2>0.9とSNR>4、カルシウムトランジェントにはR2>0.5とSNR>3。これらの拒絶基準は、測定の質、細胞の質、および研究者の主要な結果に応じて、ユーザーが調整できます。たとえば、研究者の関心が主に緩和速度論である場合、ピークまでの時間変数の基準を下げることができます。非常に強いカルシウム過渡現象が得られる場合は、SNRを大きくしてノイズの多いデータを除外する必要があります。 - エクスポートをクリックし、平均過渡データにチェックマークを付けます。スプレッドシートに表示される分析済みデータを検査します。
- コンピュータと他のすべての機器の電源を切ります。
結果
このプロトコルに従って、hiPSC-CMにおける収縮性、Ca2+ 過渡性、および化合物に対する応答の測定を行った。この光学系測定システムを用いることで、hiPSC-CMを必要なプレートに再めっきするだけで、収縮性測定を行うことができます。収縮性は、100 μm x 100 μmの関心領域(ROI)で、参照フレームに対するピクセル相関を計算することにより、毎秒250フレームで測定されます。参照系は、拡張末期にシステムによって自動的に検出されます。収縮測定と同時に、レシオメトリックカルシウム過渡が記録されます。
この研究では、3つの異なる分化ラウンドを3つの生物学的複製として使用しました。分化の各バッチについて、3つのウェルをテクニカルレプリケートとして測定した。この研究は24ウェルプレートを使用して実施され、各ウェル内の10の領域が測定されました。測定後、CytoSolverプログラムを使用してデータを直ちに分析しました。次のパラメータが報告されました:安静時の拍動周波数、TP。コン、そして結核。対照hiPSC-CMのCon80(図2A-C)。言及された各パラメータのデータの変動性を視覚化するために、各ウェル内の測定値および各微分ラウンドの3つのウェルの平均値がスーパープロット10として提示される。微分の各ラウンドおよび3つのラウンド間のデータの変動性をより適切に評価するために、各パラメータの分散係数(図2D)を計算しました。図2Dに示すように、1つの生物学的複製に対応するテクニカルレプリケートの値は、互いに非常に近い範囲内(すなわち、低い分散係数)にあり、この方法の堅牢性を示しています。
このアプリケーションは、薬物効果のテストに非常に適しています。ここでは、非選択的βアドレナリン受容体アゴニストである500 nM ISOが対照hiPSC-CMの収縮性に及ぼす影響を調べました。この化合物は心拍数を増加させ、正のルシトロピック効果を発揮することが知られています。 図3Aに示されているように、ISOはすべてのウェルで拍動頻度を有意に増加させた。ISOはまた、TPの減少で明らかな速度論を増加させた。短所と結核。コン80 (図3B、C)。全体として、ISOとのインキュベーション時に、収縮および緩和時間の短縮とともに、すべてのウェルで拍動頻度が有意に増加し、この化合物に対する期待される応答がこのプラットフォームによって登録されたことが示された。
収縮性測定と並行して、カルシウム測定も行った。収縮性データ(図2)と同様に、hiPSC-CMのカルシウム測定データを 図4に示します。TB.Ca80 は、単離されたラットまたはマウス心筋細胞よりもかなり遅く、これは、種および心拍数の違い11、ならびに初代細胞と比較して筋小胞体内のカルシウム動態が低く、カルシウム取り扱いタンパク質の発現が低いことによるhiPSC-CMにおける未熟なカルシウム取り扱いによって部分的に説明される12.収縮性データと同様に、カルシウム測定値の分散係数が計算され、技術的および生物学的反復内で低い変動性を示しています(図4C)。
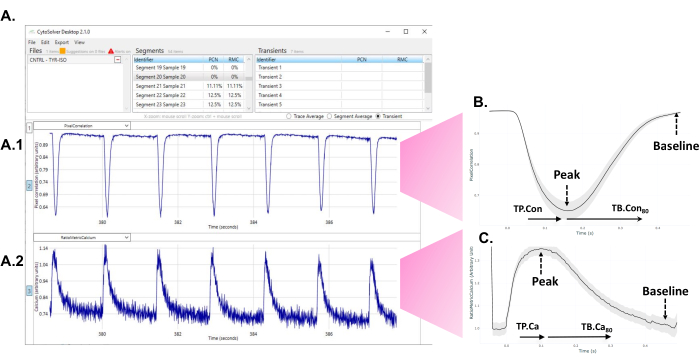
図1:実験後、CytoSolver過渡解析ツールをすぐに使用してデータを解析する 。 (A)井戸内で測定された1つの領域の許容された過渡現象(すべて青色)の例。パネル A1 は、収縮性過渡現象を示しています。パネル A2 はカルシウムトランジェントを表す。(B)1回の分化の3つのウェルでの測定から得られた一過性の平均収縮性。各単一または平均過渡現象から、異なる時点からピークまでのデータ (TP.Con)およびベースラインまでの時間(TB。Con)の収縮性過渡性を抽出できた。収縮の正確な開始は常に明確に決定できるとは限らないため、ピークまでの時間20%をピークまでの時間の測定の開始点とします。同様に、信号がベースラインに戻る正確な瞬間を評価することは困難です。したがって、ベースライン80%までの時間が緩和時間を記述するために使用される。ここでは、TP。Con(ピークまでの時間 - ピークまでの時間20%)およびTB。Con 80(ベースラインまでの時間80 %-ピークまでの時間)が使用されます。(C)1回の分化の3つのウェルにおける測定値から得られた平均カルシウム一過性データ。各単一または平均カルシウム過渡現象から、カルシウム過渡現象のピークまでの時間(TP.Ca)およびベースラインまでの時間(TB.Ca)の異なる時点からのデータを抽出できた。ピークまでの時間の測定の場合、開始点はピークまでの時間が20%であり、ベースラインまでの時間の場合、終了点はベースラインまでの時間が80%です。この調査では、TP.Ca(ピークまでの時間-ピークまでの時間20%)と TB.Ca80 (ベースラインまでの時間80%-ピークまでの時間)が使用されます。 この図の拡大版を表示するには、ここをクリックしてください。
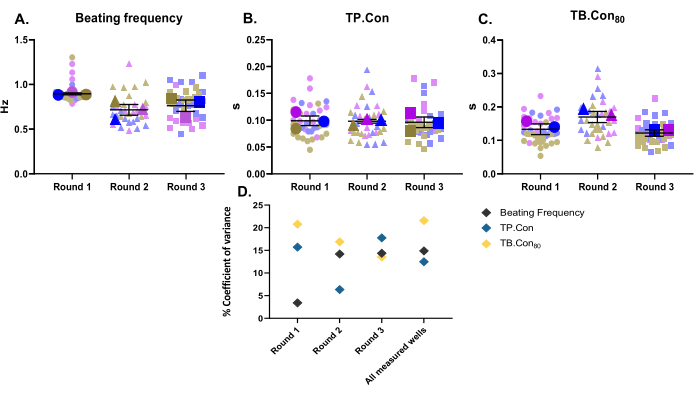
図2:3つの異なる分化ラウンドで実行されたベースライン収縮性測定。 分化の各ラウンドのための3つの生物学的複製および3つのウェル(すなわち、3つの技術的複製)。各鑑別ラウンドの3つの主要な記号は、各ウェル内の測定領域(色あせた色の背景記号)の平均値を表します。データはSEM±平均値として示され、静止拍動頻度に関するデータはヘルツで表され、TPで表されます。短所と結核。Con80、データは秒単位です。(A)安静時の鼓動頻度。(B) ピークまでの時間(TP.短所)。(C)ベースラインまでの時間80%(TB。Con80)。(D)各ラウンドで得られたデータ間および3ラウンドすべての微分間の変動を評価するために、各ウェルの平均値を使用して分散係数パーセンテージを計算しました。 この図の拡大版を表示するには、ここをクリックしてください。
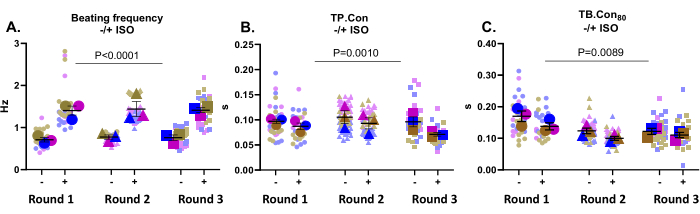
図3:ベースライン時(-)および3回の分化から3つのウェルでISO(+)とインキュベートした後の収縮性測定。 (A)安静時の拍動頻度(-)および500 nM ISO(+)とのインキュベーション後の拍動頻度。(B) ピークまでの時間(TP.Con)ベースライン時およびISOとのインキュベーション後の測定。(C)ベースラインまでの時間80%(TB。Con80)ベースライン時およびISOとのインキュベーション後の測定値。収縮性パラメータに対するISOの影響を評価するために、ボンフェローニ補正を用いた二元配置分散分析を実施した。データはSEM±平均値として示され、安静時の拍動頻度に関するデータはヘルツで表され、TPで表されます。短所と結核。Con80では、データは秒単位で表されます。この図の拡大版を表示するには、ここをクリックしてください。
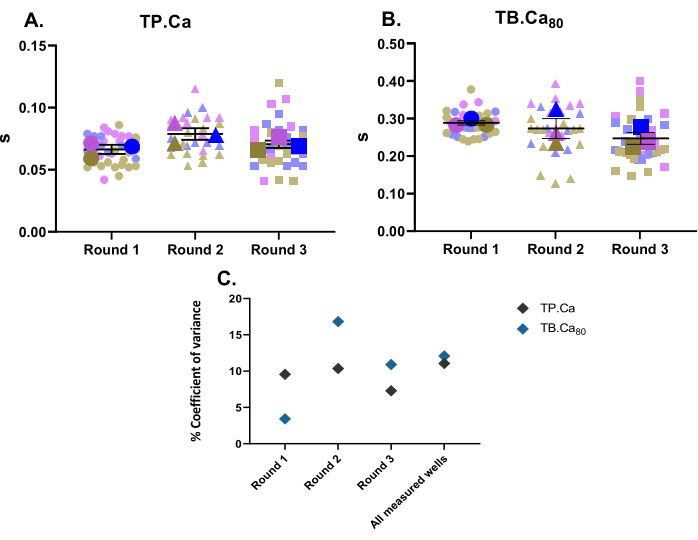
図4:3回の分化から3つのウェルで実施したベースラインカルシウム一過性測定。 (A)カルシウム過渡現象のピークまでの時間(TP.Ca)および(B)ベースラインまでの時間80%(TB.Ca80)。データはSEM±平均値として示され、TP.Ca および TB.Ca80 のデータは秒単位で表されます。(C)各ラウンドで得られたデータ間および3ラウンドすべての微分間の変動を評価するために、各ウェルの平均値を使用して分散係数パーセンテージを計算しました。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
本研究では、hiPSC-CMの収縮性およびカルシウム一過性測定を行い、これらの細胞に対するストレッサー/薬剤の影響を調べる方法について説明します。収縮性測定、レシオメトリックカルシウム測定、およびISOへの応答は、生物学的複製として3つの異なる分化ラウンドで実施されました。各生物学的複製について、テクニカル複製として3つのウェルで測定を実施した。この方法で測定を実行する理由は、サンプルとプラットフォームの生物学的変動性と技術的変動性を確実に評価できるようにするためです。適切な生物学的および技術的複製数を考慮することは別として、hiPSC-CM培養条件は、一定かつ堅牢な結果を得るために重要な役割を果たす可能性があります。測定中は、hiPSC-CMの年齢、培地の組成、再メッキ条件、化合物のインキュベーション時間などの基準と一致させることが重要です。この研究では、1つのウェルで11の領域を10秒間2回測定するのに平均568±24秒かかりました。これには、79 ± 11秒のISOインキュベーション時間が含まれます。これはウェルあたり約10分に短縮され、研究者は~4時間で完全な24ウェルプレートを測定できるはずです。気候制御は、安定したCO2を維持するために使用されます。これにより、化合物/ストレッサーがhiPSC-CMに及ぼす影響を高速に測定することができます。
iPSC-CMの収縮機能を測定するために、オプトジェネティクス13またはラベルフリーのビデオベースの顕微鏡5,6に依存するいくつかの既存のシステムがあります。オプトジェネティクスシステムは非常に複雑であり、電気物理学的および/または収縮性データを取得するために特別な技術が必要です。他のシステムは、ビデオの事後分析に依存しているため、多くのストレージが必要であり、ビデオ取得中の直接フィードバックがありません。また、十分な時間分解能や空間分解能が得られにくく、アンダーサンプリングが発生する可能性があります。同様に、蛍光レポーター7を用いたCRISPR/CAS-9編集hiPSC-CMは、心筋細胞の挙動に望ましくない影響を与える可能性があります。収縮緩和測定に蛍光色素を使用することも洗練されたアプローチですが、同じサンプルで長期間にわたって実験を行うことは制限されます14。
しかし、この光学ベースの測定プラットフォームは、蛍光色素や侵襲的な方法を使用せずに収縮緩和時間を測定するために使用できます。しかし、画素相関は空間情報を提供しないため、この方法では収縮の強さを測定することはできず、収縮と緩和の速度の変化を確実に検出することしかできません。導入した測定システムは温度制御されており、カルシウムと収縮性のデータを毎秒>200フレームの分解能でリアルタイムに取得できます。さらに、各測定の場所が保存されるため、ペアの測定が可能になり、実験の検出力が向上します。さらに、このプラットフォームは、研究者にデータを保存し、実験後すぐに分析する機能を提供します。全体として、この光学ベースの測定システムは、細胞の病態メカニズムを研究するための有望な方法であり、hiPSC-CMの機能に対する化合物の効果を評価でき、薬物スクリーニングの前臨床プロセスに役立つ可能性があります。
開示事項
EMはサイトサイファーBVの従業員です。MHはCytoCypher BVのCEOです。残りの著者は、潜在的な利益相反として解釈される可能性のある商業的または金銭的関係がない状態で研究が行われたと宣言しています。
謝辞
この研究の一部は、ユーロスターズ助成金Estars2 113937 CARDIOMYO(EM & DK)、およびNWO-VICI助成金91818602(JV)によって資金提供されています。
資料
| Name | Company | Catalog Number | Comments |
| µ-Plate 24 Well Black ID 14 mm | ibidi | 82421 | |
| B-27 Supplement (50x) | Thermo Fisher | 17504044 | |
| CytoSolver transient analysis tool | CytoCypher | A fast automatic data analysis tool | |
| DMEM/F-12 | Thermo Fisher | 11320033 | |
| Fura-2, AM | Thermo Fisher | F1221 | |
| Isoprenaline hydrochloride | Merck | 15627 | |
| KnockOut™ Serum Replacement | Thermo Fisher | 10828010 | |
| Matrigel | Merck | CLS3542C | Basement membrane |
| MultiCell CytoCypher with Nikon 20x Super Fluor objective and 730 nm LED light source and Ionwizard software | CytoCypher | Optics-based measurement system | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI 1640 | Thermo Fisher | 11875119 | |
| Tyrode | Self-made solution with final concentration of the following components: NaCl 134 mM, KCl 5 mM, Hepes 12 mM, MgSO4 1.2 mM, NaH2PO4 H2O 1.2 mM, Glucose 11 mM, Sodium Pyrovate 5 mM, 1 mM CaCl2 |
参考文献
- Tsao, C. W., et al. Heart disease and stroke statistics-2022 update: a report from the American Heart Association. Circulation. 145 (8), e153 (2022).
- Ghionzoli, N., et al. Current and emerging drug targets in heart failure treatment. Heart Failure Reviews. 27 (4), 1119-1136 (2022).
- Criscione, J., et al. Heart-on-a-chip platforms and biosensor integration for disease modeling and phenotypic drug screening. Biosensors and Bioelectronics. 220, 114840 (2023).
- vander Velden, J., et al. Animal models and animal-free innovations for cardiovascular research: current status and routes to be explored. Consensus document of the ESC Working Group on Myocardial Function and the ESC Working Group on Cellular Biology of the Heart. Cardiovascular Research. 118 (15), 3016-3051 (2022).
- Maddah, M., et al. A non-invasive platform for functional characterization of stem-cell-derived cardiomyocytes with applications in cardiotoxicity testing. Stem Cell Reports. 4 (4), 621-631 (2015).
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), e5-e16 (2018).
- Sharma, A., et al. CRISPR/Cas9-mediated fluorescent tagging of endogenous proteins in human pluripotent stem cells. Current Protocols in Human Genetics. 96 (1), 1-20 (2018).
- Wang, L., et al. Hypertrophic cardiomyopathy-linked mutation in troponin T causes myofibrillar disarray and pro-arrhythmic action potential changes in human iPSC cardiomyocytes. Journal of Molecular and Cellular Cardiology. 114, 320-327 (2018).
- Luo, X., et al. IP3R-mediated compensatory mechanism for calcium handling in human induced pluripotent stem cell-derived cardiomyocytes with cardiac ryanodine receptor deficiency. Frontiers in Cell and Developmental Biology. 8, 772 (2020).
- Lord, S. J., Velle, K. B., Mullins, R. D., Fritz-Laylin, L. K. SuperPlots: communicating reproducibility and variability in cell biology. The Journal of Cellular Biology. 219 (6), e202001064 (2020).
- Milani-Nejad, N., Janssen, P. M. L. Small and large animal models in cardiac contraction research: advantages and disadvantages. Pharmacology and Therapeutics. 141 (3), 235-249 (2014).
- Karbassi, E., et al. Cardiomyocyte maturation: advances in knowledge and implications for regenerative medicine. Nature Reviews Cardiology. 17 (6), 341-359 (2020).
- Klimas, A., Ortiz, G., Boggess, S. C., Miller, E. W., Entcheva, E. Multimodal on-axis platform for all-optical electrophysiology with near-infrared probes in human stem-cell-derived cardiomyocytes. Progress in Biophysics and Molecular Biology. 154, 62-70 (2020).
- van Meer, B. J., et al. Simultaneous measurement of excitation-contraction coupling parameters identifies mechanisms underlying contractile responses of hiPSC-derived cardiomyocytes. Nature Communications. 10 (1), 4325 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved