Medidas em Tempo Real de Parâmetros de Cálcio e Contratilidade em Cardiomiócitos Derivados de Células-Tronco Pluripotentes Induzidos Humanos
In This Article
Summary
Aqui, um método estabelecido é descrito para realizar medidas de contratilidade e cálcio em cardiomiócitos derivados de células-tronco pluripotentes induzidos por humanos usando uma plataforma óptica. Esta plataforma permite aos investigadores estudar o efeito das mutações e a resposta a vários estímulos de forma rápida e reprodutível.
Abstract
Os cardiomiócitos derivados de células-tronco pluripotentes induzidos por humanos (hiPSC-CMs) representam uma ferramenta poderosa para estudar alterações mediadas por mutações na função dos cardiomiócitos e definir os efeitos de estressores e intervenções medicamentosas. Neste estudo, demonstra-se que este sistema óptico é uma ferramenta poderosa para avaliar os parâmetros funcionais das hiPSC-CMs em 2D. Usando esta plataforma, é possível realizar medições pareadas em um ambiente de temperatura bem preservado em diferentes layouts de placas. Além disso, esse sistema fornece aos pesquisadores uma análise instantânea dos dados.
Este trabalho descreve um método para medir a contratilidade de hiPSC-CMs não modificados. A cinética de contração é medida a 37 °C com base em mudanças de correlação de pixels em relação a um quadro de referência tomado no relaxamento a uma frequência de amostragem de 250 Hz. Além disso, medidas simultâneas de transientes de cálcio intracelulares podem ser adquiridas carregando a célula com um fluoróforo sensível ao cálcio, como o Fura-2. Usando um hiperinterruptor, as medidas ratiométricas de cálcio podem ser realizadas em um ponto de iluminação de 50 μm de diâmetro, correspondendo à área das medidas de contratilidade.
Introduction
A insuficiência cardíaca é a principal causa de morte no mundo. Em 2019, as doenças cardiovasculares causaram 18,6 milhões de mortes no mundo, o que reflete um aumento de 17,1% na última década1. Apesar dos esforços dos pesquisadores em identificar alvos de drogas para prevenir e curar a insuficiência cardíaca, os resultados dos pacientes ainda são pobres2. A diferença na fisiopatologia de modelos animais em relação aos humanos pode ser um dos fatores subjacentes ao sucesso limitado para a otimização da terapia da insuficiência cardíaca3. Modelos adicionais semelhantes aos humanos são necessários para modelar doenças e testar a toxicidade e eficácia de novos compostos de drogas.
Os cardiomiócitos derivados de células-tronco pluripotentes induzidos por humanos (hiPSC-CMs) representam uma ferramenta poderosa para definir patomecanismos celulares induzidos por estressores, isquemia, metabolismo alterado ou variantes gênicas patogênicas, e a efetividade e toxicidade de intervenções medicamentosas4. Para definir os efeitos sobre as propriedades funcionais dos MC-hiPSC, justifica-se um sistema de alta velocidade que meça as propriedades sistólicas e diastólicas das contrações celulares de forma imparcial e reprodutível. Este objetivo geral do presente estudo é demonstrar que um sistema óptico é uma ferramenta poderosa para realizar análises em tempo real dos parâmetros funcionais de hiPSC-CMs.
Atualmente, existem múltiplas plataformas para avaliar a contratilidade de hiPSC-CMs. No entanto, os sistemas atuais oferecem uma leitura lenta ou o número necessário de células pode ser um desafio. Os sistemas de medição de vídeo sem rótulos5,6 dependem da análise post-hoc de vídeos, que requer muito armazenamento e carece de feedback direto durante a aquisição de vídeo. Além disso, resolução temporal e espacial suficiente é difícil de alcançar, e pode resultar em subamostragem. Outros métodos para determinar as propriedades dos cardiomiócitos, como repetições palindrômicas curtas agrupadas regularmente interespaçadas (CRISPR)/hiPSC-CMs editadas por Cas9 7 com repórteres fluorescentes, podem interferir na estabilidade gênica das células e exigir experiência laboratorial especializada.
Para superar as limitações mencionadas acima, um sistema de medição baseado em óptica único foi desenvolvido e introduzido neste estudo. Esta plataforma permite medições de contratilidade em hiPSC-CMs não modificados, simplesmente replaqueando-os em qualquer formato de placa necessário, sem qualquer limitação no tamanho da placa. Além disso, as medidas em tempo real permitem a observação direta e a análise dos parâmetros funcionais dos hiPSC-CMs, fornecendo um cenário experimental para ajustar e otimizar instantaneamente os protocolos. Além disso, o local de cada medida é armazenado, o que permite medidas pareadas na mesma amostra, aumentando assim o poder dos experimentos.
Para demonstrar o sistema óptico, medidas de contratilidade foram realizadas em uma linha controle hiPSC-CM. Essa linhagem controle de hiPSC foi gerada a partir do fibroblasto dérmico de um doador hígido do sexo masculino com cariótiponormal8. A cinética de contração foi medida a 37 °C, com base em mudanças de correlação de pixels em relação a um quadro de referência tomado durante o relaxamento a uma frequência de amostragem de 250 Hz. Como o início exato da contração nem sempre pode ser determinado de forma inequívoca, o ponto de tempo em que 20% da altura do pico foi atingido (tempo para o pico de 20%) foi tomado como ponto de partida para as medidas do tempo até o pico. Com isso, menor variabilidade foi encontrada para esse parâmetro dentro de uma amostra. Da mesma forma, como o momento exato em que o sinal retorna à linha de base é difícil de avaliar, o tempo necessário para atingir 80% do retorno à linha de base do pico (tempo até a linha de base 80%) foi usado para descrever o tempo de relaxamento.
As medidas de contratilidade global incluíram frequências de batimento em repouso, o tempo de 20% do pico ao pico de contração (TP. Con) e o tempo entre o pico de contração e 80% do valor basal (TB. Con80) (Figura 1B). Para testar o efeito de um estressor, as células foram incubadas com isoprenalina (ISO). Além disso, coincidentemente com as medidas de contratilidade, os transientes de Ca 2+ foram medidos carregando as células com éster de Fura-2-acetoximetil (Fura-2 AM) a uma frequência de amostragem de 250 Hz. As medidas ratiométricas de Ca 2+ 9 usando um hiperinterruptor foram feitas em uma área de iluminação de 50 μm de diâmetro, correspondente à área das medidas de contratilidade. Os dados de medição de Ca 2+ são representados como o tempo de 20% do pico ao pico no Ca2+ transitório (TP.Ca) e o tempo do pico a 80% do basal (TB.Ca80) (Figura 1C). Uma ferramenta de análise de dados rápida e automática foi usada para obter parâmetros contráteis e cinéticos de cálcio médios para cada área.
Protocol
1. Preparação de meios de cultura celular e reagentes
- Preparar o meio hiPSC-CM adicionando 1 mL de suplemento B27 (50x) a 49 mL de RPMI1640.
- Preparar o meio de replaqueamento adicionando primeiro 5 mL de reposição de soro knockout a 45 mL de meio hiPSC-CM. Em seguida, adicionar 22,5 μL do inibidor Y-27632 ROCK (diluição 1:2.000; concentração estoque: 10 mM) e misturar completamente.
- Prepare placas revestidas com membrana basal conforme descrito abaixo:
- Descongele um frasco de membrana basal durante a noite na geladeira ou em uma caixa de gelo.
- Diluir a membrana basal com uma quantidade adequada de Dulbecco's modified Eagle's medium/Ham's F12 (DMEM/F12). Como cada lote de membrana basal tem uma concentração diferente, calcule a quantidade de DMEM/F12 necessária para atingir uma diluição de 1 mg/1 mL. Fazer alíquotas de 0,5 ou 1 mL para armazenamento a -20 °C.
NOTA: O passo 1.3.2 precisa ser feito no gelo dentro de uma coifa de fluxo. - Descongelar a alíquota de 0,5 mL da membrana basal e diluí-la com 6 mL de DMEM/F12. Homogeneizar.
- Revestir a placa pipetando 250 μL de membrana basal/poço diluído em uma placa de 24 poços. Calcule com base na área de superfície de cada poço para diferentes formatos de placa, por exemplo, 1 mL/poço em uma placa de 6 poços.
- Incubar a placa durante 1 h numa incubadora a 37 °C.
- Preparar alíquotas Fura-2 AM dissolvendo Fura-2 AM em dimetilsulfóxido (DMSO), de acordo com o manual do fabricante para preparar alíquotas de 1 mM. Conservar as alíquotas a -20 °C.
2. Cultura de hiPSC-CMs
- Descongelar um frasco para injetáveis de hiPSC-CMs num banho-maria a 37 °C. Transfira o conteúdo descongelado do frasco para injetáveis para um tubo de 15 ml. Adicionar 10 mL do meio de replaqueamento em gota gota às células.
- Centrifugar as células durante 5 min a 100 × g.
- Retire o sobrenadante e adicione 1 mL de meio de replaqueamento. Pipete suavemente para cima e para baixo para ressuspender o pellet e remover quaisquer aglomerados celulares.
- Use um hemocitômetro ou um contador de células automatizado para contar o número de células.
- Remova a membrana basal da placa incubada e substitua-a pelo meio de replaqueamento.
- Plaquear as células com uma densidade celular apropriada em uma placa de 6/12/24/48/96 poços revestida com membrana basal (por exemplo, 250.000 células/poço em uma placa de 24 poços).
NOTA: Para experimentos transitórios de Ca2+ , plaqueie as células em placas com fundo de vidro. - Substitua o meio por meio de cultura hiPSC-CM no dia seguinte e, posteriormente, atualize o meio a cada dois dias usando 0,5 mL/poço em uma placa de 24 poços.
- Realizar as medidas de contratilidade uma vez que os hiPSC-CMs tenham se recuperado do descongelamento e replaqueamento (3-5 dias após o replaqueamento neste protocolo).
NOTA: Em caso de replaqueamento irregular de células, é possível que um grupo de células não esteja em contato com o resto das células replaqueadas e possa mostrar algum padrão de batimento irregular ou não sincronizado. Para evitar assincronia, recomenda-se ter uma distribuição uniforme de células e uma monocamada sincronizada e bem conectada de hiPSC-CMs em cada poço.
3. Medidas de contratilidade
- Ligue o sistema de medição baseado em óptica, a fonte de luz de diodo emissor de luz (LED) do microscópio e o computador (consulte a Tabela de Materiais).
- Abra o programa e abra um novo arquivo. Em Arquivo no canto superior esquerdo da tela, clique em Novo.
- Clique em Coletar, escolha Experimentos e, em seguida, selecione "iPSC + Cálcio".
- Ligue o dispositivo de climatização. Ajuste a temperatura para 37 °C e o nível de CO2 para 5%.
- Substitua o meio de cultura hiPSC-CM por solução de Tyrode (0,5 mL/poço em placa de 24 poços). Substitua a tampa da placa pela tampa do controle de temperatura.
NOTA: Se for necessário efectuar medições transitórias de cálcio, carregar as células com Fura-2 AM, conforme descrito na secção 4. - Coloque a placa dentro do sistema de medição baseado em óptica assim que o dispositivo de climatização mostrar que a temperatura é de 37 °C.
NOTA: A contração é medida usando condições de campo brilhante. - Clique em Abrir localizador de células na barra de ferramentas e aguarde até que uma nova tela apareça. No canto superior direito da tela, selecione o formato da placa e o poço.
- Selecione um poço, escolha uma área dentro do poço para observar a contração e relaxamento sincronizados, pressione o botão iniciar, clique em Adicionar medição. Selecione a duração das medições nas configurações (10 s por área). Descarte medidas de contração assincronizadas imediatamente e selecione uma nova área.
NOTA: Os transientes de contratilidade em tempo real podem ser vistos no monitor. Para contrações sincronizadas, observa-se um transiente contínuo suave, enquanto para contrações assincronizadas, pequenos picos extras são observados. - Meça várias áreas dentro do poço dependendo do tamanho do poço. Por exemplo, para acompanhar este estudo, meça 10 áreas por poço em uma placa de 24 poços. Caso apenas sejam necessárias medições basais e não haja nenhum plano para testar qualquer composto, continue a partir da etapa 3.13.
- Depois que as áreas dentro de um poço forem medidas, pressione complete e abra o instrumento de medição baseado em óptica para adicionar o estressor/composto ao poço (por exemplo, ISO de 500 nM, dissolvido em Tyrode).
- Escolha o tempo de incubação dependendo do composto de interesse (2 min com ISO neste protocolo).
- Clique na medição automática para permitir que o instrumento de medição baseado em óptica realize medições nas mesmas áreas onde as medições basais foram realizadas, resultando em medições pareadas dentro do poço.
- Pressione complete uma vez que todas as medições no poço tenham sido realizadas.
- Escolha o próximo poço no canto superior direito da tela.
- Continuar as medições de todos os poços necessários.
- Clique em parar depois que todos os poços necessários tiverem sido medidos e salve o arquivo.
NOTA: O controle climático é usado para manter o CO2 estável. Isso permite medir o efeito de compostos/estressores em hiPSC-CMs de maneira rápida.
4. Medições transitórias de cálcio
- Preparar solução de tirodeo a 37 °C.
- Dissolver as alíquotas de Fura-2 AM em solução de Tyrode para que uma concentração final de 1 μM de Fura-2 AM seja adicionada às células.
NOTA: Ao usar o Fura-2 AM, verifique se as luzes no capô de fluxo estão apagadas para minimizar a exposição à luz. - Aspirar o meio e substituí-lo por solução de Tyrode contendo Fura-2 AM.
- Incubar durante 15 minutos a 37 °C numa incubadora ou no sistema de medição baseado em óptica.
- Retire a solução de Tyrode que contém Fura-2 AM e, em seguida, lave 2x com solução fresca de Tyrode. Finalmente, incubar as células em solução de Tyrode por mais 5 min a 37 °C para permitir a desesterificação de Fura-2 AM.
- Coloque a placa dentro do sistema de medição baseado em óptica e inicie as medições, conforme descrito no ponto 3.
NOTA: Na etapa 4.6. iniciando as medidas simultaneamente com as medidas de contração, um transiente de cálcio ratiométrico é registrado: excitação a 340 nm e 385 nm em um ponto de 100 μm; emissão coletada a 510 ± 40 nm. Além dos traços de contratilidade, transientes de cálcio ratiométricos em tempo real aparecerão na tela.
5. Análise dos dados
- Para analisar os dados, clique em CytoSolver na área de trabalho.
- Clique em importar e selecione o(s) arquivo(s) a ser analisado(s).
- Após o programa realizar a análise, observe os transientes aceitos (azul) e rejeitados (vermelho) que aparecem na tela (Figura 1A).
NOTA: Aqui, foram utilizados os seguintes critérios padrão de rejeição, definidos pela relação sinal/ruído (S/R) e qualidade de ajuste (R 2): R 2 > 0,9 e SNR > 4 para transientes de contração, e R2 > 0,5 e SNR > 3 para transientes de cálcio. Esses critérios de rejeição podem ser ajustados pelo usuário dependendo da qualidade das medidas, da qualidade das células e do desfecho primário para o pesquisador. Por exemplo, se o interesse do pesquisador é principalmente cinética de relaxamento, os critérios poderiam ser reduzidos para o tempo até as variáveis de pico. Se forem obtidos transientes de cálcio muito fortes, a relação S/R pode ter de ser aumentada para excluir dados mais ruidosos. - Clique em exportar e marque para obter os dados transitórios médios. Inspecione os dados analisados apresentados em uma planilha.
- Desligue o computador e todos os outros instrumentos.
Representative Results
Seguindo esse protocolo, foram realizadas medidas de contratilidade, transientes de Ca2+ e resposta a um composto em MC-hiPSC. Usando este sistema de medição baseado em óptica, os hiPSC-CMs poderiam simplesmente ser replaqueados nas placas necessárias, e as medidas de contratilidade poderiam ser realizadas. A contratilidade é medida em uma região de interesse (ROI) de 100 μm x 100 μm a 250 quadros por segundo, calculando a correlação de pixels em relação a um quadro de referência. O quadro de referência é detectado automaticamente pelo sistema no final da diástole. Simultaneamente com as medidas de contração, um transiente de cálcio ratiométrico é registrado.
Neste estudo, três diferentes rodadas de diferenciação foram usadas como três réplicas biológicas. Para cada lote de diferenciação, três poços foram medidos como réplicas técnicas. Este estudo foi realizado com placas de 24 poços, sendo mensuradas 10 áreas dentro de cada poço. Após as medidas, o programa CytoSolver foi utilizado para analisar imediatamente os dados. Os seguintes parâmetros foram relatados: frequência de batimento de repouso, TP. Contra, e TB. Con80 dos hiPSC-CMs de controle (Figura 2A-C). Para visualizar a variabilidade dos dados para cada parâmetro mencionado, as medidas dentro de cada poço e os valores médios de três poços para cada rodada de diferenciação são apresentados como superplots10. Para melhor avaliar a variabilidade dos dados para cada rodada de diferenciação e entre as três rodadas, foi calculado o coeficiente de variância (Figura 2D) para cada parâmetro. Como mostrado na Figura 2D, os valores das réplicas técnicas correspondentes a uma réplica biológica estão dentro de uma faixa muito próxima entre si (ou seja, baixo coeficiente de variância), o que ilustra a robustez deste método.
Esta aplicação é muito bem adequada para testar os efeitos da droga. Aqui, testou-se o efeito do ISO 500 nM, um agonista não seletivo dos receptores β-adrenérgicos, sobre a contratilidade dos hiPSC-CMs controle. Este composto é conhecido por aumentar a frequência cardíaca e exercer um efeito lusitrópico positivo. Como mostrado na Figura 3A, o ISO aumentou significativamente a frequência de batimento em todos os poços. O ISO também aumentou a cinética, evidente na diminuição do TP. Contras e TB. Con80 (Figura 3B,C). No geral, após a incubação com ISO, a frequência de batimento foi significativamente aumentada em todos os poços, juntamente com uma redução no tempo de contração e relaxamento, o que indicou que a resposta esperada a este composto foi registrada por esta plataforma.
Paralelamente às medidas de contratilidade, também foram realizadas medidas de cálcio. Da mesma forma que os dados de contratilidade (Figura 2), os dados de mensuração de cálcio das hiPSC-MCs estão representados na Figura 4. A TB.Ca80 é consideravelmente mais lenta do que em cardiomiócitos isolados de ratos ou camundongos, o que é parcialmente explicado por diferenças de espécie e frequência cardíaca11, bem como pela manipulação imatura de cálcio em hiPSC-CMs devido à menor dinâmica do cálcio dentro do retículo sarcoplasmático e menor expressão de proteínas de manipulação de cálcio em comparação com células primárias12. Semelhante aos dados de contratilidade, o coeficiente de variância para as medidas de cálcio foi calculado, mostrando baixa variabilidade dentro das réplicas técnicas e biológicas (Figura 4C).
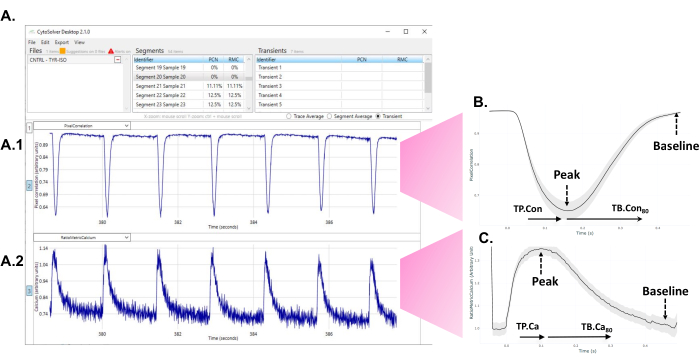
Figura 1: Uso imediato da ferramenta de análise transitória CytoSolver após o experimento para analisar os dados. (A) Um exemplo dos transientes aceitos (todos em azul) de uma área medida dentro de um poço. O painel A1 mostra os transientes contráteis. O painel A2 representa os transientes de cálcio. (B) Transiente de contratilidade médio obtido a partir de medições em três poços de uma rodada de diferenciação. A partir de cada transiente único ou médio, dados de diferentes momentos até o pico (TP. Con) e tempo até a linha de base (TB. Con) da contratilidade transiente poderia ser extraída. Como o início exato da contração nem sempre pode ser determinado de forma inequívoca, o tempo até o pico de 20% é tomado como ponto de partida para as medições do tempo até o pico. Da mesma forma, o momento exato em que o sinal retorna à linha de base é difícil de avaliar. Portanto, o tempo até a linha de base 80% é usado para descrever o tempo de relaxamento. Aqui, TP. Con (tempo para pico - tempo para pico 20%) e TB. Con80 (tempo para a linha de base 80% - tempo para o pico) são usados. (C) Dados médios de transientes de cálcio obtidos a partir de medições em três poços de uma rodada de diferenciação. De cada transiente de cálcio único ou médio, dados de diferentes momentos de tempo para o pico (TP.Ca) e tempo para o início (TB.Ca) dos transientes de cálcio puderam ser extraídos. Para medições de tempo para pico, o ponto de partida é o tempo para atingir o pico de 20%, e para o tempo para a linha de base, o ponto final é o tempo para a linha de base 80%. Neste estudo, são utilizados TP.Ca(tempo para pico - tempo para pico 20%) e TB.Ca 80 (tempo para basal 80% - tempo para pico). Clique aqui para ver uma versão maior desta figura.
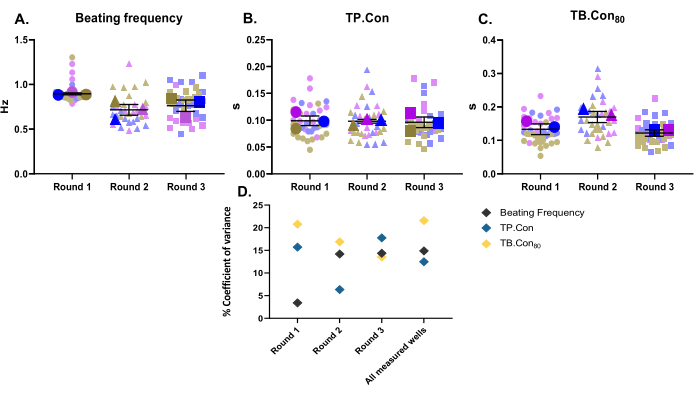
Figura 2: Medidas basais de contratilidade realizadas em três diferentes rodadas de diferenciação. Três réplicas biológicas e três poços para cada rodada de diferenciação (ou seja, três réplicas técnicas). Três símbolos principais para cada rodada de diferenciação representam o valor médio das áreas medidas (os símbolos de fundo em cores desbotadas) dentro de cada poço. Os dados são apresentados como média ± EPM. Os dados referentes à frequência de batimento em repouso estão representados em Hertz e para PT. Contras e TB. Con80, os dados são em segundos. (A) Frequência de batimento em repouso. (B) Tempo para o pico (TP. Contra). (C) Tempo basal 80% (TB. Con80). (D) Para avaliar a variação entre os dados obtidos em cada rodada e entre as três rodadas de diferenciação, o coeficiente de variância percentual foi calculado utilizando-se os valores médios de cada poço. Clique aqui para ver uma versão maior desta figura.
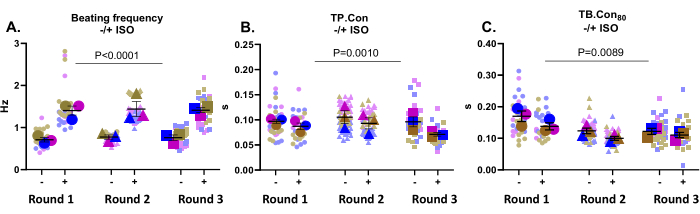
Figura 3: Medidas de contratilidade no início do estudo (-) e após incubação com ISO (+) em três poços de três rodadas de diferenciação. (A) A frequência de batimento de repouso (-) e a frequência de batimento após incubação com ISO 500 nM (+). (B) Tempo para o pico (TP. Con) medidas basais e após incubação com ISO. (C) Tempo basal 80% (TB. Con80) no início e após incubação com ISO. Para avaliar o efeito do ISO sobre os parâmetros de contratilidade, foi realizada uma Anova two-way com correção de Bonferroni. Os dados são apresentados como média ± EPM. Os dados referentes à frequência de batimento em repouso estão representados em Hertz e para PT. Contras e TB. Con80, os dados são representados em segundos. Clique aqui para ver uma versão maior desta figura.
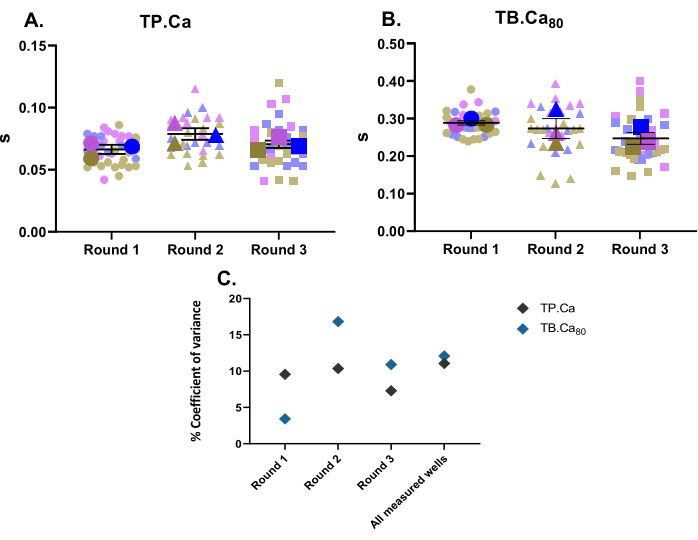
Figura 4: Medidas basais de transientes de cálcio realizadas em três poços a partir de três rodadas de diferenciação . (A) Tempo para o pico (TP.Ca) e (B) Tempo para o início do estudo 80% (TB.Ca80) dos transientes de cálcio. Os dados são apresentados como média ± MEV. TP.Ca e TB.Ca80 dados são representados em segundos. (C) Para avaliar a variação entre os dados obtidos em cada rodada e entre os três rounds de diferenciação, o coeficiente de variância percentual foi calculado utilizando-se o valor médio de cada poço. Clique aqui para ver uma versão maior desta figura.
Discussion
Neste estudo, é descrito um método para realizar medidas de contratilidade e transientes de cálcio em MC-hiPSC e estudar o efeito de estressores/drogas sobre essas células. Medidas de contratilidade, medidas ratiométricas de cálcio e resposta ao ISO foram realizadas em três diferentes rodadas de diferenciação como réplicas biológicas. Para cada réplica biológica, foram realizadas medições em três poços conforme as réplicas técnicas. A razão para realizar as medições dessa forma foi garantir que a variabilidade biológica e a variabilidade técnica da amostra e da plataforma pudessem ser avaliadas. Além de considerar o número adequado de réplicas biológicas e técnicas, a condição de cultivo hiPSC-CM pode desempenhar um papel importante para a obtenção de resultados constantes e robustos. É importante ser consistente com critérios, como a idade dos MC-hiPSC, composição do meio, condições de replaqueamento e tempo de incubação do composto durante as medições. Neste estudo, foram necessários em média 568 ± 24 s para medir 11 áreas duas vezes por 10 s em um poço. Isso inclui um tempo de incubação ISO de 79 ± 11 s. Isso se resume a aproximadamente 10 min por poço, o que deve permitir que os pesquisadores meçam uma placa completa de 24 poços em ~4 h. O controle climático é usado para manter o CO2 estável. Isso permite medir o efeito de compostos/estressores em hiPSC-CMs de maneira rápida.
Para medir a função contrátil das iPSC-CMs, existem vários sistemas existentes que utilizam optogenética13 ou microscopia baseada em vídeo label-free 5,6. Os sistemas optogenéticos são bastante complexos e requerem técnicas especiais para a obtenção de dados eletrofísicos e/ou de contratilidade. Outros sistemas dependem da análise post-hoc de vídeos, o que requer muito armazenamento e carece de feedback direto durante a aquisição de vídeo. Além disso, resolução temporal e espacial suficiente é difícil de ser alcançada, o que pode resultar em subamostragem. Da mesma forma, hiPSC-CMs editados por CRISPR/CAS-9 com repórteres fluorescentes7 podem introduzir efeitos indesejados no comportamento dos cardiomiócitos. O uso de corantes fluorescentes para medidas de contração-relaxamento também é uma abordagem elegante, mas limita a realização de experimentos na mesma amostra por um período mais longo14.
Esta plataforma de medição baseada em óptica, no entanto, poderia ser usada para medir os tempos de contração-relaxamento sem usar qualquer corante fluorescente ou métodos invasivos. No entanto, como a correlação de pixels não fornece informações espaciais, esse método não pode ser usado para medir a força de contração, mas pode apenas detectar de forma confiável mudanças na velocidade de contração e relaxamento. O sistema de medição introduzido é controlado por temperatura e pode adquirir dados de cálcio e contratilidade em tempo real a uma resolução de >200 quadros por segundo. Além disso, a localização de cada medida é armazenada, o que permite medições pareadas, aumentando assim o poder dos experimentos. Além disso, essa plataforma fornece aos pesquisadores a capacidade de armazenar dados e analisá-los instantaneamente após o experimento. Em geral, este sistema de medição baseado em óptica mostra-se um método promissor para estudar patomecanismos celulares, pode avaliar o efeito de compostos sobre a funcionalidade de hiPSC-CMs e pode ser útil com o processo pré-clínico na triagem de drogas.
Acknowledgements
Esta investigação foi financiada em parte pela bolsa Eurostars Estars2 113937 CARDIOMYO (EM & DK) e pela subvenção NWO-VICI 91818602 (JV).
Materials
| Name | Company | Catalog Number | Comments |
| µ-Plate 24 Well Black ID 14 mm | ibidi | 82421 | |
| B-27 Supplement (50x) | Thermo Fisher | 17504044 | |
| CytoSolver transient analysis tool | CytoCypher | A fast automatic data analysis tool | |
| DMEM/F-12 | Thermo Fisher | 11320033 | |
| Fura-2, AM | Thermo Fisher | F1221 | |
| Isoprenaline hydrochloride | Merck | 15627 | |
| KnockOut™ Serum Replacement | Thermo Fisher | 10828010 | |
| Matrigel | Merck | CLS3542C | Basement membrane |
| MultiCell CytoCypher with Nikon 20x Super Fluor objective and 730 nm LED light source and Ionwizard software | CytoCypher | Optics-based measurement system | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI 1640 | Thermo Fisher | 11875119 | |
| Tyrode | Self-made solution with final concentration of the following components: NaCl 134 mM, KCl 5 mM, Hepes 12 mM, MgSO4 1.2 mM, NaH2PO4 H2O 1.2 mM, Glucose 11 mM, Sodium Pyrovate 5 mM, 1 mM CaCl2 |
References
- Tsao, C. W., et al. Heart disease and stroke statistics-2022 update: a report from the American Heart Association. Circulation. 145 (8), e153 (2022).
- Ghionzoli, N., et al. Current and emerging drug targets in heart failure treatment. Heart Failure Reviews. 27 (4), 1119-1136 (2022).
- Criscione, J., et al. Heart-on-a-chip platforms and biosensor integration for disease modeling and phenotypic drug screening. Biosensors and Bioelectronics. 220, 114840 (2023).
- vander Velden, J., et al. Animal models and animal-free innovations for cardiovascular research: current status and routes to be explored. Consensus document of the ESC Working Group on Myocardial Function and the ESC Working Group on Cellular Biology of the Heart. Cardiovascular Research. 118 (15), 3016-3051 (2022).
- Maddah, M., et al. A non-invasive platform for functional characterization of stem-cell-derived cardiomyocytes with applications in cardiotoxicity testing. Stem Cell Reports. 4 (4), 621-631 (2015).
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), e5-e16 (2018).
- Sharma, A., et al. CRISPR/Cas9-mediated fluorescent tagging of endogenous proteins in human pluripotent stem cells. Current Protocols in Human Genetics. 96 (1), 1-20 (2018).
- Wang, L., et al. Hypertrophic cardiomyopathy-linked mutation in troponin T causes myofibrillar disarray and pro-arrhythmic action potential changes in human iPSC cardiomyocytes. Journal of Molecular and Cellular Cardiology. 114, 320-327 (2018).
- Luo, X., et al. IP3R-mediated compensatory mechanism for calcium handling in human induced pluripotent stem cell-derived cardiomyocytes with cardiac ryanodine receptor deficiency. Frontiers in Cell and Developmental Biology. 8, 772 (2020).
- Lord, S. J., Velle, K. B., Mullins, R. D., Fritz-Laylin, L. K. SuperPlots: communicating reproducibility and variability in cell biology. The Journal of Cellular Biology. 219 (6), e202001064 (2020).
- Milani-Nejad, N., Janssen, P. M. L. Small and large animal models in cardiac contraction research: advantages and disadvantages. Pharmacology and Therapeutics. 141 (3), 235-249 (2014).
- Karbassi, E., et al. Cardiomyocyte maturation: advances in knowledge and implications for regenerative medicine. Nature Reviews Cardiology. 17 (6), 341-359 (2020).
- Klimas, A., Ortiz, G., Boggess, S. C., Miller, E. W., Entcheva, E. Multimodal on-axis platform for all-optical electrophysiology with near-infrared probes in human stem-cell-derived cardiomyocytes. Progress in Biophysics and Molecular Biology. 154, 62-70 (2020).
- van Meer, B. J., et al. Simultaneous measurement of excitation-contraction coupling parameters identifies mechanisms underlying contractile responses of hiPSC-derived cardiomyocytes. Nature Communications. 10 (1), 4325 (2019).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved