Realtidsmätningar av kalcium- och kontraktilitetsparametrar i humaninducerade pluripotenta stamcellshärledda kardiomyocyter
In This Article
Summary
Här beskrivs en etablerad metod för att utföra kontraktilitet och kalciummätningar i humant inducerade pluripotenta stamcellshärledda kardiomyocyter med hjälp av en optikbaserad plattform. Denna plattform gör det möjligt för forskare att studera effekten av mutationer och svaret på olika stimuli på ett snabbt och reproducerbart sätt.
Abstract
Humaninducerade pluripotenta stamcellshärledda kardiomyocyter (hiPSC-CMs) representerar ett kraftfullt verktyg för att studera mutationsmedierade förändringar i kardiomyocytfunktionen och definiera effekterna av stressorer och läkemedelsinterventioner. I denna studie demonstreras att detta optikbaserade system är ett kraftfullt verktyg för att bedöma de funktionella parametrarna för hiPSC-CM i 2D. Genom att använda denna plattform är det möjligt att utföra parade mätningar i en välbevarad temperaturmiljö på olika plattlayouter. Dessutom ger detta system forskare omedelbar dataanalys.
Detta dokument beskriver en metod för att mäta kontraktilitet av omodifierade hiPSC-CM. Kontraktionskinetiken mäts vid 37 °C baserat på pixelkorrelationsförändringar i förhållande till en referensram som tagits vid avkoppling vid en samplingsfrekvens på 250 Hz. Dessutom kan samtidiga mätningar av intracellulära kalciumtransienter förvärvas genom att ladda cellen med en kalciumkänslig fluorofor, såsom Fura-2. Med hjälp av en hyperswitch kan ratiometriska kalciummätningar utföras på en belysningspunkt med en diameter på 50 μm, motsvarande arean för kontraktilitetsmätningarna.
Introduction
Hjärtsvikt är den vanligaste dödsorsaken i världen. År 2019 orsakade hjärt-kärlsjukdomar 18.6 miljoner dödsfall globalt, vilket återspeglar en ökning med 17.1% under det senaste decenniet1. Trots forskarnas ansträngningar att identifiera läkemedelsmål för att förebygga och bota hjärtsvikt är patientresultaten fortfarande dåliga2. Skillnaden i patofysiologin hos djurmodeller med avseende på människor kan vara en av de bakomliggande faktorerna till den begränsade framgången för optimering av hjärtsviktsbehandling3. Ytterligare människoliknande modeller är motiverade för att modellera sjukdomar och testa toxiciteten och effektiviteten hos nya läkemedelsföreningar.
Humant inducerade pluripotenta stamcellshärledda kardiomyocyter (hiPSC-CM) representerar ett kraftfullt verktyg för att definiera cellulära patomekanismer inducerade av stressorer, ischemi, förändrad metabolism eller patogena genvarianter och effektiviteten och toxiciteten hos läkemedelsinterventioner4. För att definiera effekter på de funktionella egenskaperna hos hiPSC-CM är ett höghastighetssystem som mäter de systoliska och diastoliska egenskaperna hos cellulära sammandragningar på ett opartiskt och reproducerbart sätt motiverat. Detta övergripande mål med den aktuella studien är att visa att ett optikbaserat system är ett kraftfullt verktyg för att utföra realtidsanalyser av de funktionella parametrarna för hiPSC-CMs.
För närvarande finns det flera plattformar för att utvärdera kontraktiliteten hos hiPSC-CM. Men nuvarande system erbjuder antingen en långsam avläsning, eller det nödvändiga antalet celler kan vara en utmaning. Etikettfria videomätningssystem5,6 förlitar sig på post-hoc-analys av videor, vilket kräver mycket lagring och saknar direkt feedback under videoförvärv. Dessutom är tillräcklig tidsmässig och rumslig upplösning svår att uppnå och kan leda till underurval. Andra metoder för att bestämma kardiomyocytegenskaper, såsom klustrade regelbundet interspaced korta palindromiska upprepningar (CRISPR) / Cas9-redigerade hiPSC-CMs7 med fluorescerande reportrar kan störa cellernas genstabilitet och kräva specialiserad laboratorieexpertis.
För att övervinna de begränsningar som nämns ovan utvecklades och introducerades ett unikt optikbaserat mätsystem i denna studie. Denna plattform möjliggör kontraktilitetsmätningar på omodifierade hiPSC-CM genom att helt enkelt plätera om dem på valfritt plattformat, utan någon begränsning i plåtstorlek. Dessutom möjliggör realtidsmätningar direkt observation och analys av de funktionella parametrarna för hiPSC-CM, och ger därmed en experimentell inställning för att omedelbart justera och optimera protokoll. Dessutom lagras platsen för varje mätning, vilket möjliggör parade mätningar på samma prov, vilket ökar experimentens kraft.
För att demonstrera det optikbaserade systemet utfördes kontraktilitetsmätningar på en kontroll-hiPSC-CM-linje. Denna kontroll-hiPSC-linje genererades från dermal fibroblast hos en frisk manlig donator med en normal karyotyp8. Kontraktionskinetiken mättes vid 37 °C, baserat på pixelkorrelationsförändringar i förhållande till en referensram som togs under avkoppling vid en samplingsfrekvens på 250 Hz. Eftersom den exakta starten på kontraktionen inte alltid kan fastställas entydigt, togs den tidpunkt då 20% av topphöjden uppnåddes (tid till topp 20%) som utgångspunkt för mätningar av tid till topp. På så sätt hittades mindre variabilitet för den här parametern i ett prov. På samma sätt, eftersom det exakta ögonblicket då signalen återgår till baslinjen är svårt att bedöma, användes den tid det tog att nå 80% av återgången till baslinjen från topp (tid till baslinje 80%) för att beskriva avkopplingstiden.
Övergripande kontraktilitetsmätningar inkluderade viloslagfrekvenser, tiden från 20% topp till toppkontraktion (TP. Con), och tiden från maximal kontraktion till 80% av baslinjen (TB. Con80) (figur 1B). För att testa effekten av en stressfaktor inkuberades celler med isoprenalin (ISO). Dessutom, i samband med kontraktilitetsmätningar, mättes Ca 2+ transienter genom att ladda cellerna med Fura-2-acetoximetylester (Fura-2 AM) vid en provtagningsfrekvens på 250 Hz. Ratiometriska Ca2+ mätningar 9 med en hyperswitch gjordes på ett belysningsområde med en diameter på 50 μm, motsvarande arean för kontraktilitetsmätningarna. Ca 2+ mätdata visas som tid från 20% topp till topp i Ca2+ transient (TP.Ca) och tiden från topp till 80% av baslinjen (TB.Ca80) (Figur 1C). Ett snabbt, automatiskt dataanalysverktyg användes för att ge genomsnittliga kontraktila och kalciumkinetiska parametrar för varje område.
Protocol
1. Beredning av cellodlingsmedier och reagenser
- Förbered hiPSC-CM-media genom att tillsätta 1 ml B27-tillägg (50x) till 49 ml RPMI1640.
- Bered ompläteringsmediet genom att först tillsätta 5 ml knockoutserumersättning till 45 ml hiPSC-CM-medium. Tillsätt sedan 22,5 μl Y-27632 ROCK-hämmare (spädning 1:2 000; lagerkoncentration: 10 mM) och blanda väl.
- Förbered basalmembranbelagda plattor enligt beskrivningen nedan:
- Tina en flaska med källarmembran över natten i kylen eller på en islåda.
- Späd basalmembranet med en lämplig mängd av Dulbeccos modifierade Eagle's medium/Ham's F12 (DMEM/F12). Eftersom varje sats basalmembran har olika koncentrationer, beräkna mängden DMEM / F12 som behövs för att uppnå en 1 mg / 1 ml utspädning. Gör 0,5 eller 1 ml alikvoter för förvaring vid -20 °C.
OBS: Steg 1.3.2 måste göras på is inuti en flödeshuv. - Tina 0,5 ml alikvot av basalmembranet och späd det med 6 ml DMEM / F12. Blanda noggrant.
- Belägg plattan genom att pipettera 250 μL utspätt basalmembran/brunn i en platta med 24 brunnar. Beräkna baserat på ytan på varje brunn för olika plattformat, till exempel 1 ml / brunn i en 6-brunnsplatta.
- Inkubera plattan i 1 timme i en 37 °C inkubator.
- Bered Fura-2 AM-alikvoter genom att lösa upp Fura-2 AM i dimetylsulfoxid (DMSO) enligt tillverkarens handbok för att bereda 1 mM alikvoter. Förvara alikvoterna vid -20 °C.
2. Odling av hiPSC-CM
- Tina en injektionsflaska hiPSC-CM i ett 37 °C vattenbad. Överför det tinade innehållet i injektionsflaskan till ett 15 ml rör. Tillsätt 10 ml av ompläteringsmediet på ett droppvis sätt till cellerna.
- Centrifugera cellerna i 5 minuter vid 100 × g.
- Ta bort supernatanten och tillsätt 1 ml ompläteringsmedium. Pipet försiktigt upp och ner för att återsuspendera pelleten och ta bort eventuella cellklumpar.
- Använd en hemocytometer eller en automatiserad cellräknare för att räkna antalet celler.
- Ta bort basalmembranet från den inkuberade plattan och ersätt det med ompläteringsmediet.
- Platta cellerna med lämplig celldensitet på en 6/12/24/48/96-brunnsplatta belagd med basalmembran (t.ex. 250 000 celler / brunn i en 24-brunnsplatta).
OBS: För Ca2+ övergående experiment, platta cellerna på glasbottenplattor. - Byt ut mediet mot hiPSC-CM-odlingsmediet nästa dag och uppdatera sedan mediet varannan dag med 0,5 ml/brunn i en platta med 24 brunnar.
- Utför kontraktilitetsmätningarna när hiPSC-CM har återhämtat sig från upptining och omplätering (3-5 dagar efter omplätering i detta protokoll).
OBS: Vid omplätering av ojämna celler är det möjligt att en grupp celler inte är i kontakt med resten av de ompläterade cellerna och kan visa något oregelbundet eller icke-synkroniserat slagmönster. För att undvika asynkroni rekommenderas det att ha en jämn fördelning av celler och ett synkroniserat väl anslutet monolager av hiPSC-CM i varje brunn.
3. Mätningar av kontraktilitet
- Slå på det optikbaserade mätsystemet, ljuskällan för mikroskopljusdiod (LED) och datorn (se materialförteckning).
- Öppna programmet och öppna en ny fil. Under Arkiv längst upp till vänster på skärmen klickar du på Ny.
- Klicka på Samla, välj Experiment och välj sedan "iPSC + kalcium".
- Slå på klimatkontrollenheten. Ställ in temperaturen på 37 °C ochCO2-nivån på 5 %.
- Byt ut hiPSC-CM-odlingsmediet mot Tyrode-lösning (0,5 ml/brunn i en platta med 24 brunnar). Sätt tillbaka locket på plattan mot locket till klimatkontrollen.
OBS: Om transienta kalciummätningar behöver utföras, fyll cellerna med Fura-2 AM, enligt beskrivningen i avsnitt 4. - Placera plattan inuti det optikbaserade mätsystemet när klimatanläggningen visar att temperaturen är 37 °C.
OBS: Kontraktion mäts med hjälp av ljusfältsförhållanden. - Klicka på Öppna cellsökaren under verktygsfältet och vänta tills en ny skärm dyker upp. Längst upp till höger på skärmen väljer du plattformat och brunn.
- Välj en brunn, välj ett område i brunnen för att observera synkroniserad sammandragning och avkoppling, Tryck på start, klicka på Lägg till mätning. Välj varaktighet för mätningar i inställningarna (10 s per område). Ignorera asynkroniserade kontraktionsmätningar omedelbart och välj ett nytt område.
OBS: Kontraktilitetstransienterna i realtid kan ses på monitorn. För synkroniserade sammandragningar observeras en jämn kontinuerlig övergående, medan för asynkroniserade sammandragningar observeras små extra toppar. - Mät flera områden i brunnen beroende på brunnens storlek. Till exempel, för att följa denna studie, mäta 10 områden per brunn i en 24-brunnsplatta. Om endast baslinjemätningar behövs och det inte finns någon plan för att testa någon förening, fortsätt från steg 3.13.
- När områdena i en brunn har mätts, tryck på slutför och öppna det optikbaserade mätinstrumentet för att lägga till spänningsorn/föreningen i brunnen (t.ex. 500 nM ISO, upplöst i Tyrode).
- Välj inkubationstid beroende på föreningen av intresse (2 min med ISO i detta protokoll).
- Klicka på automatisk mätning för att låta det optikbaserade mätinstrumentet utföra mätningar i samma områden där baslinjemätningarna utfördes, vilket resulterar i parade mätningar i brunnen.
- Tryck på slutför när alla mätningar i brunnen har utförts.
- Välj nästa brunn längst upp till höger på skärmen.
- Fortsätt mätningarna för alla nödvändiga brunnar.
- Klicka på stopp när alla nödvändiga brunnar har mätts och spara filen.
OBS: Klimatkontrollen används för att upprätthålla stabil CO2. Detta gör det möjligt att mäta effekten av föreningar/stressfaktorer på hiPSC-CM på ett höghastighetssätt.
4. Övergående kalciummätningar
- Bered Tyrode-lösning vid 37 °C.
- Lös upp alikvoterna av Fura-2AM i Tyrode-lösning så att en slutlig koncentration på 1 μM Fura-2 AM tillsätts cellerna.
OBS: När du använder Fura-2 AM, se till att lamporna i flödeshuven är släckta för att minimera ljusexponeringen. - Aspirera mediet och ersätt det med Tyrode-lösning som innehåller Fura-2 AM.
- Inkubera i 15 minuter vid 37 °C i en inkubator eller i det optikbaserade mätsystemet.
- Ta bort Tyrode-lösningen som innehåller Fura-2 AM och tvätta därefter 2x med färsk Tyrode-lösning. Inkubera slutligen cellerna i Tyrode-lösning i ytterligare 5 minuter vid 37 °C för att möjliggöra deesterifiering av Fura-2 AM.
- Placera plattan inuti det optikbaserade mätsystemet och starta mätningarna enligt beskrivningen i avsnitt 3.
OBS: I steg 4.6. Genom att starta mätningarna samtidigt med kontraktionsmätningarna registreras en ratiometrisk kalciumtransient som excitation vid 340 nm och 385 nm på en punkt på 100 μm. Utsläpp uppsamlat vid 510 ± 40 nm. Förutom kontraktilitetsspåren visas realtidsförhållandemetriska kalciumtransienter på skärmen.
5. Analys av data
- Om du vill analysera data klickar du på CytoSolver på skrivbordet.
- Klicka på importera och välj de filer som ska analyseras.
- När programmet har utfört analysen, observera de accepterade (blå) och avvisade (röda) transienterna som visas på skärmen (figur 1A).
Här användes följande standardkriterier för avslag, definierade av signal-brusförhållande (SNR) och god passform (R 2): R 2 > 0,9 och SNR > 4 för kontraktionstransienter och R2 > 0,5 och SNR > 3 för kalciumtransienter. Dessa avvisningskriterier kan justeras av användaren beroende på mätningarnas kvalitet, cellernas kvalitet och det primära resultatet för forskaren. Till exempel, om forskarens intresse huvudsakligen är avslappningskinetik, kan kriterierna sänkas för tiden till toppvariablerna. Om mycket starka kalciumtransienter erhålls kan SNR behöva ökas för att utesluta data som är bullrigare. - Klicka på exportera och markera för genomsnittliga övergående data. Inspektera analyserade data som presenteras i ett kalkylblad.
- Stäng av datorn och alla andra instrument.
Representative Results
Efter detta protokoll utfördes mätningar av kontraktilitet, Ca2+ transienter och svar på en förening i hiPSC-CM. Genom att använda detta optikbaserade mätsystem kunde hiPSC-CM enkelt ompläteras på de önskade plattorna och kontraktilitetsmätningarna kunde utföras. Kontraktilitet mäts i en 100 μm x 100 μm region av intresse (ROI) vid 250 bilder per sekund genom att beräkna pixelkorrelationen i förhållande till en referensram. Referensramen detekteras automatiskt av systemet vid änddiastolen. Samtidigt med kontraktionsmätningarna registreras en ratiometrisk kalciumtransient.
I denna studie användes tre olika differentieringsrundor som tre biologiska replikat. För varje differentieringssats mättes tre brunnar som tekniska replikat. Denna studie utfördes med 24-brunnsplattor och 10 områden inom varje brunn mättes. Efter mätningarna användes CytoSolver-programmet för att omedelbart analysera data. Följande parametrar rapporterades: viloslagfrekvensen, TP. Con och TB. Con80 av kontrollen hiPSC-CM (figur 2A-C). För att visualisera variabiliteten av data för varje nämnd parameter presenteras mätningarna inom varje brunn och medelvärdena för tre brunnar för varje differentieringsrunda som superplots10. För att bättre utvärdera variabiliteten av data för varje differentieringsrunda och mellan de tre omgångarna beräknades varianskoefficienten (figur 2D) för varje parameter. Såsom visas i figur 2D ligger värdena för tekniska replikat som motsvarar ett biologiskt replikat inom ett mycket nära intervall från varandra (dvs. låg varianskoefficient), vilket illustrerar metodens robusthet.
Denna applikation är mycket väl lämpad för att testa läkemedelseffekter. Här testades effekten av 500 nM ISO, en icke-selektiv β-adrenerg receptoragonist, på kontraktiliteten hos kontroll hiPSC-CMs. Denna förening är känd för att öka hjärtfrekvensen och utöva en positiv lusitrop effekt. Som visas i figur 3A ökade ISO slagfrekvensen signifikant i alla brunnar. ISO ökade också kinetiken, tydligt i en minskning av TP. Con och TB. Con80 (figur 3B, C). Sammantaget, vid inkubation med ISO, ökade slagfrekvensen signifikant i alla brunnar, tillsammans med en minskning av kontraktions- och avkopplingstiden, vilket indikerade att det förväntade svaret på denna förening registrerades av denna plattform.
Parallellt med kontraktilitetsmätningar utfördes också kalciummätningar. På samma sätt som kontraktilitetsdata (figur 2) visas hiPSC-CMs kalciummätningsdata i figur 4. TB.Ca80 är betydligt långsammare än i isolerade rått- eller muskardiomyocyter, vilket delvis förklaras av art- och hjärtfrekvensskillnader11, liksom av den omogna kalciumhanteringen i hiPSC-CMs på grund av lägre kalciumdynamik inom sarkoplasmatisk retikulum och lägre uttryck av kalciumhanteringsproteiner jämfört med primära celler12. I likhet med kontraktilitetsdata beräknades varianskoefficienten för kalciummätningar och visar låg variabilitet inom de tekniska och biologiska replikaten (figur 4C).
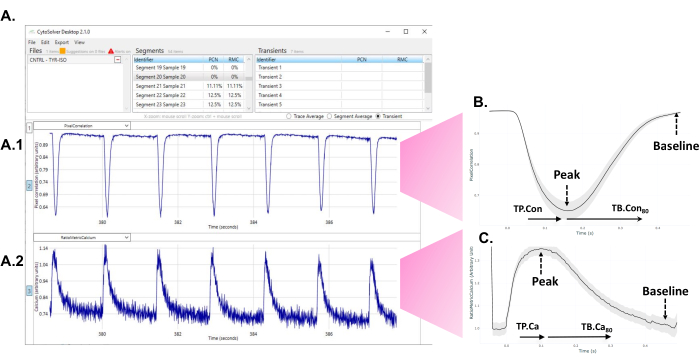
Figur 1: Omedelbar användning av CytoSolver transient analysverktyg efter experimentet för att analysera data. (A) Ett exempel på accepterade transienter (alla i blått) av ett område mätt i en brunn. Panel A1 visar kontraktila transienter. Panel A2 representerar kalciumtransienterna. (B) Genomsnittlig kontraktilitet övergående erhållen från mätningar i tre brunnar i en differentieringsomgång. Från varje enskild eller genomsnittlig transient data från olika tidpunkter till topp (TP. Con) och tid till baslinjen (TB. Con) av kontraktiliteten övergående kan extraheras. Eftersom den exakta starten på kontraktionen inte alltid kan fastställas entydigt, tas tid till topp 20% som utgångspunkt för mätningar av tid till topp. På samma sätt är det svårt att bedöma det exakta ögonblicket då signalen återgår till baslinjen. Därför används tid till baslinje 80% för att beskriva avkopplingstiden. Här, TP. Con (tid till topp - tid till topp 20%) och TB. Con80 (tid till baslinje 80% - tid till topp) används. c) Transienta kalciummedelvärdesdata erhållna från mätningar i tre brunnar i en differentieringsomgång. Från varje enskild eller genomsnittlig kalciumtransient kunde data extraheras från olika tidpunkter till topp (TP.Ca) och tid till baslinje (TB.Ca) av kalciumtransienter. För mätningar från tid till topp är startpunkten tid till topp 20 %, och för tid till baslinje är slutpunkten tid till baslinje 80 %. I denna studie används TP.Ca (tid till topp - tid till topp 20%) och TB.Ca 80 (tid till baslinje 80% - tid till topp). Klicka här för att se en större version av denna figur.
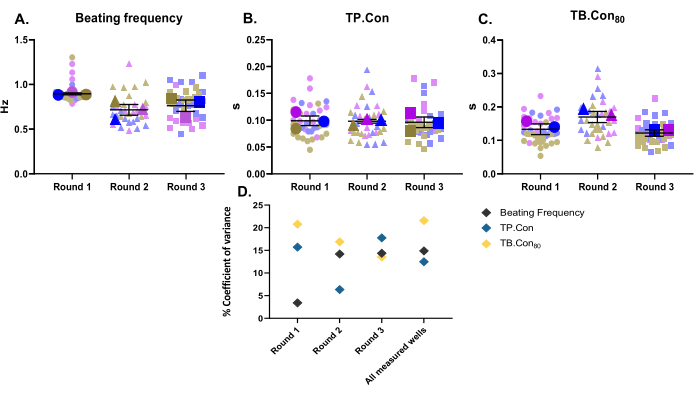
Figur 2: Baslinjekontraktilitetsmätningar utförda på tre olika differentieringsomgångar. Tre biologiska replikat och tre brunnar för varje differentieringsrunda (dvs. tre tekniska replikat). Tre huvudsymboler för varje differentieringsrunda representerar medelvärdet för de uppmätta områdena (bakgrundssymbolerna i bleka färger) inom varje brunn. Data visas som medelvärde ± SEM. Data om viloslagfrekvens representeras i Hertz och för TP. Con och TB. Con80, data är i sekunder. (A) Viloslagfrekvens. (B) Tid till topp (TP. Con). (C) Tid till baslinjen 80% (TB. Con80). (D) För att utvärdera variationen mellan de data som erhållits i varje omgång och mellan alla tre differentieringsomgångarna beräknades varianskoefficienten i procent med hjälp av medelvärdena för varje brunn. Klicka här för att se en större version av denna figur.
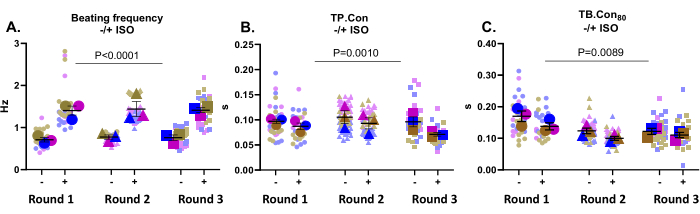
Figur 3: Kontraktilitetsmätningar vid baslinjen (-) och efter inkubation med ISO (+) på tre brunnar från tre differentieringsrundor. a) Viloslagfrekvensen (-) och slagfrekvensen efter inkubation med 500 nM ISO (+). (B) Tid till topp (TP. Con) mätningar vid baslinjen och efter inkubation med ISO. (C) Tid till baslinjen 80% (TB. Con80) mätningar vid baslinjen och efter inkubation med ISO. För att utvärdera effekten av ISO på kontraktilitetsparametrarna utfördes en tvåvägs Anova med Bonferroni-korrigering. Data visas som medelvärde ± SEM. Data om viloslagfrekvens visas i Hertz och för TP. Con och TB. Con80, data representeras i sekunder. Klicka här för att se en större version av denna figur.
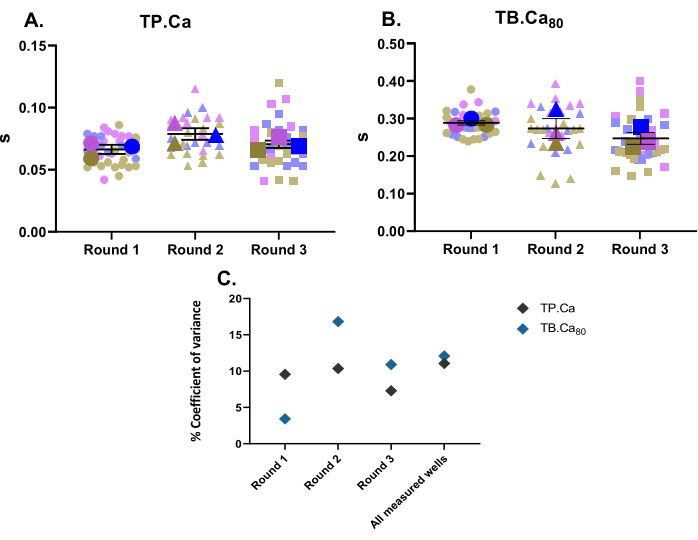
Figur 4: Baslinjemätningar av kalciumtransient utförda på tre brunnar från tre differentieringsomgångar . (A) Tid till topp (TP.Ca) och (B) tid till baslinjen 80% (TB.Ca80) av kalciumtransienter. Data visas som medelvärde ± SEM. TP.Ca ochTB.Ca 80 data representeras i sekunder. (C) För att utvärdera variationen mellan de data som erhållits i varje omgång och mellan alla tre differentieringsomgångarna beräknades varianskoefficienten i procent med hjälp av medelvärdet för varje brunn. Klicka här för att se en större version av denna figur.
Discussion
I denna studie beskrivs en metod för att utföra kontraktilitet och kalciumtransienta mätningar på hiPSC-CMs och studera effekten av stressorer/läkemedel på dessa celler. Kontraktilitetsmätningar, ratiometriska kalciummätningar och svaret på ISO utfördes på tre olika differentieringsrundor som biologiska replikat. För varje biologisk replikat utfördes mätningar på tre brunnar som de tekniska replikaten. Anledningen till att mätningarna utfördes på detta sätt var att säkerställa att den biologiska variationen och den tekniska variationen i provet och plattformen kunde utvärderas. Förutom att överväga lämpligt antal biologiska och tekniska replikat kan hiPSC-CM-odlingstillståndet spela en viktig roll för att uppnå konstanta och robusta resultat. Det är viktigt att vara konsekvent med kriterier, såsom ålder på hiPSC-CM, sammansättning av medium, replatingförhållanden och sammansatt inkubationstid under mätningar. I denna studie tog det i genomsnitt 568 ± 24 s att mäta 11 områden två gånger för 10 s i en brunn. Detta inkluderar en ISO-inkubationstid på 79 ± 11 s. Detta kommer ner till ungefär 10 min per brunn, vilket borde göra det möjligt för forskare att mäta en hel 24-brunnsplatta på ~ 4 timmar. Klimatkontrollen används för att upprätthålla stabil CO2. Detta gör det möjligt att mäta effekten av föreningar/stressfaktorer på hiPSC-CM på ett höghastighetssätt.
För att mäta kontraktil funktion av iPSC-CMs finns det flera befintliga system som förlitar sig på optogenetik13 eller etikettfri videobaserad mikroskopi 5,6. Optogenetiska system är ganska komplexa och kräver speciella tekniker för att erhålla antingen elektrofysiska och / eller kontraktilitetsdata. Andra system förlitar sig på post-hoc-analys av videor, vilket kräver mycket lagring och saknar direkt feedback under videoförvärv. Dessutom är tillräcklig tidsmässig och rumslig upplösning svår att uppnå, vilket kan leda till underurval. På samma sätt kan CRISPR / CAS-9-redigerade hiPSC-CMs med fluorescerande reportrar7 introducera oönskade effekter på kardiomyocytbeteende. Användningen av fluorescerande färgämnen för kontraktionsavslappningsmätningar är också ett elegant tillvägagångssätt, men begränsar att utföra experiment på samma prov under en längre period14.
Denna optikbaserade mätplattform kan dock användas för att mäta sammandragningsavslappningstider utan att använda något fluorescerande färgämne eller invasiva metoder. Men eftersom pixelkorrelation inte ger rumslig information kan denna metod inte användas för att mäta styrkan av sammandragning, utan kan snarare bara på ett tillförlitligt sätt upptäcka förändringar i hastigheten för sammandragning och avkoppling. Det introducerade mätsystemet är temperaturkontrollerat och kan samla in kalcium- och kontraktilitetsdata i realtid med en upplösning på > 200 bilder per sekund. Dessutom lagras platsen för varje mätning, vilket möjliggör parade mätningar, vilket ökar experimentens kraft. Dessutom ger denna plattform forskare möjlighet att lagra data och analysera dem direkt efter experimentet. Sammantaget visar sig detta optikbaserade mätsystem vara en lovande metod för att studera cellulära patomekanismer, kan utvärdera effekten av föreningar på funktionaliteten hos hiPSC-CMs och kan vara till hjälp med den prekliniska processen vid läkemedelsscreening.
Disclosures
EM är anställd hos CytoCypher BV. MH är VD för CytoCypher BV. De återstående författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
Acknowledgements
Denna forskning har delvis finansierats av Eurostars grant Estars2 113937 CARDIOMYO (EM & DK) och NWO-VICI grant 91818602 (JV).
Materials
| Name | Company | Catalog Number | Comments |
| µ-Plate 24 Well Black ID 14 mm | ibidi | 82421 | |
| B-27 Supplement (50x) | Thermo Fisher | 17504044 | |
| CytoSolver transient analysis tool | CytoCypher | A fast automatic data analysis tool | |
| DMEM/F-12 | Thermo Fisher | 11320033 | |
| Fura-2, AM | Thermo Fisher | F1221 | |
| Isoprenaline hydrochloride | Merck | 15627 | |
| KnockOut™ Serum Replacement | Thermo Fisher | 10828010 | |
| Matrigel | Merck | CLS3542C | Basement membrane |
| MultiCell CytoCypher with Nikon 20x Super Fluor objective and 730 nm LED light source and Ionwizard software | CytoCypher | Optics-based measurement system | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI 1640 | Thermo Fisher | 11875119 | |
| Tyrode | Self-made solution with final concentration of the following components: NaCl 134 mM, KCl 5 mM, Hepes 12 mM, MgSO4 1.2 mM, NaH2PO4 H2O 1.2 mM, Glucose 11 mM, Sodium Pyrovate 5 mM, 1 mM CaCl2 |
References
- Tsao, C. W., et al. Heart disease and stroke statistics-2022 update: a report from the American Heart Association. Circulation. 145 (8), e153 (2022).
- Ghionzoli, N., et al. Current and emerging drug targets in heart failure treatment. Heart Failure Reviews. 27 (4), 1119-1136 (2022).
- Criscione, J., et al. Heart-on-a-chip platforms and biosensor integration for disease modeling and phenotypic drug screening. Biosensors and Bioelectronics. 220, 114840 (2023).
- vander Velden, J., et al. Animal models and animal-free innovations for cardiovascular research: current status and routes to be explored. Consensus document of the ESC Working Group on Myocardial Function and the ESC Working Group on Cellular Biology of the Heart. Cardiovascular Research. 118 (15), 3016-3051 (2022).
- Maddah, M., et al. A non-invasive platform for functional characterization of stem-cell-derived cardiomyocytes with applications in cardiotoxicity testing. Stem Cell Reports. 4 (4), 621-631 (2015).
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), e5-e16 (2018).
- Sharma, A., et al. CRISPR/Cas9-mediated fluorescent tagging of endogenous proteins in human pluripotent stem cells. Current Protocols in Human Genetics. 96 (1), 1-20 (2018).
- Wang, L., et al. Hypertrophic cardiomyopathy-linked mutation in troponin T causes myofibrillar disarray and pro-arrhythmic action potential changes in human iPSC cardiomyocytes. Journal of Molecular and Cellular Cardiology. 114, 320-327 (2018).
- Luo, X., et al. IP3R-mediated compensatory mechanism for calcium handling in human induced pluripotent stem cell-derived cardiomyocytes with cardiac ryanodine receptor deficiency. Frontiers in Cell and Developmental Biology. 8, 772 (2020).
- Lord, S. J., Velle, K. B., Mullins, R. D., Fritz-Laylin, L. K. SuperPlots: communicating reproducibility and variability in cell biology. The Journal of Cellular Biology. 219 (6), e202001064 (2020).
- Milani-Nejad, N., Janssen, P. M. L. Small and large animal models in cardiac contraction research: advantages and disadvantages. Pharmacology and Therapeutics. 141 (3), 235-249 (2014).
- Karbassi, E., et al. Cardiomyocyte maturation: advances in knowledge and implications for regenerative medicine. Nature Reviews Cardiology. 17 (6), 341-359 (2020).
- Klimas, A., Ortiz, G., Boggess, S. C., Miller, E. W., Entcheva, E. Multimodal on-axis platform for all-optical electrophysiology with near-infrared probes in human stem-cell-derived cardiomyocytes. Progress in Biophysics and Molecular Biology. 154, 62-70 (2020).
- van Meer, B. J., et al. Simultaneous measurement of excitation-contraction coupling parameters identifies mechanisms underlying contractile responses of hiPSC-derived cardiomyocytes. Nature Communications. 10 (1), 4325 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved