Daily Transfers, Archiving Populations, and Measuring Fitness in the Long-Term Evolution Experiment with Escherichia coli (대장균을 사용한 장기 진화 실험에서의 일일 이동, 인구 보관 및 적합성 측정)
In This Article
Summary
이 프로토콜은 일일 이동 및 주기적인 동결을 수행하여 대장균 LTEE(Long-Term Evolution Experiment)를 유지하는 방법과 진화된 박테리아의 적합성 향상을 측정하기 위해 경쟁 분석을 수행하는 방법을 설명합니다. 이러한 절차는 연구자가 자신의 미생물 진화 실험을 시작하기 위한 템플릿 역할을 할 수 있습니다.
Abstract
LTEE(Long-Term Evolution Experiment)는 35년 이상 동안 77,000개의 박테리아 세대에 걸쳐 간단한 실험실 환경에 적응한 12개의 대장균 개체군을 추적했습니다. LTEE에 사용된 설정 및 절차는 미생물 진화를 연구하기 위한 신뢰할 수 있고 재현 가능한 방법을 요약합니다. 이 프로토콜에서는 먼저 LTEE 개체군을 신선한 배지로 옮기고 매일 배양하는 방법을 설명합니다. 그런 다음 LTEE 개체군에 가능한 오염 징후가 있는지 정기적으로 확인하고 이후 연구를 위해 영구적으로 동결된 "화석 기록"을 제공하기 위해 보관하는 방법을 설명합니다. 이러한 절차에 포함된 여러 안전 장치는 오염을 방지하고, 다양한 문제가 발생했을 때 이를 감지하고, 실험 진행을 크게 지연시키지 않고 중단으로부터 복구하도록 설계되었습니다. LTEE에서 진화적 변화의 전반적인 템포와 특성을 모니터링하는 한 가지 방법은 실험에서 개체군과 균주의 경쟁적 적합성을 측정하는 것입니다. 공동 배양 경쟁 분석이 수행되는 방법을 설명하고 결과에서 상대적 적합성을 계산하기 위한 스프레드시트와 R 패키지(fitnessR)를 모두 제공합니다. LTEE가 진행되는 동안 일부 집단의 행동은 흥미로운 방식으로 변화했으며 전체 게놈 시퀀싱과 같은 새로운 기술은 집단이 어떻게 진화했는지 조사할 수 있는 추가 방법을 제공했습니다. 이러한 변경 사항을 수용하거나 활용하기 위해 원래 LTEE 절차가 어떻게 업데이트되었는지에 대해 논의하는 것으로 끝납니다. 이 프로토콜은 진화와 유전학, 분자 생물학, 시스템 생물학 및 생태학 간의 연결을 연구하기 위한 모델 시스템으로 LTEE를 사용하는 연구자에게 유용할 것입니다. 보다 광범위하게, LTEE는 새로운 미생물, 환경 및 질문으로 자신의 진화 실험을 시작하는 사람들을 위해 검증된 템플릿을 제공합니다.
Introduction
1988년 2월, 리처드 렌스키(Richard Lenski)는 캘리포니아 대학교 어바인(Irvine)에서 정의된 포도당 제한 성장 배지를 함유하는 12개의 플라스크에 대장균 의 클론 배양물을 접종했습니다 1. 다음날, 그는 각 플라스크에서 배양 물의 1 %를 신선한 성장 배지가 들어있는 새로운 플라스크 세트로 옮겼습니다. 이 1:100 희석을 통해 박테리아 개체군이 사용 가능한 포도당을 소진하기 전에 100배 팽창할 수 있었으며, 이는 약 62/3세대의 세포 분열에 해당합니다. 이 절차는 다음 날에도 반복되었고 그 이후로 몇 번의 중단을 제외하고는 매일 반복되었습니다. 실험이 1992년 미시간 주립대학교로, 2022년 오스틴에 있는 텍사스 대학교로 이전된 후에도 이러한 일상적인 이전은 계속되었습니다. 그동안 새로운 돌연변이는 이러한 대장균 개체군에서 유전적 변이를 지속적으로 생성했으며 자연 선택으로 인해 진화된 세포가 조상을 능가하게 되었습니다.
렌스키는 진화의 역학과 반복성을 조사하기 위해 현재 LTEE(Long-Term Evolution Experiment)로 알려진 이 실험을 설계했다. 이러한 질문에 답하기 위해 그는 실험 설정 및 프로토콜2의 설계에 몇 가지 중요한 기능을 포함했습니다. 이러한 특징 중 하나는 모델 유기체의 신중한 선택이었습니다. 원래 12개 개체군은 모두 직계 공통 조상인 대장균 B 균주 REL606을 공유하는 단일 식민지에서 시작되었습니다. 이 균주는 이미 실험실 환경에서 일반적으로 사용되었고, 완전히 무성 생식되었으며, 플라스미드 또는 온전한 프로파지 3,4를 포함하지 않았기 때문에 선택되었습니다. 실험을 단순화한 또 다른 선택은 성장 후 각 플라스크의 세포 밀도를 제한하기 위해 성장 배지에서 매우 낮은 농도의 포도당을 사용하는 것이었습니다. 낮은 세포 밀도를 사용하는 것은 개체군 내 생태학적 상호 작용의 진화 가능성을 줄임으로써 개체군 적합성의 변화를 더 쉽게 분석할 수 있도록 하기 위한 것이었습니다(예: 교차 섭식)5.
REL606은 araA 유전자의 점 돌연변이로 인해 ʟ-arabinose를 탄소 및 에너지원(Ara-)으로 사용할 수 없습니다. LTEE를 시작하기 전에 REL607로 명명된 복원된 araA 서열을 가진 자발적 돌연변이를 REL6066에서 분리했습니다. REL607은 ʟ-아라비노스(Ara+)에서 자랄 수 있습니다. REL606은 LTEE 집단 중 6개를 시작하는 데 사용되었고, REL607은 나머지 6개를 시작하는 데 사용되었습니다. 아라비노스는 LTEE 동안 사용된 성장 배지에 존재하지 않으므로 REL607은 이러한 조건에서 REL606과 동일하게 행동합니다. 그러나 테트라졸륨 아라비노스(TA) 한천에 도말하면 Ara- 및 Ara+ 세포가 각각 빨간색과 흰색 콜로니를 형성합니다. 두 조상 대장균 균주와 그 후손을 구별하는 이 방법은 매우 유용합니다. LTEE 집단 간의 교차 오염을 감지하는 데 사용할 수 있습니다. 또한 Ara-균주 또는 개체군이 서로 경쟁할 때 Ara+ 균주에 비해 적합성을 측정하는 데 도움이 됩니다. 적합성은 반대 표시가 있는 경쟁자의 공동 배양을 설정한 다음 경쟁자가 처음에 혼합될 때와 LTEE와 동일한 조건에서 하나 이상의 성장 주기 후에 빨간색과 흰색 콜로니(TA 플레이트에 배양 희석액을 퍼뜨려 얻음)의 빈도가 어떻게 변하는지 모니터링하여 측정됩니다. 더 적합한 세포 유형의 표현은 각 성장 주기 동안 증가합니다.
LTEE의 또 다른 중요한 특징은 진화하는 모집단의 샘플이 주기적으로 보관된다는 것입니다. 글리세롤과 같은 동결방지제와 혼합하면 대장균 세포가 동결되었다가 나중에 소생될 수 있다7. LTEE 프로토콜의 일환으로, 매 75일마다(약 500세대에 해당) 새 플라스크로 옮겨지지 않은 각 모집단의 일부가 글리세롤과 혼합되어 여러 바이알에 분할되어 냉동고에 보관됩니다. 이 얼어붙은 "화석 기록"을 통해 연구자들은 LTEE에 대한 첫 번째 연구를 수행할 수 있었는데, 이 연구에서 연구자들은 다양한 시점에서 진화된 대장균 개체군을 되살리고 조상 균주와 경쟁하여 체력이 얼마나 빨리 증가하는지 추적할 수 있었습니다1. 체력 진화는 얼어붙은 "화석 기록"의 더 많은 "지층"이 보존됨에 따라 주기적으로 재측정되었습니다. 이러한 측정의 전반적인 결론은 동일한 환경 8,9,10에서 여러 세대에 걸쳐 진화한 후에도 LTEE에서 체력이 계속 향상되고 있다는 것입니다.
LTEE가 그토록 오랫동안 지속될 수 있었던 이유는 무엇입니까? 원래의 질문을 하고 답변할 수 있게 해준 많은 동일한 기능은 불운, 인적 오류 및 세계 사건으로 인한 불가피한 중단에 대한 안전 조치 및 안전 장치 역할도 했습니다. 매일 배양 물이 신선한 성장 배지로 옮겨지면 이동을 수행하는 연구원은 Ara-와 Ara+ 개체군을 번갈아 가며 수행합니다. 그런 다음 개체군이 동결되면 선택적 및 지시약 한천에 도말하여 "이웃" 개체군이 우발적으로 교차 오염되거나 혼합되었는지(예: 흰색 콜로니가 빨간색 콜로니만 형성해야 하는 개체군에 있음) 또는 외래 미생물(예: 예상치 못한 콜로니 형태 또는 세포 밀도)로 오염되었는지 확인할 수 있습니다. 인구가 훼손된 경우, 그 조상은 냉동실에서 부활하여 그 자리에서 이월 될 수 있습니다. 따라서 아라 마커와 냉동 보관소는 실험 자원과 안전 조치라는 두 가지 목적을 수행합니다.
그 역사가 매우 잘 보존되어 있고 쉽게 접근할 수 있기 때문에 실험이 시작되었을 때 존재하지 않았던 기술을 사용하여 LTEE 샘플을 연구했습니다. 예를 들어, 전체 게놈 시퀀싱은 LTEE 집단 11,12,13,14,15에서 돌연변이의 역학을 조사하는 데 사용되었으며, 전사체학 및 리보솜 프로파일링은 유전자 발현16,17의 변화를 조사하는 데 사용되었습니다. 유전적 도구는 적합성 및 다양한 표현형에 미치는 영향을 이해하기 위해 단일 돌연변이 또는 여러 진화된 돌연변이의 조합에 의해 다른 균주를 재구성하는 데 사용되었습니다 18,19,20,21. 냉동된 "화석 기록"의 샘플은 실험 기록의 일부 또는 전체 사본을 다른 실험실로 배송할 수 있도록 쉽게 보충됩니다. LTEE 샘플은 현재 남극 대륙을 제외한 모든 대륙에 존재하며 실험 자체보다 젊은 연구자들에 의해 연구되고 있습니다. LTEE의 강력한 방법과 진화된 대장균 샘플 및 역사적 기록의 균주는 또한 다른 질문과 환경을 조사하는 진화 실험의 출발점 역할을 했습니다 22,23,24,25,26,27,28,29.
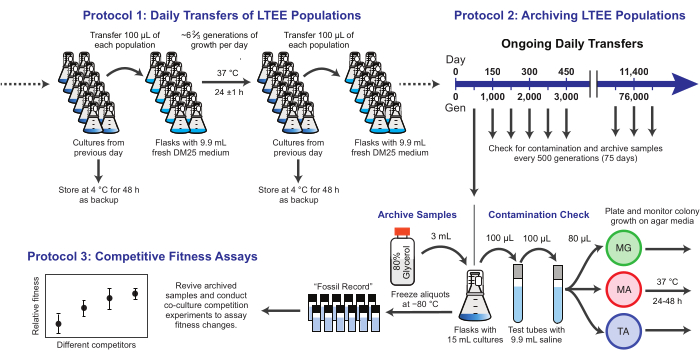
그림 1: LTEE 절차 개요 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
여기에서는 대장균 장기 진화 실험에 사용된 세 가지 핵심 프로토콜을 보여줍니다(그림 1). (1) 일일 이동을 수행하는 방법, (2) 모집단 샘플 및 클론 분리주를 보관하는 방법, (3) 적합성 차이를 측정하기 위해 공동 배양 경쟁 분석을 수행하고 분석하는 방법을 설명합니다. 우리의 희망은 이러한 프로토콜이 LTEE 자원의 지속적인 사용을 촉진하고 새로운 미생물 진화 실험의 설계에 정보를 제공하는 것입니다.
Protocol
1. LTEE 인구의 일일 이동
참고: 12개의 LTEE 개체군은 전날 플라스크에서 배양한 것의 1%를 신선한 배지에 접종하여 매일 이식됩니다. 이 프로세스의 단계는 그림 1에 요약되어 있습니다. 균주 REL606에서 시작된 6개의 Ara- 개체군은 A-1에서 A-6 으로 지정되고 균주 REL607에서 시작된 6개의 Ara+ 개체군은 A+1에서 A+6으로 지정됩니다. 무균 기술과 개체군 이동 일정 및 순서를 엄격하게 준수하면 오염 및 기타 중단의 위험을 최소화할 수 있습니다.
- LTEE가 전달될 표면을 70% 에탄올 또는 10% 표백제 용액으로 닦아 소독합니다. 분젠 버너에 불을 붙여 지역 상승 기류를 만들고 유리 제품의 연소를 가능하게 합니다.
알림: 오염을 방지하기 위해 실험실 장갑을 착용하십시오. 화염 주위의 안전을 위해 가연성이 아닌 니트릴과 같은 물질로 만들어진 장갑만 사용하는 것이 중요합니다. - 오토클레이빙으로 세척 및 멸균된 20mL 붕규산 또는 폴리프로필렌 비커로 캡을 씌운 50mL 붕규산 삼각 플라스크 13개를 준비합니다. 플라스크에 눈에 보이는 파편이 있는지 확인하고 완벽하게 깨끗하지 않은 것은 교체하십시오.
- 빨간색 마커를 사용하여 6개의 플라스크 A-1에서 A-6에 레이블을 붙이고 다른 6개의 플라스크에 검은색 마커를 사용하여 A+1에서 A+6까지 레이블을 지정합니다. 비어 있는 마지막 남은 플라스크에 월/일 형식의 날짜와 요일로 레이블을 지정합니다.
- 멸균된 10mL 혈청학적 피펫을 사용하여 13개의 플라스크 각각에 9.9mL의 DM25 배지를 채웁니다. 뚜껑 역할을 하는 비커를 제거한 후 비커를 교체하기 전에 각 플라스크의 입구에 불을 붙입니다. 각 플라스크를 채우는 사이에 피펫 끝을 불태웁니다.
알림: DM25 제작 지침은 온라인30에서 확인할 수 있습니다. 플라스틱 혈청학적 피펫을 사용하는 경우 플라스틱이 녹지 않도록 팁을 태우지 않거나 화염 시간을 제한하십시오. - 진탕 인큐베이터에서 전날의 LTEE 플라스크를 꺼냅니다.
- 각 플라스크를 빛에 비추어 검사하여 탁도와 색상을 평가하고, 플라스크 무결성을 확인하고, 이물질의 존재 여부를 확인합니다.
참고: 육안으로 볼 때 모든 Ara- 및 Ara+ 배양액은 배지의 구연산염 성장으로 인해 다른 배양균보다 ~10배 더 탁한 A-3을 제외하고 공백에 비해 약간 탁해 보입니다. 많은 외부 미생물 오염 물질도 구연산염에서 자랄 수 있으므로 A-3 이외의 개체군에서 탁도가 증가하면 오염을 나타낼 수 있습니다. 전송 전 LTEE 문화권의 이미지는 대표 결과 섹션을 참조하십시오. - 선택 사항: 블랭크 1mL와 각 배양액 1mL를 1cm 플라스틱 큐벳에 피펫팅하고 기기를 블랭킹한 후 분광 광도계를 사용하여 600nm(OD600)에서 광학 밀도 판독값을 측정하여 각 LTEE 배양에 예상 탁도가 있는지 확인합니다.
참고: 이 추가 단계는 LTEE 작업이 처음이고 탁도를 눈으로 판단하고 의심되는 이상을 문서화하고 조사하는 데 확신이 없는 연구원에게 유용할 수 있습니다. OD600 값이 예상과 같을 경우 계속 전파될 세포 집단을 오염시킬 위험을 최소화하기 위해 전날 플라스크에서 OD600 측정을 위한 샘플을 새 플라스크로 정상적으로 옮긴 후(다음 단계)를 수행하십시오. LTEE 배양에 대한 일반적인 OD600 값은 대표 결과 섹션을 참조하십시오. - 멸균 필터 팁이 있는 P200 마이크로피펫터를 사용하여 각 LTEE 플라스크에서 신선한 DM25가 들어 있는 해당 플라스크로 배양물 100μL을 옮깁니다. A−1로 시작한 다음 A+1을 전송합니다. 그런 다음 -와 + 모집단을 번갈아 가며 계속합니다. 어떤 문화가 옮겨졌는지 추적하려면 플라스크에서 또는 해당 문화로 피펫팅한 후 플라스크를 왼쪽으로 이동합니다.
참고: Ara- 와 Ara+ 개체군 간의 엄격한 이동 및 교대 순서는 교차 오염 및 혼합을 방지하고 감지하는 데 도움이 됩니다. 엄격한 무균 기술 준수: 각 이송에 대해 새 피펫 팁을 사용하고, 캡을 푼 직후와 다시 덮기 전에 플라스크의 입구에 불을 붙이고, 각 이송 사이에 70% 에탄올을 적신 보푸라기가 없는 종이 와이프로 마이크로피펫터의 배럴과 이젝터를 닦습니다. 표백제는 미량이라도 배양물을 죽일 수 있으므로 마이크로피펫터를 소독하는 데 사용해서는 안 됩니다. - 새로 접종된 플라스크를 37°C에서 24± 1시간 동안 1인치 직경에 걸쳐 120rpm 궤도 진탕으로 인큐베이션합니다.
- 전날부터 배양액을 4°C에서 보관한다. 이러한 백업 문화권을 이틀 동안 보존합니다. 이때 3일 전에 4°C에서 보관했던 오래된 배양균은 폐기한다.
참고: 이전 이틀의 배양은 필요한 경우 문제나 사고가 발생하거나 전날 배양의 오염이 전이 되기 전에 발견된 경우(예: 이상한 착색 또는 예상치 못한 미립자). - 이전을 수행한 연구자의 시간, 날짜, 이전 번호, 이름 또는 이니셜, 문화가 괜찮은지 여부 및 기타 관련 정보를 전송 로그 노트북에 입력합니다. (1) 전날의 블랭크가 오염된 경우, (2) 플라스크 또는 뚜껑이 깨지거나 파손된 경우, (3) 플라스크에 이물질이 포함되어 있는 경우, (4) 이송 중에 플라스크가 넘어지거나 떨어뜨린 경우, 또는 (5) 이러한 플라스크에서 계속하는 것이 의심스러울 수 있는 다른 사건이나 관찰이 있는 경우 1.12-1.14단계로 이동합니다.
- 전날의 LTEE 문화에 문제, 사고 또는 오염이 의심되는 경우 이전하지 마십시오. 대신, 나중에 검사하고 추가 특성화를 위해 12개의 배양 전체 세트를 4°C에서 보관하십시오.
- 전날부터 옮겨진 백업 배양물을 담고 있는 플라스크를 회수하여 4°C에서 보관하였다. 벤치 탑에 올려 실온으로 데우십시오. 각 플라스크를 부드럽게 소용돌이 치면서 세포를 다시 일시 중단시킵니다.
- 백업 플라스크에서 새로운 배지가 들어 있는 새로운 플라스크 세트로 옮기고 1.6-1.11 단계에 설명된 대로 정상적으로 실험을 계속합니다. 전송 로그에 백업 문화권이 사용되었음을 기록하고 전날과 동일한 전송 번호를 기록합니다.
참고: 한 모집단의 플라스크에서만 문제가 발견되더라도 백업 플라스크에서 12개의 모집단을 모두 옮겨 모든 모집단에서 경과된 세대 수가 위상을 유지하도록 합니다. 4°C에서 보관된 백업 플라스크에 오염이 발견되면 영향을 받는 LTEE 모집단은 모집단 샘플에 대해 3.1-3.2단계에 설명된 절차를 사용하여 냉동 재고에서 다시 시작해야 합니다. LTEE의 전송 번호는 부활 후 DM25에서 첫 번째 배양이 성장할 때까지 증가해서는 안 됩니다.
2. LTEE 모집단 보관
참고: LTEE 모집단의 샘플은 75번의 전송마다 고정됩니다. 인구는 100배 이전 희석 후 매일 ~6 2/3세대 증가하므로 이 기간은 ~500세대에 해당합니다. 보관하는 동안 LTEE 개체군은 오염 여부를 확인하기 위해 다양한 유형의 한천 배지에 도말됩니다. 선택적으로, 대표 클론은 이러한 플레이트에서 선택되고 현재 보관될 수 있다. 이러한 단계는 그림 1에 요약되어 있습니다.
- 계획된 동결 전날 또는 며칠 전에 최소 포도당(MG), 최소 아라비노스(MA) 및 테트라졸륨 아라비노스(TA)의 세 가지 유형의 한천 플레이트를 준비합니다. 각 유형의 한천에 대해 12 개의 접시와 몇 가지 엑스트라를 만드십시오. 또한 최소 250mL의 0.85%(w/v) 멸균 식염수와 50mL의 80%(v/v) 멸균 글리세롤을 준비합니다.
참고: 모든 미디어 및 솔루션에 대한 레시피는 온라인에서 사용할 수 있습니다30. LTEE가 정규 아카이빙 스케줄에 대해 500의 배수인 세대에 도달하기 전날은 마지막 동결 이후 74일째 되는 날에 문제가 감지되거나 의심되었을 때 4°C 백업 플라스크로부터의 전송으로 인해 추가된모든 일수 입니다. - 선택 사항: LTEE 집단에서 클론 분리물을 보관하는 경우 추가 공급품을 준비하십시오: 각 집단에서 3개의 클론을 분리하려면 72MG 플레이트, 80%(v/v) 글리세롤 80mL 및 DM1000 370mL가 필요합니다.
- 계획된 동결 전날 일일 LTEE 전송의 1.2단계를 수행할 때 12개의 플라스크 세트를 추가로 준비합니다. 빨간색 마커를 사용하여 xA-1에서 xA-6까지의 추가 플라스크 중 6개에 레이블을 지정하고 검은색 마커를 사용하여 나머지 6개의 xA+1에서 xA+6에 레이블을 지정합니다.
알림: "x"는 추가 플라스크 세트가 보관에 사용됨을 나타내며 LTEE의 일일 전송을 병렬로 계속하는 데 사용되는 다른 플라스크 세트와 구별됩니다. - 매일 LTEE 전송의 1.4단계를 수행할 때 25mL 혈청학적 피펫을 사용하여 14.85mL의 DM25로 보관에 사용할 각 추가 플라스크를 채웁니다.
- 1.5-1.11 단계에 설명된 대로 일반 LTEE 전송을 완료합니다. 그런 다음 1.8단계에 대한 지침을 반복하되 이번에는 전날의 각 LTEE 배양에서 150μL를 보관에 사용할 14.85mL의 신선한 DM25 추가 플라스크로 옮깁니다.
알림: 이 단계와 모든 후속 단계에서 다음 지침에 따라 오염 및 혼동을 방지하십시오. 모집단 A−1로 시작한 다음 A+1을 전송한 다음 − 및 + 모집단을 계속 번갈아 가며 진행합니다. 개체군을 전환할 때 70% 에탄올을 적신 보푸라기가 없는 종이 물티슈로 마이크로피펫터의 배럴과 이젝터를 닦습니다. 플라스크와 테스트 튜브를 트레이 또는 랙으로 이동시킨 후 피펫팅을 통해 어떤 이송이 완료되었는지 추적합니다. - 12개의 LTEE 배양물 및 단계 1.9에 기재된 블랭크와 함께 120 rpm 오비탈 쉐이킹과 함께 37°C에서 24± 1시간 동안 보관하기 위해 12개의 플라스크 세트를 인큐베이션한다.
- 동결 당일 LTEE 전송이 수행되기 최소 1시간 전에 LTEE 개체군을 도금하기 위한 소모품을 준비합니다.
- 12 MG, 12 MA 및 12 TA 한천 플레이트를 선택하십시오. 뚜렷한 오염이 없는지 육안으로 검사하십시오.
- 12개의 LTEE 모집단(A-1에서 A+6까지) 각각에 대해 각 플레이트 유형 중 하나에 레이블을 지정합니다.
알림: 접시에 라벨을 붙일 때 페트리 접시 바닥 측면에 글을 쓰십시오. 이것은 한천 아래에서 콜로니를 조사하거나 사진을 찍고 싶을 때 콜로니를 가리지 않는 데 중요합니다. 뚜껑이 섞일 수 있으므로 뚜껑에 쓰지 마십시오. - 한천 플레이트를 37°C 인큐베이터에 최소 20분 동안 두어 2.10단계에서 사용하기 전에 따뜻하게 합니다.
- 9.9mL의 식염수가 들어 있는 24개의 시험관을 준비합니다. 각각 2 개의 튜브로 구성된 12 세트로 배열하십시오.
- 플레이트와 동일한 방식으로 12개의 테스트 튜브로 구성된 두 세트 각각에 레이블을 지정하고 LTEE 모집단 식별자 아래에 "1" 또는 "2"를 추가하여 해당 모집단의 희석을 만드는 데 사용할 순서를 지정합니다.
- 평소와 같이 LTEE의 일일 전송을 계속하는 플라스크를 사용하여 1.1-1.11단계를 수행합니다. 단계 1.5 동안, 또한 진탕 인큐베이터로부터 보관을 위한 여분의 배양물을 함유하는 12개의 플라스크를 제거한다.
- 12개의 추가 플라스크 각각으로부터의 배양물을 100 μL의 배양물을 그 LTEE 집단에 대해 쌍으로 한 쌍의 식염수의 제1 시험관 내로 보관한다. 이 100배 희석액으로 튜브를 완전히 소용돌이치십시오. 이어서, 식염수의 대응하는 제2 튜브에 각각 100 μL를 피펫팅한다. 최종 10,000배 배양 희석액을 철저히 소용돌이칩니다.
- 10,000배 배양 희석액을 함유하는 각각의 튜브로부터 80 μL를 해당 집단에 대해 표지된 TA, MG 및 MA 플레이트에 피펫팅한다. 원하는 대로 멸균 살포 막대 또는 멸균 살포 비드를 사용하여 한천 표면에 액체를 균일하게 퍼뜨립니다. 세 가지 유형의 배지에 12개의 모집단이 모두 도금될 때까지 반복합니다.
- 필요한 경우 한천에 액체가 보이지 않을 때까지 플레이트를 건조시킵니다. 플레이트를 37°C로 설정된 중력 대류 인큐베이터에 거꾸로(한천 면이 위로 향하게) 놓습니다.
알림: 플레이트를 거꾸로 배양하면 한천이 마르는 것을 방지하고 응결이 한천 표면에 떨어지는 것을 방지합니다. 배양 중 한천 표면의 액체 세포가 이동하면 콜로니가 번지고 잘못된 콜로니 수가 생성될 수 있습니다. - 멸균 80%(v/v) 글리세롤 3mL를 보관용으로 지정된 12개의 추가 플라스크 각각에 추가합니다. 소용돌이 치고 부드럽게 소용돌이 치면서 철저히 섞는다.
- 각 플라스크의 혼합물을 샘플에 대한 고유 식별자, 샘플이 속한 LTEE 모집단, 냉동된 세대, 혼합된(모집단) 샘플인지 및 날짜로 라벨링된 멸균 극저온 액체로 분배합니다. 6mL를 하나의 큰 바이알에 피펫하고 1.25mL를 6개의 작은 바이알에 각각 피펫팅합니다.
참고: 큰 바이알은 작업 재고입니다. 하나의 작은 바이알은 작업 재고가 고갈되거나 오염 될 경우를 대비하여 백업됩니다. 나머지 5개의 작은 바이알은 다른 실험실로 보낼 수 있는 사본입니다. - 채워진 바이알을 -80°C에서 동결합니다.
- 배양 24시간 및 48시간 후 TA, MG 및 MA 플레이트에서 콜로니의 성장과 형태를 검사하고 문서화합니다.
참고: REL606 및 REL607 조상과 76,000세대에 도금되었을 때 12개의 LTEE 개체군 각각에 의해 형성된 콜로니의 이미지 및 설명은 대표 결과 섹션을 참조하십시오. - 선택 사항: 클론 분리주를 보관할 때 다음 단계를 수행합니다.
- MG 플레이트에서 각 LTEE 집단에 대해 3개의 클론 분리주(콜로니)를 선택하고, 새로운 MG 플레이트에 각각 개별적으로 줄무늬를 긋고, 이 플레이트를 37°C에서 16-24시간 동안 배양합니다.
참고: 형태가 다른 콜로니가 있는 경우 LTEE의 표준 관행은 먼저 가장 일반적인 유형을 선택한 다음 소수 유형에서 추가 콜로니를 선택하여 최대 다양성을 샘플링하는 것입니다. 세포를 퍼뜨리기 전에 페트리 접시 바닥 밑면에 점을 표시한 다음 성장 후 각 표시에 가장 가까운 분리된 콜로니를 선택하여 무작위 샘플링 전략을 사용할 수도 있습니다. - 다음날, 각각의 플레이트로부터 대표 콜로니를 새로운 MG 플레이트에 연속으로 배치하고, 이들 플레이트를 37°C에서 16-24시간 동안 인큐베이션한다.
- 다음 날, 각 MG 플레이트에서 분리된 콜로니 1개를 신선한 DM1000 10mL가 들어 있는 플라스크에 접종합니다. 또한 배지 오염을 테스트하기 위해 접종되지 않은 블랭크로 사용할 DM1000 10mL로 추가 플라스크 1개를 채웁니다.
- 플라스크를 37°C에서 16-24시간 동안 120rpm 직경에 걸쳐 120rpm 오비탈 쉐이킹으로 인큐베이션합니다.
- 배양 후 멸균 80%(v/v) 글리세롤 2mL를 각 플라스크에 넣고 소용돌이쳐 혼합합니다.
- 각 플라스크에서 1.25mL 분취량을 각 클론, LTEE 집단 및 기원 생성, 클론 샘플인지 및 날짜에 대한 고유 식별자가 표시된 작은 멸균 바이알에 분배합니다.
- 채워진 바이알을 -80°C에서 동결합니다.
- MG 플레이트에서 각 LTEE 집단에 대해 3개의 클론 분리주(콜로니)를 선택하고, 새로운 MG 플레이트에 각각 개별적으로 줄무늬를 긋고, 이 플레이트를 37°C에서 16-24시간 동안 배양합니다.
3. 경쟁력 분석
참고: LTEE에서 생식 적합성은 일일 이동과 동일한 조건에서 서로 다른 박테리아가 하나 이상의 24시간 배양 주기에 걸쳐 달성하는 상대적인 배가 횟수로 정량화됩니다. 특히, 한 경쟁자와 다른 경쟁자의 상대적 적합성은 공동 문화에서 일대일 경쟁을 할 때 실현된 배가율의 비율입니다. 한 쌍의 각 경쟁자는 LTEE의 동결된 "화석 기록"의 일부로 이전에 보관된 전체 집단 또는 클론 분리물일 수 있습니다. 대안적으로, 하나 또는 둘 모두의 경쟁자는 그 효과를 시험하기 위해 특정 돌연변이를 추가하거나 제거하도록 유전자 변형된 클론일 수 있다. 두 경쟁자는 이 유전자 마커가 이 분석 중에 그들을 구별하는 데 사용되기 때문에 반대 Ara+/Ara- 상태를 가져야 합니다. 경쟁 분석의 전체 워크플로우는 그림 2에 나와 있습니다. 공동 배양 단계의 기간을 1일에서 3일(또는 그 이상)로 연장하여 거의 균등하게 일치하는 경쟁자 간의 차이를 테스트할 때 적합성 추정치의 정밀도를 향상시킬 수 있습니다. 이 프로토콜의 다른 중요한 고려 사항 및 가능한 수정 사항에 대해서는 토론 을 참조하십시오.
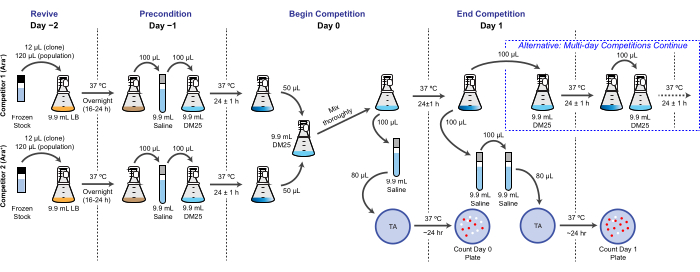
그림 2: 경쟁 분석 순서도. 1일 경쟁 분석에 대한 전체 절차가 표시됩니다. 3일간의 절차는 1일차와 2일차의 대체 경로로 계속되며, 1일차 대회 1일차에 표시된 것과 같은 방식으로 3일차에 도금됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 소모품 준비
- 얼마나 많은 경쟁사 LTEE 균주 및/또는 모집단을 사용할 것인지, 그리고 각 경쟁사 쌍에 대해 얼마나 많은 복제 경쟁 분석을 수행할 것인지 결정합니다. 다음 단계에 설명된 대로 필요한 소모품을 준비합니다.
참고: 모든 미디어 및 솔루션에 대한 레시피는 온라인에서 사용할 수 있습니다30. 대회 실험의 모든 날에 필요한 플라스크와 시험관은 미리 채우거나 사용할 날에 필요에 따라 채울 수 있습니다. 플라스크와 시험관을 미리 채워 놓은 경우 증발을 최소화하기 위해 어두운 곳에서 실온에 보관하십시오. TA 플레이트는 배양 희석액이 퍼질 수 있도록 부은 후 충분히 건조될 수 있도록 사용 시기로부터 최소 2일 전에 준비해야 합니다. 피펫팅 실수, 오염된 플레이트 또는 기타 경미한 사고가 있는 경우 실험을 계속할 수 있도록 항상 몇 개의 추가 플라스크, 시험관 및 TA 플레이트를 준비하십시오. - 부흥일(-2일)의 경우, 경쟁자로 사용될 대장균 균 주 또는 개체군당 9.9mL의 DM1000 또는 Lysogeny Broth(LB)가 들어 있는 20mL 비커로 덮인 멸균 50mL 삼각 플라스크 1개를 채웁니다. 플라스크에 동일한 배지 9.9mL를 하나 더 채워 접종되지 않은 블랭크로 사용합니다.
- 전처리일(Day -1)의 경우, 시험관 1개에 경쟁자당 0.85%(w/v) 멸균 식염수 9.9mL를 채우고, 한 쌍의 경쟁자 사이에 복제 분석당 9.9mL의 DM25가 포함된 플라스크 2개를 채우고, 블랭크의 경우 9.9mL의 DM25가 포함된 플라스크 1개를 더 채웁니다.
- 대회가 시작되는 날(0일) 동안 플라스크 1개에 DM25 9.9mL를 채우고, 시험관 1개에 0.85%(w/v) 멸균 식염수 9.9mL를 채우고, 대회 분석 복제물당 TA 플레이트 1개를 준비합니다. 플라스크에 DM25 9.9mL를 하나 더 채워 블랭크로 사용합니다.
- 대안: 첫 번째 대회 이후 여러 날에 걸친 대회의 매일 대회 복제당 9.9mL DM25로 플라스크 하나를 채우고 블랭크를 위해 9.9mL의 DM25로 플라스크를 하나 더 채웁니다.
- 대회 마지막 날(예: 1일차 또는 3일차)에 두 개의 시험관에 9.9mL의 0.85%(w/v) 멸균 식염수를 채우고 대회 복제당 하나의 TA 플레이트를 준비합니다.
- 얼마나 많은 경쟁사 LTEE 균주 및/또는 모집단을 사용할 것인지, 그리고 각 경쟁사 쌍에 대해 얼마나 많은 복제 경쟁 분석을 수행할 것인지 결정합니다. 다음 단계에 설명된 대로 필요한 소모품을 준비합니다.
- −2일차: DM1000 또는 LB에서 경쟁자를 따로 소생시킵니다.
- 각 경쟁업체에 대해 9.9mL의 DM1000 또는 LB로 채워진 플라스크에 라벨을 붙이고, 동일한 배지 배치에서 9.9mL로 채워진 추가 플라스크에 라벨을 붙여서 오염 여부를 테스트하기 위해 접종되지 않은 블랭크로 사용합니다.
참고: 냉동 재고는 동결 보존된 세포의 보다 균일하고 예측 가능한 회수를 위해 LB 또는 DM1000에서 부활합니다. 동결 방지제로 사용되는 글리세롤은 대장균에 의해 대사될 수 있으며, 이는 샘플이 DM25에서 부활하면 예상보다 더 높은 세포 밀도로 이어질 것입니다. LB 및 DM1000은 이러한 합병증이 무시할 수 있을 정도로 높은 세포 밀도로의 성장을 지원합니다. - 경쟁사 균주의 냉동 재고가 들어 있는 극저온 액체를 -80°C 냉동고에서 꺼냅니다. 바이알을 사용하는 동안 얼음 양동이에 차갑게 보관하십시오.
- 각 냉동 스톡이 해동된 후 완전히 소용돌이쳐 대장균 세포를 재현탁합니다. 클론을 되살리는 경우 신선한 배지가 들어 있는 플라스크에 냉동 스톡 12μL를 접종합니다. 개체군을 되살리는 경우 플라스크에 냉동 스톡 120μL를 접종합니다.
참고: 120μL 부피의 냉동 스톡은 모집단에 사용되므로 되살아나는 세포의 수는 LTEE 모집단의 1%가 새 플라스크로 옮겨질 때 매일 병목 현상과 거의 동일합니다. 냉동 주식을 여러 번 해동하고 소용돌이치면 세포에 스트레스가 가해지고 시간이 지남에 따라 주식의 생존 능력이 감소할 수 있습니다. 주어진 LTEE 모집단 또는 클론이 대회에서 여러 번 사용될 예정인 경우, 재고의 여러 사본을 다시 성장시키고 동결하여 단일 제품이 여러 번 해동되고 다시 냉동되지 않도록 하는 것이 좋습니다. - 부흥 플라스크 및 블랭크를 37°C에서 하룻밤 동안(16-24시간) 1인치 직경에 걸쳐 120 rpm 오비탈 진탕으로 인큐베이션한다.
- 각 경쟁업체에 대해 9.9mL의 DM1000 또는 LB로 채워진 플라스크에 라벨을 붙이고, 동일한 배지 배치에서 9.9mL로 채워진 추가 플라스크에 라벨을 붙여서 오염 여부를 테스트하기 위해 접종되지 않은 블랭크로 사용합니다.
- 1일차: DM25에서 경쟁자를 별도로 사전 조건 지정
- 각 경쟁자에 대해 9.9mL의 식염수로 채워진 시험관에 라벨을 붙입니다. 한 쌍의 경쟁자 간의 각 복제 경쟁 분석에 대해 9.9mL의 DM25로 채워진 두 개의 50mL 플라스크에 각각 복제 번호와 경쟁자 중 하나의 이름을 표시합니다. 9.9mL의 DM25로 채워진 하나의 추가 플라스크에 라벨을 붙여 블랭크로 사용합니다.
- 부활 한 경쟁자의 문화가 들어있는 플라스크를 인큐베이터에서 꺼내십시오. 눈으로 탁도를 검사하여 성장했는지, 명백한 오염이 없는지 확인하십시오.
- 각 플라스크에서 100 μL를 해당 경쟁자용 식염수 시험관에 피펫팅합니다.
참고: 이 단계는 배양을 100배 희석하는데, 이는 LTEE에서 사용되는 DM25 환경보다 LB 및 DM1000에서 세포 밀도가 훨씬 높기 때문에 필요합니다( 대표 결과 참조). - 희석된 배양물로부터 100 μL를 피펫팅하기 직전에 각 희석 튜브를 신선한 DM25가 담긴 플라스크에 완전히 와동시킨다. 각 복제 분석에 대해 이러한 사전 컨디셔닝 플라스크 중 2개를 각 경쟁자에 대해 하나씩 접종합니다.
- 예비컨디셔닝 플라스크 및 블랭크를 37°C에서 24 ± 1시간 동안 1 인치 직경에 걸쳐 120 rpm 오비탈 진탕으로 인큐베이션한다.
- Day 0: 초기 카운트를 위해 경쟁자와 플레이트를 혼합하여 경쟁 시작
- 각 경쟁 분석 복제에 대해 9.9mL의 DM25로 채워진 플라스크 1개와 식염수 9.9mL로 채워진 시험관 1개에 라벨을 붙입니다. 플라스크와 튜브에 각 경쟁자 쌍과 경쟁 분석의 복제 횟수를 고유하게 식별하는 방식으로 라벨을 붙입니다. 9.9mL의 DM25로 채워진 하나의 추가 플라스크에 라벨을 붙여 블랭크로 사용합니다.
- 인큐베이터에서 프리컨디셔닝 플라스크를 꺼냅니다. 눈으로 탁도를 검사하여 성장했는지, 명백한 오염이 없는지 확인하십시오.
- Ara- 경쟁자 50μL를 신선한 DM25로 채워진 첫 번째 복제 경쟁 플라스크에 옮깁니다. 즉시 Ara+ 경쟁사 50μL를 동일한 경쟁 플라스크에 옮기고 부드럽게 소용돌이치면서 혼합합니다.
- 모든 경쟁 제품 쌍의 모든 반복실험에 대해 3.4.3단계를 반복합니다.
참고: 경쟁 플라스크는 이제 DM25에서 성장한 대장균 배양물의 전체 100배 희석을 가지며, 이는 매일 이식 후 LTEE 경험에서 동일한 조건의 세포입니다. 전송 및 믹싱을 수행하는 순서가 중요합니다. 두 경쟁자를 각 플라스크에 즉시 하나씩 추가하여 신선한 매체에서 성장하지 못하도록합니다. 예를 들어, 모든 경쟁 플라스크에 Ara- 배양을 추가하지 말고 돌아가서 모든 Ara+ 균주를 추가합니다. - 새로 접종된 각 경쟁 플라스크에서 100 μL를 피펫팅하여 해당 경쟁 분석 복제를 위해 표지된 식염수 테스트 튜브에 넣어 각 튜브에 결합된 사전 컨디셔닝된 DM25 배양물의 전체 10,000배 희석액을 포함하도록 합니다.
- 경쟁 플라스크와 블랭크를 쉐이킹 인큐베이터에 넣습니다. 경쟁 플라스크를 37°C에서 24± 1시간 동안 1인치 직경에 걸쳐 120rpm 궤도 진탕으로 배양합니다.
- 같은 날, 경쟁 플라스크를 인큐베이터에 넣은 직후, 단계 3.4.5로부터의 각 시험관을 완전히 와동시키고, 단계 2.10에 기재된 바와 같이 이들 10,000배 희석액 80μL를 TA 플레이트에 퍼뜨린다. 각 플레이트의 바닥 측면에 혼합된 한 쌍의 균주, 복제 번호 및 "Day 0"이라는 레이블을 지정하여 각 경쟁자의 초기 표현을 결정하는 데 사용될 것임을 나타냅니다.
- Ara- 및 Ara+ 경쟁자의 콜로니가 보이고 구별될 때까지 37°C의 중력 대류 인큐베이터에서 TA 플레이트를 거꾸로 배양합니다. 일반적으로 이것은 16-24시간 이내에 발생하지만 일부 진화된 균주의 경우 더 오래 걸릴 수 있습니다. 각 플레이트에서 Ara- (빨간색) 및Ara+ (흰색) 콜로니의 수를 세고 결과를 기록합니다.
참고: TA 플레이트의 Ara- 및 Ara+ 콜로니 색상 간의 차이는 플레이트를 4°C에서 보관하더라도 시간이 지남에 따라 덜 뚜렷해지므로 인큐베이터에서 꺼낸 후 가능한 한 빨리 계수해야 합니다. Ara- 및 Ara+ 세포에 의해 형성된 콜로니의 전형적인 모습을 보여주는 TA 플레이트의 이미지가 대표 결과에 포함되어 있습니다. 이 섹션에는 일반적인 "엣지 케이스" 콜로니(예: 다른 콜로니 유형의 겹침 또는 파생물)의 이미지도 있으며 이를 계산하는 방법을 설명합니다. 경쟁자에 의해 TA 플레이트에 형성된 콜로니의 성장률과 형태가 이전에 특성화되지 않은 경우, 경쟁자가 여전히 서로 분리되어 있는 0일에 전처리 플라스크에서 식염수에 10,000배 희석된 80μL를 뿌립니다. 그런 다음 37°C에서 16-24시간 이상 배양한 후 이러한 대조군 플레이트에서 콜로니를 검사합니다.
- 대안: 1일차 및 2일차: 3일간의 대회 계속
- 각 경쟁 분석 복제에 대해 9.9mL의 DM25로 채워진 하나의 플라스크에 라벨을 붙입니다. 각 경쟁자 쌍, 복제 번호 및 경쟁 분석 날짜를 고유하게 식별하는 방식으로 플라스크에 라벨을 붙입니다. 9.9mL의 DM25로 채워진 하나의 추가 플라스크에 라벨을 붙여 블랭크로 사용합니다.
- 인큐베이터에서 전날의 경쟁 플라스크를 꺼냅니다. 눈으로 탁도를 검사하여 예상 성장을 확인하고 오염을 감지합니다.
- 각 대회 플라스크에서 100 μL를 대회 다음날을 위해 신선한 배지의 해당 플라스크로 옮깁니다.
- 새 경쟁 플라스크와 블랭크를 진탕 인큐베이터에 넣습니다. 37°C에서 24± 1시간 동안 1인치 직경에 걸쳐 120rpm 궤도 진탕으로 배양합니다.
- 대회 2일차에 3.5.1-3.5.4단계를 반복한 후 진행하세요.
- 1일차 또는 3일차: 대회를 마치고 최종 집계를 위한 플레이트
- 각 경쟁 플라스크에 대해 9.9mL의 식염수로 채워진 두 개의 시험관을 준비합니다. 각 경쟁자 쌍, 복제 번호 및 첫 번째 또는 두 번째 희석 여부를 고유하게 식별하는 방식으로 레이블을 지정합니다.
- 인큐베이터에서 경쟁 플라스크를 꺼냅니다. 눈으로 탁도를 검사하여 자랐고 명백한 오염이 없음을 감지합니다.
- 각 경쟁 플라스크에서 100 μL를 해당 복제를 위한 식염수의 첫 번째 튜브에 피펫팅합니다. 생성된 튜브에는 DM25 배양물의 100배 희석액이 포함되어 있습니다.
- 각 100배 희석 튜브를 소용돌이하여 완전히 혼합하고 100μL를 식염수의 두 번째 튜브에 피펫팅하여 복제합니다. 생성된 튜브에는 DM25 배양물의 10,000배 희석액이 포함되어 있습니다.
- 10,000배 희석액이 들어 있는 각 시험관을 완전히 소용돌이치게 하고, 2.10 단계에 기재된 바와 같이 80 μL를 TA 플레이트에 펼친다. 각 플레이트의 바닥 측면에 혼합된 균주 쌍, 반복 횟수, 1일 대회의 경우 "Day 1", 3일 대회의 경우 "Day 3"이라는 라벨을 붙여 각 경쟁자의 최종 대표성을 결정하는 데 사용될 것임을 나타냅니다.
- TA 플레이트를 37°C에서 배양하고 단계 3.4.8에 설명된 대로 성장 후 Ara- 및 Ara+ 콜로니를 계수합니다.
참고: 모든 전송 및 도금 단계에서 각 경쟁 분석의 반복 횟수를 추적하십시오. 서로 다른 반복 분석 간에 어떤 최종 카운트와 초기 카운트가 일치하는지 혼동하면 동일한 두 경쟁자가 각각 혼합된 경우에도 잘못된 적합성 추정치가 발생합니다.
- 계산 및 플롯 적합성
- Excel을 사용하여 상대 적합도를 계산하고 플로팅하는 경우 XLS 스프레드시트(보충 파일 1)를 다운로드합니다. R을 사용하는 경우 fitnessR 패키지31 을 설치하고 CSV(쉼표로 구분된 값) 템플릿(보충 파일 2)을 다운로드하거나 비네트의 지침에 따라 이 파일의 새 복사본을 생성합니다.
- 다운로드한 파일의 지정된 세포 또는 컬럼에서 수행된 경쟁 분석에 대해 100의 "전사 희석"을 입력합니다. 경쟁업체가 공동 배양된 일일 성장 주기의 총 수를 "이전 횟수"로 입력합니다(예: 3일 경쟁의 경우 3).
- 각 경쟁 제품 쌍의 이름을 지정된 셀 또는 열에 입력하고 기준 변형을 "competitor1"로, 검정 변형 또는 모집단을 "competitor2"로 입력합니다.
- 각 경쟁 분석 반복실험에 대해 각각의 초기 및 최종 콜로니 수를 다운로드한 파일의 지정된 열에 입력합니다.
- Excel 스프레드시트를 사용하는 경우 이제 이 추정치에 대한 평균 상대 적합성 값과 95% 신뢰 한계가 표시됩니다. 경쟁업체의 다양한 조합에 대한 결과를 다른 시트에 복사하고 결과를 요약하는 차트를 만듭니다. R을 사용하여 데이터를 분석하는 경우 fitnessR 패키지에 대한 비네트의 지침에 따라 이러한 계산을 수행하고, 계산된 값이 포함된 CSV 파일을 출력하고, 결과를 플로팅합니다.
Representative Results
LTEE 배양의 외관 및 탁도
DM25의 낮은 포도당 농도로 인해 완전히 성장한 LTEE 집단의 탁도는 12개의 플라스크 중 11개에서만 거의 볼 수 없습니다. LTEE 배양물을 눈으로 검사하여 정상적인 성장과 오염 징후를 확인할 때(단계 1.6), LTEE 집단이 포함된 각 플라스크를 블랭크와 나란히 비교해야 합니다(그림 3A). 예외는 집단 A-3으로, 구연산염을 추가 탄소 및 에너지원으로 사용하도록 진화하여 더 높은 세포 밀도에 도달합니다32. REL606 및 REL607 조상 균주의 DM25 배양의 탁도는 전형적인 진화된 개체군의 탁도와 유사합니다(그림 3B). LTEE 균주 및 개체군은 더 높은 농도의 포도당과 LB의 훨씬 더 높은 밀도로 인해 DM1000에서 더 높은 밀도로 성장합니다(그림 3B). A-3 LTEE 집단의 DM25 배양 밀도는 DM25와 DM1000에서 REL606의 배양 밀도 사이의 중간입니다(그림 3C).

그림 3: LTEE 배양의 모습. (A) 실험이 76,253 1/3세대에 도달한 날에 DM25에서 24시간 동안 성장한 후 12개의 LTEE 개체군을 포함하는 플라스크가 블랭크와 함께 그려져 있습니다. (B) DM25, DM1000 및 LB에서 24시간 동안 성장한 REL606 및 REL607 조상의 배양물을 포함하는 플라스크가 미디어 블랭크와 함께 사진에 표시됩니다. (C) DM25의 A-3 개체군 플라스크의 탁도가 DM25 및 DM1000의 REL606 조상과 어떻게 비교되는지 보여주는 동일한 플라스크의 사진을 나란히 확대합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
DM25(단계 1.7)에서 성장한 배양물의 600nm(OD600)에서 광학 밀도의 분광 광도계 판독값은 LTEE 개체군(그림 4A)과 그 조상(그림 4B) 모두에 대한 이러한 시각적 관찰과 일치합니다. 이러한 판독값은 오염이나 실수가 의심될 때 성장을 정량적으로 비교하고 문서화하는 데 사용할 수 있습니다. 76,000 세대에서 76,500 세대 사이의 LTEE 개체군을 측정하기 위해 구연산염에서 자라도록 진화 한 인구 인 A-3의 OD600은 평균 0.223 (0.218-0.227, 95 % 신뢰 구간)이었습니다. 다른 11개 모집단의 OD600은 평균 0.0252였습니다(0.0239-0.0265, 95% 신뢰 구간). 11개의 정상 집단 사이에서 OD600 수치에 약간이지만 상당한 차이가 있었습니다(NS 10,88 = 5.1035, NS = 7.5×10-6). LTEE 개체군은 약 5-6시간의 배양 후에 정지기에 도달합니다. 아침에 옮기면 같은 날 오후 중순에서 늦은 오후까지 성장이 보일 것입니다. 많은 종류의 미생물이 구연산염에서 호기성으로 자랄 수 있습니다. 따라서 A-3 이외의 개체군에서 탁도가 증가하면 외부 오염의 징후일 가능성이 높습니다.
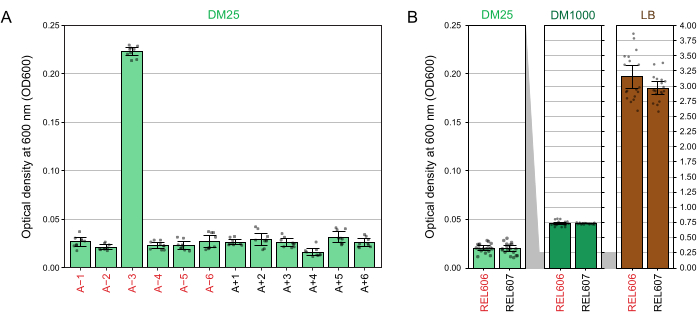
그림 4: LTEE 배양의 탁도. (A) 실험의 76,000 및 76,500 세대 사이의 3 개의 상이한 날에 24 시간 성장 사이클 후 12 개의 LTEE 집단의 600 nm (OD600)에서의 광학 밀도. 3개의 다른 날짜 각각에 대한 3개의 1mL 분취량의 OD600 값을 점으로 표시합니다. 같은 날부터 블랭크의 3개의 상이한 분취량의 평균 OD600 값을 이들 값에서 뺀다. 채워진 막대는 평균을 나타냅니다. 오차 막대는 95% 신뢰 한계입니다. (B) DM25, DM1000 및 LB에서 REL606 및 REL607 조상의 배양물의 OD600. 각 조건 및 균주에 대한 2개의 개별 배양의 3개의 상이한 일 각각에 대한 3개의 1mL 분취액의 OD600 값은 점으로 표시된다. 같은 날부터 블랭크의 3개의 상이한 분취량의 평균 OD600 값을 이들 값에서 뺀다. 채워진 막대는 평균을 나타내고 오차 막대는 95% 신뢰 한계입니다. 패널 사이의 회색 음영 영역은 DM25 패널과 DM1000 및 LB 패널 사이에서 OD600 축의 크기가 조정되는 방식을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
LTEE 콜로니의 성장과 형태
개체군을 다른 매체에 도금하여 오염 여부를 확인할 때(단계 2.15), REL606 및 REL607 조상과 모든 진화된 개체군은 최소 포도당(MG) 한천 플레이트에 반투명하고 다소 불규칙한 가장자리를 가진 흰색 콜로니를 형성합니다(그림 5A). MG 한천의 조성은 더 높은 농도의 포도당을 제외하고는 일일 LTEE 전달에 사용되는 DM25의 조성과 동일하므로 진화된 LTEE 개체군은 종종 조상보다 MG에서 더 큰 콜로니를 형성합니다. DM25의 세포 밀도가 더 높기 때문에 A-3 개체군은 다른 개체군과 동일한 부피를 도금하면 몇 배 더 많은 콜로니를 갖게 되며 이는 콜로니의 크기를 제한할 수 있습니다. 가장 흔한 유형의 오염 미생물은 MG에서 완전히 흰색이고 불투명하며 완벽한 원형 집락을 형성합니다.
최소 아라비노스(MA) 한천에서 REL607 조상과 Ara+ 개체군은 일반적으로 모두 약간 반투명한 흰색 군체를 형성합니다. 이 전형적인 성장 패턴은 아라비노스의 성장 결함을 진화시키고 더 이상 MA에서 집락을 형성하지 않는 A+6을 제외하고 76,000세대에 걸쳐 Ara+ 개체군에서 지속되었습니다(그림 5B). DM25에서 LTEE 전달 동안 아라비노스의 성장을 유지하기 위한 선택이 없으므로 다른 Ara+ 개체군도 실험이 계속됨에 따라 결국 MA 한천 플레이트에 콜로니 형성을 중단할 수 있습니다. A-3을 제외하고, Ara- 개체군은 MA 한천에 집락을 형성하지 않지만, 면밀한 조사에서 한천의 미량 영양소로 인해 미세 집락이 드러날 수 있습니다. A-3 개체군은 MA에 수많은 작은 콜로니를 형성하는데, 이는 이 세포가 이 배지에도 존재하는 구연산염에서 자랄 수 있기 때문입니다. MA의 오염 물질 식민지는 드뭅니다.
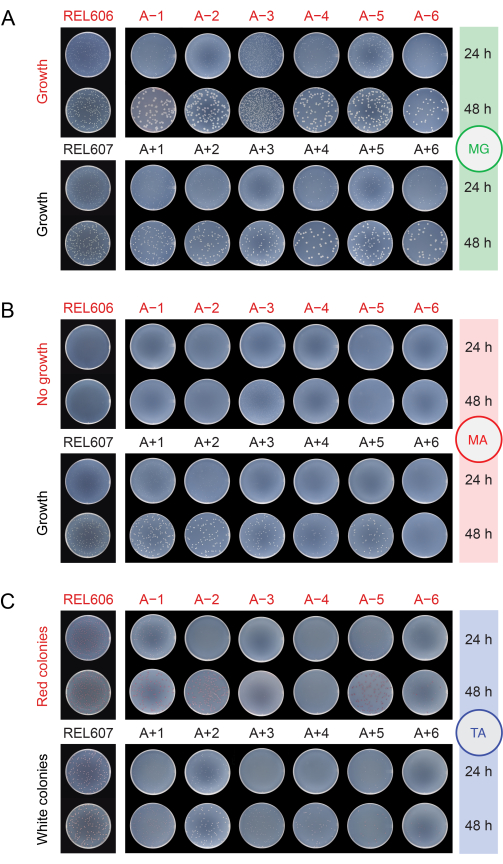
그림 5: 오염을 감지하기 위한 도금 LTEE 모집단. 실험이 76,026 2/3세대에 도달한 날에 REL606 및 REL607 조상과 12개의 LTEE 집단의 희석액을 (A) MG, (B) MA 및 (C) TA 한천 플레이트에 도말하고 24시간 및 48시간 후에 촬영했습니다. 모든 배양물에 대해 동일한 희석이 이루어졌지만, 더 높은 세포 밀도를 어느 정도 설명하기 위해 LTEE 집단에 대한 프로토콜에 설명된 것과 같이 조상에 대해 절반의 부피가 도금되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
테트라졸리움 아라비노스(TA) 한천에서 REL606 조상과 모든 Ara- 개체군은 적색 집락을 형성할 것으로 예상되는 반면, REL607 조상과 모든 Ara+ 개체군은 일반적으로 흰색(밝은 분홍색 또는 복숭아 색조를 포함할 수 있음)인 군체를 형성해야 합니다(그림 5C). LTEE 조상은 16-24시간 이내에 TA 한천에서 Ara- 및 Ara+로 쉽게 식별할 수 있는 강력한 콜로니를 형성합니다. 원래 이 차이는 Ara-와 Ara+ 개체군 간의 교차 오염을 감지하는 데 사용될 수 있었습니다. 그러나 TA 한천은 일상적인 전달에 사용되는 화학적으로 정의된 DM25 배지보다 더 복잡한 영양 조성을 가지고 있으며, LTEE의 대장균이 이러한 조건에서 강력하게 성장할 수 있는 능력을 유지해야 한다는 진화적 압력이 없었습니다. 결과적으로, 일부 진화된 LTEE 개체군은 이제 TA 플레이트에서 열악한 성장을 나타내며, 콜로니를 형성하는 데 48시간이 걸리거나 전혀 안정적으로 성장하지 않습니다. 진화된 LTEE 개체군에 의해 TA에 형성된 군체의 색상과 형태도 조상에 비해 변화하고 서로 갈라졌습니다. 몇 가지 비정상적인 식민지의 존재가 항상 오염의 표시는 아닙니다. araA 활성을 회복시키는 복귀 돌연변이에 비해 아라비노스 이용에 영향을 미치는 기능 상실 돌연변이의 가능성이 더 높기 때문에 LTEE 균주의 Ara 마커 상태를 특히 Ara+에서 Ara-로 전환하는 자발적인 돌연변이가 발생할 수 있습니다. Ara 마커 상태를 전환하는 돌연변이는 과돌연변이(A-1, A-2, A-3, A-4, A+3 및 A+6)를 진화시킨 집단에서 더 흔합니다13. TA 한천에서 다른 종의 오염 미생물은 종종(항상 그런 것은 아님) LTEE 균주 또는 개체군에 의해 형성된 것과는 다른 뚜렷한 흰색 경계로 둘러싸인 빨간색 중심이 있는 작고 완벽한 원형 콜로니를 형성합니다.
코컬쳐 공모전 결과
두 LTEE 조상(각각 REL606 및 REL607)의 모든 Ara- 및 Ara+ 쌍과 20,000세대에 보관된 A-5 및 A+5 모집단 샘플(각각 REL8597 및 REL8604) 간의 경쟁은 서로 다른 Ara 마커 상태를 가진 콜로니를 TA 한천에서 분화하고 계수할 수 있는 방법을 보여줍니다(단계 3.4.8 및 3.6.6)(그림 6). 콜로니는 DM1000에서 부활로 시작된 1일 및 3일 분석 전후에 각 경쟁자 쌍에 대해 6개의 복제 플라스크에 대해 계산되었습니다(표 1). 동일한 희석 및 도금된 부피에 대해 관찰된 총 콜로니 수는 진화된 LTEE 개체군의 배양이 DM25의 조상 균주의 배양보다 낮은 세포 밀도에 도달하기 때문에 경쟁자가 혼합된 것과 다릅니다. 이러한 차이는 증가된 세포 크기의 진화의 결과이며, 이는 실험 8,33의 처음 수천 세대 동안 모든 LTEE 집단에서 발생하였다.
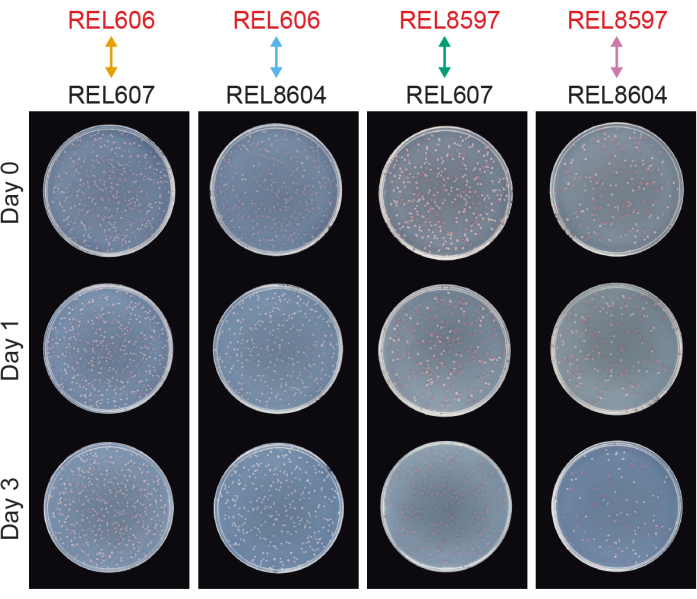
그림 6: TA 한천 플레이트에 도말된 경쟁 분석. 경쟁 분석으로부터의 TA 한천 플레이트의 예. REL606 및 REL607은 각각 LTEE의 Ara- 및 Ara+ 조상입니다. REL8597과 REL8604는 LTEE의 얼어붙은 "화석 기록"에서 각각 20,000명의 A-5 및 A+5 세대입니다. 각 균주 쌍 사이의 하나의 복제 분석에 해당하는 TA 플레이트를 대회 0일차, 1일차 및 3일차에 대해 표시합니다. 플레이트는 37°C에서 24시간 동안 성장한 후 촬영했습니다. REL606 및 REL8597 경쟁자의 세포는 Ara- 이며 적색 콜로니를 형성합니다. REL607 및 REL8604 경쟁자의 세포는 Ara+ 이며 흰색 콜로니를 형성합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
일반적인 경쟁 TA 플레이트에 있는 대부분의 콜로니는 서로 다른 유형의 초기 원형 콜로니가 함께 성장한 수를 쉽게 계산할 수 있는 방식으로 잘 분리되거나 겹칩니다(그림 7A). 그러나 두 가지 색상이 혼합 된 비정형 식민지 또는 성장을 계산하는 방법이 명확하지 않은 상황이 발생할 수 있습니다. 첫째, 흰색 Ara+ 군체와 빨간색 Ara-군체가 겹치면 Ara+ 군체가 자라서 Ara-군체를 덮는 경향이 있습니다. 이 상황에서는 더 큰 Ara+ 군체의 작은 빨간색 패치 또는 반투명 "간격"을 Ara- 군체로 계산해야 합니다(그림 7B). 둘째, 자발적인 Ara+ 돌연변이는 때때로 Ara-colonies에서 발생합니다. 이러한 돌연변이는 일반적으로 추가 영양소로 아라비노스에 접근하면 더 빨리 성장하기 때문에 적색 군체의 내부에서 더 빨리 퍼지는 흰색 섹터(유두)로 나타납니다(그림 7C). 이 백색 부문 식민지는 하나의 Ara-colony로 간주되며 Ara+ 식민지는 없습니다. 이 상황은 플레이트를 48시간 이상 배양하는 경우 더 흔해집니다. 셋째, 때때로 반투명 분홍빛이 도는 집락이 관찰됩니다(그림 7D). 이들은 Ara-경쟁자에 의해 형성됩니다. 마지막으로, 내부가 약간 다른 적색 음영을 가진 소수의 원형 콜로니는 한천을 준비하는 동안 또는 표면에 배양 희석액을 뿌릴 때 몇 개의 외부 미생물 세포에 의해 오염될 때 TA 플레이트에서 자라는 경우가 있습니다(그림 7E). 이러한 오염 물질 식민지는 계산되어서는 안됩니다. TA 플레이트에 비정형 콜로니가 많기 때문에 경쟁 문화의 오염이 의심되는 경우 해당 복제를 배제해야 합니다.
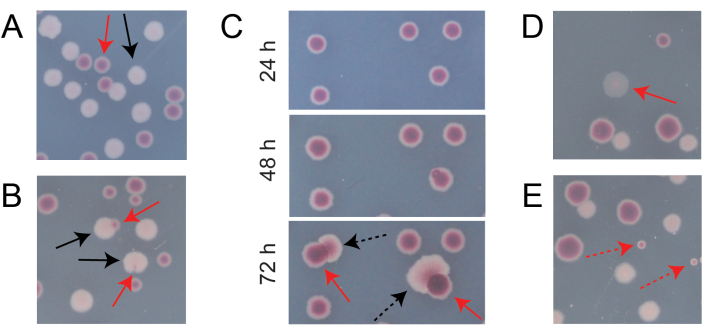
그림 7: TA 한천에서 Ara- 및 Ara+ 콜로니를 계산할 때 발생하는 에지 케이스. 각 패널에서 계산해야 하는 일부 Ara- 및 Ara+ 콜로니는 각각 빨간색 및 검은색 화살표로 표시됩니다. 계산해서는 안되는 식민지는 나타나는 유형에 해당하는 점선 화살표로 표시됩니다. 모든 사진은 패널 C를 제외하고 배양 24시간 후에 촬영되었습니다. (A) 정상 Ara- 및 Ara+ 콜로니의 예. (B) 백색 군체 외부의 투명한 틈으로만 거의 보이지 않는 군체를 포함하여 인근 Ara-군체에 과도하게 자라는 Ara+ 군체의 예. 이러한 각 경우를 각 유형마다 하나씩 두 개의 콜로니로 간주합니다. (C) Ara+ 돌연변이 섹터를 생성하는 Ara-식민지의 예. 각 경우를 단일 Ara- 식민지로 간주하십시오. 발생하는 백색 구역(유두)은 식민지 내에서 발생하는 Ara+ 돌연변이 때문입니다. 동일한 콜로니 밭이 24시간, 48시간 및 72시간의 성장 후에 표시됩니다. (D) 반투명 분홍색 콜로니의 예. Ara-로 계산하십시오. (E) 대장균이 아닌 미생물에 의한 외부 오염에 의해 형성된 콜로니의 예. 이들은 빨간색이지만 더 작고 뚜렷한 흰색 경계가 있는 완벽한 원형입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Excel 스프레드시트(보충 파일 1)를 사용하거나 CSV 템플릿(보충 파일 2)에 입력된 집락 수에 대해 R에서 fitnessR 패키지 함수를 실행하여 이러한 대회의 집락 수를 분석하면 두 조상이 분석의 정밀도 내에서 적합성 측면에서 구별할 수 없으며 20,000세대 A-5 및 A+5 집단 모두 조상보다 훨씬 더 적합하다는 것을 알 수 있습니다. 진화된 집단 어느 쪽도 다른 집단보다 유의하게 더 적합하지 않다는 것입니다(Welch's t-tests, p > 0.05)(그림 8). 상대 체력 추정치의 정밀도는 밀접하게 일치하는 쌍 중 하나에 대한 1일 경쟁에 비해 3일 경쟁에서 향상됩니다(REL606 대 REL607). 이러한 측정의 정밀도는 원하는 경우 더 많은 성장 주기로 더 긴 경쟁을 수행함으로써 더욱 증가할 수 있습니다. 그러나 여러 날에 걸친 대회의 결과는 한 경쟁자가 다른 경쟁자에 비해 너무 많아지면 유익하지 않으며, 두 균주의 비율을 정확하게 결정할 수 없기 때문에 두 균주의 비율을 정확하게 결정할 수 없습니다. 이것은 진화된 20,000세대 인구(REL606 대 REL8604 및 REL607 대 REL8597)에 대한 조상의 3일 간의 경쟁의 경우입니다(그림 6 및 표 1).
표 1: 경쟁 적합성 분석의 집락 수. 2개의 Ara- 및 2개의 Ara+ 경쟁자의 모든 쌍별 조합에 대해 6개의 반복을 사용한 1일 및 3일 경쟁 분석이 수행되었습니다. REL606 및 REL607은 각각 LTEE의 Ara- 및 Ara+ 조상입니다. REL8597과 REL8604는 LTEE의 얼어붙은 "화석 기록"에서 각각 20,000세대 A-5 및 A+5 개체군입니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
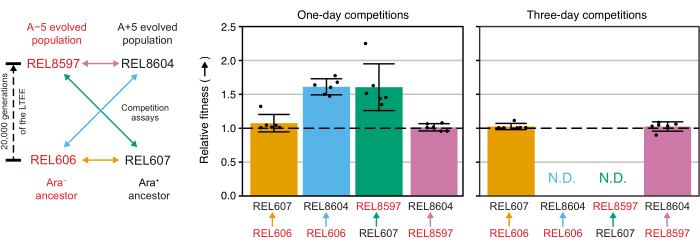
그림 8: 경쟁 분석을 사용하여 측정한 상대 적합성. LTEE 조상과 20,000명의 A-5 및 A+5 LTEE 인구 간의 1일 및 3일 경쟁 분석 결과. 왼쪽 다이어그램은 4개의 쌍별 대회를 색상으로 구분된 양방향 화살표로 보여줍니다. 두 개의 Ara- (빨간색 라벨)와 두 개의 Ara+ (검은색 레이블) 경쟁자의 각 조합은 6배 복제로 테스트되었습니다. 표 1 의 콜로니 계수는 fitnessR 패키지31을 사용하여 R에서 분석되었고, 결과는 ggplot2 패키지(버전 3.4.0)34를 사용하여 플로팅되었습니다. 적합성은 레이블의 화살표가 화살표가 오는 경쟁자를 기준으로 향하는 경쟁자로 표시됩니다(예: REL606에 대한 REL8604). 각 경쟁 분석 반복에 대한 콜로니 수에서 추정된 상대 적합성 값(포인트), 경쟁자 쌍에 대한 평균 상대 적합성 값(다이어그램과 동일한 색상 코딩으로 채워진 막대) 및 95% 신뢰 구간(오차 막대)이 표시됩니다. 조상과 진화된 개체군 사이의 3일 경쟁에 대한 상대적 적합성 값은 결정될 수 없었는데(N.D.) 3일째 판에 조상의 군체가 0개 또는 매우 적었기 때문입니다( 표 1 참조). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1. 상대 체력을 계산하기 위한 Excel 스프레드시트 파일입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2. fitnessR 패키지를 사용하여 R에서 상대적 적합도를 계산하기 위한 쉼표로 구분된 값 입력 파일 템플릿입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
Discussion
LTEE 및 그 방법의 장기 복원력
대장균 장기 진화 실험(LTEE)은 이제 네 번째 10년을 맞이하고 있습니다. 어떤 기간의 미생물 진화 실험이든 재현 가능한 환경을 유지하고, 오염을 방지하고, 샘플을 보관하고, 적합성을 정확하게 측정하는 것이 중요합니다. LTEE는 균질한 환경을 조성하는 잘 흔들린 플라스크와 낮은 세포 밀도를 지원하는 화학적으로 정의된 성장 배지의 사용을 포함하여 이러한 목표를 달성하기 위해 오랜 시간 동안 검증된 몇 가지 전략을 보여줍니다. 또한, LTEE는 진화 환경에서 쉽게 스크리닝되고 선택적으로 중립적인 표현형(콜로니 색상)을 제공하는 유전자 마커가 다른 조상 균주를 사용합니다. 이 실험 설계 기능은 내부 및 외부 오염을 식별하는 수단을 제공하고 적합성 측정을 용이하게 합니다. 그러나 1988년 이후 LTEE에서 사용해온 모든 절차와 안전 장치가 똑같이 강력한 것으로 입증된 것은 아닙니다. LTEE가 시작되었을 때 신뢰할 수 있었던 일부 방법은 대장균 개체군이 진화함에 따라 효과가 떨어졌습니다. 다행스럽게도 이러한 문제가있는 방법은 실험 시작 이후 개발 된 기술을 사용하여 보강하거나 대체 할 수 있습니다.
이물질 검출
오염 감지는 LTEE에 매우 중요합니다. 오염은 LTEE 개체군 사이(교차 오염)와 환경의 미생물(외부 오염)의 두 가지 종류가 있을 수 있습니다. 대부분의 경우 무균 기술을 주의 깊게 사용하고 배지 준비 및 일상적인 이송 중에 세심한 주의를 기울이면 두 가지 유형의 오염을 모두 예방할 수 있지만 발생합니다. 실험 초기에 TA 한천에 대한 도금은 Ara-와 Ara+ 개체군 간에 항상 번갈아 가며 전달되었기 때문에 교차 오염 사례를 감지하는 데 사용할 수 있었습니다. 특정 박테리오파지에 대한 이러한 대장균의 민감도 및 내성에 대한 지문은 또한 LTEE 개체군을 오염시킬 수 있는 일반적으로 사용되는 대장균 실험실 균주와 구별할 수 있는 설계 기능으로 의도되었습니다4. 그러나 이러한 유전적 마커는 실험이 진행됨에 따라 신뢰할 수 없게 되었습니다(예: 일부 개체군은 더 이상 TA 한천에 집락을 형성하지 않음)10,35. 다행스럽게도 개체군은 실험 중에 별도의 진화 역사를 경험하면서 유전적으로 갈라졌으며, 이로 인해 이제 교차 오염을 감지하는 데 사용할 수 있는 새로운 유전적 마커가 생성되었습니다. 예를 들어, 각 집단은 pykF 및 nadR 유전자 14,36,37에서 돌연변이의 독특한 조합을 진화시켰습니다. 우리는 때때로 이 두 유전자를 PCR 증폭하고 Sanger하여 비정상적인 형태나 색상을 가진 콜로니가 교차 오염으로 인한 것인지 여부를 테스트합니다. 전체 게놈 및 전체 집단 시퀀싱 비용이 계속 감소함에 따라 LTEE 집단의 일상적인 시퀀싱이 곧 가능해질 수 있으며, 이에 따라 오염 징후를 모니터링할 수 있는 새로운 기회가 제공될 수 있습니다.
경쟁력 측정
LTEE가 원래 방법을 능가하는 또 다른 사례는 진화된 대장균의 적합성이 실험 환경에서 증가하여 여기에 설명된 프로토콜을 사용하여 조상에 대한 오늘날 개체군의 적합성을 더 이상 직접 측정할 수 없다는 것입니다. 진화된 개체군은 조상을 능가하여 하루 동안의 경쟁 후에 셀 수 있는 조상 식민지가 거의 또는 전혀 남아 있지 않습니다. 이 큰 적합성 차이를 처리하기 위한 한 가지 방법은 균주의 불균등한 시작 비율을 사용하여 덜 적합한 경쟁자(예: 90μL 조상 및 10μL 진화된 경쟁자)에 혼합된 초기 부피에 가중치를 부여하는 것입니다. 두 번째 접근법은 LTEE 조상보다 더 높은 적합성을 가진 진화된 Ara-클론을 식별하고, MA 한천에서 선택하여 자발적인 Ara+ 복귀 돌연변이를 분리한 다음, 복귀 균주가 경쟁 분석 6,38을 사용하여 부모와 동일한 적합성을 갖는지 확인하는 것입니다. 이 새로운 Ara-/Ara+ 쌍은 REL606/REL607 대신 일반적인 경쟁자 균주 세트로 사용할 수 있습니다. 이상적으로, 공통 경쟁자로 선택된 진화된 Ara-클론(및 Ara+ 복귀자)은 실험에서 관심 있는 모든 균주에 비해 중간 적합성을 갖습니다. LTEE의 처음 50,000 세대 동안, 이 두 가지 접근법(동일하지 않은 시작 비율 또는 공통 경쟁자 사용)은 일반적인 접근법39에 비해 의미 있게 다른 적합성 측정을 생성하지 못했습니다.
경쟁 프로토콜에 대한 이러한 수정은 항상 사실이 아닐 수도 있는 특정 단순화 가정을 만듭니다. 하나는 체력 측정이 전이적이라는 것입니다. 즉, 두 모집단을 각각 공통 경쟁자 균주와 개별적으로 경쟁하면 두 모집단의 상대적 적합성을 서로 추론할 수 있습니다. 이러한 관계는 대부분의 경우 LTEE(40)에 대해서는 사실인 것으로 밝혀졌지만, 다른 실험(41)에 대해서는 그렇지 않다. 이러한 불일치의 한 가지 이유는 부정적인 주파수 의존적 적합성 효과의 진화 일 수 있습니다. 이러한 상황은 LTEE의 개체군 A-2에서 서로 다른 두 개의 분기된 계통에서 분리된 균주가 서로 경쟁할 때 발생합니다(19,42). 각각은 희귀 할 때 교차 공급으로 인해 공존을 안정화시키는 이점이 있습니다. 서로 다른 돌연변이 세트를 가진 혈통의 장기 공존을 보여주는 시퀀싱 데이터는 유사한 상호 작용이 다른 LTEE 집단에서도 발생했을 수 있음을 시사합니다14,43, 적합성 추정치를 눈에 띄게 변경할 만큼 충분히 강한지 여부는 확실하지 않습니다. 마지막으로, LTEE32의 집단 A-3에서 구연산염에 대한 호기성 성장의 진화는 이러한 세포의 적합성이 이제 구연산염을 사용할 수 없는 세포와 경쟁할 때 "개인" 자원의 사용을 통합한다는 것을 의미하며, 이는 이러한 결과를 해석하는 것을 복잡하게 만듭니다. 이러한 예외에도 불구하고 낮은 포도당 농도와 잘 흔들리는 환경의 사용은 의심할 여지 없이 LTEE 균주와 개체군 간의 적합성 비교를 단순화했습니다.
이후 세대에 이르러서, LTEE 집단 중 일부는 더 이상 TA 한천에 콜로니를 형성하지 않으며, 이는 수정된 프로토콜을 사용하여 경쟁 실험을 수행하는 것을 어렵거나 불가능하게 만든다10. 콜로니 성장을 필요로 하지 않는 대안적 방법은 앰플리콘44에서 두 개의 대체 대립 유전자를 포함하는 판독의 비율을 계산하기 위해 차세대 시퀀싱을 사용하는 FREQ-seq와 같이 잠재적으로 두 경쟁자의 상대적 표현을 결정하는 데 사용될 수 있습니다. 이 방법 또는 이와 유사한 방법은 조상 서열에 비해 Ara 대립 유전자 또는 pykF 및 nadR과 같은 새로 진화된 돌연변이와 함께 잠재적으로 사용될 수 있습니다. 다른 유형의 중성 마커를 도입하는 유전자 변형을 수행하는 것도 상대적 적합성을 측정하는 데 사용할 수 있습니다. 예를 들어, 형광 단백질 유전자는 LTEE 파생 실험에서 세포의 염색체에 삽입되어 유세포 분석(45)을 사용하여 경쟁자를 계수할 수 있습니다. 동일한 경쟁 플라스크에서 두 개 이상의 균주를 함께 혼합할 수 있는 가능성을 열어주는 또 다른 접근 방식은 PCR 증폭 및 시퀀싱할 수 있는 바코드를 서로 다른 경쟁업체의 게놈에 삽입하는 것입니다. 이 접근법은 진화 실험에서 계보 추적에 사용되었다46. 유세포 분석과 바코드 시퀀싱은 모두 콜로니 계수에 비해 두 균주의 훨씬 더 극단적인 비율을 정확하게 측정할 수 있으므로(한천 플레이트에서 계산할 수 있는 < 500개에 비해 > 10,000개의 세포/게놈을 쿼리할 수 있기 때문에) 이러한 방법을 사용하면 공통 경쟁자와 비교하여 측정할 수 있는 적합성 차이 측면에서 동적 범위를 높일 수 있습니다.
장기 미생물 진화 실험을 위한 대안 설계
모든 장점에도 불구하고 LTEE는 완벽하지 않습니다. 설계의 특정 측면으로 인해 노동 집약적이고 인적 오류가 발생하기 쉽습니다. 예를 들어, 연구원은 실험을 계속하기 위해 매일 실험실에 와서 삼각 플라스크 사이에 피펫을 넣어야 합니다. 경쟁 실험은 또한 멸균 유리 제품, 매체, 인큐베이터 공간 및 식민지 계수에 대한 요구 사항이 소수의 경쟁자라도 적당한 복제로 테스트될 때 급격히 증가한다는 점을 감안할 때 벅찬 물류 장애물이 될 수 있습니다. 우리는 종종 96웰 마이크로플레이트에서 작동하는 피펫팅 로봇과 같은 실험실 자동화 시스템이나 화학 조절기 또는 터비도스탯과 같은 연속 배양 시스템을 활용하지 않는 이유에 대한 질문을 받습니다. 대답은 간단합니다 : LTEE는 어떤 의미에서 오랜 역사를 가진 죄수입니다. 50mL 삼각 플라스크에서 특정 속도로 진탕하는 10mL 배양액에서 벗어나지 말아야 하는데, 이는 실험을 근본적으로 변화시킬 위험이 있기 때문입니다. 이러한 개체군이 수십 년 동안 적응해 온 환경의 미묘한 측면(예: 폭기량)은 마이크로플레이트 또는 연속 배양 시스템에서 변경될 것입니다. 각 전송의 개체군 병목 현상도 다를 수 있으며(예: 마이크로플레이트에서는 더 작음) 진화 역학을 변화시킬 수 있습니다. 요컨대, 여기에 설명된 방법에서 벗어나면 LTEE가 다른 실험이 되거나 최소한 진화 궤적을 방해하는 불연속성이 발생할 위험이 있습니다.
새로운 진화 실험을 설계하는 연구자들은 미생물 개체군을 전파하는 이러한 다른 방법을 고려하면서 잠재적인 이점과 단점을 인식해야 합니다. 마이크로웰 플레이트에서 개체군을 이동하기 위해 피펫팅 로봇을 사용하는 것은 어떤 면에서 논리적으로 더 간단하며 이러한 방식으로 전파될 수 있는 많은 수의 복제 개체군으로 인해 매우 강력하다는 것을 증명할 수 있습니다47,48,49. 그러나 대부분의 현재 설정에서 자동 이송은 완전히 멸균 상태에서 이루어지지 않으므로 외부 오염 가능성이 높아집니다. 오염을 방지하기 위해 성장 배지에는 종종 항생제가 보충되어 진화에 영향을 미치는 환경의 특징이됩니다. 마이크로웰 플레이트의 이송은 또한 교차 오염 사건이 발생하기 쉽습니다. 마지막으로, 마이크로웰 플레이트의 환경(특히 흔들리지 않는 경우)은 벽 성장, 응집 및 하나의 우물에 여러 틈새를 생성하여 진화를 복잡하게 만들 수 있는 기타 현상을 선택하는 경향이 있습니다. 작은 우물에서 개체군 크기를 크게 유지하기 위해 풍부한 배지 또는 고농도의 영양소를 사용하면 이러한 복잡성이 악화 될 수 있습니다. 이러한 상호 작용이 발생하면 체력 측정 및 해석이 훨씬 더 어려워 질 수 있습니다.
미생물 진화를 위한 연속 배양 시스템에는 신선한 배지를 지속적으로 펌핑하고 배양을 펌핑하는 케모스타트(chemostats)와 세포를 일정한 성장 상태로 유지하기 위해 자동 감지 및 펌핑을 통해 배양물을 주기적으로 희석하는 터비도스타트(turbidostats)가 포함됩니다. 이러한 시스템은 미생물 생리학과 진화를 모델링하고자 할 때 매우 유용한데, 그 이유는 미생물을 항상 영양소가 있는 환경에 유지함으로써 미생물이 성장과 기아 사이를 전환하는 것을 피하기 때문이다50. 광학 밀도, O2 소비, pH 및 문화 환경 및 성장의 기타 측면을 실시간으로 측정하는 센서를 추가할 수도 있습니다. 그러나, 현재의 연속식 배양 시스템은 맞춤형 셋업(51,52,53,54)을 구축하기 위해 고가의 장비 구매 또는 전문 지식을 필요로 한다. 또한 세포가 배양실에 달라붙어 희석을 피하는 벽 성장은 주기적으로 멸균되지 않는 한 연속 배양 시스템에서 진화적 역학을 저해합니다. 이러한 제약으로 인해, 현재까지 대부분의 케모스타트 및 터비도스타트 진화 실험은 제한된 기간 및/또는 연속 전달 진화 실험에 비해 상대적으로 적은 수의 독립적으로 진화하는 개체군을 포함했습니다.
결론
LTEE에 대해 여기에서 시연하는 방법은 고유한 역사적 기록을 연구하고 이러한 대장균 개체군의 개방형 진화를 계속하는 데 중요합니다. 또한 실험실 자동화를 활용하거나 LTEE에서 의도적으로 생략된 자연 환경에서 발견되는 복잡성의 다양한 요소를 다시 추가할 수 있는 새로운 진화 실험을 고려하는 다른 사람들에게 출발점을 제공합니다. 1988 년 이래로 실험적 진화는 한 분야로 번성했습니다. 이 기간 동안 전 세계 실험실의 연구자들은 진화를 연구하고 창의적인 실험 설계를 도입하고 새로운 기술을 사용하여 결과를 모니터링함으로써 혁신하는 이 접근 방식의 엄청난 유연성을 입증했습니다. LTEE의 방법은 종점을 나타내지는 않지만 앞으로도 계속해서 영감을 주고 이 분야의 기반을 제공하기를 바랍니다.
Disclosures
이해 상충이 선언되지 않았습니다.
Acknowledgements
리차드 렌스키(Richard Lenski)와 대장균(E. coli )에 대한 장기 진화 실험(Long-Term Evolution Experiment)을 연구하고 유지하는 데 기여한 많은 연구자들, 특히 니르자 하젤라(Neerja Hajela)에게 감사드립니다. LTEE는 현재 미국 국립과학재단(National Science Foundation, DEB-1951307)의 지원을 받고 있습니다.
Materials
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride (TTC) | Sigma-Aldrich | T8877 | |
| 20 mL Glass Beaker | Sigma-Aldrich | CLS100020 | |
| 50 mL Erlenmeyer Flasks | Sigma-Aldrich | CLS498050 | |
| Agar | Sigma-Aldrich | A1296 | |
| Ammonium Sulfate | Sigma-Aldrich | AX1385 | |
| Antifoam | Sigma-Aldrich | A5757 | |
| Arabinose | Sigma-Aldrich | A3256 | |
| Freezer Box (2") | VWR | 82007-142 | |
| Freezer Box (3") | VWR | 82007-144 | |
| Freezer Box Cell Divider (49-place) | VWR | 82007-150 | |
| Freezer Box Cell Divider (81-place) | VWR | 82007-154 | |
| Freezer Vials (1/2-Dram) | VWR | 66009-816 | |
| Freezer Vials (2-Dram) | VWR | 66010-560 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Glycerol | Fisher Scientific | G33 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Metal Tray | Winco | SPJP-202 | |
| Petri Dish | Fisher Scientific | FB0875712 | |
| Potassium Phosphate Dibasic Trihydrate | Sigma-Aldrich | P5504 | |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P5379 | |
| Sodium Chloride | Sigma-Aldrich | M7506 | |
| Sodium Citrate Tribasic Dihydrate | Sigma-Aldrich | C7254 | |
| Test Tube Cap (18mm) | VWR | 10200-142 | |
| Test Tube Rack (18mm, steel) | Adamas-Beta | N/A | Test Tube Racks Stainless Steel Grid Arrangement 72 Holes (17-19 mm) |
| Test Tubes (18 x 150 mm) | VWR | 47729-583 | |
| Thiamine, Hydrochloride | Millipore | 5871 | |
| Tryptone | Gibco | 211705 | |
| Yeast Extract | Gibco | 212750 |
References
- Lenski, R. E., Rose, M. R., Simpson, S. C., Tadler, S. C. Long-term experimental evolution in Escherichia coli. I. Adaptation and divergence during 2,000 generations. The American Naturalist. 138 (6), 1315-1341 (1991).
- Fox, J. W., Lenski, R. E. From here to eternity-the theory and practice of a really long experiment. PLoS Biology. 13 (6), e1002185 (2015).
- Daegelen, P., Studier, F. W., Lenski, R. E., Cure, S., Kim, J. F. Tracing ancestors and relatives of Escherichia coli B, and the derivation of B strains REL606 and BL21(DE3). Journal of Molecular Biology. 394 (4), 634-643 (2009).
- Studier, F. W., Daegelen, P., Lenski, R. E., Maslov, S., Kim, J. F. Understanding the differences between genome sequences of Escherichia coli B strains REL606 and BL21(DE3) and comparison of the E. coli B and K-12 genomes. Journal of Molecular Biology. 394 (4), 653-680 (2009).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nature Reviews Genetics. 14 (12), 827-839 (2013).
- Lenski, R. E. Experimental studies of pleiotropy and epistasis in Escherichia coli. II. Compensation for maladaptive pleiotropic effects associated with resistance to virus T4. Evolution. 42 (3), 425-432 (1988).
- Calcott, P. H., Gargett, A. M. Mutagenicity of freezing and thawing. FEMS Microbiology Letters. 10 (2), 151-155 (1981).
- Lenski, R. E., Travisano, M. Dynamics of adaptation and diversification: a 10,000-generation experiment with bacterial populations. Proceedings of the National Academy of Sciences of the United States of America. 91 (15), 6808-6814 (1994).
- Wiser, M. J., Ribeck, N., Lenski, R. E. Long-term dynamics of adaptation in asexual populations. Science. 342 (6164), 1364-1367 (2013).
- Lenski, R. E., et al. Sustained fitness gains and variability in fitness trajectories in the long-term evolution experiment with Escherichia coli. Proceedings of the Royal Society B: Biological Sciences. 282 (1821), 20152292 (2015).
- Barrick, J. E., et al. Genome evolution and adaptation in a long-term experiment with Escherichia coli. Nature. 461 (7268), 1243-1247 (2009).
- Blount, Z. D., Barrick, J. E., Davidson, C. J., Lenski, R. E. Genomic analysis of a key innovation in an experimental Escherichia coli population. Nature. 489 (7417), 513-518 (2012).
- Tenaillon, O., et al. Tempo and mode of genome evolution in a 50,000-generation experiment. Nature. 536 (7615), 165-170 (2016).
- Good, B. H., McDonald, M. J., Barrick, J. E., Lenski, R. E., Desai, M. M. The dynamics of molecular evolution over 60,000 generations. Nature. 551 (7678), 45-50 (2017).
- Consuegra, J., et al. Insertion-sequence-mediated mutations both promote and constrain evolvability during a long-term experiment with bacteria. Nature Communications. 12 (1), 980-980 (2021).
- Cooper, T. F., Rozen, D. E., Lenski, R. E. Parallel changes in gene expression after 20,000 generations of evolution in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 100 (3), 1072-1077 (2003).
- Favate, J. S., Liang, S., Cope, A. L., Yadavalli, S. S., Shah, P. The landscape of transcriptional and translational changes over 22 years of bacterial adaptation. eLife. 11, e81979 (2022).
- Khan, A. I., Dinh, D. M., Schneider, D., Lenski, R. E., Cooper, T. F. Negative epistasis between beneficial mutations in an evolving bacterial population. Science. 332 (6034), 1193-1196 (2011).
- Plucain, J., et al. Epistasis and allele specificity in the emergence of a stable polymorphism in Escherichia coli. Science. 343 (6177), 1366-1369 (2014).
- Quandt, E. M., Deatherage, D. E., Ellington, A. D., Georgiou, G., Barrick, J. E. Recursive genomewide recombination and sequencing reveals a key refinement step in the evolution of a metabolic innovation in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 111 (6), 2217-2222 (2014).
- Leon, D., D'Alton, S., Quandt, E. M., Barrick, J. E. Innovation in an E. coli evolution experiment is contingent on maintaining adaptive potential until competition subsides. PLoS Genetics. 14 (4), e1007348 (2018).
- Bennett, A. F., Lenski, R. E., Mittler, J. E. Evolutionary adaptation to temperature. I. Fitness responses of Escherichia coli to changes in its thermal environment. Evolution. 46 (1), 16-30 (1992).
- Kibota, T. T., Lynch, M. Estimate of the genomic mutation rate deleterious to overall fitness in E. coli. Nature. 381 (6584), 694-696 (1996).
- Friesen, M. L., Saxer, G., Travisano, M., Doebeli, M. Experimental evidence for sympatric ecological diversification due to frequency-dependent competition in Escherichia coli. Evolution. 58 (2), 245-260 (2004).
- Cooper, T. F. Recombination speeds adaptation by reducing competition between beneficial mutations in populations of Escherichia coli. PLoS Biology. 5 (9), e225 (2007).
- Cooper, T. F., Lenski, R. E. Experimental evolution with E. coli in diverse resource environments. I. Fluctuating environments promote divergence of replicate populations. BMC Evolutionary Biology. 10, 11 (2010).
- Quan, S., et al. Adaptive evolution of the lactose utilization network in experimentally evolved populations of Escherichia coli. PLoS Genetics. 8 (1), e1002444 (2012).
- Deatherage, D. E., Kepner, J. L., Bennett, A. F., Lenski, R. E., Barrick, J. E. Specificity of genome evolution in experimental populations of Escherichia coli evolved at different temperatures. Proceedings of the National Academy of Sciences of the United States of America. 114 (10), E1904-E1912 (2017).
- Izutsu, M., Lake, D. M., Matson, Z. W. D., Dodson, J. P., Lenski, R. E. Effects of periodic bottlenecks on the dynamics of adaptive evolution in microbial populations. BioRixv. , 4457 (2021).
- Chavarria-Palma, J. E., Blount, Z. D., Barrick, J. E. . LTEE Media Recipes. , (2022).
- Barrick, J. E., Lake, D. M. fitnessR: fitnessR-v1.0.0. barricklab. , (2023).
- Blount, Z. D., Borland, C. Z., Lenski, R. E. Historical contingency and the evolution of a key innovation in an experimental population of Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 105 (23), 7899-7906 (2008).
- Grant, N. A., Magid, A. A., Franklin, J., Dufour, Y., Lenski, R. E. Changes in cell size and shape during 50,000 generations of experimental evolution with Escherichia coli. Journal of Bacteriology. 203 (10), 22 (2021).
- Wickham, H. . ggplot2: Elegant Graphics for Data Analysis. , (2016).
- Meyer, J. R., et al. Parallel changes in host resistance to viral infection during 45,000 generations of relaxed selection. Evolution. 64 (10), 3024-3034 (2010).
- Woods, R., Schneider, D., Winkworth, C. L., Riley, M. A., Lenski, R. E. Tests of parallel molecular evolution in a long-term experiment with Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 103 (24), 9107-9712 (2006).
- . LTEE-Ecoli: genomics resources for the Long-Term Evolution Experiment with Escherichia coli Available from: https://github.com/barricklab/LTEE-Ecoli (2022)
- Izutsu, M., Lenski, R. E. Experimental test of the contributions of initial variation and new mutations to adaptive evolution in a novel environment. Frontiers in Ecology and Evolution. 10, 958406 (2022).
- Wiser, M. J., Lenski, R. E. A comparison of methods to measure fitness in Escherichia coli. PLoS One. 10 (5), 0126210 (2015).
- de Visser, J. A. G. M., Lenski, R. E. Long-term experimental evolution in Escherichia coli. XI. Rejection of non-transitive interactions as cause of declining rate of adaptation. BMC Evolutionary Biology. 2 (1), 19 (2002).
- Paquin, C. E., Adams, J. Relative fitness can decrease in evolving asexual populations of S. cerevisiae. Nature. 306 (5941), 368-371 (1983).
- Rozen, D. E., Lenski, R. E. Long-Term Experimental Evolution in Escherichia coli. VIII. Dynamics of a balanced polymorphism. The American Naturalist. 155 (1), 24-35 (2000).
- Quandt, E. M., Gollihar, J., Blount, Z. D., Ellington, A. D., Georgiou, G., Barrick, J. E. Fine-tuning citrate synthase flux potentiates and refines metabolic innovation in the Lenski evolution experiment. eLife. 4, e09696 (2015).
- Chubiz, L. M., Lee, M. -. C., Delaney, N. F., Marx, C. J. FREQ-Seq: a rapid, cost-effective, sequencing-based method to determine allele frequencies directly from mixed populations. PLoS One. 7 (10), e47959 (2012).
- Gallet, R., Cooper, T. F., Elena, S. F., Lenormand, T. Measuring selection coefficients below 10-3: method, questions, and prospects. Genetics. 190 (1), 175-186 (2012).
- Levy, S. F., et al. Quantitative evolutionary dynamics using high-resolution lineage tracking. Nature. 519 (7542), 181-186 (2015).
- Lang, G. I., Botstein, D., Desai, M. M. Genetic variation and the fate of beneficial mutations in asexual populations. Genetics. 188 (3), 647-661 (2011).
- Frenkel, E. M., et al. Crowded growth leads to the spontaneous evolution of semistable coexistence in laboratory yeast populations. Proceedings of the National Academy of Sciences. 112 (36), 11306-11311 (2015).
- Jordt, H., et al. Coevolution of host-plasmid pairs facilitates the emergence of novel multidrug resistance. Nature Ecology and Evolution. 4 (6), 863-869 (2020).
- Gresham, D., Dunham, M. J. The enduring utility of continuous culturing in experimental evolution. Genomics. 104 (6), 399-405 (2014).
- Miller, A. W., Befort, C., Kerr, E. O., Dunham, M. J. Design and use of multiplexed chemostat arrays). Journal of Visualized Experiments. (72), e50262 (2013).
- Toprak, E., et al. Building a morbidostat: an automated continuous-culture device for studying bacterial drug resistance under dynamically sustained drug inhibition. Nature Protocols. 8 (3), 555-567 (2013).
- Wong, B. G., Mancuso, C. P., Kiriakov, S., Bashor, C. J., Khalil, A. S. Precise, automated control of conditions for high-throughput growth of yeast and bacteria with eVOLVER. Nature Biotechnology. 36 (7), 614-623 (2018).
- Ekkers, D. M., Branco Dos Santos, F., Mallon, C. A., Bruggeman, F., Van Doorn, G. S. The omnistat: A flexible continuous-culture system for prolonged experimental evolution. Methods in Ecology and Evolution. 11 (8), 932-942 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved