Geração e Manipulação de Organoides Intestinais em Rato
* These authors contributed equally
In This Article
Summary
Aqui, apresentamos um protocolo para gerar organoides intestinais de ratos e usá-los em várias aplicações a jusante. Os ratos são frequentemente um modelo pré-clínico preferido, e o robusto sistema organoide intestinal preenche a necessidade de um sistema in vitro para acompanhar os estudos in vivo .
Abstract
Ao usar organoides para avaliar a fisiologia e as decisões de destino celular, é importante usar um modelo que recapitule de perto os contextos in vivo . Assim, organoides derivados do paciente são usados para modelagem de doenças, descoberta de drogas e triagem de tratamento personalizada. Organoides intestinais de camundongos são comumente utilizados para entender aspectos da função/fisiologia intestinal e decisões dinâmicas/destino de células-tronco. No entanto, em muitos contextos de doenças, os ratos são frequentemente preferidos em relação aos camundongos como modelo devido à sua maior semelhança fisiológica com os humanos em termos de fisiopatologia da doença. O modelo de rato tem sido limitado pela falta de ferramentas genéticas disponíveis in vivo, e organoides intestinais de ratos têm se mostrado frágeis e difíceis de cultivar a longo prazo. Aqui, nós nos baseamos em protocolos publicados anteriormente para gerar organoides intestinais robustos de ratos a partir do duodeno e jejuno. Fornecemos uma visão geral de várias aplicações a jusante utilizando organoides intestinais de ratos, incluindo ensaios funcionais de inchamento, coloração de montagem inteira, geração de monocamadas enteróides 2D e transdução lentiviral. O modelo organoide de rato fornece uma solução prática para a necessidade do campo para um modelo in vitro que mantenha relevância fisiológica para humanos, possa ser rapidamente manipulado geneticamente e seja facilmente obtido sem as barreiras envolvidas na aquisição de organoides intestinais humanos.
Introduction
A arquitetura epitelial e a composição celular do intestino delgado humano são complexas, refletindo suas funções fisiológicas. O principal papel do intestino delgado é absorver os nutrientes dos alimentos que passam pelo seu lúmen1. Para maximizar essa função, a superfície intestinal é organizada em saliências semelhantes a dedos chamadas vilosidades, que aumentam a área de superfície absortiva, e invaginações semelhantes a taças chamadas criptas, que abrigam e isolam as células-tronco. Dentro do epitélio, vários tipos de células especializadas absortivas e secretoras são geradas para desempenhar funçõesdistintas1. Devido a essa complexidade, tem sido difícil modelar tecidos como o intestino em linhagens celulares imortalizadas transformadas em alta passagem. No entanto, o estudo de células-tronco, especialmente células-tronco adultas e seus mecanismos de diferenciação, tem permitido o desenvolvimento de culturas de organoides intestinais 3D. O uso de modelos organoides tem transformado o campo, em parte devido à recapitulação de alguns componentes arquitetônicos e à heterogeneidade do tipo celular encontrada no intestino intacto. Organoides intestinais podem ser cultivados in vitro a longo prazo devido à manutenção da população ativa de células-tronco2.
Os organoides intestinais tornaram-se rapidamente um modelo adaptável para estudar a biologia de células-tronco, fisiologia celular, doenças genéticas e nutrição3,4, bem como uma ferramenta para desenvolver novos métodos de liberação de fármacos5. Além disso, organoides derivados do paciente estão sendo utilizados para modelagem de doenças, descoberta de fármacos, triagem personalizada de tratamentos,entre outros6,7,8,9. No entanto, organoides intestinais humanos ainda apresentam desafios. A disponibilidade de tecidos, os requisitos para aprovação do Comitê de Revisão Institucional e questões éticas limitam o uso generalizado de amostras humanas. Adicionalmente, organoides intestinais humanos gerados a partir de criptas intestinais requerem duas condições distintas de cultivo para a manutenção de células-tronco indiferenciadas ou para induzir a diferenciação de tipos celulares maduros10. Isso contrasta com o in vivo, onde células-tronco e tipos de células maduras diferenciadas estão presentes simultaneamente e continuamente geradas/mantidas1. Por outro lado, organoides intestinais de camundongos, que são cultivados em um coquetel menos complexo de fatores de crescimento, não requerem essa troca na composição do meio e podem manter células-tronco e células diferenciadas no mesmo contexto de mídia 2,11. No entanto, as principais diferenças no intestino de camundongos quando comparado aos humanos podem tornar os organoides de camundongos um modelo subótimo em muitos casos. Em geral, muitos organoides intestinais de mamíferos maiores, incluindo cavalos, porcos, ovelhas, vacas, cães e gatos, foram gerados com sucesso em condições de cultura mais alinhadas com organoides intestinais de camundongos do que as condições de cultura de organoides intestinais humanos12. As diferenças nas condições dos fatores de crescimento entre organoides humanos e de camundongos provavelmente refletem diferenças na composição do nicho de células-tronco e diferentes requisitos para sobrevivência, proliferação e manutenção de células-tronco. Portanto, há necessidade de um sistema organoide modelo de fácil acesso que 1) se assemelhe muito à composição celular intestinal humana, 2) contenha células-tronco com requisitos de fator de crescimento como os organoides intestinais humanos e 3) seja capaz de manter continuamente compartimentos indiferenciados e diferenciados. Idealmente, o sistema seria a partir de um modelo animal pré-clínico comumente usado, de modo que experimentos in vivo e in vitro possam ser correlacionados e usados em conjunto.
O rato é um modelo pré-clínico comumente utilizado para estudos de fisiologia e farmacologia intestinal devido à sua fisiologia e bioquímica intestinal muito semelhantes às dos seres humanos13, particularmente no que diz respeito à permeabilidade intestinal14. Seu tamanho relativamente maior em comparação com os camundongos os torna mais suscetíveis a procedimentos cirúrgicos. Enquanto modelos animais de grande porte, incluindo porcos, às vezes são usados, os ratos são um modelo mais acessível, requerem menos espaço para criação e têm linhagens padrão prontamente disponíveis comercialmente15. Uma desvantagem do uso de modelos de ratos é que o kit de ferramentas genéticos para estudos in vivo não está bem desenvolvido em comparação com camundongos, e a geração de novas linhagens de ratos, incluindo knockouts, knock-ins e transgênicos, é muitas vezes de custo proibitivo. O desenvolvimento e a otimização de um modelo organoide intestinal robusto de ratos permitiria a manipulação genética, tratamentos farmacológicos e estudos de maior rendimento em um modelo acessível que mantém a relevância fisiológica chave para humanos. No entanto, as vantagens de um modelo organoide de roedor em relação a outro é altamente dependente do processo ou gene em estudo; Certos genes encontrados em humanos podem ser pseudogenes em camundongos, mas não em ratos16,17. Além disso, subtipos celulares espécie-específicos estão sendo cada vez mais revelados pelo RNAseq unicelular18,19,20. Finalmente, modelos de doenças intestinais de ratos e camundongos frequentemente exibem variações consideráveis nos fenótipos21,22, de modo que o modelo que mais recapitula os sintomas e o processo de doença observados em humanos deve ser selecionado para o trabalho a jusante. A geração de um modelo organoide intestinal de rato fornece flexibilidade e escolha adicionais para os pesquisadores na seleção de um sistema modelo mais apropriado para suas circunstâncias. Aqui, os protocolosexistentes23,24 são expandidos para a geração de organoides intestinais de ratos e um protocolo é delineado para a geração e manutenção de organoides intestinais de ratos a partir do duodeno ou jejuno. Além disso, várias aplicações a jusante, incluindo infecção lentiviral, coloração de montagem inteira, e ensaios de inchaço de forskolin, são descritos.
Protocol
NOTA: Toda a cultura de células deve ser manuseada usando técnica asséptica adequada em uma capela de cultura de tecidos. Todos os trabalhos com animais neste estudo foram aprovados pelo Institutional Animal Care and Use Committee (IACUC) de Yale.
1. Preparação de reagentes para cultura celular
- Prepare o meio R-spondin 1 condicionado seguindo as instruções do fabricante. Prepare a mídia condicionada Wnt3a seguindo as instruções do fabricante. Prepare o AdDMEM+ conforme descrito na Tabela 1.
- Ressuspender gastrina em dH2O estéril para preparar um estoque de 100 μM. Alíquota e armazenar a -80 °C. Ressuspender N-acetilcisteína em água estéril para preparar um estoque de 100 mM. Alíquota e armazenar a -20 °C por até 1 mês.
- Ressuspender Noggin humano recombinante em solução salina tamponada com fosfato (PBS) + albumina de soro bovino (BSA) a 0,1% para preparar um estoque de 250 μg/mL. Alíquota e armazenar a -80 °C. Ressuspender o fator de crescimento epidérmico (EGF) recombinante de camundongos em PBS + BSA 0,1% para preparar um estoque de 100 μg/mL. Alíquota e armazenar a -80 °C.
- Diluir o IGF-1 humano recombinante em PBS + BSA 0,1% para preparar um estoque de 100 μg/mL. Alíquota e armazenar a -80 °C. Ressuspender FGF-2 humano recombinante em Tris 5 mM, pH 7,6, para preparar um estoque de 100 μg/mL. Alíquota e armazenar a -80 °C.
NOTA: Para todos os fatores de crescimento, utilizar uma diluição intermediária em PBS + 0,1% BSA até 100x a concentração final no meio de cultura. Conservar a -20 °C.
2. Estabelecimento de organoides do intestino delgado de ratos
OBS: Este protocolo foi modificado a partir de dois protocolos previamente publicados para organoides intestinais deratos23,24.
- Preparar meios organoides intestinais de rato (rIOM) de acordo com a Tabela 2 e colocar banho-maria a 37 °C. Este meio completo é estável por 5 dias a 4 °C.
- Preparar 10 mL de ácido etilenodiaminotetracético (EDTA) 3 mM em PBS em um tubo cônico de 15 mL e manter no gelo. Descongelar 250 μL de extrato de matriz extracelular (EME) sobre gelo.
- Jejue um rato durante a noite com acesso à água ad libitum. Eutanasiar o rato de acordo com o protocolo aprovado pela IACUC. Neste protocolo, ratos machos adultos da raça Sprague Dawley (pesando ~200 g) foram eutanasiados via inalação de CO2 (Tabela de Materiais). O deslocamento cervical foi utilizado como método secundário de eutanásia.
- Utilizar pinça autoclavada estéril e tesoura de dissecção para dissecção. Coloque o rato eutanasiado na superfície de dissecção ventral para cima. Aperte a camada da pele com pinças; Os cortes a seguir devem ser feitos no nível da superfície, para que eles estejam apenas cortando essa camada da pele e não profundamente o suficiente para danificar os órgãos internos.
- Para abrir a cavidade abdominal, usando uma tesoura de dissecção grande e afiada, corte a camada da pele em um corte grande, longitudinal, ao nível da superfície no centro do abdômen. Em seguida, a partir desse corte, faça dois cortes horizontais mais curtos, um de cada lado. Use pinças para descascar a pele para expor a cavidade abdominal. Corte através da membrana peritoneal para expor totalmente os órgãos internos na cavidade abdominal com pronto acesso ao intestino.
- Com tesoura e pinça, localize o estômago e identifique o duodeno aproximadamente 2-3 cm distal a ele, que aparece como um segmento amarelado. O jejuno proximal está localizado aproximadamente 4-5 cm distal ao ligamento de Treitz, que serve como um ponto de referência entre o duodeno e o jejuno.
- Coloque o fragmento intestinal isolado em uma placa de Petri de 10 cm. Limpe o segmento intestinal desejado do mesentério tanto quanto possível. Lave com 10 mL de PBS gelado até limpar o conteúdo luminal. Em um papel toalha, corte o segmento intestinal em pedaços de ~2 cm de comprimento. Abra cada peça intestinal longitudinalmente para expor o epitélio.
- Usando uma lâmina de microscópio de vidro, raspe a superfície luminal exposta para remover as vilosidades. Coloque pedaços intestinais na solução preparada de EDTA no gelo. Gire a 4 °C por 30 min em um revólver de tubo regulado para 10 rpm.
- No microscópio de dissecação, despeje o conteúdo do tubo cônico em uma placa de Petri de 10 cm. Adicione mais ~5 mL de PBS gelado.
- Usando pinças finas, segure um segmento intestinal e agite vigorosamente. Será possível ver a liberação do epitélio para o PBS. A princípio, o PBS conterá principalmente vilosidades.
- Continue a agitar. Descarte periodicamente o PBS contendo vilosidades e adicione 10 mL de PBS fresco gelado aos fragmentos intestinais. Continue a agitar os fragmentos e repita essa etapa de lavagem até que as vilosidades não sejam mais liberadas no PBS, mas em vez disso, o PBS contém principalmente criptas. Não exceda 15 min para isolamento de criptas, para que a viabilidade celular não seja comprometida.
- Descarte os fragmentos intestinais restantes. Enriqueça o PBS restante na placa de Petri para criptas intestinais. Em uma capa de cultura de tecidos, coletar as criptas contendo PBS e filtrar através de um filtro de células de 70 μm (Tabela de Materiais).
- Centrifugar a 250 x g por 5 min. Retire o sobrenadante e ressuspenda o pellet em 5 mL de AdDMEM+. Centrifugar novamente a 250 x g por 5 min.
OBS: Recomenda-se o uso de centrífuga com rotor de caçamba oscilante. - Retire o sobrenadante, deixando ~50 μL de meio com o pellet. Ressuspenda a pelota na mídia restante e adicione à alíquota do EME no gelo. Pipete suavemente para cima e para baixo para suspender as criptas uniformemente em todo o EME. Evite introduzir bolhas.
- Placa de 50 μL de cúpulas EME em uma placa de cultura de tecidos de 35 mm e incubar por 20 min em uma incubadora de cultura de tecidos a 37 °C e 5% CO2 .
- Adicionar 2 mL de rIOM (Tabela 2) contendo 10 μM Y27632 e 10 μM CHIR99021 (Tabela 3). Após a passagem, Y27632 e CHIR99021 podem ser descontinuados.
- Troque o rIOM a cada 2-3 dias. Passagem conforme necessário, geralmente entre 3-7 dias, dependendo do número inicial de organoides, tamanho e taxa de crescimento.
3. Organoides intestinais de ratos que passam
- Descongelar uma alíquota de 250 μL de EME no gelo e pré-aquecer o rIOM a 37 °C.
- Aspirar o meio de uma placa de 35 mm contendo organoides e adicionar 1 mL de reagente de dissociação para liberar imediatamente os organoides das cúpulas EME.
- Transferir imediatamente o reagente de dissociação com organoides fragmentados para um tubo cônico de 15 mL. Lavar a placa de cultura com 2 mL de AdDMEM+ e adicionar ao tubo cônico de 15 mL contendo organoides fragmentados.
- Com uma pipeta de vidro Pasteur, pipetar suavemente para cima e para baixo 15-20 vezes para fragmentar os organoides. Centrifugar a 350 x g por 2 min.
- Adicione ~50 μL de solução do fundo do tubo cónico para o EME. Pipetar suavemente para cima e para baixo para misturar. Evite fazer bolhas.
- Placa de 50 μL de cúpulas EME em uma placa de 35 mm e incubar por 20 min em uma incubadora de cultura de tecidos a 37 °C e 5% CO2 .
- Adicionar 2 mL de rIOM com 10 μM Y27632 e 10 μM CHIR99021. Troque a mídia de crescimento a cada 2-3 dias. Ao alterar a mídia, Y27632 e CHIR99021 podem ser omitidos.
4. Criopreservação e descongelamento de organoides intestinais de ratos
- Criopreservação de organoides intestinais de ratos
NOTA: O protocolo de criopreservação foi modificado de um protocolo anterior para organoides humanos e de camundongos25. Antes do congelamento, os organoides devem ter pelo menos duas passagens em cultura primária. É aconselhável cultivar organoides até o ponto de grandes esferoides ou organoides ligeiramente brotados antes da criopreservação, pois isso resultará em um maior rendimento de organoides viáveis após o descongelamento. Isso pode ser feito aumentando-se o meio condicionado com R-espondina para 15% e/ou adicionando-se 10 mM de nicotinamida (Tabela 3) à cultura organoide.- Usando um microscópio, conte o número de organoides na placa de 35 mm. Rotule os crióvios de tal forma que 200 organoides serão aliquotados em cada criovial.
- Retire o rIOM da placa de 35 mm. Substitua por 2 mL de PBS grau de cultura de tecido frio.
- Usando uma ponta P1000, solte as cúpulas EME da parte inferior do prato de cultura para o PBS pipetando para cima e para baixo. Continue a pipetar para cima e para baixo ~20 vezes para quebrar o EME e liberar os organoides. Coletar os organoides e PBS em um tubo cônico de 15 mL.
- Adicione 2 mL de PBS frio à placa de cultura e pipete para cima e para baixo para liberar os organoides restantes no PBS. Transferir o PBS para o tubo cônico de 15 mL.
- Pellet os organoides por centrifugação a 290 x g por 5 min. Retire e descarte o sobrenadante sem interromper a pastilha organoide.
- Lave o pellet ressuspendendo suavemente em 5 mL de AdDMEM+ frio. Centrifugar a 200 x g por 4 min. Retire e descarte cuidadosamente o sobrenadante.
- Ressuspender o pellet organoide em 1 mL de meio de congelação a frio por 200 organoides. Alíquota 1 mL de organoides em meio congelante por criovial marcado. Coloque os criósicos num recipiente de congelação.
- Armazenar os organoides num recipiente de congelação a -80 °C durante 24 h e, em seguida, transferir os frascos para azoto líquido para armazenamento a longo prazo.
- Descongelamento de organoides intestinais de ratos
OBS: Este protocolo foi modificado de um protocolo anterior para descongelamento de organoides intestinais humanos e de camundongos26.- Descongelar uma alíquota de 250 μL de EME no gelo. Preparar rIOM suplementado com meio condicionado com 15% de R-spondin, 10 μM Y27632 e 10 μM CHIR99021. Quente a 37 °C.
- Adicionar 2 mL de meio de descongelamento (Tabela 3) a um tubo cônico de 15 mL à temperatura ambiente.
- Recupere e descongele um frasco para injetáveis de organoides a partir de azoto líquido, colocando o frasco para injetáveis num banho-maria a 37 °C até que o frasco para injetáveis esteja quase completamente descongelado.
- Adicionar 1 ml de meio de descongelamento ao frasco para injetáveis e transferir todo o conteúdo para o tubo cónico que contém o meio de descongelamento. Lave o frasco para injetáveis duas vezes com 1 ml de meio de descongelamento e transfira para o tubo cónico.
- Centrifugar a 200 x g por 5 min. Aspirar o meio, deixando ~50 μL de meio com os organoides. Transferir o meio contendo organoides para 250 μL de EME.
- Distribua uniformemente os organoides através do EME, pipetando para cima e para baixo, evitando bolhas. Pipetar seis cúpulas de 50 μL em uma placa de cultura de tecidos de 35 mm.
- Incubar na incubadora de cultura de tecidos por 15-20 min para permitir que o EME se polimerize. Adicionar 2 mL do rIOM preparado ao prato.
- Após 2 dias, substitua a mídia por rIOM. O uso de Y27632 e CHIR99021 pode ser suspenso. O crescimento organoide pode ser lento na primeira passagem após o descongelamento. É aconselhável passar os organoides duas vezes após o descongelamento antes de iniciar os experimentos.
5. Geração de monocamadas 2D intestinais de ratos a partir de organoides 3D
NOTA: O protocolo a seguir descreve os volumes necessários para gerar 24 poços de uma placa de 48 poços revestida com EME, começando com seis cúpulas de 50 μL (prato de 35 mm) contendo ~300 organoides intestinais/cúpula (escala: uma cúpula gera quatro poços), mas pode ser ampliada para cima ou para baixo conforme necessário. Como escrito, este protocolo atinge ~80% de confluência em 4-5 dias. Em maior confluência, as células começam a adquirir estruturas organoides 3D novamente. Em baixa confluência (≤40%), as células permanecem como monocamadas e são viáveis por ~14 dias. Se o objetivo do estudo é usar monocamadas 2D, reduza a escala para que uma cúpula gere oito poços de uma placa de 24 poços. Os poços também podem ser revestidos com colágeno I para formar monocamadas.
- Preparação de superfícies revestidas
- Para revestir a placa com EME, diluir EME 1:20 em AdDMEM+ frio (Tabela 1). Para revestimento com colágeno, prepare o colágeno I de acordo com as instruções do fabricante. Diluir 5 mg/mL de colágeno I em AdDMEM+ para 100 μg/mL (1:50 neste caso).
- Revestir a placa com 200 μL de EME diluído ou colágeno para cobrir totalmente a superfície do poço. Incubar durante 1-2 h a 37 °C numa incubadora de cultura de tecidos. Preparar meio organoide intestinal de rato para cultura de monocamada 2D (rIOM2D) conforme Tabela 4.
- Geração de monocamadas
- Aspirar o meio de uma placa de 35 mm contendo organoides. Adicionar 1 mL de PBS.
- Interrompa o EME nos poços riscando com uma ponta P1000. Pipetar para cima e para baixo aproximadamente 20 vezes para soltar todo o EME. Transfira tudo para um tubo cônico de 15 mL.
- Adicionar 1 mL de PBS à placa de 35 mm para recuperar quaisquer organoides adicionais e transferir para o mesmo tubo cônico de 15 mL.
- Centrifugar a 350 x g por 2 min e aspirar o sobrenadante, incluindo o resíduo EME. Adicionar 1 ml de solução de tripsina ao pellet organoide e incubar a 37 °C durante 2 min.
- Pipetar para cima e para baixo 10 vezes usando uma ponta P1000 e adicionar 2 mL de AdDMEM+ para neutralizar a tripsina.
- Centrifugar a 350 x g por 5 min. Aspirar o sobrenadante e adicionar 4,8 mL de rIOM2D (Tabela 4). Ressuspenda a pastilha de célula.
- Antes de colocar os organoides, retire qualquer excesso de EME ou colágeno em AdDMEM+ dos poços. Em seguida, adicione 200 μL de organoides em rIOM2D e 10 μM Y27632 a cada poço pré-revestido.
- Após 4-16 h, coletar o meio e centrifugar a 1.000 x g por 1 min. Transfira o sobrenadante para um novo tubo cônico de 15 mL e descarte o pellet.
- Lave cada poço com 300 μL de PBS e adicione 200 μL do rIOM2D centrifugado a cada poço. Troque o rIOM2D a cada 2-3 dias, suspendendo o uso do Y27632.
- Reforma de organoides 3D a partir de monocamadas 2D
NOTA: As monocamadas cultivadas em EME podem ser induzidas a reformar organoides 3D, enquanto as monocamadas cultivadas em colágeno I não retornam eficientemente aos organoides 3D. Normalmente, 2-3 poços de organoides gerados a partir de monocamadas podem ser usados para fazer uma cúpula de 50 μL de EME no dia 5.- Diluir o EME 1:4 em rIOM2D. Quando as monocamadas atingirem ~80% de confluência, aspirar cuidadosamente o meio e adicionar 100 μL de EME diluído aos poços contendo monocamadas.
- Incubar a 37 °C, 5% CO2 em estufa de cultura de tecidos por 20 min. Em seguida, adicionar 100 μL de rIOM2D e retornar à incubadora de cultura de tecidos. Os organoides 3D serão gerados dentro de 5 dias após a adição de EME diluído.
- Depois que pequenos organoides tiverem se reformado (~dia 5), prepare rIOM. Coletar todo o conteúdo do poço, pipetando para cima e para baixo para interromper o EME, e transferir para um tubo cônico de 15 mL.
- Centrifugar a 350 x g por 2 min. Aspirar o sobrenadante e o resíduo EME.
- Adicionar 1 mL de AdDMEM+ gelado e centrifugar a 350 x g por 2 min. Retire o sobrenadante, deixando ~50 μL de mídia.
- Transfira os 50 μL do meio e organoides para uma alíquota EME de 250 μL. Pipetar para cima e para baixo para distribuir os organoides por toda a EME.
- Pipetar 50 μL de cúpulas EME em uma placa de 35 mm e incubar por 20 min em uma incubadora de cultura de tecidos.
- Adicionar 2 mL de rIOM mais 10 μM Y27632. Troque a mídia de crescimento a cada 2-3 dias. Ao alterar a mídia, Y27632 pode ser omitido.
6. Manipulação genética
- Transfecção transitória de monocamadas 2D
CUIDADO: Preparar monocamadas epiteliais intestinais de rato após a secção 5.1 numa placa de 48 poços. A transfecção deve ser realizada com 70%-80% de confluência. Substitua sempre o meio nos poços por 200 μL de rIOM2D fresco antes de transfectar. Calcular as razões de absorbância de 260/280 nm e 260/230 nm do DNA plasmidial; estes devem estar acima de 1,8 para garantir bons resultados de transfecção.
NOTA: Use um controle de plasmídeo para calcular a eficiência da transfecção. Um plasmídeo que codifica uma proteína fluorescente é recomendado para facilitar a atividade. Nesse protocolo, foi utilizado o pLJM1-EGFP27 .- Preparar 1 mg/mL de polietilenimina 20 kDa (PEI; Tabela 3). Para cada poço, preparar o tubo A (0,6 μg de plasmídeo + 50 μL de meio de soro reduzido) e o tubo B (1,8 μL de PEI + 50 μL de meio de soro reduzido). Manter uma relação DNA:PEI de 1:3.
- Vórtice ambos os tubos por 30 s. Combine o tubo A e o tubo B, e volte a usar vórtice por 30 s. Se necessário, use uma centrífuga para girar para baixo. Incubar durante 20 minutos à temperatura ambiente.
- Adicione suavemente o complexo DNA/PEI drop-wise à monocamada 2D. Gire suavemente o prato para misturar. Incubar a 37 °C, 5% CO2. A expressão geralmente pode ser detectada após 24 h.
NOTA: Se for necessário retornar às estruturas organoides 3D, aguarde 48 h após a transfecção para adicionar EME diluído.
- Transdução lentiviral de organoides intestinais de ratos
OBS: Antes de trabalhar com lentivírus, obtenha a devida autorização e treinamento especializado da instituição. Use sempre equipamentos de proteção individual (EPIs) apropriados ao manusear lentivírus. Embora não seja descrito aqui, lentivírus concentrado de alta qualidade é essencial para a infecção bem-sucedida de organoides. Este protocolo utilizou vetor pLJM1-EGFP vazio27 para expressar GFP solúvel. Este protocolo é modificado a partir de um protocolo publicado anteriormente28. A eficiência da transdução depende da qualidade e concentração das partículas virais, da dissociação eficiente dos organoides em pequenos aglomerados celulares e do gene que está sendo expresso. Quando calculada 5 dias após a infecção, a eficiência média da transdução antes da seleção foi de 19,4% (± desvio padrão de 6,5%).- Aos 2 dias antes da infecção lentiviral, planeje a passagem (seção 3) de dois poços densos de uma placa de 24 poços para cada lentivírus que será transduzido. Cada poço de uma placa de 24 poços pode acomodar uma cúpula de 50 μL de EME.
- Uma vez solidificado o EME, adicionar 0,5 mL de rIOM suplementado com 10 mM de nicotinamida, 10 μM Y27632 e 2,5 μM CHIR99021. Isso induz grandes morfologias esferoides, o que é favorável para a eficiência da transdução lentiviral. Dentro de 2 dias após o plaqueamento, os organoides de rato devem ser grandes esferoides. Se for observada diferenciação significativa (isto é, brotamento), repasse os organoides.
- Descongelar o vírus concentrado no gelo. Preparar novos meios de transdução, conforme Tabela 3.
- Usando uma ponta P1000, solte as cúpulas EME da parte inferior do prato de cultura celular para a mídia pipetando para cima e para baixo. Continue a pipetar para cima e para baixo 20 vezes para quebrar o EME e liberar os organoides.
- Pipetar os organoides e meios para um tubo cônico de 15 mL. Todos os poços podem ser agrupados, desde que os organoides tenham o mesmo genótipo e sejam da mesma linhagem.
- Lave cada poço duas vezes com 1 mL de AdDMEM+ frio. Coletar o AdDMEM+ e transferi-lo para o mesmo tubo cônico de 15 mL.
- Usando uma pipeta de vidro Pasteur, interrompa mecanicamente os organoides do rato. Esta é uma etapa crítica, pois o objetivo são pequenos aglomerados multicelulares de células. Pipetar para cima e para baixo ~30 vezes. Verifique a eficiência da interrupção sob o microscópio usando uma objetiva de 4x. Continue este processo até que a suspensão celular seja composta principalmente por aglomerados celulares com poucos organoides restantes.
NOTA: Alternativamente, os organoides podem ser centrifugados a 200 x g por 5 min à temperatura ambiente, o sobrenadante cuidadosamente removido e ressuspendido em 1 mL de enzima recombinante substituindo tripsina/EDTA convencional, pré-aquecido a 37 °C na incubadora de cultura de tecidos. Incubar os organoides em reposição de tripsina por 2 min em banho-maria a 37 °C, com vórtice regular para promover dissociação. Evite incubação prolongada com reposição de tripsina, pois isso pode promover a morte celular. Verifique regularmente a eficiência da interrupção sob o microscópio usando uma objetiva de 4x. Quando a suspensão for composta principalmente por células únicas com poucas culturas celulares, diluir a reposição de tripsina adicionando 4 mL de AdDMEM+ e prosseguir com a etapa seguinte. - Gire o tubo cônico de 15 mL contendo os aglomerados celulares a 200 x g por 5 min a 4 °C. Retire e descarte cuidadosamente o sobrenadante, tomando cuidado para não atrapalhar o pellet celular.
- Ressuspender os aglomerados celulares em 230 μL de meio de transdução por poço a ser infectado. Para a infecção, use um poço de uma placa de 48 poços para cada lentivírus.
- Placa de 230 μL de suspensão celular em cada poço de uma placa marcada de 48 poços. Adicionar 20 μL de vírus concentrado a cada poço. Use uma ponta P1000 para misturar a solução vírus/célula em cada poço e selar a placa com um filme transparente.
- Realizar a espinoculação: centrifugar a placa a 600 x g por 1 h a 32 °C. Abrir o selo da placa e incubar a 37 °C, 5% CO2 durante 6 h.
- Pré-aqueça uma placa de 24 poços na incubadora de 37 °C.
- Após a incubação, pipetar cada poço para cima e para baixo e transferir o conteúdo para um tubo marcado de 1,5 mL. Lave cada poço com 750 μL de AdDMEM+ e transfira para o tubo. Gire os tubos a 600 x g durante 5 min a 4 °C.
- Retire os tubos da centrífuga e guarde no gelo. Use uma ponta P1000 para remover cuidadosamente e descartar corretamente o sobrenadante.
- Ressuspenda o pellet de célula em EME e placa de 50 μL cúpulas na placa pré-aquecida de 24 poços. Incubar durante 15-20 min a 37 °C até que o EME seja polimerizado.
- Adicionar a cada poço 500 μL de rIOM suplementado com 10 mM de nicotinamida, 10 μM de Y27632 e 2,5 μM de CHIR99021.
- Substitua o meio por rIOM mais 10 μM Y27632 1 dia após a infecção. Troque a mídia a cada 2-3 dias. Se a seleção for realizada, adicione a seleção 48-72 h após a infecção. Para a seleção de puromicina, use 2 μg/mL de puromicina.
7. Imunofluorescência da coloração de montagem inteira de organoides
- Aspirar o meio e adicionar paraformaldeído (PFA) a 4% em PBS-Tween 20 (PBS-T) (Tabela 3) aos organoides em uma placa de cultura celular. Incubar à temperatura ambiente durante 10 min.
- Solte os organoides do EME pipetando para cima e para baixo. Recolher os organoides num tubo de 0,75 ml. Os organoides se acomodarão no fundo do tubo por gravidade dentro de alguns minutos. Se necessário, centrifugar a 100 x g por 1 min.
- Usando uma pipeta de transferência, remova o PFA e ressuspenda os organoides em PBS-T. Deixe os organoides se acomodarem no fundo do tubo. Retirar o PBS-T e ressuspender em 200 μL de solução em bloco (Tabela 3).
- Incubar à temperatura ambiente num balancim ou nutador durante 45 minutos. Os organoides podem se aglomerar e se acomodar no fundo do tubo. Periodicamente, mexa o dedo no tubo para ressuspender e dispersar por toda a solução.
- Deixe os organoides se acomodarem no fundo do tubo. Se necessário, centrifugar a 100 x g por 1 min. Remova a solução de bloco.
- Adicionar anticorpo primário diluído em 100 μL de solução em bloco. Incubar à temperatura ambiente num misturador nutante durante 45 min a 24 rpm. As concentrações de anticorpos variam dependendo do anticorpo utilizado.
NOTA: Esta etapa pode ser estendida com base no anticorpo primário, até a noite a 4 °C. - Deixe os organoides se acomodarem no fundo do tubo. Se necessário, centrifugar a 100 x g por 1 min.
- Lave em PBS-T cinco vezes usando uma pipeta de transferência. Incubar à temperatura ambiente durante 5 min em misturador nutante a 24 rpm. Repita esta etapa duas vezes.
- Adicionar anticorpo secundário diluído 1:200 e 50 μg/mL de 4′,6-diamidino-2-fenilindol (DAPI) diluído em 100 μL de solução em bloco. Incubar à temperatura ambiente num misturador nutante durante 30 min a 24 rpm.
- Deixe os organoides se acomodarem no fundo do tubo. Se necessário, centrifugar a 100 x g por 1 min. Remover anticorpo secundário. Lave cinco vezes em PBS-T usando uma pipeta de transferência.
- Incubar à temperatura ambiente durante 5 min num misturador de nutação a 24 rpm. Repita a etapa de lavagem duas vezes.
- Enquanto os organoides estão lavando, aqueça uma alíquota do selante VALAP (Tabela 3) a 40-50 °C para liquefazer. Usando um pincel, pinte um quadrado fino de VALAP em uma lâmina de microscópio aproximadamente do tamanho de uma lamínula. Use uma tampa de 22 mm x 22 mm nº 1.5.
- Usando uma tesoura, corte a extremidade de uma ponta de pipeta P200. Transfira organoides para o poço VALAP na lâmina. Usando um lenço de papel, retire cuidadosamente o PBS-T. Não deixe os organoides secarem.
- Inundar o poço VALAP com um meio de montagem antifade (Tabela 3). Para um quadrado de ~22 mm x 22 mm, isso exigirá 100-150 μL de antifade.
- Os organoides podem se agrupar; gire o antifade com uma ponta de pipeta para redistribuir os organoides, se necessário. Montagem com tampa de 22 mm x 22 mm nº 1.5, evitando bolhas de ar. Sele a lamínula pintando uma fina camada de VALAP nas bordas.
NOTA: Para microscópios invertidos, os organoides também podem ser montados em uma placa de fundo de vidro de 35 mm.
8. Inchaço induzido por forskolin de organoides intestinais de ratos
- Crescer os organoides por 3-5 dias após a passagem em rIOM. É aconselhável cultivar organoides em uma placa de 24 poços para garantir que a mesma região possa ser facilmente reimaginada. Capturar imagens antes da adição de forskolina (T0).
- Adicionar forskolina (Tabela 3) diretamente ao meio organoide até uma concentração final de 10 μM. Adicionar o mesmo volume de dimetilsulfóxido (DMSO) aos poços controle.
- Imagem dos poços controle e tratados com forskolin em intervalos regulares, a cada 15-30 min. Quando não estiver por imagem, mantenha os organoides na incubadora ou use um sistema de imagem controlado com incubação. O inchaço máximo deve ser observado por 120 min.
- Seguir protocolos padronizados para cálculo do edema relativo a partir das imagens adquiridas29.
Representative Results
Organoides duodenais e jejunais de rato foram gerados usando o protocolo descrito na seção 2. É muito importante durante as etapas de isolamento da cripta que as vilosidades sejam eficientemente esgotadas do PBS. Se muitas vilosidades são plaqueadas no EME com criptas, pode causar a morte de toda a cultura e falha em estabelecer uma linha organoide. Por causa disso, é útil isolar criptas sob um escopo de dissecação, permitindo a confirmação visual do esgotamento de villar. A Figura 1 mostra fragmentos e criptas representativas de villar (Figura 1A). Observe o tamanho significativamente menor das criptas em comparação com as vilosidades (Figura 1B). Após o plaqueamento, as criptas se expandirão em esferoides nos próximos dias e começarão a brotar e se diferenciar no dia 4-7 (Figura 2). Uma vez que os organoides atingem um estágio de brotamento extenso, eles devem ser passados. Durante a passagem, é importante interromper os organoides o suficiente para separar os brotos das criptas, de modo que o número de organoides possa ser expandido (Figura 3B).
A recuperação bem-sucedida dos organoides após o congelamento é altamente dependente do estado em que eles são congelados. Organoides em estado altamente proliferativo e indiferenciado se recuperam com a mais alta eficiência. Portanto, recomendamos induzi-los a serem esféricos e císticos em vez de brotados e diferenciados. Para isso, Wnt pode ser hiperativado aumentando a quantidade do ligante Wnt R-spondin no meio e incluindo nicotinamida no meio, que tem demonstrado apoiar a formação de organoides e a sobrevivência celular em vários sistemas de cultura30,31. A Figura 3A demonstra uma cultura organoide saudável apenas 2 dias após o descongelamento. A inclusão da BSA na mídia durante o descongelamento também ajudou na sobrevivência de culturas de organoides intestinais de ratos, que provaram ser mais delicadas do que organoides intestinais de camundongos.
Embora a cultura organoide 3D seja frequentemente preferida porque recapitula parte da arquitetura intestinal normal, ela torna outras abordagens, incluindo imagens vivas, transfecções e transduções lentivirais, mais desafiadoras tecnicamente. O uso de monocamadas 2D geradas a partir de organoides3D 32 (Figura 4) permite maior eficiência na introdução dos plasmídeos. Enquanto organoides intestinais 3D são tradicionalmente resistentes a transfecções transitórias, plasmídeos que codificam para EGFP podem ser introduzidos com sucesso usando métodos de transfecção baseados em lipídios. A abordagem mais custo-efetiva usando PEI é descrita na etapa 6.1 (Figura 5), mas a eletroporação e os reagentes de transfecção comercialmente disponíveis também produziram resultados comparáveis (dados não mostrados). Estudos futuros serão focados em saber se essas abordagens podem ser usadas para introduzir construtos CRISPR em monocamadas.
Era importante ser capaz de reformar organoides 3D de monocamadas 2D após a transfecção para que pudessem ser mantidos como uma linha passável com componentes arquitetônicos 3D de criptas. Curiosamente, as monocamadas 2D banhadas no EME foram prontamente reformadas em pequenos esferoides quando o EME foi adicionado de volta ao topo das células, enquanto um substrato de colágeno I não foi suficiente para a reforma das estruturas 3D (Figura 6).
Enquanto transfecções transitórias são úteis para muitos estudos, a formação de linhas estáveis são muitas vezes mais úteis, exigindo a introdução de lentivírus nas células. Organoides intestinais de ratos foram infectados com lentivírus modificando protocolos previamente publicados (Figura 7). Uma etapa chave no protocolo é a ruptura de organoides em pequenos agregados ou aglomerados celulares. Se as culturas não forem eficientemente interrompidas e os organoides permanecerem intactos, as partículas lentivirais não entrarão nas células. Após a infecção, os organoides devem se recuperar e voltar a crescer. O protocolo aqui descrito permite a captação de partículas virais em 10%-48% (média: 19,4% ± 6,5%) das células antes da seleção.
A coloração de montagem completa de organoides pode ser difícil devido à remoção incompleta do resíduo de EME ou penetrância incompleta de anticorpos. O protocolo aqui descrito permite a coloração robusta de organoides. A visualização de organoides em um microscópio confocal também pode ser difícil se eles estiverem muito longe da lamínula. Usando VALAP, um poço com alguma altura é criado de tal forma que os organoides não são esmagados pela lamínula, mas ainda são autorizados a se acomodar perto da lamínula para facilitar a obtenção de imagens. A coloração representativa contra o canal ânion apical cystic fibrosis transmembrane conductance regulator (CFTR) e faloidina para marcar F-actina é mostrada na Figura 8.
Finalmente, os organoides têm utilidade em ensaios funcionais. Organoides derivados de pacientes com fibrose cística têm sido usados para rastrear a função da CFTR, uma vez que o tratamento com o agonista do AMPc forskolina induz secreção fluida robusta mediada por CFTR, causando edema organoide 29,33-37. Um dos objetivos deste trabalho foi identificar e desenvolver um modelo organoide que possa ser utilizado em paralelo a estudos pré-clínicos in vivo. Portanto, nosso objetivo foi determinar se organoides intestinais de ratos sofrem edema induzido por forskolina. De fato, dentro de 30 min de tratamento com forskolin, organoides de rato incharam, com um efeito máximo observado por 120 min (Figura 9).
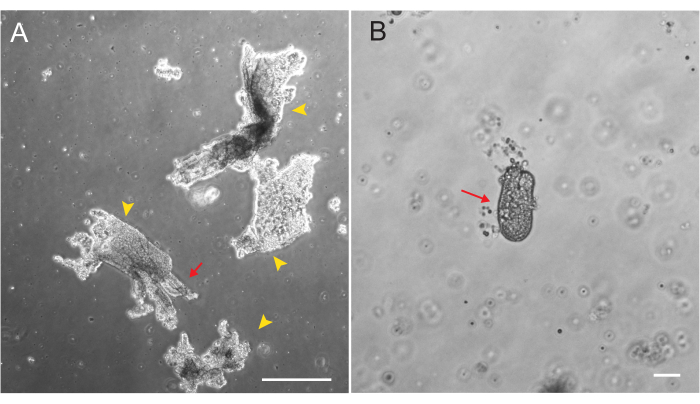
Figura 1: Fragmentos e criptas de Villar durante o isolamento epitelial. (A) Imagem representativa de fragmentos de Villar em solução de EDTA durante o protocolo de isolamento de criptas. Pontas de seta amarelas marcam fragmentos de vilões. As setas vermelhas representam criptas presas a um fragmento de vilão. Observe a diferença nos tamanhos relativos. (B) Imagem de maior magnificação de uma única cripta (seta vermelha) para que a morfologia possa ser visualizada. Barras de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.
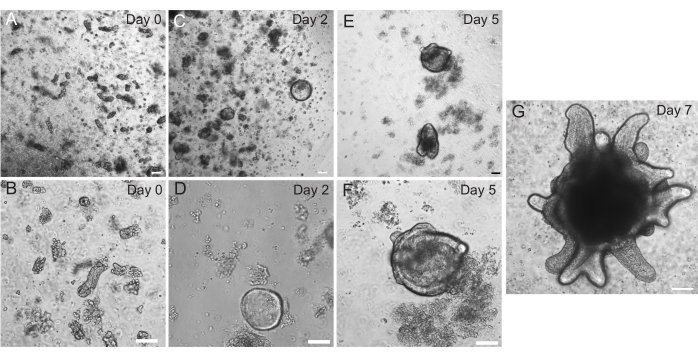
Figura 2: Progressão organoide intestinal do rato. As criptas do jejuno de ratos foram plaqueadas em EME imediatamente após o isolamento (A,B). Em 2 dias, as criptas tornaram-se esferoides (C,D). No Dia 5, eles começaram a iniciar brotos de cripta (E,F), que se elaboraram e cresceram no Dia 7 (G). Barras de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.
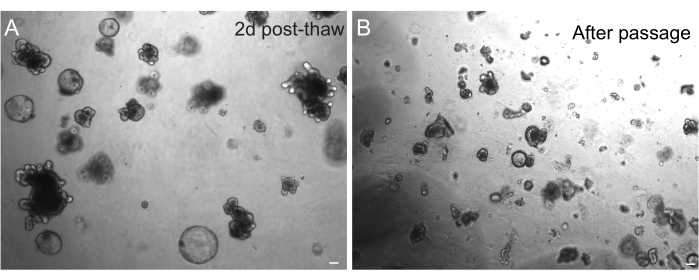
Figura 3: Organoides após descongelamento e passagem. (A) Os organoides jejunais de ratos foram descongelados seguindo os protocolos descritos após criopreservação. Observe a presença de esferoides e organoides brotados apenas 2 dias após o descongelamento. (B) A mesma linha organoide representada em A imediatamente após a passagem seguindo o protocolo delineado. Observe a diferença de tamanho relativo entre estruturas em A e B e a presença de domínios semelhantes a criptas únicas em B. Barras de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.
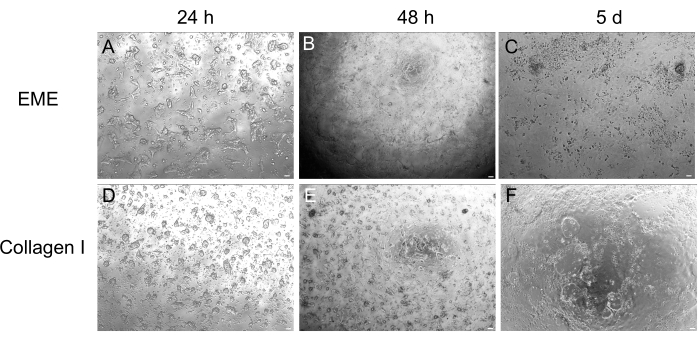
Figura 4: Formação de monocamada 2D a partir de organoides 3D. (A-C) Progressão de monocamada 2D em EME. (D-F) Progressão da monocamada 2D no colágeno I. No dia 5, cada condição produziu ~80% de confluência. Barras de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.
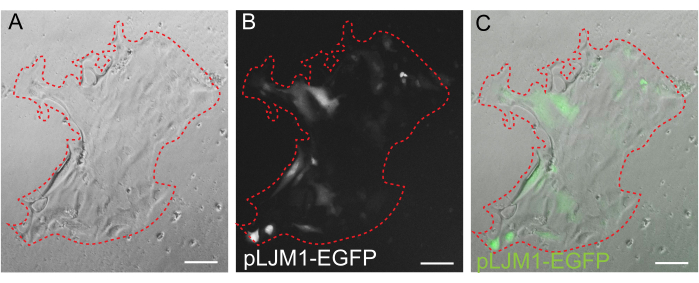
Figura 5: Transfecção transitória de uma monocamada 2D. Imagem representativa de uma monocamada 2D crescida em EME transfectada transitoriamente com plasmídeo pLJM1-EGFP usando PEI. (A) Campo brilhante, (B) fluorescência (GFP), (C) sobreposição. A linha vermelha pontilhada marca o limite da monocamada. Barras de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.
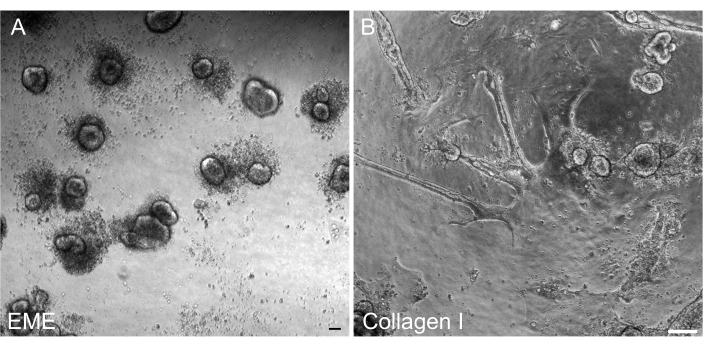
Figura 6: Reforma de organoides 3D a partir de monocamadas 2D em EME. (A) Formação de organoides 3D a partir de monocamadas 2D cultivadas em EME. Organoides formados eficientemente por 5 dias após a adição de EME à superfície apical da monocamada. Observe a abundância de células mortas ao redor dos pequenos esferoides 3D. (B) Persistência das monocamadas 2D 5 dias após a adição de colágeno I à superfície apical das monocamadas 2D cultivadas sobre colágeno I. Barras de escala: 100 μm. Clique aqui para ver uma versão ampliada desta figura.
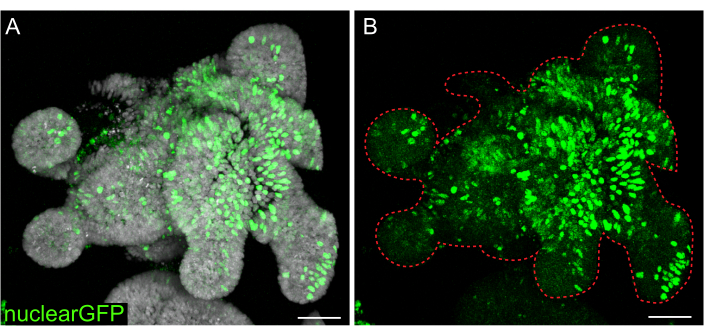
Figura 7: Infecção lentiviral de organoides 3D. Organoides do jejuno de ratos foram infectados com partículas lentivirais de GFP nuclear usando o protocolo delineado. Após recuperação e crescimento por 5 dias, os organoides foram fixados e contracorados com DAPI. (A) DAPI: cinza; nuclearGFP: verde. (B) nuclearGFP:verde. A linha vermelha pontilhada marca o limite organoide. Barras de escala: 50 μm. Clique aqui para ver uma versão maior desta figura.
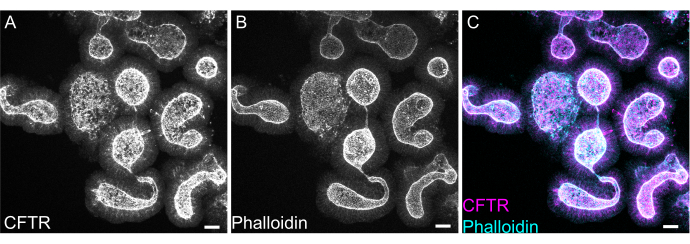
Figura 8: Imunofluorescência de montagem total de organoides intestinais de ratos. (A) CFTR, (B) faloidina e (C) imunofluorescência de montagem total de organoides jejunais de ratos. Notar o enriquecimento apical da coloração CFTR em organoides (cinza em A, magenta em C). A faloidina marca F-actina e marca proeminentemente a borda da escova apical (cinza em B, ciano em C). Barras de escala: 25 μm. Clique aqui para ver uma versão maior desta figura.
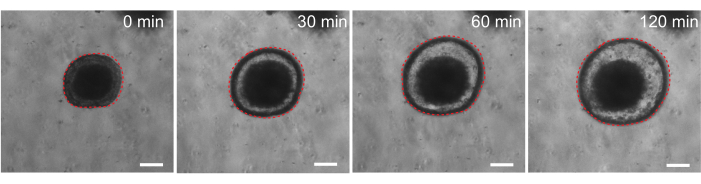
Figura 9: Os organoides intestinais de ratos incham após a estimulação com forskolina. Tempo representativo de curso do inchaço organoide intestinal de rato após a adição do agonista do AMPc forskolina. O tempo de 0 min representa o ponto de tempo imediatamente anterior à adição de 10 μM de forskolina. As imagens mostram o mesmo organoide em intervalos de tempo de 30 min. Edema máximo foi observado em 120 min após a adição de forskolin. A linha vermelha pontilhada delineia o limite organoide. O material escuro no meio do lúmen organoide é composto por células mortas. Barras de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Receita AdDMEM+. Ingredientes para fazer a mídia padrão AdDMEM+, que é a mídia base em todos os métodos mostrados aqui. Clique aqui para baixar esta tabela.
Tabela 2: Receita de meios organoides intestinais de ratos (rIOM). Receita detalhada do meio organoide intestinal padrão de rato, incluindo solvente e condições de armazenamento para proteínas recombinantes. Clique aqui para baixar esta tabela.
Tabela 3: Soluções. Receitas e instruções para fazer outras soluções utilizadas ao longo do protocolo. Clique aqui para baixar esta tabela.
Tabela 4. Meio organoide intestinal de rato para cultura 2D de monocamada (rIOM2D). Receita modificada de meios de cultura organoides otimizados para o crescimento 2D de monocamadas. Clique aqui para baixar esta tabela.
Discussion
O desenvolvimento de um modelo organoide intestinal de ratos preserva importantes características funcionais encontradas no órgão in vivo e é uma ferramenta promissora para testes pré-clínicos, triagem de drogas e ensaios funcionais. Esse modelo in vitro pode ser usado em paralelo a estudos de gastroenterologia pré-clínica in vivo , para os quais os ratos são frequentemente um modelo preferido devido ao seu maior tamanho intestinal, aspectos fisiológicos compartilhados com humanos e, em alguns casos, por serem melhores modelos de doença38. Aqui, um protocolo passo-a-passo robusto para o isolamento de criptas intestinais de ratos, geração e cultura de longo prazo de organoides intestinais de ratos, bem como aplicações a jusante, incluindo ensaios funcionais de inchamento de forskolin, imunofluorescência de montagem inteira, cultura de monocamada 2D e manipulação genética lentiviral é descrito. É provável que organoides intestinais de ratos sejam relevantes em muitos contextos de doenças onde a fisiopatologia de modelos de camundongos é inadequada e pode fornecer um modelo melhor para a fisiologia intestinal humana em comparação com organoides intestinais de camundongos.
Para estabelecer culturas organoides de vida longa que possam ser passadas e expandidas, é essencial identificar os principais fatores de crescimento necessários para manter a proliferação epitelial intestinal. Organoides de camundongos são mais frequentemente cultivados em um coquetel simples de EGF, R-spondin e Noggin, embora tenha sido relatado que Noggin não é necessário para a cultura de organoides intestinais39. Os meios condicionados podem substituir os fatores de crescimento recombinantes e as linhagens celulares mais comumente usadas são L-WRN, que secreta células Wnt3a, Rspondin-3 e Noggin39, L-Wnt3a e HA-Rspondin1-Fc 293T40. O meio condicionado com L-WRN é suficiente para suportar não apenas o crescimento de organoides intestinais39 em camundongos, mas também o crescimento de organoides intestinais de vários animais de fazenda e animais de companhia, incluindo cães, gatos, galinhas, cavalos, vacas, ovelhas e porcos12. No entanto, os organoides intestinais humanos são muito diferentes em suas exigências de fatores de crescimento, pois requerem formulações de meios distintos para sua fase de crescimento de expansão (i.e., a progressão de pequenos para grandes esferoides) versus sua fase de diferenciação (i.e., a geração e maturação de tipos celulares diferenciados)10. As exigências de meios dos organoides intestinais de ratos espelham de perto as dos meios de crescimento de expansão para organoides intestinais humanos, mas, notadamente, organoides de ratos são capazes de crescimento e diferenciação neste ambiente de meios, simplificando consideravelmente suas necessidades de cultura. Enquanto nossas tentativas iniciais se concentraram em estabelecer e cultivar organoides intestinais de ratos em meios condicionados por L-WRN, a cultura de longo prazo foi tênue, e as linhagens de organoides intestinais de ratos sofreram de falta de robustez (dados não mostrados). Isso pode ser porque as linhagens celulares L-WRN são projetadas para secretar R-espondina 3, enquanto a linha celular 293T-Rspo1 recomendada aqui é projetada para secretar R-espondina 1. É possível que organoides de ratos e humanos prefiram a R-espondina 1, potencialmente responsável pela falha das linhagens organoides de ratos em meios condicionados por L-WRN.
Para recapitular mais de perto o cenário in vivo , é importante desenvolver condições de cultura de organoides que permitam a sobrevivência, manutenção e proliferação de células-tronco, e que possam manter o turnover celular e eventos simultâneos de diferenciação em tipos celulares discretos. Portanto, as concentrações de proteínas recombinantes e/ou proteínas em meios condicionados precisam ser rigorosamente tituladas e controladas para atingir esse equilíbrio perfeito. Em particular, níveis ótimos de Wnt são essenciais para evitar a perda de culturas de organoides intestinais. Muito pouco Wnt em meios condicionados será incapaz de suportar o crescimento, levando a uma perda de células-tronco e subsequente morte organoide; a superativação de Wnt fará com que os organoides sejam císticos e indiferenciados10. Embora não detalhado aqui, é altamente recomendável testar cada lote de mídia condicionada L-Wnt3a e 293T-Rspo1 usando um ensaio de luciferase do repórter Wnt, como uma linha de células Topflash41. Estudos anteriores descreveram que um lote ótimo de meio L-Wnt3a deve resultar em um aumento de sinal de 15 vezes a 12,5% e um aumento de sinal de 300 vezes a 50%, em comparação com 1% de L-Wnt3a10. Como os organoides de rato são mais sensíveis do que os organoides de camundongo aos requisitos de cultura, particularmente aos níveis de ativação de Wnt, essas etapas adicionais de controle de qualidade ajudam muito a facilitar a robustez e a confiabilidade das culturas de organoides de ratos. Como uma linha de repórter semelhante não está disponível para testar a atividade de Bmp e as concentrações relativas de Noggin em meios condicionados de Noggin, é aconselhável usar Noggin recombinante quando possível para controlar precisamente os níveis de Noggin. Embora organoides intestinais de camundongos possam ser cultivados e mantidos na ausência de Noggin39, isso não foi tentado para culturas de organoides intestinais de ratos.
Além dos requisitos de cultura celular, o estabelecimento inicial bem sucedido de uma linhagem organoide de rato depende criticamente da depleção eficiente de vilosidades diferenciadas durante o isolamento de criptas. Altos níveis de contaminação causam a morte das criptas, presumivelmente devido a sinais das células moribundas ou sequestro de fatores essenciais. Para esgotar essas vilosidades diferenciadas das preparações epiteliais de forma precisa e consistente, recomenda-se realizar isolamentos epiteliais com o auxílio de um estereoscópio. O exame visual do epitélio que está sendo liberado fornece uma pista clara de quando descartar o PBS e substituí-lo (Figura 1). As criptas não devem ser coletadas até que haja esgotamento suficiente das vilosidades. As células Villar são terminalmente diferenciadas e não podem gerar organoides em cultura. Além disso, a passagem subsequente de organoides intestinais de ratos e seu uso para qualquer aplicação a jusante requer cuidados delicados. A incubação em reagentes de dissociação por períodos mais longos (10 min) resulta em morte celular significativa e perda da linha organoide.
Aqui, um protocolo simples e rápido para geração de monocamadas intestinais a partir de organoides de ratos é descrito. Os substratos EME e colágeno I têm efeitos diferentes sobre o epitélio, que podem ser aproveitados dependendo do objetivo do estudo. O EME permite a adesão rápida e eficiente de células únicas e a formação de projeções celulares. Em contraste, o revestimento da superfície com colágeno I retarda esses processos. Uma vez que as monocamadas atingem aproximadamente 80% de confluência, as células cultivadas em EME começam a gerar estruturas organoides 3D novamente. No entanto, eles carecem de suporte físico e químico suficiente para o crescimento contínuo. Essa reversão de volta ao estado organoide pode ser evitada mantendo as monocamadas na EME em uma confluência de 50%-80%. A adição de EME diluído à superfície apical das monocamadas promove a rápida recuperação e formação de organoides de novo, gerando regiões de convergência mais rápida e prontamente. Em uma superfície de colágeno I, as células podem formar uma monocamada uniforme e gerar pequenos aglomerados. Entretanto, a adição de colágeno I sobre as monocamadas não é suficiente para induzir a formação de organoides. O EME deve ser diluído ao adicionar à superfície da monocamada, pois haverá uma resistência mecânica mais forte para o organoide nascente superar. No entanto, este EME diluído não permite a formação robusta de grandes organoides. Qualquer organoide de rato gerado de novo que se desprenda naturalmente da superfície deve ser imediatamente removido e transferido para EME não diluído para que o suporte estrutural e o crescimento possam ser restaurados. Devido ao pequeno tamanho dos organoides nesta etapa, a passagem de organoides não é recomendada até que o crescimento robusto tenha sido estabelecido. O significado biológico subjacente de por que EME pode apoiar a reforma de organoides, mas se o colágeno I pode ou não fazer isso, não está claro. No entanto, há relatos de que células cultivadas em colágeno 3D não podem formar organoides brotados42,43 ou suportar a manutenção a longo prazo. Os produtos EME comercialmente disponíveis são misturas heterogêneas de proteínas extracelulares, principalmente laminina e colágeno IV44. Portanto, a composição distinta de proteínas e a capacidade de uma célula epitelial de se envolver com a matriz extracelular usando diferentes complexos celulares poderiam permitir o remodelamento na EME, mas não no colágeno I. Não foi testado se as monocamadas derivadas do colágeno I podem ser colocadas na EME para apoiar a formação e o crescimento de organoides.
A manipulação genética do modelo organoide intestinal de ratos é descrita aqui, e protocolos para transdução lentiviral de organoides 3D e transfecção transitória de monocamadas 2D são descritos. Para superar a baixa eficiência da transdução de organoides lentivirais, um protocolo foi desenvolvido para a transfecção transitória de monocamadas 2D. A morfologia plana e os domínios apicais expostos das monocamadas proporcionam acesso mais fácil a vírus e complexos contendo DNA. Para a validação dessa técnica, utilizou-se a expressão de um repórter do EGFP utilizando o vetor pLJM1-EGFP. A expressão do repórter GFP foi observada após 24 h, e foi mantida por 5-6 dias em monocamadas. Estudos futuros com foco na transdução lentiviral de monocamadas provavelmente terão maior eficiência do que a transdução de organoides 3D. Usando os protocolos acima, organoides 3D podem ser reformados a partir de monocamadas 2D infectadas para facilitar a criação de linhas estáveis. Com cuidado, linhagens de organoides intestinais de ratos podem ser mantidas com sucesso por mais de um ano, permanecendo estáveis ao longo de muitas passagens, criopreservadas, descongeladas com sucesso e geneticamente modificadas usando transdução lentiviral, abordando assim a necessidade de um modelo organoide intestinal in vitro acessível e tratável que mantenha a relevância fisiológica para os seres humanos.
Disclosures
Nenhum.
Acknowledgements
Agradecemos aos membros dos laboratórios Sumigray e Ameen por suas discussões atenciosas. Este trabalho foi apoiado por uma bolsa de saúde infantil da Fundação Charles H. Hood e uma bolsa da Fundação de Fibrose Cística (004741P222) para KS e pelo Instituto Nacional de Diabetes e Doenças Digestivas e Renais dos Institutos Nacionais de Saúde para NA sob o número de prêmio 2R01DK077065-12.
Materials
| Name | Company | Catalog Number | Comments |
| 3-D Culture Matrix Rat Collagen I | Cultrex/R&D Systems | 3447-020-01 | |
| 70 µm cell strainer | Corning/Falcon | 352350 | |
| Advanced DMEM/F12 | Gibco/Thermo Fisher | 12634010 | |
| Amphotericin B | Sigma Aldrich | A2942-20ML | |
| B-27 Supplement (50X), serum free | Thermo Fisher | 17504044 | |
| CHIR99021 | Cayman Chemical | 13122 | |
| CryoStor | Stem Cell Technologies | 100-1061 | |
| Cultrex HA-Rspondin1-Fc 293T cells | R & D Systems | 3710-001-01 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes/Thermo Fisher | D1306 | |
| FBS | Gibco/Thermo Fisher | 16-000-044 | |
| Gastrin I (human) | Sigma Aldrich | G9145 | |
| Gentle Cell Dissociation Reagent | Stem Cell Technologies | 100-0485 | |
| Glutamax | Thermo Fisher | 35-050-061 | |
| Growth factor-reduced Matrigel, phenol red-free | Corning | 356231 | |
| HEPES | AmericanBio | AB06021 | |
| Lanolin | Beantown Chemical | 144255-250G | |
| L-glutamine | Gibco/Thermo Fisher | A2916801 | |
| L-Wnt3a cells | ATCC | CRL-2647 | |
| N-2 Supplement (100X) | Thermo Fisher | 17502-048 | |
| N-acetylcysteine | Sigma Aldrich | A9165-5G | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Opti-MEM I Reduced Serum Medium | Gibco/Thermo Fisher | 31985070 | |
| Paraffin | Fisher Scientific | P31-500 | |
| Parafilm | Sigma Aldrich | P7793 | transparent film |
| PBS | Thermo Fisher | 10010023 | |
| Penicillin/Streptomycin | Gibco/Thermo Fisher | 15140122 | |
| pLJM1-EGFP | Addgene | 19319 | |
| Polybrene | Millipore | TR-1003-G | |
| Polyethylenimine hydrochloride (PEI) | Sigma Aldrich | 764965 | |
| p-phenylenediamine | Acros Organics/Thermo Fisher | 417481000 | |
| Puromycin | VWR | J593-25mg | |
| Recombinant human FGF2 protein | Peprotech | 100-18B-250ug | |
| Recombinant human IGF-1 protein | Biolegend | B356441 | |
| Recombinant human Noggin protein | R & D Systems | 6057-NG-100 | |
| Recombinant mouse EGF protein | Thermo Fisher | PMG8041 | |
| Sprague Dawley rat | Charles River Laboratories | Strain 001 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| TrypLE Express Enzyme | Gibco/Thermo Fisher | 12604013 | |
| Y27632 dihydrochloride | Sigma Aldrich | Y0503 |
References
- Beumer, J., Clevers, H. Cell fate specification and differentiation in the adult mammalian intestine. Nature Reviews. Molecular Cell BiologyI. 22 (1), 39-53 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Yin, Y. -. B., de Jonge, H. R., Wu, X., Yin, Y. -. L. Enteroids for nutritional studies. Molecular Nutrition & Food Research. 63 (16), 1801143 (2019).
- Cai, T., et al. Effects of six common dietary nutrients on murine intestinal organoid growth. PLoS One. 13 (2), e0191517 (2018).
- Davoudi, Z., et al. Gut Organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery. Marine Drugs. 19 (5), 282 (2021).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Yin, Y. B., de Jonge, H. R., Wu, X., Yin, Y. L. Mini-gut: a promising model for drug development. Drug Discovery Today. 24 (9), 1784-1794 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Gunther, C., Winner, B., Neurath, M. F., Stappenbeck, T. S. Organoids in gastrointestinal diseases: from experimental models to clinical translation. Gut. 71 (9), 1892-1908 (2022).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), 106 (2020).
- Zhao, Z., et al. Organoids. Nature Reviews Methods Primers. 2 (1), 94 (2022).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Fagerholm, U., Johansson, M., Lennernas, H. Comparison between permeability coefficients in rat and human jejunum. Pharmaceutical Research. 13 (9), 1336-1342 (1996).
- Dubbelboer, I. R., Dahlgren, D., Sjogren, E., Lennernas, H. Rat intestinal drug permeability: A status report and summary of repeated determinations. European Journal of Pharmaceutics and Biopharmaceutics. 142, 364-376 (2019).
- Bryda, E. C. The Mighty Mouse: the impact of rodents on advances in biomedical research. Missouri Medicine. 110 (3), 207-211 (2013).
- Zhang, Z., Carriero, N., Gerstein, M. Comparative analysis of processed pseudogenes in the mouse and human genomes. Trends in Genetics. 20 (2), 62-67 (2004).
- Lambracht-Washington, D., Fischer Lindahl, K. Active MHC class Ib genes in rat are pseudogenes in the mouse. Immunogenetics. 56 (2), 118-121 (2004).
- Busslinger, G. A., et al. Human gastrointestinal epithelia of the esophagus, stomach, and duodenum resolved at single-cell resolution. Cell Reports. 34 (10), 108819 (2021).
- Burclaff, J., et al. A proximal-to-distal survey of healthy adult human small intestine and colon epithelium by single-cell transcriptomics. Cellular and Molecular Gastroenterology and Hepatology. 13 (5), 1554-1589 (2022).
- Haber, A. L., et al. A single-cell survey of the small intestinal epithelium. Nature. 551 (7680), 333-339 (2017).
- Olivier, A. K., Gibson-Corley, K. N., Meyerholz, D. K. Animal models of gastrointestinal and liver diseases. Animal models of cystic fibrosis: gastrointestinal, pancreatic, and hepatobiliary disease and pathophysiology. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (6), G459-G471 (2015).
- Lu, P., et al. Animal models of gastrointestinal and liver diseases. Animal models of necrotizing enterocolitis: pathophysiology, translational relevance, and challenges. American Journal of Physiology. Gastrointestinal and Liver Physiology. 306 (11), G917-G928 (2014).
- Fujii, M., et al. Human intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Hedrich, W. D., et al. Development and characterization of rat duodenal organoids for ADME and toxicology applications. Toxicology. 446, 152614 (2020).
- How to Cryopreserve Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/area-of-interest/organoid-research/intestinal-research/tech-tips-protocols/how-to-cryopreserve-intestinal-organoids.html (2023)
- How to Thaw Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/educational-materials/protocols/how-to-thaw-intestinal-organoids.html (2023)
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Van Lidth de Jeude, J. F., Vermeulen, J. L., Montenegro-Miranda, P. S., Vanden Brink, G. R., Heijmans, J. A protocol for lentiviral transduction and downstream analysis of intestinal organoids. Journal of Visualized Experiments. (98), e52531 (2015).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: an in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), e55159 (2017).
- Regent, F., et al. Nicotinamide promotes formation of retinal organoids from human pluripotent stem cells via enhanced neural cell fate commitment. Frontiers in Cellular Neuroscience. 16, 878351 (2022).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Breau, K. A., et al. Efficient transgenesis and homology-directed gene targeting in monolayers of primary human small intestinal and colonic epithelial stem cells. Stem Cell Reports. 17 (6), 1493-1506 (2022).
- Berkers, G., et al. Rectal organoids enable personalized treatment of cystic fibrosis. Cell Reports. 26 (7), 1701-1708 (2019).
- deWinter-de Groot, K. M., et al. Forskolin-induced swelling of intestinal organoids correlates with disease severity in adults with cystic fibrosis and homozygous F508del mutations. Journal of Cystic Fibrosis. 19 (4), 614-619 (2020).
- Dekkers, J. F., vander Ent, C. K., Beekman, J. M. Novel opportunities for CFTR-targeting drug development using organoids. Rare Diseases. 1, 27112 (2013).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- van Mourik, P., Beekman, J. M., vander Ent, C. K. Intestinal organoids to model cystic fibrosis. European Respiratory Journal. 54 (1), 1802379 (2019).
- Tong, T., et al. Transport of artificial virus-like nanocarriers through intestinal monolayers via microfold cells. Nanoscale. 12 (30), 16339-16347 (2020).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nature Protocols. 8 (12), 2471-2482 (2013).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nature Medicine. 15 (6), 701-706 (2009).
- Xu, Q., et al. Vascular development in the retina and inner ear: control by Norrin and Frizzled-4, a high-affinity ligand-receptor pair. Cell. 116 (6), 883-895 (2004).
- Jabaji, Z., et al. Type I collagen as an extracellular matrix for the in vitro growth of human small intestinal epithelium. PLoS One. 9 (9), e107814 (2014).
- Sachs, N., Tsukamoto, Y., Kujala, P., Peters, P. J., Clevers, H. Intestinal epithelial organoids fuse to form self-organizing tubes in floating collagen gels. Development. 144 (6), 1107-1112 (2017).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved