Визуализация ATG9A, многодиапазонного мембранного белка
In This Article
Summary
В этом протоколе описаны различные методы, которые могут помочь в изучении биологии ATG9A, включая иммунофлуоресценцию с последующим анализом изображений, рассмотрение вопросов транзиторной гиперэкспрессии и исследование статуса гликозилирования ATG9A с помощью вестерн-блоттинга.
Abstract
Аутофагия — это высококонсервативный путь, который клетка использует для поддержания гомеостаза, разрушения поврежденных органелл, борьбы с вторгшимися патогенами и выживания при патологических состояниях. Набор белков, называемых белками ATG, составляет основной механизм аутофагии и работает вместе в определенной иерархии. Исследования, проведенные в последние годы, улучшили наши знания о пути аутофагии. Совсем недавно было высказано предположение, что везикулы ATG9A находятся в центре аутофагии, поскольку они контролируют быстрый de novo синтез органеллы, называемой фагофором. Изучение ATG9A оказалось сложной задачей, поскольку ATG9A является трансмембранным белком и присутствует в различных мембранных компартментах. Таким образом, понимание его незаконного оборота является важным элементом для понимания аутофагии. Здесь представлены подробные методы, которые могут быть использованы для изучения ATG9A и, в частности, его локализации с помощью иммунофлуоресцентных методов, которые могут быть оценены и количественно определены. Также рассматриваются ловушки преходящей гиперэкспрессии. Правильная характеристика функции ATG9A и стандартизация методов анализа ее трафика имеют решающее значение для дальнейшей характеристики событий, управляющих инициацией аутофагии.
Introduction
ATG9A является единственным трансмембранным белком основного механизма аутофагии и перемещается между Гольджи и цитозольным компартментом везикулы ATG9A, проходя через эндосомальный компартмент1. Долгое время оставаясь загадочным, ATG9A недавно был описан как липидный скрамблаз, поскольку он уравновешивает липиды через мембранные бислои 2,3. В настоящее время ясно, что ATG9A находится на вершине иерархии в образовании аутофагосом, и его изучение, таким образом, жизненно важно для понимания аутофагии 4,5. Таким образом, везикулы ATG9A недавно были предложены в качестве «семени» аутофагосомы 6,7. Однако предыдущие исследования показали, что ATG9A лишь временно взаимодействует с формирующейся аутофагосомой на разных стадиях ее созревания и не интегрируется в аутофагическую мембрану 6,8,9,10,11. Таким образом, необходимы дальнейшие исследования, чтобы полностью разгадать роль и потенциальные множественные функции ATG9A в образовании аутофагосом. Тем не менее, расхождение между текущими моделями и предыдущими данными может быть устранено только с помощью целенаправленных экспериментов, направленных на борьбу с незаконным оборотом ATG9A с использованием валидированных количественных подходов и внутриклеточных маркеров.
Для изучения ATG9A используются различные инструменты, каждый из которых имеет свои преимущества и недостатки, и использование этих инструментов осложняется структурой ATG9A, его молекулярной функцией и клеточным трафиком 2,8,12. ATG9A образует гомотример, гликозилируется и транспортируется по всей клетке в такие компартменты, как Гольджи, эндосомы и плазматическая мембрана13,14. Учитывая его сложный маршрут, существует несколько проблем при интерпретации показаний, таких как рассеивание ATG9A из Гольджи при специфическом лечении или стимулах (таких как голодание питательных веществ и сыворотки). ATG9A чрезвычайно динамичен с точки зрения везикулярного трафика; действительно, везикулы, содержащие ATG9A, были определены как компартмент ATG9A в контексте аутофагии, вызванной голоданием. Компартмент ATG9A, образованный этими динамическими везикулами, временно взаимодействует с несколькими внутриклеточными органеллами 8,15,16,17. Описанные здесь методы, включая иммунофлуоресценцию, живую визуализацию и анализ гликозилирования, должны помочь в обнаружении и понимании биологии ATG9A. В частности, подходы, описанные в этой статье, помогут ответить на вопросы локализации в конкретных клеточных компартментах и взаимодействии с конкретными белковыми партнерами и/или мембранными компартментами. Поскольку гидрофобный консервативный домен ядра ATG9A (PFAM домен PF04109) имеет уникальную топологию и циклы ATG9A между несколькими мембранными компартментами, исследователи должны знать об определенных подводных камнях и артефактах при временной гиперэкспрессии ATG9A, включая, помимо прочего, удержание эндоплазматического ретикулума (ER). Другие возможные проблемы могут возникнуть из-за неправильного сворачивания белка, артефактной агрегации в нормальных условиях выращивания или недостаточного обнаружения везикулярного компартмента из-за неоптимальных протоколов пермеабилизации для иммунофлуоресценции.
При визуализации эндогенного ATG9A необходимо соблюдать осторожность при подготовке образцов и получении изображений, чтобы обеспечить качество последующего количественного анализа и правильную интерпретацию данных. Сочетание методов, описанных в этой статье, со стандартными биохимическими подходами (такими как иммунопреципитация или эксперименты с вытягиванием, не описанные здесь) должно улучшить наше понимание функции ATG9A. Этот экспериментальный инструментарий предназначен для того, чтобы помочь новым исследователям сориентироваться в некоторых анализах, необходимых для определения функции ATG9A в их биологической системе.
Protocol
Все реагенты, использованные в этом исследовании, коммерчески доступны, за исключением конструкций ДНК ATG9A и самодельного антитела STO-215 (см. таблицу материалов), которые доступны по запросу. Описанные здесь инструменты анализа основаны на программном обеспечении с открытым исходным кодом (FIJI/ImageJ)18.
1. Клеточная культура
- Поддерживайте HEK293A клеток в колбе, обработанной культурой тканей T150, до 80%-90% слияния в DMEM с высоким содержанием глюкозы (модифицированная среда Dulbecco's Eagle Medium) с добавлением 10% FBS (фетальной бычьей сыворотки) и 4 мМ L-глютамина (см. таблицу материалов). Инкубируют клетки при 37 °C в инкубаторе для увлажненных культур тканей при 10%CO2.
ПРИМЕЧАНИЕ: HEK293A клетки используются в настоящем исследовании, так как они имеют устойчивый канонический ответ аутофагии при аминокислотном голодании, который, в частности, обнаруживается по увеличению липидного, мембраноассоциированного LC3 1,9,19, и пригодны для визуализации. - Прохождение клеток путем аспирации среды из колбы с помощью серологической пипетки. Промойте клетки один раз 15 мл 1x PBS (фосфатно-буферного физиологического раствора) или аналогичного раствора, прежде чем добавить 2 мл раствора трипсина-ЭДТА (этилендиаминтетрауксусной кислоты) для отделения клеток. Соберите отделенные клетки с 8 мл DMEM и засейте обратно некоторое количество клеток так, чтобы через 2 дня было достигнуто слияние 80%-90% для экспериментов, описанных здесь.
2. Эндогенное окрашивание ATG9A
- Посевные клетки HEK293A (или клетки по выбору) на стерильных стеклянных покровных стеклах No 1,5, помещенных в 24-луночную пластину так, чтобы на следующий день они сливались ~80%. Как правило, это дает 7 x 10,4 ячейки/лунку в 500 мкл DMEM.
ПРИМЕЧАНИЕ: Для HEK293A клеток или других слабо адгезивных клеточных линий покровные стекла должны быть покрыты поли-D-лизином в концентрации 0,1 мг/мл в деионизированной воде. Добавьте 500 мкл поли-D-лизина (см. Таблицу материалов) на верхнюю часть покровных стекол, помещенных в лунки на 10 мин при комнатной температуре (RT), после чего следует три промывки деионизированной водой и последняя промывка в DMEM. Приступайте к посеву клеток после покрытия, и следите за тем, чтобы они были равномерно распределены в культуральной чашке. - Обработайте клетки в соответствии с конкретными экспериментальными условиями (например, голодание в течение 2 ч в EBSS [сбалансированный солевой раствор Эрла]).
ПРИМЕЧАНИЕ: Состав EBSS: 1 г/л D-глюкозы, 6,8 г/л NaCl, 0,4 г/л KCl, 0,151 г/л CaCl 2,2H 2 O, 0,2 г/л мМ MgSO 4,7 H 2 O, 0,124 г/л 2 HPO4,2 H 2 O и 2,2 г/л NaHCO 3 (см. таблицу материалов) растворенных в дистиллированнойводе. - Аспирируют среду и осторожно заменяют ее 500 мкл 4% раствора формальдегида в PBS с добавлением 0,1 мМ CaCl 2 и 0,1 мМ MgCl2 в течение 20 мин при RT для фиксации клеток.
- Отсасывайте 4% раствор формальдегида из каждой лунки, заменяя его 500 мкл PBS. Повторите этот шаг стирки три раза. Не допускайте, чтобы покровные стекла высохли или оставались без жидкости.
- Гасят свободные альдегидные группы, используя 500 мкл 50 мМ раствора NH4Cl в PBS в течение 10 мин при RT.
- Аспирируйте PBS и замените его 500 мкл раствора дигитонина 50 мкг/мл в PBS (исходный раствор 1 мг/мл в деионизированной воде, см. таблицу материалов) в течение 5 мин при RT для пермеабилизации клеток.
- Аспирируйте раствор дигитонина из каждой лунки и замените его 500 мкл PBS. Повторите этот шаг стирки три раза.
- Отсасывайте PBS из каждой лунки и заменяйте его 500 мкл блокирующего раствора (5% BSA [бычий сывороточный альбумин], разбавленный в PBS) в течение 30 мин при RT.
- Аспирируйте блокирующий раствор и замените его 500 мкл PBS.
- С помощью пинцета соберите покровные стекла из лунки, осторожно удалите излишки раствора PBS с помощью тонких салфеток или целлюлозной фильтровальной бумаги и аккуратно положите каждое покровное стекло клеточной стороной вниз на 50 мкл капли раствора первичных антител (например, Armenian Hamster 14F2, разбавленный до 0,9 мкг/мл в 1% растворе BSA/PBS, см. таблицу материалов). Инкубируют в увлажненной камере в течение 1 ч при РТ.
ПРИМЕЧАНИЕ: Для удобства обращения капли раствора антител можно поместить на лист самогерметизирующейся термопластичной пленки (см. Таблицу материалов) в другом контейнере, а не непосредственно на твердую поверхность. - Соберите покровные стекла с помощью пинцета и, осторожно слив излишки раствора первичных антител с помощью тонких салфеток, замените покровные стекла (клеточной стороной вверх) в 24-луночном планшете и промойте их три раза PBS.
- Повторите шаг 2.10. Используя пинцет, соберите покровные стекла из каждой лунки, осторожно сливая излишки PBS с помощью тонких салфеток, и аккуратно положите каждый покровный лист (клеточной стороной вниз) на 50 мкл капли раствора вторичных антител, разведенного 1:1,000 в 1% растворе BSA/PBS (например, Cy3 Goat Anti-Armenian Hamster IgG, который имеет минимальную перекрестную реактивность с бычьим, человеческим, белки сыворотки крови мыши, кролика и крысы (см. таблицу материалов). Инкубируют в увлажненной камере в течение 1 ч при РТ.
ПРИМЕЧАНИЕ: Опционально: Маркер цитоскелета может быть использован в дополнение к вторичному антителу для последующего анализа изображения (например, Alexa Fluor 647 Phalloidin dilut 1:1,000, см. Таблицу материалов). Для удобства обращения капли раствора антител можно поместить на лист герметизирующей пленки в другом контейнере, а не непосредственно на твердую поверхность. - Соберите покровные стекла с помощью пинцета и, после слива излишков раствора вторичных антител, поместите их в 24-луночную пластину (клеточной стороной вверх) и промойте их три раза 500 мкл PBS.
- С помощью пинцета соберите покровные стекла, осторожно сливая излишки PBS с помощью тонких тканевых салфеток, и аккуратно положите каждый покровный лист (клеточной стороной вниз) на 50 мкл 50 мкл раствора Хёхста 1:4 000 (Hoechst 33342) в PBS. Инкубируют во влажностной камере в течение 5 мин при РТ.
ПРИМЕЧАНИЕ: Для удобства обращения капли раствора антител можно поместить на лист герметизирующей пленки в другом контейнере, а не непосредственно на твердую поверхность. - Соберите покровные стекла с помощью пинцета и, осторожно слив излишки раствора Hoechst с помощью тонких тканевых салфеток, замените покровные стекла в 24-луночном планшете и промойте три раза PBS и один раз деионизированной водой (500 мкл на стирку).
- Осторожно слейте излишки деионизированной воды с помощью тонких салфеток и аккуратно положите каждое покровное стекло (клеточной стороной вниз) на каплю 10-20 мкл монтажного раствора (см. Таблицу материалов), нанесенную на предметное стекло микроскопа для иммунофлуоресценции, избегая образования пузырьков воздуха.
ПРИМЕЧАНИЕ: Используемая здесь монтажная среда имеет тот же показатель преломления, что и иммерсионное масло, и затвердевает через несколько часов при RT или в течение ночи при 4 °C. Можно использовать незатвердевающие монтажные растворы, но необходимо позаботиться о том, чтобы запечатать покровное покрытие лаком для ногтей. - Удалите излишки монтажного раствора путем аспирации и дайте образцам высохнуть, лежа в горизонтальном положении на РТ в темноте либо в держателе предметного стекла, либо накрыв алюминиевой фольгой.
3. Получение изображения
- Включите конфокальный микроскоп. Откройте программное обеспечение для обработки изображений (см. Таблицу материалов), чтобы начать настройку получения изображения.
- На вкладке «Функция» выберите объектив Plan-Apochromat 63x/1.4 Oil DIC M27 для получения изображений для анализа.
- На вкладке «Функция сбора» включите соответствующие лазеры в зоне «Лазер» панели управления («Аргон», «Диод-405-30», «ДПСС 561-10» и «HeNe633»).
- В области Imaging Setup панели управления создайте четыре дорожки, каждая из которых соответствует одному каналу, для выполнения последовательного захвата.
- Установите соответствующее разрешение изображений в окне Acquisition Mode (Режим съемки). Установите разрешение 1 024 x 1 024 (Размер кадра) и выберите Битовая глубина 16 бит.
- Для каждого канала отрегулируйте мощность и усиление лазера, чтобы получить хороший сигнал без насыщенных пикселей, которые затруднили бы анализ интенсивности изображения. С помощью кнопки Live установите уровень выходного лазера и усиление (ведущий).
ПРИМЕЧАНИЕ: Для обнаружения насыщенных пикселей рекомендуется использовать опцию индикатора диапазона. Поддерживайте мощность лазера в диапазоне от 1% до 10%, а коэффициент усиления (ведущий) ниже 850, чтобы избежать фонового шума. - В зоне «Каналы» Панели управления установите одинаковую апертуру точечного отверстия для каждого канала, считая 1 единицу Эйри (AU) для канала с наибольшей длиной волны.
- Приобретите 10 случайных полей, содержащих одинаковое количество клеток (по 20-30 клеток на поле). Получение 100-200 ячеек для каждого условия обеспечит хорошую мощность для последующего анализа изображений.
4. Анализ изображения рассеивания ATG9A
- Загрузите программное обеспечение FIJI из Интернета (см. Таблицу материалов). Откройте изображение с FIJI , нажав на Plugins > Bio-Formats > BioFormats Importer.
- Нажмите « Анализ» > «Задать измерения» и выберите «Среднее значение серого » в окне измерений для анализа интенсивности.
- Нажмите на Image > Color > Split Channels и разделите каналы на три изображения (маркер Гольджи, цитоскелет, сигнал ATG9A).
- Перейдите в Image > Adjust > Threshold ( Изображение Adjust Threshold) и задайте порог в канале, соответствующий маркеру Гольджи.
- Нажмите « Редактировать > выделение» > «Создать выделение» и создайте выделение из двоичного изображения.
- Перейдите в раздел Редактировать > выборку > Добавить в менеджер > Переименовать (Golgi), сохраните выделение в менеджере ROI и переименуйте его в Golgi.
- Щёлкните по Image > Adjust > Threshold и определите порог в канале, соответствующем маркеру цитоскелета, чтобы определить контур клетки.
- Перейдите в меню Редактировать > выделение > Создать выделение и создайте выделение из двоичного изображения.
- Нажмите « Редактировать выборку» > > «Добавить в менеджера» > «Переименовать (всего)», сохраните выборку в менеджере ROI и переименуйте ее в «Всего».
- Выберите изображение, соответствующее окрашиванию ATG9A.
- В разделе «Анализ > измерение» примените ROI Гольджи, щелкнув по нему, и измерьте интенсивность области Гольджи .
- Нажмите на Analyze > Measure, примените ROI Total, щелкнув по нему, и измерьте интенсивность региона Total.
- Повторите процедуру для всех изображений, сохраните результаты в виде файлов .csv и обработайте данные по следующей формуле:
Скорость рассеивания ATG9A = интенсивность Гольджи/Общая интенсивность
5. Визуализация конструктов ATG9A в реальном времени
- Высейте HEK293A клетки (или клетки выбора) в 2 мл среды в чашку для культуры тканей диаметром 60 мм, чтобы они достигли слияния ~65%-70% на следующий день; Обычно это дает 1 x 10 6-2 x 106 ячеек.
- На следующий день приготовьте смеси Липофектамин:ДНК (или подходящий альтернативный реагент для трансфекции ДНК, см. Таблицу материалов) следующим образом:
- В зависимости от эффективности экспрессии конструкта разбавляют 0,5-2 мкг плазмидной ДНК в 100 мкл подходящей безсывороточной среды и осторожно перемешивают раствор пипетками вверх и вниз. Выдерживают смесь в течение 5 мин при РТ.
ПРИМЕЧАНИЕ: Конструкция плазмидной ДНК специфична для эксперимента. Исследователи могут клонировать как самостоятельно, так и получать от авторов по запросу. - Развести реагент для трансфекции Lipofectamine 2000 в соотношении 3:1 Липофектамин:ДНК в 100 мкл подходящей среды, не содержащей сыворотки, и осторожно перемешать раствор путем пипетирования вверх и вниз. Инкубируйте эту смесь в течение 5 минут при RT.
- Смешайте оба раствора вместе, осторожно пипетируя вверх и вниз и инкубируя в течение 20 минут при RT.
- В зависимости от эффективности экспрессии конструкта разбавляют 0,5-2 мкг плазмидной ДНК в 100 мкл подходящей безсывороточной среды и осторожно перемешивают раствор пипетками вверх и вниз. Выдерживают смесь в течение 5 мин при РТ.
- Добавьте смесь липофектамин:ДНК в каждую чашку клеточной культуры, содержащую 4 мл питательной среды, и осторожно покачайте планшет вперед и назад, чтобы смесь равномерно распределилась. Инкубируют клетки при 37 °C во влажном инкубаторе клеточных культур при 10%CO2.
- Через 4 ч после трансфекции замените среду свежей питательной средой и инкубируйте клетки при 37 °C в инкубаторе для увлажненных клеточных культур при 10%CO2 в течение ночи.
- На следующий день трипсинизируют, подсчитывают и пересаживают клетки в культуральные чашки, пригодные для микроскопии живых клеток (чашки для культивирования со стеклянным покровным стеклом No 1,5, см. Таблицу материалов). Засейте 0,4 x 10 6-0,7 x 106 ячеек на чашки, чтобы достичь слияния ~60%-75% на покровном стекле во время визуализации.
ПРИМЕЧАНИЕ: Покрытие поли-D-лизином, как описано в шаге 2.1, рекомендуется для HEK293A ячеек. - На следующий день (через 48 ч после трансфекции) сделайте снимок клеток.
6. Исследование состояния гликозилирования ATG9A
- Посев HEK293A клеток (или клеток выбора) в 10-сантиметровую чашку для тканевой культуры, чтобы они достигли ~80% слияния на следующий день, если планируется исследовать эндогенный ATG9A, который обычно дает 1,5 x 10 6-2,5 x 106 клеток в 10 мл. В качестве альтернативы, засейте клетки так, чтобы они достигли ~65%-70% слияния при трансфекции конструкций ATG9A, что обычно дает 1 x 10 6-1,5 x 106 клеток в 10 мл.
- На следующий день обработайте клетки циклогексамидом в дозе 100 мкг/мл (CHX, см. таблицу материалов) или препаратом. Инкубируйте в течение 24 часов (или до желаемого момента времени).
- Извлеките клетки из инкубатора, аспирируйте среду и положите на лед. Замените его 5 мл ледяного 1x PBS. Физически отделите клетки от чашки с помощью скребка для клеток и пипетируйте раствор PBS-клеток в пробирку с коническим дном объемом 15 мл. Центрифуга при 800 x g в течение 5 мин при 4 °C, чтобы гранулировать клетки.
- Аспирируют надосадочную жидкость и ресуспендируют клетки в ~100 мкл (в зависимости от размера клеточной гранулы) ледяного буфера для лизиса TNTE (1% Triton, 150 мМ NaCl, 20 мМ Tris-HCl, pH 7,4, 0,5 мМ ЭДТА) с добавлением таблеток-коктейлей ингибитора протеазы (см. Таблицу материалов) и переносят в микроцентрифужную пробирку объемом 1,5 мл.
- Инкубируйте лизат на льду в течение 15 минут. После этого центрифугируют лизат при 20 000 x g в течение 10 мин при 4 °C для осаждения ядер и нерастворимого мусора и переносят надосадочную жидкость в свежую микроцентрифужную пробирку.
- Количественно определите концентрацию белка лизата с помощью метода Брэдфорда20 и спектрофотометра, который может измерять на длине волны 595 нм.
- Нормализуйте количество белка и смешайте 16 мкл лизата (содержащего в общей сложности не более 100 мкг белка) с 5-кратным буфером PNGase F (пептид: N-гликозидаза F) в соответствии с инструкциями производителя перед добавлением 1 мкл фермента PNGase F (см. таблицу материалов). Инкубируйте в соответствии с инструкциями производителя PNGase F.
- Добавьте объем буфера для образца 3x Laemmli для достижения концентрации 1x и инкубируйте при 65 °C в течение 5 минут перед загрузкой для электрофореза с использованием геля из трис-ацетата для максимального разделения белков. Переносят белки из геля на подходящую мембрану (например, ПВДФ [поливинилидендифторид]), используя стандартные протоколы вестерн-блоттинга21 (см. таблицу материалов).
ПРИМЕЧАНИЕ: Кипячение образцов при 95 °C приведет к агрегации ATG9A, что снизит обнаружение ATG9A. - Проводят вестерн-блот с использованием специфических антител к ATG9A (антитела STO-215, собственного производства1) (см. Таблицу материалов). Оставьте участок мембраны с более высокой молекулярной массой неразрезанным, чтобы визуализировать частицы с более высокой молекулярной массой ATG9A.
Representative Results
ATG9A представляет собой трансмембранный белок, связанный с несколькими внутриклеточными мембранными компартментами 8,17,22,23,24. В базальных условиях ATG9A в основном локализуется в транс-сети Гольджи (TGN), на что указывает иммунофлуоресценция эндогенного белка и перекрытия с GM130, цис-маркером Гольджи (рис. 1A), а также в небольших везикулах, которые частично перекрываются с компартментом эндоцитарной рециркуляции (ERC)23. Локализация ATG9A в Гольджи может быть обнаружена с помощью различных иммунофлуоресцентных протоколов. Тем не менее, везикулярная фракция ATG9A, а также изменение ее локализации, в частности, увеличение везикулярного пула, в ответ на специфические стимулы, такие как голодание питательных веществ и сыворотки, могут быть довольно изменчивыми по интенсивности и трудно визуализироваться с помощью традиционных методов визуализации. Соотношение между ATG9A, локализованным в точке Гольджи, и ATG9A, локализованным в везикулярной фракции, называется скоростью дисперсии ATG9A. Для обнаружения изменений в скорости диспергирования ATG9A, например, при обработке EBSS, которая используется для истощения как сыворотки, так и аминокислот, полезны маркер Гольджи, такой как GM130 или TGN46, и маркер цитоскелета, такой как фаллоидин, который окрашивает контур клетки25, для быстрого количественного определения дисперсии ATG9A (рис. 1B). Важно отметить, что анализ среднего коэффициента флуоресценции можно интерпретировать только как сравнительную меру между условиями, а не как фиксированную скорость рассеивания. Соотношение между компартментами сильно зависит от биологических и небиологических факторов, таких как используемая клеточная линия, качество окрашивания или применяемые методы определения пороговых значений (рис. 1B). По этой причине исследователю необходимо настроить конвейер, способный обнаруживать обогащение ATG9A Гольджи в конкретных экспериментальных условиях, а затем распространять анализ с теми же параметрами на все изображения в анализируемом наборе. Репрезентативные бинарные изображения и области, выбранные для анализа средней флуоресценции ATG9A, показаны в качестве ориентира на рисунке 1B.
ATG9A содержит несколько трансмембранных доменов, окруженных двумя относительно гибкими и неструктурированными N- и C-концевыми доменами, из которых С-концевая последовательность охватывает почти половину белка12. Важно отметить, что на характер локализации гиперэкспрессии ATG9A может влиять то, какой конец белка помечен (рис. 2A). В частности, при использовании систем переходной экспрессии и маркировке ATG9A непосредственно на его N-конце флуоресцентной меткой (например, eGFP, mRFP или производными) его локализация Гольджи может быть частично нарушена, при этом меньшее обогащение наблюдается в базальных (т.е. вскормленных) условиях, в то время как везикулы ATG9A все еще хорошо видны (рис. 2A). Маркировка ATG9A на С-конце, по-видимому, немного индуцирует более крупные GFP-положительные кластеры, которые могут быть агрегированы. Наконец, мономерная версия mRFP-ATG9A также демонстрирует аналогичные флуоресцентные кластеры везикул и небольшое окрашивание по Гольджи в клетках с гиперэкспрессией (рис. 2A).
ATG9A сворачивается в мембране ER, прежде чем попасть в везикулы Гольджи и ATG9A. Во время своего пребывания в ER ATG9A модифицируется N-сцепленными гликанами на аспарагине 99, а затем, достигнув Гольджи, приобретает сложные, зрелые N-связанные гликаны 1,14. Эта модификация путем гликозилирования может быть обнаружена с помощью вестерн-блоттинга по появлению двойной полосы14. В соответствии со своей внутриклеточной локализацией, большинство эндогенных ATG9A содержат сложные N-связанные гликаны, и, следовательно, преобладает высокомолекулярная весовая полоса, а также видна слабая полоса нижнемолекулярной массы (рис. 2B). Наличие двойной полосы наиболее легко заметить при использовании трис-ацетатных гелей для улучшения разрешения высокомолекулярных белков (рис. 2B, контроль, t = 0). Когда эндогенный белок подвергается обработке PNGase F (пептид: N-гликозидаза F), которая удаляет большую часть сложных N-связанных гликанов, белок работает как одна полоса (рис. 2B, PNGase F, t = 0). Таким образом, статус N-связанного гликозилирования ATG9A может быть использован в качестве прокси для мониторинга выхода ATG9A из ER в Гольджи, что отражается относительным соотношением между двумя полосами.
При трансфектировании mRFP-ATG9A конструирует временно, сверхэкспрессированный белок первоначально накапливается в ER, возможно, из-за того, что механизм транспортировки не может сворачивать и транспортировать весь ATG9A, и преобладает полоса с более низкой молекулярной массой (рис. 2C, контрольная t = 0). Примечательно, что через 24 ч после экспрессии mRFP-ATG9A наблюдается примерно равное распределение между верхней и нижней полосами, что позволяет предположить, что пул mRFP-ATG9A перемещается в зону Гольджи (рис. 2C, контроль, t = 24). Если клетки обрабатывают циклогексимидом (CHX), который блокирует de novo синтез белка26, можно прояснить сворачивание и выход ATG9A из ER. Поскольку эндогенный белок сворачивается, гликозилируется и находится в системе Гольджи, лечение CHX существенно не изменяет соотношение низкомолекулярных и высокомолекулярных массовых полос (рис. 2B, контроль). Однако, используя переходную экспрессию mRFP-ATG9A, обработка CHX способствует накоплению более высокомолекулярной полосы массы (Рисунок 2C, Контроль, CHX t = 24). Высокомолекулярная сверхэкспрессия полосы mRFP-ATG9A после обработки PNGase F коллапсирует в нижнюю полосу (рис. 2C, PNGase F, t = 24). Эти данные показывают, что эндогенный белок быстро приобретает зрелые гликаны, что отражается в преобладании высокомолекулярной полосы, а погоня CHX не влияет на соотношение двойных полос (рис. 2Б). В случае транзиторной гиперэкспрессии mRFP-ATG9A лечение CHX индуцирует накопление верхней полосы, что указывает на то, что более зрелые гликаны приобретаются по мере того, как пул ER сворачивается и выходит из ER в Гольджи (рис. 2C).
Добавление линкера между последовательностью ATG9A и флуоресцентными метками может быть полезным для содействия более физиологической локализации и перемещению белка. Слияние последовательности 3x-FLAG (24 аминокислоты) между N-концевым флуорофором и ATG9A помогает сверхэкспрессируемому белку вести себя аналогично эндогенным (рис. 3). Действительно, гиперэкспрессия mCherry-3xFLAG-ATG9A локализуется с маркером Гольджи GM130 в условиях кормления (рис. 3A). Важно отметить, что эта локализация и везикулярный компартмент ATG9A сохраняются с течением времени, что позволяет проводить пространственно-временные исследования транспорта ATG9A (рис. 3B).
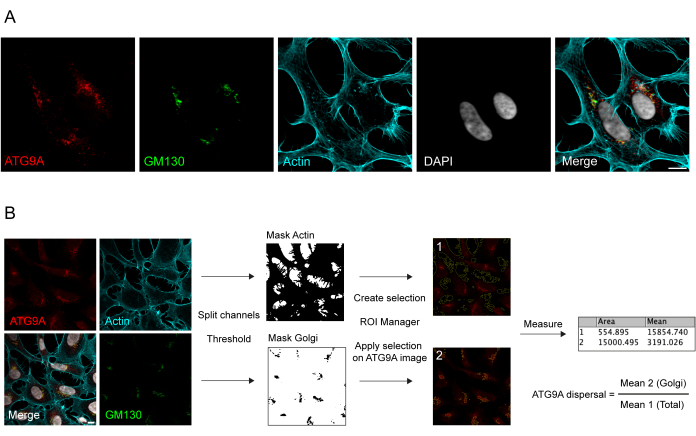
Рисунок 1: Анализ изображений эндогенной локализации ATG9A. (A) Репрезентативное иммунофлуоресцентное изображение эндогенного ATG9A (красный), GM130 в качестве маркера Гольджи (зеленый) и фаллоидина для визуализации актинового цитоскелета (голубой). Масштабная линейка = 10 мкм. (B) Рабочий процесс анализа изображений для определения фракции эндогенного ATG9A, который локализуется в области Гольджи. Масштабная линейка = 10 мкм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
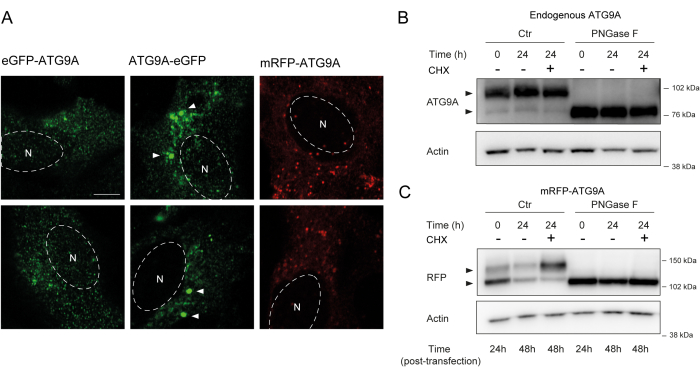
Рисунок 2: Анализ флуоресцентно меченых конструкций ATG9A по локализации и гликозилированию. (A) eGFP N-терминально меченый ATG9A менее локализован в Гольджи и в основном находится в везикулах. С-концевая метка eGFP ATG9A демонстрирует агрегаты внутри клетки (некоторые примеры отмечены белыми стрелками; eGFP-ATG9A и ATG9A-eGFP выделены зеленым цветом). mRFP N-терминально меченый ATG9A менее локализован в Гольджи и в основном находится в везикулах. N обозначает приблизительное местоположение клеточного ядра, а mRFP-ATG9A выделен красным цветом. Масштабная линейка = 5 мкм. (B) Эндогенный ATG9A выглядит как две полосы при анализе с помощью вестерн-блоттинга (стрелки): верхняя полоса (сложные N-связанные гликаны) и нижняя полоса (без зрелых N-связанных гликанов). Лечение циклогексамидом (CHX) не влияет на соотношение между верхней и нижней полосами. Лечение PNGase F вызывает исчезновение верхней полосы. (C) После транзиторной трансфекции помеченного mRFP ATG9A в HEK293A клетках на вестерн-блоттинге (наконечники стрелок) видны две заметные полосы. Лечение PNGase F вызывает исчезновение верхней полосы. Лечение CHX после трансфекции приводит к усилению гликозилирования, так как пул трансфицированного ATG9A транспортируется из ER в Гольджи. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
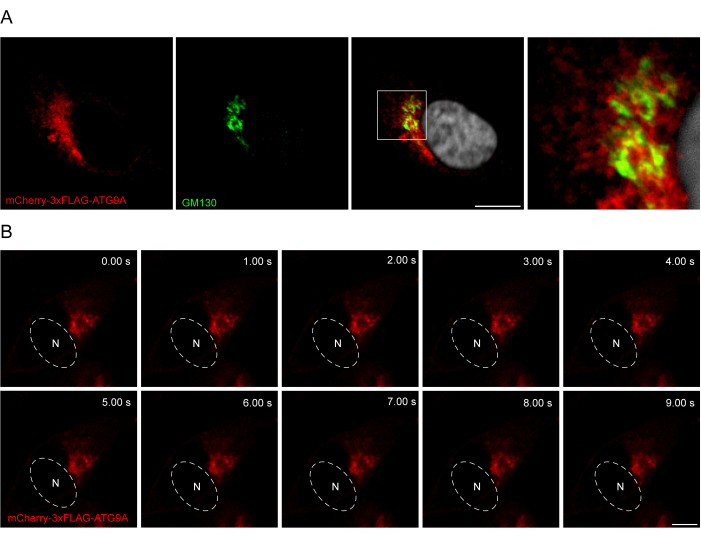
Рисунок 3: Анализ локализации mCherry-3xFLAG-ATG9A методом иммунофлуоресценции и визуализации в реальном времени. (A) Иммунофлуоресцентные эксперименты с HEK293A клетками, временно гиперэкспрессирующими mCherry-3xFLAG-ATG9A и окрашенными маркером Гольджи GM130. Масштабная линейка = 10 мкм. mCherry-3xFLAG-ATG9A выполнен в красном цвете, а маркер GM130 Golgi — в зеленом. (B) Монтаж из экспериментов по визуализации в HEK293A клетках с временной гиперэкспрессией mCherry-3xFLAG-ATG9A. N обозначает приблизительное расположение ядра. Таймфрейм = 1 кадр в секунду. Масштабная линейка = 10 мкм. mCherry-3xFLAG-ATG9A окрашен в красный цвет. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Discussion
Это исследование иллюстрирует различные инструменты, которые могут быть использованы для исследования локализации ATG9A. Во-первых, в этом исследовании описывается, как ATG9A может быть визуализирован с помощью иммунофлюоресценции и как это может быть количественно оценено. Во-вторых, сравниваются стратегии, которые могут быть использованы для маркировки ATG9A флуоресцентным маркером для визуализации как в фиксированных, так и в живых клетках. Наконец, в этой работе описывается, как исследовать и использовать состояние гликозилирования ATG9A, чтобы определить, вышел ли ATG9A из ER и прошел ли он через Гольджи.
Что касается характеристики эндогенной локализации ATG9A методом иммунофлуоресценции, необходимо соблюдать осторожность с методами фиксации и пермеабилизации, используемыми в эксперименте. В соответствии со стандартными процедурами, описанными здесь, фиксация параформальдегида в сочетании с пермеабилизацией дигитонина являются хорошими условиями для визуализации как ассоциированных с Гольджи ATG9A, так и ATG9A-положительных везикул7. Наряду с фиксацией и пермеабилизацией решающее значение имеет и время инкубации с первичным раствором антител. Мы наблюдали, но не задокументировали, что более высокие концентрации раствора первичных антител и более длительный инкубационный период могут привести к искаженному увеличению окрашивания ATG9A по методу Гольджи, что в конечном итоге ставит под угрозу обнаружение перераспределения ATG9A в другие мембранные компартменты. Кроме того, поскольку ATG9A присутствует во многих внутриклеточных компартментах 1,13,17,22,23,24,27,28, важно использовать специфические мембранные маркеры вместе с ATG9A, чтобы определить, где находится ATG9A. В прошлом для количественной оценки локализации ATG9A использовалось несколько подходов, в том числе коэффициент корреляции Пирсона для колокализации29. Однако частичное перекрытие ATG9A с Гольджи и отдельным везикулярным компартментом приводит к большому количеству пиксельных выбросов, что может исказить интерпретацию коэффициента корреляции. По этой причине предпочтительным является более упрощенный подход, основанный на соотношении средней флуоресценции в двух анализируемых компартментах, и этот подход менее чувствителен к межклеточной изменчивости. Для получения дополнительной информации об анализе изображений с помощью микроскопии читатели могут обратиться к главе30 этой книги.
При исследовании статуса гликозилирования ATG9A важен выбор гелей для проведения вестерн-блоттинга. Для этого протокола предпочтительны 3%-8% гели с трис-ацетатом, поскольку они обеспечивают самое высокое разрешение для более крупных белков, но также можно использовать альтернативные гелевые композиции или работающие буферы, которые обеспечивают хорошее разделение высокомолекулярных белков. Экспериментатор может обеспечить максимальное разделение белков, увеличив время электрофореза.
При подготовке образцов для визуализации ATG9A на вестерн-блоттинге следует соблюдать осторожность, чтобы не кипятить образцы после добавления буфера Леммили; кипячение при 95 °C индуцирует образование агрегатов ATG9A, и, следовательно, ATG9A не может эффективно мигрировать в гель1. Рекомендуется нагревать образцы при 65 °С в течение 5 мин27.
Высокие уровни трансфекции обычно приводят к более высокому накоплению ATG9A в ER, в то время как умеренные уровни экспрессии помогают физиологической локализации белка. Как ни странно, инкубационное время 72 ч вместо 48 ч часто помогает уменьшить артефакты локализации ER. Примечательно, что mRFP-ATG9A может точно сообщать о транспорте ATG9A и функционировать, если уровни контролируются с помощью уровней экспрессии или с помощью стабильных клеточных линий 8,9,22,27.
Неспособность популяции гиперэкспрессированных ATG9A получить зрелые N-связанные гликаны может быть использована в качестве считывания для возмущенного трафика ATG9A. При мутации или удалении определенных участков ATG9A существует риск повышенной задержки ER, что может привести к неудаче в получении зрелых N-связанных гликанов и, таким образом, к более быстрой миграции полосы ATG9A на вестерн-блоттинге. Исследователи, работающие с усеченными конструкциями ATG9A, должны проверять удержание ER, состояния гликозилирования и локализацию по Гольджи.
Для визуализации живых клеток ATG9A микроскоп Airyscan, основанный на функции быстрого Airyscan, обеспечивает оптимальное разрешение, как правило, около 120 нм. Для точности локализации частота кадров около 1-2 кадров в секунду (fps) в режиме сверхвысокого разрешения является оптимальной в зависимости от количества каналов изображения. Аналогичные конфокальные микроскопы, которые могут получать изображения с высокой скоростью, также могут быть использованы для визуализации везикул ATG9A; Однако следует отметить, что скорость визуализации может напрямую влиять на обнаружение событий и, следовательно, влиять на интерпретацию данных.
Таким образом, представленные протоколы описывают способы количественной оценки и характеристики локализации ATG9A методами иммунофлюоресценции, микроскопии живых клеток и статуса гликозилирования. Эти протоколы могут помочь исследователям, работающим с ATG9A, и помочь избежать некоторых подводных камней.
Disclosures
S.A.T. входит в научно-консультативный совет Casma Therapeutics.
Acknowledgements
Авторы благодарят Рокко Д'Антуоно (Rocco D'Antuono) за корректуру рукописи, а также всех нынешних и бывших сотрудников лаборатории молекулярной клеточной биологии аутофагии (MCBA) за обсуждения, которые привели к уточнению этих протоколов. A. V.V., S.D.T., E.A., S.A.T. были поддержаны Институтом Фрэнсиса Крика, который получает основное финансирование от Cancer Research UK (CC2134) и Совета по медицинским исследованиям Великобритании (CC2134). Это исследование было полностью или частично профинансировано Wellcome Trust (CC2134). В целях открытого доступа автор применил публичную лицензию CC BY к любой версии рукописи, принятой автором, возникшей в результате этой статьи.
Materials
| Name | Company | Catalog Number | Comments |
| 24 multiwell plates | Falcon | 353047 | For tissue culture |
| 35 mm Dish | No. 1.5 Coverslip | 14 mm Glass Diameter | Uncoated | MATTEK | P35G-1.5-14-C | Cell culture dish for live-cell microscopy |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 60 mm tissue culture dish | Thermofischer Scientific | 10099170 | For tissue culture |
| Alexa Fluor 647 Phalloidin | Thermofischer Scientific | A22287 | Actin stain |
| anti-ATG9A antibody | home made | STO-215 | Rabbit anti N-terminal peptide ATG9A |
| anti-Rabbit IgG, peroxidase-linked | Invitrogen | 10794347/NA934-1ml | Secondary antibody for rabbit polyclonal STO-215 |
| anti-RFP antibody | Evrogen | AB233 | for Western Blot |
| ATG9A Monoclonal Antibody (14F2 8B1), Invitrogen | Invitrogen | 15232826 | Antibody for immunofluorescence |
| ATG9A-eGFP | home made | Construct which expresses tagged ATG9A | |
| Bemis Parafilm | Thermofischer Scientific | 11747487 | self-sealing thermoplastic film |
| Bio-Rad Protein Assay Dye Reagent Concentrate | Bio-Rad | 5000006 | For determining protein concentration |
| Bovine serum albumin (BSA) | Merck | 10735086001 | For blocking non-specific labelling |
| CaCl2.2H2O | / | For PBS and EBSS | |
| cOmplete Protease Inhibitor Cocktail | Roche | 11697498001 | Supplement in lysis buffer to prevent protein degradation |
| Cy3 AffiniPure Goat Anti-Armenian Hamster IgG | Jackson ImmunoResearch | 127-165-099 | Secondary antibody for i14F2 8B1 antibody for mmunofluorescence |
| Cyclohexamide | Sigma Aldrich | 66-81-9 | To stop protein translation |
| D-Glucose | / | For EBSS | |
| Digitonin | Merck | 300410 | For permeabilizing cells |
| DMEM | Merck | D6546-6x500ml | For tissue culture |
| eGFP-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Fetal Bovine Serum | Gibco | 10270-106 | Supplement for DMEM for cell culture |
| FIJI (ImageJ) | / | https:/fiji.sc/ | Open source image analysis software |
| Hoechst | Thermofischer Scientific | H3570 | Stains the nucleus |
| KCl | / | For EBSS | |
| L-glutamine | Sigma | 67513 | For tissue culture |
| Lipofectamine 2000 | Invitrogen | 11668-019 | For Cell Transfection |
| LSM880 Airyscan microscope | Zeiss | / | Confocal microscopy |
| MgCl2 | / | For PBS | |
| MgSO4.7H2O | / | For EBSS | |
| Mowiol mounting solution | Millipore | 475904 | for permanent mounting glass coverslips |
| NaCl | / | For EBSS | |
| NaH2PO4.2H2O | / | For EBSS | |
| NaHCO3 | / | For EBSS | |
| NuPAGE 3 to 8%, Tris-Acetate, 1.5 mm, Mini Protein Gels | Thermofischer Scientific | EA0378BOX | for Western Blotting |
| NuPAGE MES SDS Running Buffer (20x) | Life Tech | NP0002 | for Western Blotting |
| Opti-MEM I Reduced Serum Medium | Thermo | 31985062 | For Cell Transfection |
| Paraformaldehyde | Agar Scientific | R1026 | For fixing cells |
| pcDNA3.1-mCherry-3xFlag-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Phosphate Buffered Saline (PBS) | / | For tissue culture | |
| PNGaseF | NEB | P0710S | To remove N-linked glycans |
| Poly-D-lysine hydrobromide mol wt 70,000-150,000 | Merck | P0899 | For coating coverslips |
| Rapid PNGase F enzyme | NEB | P07105 | To remove N-linked glycans |
| RFP-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Triton X-100 | Thermofischer Scientific | 13454259 | Detergent for Cell lysis |
| Trypsin-EDTA solution | Sigma | T4049 | For tissue culture |
| Whatman Filter Paper | Merck | WHA1001325 | For Western Blot and IF |
| XCell SureLock Mini-Cell Electrophoresis System | Invitrogen | EI0001 | For Western Blotting |
| Zen Black edition | Zeiss | / | Used to operate the LSM 880 |
References
- Young, A. R., et al. Starvation and ULK1-dependent cycling of mammalian Atg9 between the TGN and endosomes. Journal of Cell Science. 119, 3888-3900 (2006).
- Maeda, S., et al. lipid scrambling activity and role in autophagosome formation of ATG9A. Nature Structural & Molecular Biology. 27 (12), 1194-1201 (2020).
- Matoba, K., et al. Atg9 is a lipid scramblase that mediates autophagosomal membrane expansion. Nature Structural & Molecular Biology. 27 (12), 1185-1193 (2020).
- Mercer, T. J., Gubas, A., Tooze, S. A. A molecular perspective of mammalian autophagosome biogenesis. Journal of Biological Chemistry. 293 (15), 5386-5395 (2018).
- Yamamoto, H., Zhang, S., Mizushima, N. Autophagy genes in biology and disease. Nature Reviews: Genetics. , (2023).
- Sawa-Makarska, J., et al. Reconstitution of autophagosome nucleation defines Atg9 vesicles as seeds for membrane formation. Science. 369 (6508), (2020).
- Melia, T. J., Lystad, A. H., Simonsen, A. Autophagosome biogenesis: From membrane growth to closure. Journal of Cell Biology. 219 (6), 202002085 (2020).
- Orsi, A., et al. Dynamic and transient interactions of Atg9 with autophagosomes, but not membrane integration, are required for autophagy. Molecular Biology of the Cell. 23 (10), 1860-1873 (2012).
- Judith, D., et al. ATG9A shapes the forming autophagosome through Arfaptin 2 and phosphatidylinositol 4-kinase IIIbeta. Journal of Cell Biology. 218 (5), 1634-1652 (2019).
- Karanasios, E., et al. Autophagy initiation by ULK complex assembly on ER tubulovesicular regions marked by ATG9 vesicles. Nature Communications. 7, 12420 (2016).
- Koyama-Honda, I., Itakura, E., Fujiwara, T. K., Mizushima, N. Temporal analysis of recruitment of mammalian ATG proteins to the autophagosome formation site. Autophagy. 9 (10), 1491-1499 (2013).
- Guardia, C. M., et al. Structure of human ATG9A, the only transmembrane protein of the core autophagy machinery. Cell Reports. 31 (13), 107837 (2020).
- Soreng, K., et al. SNX18 regulates ATG9A trafficking from recycling endosomes by recruiting Dynamin-2. EMBO Reports. 19 (4), e44837 (2018).
- Staudt, C., Gilis, F., Boonen, M., Jadot, M. Molecular determinants that mediate the sorting of human ATG9A from the endoplasmic reticulum. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1863 (9), 2299-2310 (2016).
- Knaevelsrud, H., Carlsson, S. R., Simonsen, A. SNX18 tubulates recycling endosomes for autophagosome biogenesis. Autophagy. 9 (10), 1639-1641 (2013).
- Takahashi, Y., et al. The Bif-1-Dynamin 2 membrane fission machinery regulates Atg9-containing vesicle generation at the Rab11-positive reservoirs. Oncotarget. 7 (15), 20855-20868 (2016).
- Imai, K., et al. Atg9A trafficking through the recycling endosomes is required for autophagosome formation. Journal of Cell Science. 129 (20), 3781-3791 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- van Vliet, A. R., et al. ATG9A and ATG2A form a heteromeric complex essential for autophagosome formation. Molecular Cell. 82 (22), 4324-4339 (2022).
- Kielkopf, C. L., Bauer, W., Urbatsch, I. L. Bradford assay for determining protein concentration. Cold Spring Harbor Protocols. 2020 (4), 102269 (2020).
- Kurien, B. T., Scofield, R. H. Validating antibody specificities for immunohistochemistry by protein blotting. Methods in Molecular Biology. 2593, 21-33 (2023).
- Lamb, C. A., et al. TBC1D14 regulates autophagy via the TRAPP complex and ATG9 traffic. EMBO Journal. 35 (3), 281-301 (2016).
- Longatti, A., et al. TBC1D14 regulates autophagosome formation via Rab11- and ULK1-positive recycling endosomes. Journal of Cell Biology. 197 (5), 659-675 (2012).
- Ravussin, A., Brech, A., Tooze, S. A., Stenmark, H. The phosphatidylinositol 3-phosphate-binding protein SNX4 controls ATG9A recycling and autophagy. Journal of Cell Science. 134 (3), (2021).
- DesMarais, V., Eddy, R. J., Sharma, V. P., Stone, O., Condeelis, J. S. Optimizing leading edge F-actin labeling using multiple actin probes, fixation methods and imaging modalities. BioTechniques. 66 (3), 113-119 (2019).
- Ennis, H. L., Lubin, M. Cycloheximide: Aspects of inhibition of protein synthesis in mammalian cells. Science. 146 (3650), 1474-1476 (1964).
- Webber, J. L., Tooze, S. A. Coordinated regulation of autophagy by p38alpha MAPK through mAtg9 and p38IP. EMBO Journal. 29 (1), 27-40 (2010).
- Claude-Taupin, A., et al. ATG9A protects the plasma membrane from programmed and incidental permeabilization. Nature Cell Biology. 23 (8), 846-858 (2021).
- Aaron, J. S., Taylor, A. B., Chew, T. L. Image co-localization - Co-occurrence versus correlation. Journal of Cell Science. 131 (3), 211847 (2018).
- D'Antuono, R., Nechyporuk-Zloy, V. Basic digital image acquisition, design, processing, analysis, management, and presentation. Principles of Light Microscopy: From Basic to Advanced. , 77-104 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved