התחדשות סולם דגי זברה בתרבות הקשקשים של טוטו ואקס ויוו
In This Article
Summary
פרוטוקול זה מתאר את הקציר וההדמיה של קשקשים אלסמואידים של דגי זברה במהלך התחדשות in vivo . בנוסף, תרבות ex vivo של קשקשים אלה עד 7 ימים לאחר הקציר מוצג.
Abstract
מחלות שלד הן לעתים קרובות מורכבות באטיולוגיה שלהן ומשפיעות על מיליוני אנשים ברחבי העולם. בשל הזדקנות האוכלוסייה, יש צורך בטיפולים חדשים שיוכלו להקל על העומס על מערכות הבריאות. מכיוון שמחלות אלה מורכבות, קשה ויקר למדל במדויק את הפתופיזיולוגיה של העצם בתנאי מעבדה. האתגר של התחום הוא להקים פלטפורמה חסכונית ורלוונטית ביולוגית למידול מחלות עצם שניתן להשתמש בה כדי לבחון תרכובות טיפוליות פוטנציאליות. פלטפורמה כזו צריכה לאפשר באופן אידיאלי הדמיה דינמית של התנהגויות תאים של אוסטאובלסטים בוני עצם ואוסטאוקלסטים משפילי עצם הפועלים בסביבת המטריצה המינרלית שלהם. דגי זברה משמשים יותר ויותר כמודלים בשל זמינותם של כלים גנטיים, כולל קווי כתב טרנסגניים, והעובדה שחלק מרקמות השלד (כולל הקשקשים) נשארות שקופות לבגרות, מה שמאפשר אפשרויות הדמיה דינמיות. מכיוון שלקשקשים של דגי זברה יש גם אוסטאובלסטים וגם אוסטאוקלסטים והם נפוצים מאוד, הם מספקים משאב נגיש וזמין בשפע של יחידות עצם עצמאיות. יתר על כן, לאחר הסרתם, קשקשי דגי הזברה הבוגרים מתחדשים במלואם, ולכן מציעים דרך לחקור את הצמיחה המרחבית-זמנית של רקמה מינרלית in vivo. כאן, אנו מפרטים פרוטוקולים לקציר ומעקב אחר התחדשות הקשקשים. לבסוף, מוצג גם פרוטוקול לתרבית יציבה של קשקשים ex vivo למשך שבוע ולאחר תגובת הריפוי לאחר נזק מבוקר למטריצה המינרלית של הסולם לאורך זמן.
Introduction
עצם היא רקמת חיבור קשה המהווה חלק עיקרי מהשלד, מאפשרת תנועה ומשמשת כמאגר מינרלים בגוף. על מנת לשמור על עצם בריאה, איזון מעולה בין היווצרות עצם והתפרקות חיוני באמצעות פעילות מצומדת של אוסטאובלסטים (שהם אנבוליים) ואוסטאוקלסטים (אשר סופחים את העצם). איזון זה מופר על ידי הזדקנות או חוסר איזון הורמונלי, המוביל לעתים קרובות למחלות שבריריות עצם כגון אוסטאופורוזיס1. למרות שהתרופות הקיימות אושרו לטיפול במחלות שבריריות עצם, לרבות מהן יש תופעות לוואי; לכן, יש צורך בטיפולים חדשים1. לפיכך, נותר צורך בשפע מקורות של רקמת עצם רלוונטית ביולוגית שניתן להשתמש בהם כדי לבחון תרכובות טיפוליות פוטנציאליות.
באופן מסורתי, מודלים של מכרסמים ומערכות תרביות תאים שימשו לחקר ביולוגיה של העצם. עם זאת, דגי זברה הופכים יותר ויותר למודל בחירה נוסף. למרות שאינם מערכת יונקים, דגי זברה מציעים יתרונות מסוימים לחקר העצם על פני מכרסמים; אלה כוללים את פריותם ואת שקיפותם של הזחלים; אפילו בבגרות, חלק מרקמות השלד, כולל הקשקשים והסנפירים, נשארות שקופות, מה שמאפשר דימות in vivo ברזולוציה גבוהה וזמינות מוגברת של מוטציות שלד 2,3. הן הסנפירים והן הקשקשים של דגי הזברה מסוגלים להתחדשות מלאה לאחר הסרתם. התחדשות השלד ותיקון פציעות של סנפירי דגי זברה נחקרו בהרחבה 4,5, בעוד שקשקשי דגי זברה הם מודל עצם חדש יותר בתחום, אך מציעים יתרונות לתרבית ex vivo 6.
הקשקשים נפוצים מאוד, עם לפחות 300 קשקשים על כל דג המשמשים ככיסוי מגן לדגים. כל סולם הוא צלחת מינרלית קטנה המורכבת מאוסטאובלסטים יוצרי עצם ואוסטאוקלסטים סופחי עצם של מטריצת שלד עשירה בקולגן7. תהליך האוסיפיקציה של קשקשי דגי הזברה ועצמות האדם דורש התמיינות של תאי גזע מזנכימליים לאוסטאובלסטים כדי ליצור את המטריצה המינרלית. קשקשי דגי זברה מציעים יתרון גדול לחקר השלד עם יכולת ההתחדשות החזקה שלהם שניתן להשתמש בה כדי לחקור התחדשות ותיקון עצם. עם זאת, למרות נוכחותם של אוסטאובלסטים ואוסטאוקלסטים, קשקשי דגי זברה חסרים אוסטיאוציטים החשובים לעיצוב מחדש של העצם האנושית ולמכנוסנסציה; המיקום השטחי של הקשקשים אומר שניתן להסיר אותם בקלות עם זוג מלקחיים. עם הסרת הסולם, מתרחשת שרשרת של אירועים, והתחדשות קנה המידה מתחילה 8,9. קיימות אפשרויות צביעה והדמיה שונות כדי להמחיש את הפעילות של אוסטאובלסטים ואוסטאוקלסטים ואת המינרליזציה של הקשקשים, כפי שמוצג באיור 1. בנוסף, הזמינות של שורות כתבים טרנסגניות פלואורסצנטיות רלוונטיות רבות של דגי זברה פירושה שניתן לדמיין דינמיקה של תאים במהלך התחדשות 7,10,11. תהליך זה מאפשר להבין טוב יותר את היווצרות העצם דה נובו על ידי התבוננות בדפוסים המוקדמים של התחדשות אבנית על צלע הדג כדי לחקור מורפולוגיה, פעילות תאית ופרופילים גנטיים של קשקשים מתחדשים אלה. הביולוגיה של היווצרות אבנית והתחדשות אופיינה היטב. חשוב לציין, קשקשים יכולים להראות יכולת ניבוי טובה עבור תרכובות רלוונטיות מבחינה טיפולית12 וטיפול בדגים עם גלוקוקורטיקואידים מוביל לסולם שמתחדש כדי להראות פנוטיפים אוסטיאופורוטיים13. התעתיק של סולמות ההתחדשות מראה כי גנים המופעלים בהתחדשות אבנית מועשרים עבור אלה הקשורים למחלות שלד אנושיות, מה שמדגים עוד יותר את הרלוונטיות שלהם כמערכת מודל 6,14.
לבסוף, קשקשים אלה יכולים להיות בתרבית ex vivo עד 7 ימים. בהשוואה לתרביות קו תאים המורכבות בדרך כלל מסוג תא יחיד, תרבית בקנה מידה Ex vivo מספקת הזדמנויות מחקר עצם במבחנה בסביבתה הטבעית המכילה הן אוסטאובלסטים והן אוסטאוקלסטים עם המטריצה החוץ תאית הטבעית שלה 8,12,15,16.
תרבית קנה המידה גם מאפשרת לנו לבצע בדיקות סמים עבור מטרות אוסטאואנאבוליות חדשות. שפע הקשקשים על הדג פירושו שניתן למלא לפחות שתי צלחות של צלחת 96 בארות מדג אחד בלבד, מה שמאפשר סינון מורכב בפורמט רב בארות שבו כל באר מכילה קנה מידה אחד יחד עם נישה טבעית של תאים. בנוסף, מכיוון שהמאזניים דקים, ספיגת התרופות צפויה12. לסיכום, לקשקשים האלסמואידים של דגי הזברה יש פוטנציאל גדול במחקר השלד והם יכולים לעזור לנו לקבל תובנה נוספת לגבי האירועים התאיים במהלך היווצרות ותיקון העצם. כאן, אנו מתארים פרוטוקולים לקציר קשקשים כדי לעקוב אחר התחדשות in vivo ותרבות את המאזניים ex vivo.
Protocol
היחידה המדעית של בעלי חיים באוניברסיטה (ASU) אחראית לטיפול בדגי זברה בהנחיית הנחיות גידול דגי זברה. כל ההליכים, כולל קצירת אבנית, צביעת עצם חיה והדמיה חיה, אושרו ובוצעו תחת רישיון פרויקט משרד הפנים הבריטי (PP4700996). עבור כתב יד זה, דגי זברה טרנסגניים בוגרים צעירים מקו sp7:mCherry [Tg(osterix:mCherry-NTR)pd46] שימש17. הדג כלל זכרים ונקבות בני 4 חודשים.
1. התחדשות בקנה מידה In vivo
- לפני תחילת ניסוי התחדשות קנה המידה, העבירו דגי זברה מהמכלים הראשיים שלהם למכלים נפרדים (ראו טבלת חומרים) וחזרו למכלים הבודדים האלה לאחר הדמיה לאורך כל הניסוי, כפי שמוצג באיור 2. זאת כדי להבטיח שכל קשקשי ההתחדשות הם אלה שנקצרו לצורך הניסוי; דיור קבוצתי יכול להוביל לאובדן ספורדי של קשקשים עקב פציעות הנגרמות על ידי דגים אחרים.
הערה: הדגים ממוקמים בנפרד כדי למנוע לחימה ואובדן אבנית בין דגים. - רשום מידע עבור כל דג ניסוי (כלומר, גנוטיפ, גיל ומין) בהתאם לתכנון הניסוי. השתמש במצלמה (מצלמות סמארטפון עובדות מצוין) כדי לצלם תמונה של כל דג ליד סרגל כדי לתעד את גודל/אורך הדג ואת מצבו הבריאותי.
- ביום הניסוי, הרדימו את דגי הזברה באמצעות 0.05% (v/v) טריקאין מתאן סולפונט (MS222, ראו טבלת חומרים) על ידי טבילה, ולאחר מכן הניחו אותו על צלחת פטרי עם רקמה לחה כדי למנוע תזוזה של הדג במהלך הדמיה או קציר.
- הניחו את הדג על צידו (בדרך כלל משתמשים כאן באגף שמאל לשמירה על עקביות). בצע הדמיה אגפית באמצעות סטריאומיקרוסקופ עם הגדלה מתאימה (בדרך כלל, 2x, 4x, ו / או 6.3x ו 8x שימשו במחקר הנוכחי כדי ללכוד הן את האזור המתחדש הכולל והן את האזור המוגדל לתצפית מפורטת).
הערה: נקודות הזמן של הדמיה מאגף תלויות במטרת הניסוי ובבחירת הכתבים המהונדסים. לדוגמה, כדי לעקוב אחר אוסטאובלסטים במהלך התחדשות קנה מידה, נקודות הזמן המוצעות הן יום 0 (אונטוגנטי), יומיים לאחר הקציר (dph), 4 dph, 7 dph, 10 dph, 14 dph, 21 dph. כדי להפחית את ההשפעות של הרדמה חוזרת, שמור על נקודות זמן הדמיה מינימליות ככל הנדרש לניסוי. - קצרו קשקשים באמצעות פינצטה ומלקחיים עדינים מתחת לסטריאומיקרוסקופ. מעבירים את הקשקשים שנקטפו לצינורות איסוף להכתמת אבנית מאוחר יותר.
הערה: המספר המרבי של מאזניים שניתן לקצור יהיה תלוי באישורים אתיים מקומיים הקיימים. בדרך כלל אנו קוצרים כ-20 עד 30 קשקשים ואוספים אותם לצינורות איסוף נפרדים לצורך צביעת אבנית מאוחר יותר, כגון ALP, von Kossa14. - אסוף את הקשקשים לתוך צינור איסוף של 1.5 מ"ל או 2 מ"ל. זה תלוי בטכניקת הצביעה בה משתמשים.
- הן עבור צביעת ALP והן עבור צביעת פון קוסה, העבירו את הקשקשים לצינורות איסוף המכילים מים שעברו דה-יוניזציה, ואילו עבור צביעת TRAP או אימונוהיסטוכימיה, העבירו את הקשקשים לצינורות איסוף המכילים 4% PFA (תמיסת קיבוע).
- אופציונלי: לפני העברת מאזניים לצינורות, צלם תמונות של קשקשים בודדים שנקטפו במידת הצורך.
הערה: נקודות הזמן המומלצות לקציר קנה מידה הן יום 0 (אונטוגנטי), יום 10 ויום 21 (סולמות מתחדשים).
2. צביעת עצם חיה
הערה: צביעת שלד חי יכולה להתבצע גם כאשר דגי ניסוי אינם מהונדסים עבור כתבים פלואורסצנטיים או כאשר הם נושאים כתבים טרנסגניים בצבע יחיד. צביעה חיה יכולה לשמש כדי להשלים טרנסגניות; לדוגמה, ניתן להשתמש בכתב אוסטאובלסט כגון SP7/OSX בצבע אחד (למשל, GFP), ואז להכתים עצם באדום עם אדום אליזרין (AR). AR ו calcein ירוק יכול לשמש עבור אותם דגים יחד; בתרחיש זה, AR משמש כדי לתייג עצם מקורית או אונטוגנטית על ידי קשירה למטריצה מינרלית של עצם מיושנת, וקלצאין נקשר ליוני סידן הנמצאים בשפע בעצם שזה עתה נוצרה. לדוגמה, בעת צביעת סולם אונטוגנטי, AR ניתן לדמיין, אבל calcein ירוק עשוי להיות נעדר או מינימלי מאז קשקשים אונטוגנטיים יש רמות נמוכות של היווצרות עצם חדשה.
- בצע צביעה חיה של אדום אליזרין (AR).
- הכינו בקבוק של 2x תמיסת צביעה AR על ידי ערבוב 0.5% (w/v) מלאי תמיסת אליזרין (10 מ"ל) עם 10 מ"ל של 1 M ציר HEPES (ריכוז סופי, 10 mM) (ראה טבלת חומרים).
- מלאו עד 1 ליטר בתמיסת Danieau אחת (ראו טבלת חומרים). הפתרון חייב להישמר בחושך או עטוף בנייר כסף.
- ביום הניסוי, הביאו 500 מ"ל של תמיסת 2x AR למתקן דגי הזברה, והוסיפו 500 מ"ל של מי מערכת (מהאקווריום) כדי ליצור פתרון AR עובד 1x.
- מעבירים דגים מהמכלים שלהם לתמיסת צביעה AR עובדת 1x ומשאירים למשך 15-20 דקות. שטפו את הכתם העודף על הדג עם 15 דקות 'שטיפה' במי המערכת.
- בצע צביעה חיה של Calcein Green.
- הכינו בקבוק של תמיסת צביעה ירוקה 2x Calcein על ידי הוספת 45 מ"ג אבקת Calcein לתוך 900 מ"ל של 1x תמיסת Danieau (ראה טבלה של חומרים). השתמשו במערבל מגנטי כדי לאפשר לאבקה להתמוסס לחלוטין.
- כוונן את ה- pH ל- 8. זהו פתרון 2x מניות Calcein ירוק. ניתן לאחסן את התמיסה בחושך/לעטוף בנייר כסף עד חודש.
- ביום הניסוי, הביאו 500 מ"ל של 2x תמיסת Calcein Green למתקן דגי הזברה, והוסיפו 500 מ"ל של מי מערכת כדי ליצור פתרון Calcein Green עובד 1x. מומלץ להשתמש בתמיסת צביעת קלצין טרייה.
- מעבירים דגים מהמכלים שלהם לתמיסת צביעה ירוקה Calcein עובדת 1x ומשאירים למשך 1-2 שעות. בהתאם לגודל הדג, ייתכן שיהיה צורך בזמן צביעה ארוך יותר.
- שטפו את הכתם העודף על הדג על ידי 15 דקות 'שטיפה' במי המערכת.
הערה: דמיינו את הדג המוכתם בירוק קלצין בהקדם האפשרי מכיוון שכתם זה ידהה תוך מספר שעות.
3. צביעת פוספטאז אלקליין (ALP) על קשקשים לאחר הקציר
- הכן את תמיסת צביעת ALP על ידי ערבוב 100 mM Tris (pH 9.5 עם HCl) עם 100 mM NaCl ו- 50 mM MgCl2.
- השתמש בפתרון מניות NBT/BCIP הזמין מסחרית (ראה טבלת חומרים).
- מעבירים את הקשקשים לצינורות המכילים מים שעברו דה-יוניזציה.
- שטפו את הקשקשים בתמיסת צביעת ALP במשך 5 דקות.
- בינתיים, הכינו תמיסת צביעה עובדת על ידי הוספת 200 מיקרוליטר של תמיסת NBT/BCIP ל-10 מ"ל של חיץ צביעת ALP. זה צריך להיות מוכן טרי בזמן הכתמה.
- הכתימו את הקשקשים עם תמיסת צביעת ALP עובדת למשך 15 דקות.
- עצור את התגובה על ידי שטיפת הקשקשים עם מים deionized.
4. צביעת פון קוסה על מאזניים לאחר הקציר
- הכינו תמיסת כסף חנקתי 5% (w/v).
- הכינו תמיסת נתרן תיוסולפט 5% (w/v).
- העבירו קשקשים שנקטפו לצינורות המכילים מים שעברו דה-יוניזציה.
- דגרו על הקשקשים בתמיסת כסף חנקתי במשך 40 דקות תחת אור חזק.
הערה: יש ללבוש ציוד מגן אישי (PPE) מכיוון שחנקת כסף משאירה כתם שקשה להסיר. - שטפו את הקשקשים פעמיים במשך 5 דקות עם מים נטולי יונים.
הערה: יש לאסוף ולסלק פסולת כסף חנקתי בהתאם להנחיות המקומיות. - דוגרים על הקשקשים בנתרן תיוסולפט במשך 5 דקות.
- שטפו את הקשקשים פעמיים במשך 5 דקות עם מים נטולי יונים.
5. צביעת מלכודת קולורימטרית
הערה: לנוהל המפורט, עיין בעבודה18 שפורסמה בעבר.
- הכינו את פתרונות הצביעה.
- הכינו תמיסת פוספט 10 מ"ג/מ"ל נפתול AS-MX.
- שקלו 5 מ"ג נפתול AS-MX פוספט (ראו טבלת חומרים).
- במכסה האדים, הכינו צינור עם 0.5 מ"ל של N, N'-dimethylformamide והמיסו 5 מ"ג של נפתול AS-MX פוספט ב-0.5 מ"ל של N, N'-dimethylformamide כדי ליצור תמיסת מלאי של 10 מ"ג/מ"ל של נפתול AS-MX פוספט (נערו בעדינות).
- הכן 1.6 מ"מ של תמיסת מלאי LB אדומה אדומה מהירה בטרטרט נתרן של 50 מ"מ.
- הכן 50 מ"ל של 0.1 M נתרן אצטט ב pH 5 (להוסיף 0.41015 גרם של אצטט נתרן ב 50 מ"ל של מים deionized ולהתאים את ה- pH ל 5 עם 100% חומצה אצטית).
- להמיס 0.575 גרם נתרן L-טרטרט דיבייסיק דיהידרט (ראה טבלת חומרים) ב 50 מ"ל של 0.1 M נתרן אצטט חיץ (pH = 5).
- מוסיפים 30 מ"ג של מלח LB סגול אדום מהיר.
- הכן PBS-0.1Tx (להמיס 500 μL של Triton-X ב 500 מ"ל של PBS).
- הכן PBS-0.1Tw (להמיס 500 μL של Tween-20 ב 500 מ"ל של PBS).
- הכינו תמיסת פוספט 10 מ"ג/מ"ל נפתול AS-MX.
- הכן פתרון TRAP עובד.
- ערבבו את שתי תמיסות הסטוק יחד במכסה האדים (0.5 מ"ל של תמיסת פוספט Naphthol AS-MX של 10 מ"ג/מ"ל ו-50 מ"ל של תמיסת מלאי LB של 1.6 מ"מ Fast Red Violet ב-50 מ"מ נתרן טרטרט).
הערה: כעת ניתן להשתמש בפתרון העבודה מחוץ למכסה המנוע. ניתן לאחסן אותו במקרר (עטוף בנייר כסף) עד חודש. יש לאחסן במיכלים נפרדים מנוגדנים או ריאגנטים אחרים הרגישים לקיבוע. יש להרחיק מאור ככל האפשר. - אופציונלי: הכנת תמיסת הלבנה (על דגימות קבועות שהוכתמו ב-TRAP) ב-PBS ו-0.1% Tween-20 (PBS-0.1%Tw).
- הכינו תערובת בריכוז סופי של 0.5% אשלגן הידרוקסידי (KOH) (מ-10% תמיסת מלאי (w/v)) ו-3% מי חמצן (H2O2) (33% תמיסת מלאי, מאוחסנת במקרר).
- ערבבו את שתי תמיסות הסטוק יחד במכסה האדים (0.5 מ"ל של תמיסת פוספט Naphthol AS-MX של 10 מ"ג/מ"ל ו-50 מ"ל של תמיסת מלאי LB של 1.6 מ"מ Fast Red Violet ב-50 מ"מ נתרן טרטרט).
- בצע קיבוע לדוגמה.
- תקן מאזניים ב-4% PFA ב-1x PBS המתנדנד או מסתובב במשך 40 דקות בטמפרטורת החדר (RT).
- יש להסיר את ה-4% PFA ולשטוף עם PBS-0.1Tx לפחות 3 פעמים למשך 5 דקות כל כביסה.
- יש לעבור ישירות לצביעת TRAP (הגישה הטובה ביותר) או לאחסן ב-PBS-0.1 Tx למשך הלילה.
- בצעו צביעת TRAP של הקשקשים.
- הסר את פתרון PBS-0.1 Tx והוסף את פתרון העבודה TRAP colorimetric (שלב 5.2.1) כדי לכסות את הדגימות במלואן (כלומר, 1 מ"ל בצינור מיקרוצנטריפוגה של 1.5 מ"ל).
- דוגרים במשך 1-2 שעות ב- RT, מתנדנדים בחושך.
- הסירו את תמיסת הצביעה ושטפו לפחות 3 פעמים עם PBS-0.1 Tw למשך 5 דקות כל כביסה.
- לאחר תיקון הדגימות ב- 4% PFA למשך 30 דקות ב- RT, תוך נדנוד עדין בחושך.
- הסר את תמיסת ה- PFA על-ידי שטיפה 3 פעמים עם PBS-0.1 Tw למשך 5 דקות כל שלב.
הערה: ניתן לאחסן את הדגימות (בתמיסות אחסון/הרכבה על שקופיות מיקרוסקופ) בטמפרטורה של 4°C בחושך ללא הגבלת זמן.
6. הרכבה של קשקשים מוכתמים
- הכינו את אמצעי ההרכבה על ידי הוספת 2.4 גרם גבישי Mowiol 4-88 ל-6 גרם גליצרול (ראו טבלת חומרים). ניתן להשתמש בכל מדיית הרכבה מועדפת.
- מוסיפים 6 מ"ל מים נטולי יונים, ומשאירים על מערבל מגנטי למשך שעה.
- מוסיפים 12 מ"ל של 0.2 M Tris (pH 8.5) ודגרים בטמפרטורה של כ-53 מעלות צלזיוס עד שגבישי Mowiol מתמוססים במלואם.
- להבהיר את הפתרון על ידי צנטריפוגה ב 2000 x גרם במשך 20 דקות בטמפרטורת החדר.
- העבר את הפתרון לגורם מכיל לאחסון. את אמצעי ההרכבה ניתן לשמור במקפיא במשך כ -12 חודשים. פתרון Mowiol מופשר יציב עד חודש אחד.
- הרכיבו את הקשקשים על שקופית מיקרוסקופ בהרכבה על המדיום, כסו אותם בכיסוי וצפו בהם תחת מיקרוסקופ.
7. תרבות אקס ויו של מאזניים
הערה: שלב זה נלקח מ- de Vrieze et al.12.
- לפני קציר הקשקשים בסביבה סטרילית, מכינים את המדיום האוסטאוגניואת צלחת התרבית.
- מדיום תרבית אוסטאוגנית (OCM): בצינור צנטריפוגה סטרילי, יש לייצר 15 מ"ל OCM במדיום תרבית תאים סטנדרטי (גלוקוז גבוה, ללא גלוטמין, ללא פנול אדום) בריכוזים הסופיים של 1% סרום עגל בקר, 1% (200 מילימול L-אלניל-L-גלוטמין דיפפטיד ב-0.85% NaCl), 1% תמיסה אנטיביוטית/אנטי-מיקוטית (100x), 4 mM CaCl2, 10 mM β-גליצרופוספט, 1 ננומטר נתרן פירובט ו-1% אמפוטריצין B (אופציונלי) (ראה טבלת חומרים).
- יוצקים את OCM לתוך מאגר מגיב סטרילי, ובאמצעות פיפטה רב ערוצית, להוסיף 100 μL לכל באר של צלחת 96 באר.
- אוטמים את הצלחת בעלת 96 הבארות ומאחסנים את הצלחת. OCM ניתן לאחסן במקרר לתקופה קצרה (לילה עד שבוע) ולשמור על 28 ° C לפני השימוש.
- בצע קציר אבנית ושטיפת PBS.
- קוצרים את הקשקשים באמצעות פינצטה/מלקחיים סטריליים ומפקידים אותם בצלוחית פטרי המכילה תמיסת PBS סטרילית.
- בצע הגדרת לוחית.
- מעבירים כל סולם מצלחת הפטרי לכל באר על צלחת 96 בארות עם 100 μL של OCM (מחומם ל 28 ° C) באמצעות מלקחיים סטריליים.
- לאחר שכל הקשקשים מועברים לצלחת, הביאו את הצלחת תחת סטריאומיקרוסקופ. השתמשו בקצה פיפטה דק וסטרילי כדי להזיז בעדינות כל סולם לתחתית הבאר ולהרחיק אותם מהצד של הבארות כדי למנוע השתקפות אור במהלך רכישת התמונה.
הערה: שלב זה נדרש רק אם אתה מבצע הדמיה חיה. - העבירו בזהירות את הצלחת לאינקובטור או למערכת הדמיה חיה (LIS, ראו טבלת חומרים) (נקבעו על 28°C, 5% CO2), שם ניתן לגדל את הקשקשים בתרבית עד 7 ימים.
- רענן OCM (אופציונלי).
- מחממים את ה-OCM שאוחסן במקרר ל-28°C.
- מעבירים בזהירות את צלחת 96 הבארות לסביבה סטרילית. באמצעות פיפטה רב ערוצית, לשאוף 50 μL מכל באר. לשם כך, לחצו את הקצוות על הקירות ואל תטבלו אותם עד לתחתית כדי למנוע שאיפה/הזזה/הסרת הקשקשים. השתמש בעצות חדשות למצבים שונים.
- יוצקים את OCM לתוך מאגר מגיב סטרילי, ובאמצעות פיפטה רב ערוצית להוסיף 60 μL של OCM לכל באר.
- הניחו את הצלחת מתחת לסטריאומיקרוסקופ ובדקו אם יש קשקשים שאינם במקומם (קרוב מדי לדפנות, צף או במצב אנכי בתוך המדיה). מקמו אותם מחדש עם קצה פיפטה דק וסטרילי במידת הצורך.
- מחזירים את הצלחת לאינקובטור/LIS.
הערה: אין לרענן את המדיום אם הניסוי כולל שעון ביולוגי (CR), מכיוון שהלם בסרום יכול להשפיע על השעון הביולוגי. שים לב אם לומדים CR מציין כי תנאי האור גם לאפס את השעון.
- ביצוע צביעה והדמיה בקנה מידה לאחר תרבית (אופציונלי).
- לאחר 6 ימים של תרבות, לתקן אותם ולכוון אותם עבור כתמים מתאימים כגון פון Kossa ו ALP שהוזכרו לעיל.
- לחלופין, אם לדגי הניסוי יש תג פלואורסצנטי, הכניסו את הצלחת למערכת הדמיה חיה.
הערה: אם אתה משתמש במערכת הדמיה חיה, ודא שהיא מוגדרת לטמפרטורה ולרמת CO2 המתאימה לניסוי. בדרך כלל, במחקר זה, 28 ° C ו 5% CO2 שימשו. בחר מסננים מתאימים ונקודות זמן הדמיה (כאן, מרווח של 2 או 4 שעות, אשר מספיק כדי לעקוב אחר נדידת אוסטאובלסט, שימש) ומטרות הגדלה נמוכה (כלומר, 4x) כדי להבטיח הדמיה אחידה של הבארות כולו. הסיבה לכך היא שהמאזניים נוטים לנוע בתוך הבארות, במיוחד במהלך שינויים במדיה.
Representative Results
התחדשות בקנה מידה
ניתן לעקוב אחר התחדשות אבנית באמצעות סטריאומיקרוסקופ פלואורסצנטי סטנדרטי על ידי הדמיה של צלע דג הזברה. איור 3A מראה שינויים בביטוי sp7/osx של הקשקשים במהלך התחדשות קנה המידה בדג זברה בן 4 חודשים. נקודות הזמן לדימות האגפים שמוצגות באיור 3A הן אונטוגנטיות (קשקשים מקוריים, לפני הקציר), יום 2, יום 4 ויום 10 לאחר הקציר. בדרך כלל אנו משתמשים בקווים טרנסגניים מסוג osx (הידוע גם בשם osterix או sp7) (כ-GFP (Tg(Ola.sp7:NLS-eGFP)19 או mCherry Tg(osterix:mCherry-NTR)pd46)17 כדי לעקוב אחר שינויים במערכת השלד כפי שהוא מסמן אוסטאובלסטים המייצרים עצמות. דפוסים מוקדמים של קשקשים חדשים שנוצרו ניתן לראות על 2 ימים של התחדשות. דפוס מוקדם זה של התחדשות אבנית משתבש במקרים מסוימים, במיוחד במוטציות שלד. על ידי מעקב אחר התקדמות ההתחדשות, ניתן לנתח את היכולת ואת קצב ההתחדשות. ביום קציר האבנית, הדמיה פרטנית של קשקשים שנקטפו יכולה להתבצע לאחר הדמיה מאגף באמצעות אותו סטריאומיקרוסקופ, כפי שמוצג באיור 3B. לקשקשים מחודשים יש ביטוי OSX גבוה בהרבה בהשוואה לקשקשים אונטוגנטיים של יום 0 מכיוון שאוסטאובלסטים נדרשים ליצירת העצם החדשה.
תרבות בקנה מידה Ex vivo
למרות שניתן לחקור את תהליך היווצרות העצם דה נובו על ידי מעקב אחר תהליך ההתחדשות על צלע הדג, אנו יכולים גם להשתמש במודל זה כדי לחקור תיקון וריפוי של פציעות שלד עם תרבית בקנה מידה ex vivo על ידי ביצוע פציעה על המאזניים עם אזמל. באמצעות מערכת הדמיה חיה, ניתן לעקוב אחר התיקון בזמן אמת. איור 4 מראה תוצאה מייצגת של תגובת ריפוי פציעות בקנה מידה אונטוגנטי תוך 3 ימים לתוך תרבית שבה האוסטאובלסטים מסומנים ב-osx: mCherry. אתר הפציעה שמוצג על-ידי הכניסות בתחילת התרבית מראה פער ברור בין אוסטאובלסטים ל-scale circuli (איור 4A). ניתן לעקוב אחר נדידת האוסטאובלסטים לעבר אתר הפציעה באמצעות הדמיה בהילוך מהיר. לאחר 3 ימים בתרבית, רוחב הפער מצטמצם, וניתן לראות את הביטוי שלה-osx בין הפער לבין הסקאלה החדשה שנוצרה (איור 4B). בנוסף, המורפולוגיה מבחינת צורת האוסטאובלסטים, היא מעגלית יותר בתחילת התרבית ולאחר 3 ימים, מוארכת יותר. שינוי זה במראה האוסטאובלסטים נובע ככל הנראה מהיותו בתרבית ולא בסביבתו הטבעית (הקשורה לדגים).
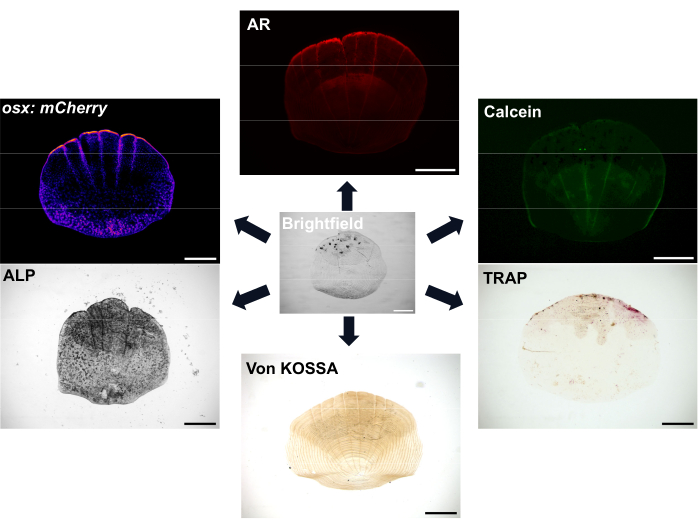
איור 1: דוגמאות לאפשרויות הדמיה עבור קני מידה. ניתן להמחיש אוסטאובלסטים באמצעות קווי כתב טרנסגניים osx/sp7 (ב-GFP או ב-mCherry). ניתן להשתמש בצביעת ALP כדי להראות את פעילות האוסטאובלסט. צביעת TRAP יכולה להראות את הפעילות של אוסטאוקלסטים. אדום אליזרין (AR) וירוק קלצין הם שני צבעים שניתן להשתמש בהם בדגים חיים; AR מתייג מינרליזציה ו Calcein תוויות עצם חדשה שנוצרה. ניתן להראות את מידת המינרליזציה גם עם צביעת פון קוסה. פסי קנה מידה: 500 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
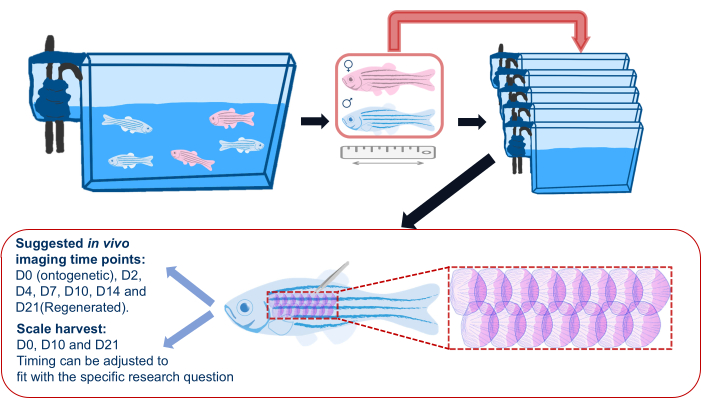
איור 2: המחשה סכמטית של ניסוי רגנרציה בקנה מידה. סכמה גנרית של ניסוי התחדשות קנה מידה המראה כי דגים מופרדים למכלים בודדים לפני הניסוי. אורך, מין ובריאות נרשמים. הסכימה מראה גם את האזור המוצע בצלע הדגים כדי לקצור קשקשים ונקודות זמן מוצעות להדמיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
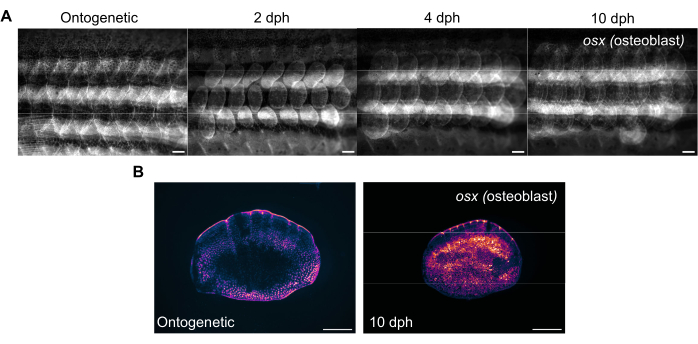
איור 3: תמונות מייצגות של ביטוי אוסטריקס (כדי להמחיש אוסטאובלסטים) במהלך התחדשות קנה מידה שנלקחו מדג זברה בן 4 חודשים. (A) תמונות האגפים שצולמו ביום 0 (לפני הקציר, קשקשים אונטוגנטיים), 2 dph (ימים לאחר הקציר) יום 2, 4 dph ו-10 dph למעקב אחר שינויים בביטוי OSX . פסי קנה מידה: 1 מ"מ. (B) תמונות מייצגות של סולם אונטוגנטי וסולם של 10 dph שנלקחו מאותו דג כמו בלוח (A). שים לב לרמות המוגברות של ביטוי osx כפי שמוצג במגנטה במרכז סולמות ההתחדשות. פסי קנה מידה: 500 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
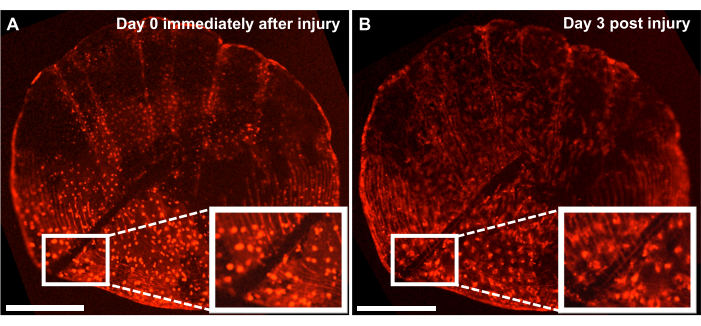
איור 4: תוצאות מייצגות של תגובה לתיקון פגיעות שלד בקנה מידה אונטוגנטי שנלכד מדגי זברה בני 4 חודשים באמצעות מערכת הדמיה חיה. (A) קשקשים אונטוגנטיים עם פגיעה שנעשתה על ידי אזמל באותו יום של הקציר (נקודת זמן 0/יום0) של התרבית. (B) אותו סולם מוצג 3 ימים לאחר הפציעה. הכניסה מציגה את אזור הפציעה. פסי קנה מידה: 500 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
הקשקשים האלסמואידים של דגי הזברה, כמודל חדשני לחקר השלד, טומנים בחובם פוטנציאל רב לסייע להבנתנו את תחזוקת העצם, התחדשות ותיקון פציעות. שפע הקשקשים על דגים מאפשר סינון תרכובות בתפוקה בינונית עד גבוהה תוך הפחתת מספר בעלי החיים בשימוש והגבלת השונות התוך-אישית. כאן, פרוטוקולים להתחדשות בקנה מידה ותרבות בקנה מידה ex vivo מוצגים כדי ללמוד התחדשות ותיקון.
יש לקחת בחשבון כמה שלבים קריטיים בעת ביצוע פרוטוקול זה. הסרה זהירה של הקשקשים היא חיונית, במיוחד כאשר משתמשים בקו כתב מהונדס כדי להגביל את ההפרעה לאוכלוסיית התאים הנגרמת על ידי הקציר. אם רוצים לערוך השוואות לקשקשים אונטוגנטיים, יש לוודא שהאזור אינו מכיל קשקשים המתחדשים באופן ספונטני (דבר שיכול להתרחש באופן טבעי לאורך חיי הדגים). ודא שהסביבה והציוד סטריליים לתרבית ex vivo כדי להשיג הישרדות תאים אופטימלית וזיהום מינימלי בתרבית.
בהתאם לשאלת המחקר הספציפית, ניתן לבצע התאמות לפרוטוקול, כגון שילוב קווי כתב טרנסגניים שונים כדי לדמיין סוגי תאים אחרים של פרופילי ביטוי גנים במהלך התחדשות ותיקון11,14.
הטווח הרחב של הכתמים שניתן לבצע על המאזניים פירושו שעבור כל תרכובת או מצב נבדק ניתן להסתכל על השפעותיו על העצם מזוויות שונות; בעוד שכתבי SP7/OSX יכולים להראות מספרי אוסטאובלסטים, צביעת ALP יכולה לדמיין פעילות אוסטאובלסט, צביעת TRAP יכולה לדמיין פעילות אוסטאוקלסט, צביעה חיה בצבע ירוק קלצין יכולה לתייג עצם חדשה שנוצרה וצביעת אליזרין אדומה או פון קוסה יכולה להראות מינרליזציה בקנה מידה. פעילות לוציפראז לכימות אוסטאובלסטים יכולה לשמש גם12. בשילוב עם טכניקות צביעה אלה, ניתן ללמוד את התרומה היחסית של אוסטאובלסטים ואוסטאוקלסטים לאפקט עצם נתון. קשקשים חסרים אוסטיאוציטים, הנפוצים בעצמות יונקים והם הגורמים העיקריים לתגובה מכנו-חושית בעצמות; תיקון קנה מידה והתחדשות במודל זה מונעים בעיקר על ידי אוסטאובלסטים עם עיצוב מחדש לאחר מכן על ידי אוסטאוקלסטים 8,9. חשוב לציין כי השונות מתרחשת בין אנשים וקבוצות גיל20. כדי למזער זאת, שטח הקציר בקנה מידה חייב להיות קבוע, מכיוון שמיקומים שונים יכולים ליצור מורפולוגיות קנה מידה שונות, ודגים מאותן קבוצות אחים משמשים כך שהגיל והגודל יהיו עקביים. עם זאת, מכיוון שניתן לקצור קשקשים מרובים לכל דג, ניתן לבצע יותר ניסויים באמצעות פחות דגים, מה שמפחית את השונות התוך-אישית.
לסיכום, פרוטוקולים אלה מראים טכניקות ניסיוניות שניתן ליישםעל סולמות אונטוגנטיים ומתחדשים. לסיכום, קשקשים אלסמואידים מראים פוטנציאל גדול כמודל שלד לסייע בהבנת היווצרות העצם ותיקונה; ויסייע להפחית את השימוש בבעלי חיים לבדיקת תרכובת אוסטאואנאבולית בתפוקה גבוהה.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
ברצוננו להודות למתיו גרין מיחידת השירות לבעלי חיים על גידול דגים ולקייטי ג'פסון ממרכז וולפסון לדימות ביולוגי. CLH, DB ו-QT מומנו על ידי Versus Arthritis (CLH Senior Fellowship 21937, DB and QT Intermediate Fellowship 22044), RR מומן על ידי (NHMRC APP1158758). עבודה זו נתמכה גם על ידי מענק BBSRC (BB/T001984/1).
Materials
| Name | Company | Catalog Number | Comments |
| 10x Phosphate buffered saline (PBS) | Gibco | 70013-016 | PBS |
| 12-Multichanel Pipette | Sartorius | 728230 | Multichanel pipette, Proline Plus Mechanical Pipette, 12 Channel, , 10-100 µL. |
| 15 mL Centrifuge tubes | Corning | 430791 | Centrifuge tube, CentriStar Cap, Polypropylene, RNAse/DNAse free, Non-pyrogenic |
| 4% Paraformaldehyde (PFA) | Sigma | P6148 | PFA |
| Alizarin red | Sigma | A5533 | |
| Amphotericin B | ThermoFisher Scientific | 15290026 | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher Scientific | 11772644 | Sealing film |
| Calcein powder | Sigma | C0875 | |
| Calcium Chloride | Thermo Scientific | L13191.30 | |
| Corning 96 well plate | Corning | 3596 | 96-well-plate, Clear, Flat Bottom Polystyrene TC-treated Microplates, Individually Wrapped, with Lid, Sterile |
| Cover slips | VWR | 631-0146 | |
| Cytiva HyClone Iron-Supplemented Calf Serum | Fisher Scientific | SH30072.03 | |
| Danieau | Sigma | ||
| DMEM | Life Technologies | 31053 | |
| Falcon tubes | Corning | 430828 | |
| Fast Red Violet LB stock solution | Sigma | F3381 | |
| GlutaMAX Supplement | Life Technologies | 35050 | |
| Glycerol | Sigma | 81381 | |
| Hepes | Sigma | H3375 | |
| Incubator | X | Incubator, Set up to 28 °C and 5% CO2 | |
| IncuCyte Zoom | Sartorious | X | Live Imaging System, Set up to 28 °C and 5% CO2 |
| Leica stereomicroscope | X | Sterioscope | |
| L-tartrate dibasic dihydrate | Sigma | 228729 | |
| Mgcl2 | BDH Laboratory Sup. | 261237T | |
| Microscope slides | Epredia | J2800AMNZ | |
| Mowiol 4-88 | Sigma | 9002-89-5 | |
| MQ water | X | ||
| N, N’-dimethylformamide (Merck: D4451) | Merck | D4451 | |
| NaCL | Fisher Chemical | S/3120/53 | |
| Naphthol AS-MX phosphate | Merck | N4875 | |
| NBT/BCIP solution | Sigma | #000000011681451001 | |
| Penicillin-Streptomycin | Life Technologies | 15140 | |
| Petri Dishes | Corning | 430589 | 35 mm sterile Petri dish, Non-treated, Nonpyrogenic, Polystyrene. |
| Reagent Reservoir | Startub | E2310-1025 | 25mL Reagent Reservoir |
| Silver nitrate | Sigma | 209139 | |
| Sodium acetate | Sigma | 52889 | |
| Sodium beta-glycerophosphate pentahydrate | Thermo Scientific | L03425.14 | |
| Sodium pyruvate solution | Sigma | S8636 | |
| Sodium tartrate | Sigma | S4797 | |
| Sodium thioculphate | Sigma | 563188 | |
| Tricaine methane sulfonate (MS222) | Sigma | E10521 | |
| Tris | Sigma | 252859 | |
| Triton-X100 | Sigma | T8787 | |
| Tween-20 | SLS | CHE3852 | |
| Tweezers Number 5 | Dumont | 500341 | Tweezer, INOX, biology grade |
| Zebrafish tanks | Tecniplast | ZB30BCP | 3.5 L - 28 cm x 11 cm x 17 cm |
| Zebrafish tanks | Tecniplast | ZB30BCP | 1 L - 28 cm x 7 cm x 11 cm |
References
- Tobias, J. H., et al. Opportunities and challenges in functional genomics research in osteoporosis: report from a workshop held by the causes working group of the osteoporosis and bone research academy of the Royal Osteoporosis Society on October 5th 2020,". Frontiers in Endocrinology. 11, (2021).
- Busse, B., Galloway, J. L., Gray, R. S., Harris, M. P., Kwon, R. Y. Zebrafish: An emerging model for orthopedic research. Journal of Orthopaedic Research. 38 (5), 925-936 (2020).
- Dietrich, K., et al. Skeletal biology and disease modeling in zebrafish. Journal of Bone and Mineral Research. 36 (3), 436-458 (2021).
- McGowan, L. M., Kague, E., Vorster, A., Newham, E., Cross, S., Hammond, C. L. Wnt16 elicits a protective effect against fractures and supports bone repair in zebrafish. JBMR Plus. 5 (3), 10461 (2021).
- Sehring, I., Weidinger, G. Zebrafish fin: Complex molecular interactions and cellular mechanisms guiding regeneration. Cold Spring Harbor Perspectives in Biology. 14 (7), 040758 (2022).
- Bergen, D. J. M., Kague, E., Hammond, C. L. Zebrafish as an emerging model for osteoporosis: a primary testing platform for screening new osteo-active compounds. Frontiers in Endocrinology. 10 (6), (2019).
- Aman, A. J., Fulbright, A. N., Parichy, D. M. Wnt/β-catenin regulates an ancient signaling network during zebrafish scale development. Elife. 7, 37001 (2018).
- Iwasaki, M., Kuroda, J., Kawakami, K., Wada, H. Epidermal regulation of bone morphogenesis through the development and regeneration of osteoblasts in the zebrafish scale. Developmental Biology. 437 (2), 105-119 (2018).
- Metz, J. R., de Vrieze, E., Lock, E. J., Schulten, I. E., Flik, G. Elasmoid scales of fishes as model in biomedical bone research. Journal of Applied Ichthyology. 28 (3), 382-387 (2012).
- Cox, B. D., De Simone, A., Tornini, V. A., Singh, S. P., Di Talia, S., Poss, K. D. In toto imaging of dynamic osteoblast behaviors in regenerating skeletal bone. Current Biology. 28 (24), 3937-3947 (2018).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders,". Frontiers in Endocrinology. 11, (2020).
- de Vrieze, E., Zethof, J., Schulte-Merker, S., Flik, G., Metz, J. R. Identification of novel osteogenic compounds by an ex-vivo sp7: Luciferase zebrafish scale assay. Bone. 74, 106-113 (2015).
- De Vrieze, E., Moren, M., Metz, J. R., Flik, G., Lie, K. K. Arachidonic acid enhances turnover of the dermal skeleton: Studies on zebrafish scales. PLoS One. 9 (2), 89347 (2014).
- Bergen, D. J. M., et al. Regenerating zebrafish scales express a subset of evolutionary conserved genes involved in human skeletal disease. BMC Biology. 20 (1), 21 (2022).
- Bergen, D. J. M., et al. High bone mass disorders: New insights from connecting the clinic and the bench. Journal of Bone and Mineral Research. , (2022).
- Pasqualetti, S., Banfi, G., Mariotti, M. Osteoblast and osteoclast behavior in zebrafish cultured scales. Cell and Tissue Research. 350 (1), 69-75 (2012).
- Singh, S. P., Holdway, J. E., Poss, K. D. Regeneration of amputated zebrafish fin rays from de novo osteoblasts. Developmental Cell. 22 (4), 879-886 (2012).
- Ethiraj, L. P., Fong, E. L. S., Liu, R., Chan, M., Winkler, C., Carney, T. J. Colorimetric and fluorescent TRAP assays for visualising and quantifying fish osteoclast activity. European Journal of Histochemistry. 66 (2), 3369 (2022).
- DeLaurier, A., et al. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505 (2010).
- Carnovali, M., Banfi, G., Mariotti, M. Age-dependent modulation of bone metabolism in zebrafish scales as new model of male osteoporosis in lower vertebrates. Geroscience. 43 (2), 927-940 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved